-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Syndrom kombinované fibrózy a emfyzému – CPFE syndrom
Syndrome of combined pulmonary fibrosis and emphysema – CPFE syndrome
Pulmonary fibrosis and emphysema have been considered as two entirely different groups of diseases. In spite of this, combined pulmonary fibrosis and emphysema (CPFE) syndrome, where the two pathologic phenotypes (fibrosis and emphysema) are described in one patient, has been repeatedly described in past 20 years. The clinical, functional and morphologic phenotype corresponds to both diseases in combination. Probable common pathogenetic feature of emphysema and fibrosis is transforming growth factor beta (TGF-β), the cytokine that plays a crucial role in process of healing and fibrogenesis. TGF-β is likely to influence the mechanism of epithelial - mesenchymal transdifferentiation (EMT) and even epithelial - mesenchymal crosstalk (EMC), that are the main pathogenetic mechanisms of diffuse interstitial lung diseases, both fibrosis and emphysema. From the clinical point of view, few forms of CPFE exist, according to emphysema and fibrosis ratio and mutual position. CPFE patient’s prognosis is unfavourable despite treatment, but probably better then in isolated idiopathic pulmonary fibrosis.
Key words:
pulmonary fibrosis, emphysema, pathogenesis, clinical presentation.
Autoři: M. Vašáková 1; P. Žáčková 1; R. Matěj 2
Působiště autorů: Pneumologická klinika 1. LF UK Přednosta: prof. MUDr. Jiří Homolka, DrSc. 1; Odddělení patologie a molekulární mediciny Primář: MUDr. František Koukolík, DrSc. Fakultní Thomayerova nemocnice s poliklinikou, Praha 2
Vyšlo v časopise: Prakt. Lék. 2009; 89(6): 287-289
Kategorie: Přehledy
Souhrn
Plicní fibróza a emfyzém byly donedávna popisovány jako dvě zcela odlišné entity, které nemají patogeneticky nic společného. V posledních 20 letech byl však opakovaně popsán kombinovaný syndrom fibrózy a emfyzému (CPFE), kde jsou zastoupeny oba dva patologické obrazy současně a vytvářejí tak klinický, funkční a morfologický fenotyp odpovídající kombinaci obou nemocí. Pravděpodobným společným jmenovatelem v patogenezi těchto nemocí je cytokin ovlivňující hojení a fibrogenezi – transformující růstový faktor beta (TGF-β). TGF-β zřejmě ovlivňuje i mechanismu přechodu epiteliálních buněk v buňky mesenchymové (EMT) a komunikaci mezi těmito buňkami (EMC), což jsou hlavní mechanismy vzniku difúzních změn plicního intersticia, ať už ve smyslu fibrózy, nebo emfyzému. Klinicky existuje několik forem CPFE dle poměru a rozložení fibrózních a emfyzémových změn. Prognóza nemocných je nedobrá navzdory léčbě, i když je pravděpodobně lepší než u pacientů s idiopatickou plicní fibrózou.
Klíčová slova:
plicní fibróza, emfyzém, patogeneze, klinický obraz.Úvod
Plicní fibróza a emfyzém byly donedávna popisovány jako dvě zcela odlišné entity, které nemají patogeneticky nic společného. V posledních 20 letech byl však opakovaně popsán kombinovaný syndrom fibrózy a emfyzému (CPFE), kde jsou zastoupeny oba dva patologické obrazy současně a vytvářejí tak klinický, funkční a morfologický fenotyp odpovídající kombinaci obou nemocí. Poprvé byl tento syndrom v literatuře popsán v roce 1990 Wigginsem, nejrozsáhlejší soubor pak byl popsán Vincentem Cottinem, který v roce 2005 zveřejnil svoji skupinu 61 pacientů s CPFE (1).
Fibrotizující složka je obvykle tvořena některým z obrazů idiopatických intersticiálních pneumonií (IIP), nejčastěji idiopatickou plicní fibrózou, tzv obvyklého typu (IPF-UIP), nebo nespecifickou intersticiální pneumonitidou (NSIP). Obecně IIP a její hlavní reprezentant IPF-UIP jsou skupinou závažných plicních nemocí, které vedou obvykle k výrazné fibrotizaci plicní tkáně a devastaci plicní architektoniky.
Klinickým a funkčním důsledkem je u pacienta progredující dušnost s výraznou progresivní poruchou plicních funkcí, vývojem plicní hypertenze a respiračního a kardiálního selhání. Prognóza pacientů s IPF-UIP je infaustní, většina z nich umírá do 3 let od diagnózy. Prognóza NSIP je o něco lepší, zůstávají totiž zachovány i okrsky relativně nepostižené plicní tkáně.
V rámci NSIP rozeznáváme 3 podtypy, a to:
- podtyp buněčný,
- podtyp fibrotický, a
- podtyp smíšený.
Podtyp fibrotický má prognózu nejhorší, obvykle se blíží prognóze IPF-UIP, podtyp buněčný a smíšený mají prognózu lepší, což je dáno tím, že určitá porce změn v plicní tkáni odpovídá aktivním zánětlivým změnám, které obvykle lze ovlivnit protizánětlivou, většinou kortikoidní, léčbou (6) (Tab. 1).
Tab. 1. Klasifikace idiopatických intersticiálních pneumonií 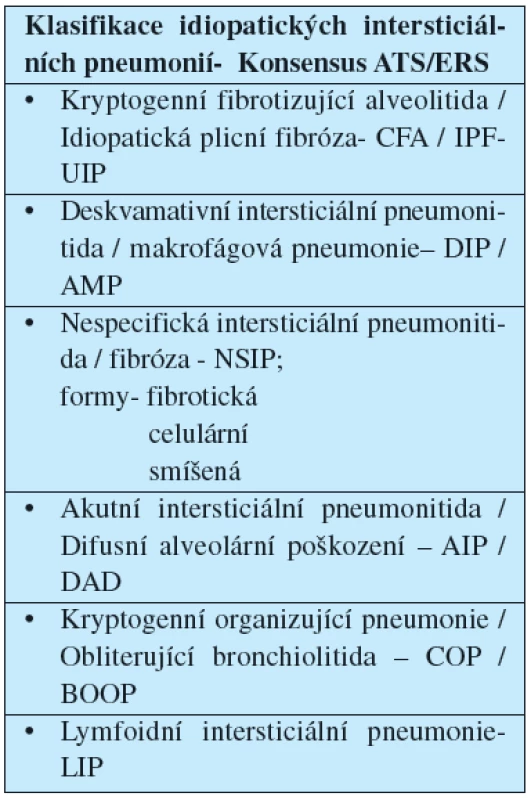
Plicní emfyzém je značně heterogenní skupinou nemocí s rozdílným obrazem a závažností, základním principem je redukce počtu plicních sklípků daná devastací jejich stěny a splývaním sousedících alveolů ve větší prostory. Postižení sklípků nebývá izolované, obvykle je doprovázeno i změnami na bronchiolech či bronších. Klinicky se nemusí prakticky projevovat (senilní emfyzém), většinou se však setkáme s poměrně výraznou klinickou symptomatologií, obrazem tzv. chronické obstrukční plicní nemoci různého stupně závažnosti.
Na vzniku emfyzému se velmi často podílí kouření, ale existují i kongenitální formy dané defekty v syntéze antiproteáz, nejčastěji alfa-1 - antitrypsinu. Prognóza onemocnění závisí na typu a rozsahu emfyzému, v pozdních fázích nemoci dochází již k velmi výrazné redukci funkční plicní tkáně s druhotnými změnami na plicních cévách a s plicní hypertenzí a cor pulmonale.
Patogeneze CPFE
Zdá se, že patogeneticky je společným jmenovatelem cytokin, ovlivňující hojení a fibrogenezi, transformující růstový faktor beta (TGF-β). Ten působí na buňky (fibroblasty, epiteliální buňky) přes svůj receptor TGF-RI a cestou signalizačních proteinů (Smad 2, 3 a zřejmě i 4) pak přechází signál do jádra, čímž dochází změně exprese faktorů ovlivňujících hlavně apoptózu a diferenciaci těchto buněk. TGF-β působí proapoptoticky a aniproliferačně na alveolární epitel a antiapoptoticky a proproliferačně na fibroblasty, navíc ovlivňuje také depozici extracelulární matrix (ECM).
Dlouho se spekulovalo o původu plicních myofibroblastů, zda se vyvíjejí primárně v plicích, či mimo plíce. Posledním, a to revolučním objevem je, že tyto buňky pravděpodobně vznikají mechanismem tzv. epitelomezenchymální transdiferenciace (EMT) v plicích z alveolárních epiteliálních buněk 2. typu. Doposud existovaly důkazy pro transdiferenciaci pneumocytů 2. typu do 1. typu při reepitelizaci alveolárních lézí. Transdiferenciace ale zřejmě může proběhnout ve vhodném cytokinovém prostředí i opačným směrem a pak další transdiferenciací z pneumocytů 2. typu mohou vzniknout mezenchymové buňky. Tím je vlastně vysvětlen původ myofibroblastů objevujících se v místě alveolárních epiteliálních lézí v časné patogenezi idiopatické plicní fibrózy (IPF).
TGF-β zřejmě přímo ovlivňuje pneumocyty 2. typu, které pak zvyšují expresi markerů mezenchymální diferenciace – aktin hladkých svalů alfa (a-SMA), kolagen I, vimentin a snižují expresi typických epiteliálních markerů (aquaporin 5, cytokeratin). Důkazem pro EMT je také kolokalizace proteinů mezenchymální i epiteliální diferenciace v plicích, transkripčního faktoru štítné žlázy (TTF-1-NKx2.1), prekurzoru surfaktantového proteinu B (pro-SP-B) a a-SMA.
Morfologicky se pak v těchto oblastech podařilo prokázat vmezeření fibroblastů mezi alveolárními epiteliálními buňkami a bazální membránou alveolu. Zajímavé je působení antioxidačních faktorů na EMT. N-acetylcystein inhibuje EMT a inhibuje také TGF-β indukovanou zvýšenou expresi vimentinu.
Kromě EMT a proliferace fibroblastů pozorujeme jako další patologický rys u difúzních plicních procesů alteraci epitelomezenchymální komunikace (cross-talk) (EMC). Zřejmě i zde hraje roli TGF-β, který způsobuje přeprogramování transkripce skeletálních proteinů (transgelin), zřejmě cestou Smad. Alterace EMC se pak projevuje hlavně v okrscích emfyzému a je často spojena s metaplastickými epiteliemi v této oblasti.
Dále se pak v patogenezi emfyzému a fibrózy uplatňuje systém proteáz a antiproteáz, kde u emfyzému předpokládáme jejich nerovnováhu a u IPF pak zvýšení exprese tkáňových inhibitorů metaloproteináz (TIMP) a inhibitoru aktivátoru plasminogenu (PAI-1). I tato cesta je pravděpodobně ovlivněna TGF-β signalizací cestou Smad 3, což je podpořeno pozorováním Smad 3 deficientních myší, které nevyvinou fibrózu po expozici bleomycinu, ale vyvinou spontánně emfyzém s poruchou hojení plicní tkáně (2). Hypotéza o nerovnováze proteináz a poruše hojení pak byla podpořena i prací Lucatelli et al, kde byla popsána ambivalentní role neutrofilní elastázy ve vývoji CPFE. U myší exponovaných bleomycinu předcházel elastolytický emfyzém obraz fibrózy. Zvýšená exprese neutrofilní elastázy pak kolokalizovala se zvýšenou expresí TGF. Navíc pak fibrotické i emfyzematózní změny byly ovlivnitelné inhibitory neutrofilní elastázy (3).
Dalším z cytokinů, který pravděpodobně hraje roli v patogenezi CPFE, je TNF-α. Transgenní myši se zvýšenou expresí TNF-α vyvinou jak plicní fibrózu, tak i emfyzém. Jedna z možností dvojího účinku tohoto cytokinu je jeho působení cestou dvou signalizačních drah aktivovaných přes TNF-RI. Aktivace TNF-RI cestou NF κB indukuje expresi intracelulárních proteinů inhibujících apoptózu, cestou cJun N terminální kinázy (JNK) naopak dochází k indukci apoptózy. Signalizace přes TNF-RII pak podporuje buněčnou smrt zprostředkovanou signalizací přes TNF-RI (4).
Vliv kouření na vznik CPFE je nepochybný, důležitý je však i vliv genotypu. V práci Lungarelly et al byly popsány mechanismy vzniku CPFE a jeho různé manifestace v myších modelech s různým genotypem receptoru pro produkty pokročilé glykace (RAGE) při expozici cigaretovému kouři. Fibrotická i emfyzematózní reakce byla snáze vyvolána kouřením u myší, které měly větší podíl membránově vázaného full length (FL) RAGE (FL-RAGE), který existuje kromě formy membránové i ve formě solubilní (S-RAGE). FL-RAGE pak aktivuje expresi cestou NF κB a dochází k aktivaci makrofágů a k zánětu a také ke zvýšené exprexi TGF-β, a tím i výše popsané patogenetické cestě CPFE (5).
Klinický obraz
Klinicky se projevuje CPFE většinou progredující námahovou dušností, někdy bývají přítomny známky velmi podobné klinickému obrazu chronické obstrukční plicní nemoci. Po funkční stránce většinou naměříme normální usilovnou vitální kapacitu (FVC), jednovteřinovou kapacitu (FEV1) a totální kapacitu (TLC), doprovázenou snížením transfer faktoru pro kysličník uhelnatý (TLCO) a parciálního tlaku kyslíku v arteriální krvi (paO2). Postiženi jsou hlavně kuřáci s výraznou převahou mužského pohlaví. Na HRCT jsou známky emfyzému i fibrózy. CPFE bývá častěji při intersticiálním plicním postižení u revmatoidní artritidy (RA) a pak u kuřáků s IPF.
CPFE kromě RA můžeme pozorovat i u systémové sklerodermie a u smíšeného onemocnění pojiva (MCTD). Dle distribuce fibrotických a emfyzematózních změn pozorujeme několik forem CPFE:
- forma s postupným přechodem změn – v horních polích centrilobulární emfyzém, který přechází kaudálním směrem do fibrózy a paraseptálního emfyzému (Obr. 1),
- paraseptální emfyzém s fibrózou – obraz mléčného skla se střídá s voštinovitou plicí a paraseptálním emfyzémem,
- forma s oddělenými entitami – okrsky fibrózy se střídají s okrsky emfyzému (Obr. 2).
Obr. 1. CPFE – forma s postupným přechodem změn 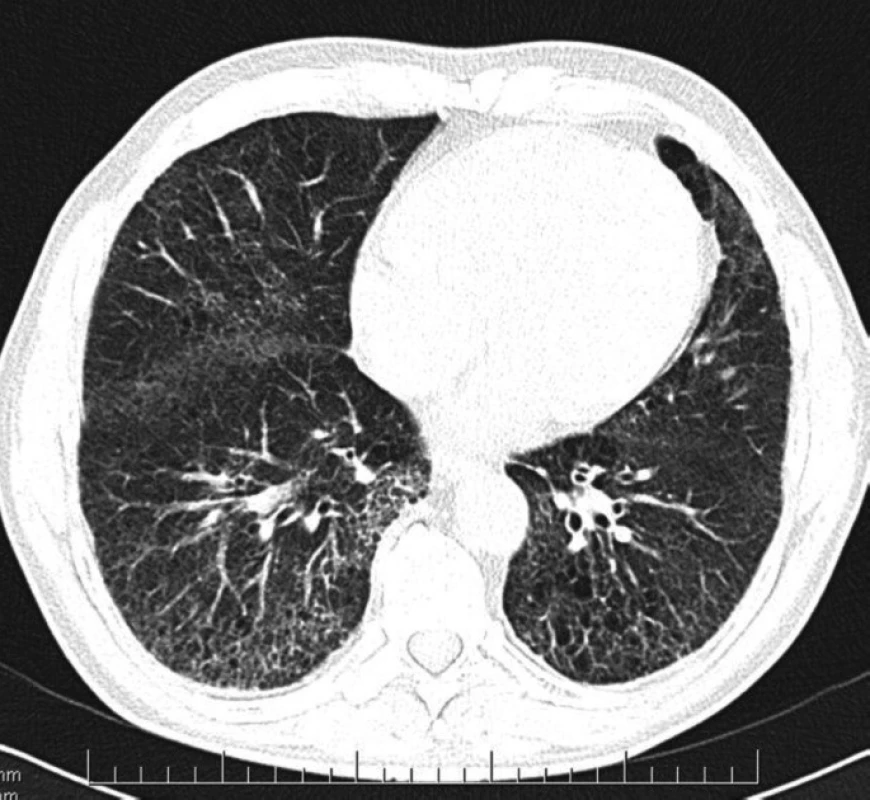
Obr. 2. CPFE – forma s oddělenými entitami komplikovaná pneumotoraxem s podkožním emfyzémem (2) 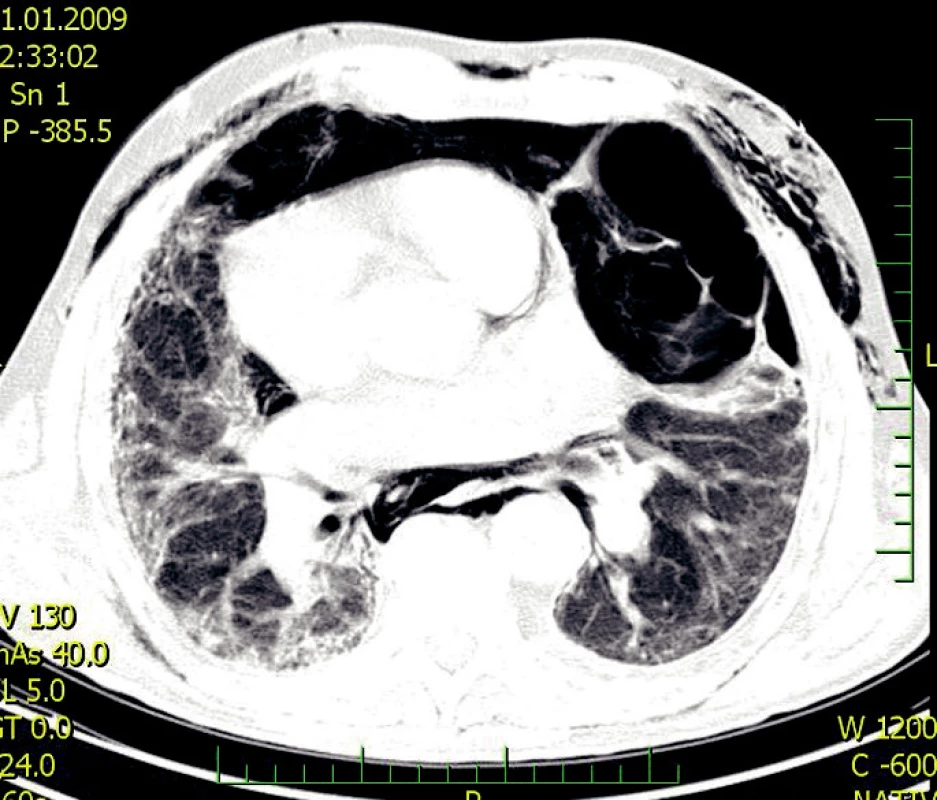
Pro plicní funkce platí, čím vyšší je podíl emfyzému, tím vyšší je TLC a nižší FEV1/FVC, a čím vyšší je podíl fibrózy, tím nižší je TLC a vyšší poměr FEV1/FVC. Čím větší část plic CPFE postihuje, tím je nižší TLCO. Plicní objemy jsou nejvíce zachovány u formy s postupným přechodem změn. U pacientů laboratorně často zachytíme přítomnost autoprotilátek: ANA, ANCA, RF antielastinových protilátek.
Histopatologicky je obraz onemocnění charakterizován intersticiálním fenotypem UIP, méně pak NSIP, deskvamativní intersticiální pneumonitidy (DIP) a obliterující bronchiolitidy s organizující se pneumonií (BOOP) (1) (Obr. 3, 4).
Obr. 3. CPFE – plicní biopsie – hematoxylin eosin – makroskopicky 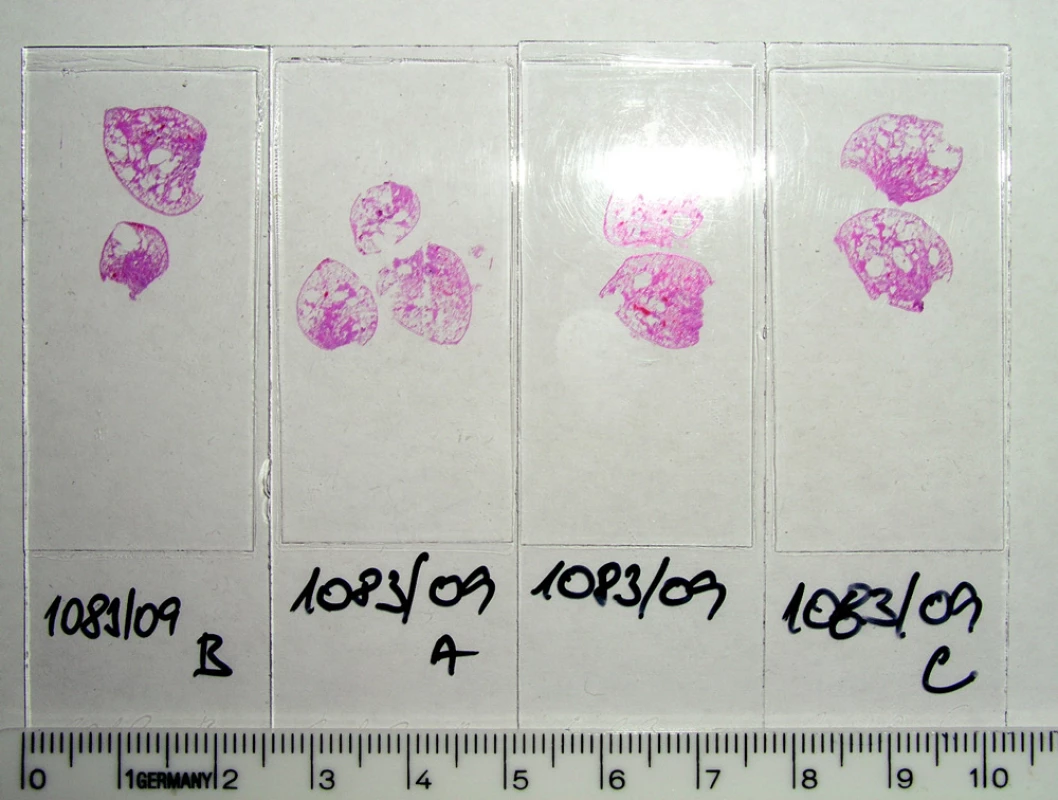
Obr. 4. CPFE plicní biopsie – kombinace emfyzému a fibrózy 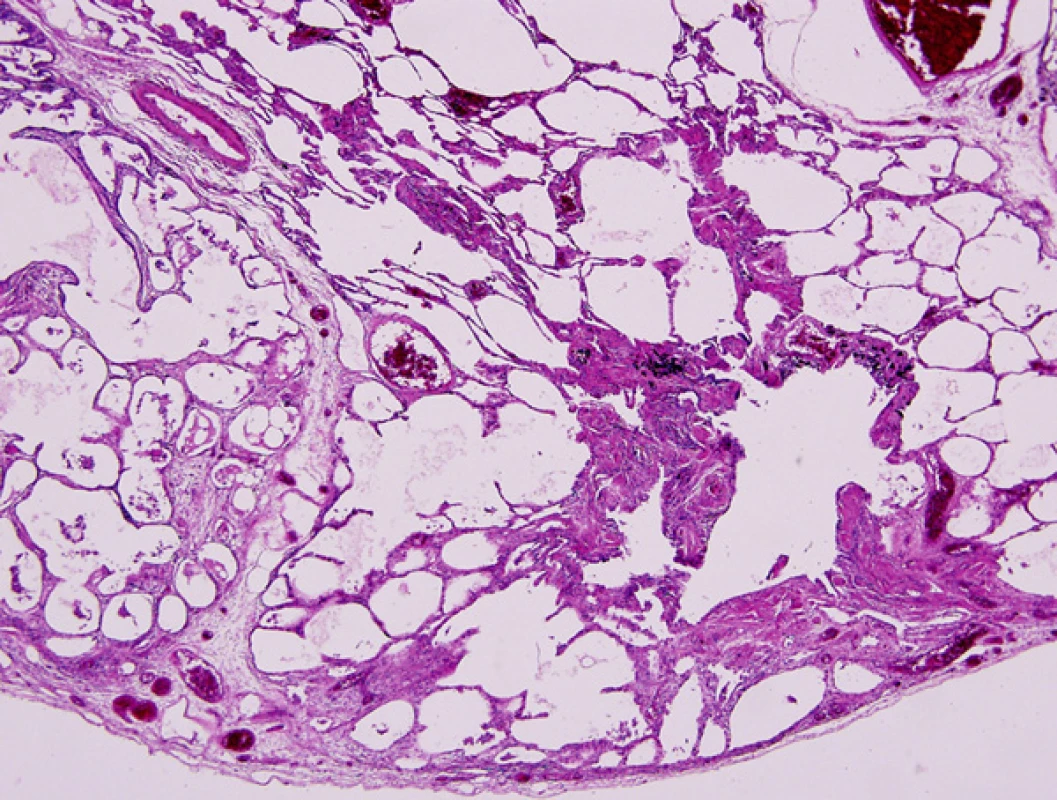
Léčba a prognóza
Co se týče léčby, doporučeny jsou systémově podané kortikoidy (obvykle prednison 0,5 mg/kg tělesné hmotnosti) nebo kombinovaná imunosuprese (azathioprin v dávce 100–150 mg/den přidaný k systémovým kortikoidům). Medián přežití je lepší než u IPF izolované, 55 % pacientů přežívá 5 let. Výrazně horší prognózu mají pacienti s plicní hypertenzí, kdy 5 let přežije pouze 25 % pacientů.
Kouření je rizikovým faktorem jak pro emfyzém, tak pro IPF, matoucí je fakt, že kuřáci mají méně závažnou IPF v době diagnózy, ale to je zřejmě dáno tzv. „smoker-effect“, čili časnější diagnózou onemocnění u kuřáků díky výraznějším potížím (1).
Podpořeno grantem IGA MZ ČR NR 9131
doc. MUDr. Martina Vašáková, Ph.D.
Pneumologická klinika 1. LF UK
Fakultní Thomayerova nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4
E-mail: martina.vasakova@ftn.cz
Zdroje
1. Cottin, V., Nunes, H., Brillet, P-Y. et al. Combined pulmonary fibrosis and emphysema: a distinct underrecognized entity. Eur. Respir. J. 2005, 26, p. 586-593.
2. Gauldie, J., Kolb, M., Kjetil, A. et al. Smad 3 signaling involved in pulmonary fibrosis and emphysema. Proc. Am. Thorac. Soc. 2006, 3, p. 696-670.
3. Lucattelli, M., Bartalesi, B., Cavarra, E. et al. Is neutrophil elastase the missing link between emphysema and fibrosis? Evidence from two mouse models. Respir. Res. 2005; 6, p. 83-96.
4. Lundblad, L.K.A., Thompson-Figueroa, J., Leclair, T. et al. Tumor necrosis factor alpha overexpression in lung disease. A single cause behind a complex phenotype. Am. J. Respir. Crit. Care Med. 2005, 171, p.1363-1370.
5. Lungarella, G., Cavarra, E., Lucattelli, M. et al. The dual role of neutrophil elastase in lung destruction and repair. Int. J. Biochem. Cell Biol. 2008, 40(6-7), p. 1287-1296.
6. Vašáková, M. Idiopatická plicní fibróza - kryptogenní fibrotizující alveolitida. Postgrad. med. 2009, 11(2), s. 133 - 137.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2009 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Syndrom kombinované fibrózy a emfyzému – CPFE syndrom
- Hodnocení zdravotních dopadů profesionální expozice karcinogenům v jednotlivých hospodářských odvětvích
- Zdravotní komplikace zneužívání návykových látek a možnosti prevence v primární péči
- Chyby při léčbě deliria tremens
- Rané faktory ovlivňující vznik obezity na začátku života
- Oboustranná rekonstrukce prsů dvěma DIEP laloky Jak ji hodnotí pacientky?
- Epidemiologie a socioekonomické dopady hyperaktivity močového měchýře
- Bolestivá noha
- Srdeční AL-amyloidóza s relativně benigním průběhem
- Význam parametrů krevního obrazu pro diagnostiku a odhad prognózy u pacientů s myelodysplastickým syndromem
- Dermatovenerologie v ČR O dermatologii s nadhledem i vážně s prof. MUDr. Petrem Arenbergerem, DrSc., MBA, předsedou České dermatovenerologické společnosti ČLS JEP
- Poučení a souhlas pacienta, který je pod vlivem alkoholu
- Bohumil Eiselt, profesor vnitřního lékařství a zakladatel Spolku českých lékařů
- Miniportréty slavných českých lékařů Profesor MUDr. Zdeněk Mysliveček, představitel české psychiatrie v první polovině 20. století
- Nekamenujte proroky
- Prof. MUDr. Květoslav Šipr, CSc., se dožívá 75 let
- O neurologovi, který sbírá úsměvné historky
- NÁZOR
- Odpověď autorů článku „Konec elektromagnetické hypersenzitivity“
- Jubilea
- Komunikace ve zdravotnické péči
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zdravotní komplikace zneužívání návykových látek a možnosti prevence v primární péči
- Chyby při léčbě deliria tremens
- Syndrom kombinované fibrózy a emfyzému – CPFE syndrom
- Bolestivá noha
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



