-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMiesto ultrasonografickej diagnostiky v sledovaní gravidity komplikovanej diabetom tehotnej ženy
Role of ultrasound diagnostics in monitoring the pregnancy complicated by diabetes of a pregnant woman
This review provides a broader view of the importance and role of ultrasound diagnostics in the management of pregnancies complicated with pre-existing diabetes mellitus. A stress is put on the role of ultrasound diagnostics in evaluating the status and development of the fetus at risk due to diabetes mellitus of a pregnant woman. For its clarity, the issue is broken down by trimesters of pregnancy and covers a range of related topics including: dating of pregnancy, early prediction of its complications, ultrasound screening for congenital malformations and fetal aneuploidy, fetal echocardiography and assessment of the status and growth of the fetus at the end of pregnancy.
Key words:
diabetes – malformations – pregnancy – ultrasound diagnostics
Autoři: Karol Dókuš 1; Silvia Dókušová 2; Emil Martinka 2; Ján Danko 1
Působiště autorů: Gynekologicko-pôrodnícka klinika Jesseniovej LF UK a UN Martin, prednosta prof. MUDr. Ján Danko, CSc. 1; Diabetologické oddelenie, Národný endokrinologický a diabetologický ústav, Ľubochňa, primár doc. MUDr. Emil Martinka, PhD. 2
Vyšlo v časopise: Prakt Gyn 2014; 18(2): 121-126
Kategorie: Gynekologie a porodnictví: Přehledový článek
Souhrn
Prehľadová práca prináša širší pohľad na význam a postavenie ultrasonografickej (USG) diagnostiky v manažmente tehotností žien s preexistujúcim diabetes mellitus. Zameraná je na miesto USG pri hodnotení stavu a vývoja plodu ohrozeného diabetom tehotnej ženy. Pre prehľadnosť je tematika členená podľa trimestrov tehotnosti a pokrýva spektrum súvisiacich problémov, ku kterým patria: datovanie tehotnosti, včasná predikcia jej komplikácií, ultrasonografický skríning vrodených malformácií a aneuploídie plodu, fetálna echokardiografia a hodnotenie rastu aj stavu plodu ku koncu tehotnosti.
Kľúčové slová:
diabetes – malformácie – tehotnosť – ultrasonografická diagnostikaÚvod
Za posledné desaťročie zaznamenal vývoj ultrasonografickej (USG) diagnostiky vskutku pozoruhodný vývoj, ktorému dominujú zvýšenie rozlišovacej schopnosti USG-vyšetrovania a zavádzanie 3-D (dimenzionálnej) a 4-D technológií zobrazovania do klinickej praxe. Gravidita žien s preexistujúcim diabetom sa radí medzi tzv. rizikové tehotnosti, ktoré sú charakterizované častejším výskytom komplikácií ohrozujúcich zdravie a život tehotnej ako aj jej plodu.
Ultrasonografické vyšetrenie v 1. trimestri
K hlavným úlohám USG vo včasných fázach tehotnosti patrí verifikácia lokalizácie tehotnosti, potvrdenie životaschopnosti zárodku, zistenie početnosti tehotnosti a v neposlednom rade aj možnosť určenia dĺžky jej trvania (datovanie). Datovanie tehotnosti má zásadný význam z pohľadu neskoršieho posúdenia rastu plodu, ktorého trend býva predmetom klinického záujmu hlavne u tehotných s diabetom. Práve v prvom trimestri je možné vzájomnou komparáciou údajov o dátume začiatku poslednej menštruácie (last menstrual period – LMP) a USG-merania dĺžky „temeno – kostrč“ (crown-rump length – CRL) urobiť presný odhad trvania tehotnosti a určiť tak aj predpokladaný dátum pôrodu (obr. 1). Prínos býva zjavný najmä u žien s nepravidelným menštruačným cyklom, napr. aj u žien so syndrómom polycystických ovárií (polycystic ovary syndrome – PCOS) a poruchami glukózovej tolerancie. Možnosť datovania tehotnosti pomocou merania CRL plodu bola prvýkrát popísaná Robinsonom a Flemingom v roku 1975. Pri tomto postupe je možné určiť trvanie tehotnosti s presnosťou 4–7 dní. Zaujímavé je, že u tehotných diabetičiek sú referenčné hodnoty pre CRL o niečo menšie ako v zdravej populácii žien. Meranie CRL je v presnosti datovania tehotnosti lepšie ako údaj o LMP. V bežnej praxi je tak preferované datovanie podľa CRL, najmä ak je rozdiel oproti LMP > 5 dní, resp. ak údaj o LMP absentuje. Vo včasnějších fázach tehotnosti (< 5. gestačný týždeň), keď CRL nie je meraním možné stanoviť, do úvahy prichádza aj meranie priemeru gestačného vačku (gestational sac diameter – GSD) alebo žĺtkového vačku (yolk sac diameter – YSD). Interpretácia týchto výsledkov však môže byť skreslená tým, že podobne CRL, aj referenčná hodnota pre YSD býva u diabetičiek oproti zdravým ženám zmenená. V tomto prípade býva zvýšená. Príčinou nepresností v datovaní tehotnosti môže byť aj fakt, že zvýšené hodnoty YSD môžu súvisieť s včasným vývojom potratu [1].
Obr. 1. Meranie vzdialenosti CRL (temeno-kostrč) v 8.<sup>+4</sup> týždni tehotnosti 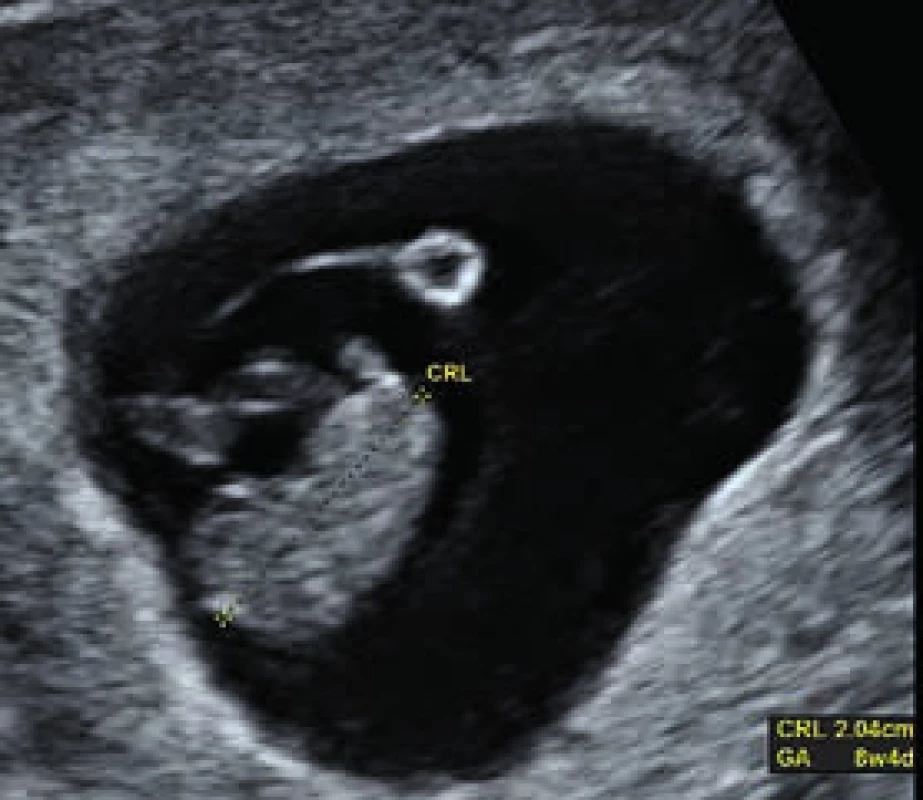
Pokrok spojený so zavedením transabdominálnej a transvaginálnej sonografie s vysokou rozlišovacou schopnosťou umožnil detailné posúdenie anatómie plodu už v prvom trimestri gravidity. Analýza viacerých štúdií posudzujúcich USG-hodnotenie morfológie plodu v prvom trimestri potvrdila možnosť detekcie veľkých malformácií v rozmedzí 48–84 % [2].
Vďaka rozlišovacej schopnosti moderných USG-prístrojov je možné už v prvom trimestri zhodnotením morfológie srdca plodu vylúčiť prítomnosť viacerých významných vrodených chýb srdca (AVSD, VSD, HLHS, Ebsteinova anomália a pod) alebo potvrdiť normálny vývoj CNS plodu a vylúčiť anomálie, ako sú anencefália a syndróm kaudálnej regresie. Posledný menovaný je typický pre tzv. diabetickú embryopatiu. Zoznam malformácií plodu, ktoré je možné diagnostikovať počas prvého trimestra gravidity, uvádza tabuľka.
Tab. 1. Malformácie plodu potenciálne detekovatelné v prvom trimestri gravidity. 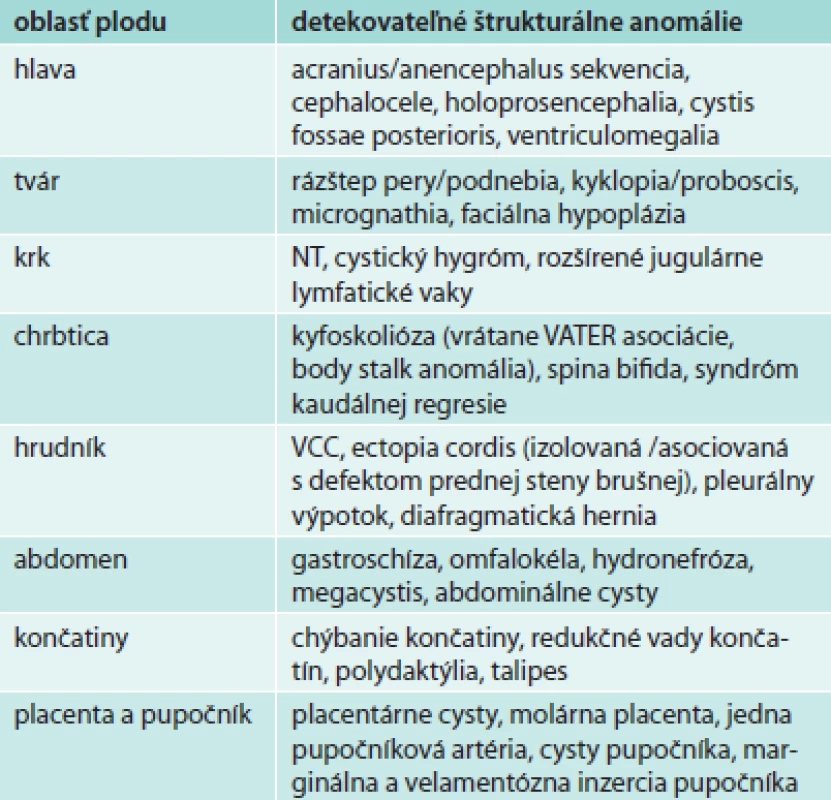
V štúdiách sledujúcich rizikové tehotnosti (diabetes mellitus) bola zaznamenaná najvyššia miera detekcie malformácií. V 5-ročnej prospektívnej štúdii na súbore 2 876 žien Ebrashy et al posudzovali efektivitu dvojfázového skríningu fetálnej anatómie. Štúdia preukázala až 82% úspešnosť morfologického posúdenia plodu transvaginálnou cestou v prvom trimestri gravidity. Bolo tiež potvrdené, že úspešnosť USG-zobrazenia nepriamo koreluje s hodnotou BMI tehotnej ženy [3]. Donedávna takmer nemysliteľné vyšetrenie anatómie plodu v prvom trimestri tehotnosti sa dnes stáva už štandardom USG-diagnostiky.
Prvotrimestrový skríning fetálnej aneuploídie
Kombinácia vyšetrenia viacerých USG-parametrov plodu v 11.–13.+6 týždni tehotnosti ako nuchálnej translucencie (NT), nosovej kosti (NB), fronto-maxilárneho faciálneho uhla (FMF), prietokometrie v ductus venosus (DV) a trikuspidálnej regurgitácie v srdci plodu (TR) spolu s vyšetrením sérových hladín tehotenského plazmatického proteínu A (PAPP-A) a voľnej hladiny β-podjednotky ľudského choriongonadotropínu (βHCG) je dnes štandarným spôsobom skríningu fetálnej aneuploídie (napr. Downov syndróm, trizómia 21) na rozhraní prvého trimestra tehotnosti (obr. 2) [4]. Hoci diabetes ženy nemá vplyv na výsledky merania NT, štúdie naznačili, že vyššie hodnoty NT (≥ 95. percentil) sú častejšie asociované s gestačným diabetes mellitus, poruchami glukózovej tolerancie a makrosómiou plodu. Naopak, sérové hladiny vyššie uvedených markerov, najmä βHCG, diabetom ovplyvnené sú, a preto je pri nich potrebná korekcia.
Obr. 2. USG-meranie NT (nuchálnej translucencie) u plodu v 12.<sup>+4</sup> týždni tehotnosti 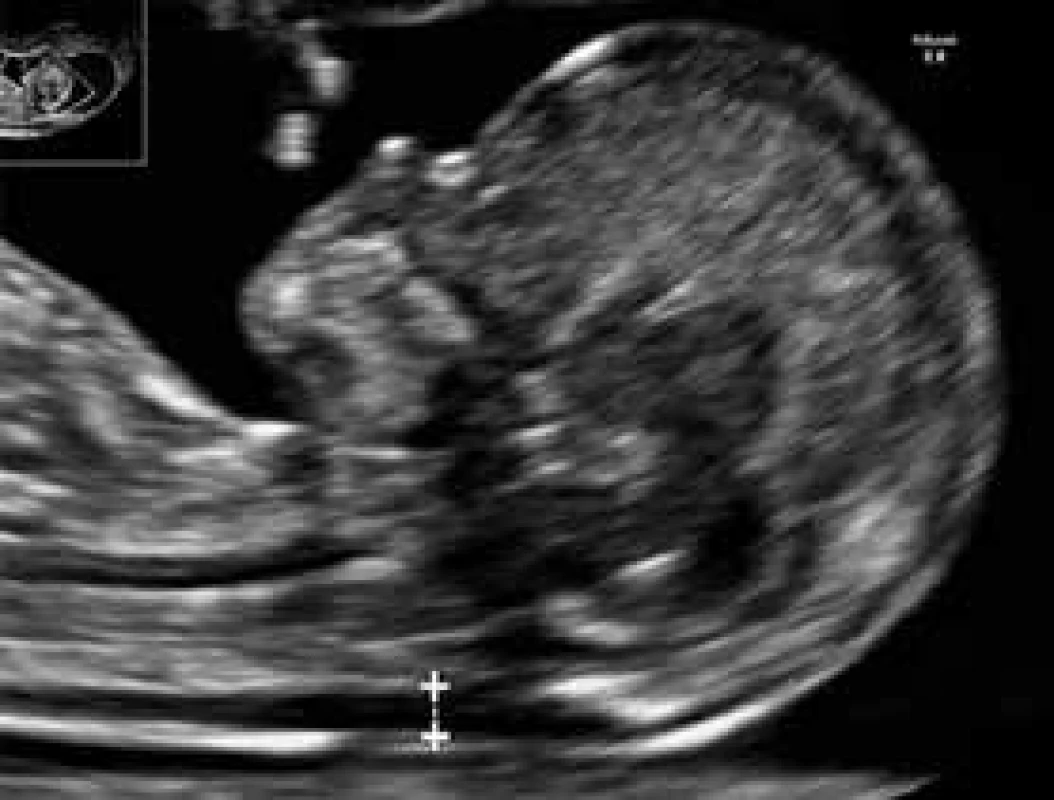
Možnosti včasnej predikcie komplikácií tehotnosti
Moderný perinatologický výskum sa zameriava hlavne na hľadanie stratégií, ktoré by umožnili včasnú predikciu klinicky významných komplikácií tehotnosti (napr. preeklampsia, rastová reštrikcia plodu, predčasný pôrod a pod). Mnohé z týchto stratégií zohľadňujú aj výsledky USG-merania. Plasencia et al ako prví popísali model včasnej predikcie preeklampsie na základe vyšetrenia prietoku krvi cez uterinnú artériu u tehotných žien v prvom trimestri gravidity. Ukázalo sa však, že tento model bol valídny len u nízkorizikovej populácie žien a nemá prakticky žiadny benefit u rizikových tehotných, ako napr. žien s preexistujúcim diabetom. Snahou bolo preto rozšíriť tento model o ďalšie materské rizikové faktory (sérové, anamnestické), ktorých inkorporácia by umožnila predikciu včasných a závažnejších (early-onset, < 34. týždňa) foriem preeklampsie [5,6]. Úplne najnovšie postupy predikcie dokonca využívajú použitie 3-D prietokových a objemových meraní (obr. 3).
Obr. 3. 3-D ultrasonografické zobrazenie plodu v 12.<sup>+2</sup> týždni tehotnosti 
Medzi časté patológie tehotnosti patria aj poruchy rastu plodu vedúce k jej nepriaznivému konečnému výsledku. S tým sa môžeme často stretnúť práve u žien s diabetom. Už aj v prvom trimestri tehotnosti sa črtajú možnosti včasnej predikcie týchto stavov. Napríklad tak bolo zistené, že u detí s nadmernou pôrodnou hmotnosťou (makrosómia, LGA plody – large for gestational age) boli hodnoty CRL merania v prvom trimestri signifikantne väčšie ako by sa očakávalo na základe datovania tehotnosti a aj v porovnaní s plodmi s normálnou pôrodnou hmotnosťou pre daný gestačný týždeň [7]. S makrosómiou plodu bývajú pozitívne asociované aj hodnoty merania NT, sérových hladín PAPP-A a βHCG a anamnéza preexistujúceho diabetu. Naopak, nízke hodnoty NT a spomenutých sérových markerov sú asociované s pôrodmi detí s nízkou pôrodnou hmotnosťou [8,9].
Detekcia malformácií plodu v 2. trimestri
Druhý trimester tehotnosti je považovaný za najviac optimálny čas, kedy je možné úspešne realizovať „morfologické“ USG-vyšetrenie plodu za účelom diagnostiky významných fetálnych malformácií. O to viac sa to týka tehotností, ktorých priebeh je komplikovaný preexistujúcim diabetom. Hoci je známe, že na vzniku malformácií plodu participuje nedostatočná metabolická kompenzácia cukrovky v čase embryogenézy, výpovedná hodnota hladiny glykovaného hemoglobínu (HbA1c) je v tomto smere pomerne limitovaná. Platí však, že výskyt rôznych malformácií plodu dobre koreluje s narastajúcou hodnotou HbA1c a u tehotných žien s preexistujúcim diabetom môže dosahovať až 15 %. K najčastejšie sa vyskytujúcim chybám plodu patria vrodené chyby srdca zahrňujúce defekty septa a veľkých ciev srdca plodu. Pre detekciu anomálií plodu pomocou HbA1c však nie je možné stanoviť žiadnu kritickú hodnotu, pod ktorou by napríklad riziko malformácií neexistovalo. Z toho dôvodu je prenatálna diagnostika malformácií plodu takmer výlučnou záležitosťou uplatnenia sa USG.
Vrodené srdcové chyby (VSCH) sú najčastejším typom malformácií asociovaných s diabetom matky. Ďalšími frekventovanými sú anomálie centrálneho nervového systému, skeletu a urogenitálneho traktu plodu. Asi najšpecifickejšou anomáliou pre diabetes mellitus je tzv. syndróm kaudálnej regresie vyznačujúci sa čiastočnou alebo úplnou agenézou lumbosakrálnej chrbtice a neurologickým deficitom v oblasti dolných končatín. Hoci sa tento syndróm v bežnej populácii vyskytuje veľmi zriedkavo (1 : 60 000 tehotností), niektoré štatistiky uvádzajú až 1–2% výskyt u plodov žien diabetičiek [10]. Úspešnosť USG-detekcie fetálnych anomálií v druhom trimestri sa pohybuje na úrovni 80 %. Platí to však len pre terciárnu úroveň zdravotnej starostlivosti, kde sa predpokladá účasť expertov v USG-diagnostike. Významným problémom najmä diabetickej populácie, ktorý výrazne limituje možnosti USG, je vysoká prevalencia obezity u tehotných žien (vysoký BMI). Obezita sťažuje penetráciu USG-vlnenia tkanivami a nutné je preto voliť nižšie frekvencie USG vedúce ku strate potrebnej rozlišovacej schopnosti USG-zobrazenia. Uvádzaná miera detekcie malformácií plodov je tak pri diabete niekedy podstatne nižšia v porovnaní so zdravými ženami. Vo všeobecnosti možno povedať, že detekcia fetálnych anomálií so zvyšujúcim sa BMI klesá. U pacientok s extrémnou obezitou 3. stupňa (BMI ≥40 kg/m2) je napríklad len okolo 25 %. Znamená to, že aj po „normálnom“ výsledku morfologického USG-vyšetrenia plodu existuje tzv. reziduálne riziko fetálnej vývojovej anomálie, ktoré sa u žien s diabetom a normálnym BMI hýbe niekde na úrovni 4 % [11].
Fetálna echokardiografia (F-ECHO)
Jej prínos oproti štandardnému morfologickému USG-vyšetreniu je pri záchyte VSCH plodov žien s diabetom nejednoznačný. Uvádzaná prevalencia fetálnych VSCH u diabetičiek býva v rozmedzí 1,2–15 % [12]. Výsledky štúdií sa prikláňajú k názoru, že pri normálnom náleze rutinného morfologického vyšetrenia 4-dutinového rezu a výtokových traktov srdca plodu je ďalší prínos F-ECHO len minimálny. Analýza prínosu a nákladov použitím modelu viacerých rozhodnutí ukázala, že efektívnejší je taký spôsob USG-diagnostiky, ktorý znamená implementáciu F-ECHO až na základe abnormálneho výsledku rutinného skenu. Univerzálny skríning pomocou F-ECHO u tehotných s diabetom by v USA podľa odhadov priniesol len zbytočné navýšenie nákladov vo výške asi 424 797 USD [13]. Dôležité však je, že ten istý výskum potvrdil, že všetky skúmané skríningové stratégie boli nákladovo efektívnejšie ako skríning žiaden. Ani podľa iných autorov nemá univerzálny skríning F-ECHO u diabetických žien pri normálnom výsledku bežného USG-morfologického vyšetrenia výraznejší význam [14].
Okrem možnosti presnejšej diagnostiky vrodených vývojových chýb plodu môže USG-vyšetrenie v druhom trimestri napomôcť aj pri datovaní tehotnosti, najmä ak z nejakého dôvodu toto nebolo možné realizovať už v trimestri prvom.
Hodnotenie plodu v 3. trimestri tehotnosti
K hlavným úlohám USG-diagnostiky v tejto fáze tehotnosti patrí posúdenie rastu plodu, odhad jeho hmotnosti (estimated fetal weight – EFW), kontrola jeho uloženia v maternici a verifikácia celkového stavu plodu (well-being). Pacientky s diabetom sú obvykle USG-monitorované každé 3 až 4 týždne, pokiaľ si to ich stav alebo stav plodu nevyžaduje častejšie. U plodov diabetičiek sa častejšie vyskytuje makrosómia plodu a pôrod dieťaťa s nadmernou pôrodnou hmotnosťou pre daný gestačný vek (large for gestational age – LGA, pôrodná hmotnosť > 90. percentil). V prípade chronických komplikácií diabetu sú naopak plody vystavené riziku spomaleného rastu, tzv. rastovej reštrikcii. Deje sa tak pri poruchách vývoja placenty s rozvojom chronickej placentárnej insuficiencie v dôsledku diabetickej vaskulopatie u tehotnej ženy. Makrosómia plodu je však v tomto ohľade pre preexistujúci diabetes mellitus podstatne špecifickejšia.
Makrosómia plodu býva definovaná na základe EFW > 90. percentil pre daný gestačný týždeň. K jej dôsledkom patrí zvýšená frekvencia pôrodného traumatizmu u rodičky a novorodenca ako aj zvýšenie perinatálnej mortality [15]. Nedávna štúdia porovnávajúca viac ako 5 000 tehotností s preexistujúcim diabetom u tehotnej s viac ako 1,2 miliónom tehotností zdravých žien preukázala, že riziko makrosómie plodu bolo u diabetičiek 12,6 % oproti 3,9 % u zdravých žien. V priebehu rokov je možné v populácii tehotných diabetičiek pozorovať nárast frekvencie pôrodov nadmerne veľkých (LGA) detí. Kým v rokoch 1991–1997 bol ich výskyt 27,6 %, v rozmedzí rokov 1998–2003 ich podiel stúpol až na 35 %. V rovnakých časových rozmedziach bol u zdravých žien zistený nárast len o 0,4 %. V prípade pokračovania takéhoto trendu možno do budúcna očakávať tiež rast súvisiacej materskej a neonatálnej morbidity. Pri prevencii tohto vývoja bude zohrávať svoju úlohu aj spresnenie USG-odhadu pôrodnej hmotnosti plodu, najmä čo sa týka rizikovej populácie žien s diabetom [16].
Podľa údajov sa senzitivita USG-diagnostiky v predikcii makrosómie plodu pohybuje v rozmedzí 33–83 % a špecificita 77–98 %. Konkrétne výsledky však závisia od typu matematického vzorca použitého na výpočet odhadu hmotnosti. Organizácia ACOG v USA uvádza, že „aj keď môže byť diagnostika makrosómie pomocou USG-diagnostiky nepresná, profylaktické ukončenie tehotnosti cisárskym rezom je indikované pri EFW > 5 000 g u žien bez diabetu a > 4 500 g u žien s diabetom“. U tehotných diabetičiek je oproti zdravým ženám tiež vhodné akceptovať nižšiu hraničnú hodnotu EFW (o 500 g) vzhľadom na častý výskyt závažnej dystokie ramienok plodu počas pôrodu. Príčina tejto komplikácie tkvie v rozdielnej distribúcii telesnej hmotnosti u plodov diabetičiek. Dôvodom nižšej hranice je aj presnosť USG-merania, pretože podcenenie makrosómie podľa odhadu EFW vedie k významnému nárastu materského aj neonatálneho pôrodného traumatizmu [17].
Vo viacerých štúdiách boli porovnávané rozdielne matematické modely predikcie makrosómie plodu. Všeobecne je známe, že obvod bruška plodu (AC) je USG-parametrom, ktorý býva pri poruchách rastu plodu najviac ovplyvnený, pretože práve pečeň je orgánom, ktorého veľkosť býva dostupnosťou živín najviac zmenená. Ukázalo sa, že meranie dĺžky pečene u plodu dobre koreluje s hodnotami glykémie diabetičky. Zaujímavé je, že pomer AC a priemeru retroperitoneálneho priestoru nebýva pri poruchách rastu plodu významnejšie zmenený. Súvisí to zrejme s tým, že orgány uložené peritoneálne aj retroperitoneálne sú pri poruchách rastu postihnuté približne proporcionálne. Podľa niektorých autorov umožňuje meranie plochy priečneho rezu pupočnou šnúrou spolu s hodnotením AC (> 95. percentil) dosiahnuť 100% predikciu fetálnej makrosómie. Túto hypotézu však následné štúdie nepotvrdili [18]. Posudzovanie množstva plodovej vody a EFW (> 4 000 g) býva tiež asociované s pôrodmi nadmerne veľkých (LGA) novorodencov, no tento postup v podstate nezlepšuje možnosti predikcie makrosómie plodu v porovnaní so samotným EFW [19].
Pri predikcii makrosómie plodov u diabetičiek bývajú často využívané aj merania hrúbky mäkkých tkanív plodu. U makrosomickych plodov žien liečených inzulínom bola popísaná signifikantne väčšia hrúbku prednej brušnej steny (anterior abdominal wall – AAW). Na základe výpočtu hraničných hodnôt AAW pre daný gestačný týždeň sa potvrdilo, že vyššie hodnoty AAW alebo AC > 90. percentil dokážu zvýšiť validitu predikcie LGA novorodencov až na 88 % [20]. Regresné rovnice zahrňujúce aj hrúbku mäkkých tkanív plodu (stehno) takisto umožnili zlepšiť výpovednú hodnotu odhadu, tá však opäť nebola signifikantne lepšia oproti štandardnému vzorcu pre výpočet EFW [21]. Meranie vzdialenosti „líčko – líčko“ u plodu (cheek-cheek diameter – CCD) bolo na 94 % asociované s potrebou cisárskeho rezu, a to nezávisle od EFW. Sľubné sa ďalej zdajú aj 3-D objemové merania rôznych častí plodu (stehno, rameno), ale v klinickej praxi nie sú zatiaľ širšie využívané, hoci týmto spôsobom je možné docieliť zníženie chyby odhadu EFW z 8,5 % v prípade vzorca podľa Hadlocka na hodnotu 6,6 % (obr. 4) [22].
Obr. 4. 3-D ultrasonografické zobrazenie profilu tváre v 28.<sup>+6</sup> týždni tehotnosti 
Posúdenie stavu plodu ku koncu tehotnosti
U diabetičiek je zvýšené aj riziko mŕtvorodenosti ich detí. Podľa švédskej štúdie bol pomer šancí pre mŕtvorodenosť detí žien diabetičiek oproti zdravým ženám na úrovni 3,34 (fetálne straty > 20. týždni) [16]. Aj napriek celkovo klesajúcemu trendu mŕtvorodenosti u diabetičiek od 50. rokov 20. storočia, sa jej aktuálna hodnota pohybuje na úrovni 5,9 prípadu na 1 000 živonarodených detí, čo je stále hodnota vyššia oproti bežnej populácii so 4 prípadmi na 1 000 živonarodených detí [23]. Z týchto dôvodov je tehotným ženám s preexistujúcim diabetom odporúčané častejšie antenatálne sledovanie stavu ich plodu. Zvyčajne sa tak deje formou sériových non-stress testov (NST), hodnotenia biofyzikálneho skóre (USG-hodnotenie tonusu, pohybov, dýchacích pohybov plodu a množstva plodovej vody spolu s NST) a posúdením USG-prietokových parametrov vo fetoplacentárnej cirkulácii [24]. Normálny výsledok NST testovania 2-krát týždenne má potom viac ako 90% negatívnu prediktívnu hodnotu pre mŕtvorodenosť detí diabetičiek. Vzhľadom na to, že pozitívna prediktívna hodnota nepriaznivého výsledku tehotnosti je pri nereaktívnom NST iba 50–70 %, odporúča sa v prípadoch nereaktívneho NST pokračovať v robení biofyzikálneho profilu s doplnením USG-meraní o vyššie uvedené parametre. Zaujímavým zistením je, že plody diabetičiek mávajú aj napriek normálnemu NST a biofyzikálnemu skóre nižšie hodnoty pupočníkového pH (z kordocentézy) oproti plodom zdravých žien. To bolo aj jedným z dôvodov zaradenia USG-vyšetrenia fetoplacentárnej cirkulácie do hodnotenia celkového stavu plodu u žien diabetičiek. USG-vyšetrenie pupočníkovej cirkulácie dobre odráža stupeň rezistencie v patologicky zmenenej placente a už dávno sa takéto vyšetrenie využíva pri hodnotení stavu plodu s rastovou reštrikciou. Štúdie u žien s preexistujúcim diabetom však potvrdili nedostatočnú validitu a nízku senzitivitu pupočníkovej prietokometrie u plodu (cca 35 %) pre detekciu komplikácií tehotnosti. V súčasnej dobe tak nie sú dôvody na výmenu bežne používaného NST skríningu a biofyzikálneho skóre za USG-prietokometriu s cieľom zlepšovania predikcie komplikácií tehotností u žien diabetičiek.
Ďalšie aplikácie ultrasonografie v 3. trimestri
V predchádzajúcich statiach bola popísaná úloha F-ECHO pri diagnostike štrukturálnych VSCH plodu. Aj v 3. trimestri existuje u tehotných diabetičiek potenciál pre jej zaradenie do prenatálneho skríningu. Je známe, že asi 30 % novorodencov žien s preexistujúcim diabetom sa rodí s diabetickou kardiomyopatiou (DKM). Väčšina týchto detí býva asymptomatická a k rezolúcii nálezu DKM dochádza už v priebehu prvých 2 až 4 týždňov po pôrode [23]. Spočiatku sa predpokadalo, že DKM majú len plody a novorodenci tých matiek, ktoré nemali v tehotnosti dostatočnú kontrolu glykémie. DKM s hypertrofiou pravej komory srdca a mezikomorového septa bola popísaná aj u plodov žien s dobrou metabolickou kontrolou diabetu. Tieto poznatky potvrdili aj ďalšie štúdie u žien s metabolicky dobre kontrolovaným diabetom 1. typu. Navyše, u ich plodov boli takisto popísané poruchy diastolickej funkcie srdca, a to nezávisle na prítomnosti DKM [25]. Hoci preto dnes neexistuje žiaden štandardný spôsob skríningu DKM pomocou F-ECHO u žien s diabetom, dá sa očakávať, že ak by predsa len vznikol, umožňoval by lepšie plánovanie ukončovania rizikovej tehotnosti žien s preexistujúcim diabetom.
Zhrnutie
Spektrum úloh, ktoré zastáva USG-diagnostika v manažmente tehotností komplikovaných diabetom ženy je veľmi široké. Patrí sem posúdenie lokalizácie, vývoja a viability tehotnosti v jej najvčasnejších fázach vývoja, ako aj možnosť včasného a detailného morfologického vyšetrenia plodu. Významným miestom jej aplikácie je možnosť včasného posúdenia rizika genetického postihnutia plodu, ktoré je aj napriek rýchlemu vývoju metód neinvazívnej prenatálnej diagnostiky cenovo jasne výhodnejšie. V neskorších fázach tehotnosti USG-diagnostika umožňuje posudzovanie rastu, odhad pôrodnej hmotnosti, uloženia aj celkového stavu plodu. USG-diagnostika poskytuje klinicky cenné informácie o stave a vývoji plodu in utero, ktoré sú o to cennejšie, ak ide o rizikovú graviditu žien s preexistujúcim diabetom. Dá sa očakávať, že význam USG-diagnostiky bude v perinatológii naďalej narastať, a to hlavne vďaka vývoju a zavádzaniu nových možností UZ zobrazovania pomocou 3-D a 4-D technológií.
Otištěno s laskavým svolením vydavatelství Facta Medica, redakční rady a šéfredaktora časopisu Forum diabetologicum.
Poprvé publikováno ve Forum Diab 2014; 3(2): 87–92.
MUDr. Karol Dókuš, PhD.
dokus@jfmed.uniba.sk
prof. MUDr. Ján Danko, CSc.
Gynekologicko-pôrodnícka klinika JLF UK a MFN Martin
www.jfmed.uniba.sk
MUDr. Silvia Dókušová
doc. MUDr. Emil Martinka, PhD.
www.nedu.sk
Zdroje
1. Berdahl DM, Blaine J, Van Voorhis B et al.: Detection of enlarged yolk sac on early ultrasound is associated with adverse pregnancy outcomes. Fertil Steril 2010; 94(4): 1535–1537.
2. Timor-Tritsch IE, Fuchs KM, Monteagudo A et al. Performing a fetal anatomy scan at the time of first-trimester screening. Obstet Gynecol 2009; 113(2 Pt 1): 402–407.
3. Ebrashy A, El Kateb A, Momtaz M et al. 13–14-week fetal anatomy scan: a 5-year prospective study. Ultrasound Obstet Gynecol 2010; 35(3): 292–296.
4. Spencer K, Cowans NJ, Spencer CE et al. A re-evaluation of the influence of maternal insulin-dependent diabetes on fetal nuchal translucency thickness and first-trimester maternal serum biochemical markers of aneuploidy. Prenat Diagn 2010; 30(10): 937–940.
5. Plasencia W, Maiz N, Bonino S et al. Uterine artery Doppler at 11 + 0 to 13 + 6 weeks in the prediction of pre-eclampsia. Ultrasound Obstet Gynecol 2007; 30(5): 742–749.
6. Herraiz I, Arbues J, Camano I et al. Application of a first - trimester prediction model for pre-eclampsia based on uterine arteries and maternal history in high-risk pregnancies. Prenat Diagn 2009; 29(12): 1123–1129.
7. Hackmon R, Le Scale KB, Horani J et al. Is severe macrosomia manifested at 11–14 weeks of gestation? Ultrasound Obstet Gynecol 2008; 32(6): 740–743.
8. Poon LC, Karagiannis G, Stratieva V et al. First-trimester prediction of macrosomia. Fetal Diagn Ther 2011; 29(2): 139–147.
9. Poon LC, Karagiannis G, Staboulidou I et al. Reference range of birth weight with gestation and first-trimester prediction of small - for-gestation neonates. Prenat Diagn 2011; 31(1): 58–65.
10. Bashiri A, Shizaf B, Burstein E et al. Three dimensional ultrasound diagnosis of caudal regression syndrome at 14 gestational weeks. Arch Gynecol Obstet 2009; 280(3): 505–507.
11. Dashe JS, McIntire DD, Twickler DM. Effect of maternal obesity on the ultrasound detection of anomalous fetuses. Obstet Gynecol 2009; 113(5): 1001–1007.
12. Davey BT, Seubert DE, Phoon CK. Indications for fetal echocardiography high referral, low yield? Obstet Gynecol Surv 2009; 64(6): 405–415.
13. Odibo AO, Coassola KM, Stamilio DM et al. Should all pregnant diabetic women undergo a fetal echocardiography? A cost-effectiveness analysis comparing four screening strategies. Prenat Diagn 2006; 26(1): 39–44.
14. Sekhavat S, Kishore N, Levine JC. Screening fetal echocardiography in diabetic mothers with normal findings on detailed anatomic survey. Ultrasound Obstet Gynecol 2010; 35(2): 178–182.
15. Sacks DA. Etiology, detection, and management of fetal macrosomia in pregnancies complicated by diabetes mellitus. Clin Obstet Gynecol 2007; 50(4): 980–989.
16. Persson M, Norman M, Hanson U. Obstetric and perinatal outcomes in type 1 diabetic pregnancies: a large, population-based study. Diabetes Care 2009; 32(11): 2005–2009.
17. Melamed N, Yogev Y, Meizner I et al. Sonographic prediction of fetal macrosomia: the consequences of false diagnosis. J Ultrasound Med 2010; 29(2): 225–230.
18. Cromi A, Ghezzi F, Di Naro E et al. Large cross-sectional area of the umbilical cord as a predictor of fetal macrosomia. Ultrasound Obstet Gynecol 2007; 30(6): 861–866.
19. Ben-Haroush A, Melamed N, Mashiach R et al. Use of the amniotic fluid index combined with estimated fetal weight within 10 days of delivery for prediction of macrosomia at birth. J Ultrasound Med 2008; 27(7): 1029–1032.
20. Higgins MF, Russell NM, Mulcahy CH et al. Fetal anterior abdominal wall thickness in diabetic pregnancy. Eur J Obstet Gynecol Reprod Biol 2008; 140(1): 43–47.
21. Scioscia M, Scioscia F, Vimercati A et al. Estimation of fetal weight by measurement of fetal thigh soft-tissue thickness in the late third trimester. Ultrasound Obstet Gynecol 2008; 31(3): 314–320.
22. Lee W, Balasubramaniam M, Deter RL, et al. New fetal weight estimation models using fractional limb volume. Ultrasound Obstet Gynecol 2009; 34(5): 556–565.
23. Dudley DJ. Diabetic-associated stillbirth: incidence, pathophysiology, and prevention. Clin Perinatol 2007; 34(4): 611–626.
24. Graves CR. Antepartum fetal surveillance and timing of delivery in the pregnancy complicated by diabetes mellitus. Clin Obstet Gynecol 2007; 50(4): 1007–1013.
25. Hatem MA, Zielinsky P, Hatem DM et al. Assessment of diastolic ventricular function in fetuses of diabetic mothers using tissue Doppler. Cardiol Young 2008; 18(3): 297–302.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Těhotná kuřačkaČlánek Sexualita v graviditě
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2014 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Vážení čtenáři, a tedy snad i přátelé Praktické gynekologie,
- Rozhovor s doc. MUDr. Michaelem Halaškou, Ph.D., prezidentem European Network of Young Gynae Oncologists (ENYGO) o poslání a přínosu této organizace
- Výhodné vlastnosti gestodenu a jejich využití v kombinované hormonální antikoncepci
- Vedenie tehotnej diabetičky diabetológom
- Miesto ultrasonografickej diagnostiky v sledovaní gravidity komplikovanej diabetom tehotnej ženy
- Novinky v laboratorní diagnostice a predikci preeklampsie
- Jsou vaginálně aplikované izoflavony vhodnou náhradou estrogenů?
- Odvykání kouření v těhotenství
- Těhotná kuřačka
- Sexualita v graviditě
- Atypické nálezy v diagnostice prekanceróz a karcinomu děložního hrdla: kazuistiky
- Partnerské vztahy a sexuální život u žen s nádorovým onemocněním
- Posudek soudního znalce v dětské gynekologii
- Syndrom vyhoření – kritický pohled
- International Menopause Society – 14th World Congress on the Menopause
- Laura Janáčková. Život je boj. Praktický průvodce rakovinou pro nemocné a jejich blízké.
- Růžičková Kirchnerová O, Teřl M. Diagnostika a léčba plicních onemocnění v těhotenství.
- Měchurová A. Kardiotokografie.
- Mára M et al. Vybrané kazuistiky z gynekologické endoskopie.
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výhodné vlastnosti gestodenu a jejich využití v kombinované hormonální antikoncepci
- Atypické nálezy v diagnostice prekanceróz a karcinomu děložního hrdla: kazuistiky
- Jsou vaginálně aplikované izoflavony vhodnou náhradou estrogenů?
- Odvykání kouření v těhotenství
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



