-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty
Docetaxel–Cabazitaxel–Enzalutamide Versus Docetaxel–Enzalutamide in Patients with Metastatic Castration-resistant Prostate Cancer
Aim:
The aim of this retrospective study was to compare the efficacy of the sequence docetaxel–cabazitaxel–enzalutamide vs. docetaxel–enzalutamide in patients with metastatic castration-resistant prostate cancer.Patients and Methods:
Of the cohort of 35 patients, 11 were treated with the sequence docetaxel–cabazitaxel–enzalutamide and 24 were treated with the sequence docetaxel–enzalutamide. The doses were as follows: docetaxel, 75 mg/m2; cabazitaxel, 25 mg/m2; and enzalutamide, 160 mg/day. Overall survival (OS) was defined as the interval between the initial dose of docetaxel and death or the date of the last control for survivors (censored). OS was assessed using the Kaplan-Meier method, and the two arms were compared using the log-rank test. The significance level for all statistical tests was set at α = 0.05.Results:
The median OS of patients treated with the sequence docetaxel–cabazitaxel–enzalutamide was 28.8 months, vs. 24.4 months in patients treated with the sequence docetaxel–enzalutamide. No statistically significance differences in OS were found between the two arms (HR 0.678, 95% CI 0.264–1.744; p = 0.418). Grade 3–4 toxicity was observed for each drug, as follows: docetaxel: fatigue and peripheral neuropathy in six patients, nausea in three patients, and diarrhea and neutropenia in one patient; cabazitaxel: anemia in two patients and neutropenia in one patient; and enzalutamide: anemia in six patients, thrombocytopenia in two patients, and cerebral hemorrhage in one patient.Conclusion:
No statistically significant differences in OS were found between the sequences docetaxel–cabazitaxel–enzalutamide and docetaxel–enzalutamide.Key words:
prostate cancer – metastasis – chemotherapy – targeted hormonal treatment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
13. 2. 2017Accepted:
20. 3. 2017
Autoři: I. Richter 1,2; J. Dvořák 2
; J. Bartoš 1
Působiště autorů: Onkologické oddělení, Krajská nemocnice Liberec, a. s. 1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha 2
Vyšlo v časopise: Klin Onkol 2017; 30(4): 289-293
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2017289Souhrn
Cíl:
Cílem prezentované práce je retrospektivní zhodnocení všech pacientů s metastatickým kastračně rezistentním karcinomem prostaty léčených sekvencí docetaxel–kabazitaxel–enzalutamid a sekvencí docetaxel–enzalutamid.Pacienti a metody:
Celkem 11 pacientů bylo léčeno sekvencí docetaxel–kabazitaxel–enzalutamid, 24 pacientů bylo léčeno sekvencí docetaxel–enzalutamid. Dávkování bylo standardní (docetaxel 75 mg/m2 à 3 týdny, kabazitaxel 25 mg/m2 à 3 týdny, enzalutamid 160 mg/den, cyklus à 28 dnů). Celkové přežití (overall survival – OS) jsme definovali jako dobu od zahájení terapie docetaxelem do data úmrtí nebo k datu poslední kontroly u přeživších pacientů (cenzorovaná data). Analýza OS byla vypočtena pomocí Kaplan-Meierovy analýzy. Srovnání léčebných výsledků obou ramen jsme analyzovali pomocí log-rank testu. Statistická analýza byla hodnocena na hladině významnosti 0,05.Výsledky:
Medián OS u pacientů léčených sekvencí docetaxel–kabazitaxel–enzalutamid činil 28,8 měsíce, medián OS u pacientů léčených sekvencí docetaxel–enzalutamid činil 28,4 měsíce. Nebyl prokázán statisticky významný rozdíl v OS mezi oběma rameny (HR 0,678, 95% CI 0,264–1,744; p = 0,418). Toxicita stupně 3 a 4: docetaxel: únava a periferní neuropatie u šesti, nevolnost u tří, průjem a neutropenie u jednoho pacienta; kabazitaxel: anémie u dvou a neutropenie u jednoho pacienta; enzalutamid: anémie u šesti, trombocytopenie u dvou a hemoragická mozková příhoda u jednoho pacienta.Závěr:
Neprokázali jsme statisticky významný rozdíl v OS mezi oběma hodnocenými rameny.Klíčová slova:
karcinom prostaty – metastázy – chemoterapie – cílená hormonální léčbaÚvod
Karcinom prostaty patří mezi nejčastější onkologická onemocnění u mužů [1]. Metastatický karcinom prostaty je prakticky vždy zpočátku hormonálně senzitivní onemocnění. Postupem času dochází k poklesu účinku na primární hormonální léčbu, i přes kastrační hodnoty testosteronu. Onemocnění definujeme jako kastračně rezistentní karcinom prostaty (castration-resistant prostate cancer – CRPC) [2]. V roce 2004 byly publikovány dvě klinické studie TAX 327 a SWOG 9916, které prokázaly významné prodloužení celkového přežití (overall survival – OS) u pacientů s metastatickým CRPC (mCRPC). Obě studie hodnotily jako nové cytostatikum docetaxel [3,4]. Docetaxel v kombinaci s prednisonem se stal následně standardem léčby 1. linie mCRPC [5–7]. Další linie léčby po 1. linii léčby nebyly dlouho standardně definované. V roce 2010 byly publikovány výsledky randomizované klinické studie III. fáze, která hodnotila kabazitaxel a mitoxantron v kombinaci s prednisonem u 755 pacientů s mCRPC, kteří byli předléčeni docetaxelem. Studie prokázala významné prodloužení OS u pacientů léčených kabazitaxelem (15,1 vs. 12,7 měsíce), byla popsána 30% redukce relativního rizika úmrtí (HR 0,7, 95% CI 0,59–0,83; p < 0,0001) [8]. Další publikované práce potvrdily, že i přes kastrační hodnoty testosteronu má aktivace androgenního receptoru (AR) významný vliv na progresi onemocnění [9–11]. Enzalutamid patří mezi ireverzibilní inhibitor AR, který prokázal významné prodloužení OS u pacientů s mCRPC po předchozí terapii docetaxelem (18,4 vs. 13,6 měsíce, HR 0,63, 95% CI 0,53–0,75; p < 0,001) ve srovnání s placebem [12]. Na našem oddělení jsme začali kabazitaxel používat od roku 2013, enzalutamid od roku 2014 po předchozí terapii docetaxelem [13,14]. Hledání optimální léčebné sekvence u pacientů s mCRPC je vysoce aktuální. Cílem naší prezentované práce je retrospektivní zhodnocení všech pacientů s mCRPC léčených sekvencí docetaxel–kabazitaxel–enzalutamid a sekvencí docetaxel–enzalutamid.
Pacienti a metody
Celkem jsme retrospektivně hodnotili 35 nemocných s mCRPC léčených na našem oddělení. Sekvencí docetaxel–ka-bazitaxel–enzalutamid bylo léčeno 11 pacientů, 24 pacientů bylo léčeno sekvencí docetaxel–enzalutamid. Demografická data a vstupní charakteristika obou souborů pacientů jsou uvedeny v tab. 1. Dávkování bylo standardní – docetaxel byl podáván v dávce 75 mg/m2 à 3 týdny společně s prednisonem 10 mg/den, kabazitaxel byl podáván v dávce 25 mg/m2 à 3 týdny opět s prednisonem 10 mg/den. Enzalutamid byl aplikován v dávce 160 mg/den, cyklus byl à 28 dnů. U žádného pacienta léčeného enzalutamidem nebyly indikovány kortikoidy. Pro léčebnou sekvenci docetaxel–kabazitaxel–enzalutamid byli indikováni nemocní po léčbě docetaxelem, kteří buď progredovali na docetaxel v průběhu jeho terapie, nebo do 3 měsíců od ukončení terapie docetaxelem (ve smyslu tehdejší úhradové vyhlášky). Maximální počet aplikovaných cyklů kabazitaxelu byl omezen plátcem na 10, stejná délka léčby byla i u nemocných ve studii TROPIC [8]. Do léčebné sekvence docetaxel–enzalutamid jsme indikovali nemocné s trváním léčebné odpovědi po terapii docetaxelem delší než 3 měsíce. Enzalutamid byl dále indikován u pacientů, kteří progredovali na docetaxel a současně byli v horším výkonnostním stavu (podle ECOG 2) nebo měli výraznější toxické projevy na docetaxel a další cytostatickou terapii odmítli.
Tab. 1. Vstupní charakteristika souboru. 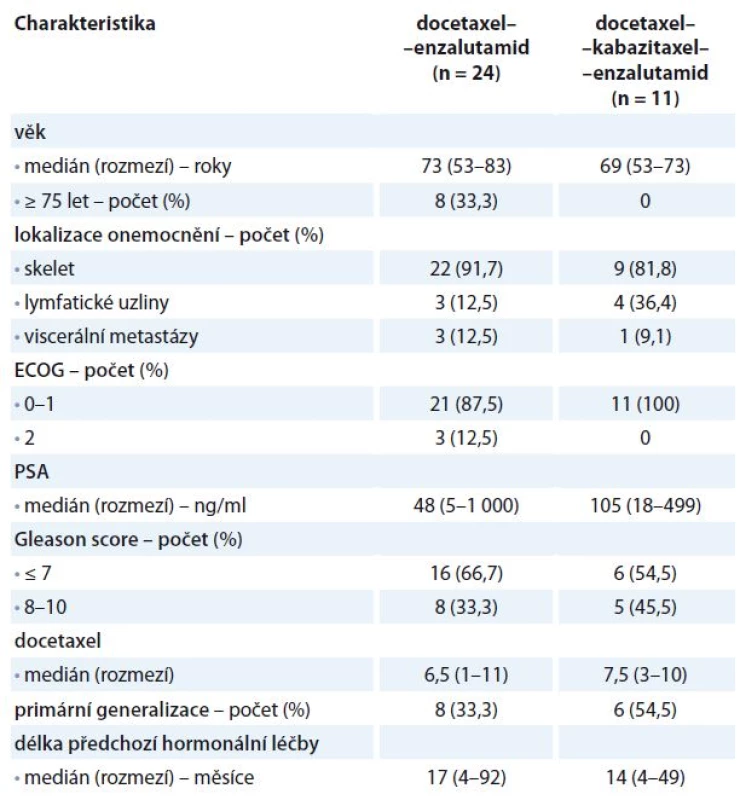
PSA – prostatický specifický antigen Cílem bylo zhodnocení OS obou léčebných ramen. OS jsme definovali jako dobu od zahájení terapie docetaxelem do data úmrtí nebo k datu poslední kontroly u přeživších pacientů (cenzorovaná data). Analýza OS byla vypočtena pomocí Kaplan-Meierovy analýzy. Srovnání léčebných výsledků obou ramen jsme analyzovali pomocí log-rank testu. Statistická analýza byla hodnocena na hladině významnosti 0,05.
Výsledky
V ramenu docetaxel–kabazitaxel–enzalutamid byl medián počtu cyklů docetaxelu 7,5 (rozmezí 3–10). U pěti pacientů bylo podáno méně než 10 cyklů docetaxelu z důvodu progrese onemocnění v průběhu této léčby. Ani u jednoho pacienta jsme léčbu docetaxelem neukončili předčasně z důvodu toxicity. Medián počtu cyklů kabazitaxelu byl 10 (rozmezí 2–10) cyklů. U čtyř pacientů jsme aplikovali méně než plánovaných 10 cyklů kabazitaxelu z důvodu progrese onemocnění. V době hodnocení celkem zemřelo osm pacientů (72,7 %) v této léčebné sekvenci. V ramenu docetaxel–enzalutamid byl medián počtu cyklů docetaxelu 6,5 (rozmezí 1–11). U 10 pacientů bylo podáno méně než 10 cyklů z důvodu toxicity. V době hodnocení zemřelo celkem 10 pacientů (41,6 %). Medián OS u pacientů léčených sekvencí docetaxel–kabazitaxel–enzalutamid činil 28,8 měsíce, medián OS u pacientů léčených sekvencí docetaxel–enzalutamid činil 28,4 měsíce (graf 1). Nebyl prokázán statisticky významný rozdíl v OS mezi oběma rameny (HR 0,678, 95% CI 0,264–1,744; p = 0,418).
Graf 1. Celkové přežití pacientů. 
Při hodnocení toxicity jsme pozorovali převážně toxicitu stupně 1 a 2, která nebyla důvodem k ukončení či přerušení léčby. Toxicita stupně 3 a 4 byla vyjádřená následně – u pacientů léčených docetaxelem jsme pozorovali únavu a periferní neuropatii u šesti, nevolnost u tří, průjem a neutropenii u jednoho pacienta. Z důvodu toxicity jsme ukončili podávaní docetaxelu u 10 pacientů (všichni v sekvencí docetaxel–enzalutamid). U pacientů léčených kabazitaxelem jsme popsali toxicitu stupně 3 a 4 – anémie u dvou a neutropenie u jednoho pacienta. U pacientů léčených enzalutamidem jsme pozorovali toxicitu stupně 3 a 4 následně – anémie u šesti, trombocytopenie u dvou a hemoragická mozková příhoda u jednoho pacienta.
Diskuze
V rámci našeho hodnocení jsme neprokázali statisticky významný rozdíl v OS obou léčebných sekvencí. Na podkladě našich výsledků si lze položit otázku, zda je vhodnější aplikovat náročnější léčbu ve trojsekvenci, nebo stačí u pacientů indikovat jenom sekvenci docetaxelu a cílené hormonální léčby. Při ozřejmění této problematiky můžeme vycházet ze vstupních charakteristik obou souborů. V ramenu docetaxel–kabazitaxel–enzalutamid se jednalo o mladší nemocné, žádný pacient nebyl starší než 75 let, pacienti měli relativně nižší výskyt kostních metastáz, měli vyšší medián PSA před zahájením terapie, vyšší hodnoty Gleason skóre, bylo vyšší zastoupení pacientů s primární generalizací a kratší dobou předchozí hormonální terapie pro metastatický karcinom než ve skupině pacientů léčených docetaxelem a enzalutamidem (tab. 1). Tedy pacienti léčení sekvencí docetaxel–kabazitaxel–enzalutamid měli horší prognostické faktory. Dále u pacientů této trojsekvence byla buď progrese na docetaxel v průběhu jeho terapie, nebo do 3 měsíců po ukončení jeho podávaní. V ramenu docetaxel–enzalutamid byla většina nemocných s léčebnou odpovědí na docetaxel, která trvala delší dobu než 3 měsíce po ukončení podávání docetaxelu. V této skupině pacientů byla progrese v průběhu terapie docetaxelem nebo do 3 měsíců od jejího ukončení popsána jenom u pěti pacientů (20,8 %). Lze tedy aplikaci kabazitaxelu chápat i jako „kompenzaci“ neúčinné léčby 1. linie docetaxelem s konečným důsledkem „vyrovnání“ léčebných výsledků obou ramen. Na podkladě našeho zhodnocení považujeme kabazitaxel u vybraných pacientů za důležitou součást léčebné strategie mCRPC. Je dále otázkou, jaký bude mít vliv na léčebné výsledky kabazitaxel po zrušení indikačního omezení s následnou možností aplikovat kabazitaxel i po delším časovém intervalu než 3 měsíce po selhání docetaxelu.
Celkově byla léčba v obou ramenech dobře tolerována, navíc se jednalo o skupinu starších mužů. Při léčbě docetaxelem byl limitující vznik periferní neuropatie jako příklad kumulativní toxicity [15]. Další terapie kabazitaxelem nezpůsobila zhoršení periferní neuropatie v našem souboru. V rámci studie TROPIC byla incidence závažné periferní neuropatie kabazitaxelu jenom u 0,8 % léčených pacientů. Při hodnocení hematologické toxicity ve studii TROPIC byl výskyt neutropenie až v 94 % případů. Až 82 % pacientů mělo vyjádřeno stupeň 3–4, z toho u 8 % pacientů se vyskytla febrilní neutropenie [8]. U nemocných léčených kabazitaxelem jsme vzhledem k jeho hematologické toxicitě aplikovali primární profylaxi pegfilgrastimem. Profylaktická aplikace růstových faktorů významně redukuje riziko vzniku neutropenie a její komplikaci (HR 0,7; p = 0,04) [16]. Mezi rizikové faktory vzniku neutropenie stupně 3–4 patří věk nad 75 let, aplikace prvního cyklu a počet neutrofilů méně než 4 000/mm3 před podáním kabazitaxelu [17]. Nejvíce nežádoucích hematologických účinků stupně 3 a 4 jsme pozorovali na terapii enzalutamidem, kde jsme anémii zaznamenali u 6 pacientů. Tato skutečnost mohla souviset s vyšší linií terapie, kde již byli pacienti s pokročilejším onemocněním a větším rozsahem kostního postižení, které mohlo mít vliv na omezení krvetvorby. Při hodnocení vlivu nadiru hemoglobinu u všech pacientů léčených enzalutamidem jsme prokázali v regresní analýze právě vznik anémie jako významný negativní prognostický znak na OS [18].
Při hodnocení našeho souboru jsme u prvního léčeného pacienta pozorovali po prvním cyklu kabazitaxelu rozvoj neutropenie stupně 3 s nutným odkladem dalšího cyklu léčby o týden. Proto jsme dále u všech pacientů léčených kabazitaxelem používali profylakticky pegfilgrastim. U pacientů jsme pak neutropenii stupně 3 a 4, která by limitovala podání léčby, již nepozorovali.
Zatím nemáme k dispozici větší prospektivní klinické studie, které by jednoznačně definovaly nejvýhodnější sekvenci terapie mCRPC po předchozí terapii docetaxelem. Preklinická data prokázala efekt kabazitaxelu po terapii docetaxelem i enzalutamidem [19]. Proběhlo několik, většinou retrospektivních hodnocení, která se zabývala problematikou nalezení optimální sekvence chemoterapie či cílené léčby proti androgennímu receptoru (tzv. ARTA terapie). Účinnost kabazitaxelu po předchozí léčbě docetaxelem a abirateronem hodnotily dvě významnější retrospektivní klinické studie. První francouzsko-britská studie neprokázala snížení léčebné odpovědi kabazitaxelu ve 3. linii ve srovnání s jeho výsledky v registrační studii TROPIC, kde byl podáván ve 2. linii léčby [20]. Naproti tomu nizozemská studie prokázala kratší medián podávání kabazitaxelu ve 3. linii než data z 2. linie ze studie TROPIC (2,8 vs. 4,9 měsíce), navíc došlo i k o jednu třetinu kratší době trvání poklesu PSA [21]. Další retrospektivní zhodnocení pacientů s mCRPC ze čtyř evropských zemí prezentoval v roce 2015 Oudard. Prokázal zlepšení OS u pacientů s trojsekvencí vedle použité dvojsekvence [22]. Problematiku hledání optimální sekvence léčby u pacientů s mCRPC „komplikuje“ i možnost podání ARTA terapie v 1. linii, ještě před aplikací docetaxelu [23,24]. Do popředí se dostává proto otázka možné zkřížené rezistence mezi cytostatickou léčbou a ARTA terapií. Zajímavou retrospektivní práci publikovali Mezynski et al, kteří retrospektivně hodnotili podání docetaxelu po předchozí terapii abirateronem. Jeho studie prokázala nižší aktivitu docetaxelu po terapii abirateronem než účinnost docetaxelu v 1. linii terapie prezentované ve studiích TAX 327 nebo SWOG 9916 [25]. Otázku interakce mezi AR a taxany hodnotilo několik studií. Taxany prokázaly interakci s androgenní signalizací v buňkách karcinomu prostaty, jednak v cytoplazmě, jednak na úrovni buněčného jádra, s vlivem na transkripční faktory androgenní genové exprese [26–29]. Hypotézu zkřížené rezistence mezi taxany a androgenní signální dráhou podporuje i další preklinická studie, která neprokázala protinádorový efekt docetaxelu a kabazitaxelu na abirateron rezistentních buňkách [30]. Výsledky výše zmíněných prací naznačují, že nové možnosti cílené hormonální léčby lze u pacientů schopných podstoupit chemoterapii aplikovat až po selhání chemoterapie, kde její efekt byl potvrzen ve studiích AFFIRM a COU-AA-301 [12,31]. Na druhé straně ale studie hodnotící docetaxel v běžné klinické praxi prokazují kratší medián OS než v registračních studiích TAX 327 nebo SWOG 9916. Například práce Templetona demonstrovala medián OS 13,6 měsíce, tedy hodnotu blížící se mediánu OS pro docetaxel po předchozí terapii abirateronem [25,32]. Potřeba prospektivních studií k ozřejmění této problematiky je vysoce aktuální.
Závěr
Naše retrospektivní práce neprokázala rozdíl v OS léčebných sekvencí docetaxel–kabazitaxel–enzalutamid a docetaxel–enzalutamid. Naše analýza potvrdila významnou úlohu kabazitaxelu u pacientů, kteří progredovali na terapii docetaxelem nebo do 3 měsíců po ukončení chemoterapie docetaxelem (negativní prognostický znak). Kabazitaxel významně nezhoršil projevy toxicity docetaxelu. Aktuálně lze kabazitaxel indikovat i u pacientů, kteří progredují po ukončení chemoterapie docetaxelem za dobu delší než 3 měsíce. Tato skutečnost může mít vliv na další zlepšení léčebných výsledků sekvence docetaxel–kabazitaxel–ARTA. I na podkladě většiny retrospektivních studií se zdá být účinnější aplikovat nové možnosti cílené hormonální léčby u pacientů schopných podstoupit chemoterapii až po selhání chemoterapie docetaxelem a kabazitaxelem, nicméně prospektivní práce k nalezení optimální sekvence po terapii docetaxelem budou nutné. U pacientů po předchozí terapii docetaxelem, kteří nejsou vhodní k další cytostatické léčbě, enzalutamid prokázal účinnost a výbornou toleranci.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Igor Richter, Ph.D.
Onkologické oddělení
Krajská nemocnice Liberec, a. s.
Husova 10
460 63 Liberec
e-mail: igor.richter@seznam.cz
Obdrženo: 13. 2. 2017
Přijato: 20. 3. 2017
Zdroje
1. Ondrušová M, Mužík J, Kliment J et al. Prostate cancer incidence and mortality in selected countries of central Europe. Klin Onkol 2011; 24 (2): 126–132.
2. Mottet N, Bastian PJ, Bellmunt J et al. EAU Guidelines on Prostate Cancer – update April 2014. Arnhem: European Association of Urology 2014 : 172.
3. Tannock IF, de Wit R, Berry WR et al. Docetaxel plus prednisone or mitoxantron plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351 (15): 1502–1512.
4. Petrylak DP, Tangen CM, Hussain MH et al. Docetaxel and estramustine compared with mitoxantrone plus prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351 (15): 1513–1520.
5. Katolická J. Chemoterapie v léčbě kastračně rezistentního karcinomu prostaty. Urol Praxi 2014; 15 (3): 120–122.
6. Ondruš D, Ondrušová M. Manažement pacientov s kastračne rezistentným metastatickým karcinómom prostaty. Klin Onkol 2015; 28 (1): 24–29. doi: 10.14735/amko201524.
7. Richter I, Dvořák j, Bartoš J. Možnosti chemoterapie v léčbě karcinomu prostaty. Klin Onkol 2017; 30 (1): 28–33. doi: 10.14735/amko201728.
8. de Bono JS, Oudard S, Ozguroglu M et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostatae cancer progressing after docetaxel treatment: a randimised open-label trial. Lancet 2010; 376 (9747): 1147–1154. doi: 10.1016/S0140-6736 (10) 61389-X.
9. Sartor AO. Progression of metastatic castrate-resistant prostatae cancer: impact of therapeutic intervention in the post-docetaxel space. J Hematol Oncol 2011; 4 : 18. doi: 10.1186/1756-8722-4-18.
10. Chen CD, Welsbie DS, Tran C et al. Molecular determinants of resistance to antiandrogen therapy. Nat Med 2003; 10 (1): 33–39.
11. Scher HI, Sawyers CL. Biology of progressive, castration-resistant prostate cancer directed therapies targeting the androgen-receptor signaling axil. J Clin Oncol 2005; 23 (32): 8253–8261.
12. Scher HI, Fizazi K, Saad F et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367 (13): 1187–1197.
13. Richter I, Dvořák J, Hejzlarová V et al. Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii. Klin Onkol 2016; 29 (2): 127–132. doi: 10.14735/amko2016127.
14. Richter I, Dvořák J, Hejzlarová V et al. Kabazitaxel v léčbě metastatického kastračně rezistentního karcinomu prostaty. Ces Urol 2016; 20 (3): 198–204.
15. Lee JJ, Swain SM. Peripheral neuropathy induced by microtubule-stabilizing agents. J Clin Oncol 2006; 24 (10): 1633–1642.
16. Tsao CK, Cutting E, Martin J et al. The role of cabazitaxel in the treatment of metastatic castration-resistant prostate cancer. Ther Adv Urol 2014; 6 (3): 97–104. doi: 10.1177/1756287214528557.
17. Heidenreich A, Bracarda S, Mason M et al. Safety of cabazitaxel in senior adults with metastatic castration-resistant prostatae cancer: results of the European compassionate-use programme. Eur J Cancer 2014; 50 (6): 1090–1099. doi: 10.1016/j.ejca.2014.01.006.
18. Richter I, Dvořák J, Bartoš J. Enzalutamid v postchemo indikaci. 24. onkologicko-urologické sympózium, Praha, 24. 11. 2016.
19. van Soest FJ, van Royen ME, de Morree ES et al. Cross-resistance between taxanes and new hormonal agents abirateron and enzalutamide may affect drug semence choices in metastatic castration-resistant prostate cancer. Eur J Cancer 2013; 49 (18): 3821–3830. doi: 10.1016/ j.ejca.2013.09.026.
20. Pezaro CJ, Le Moulec S, Albiges L et al. Response to cabazitaxel in CRPC patients previously treated with docetaxel and abirateron acetate. J Clin Oncol 2013; 31 (Suppl 6): abstr. 155.
21. Wissing MD, Coenen JL, Van den Berg P et al. A retrospective study on cabazitaxel and abirateron acetate sequential treatment (CAST) in docetaxel treated metastatic castrate-resistant prostate cancer patients. Eur Cancer Congr 2013; 411: abstr. 2904.
22. Oudard S, Angelergues A, Efstathiou E et al. Updated results of the FLAC European diabase of metastatic castration resistant prostate cancer (mCRPC) patients (pts) treated with life extending therapies in post-docetaxel (D) petting. Eur J Cancer 2015; 51 (Suppl 3): S489. abstr. 2541.
23. Ryan CJ, Smith MR, de Bono JS et al. Abirateron in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013; 368 (2): 138–148. doi: 10.1056/ NEJMoa1209096.
24. Beer TM, Amstrong AJ, Rathkof DE et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014; 371 (5): 424–433. doi: 10.1056/NEJM-oa1405095.
25. Mezynski J, Pezaro C, Bianchini D et al. Antitumour aktivity of docetaxel following treatment with the CYP17A1 inhibitor abirateron: clinical evidence for cross-resistence? Ann Oncol 2012; 23 (11): 2943–1947. doi: 10.1093/annonc/mds119.
26. Darshan MS, Loftus MS, Thadani-Mulero M et al. Taxane-induced blockade to nuclear accumulation of the androgen receptor predicts clinical response in metastatic prostate cancer. Cancer Res 2011; 71 (18): 6019–6029. doi: 10.1158/0008-5472.CAN-11-1417.
27. Jordan MA, Wilson L. Microtubules as a target for anticancer drugs. Nat Rew Cancer 2004; 4 (4): 253–265.
28. Moos PJ, Fritzpatrick FA. Taxane propagate apoptosis via two cell populations with distinctive cytological traits. Cell Growth Differ 1998; 9 (8): 687–697.
29. Li Y, Li X, Hussain M et al. Regulation of mikrotubul, apoptosis, and cell cycle-related genes by Taxotere in prostate cancer cells analyzed by microarray. Neoplasia 2004; 6 (2): 158–167.
30. van Soest RJ, van Royen ME, de Morree ES et al. Cross-resistance between taxanes and new hormonal agents abiraterone and enzalutamid may affect drug sequence choices in metastatic castration-resistant prostate cancer. Eur J Cancer 2013; 49 (18): 3821–3830. doi: 10.1016/ j.ejca.2013.09.026.
31. de Bono JS, Logothesis CJ, Molina A et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364 (21): 1995–2005. doi: 10.1056/ NEJMoa1014618.
32. Templeton AJ, Ver-Badillo FE, Wang L et al. Translating clinical trials to clinical practice: outsomes of men with metastatic castration resistant prostate cancer treated with docetaxel and prednisone in and out of clinical trials. Ann Oncol 2013; 24 : 2942–2977.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Zasedání Organizace evropských onkologických ústavů v Brně
- Soutěž o nejlepší práci
- Nové poznatky o patogenezi folikulárního lymfomu a koncepty cílené léčby
- Konfokální laserová mikroskopie v diagnostice onkologických onemocnění gastrointestinálního traktu
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
- Metastatické postižení hypofýzy
- Informace z České onkologické společnosti
- Hyperfrakcionovaná akcelerovaná radioterapie s modulovanou intenzitou u pokročilých nádorů hlavy a krku – prediktivní faktory celkového přežití
- Sekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty
- Reaktivní lymfoidní hyperplazie jater
- Nádor hrudnej steny ako zriedkavý klinický prejav metastázy hepatocelulárneho karcinómu
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Exprese antigenu CD20 na povrchu buňky maligního B lymfomu
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metastatické postižení hypofýzy
- Reaktivní lymfoidní hyperplazie jater
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



