-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHyperfrakcionovaná akcelerovaná radioterapie s modulovanou intenzitou u pokročilých nádorů hlavy a krku – prediktivní faktory celkového přežití
Intensity Modulated Hyperfractionated Accelerated Radiotherapy to Treat Advanced Head and Neck Cancer – Predictive Factors of Overall Survival
Aim:
The aim of this study was to evaluate overall survival (OS) and prognostic factors in patients ineligible for chemotherapy who were treated with a hyperfractionated accelerated schedule with simultaneous integrated boost.Material and Methods:
From May, 2008, to April, 2013, 122 patients with locally advanced nonmetastatic squamous laryngeal (14%), hypopharyngeal (30%), oropharyngeal (30%), and oral cavity (27%) cancer were treated at our institution. The median age, Karnofsky Performance Status (KPS), and gross tumor volume (GTV) of the patients were 63 years (range, 46–87 years), 80% (range, 50–100%), and 46 ml (range, 5–250 ml), resp. The median total dose of radiotherapy was 72.6 Gy (range, 62–77 Gy) at 1.4–1.5 Gy per fraction, and 55 Gy at 1.1 Gy per fraction was delivered for GTV (primary and lymphadenopathy) with a margin of 0.7 cm and regional lymphatic areas with a margin of 0.3 cm. The dose was delivered 2× a day, with a 6–8 hour interval between doses, via a 6 MeV linear accelerator. OS was estimated using the Kaplan-Meier method, and predictors of OS were analyzed using Cox proportional hazards regression.Results:
The median duration of the radiotherapy series was 37 days (range, 32–45 days). The incidence of grade 3 acute toxicity was 62% for mucosa (oral cavity and/or pharynx) and 0% for skin. Confluent mucositis cleared in all cases within 21 days. No grade 4 or 5 toxicities were recorded. PEG was introduced before treatment in 55 patients (45%). The 1-and 2-year OS was 65% and 32%, resp. KPS less than 80% (RR 2.4, 95% CI 1.3–4.2; p = 0.004), cancers other than oropharyngeal or laryngeal cancer (RR 2.0, 95% CI 1.1–3.5; p = 0.016), and capacity of high GTV (RR 1.006, 95% CI 1.001–1.011; p = 0.017) were found to be negative prognostic factors for OS. Conclusion: More than 30% of patients with poor prognosis survived for longer than 2 years. KPS before treatment was the strongest prognostic factor for better OS.Key words:
head and neck cancer – radiotherapy dose fractionation – survival analysis – acceleration – hyperfractionation
This work was supported by RVO-FNOs/2016 (HPV status as predictive and prognostic factor for primary and secondary head and neck cancer).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
9. 3. 2017Accepted:
19. 4. 2017
Autoři: J. Cvek 1; L. Knybel 1; J. Stránský 2; Petr Matoušek 3
; O. Res 2; Karol Zeleník 3
; B. Otáhal 1; L. Molenda 1; E. Skácelíková 1; N. Stieberová 1; Z. Čermáková 1; D. Feltl 4
Působiště autorů: Klinika onkologická LF OU a FN Ostrava 1; Klinika ústní, čelistní a obličejové chirurgie LF OU a FN Ostrava 2; Klinika otorinolaryngologie a chirurgie hlavy a krku LF OU a FN Ostrava 3; Onkologická klinika 1. LF UK a VFN v Praze 4
Vyšlo v časopise: Klin Onkol 2017; 30(4): 282-288
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2017282Souhrn
Cíl:
Cílem této práce je zhodnocení toxicity a prognostických faktorů celkového přežití (overall survival – OS) při použití hyperfrakcionované akcelerované radioterapie s modulovanou intenzitou u pacientů s pokročilými nádory hlavy a krku nevhodných ke konkomitantní radiochemoterapii.Metodika:
Od května 2008 do dubna 2013 bylo léčeno 122 pacientů s lokálně pokročilým nemetastazujícím spinocelulárním karcinomem hrtanu (14 %), hypofaryngu (30 %), orofaryngu (30 %) a dutiny ústní (27 %). Střední věk, KPS (Karnofského performance status) a GTV (gross tumor volume) byly 63 let (46–87 let), 80 % (50–100 %) a 46 ml (5–250 ml). Střední dávka radioterapie byla 72,6 Gy (62–77) à 1,4–1,5 Gy na oblast GTV (primární tumor a lymfadenopatie) s lemem 0,7 cm a 55 Gy à 1,1 Gy na regionální lymfatické oblasti s lemem 0,3 cm. Pomocí lineárního urychlovače 6 MeV byla doručena léčebná dávka 2× denně s přestávkami 6–8 hod. OS bylo zhodnoceno Kaplan-Meierovou metodou. Prediktory OS byly analyzovány pomocí Coxova modelu proporcionálních rizik.Výsledky:
Průměrná doba radioterapie trvala 37 dní (32–45 dní). Výskyt akutní toxicity 3. stupně byl 62 % na sliznicích (dutina ústní, hltan) a 0 % na kůži. Konfluentní zánět sliznice se zotavil ve všech případech do 21 dní. Stupeň toxicity 4 nebo 5 nebyl zaznamenán. U pacientů v kompletní remisi není žádná závislost na PEG (perkutánní endoskopické gastrostomii). Jednoleté a 2leté OS bylo 65, resp. 32 %. Multivariantní analýzou byly zjištěny negativní faktory OS – KPS horší než 80 % (RR 2,4, 95% CI 1,3–4,2; p = 0,004), jiný karcinom než orofaryngu nebo hrtanu (RR 2,0, 95% CI 1,1–3,5; p = 0,016) a velikost GTV (RR 1,006, 95% CI 1,001–1,011; p = 0,018). Dva roky po léčbě přežívá přibližně 30 % pacientů a výkonnostní stav před zahájením léčby je nejsilnějším faktorem pro OS. Další prediktory OS je potřeba hledat na molekulární úrovni.Klíčová slova:
nádory hlavy a krku – frakcionace radioterapie – analýza přežití – akcelerace – hyperfrakcionaceÚvod
Radioterapie zaujímá v léčbě nádorů hlavy a krku zásadní roli, ale i přes značný pokrok jsou léčebné výsledky stále neuspokojivé. Zlepšení celkového přežití (overall survival – OS) o 8 % je možno očekávat od přidání konkomitantní chemoterapie, event. biologické léčby [1], ale za cenu toxicity, která způsobuje nízký terapeutický index [2]. Vlastní účinnost radioterapie lze zvýšit na základě znalostí z radiobiologie a s využitím moderní ozařovací techniky [2]. Publikovaná metaanalýza klinických studií potvrdila, že je výhodné při ozařování volit alterované frakcionační režimy, zejména hyperfrakcionaci a akceleraci [3]. Kvalitnější ozáření cílového objemu za současného šetření okolních orgánů, tedy příznivějších dozimetrických vlastností, lze docílit použitím techniky IMRT (radioterapie s modulovanou intenzitou), a to zejména je-li naplánována jako konkomitantní integrovaný boost [4]. Tento protokol léčby integruje poznatky z radiobiologie a radiační fyziky, využívá tři výše uvedené výhody (hyperfrakcionace, akcelerace, dozimerie), a je tedy teoretický předpoklad pro zvýšení terapeutického indexu, resp. zlepšení léčebných výsledků bez nutného zvýšení nežádoucích účinků. Cílem této práce je zhodnocení toxicity a prognostických faktorů OS u pacientů nevhodných ke konkomitantní chemoterapii.
Materiál a metody
V období od května 2008 do dubna 2013 bylo protokolem (hyperfrakcinovaná akcelerovaná radioterapie s konkomitantním integrovaným boostem – HARTCIB) léčeno 122 pacientů s pokročilým nemetastatickým nádorem ORL oblasti. Mezi kritéria patří inoperabilní nemetastatický spinocelulární karcinom oro/hypofaryngu, hltanu nebo dutiny ústní; objemný primární tumor > 40 ml; Karnofského performance status (KPS) > 60; podepsaný informovaný souhlas; kontraindikace konkomitantního podávání chemoterapie. Perkutánní endoskopická gastrostomie (PEG) byla před radioterapií zavedena 55 pacientům (45 %), kteří měli potíže s polykáním nebo měli váhový úbytek ≥ 10 % v posledních 3 měsících. Staging byl proveden pomocí standardních klinických a paraklinických procedur, podle potřeby byla před zahájením radioterapie provedena sanace chrupu a nutriční intervence. PET, scintigrafie skeletu a CT břicha nebo hrudníku byly provedeny pouze ve vybraných případech.
Radioterapie
GTV (gros tumor volume) zahrnuje primární tumor a lymfatické uzliny určené pomocí CT a fyzikálního vyšetření a/nebo endoskopie. CTV (clinical target volume) zahrnoval GTV + 4 mm izometricky. Elektivní oblasti lymfatických uzlin zahrnují oboustranné spádové lymfatické oblasti uzlin II–V (I–V pro tumory dutiny ústní). Bezpečnostní lem CTV-PTV (planning target volume) byl 3 mm. Řízení obrazem bylo prováděno pomocí cone beam CT v týdenních intervalech (častěji v případě zjištění chyb v nastavení > 3 mm) (tab. 1).
Tab. 1. Radiobiologická analýza různých frakcionačních režimů. 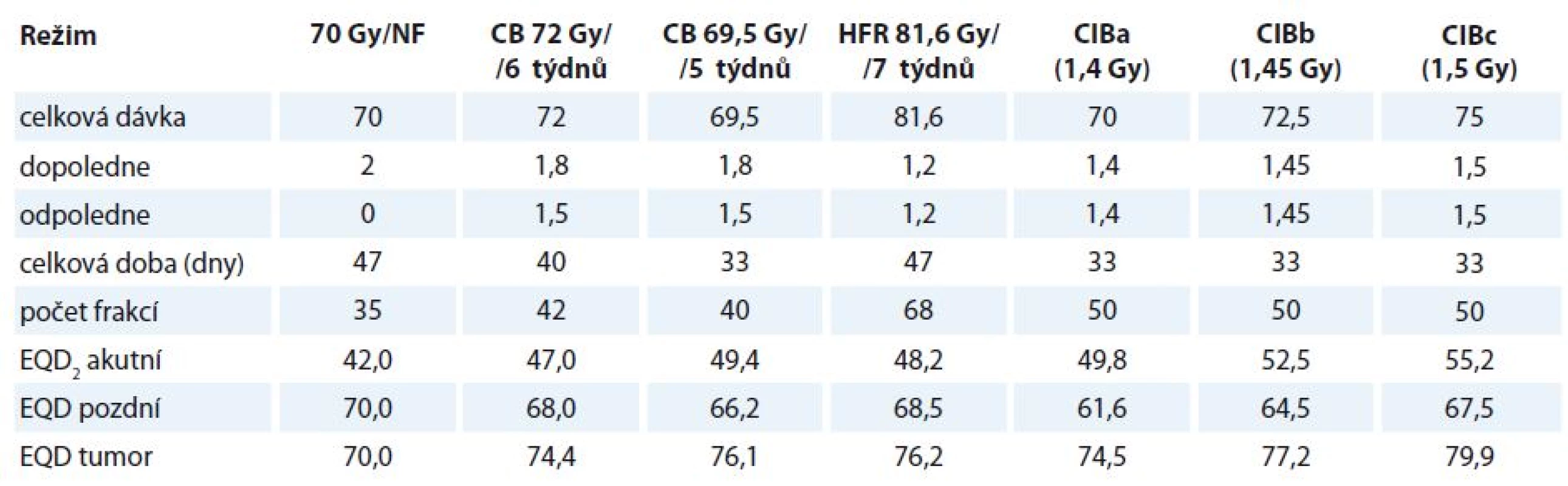
CB – konkomitantní boost, CIB – konkomitantní integrovaný boost, HFR – hyperfrakcionace, NF – normofrakcinace, EQD2 – ekvivalentní dávka à 2 Gy NF Radioterapie probíhala 2× denně s pauzou min. 6 hod, celkem 10 frakcí týdně (50 frakcí v 5 týdnech). Primární tumor s lymfadenopatií (PTVtumor) obdržel celkovou dávku 70–75 Gy à 1,4–1,5 Gy. Elektivní oblasti PTVuninvolved byly ozářeny dávkou 55 Gy à 1,1 Gy. Ozařovací plán byl normalizován na průměrnou dávku (Dmean). Bylo použito inverzní plánování (Precise PLAN® 2.11, Elekta, Crawley, UK) pro step-and-shoot IMRT 6 MeV. Požadavek na maximální dávku (Dmax) míchy < 48 Gy byl splněn ve všech případech. Pokud bylo možné chránit příušní žlázy, byl požadavek na střední dávku < 26 Gy. Hltan, dutina ústní a hrtan byly definovány jako kritické struktury, pokud nebyla zjištěna nádorová infiltrace. V těchto případech byla střední hodnota dávky minimalizována na nejnižší možnou hodnotu bez konkrétních dávkově-objemových parametrů. Dolní čelist, mozkový kmen nebo brachiální plexus byly jako kritické struktury zakresleny ve specifických případech.
Zhodnocení toxicity a reakce
Akutní toxicita byla vyhodnocována jedním onkologem během léčby a po ní jednou týdně až do zotavení podle škály RTOG/EORTC. Toxicita byla považována za akutní, pokud byla zjištěna během radioterapie nebo do 90 dnů od ukončení léčby. Pacienti byli následně vyhodnocováni v 3měsíčních intervalech otolaryngologem a radiačním onkologem. Pozdní toxicita byla zaznamenána podle škály RTOG/EORTC pro pacienty v kompletní remisi.
Statistická analýza
U OS bylo započteno datum úmrtí z jakékoli příčiny. Kumulativní pravděpodobnosti přežití, lokální kontroly a doby do generalizace od zahájení radioterapie byly vypočteny na základě Kaplan-Meierovy metody. Faktory potenciálně ovlivňující OS byly testovány nejprve univariantní analýzou. Pro spojité proměnné byl v rámci univariantní analýzy použit jednoduchý Coxův model proporcionálních rizik, pro kategoriální proměnné potom Gehan-Wilcoxonův test. Prognostické faktory s hladinou významnosti p < 0,25 z univariantní analýzy byly otestovány následně v rámci multivariantní analýzy s využitím Coxova modelu proporcionálních rizik. Hladina významnosti v rámci multivariantní analýzy byla stanovena na 0,05. Pro statistické zpracování byl použit software STATISTICA 12 (StatSoft ČR).
Výsledky
Od května 2008 do dubna 2013 bylo podle HARTCIB protokolu léčeno 122 pa-cientů s pokročilým nemetastatickým inoperabilním karcinomem hlavy a krku stadia II (2 %), III (16), IV (82 %). Medián OS byl 473 dní, medián doby do lokoregionální progrese byl 583 dní, mediánu u generalizace pak nebylo dosaženo (graf 1–3).
Graf 2. Doba do lokálně regionální progrese. 
Graf 3. Doba do vzniku vzdálených metastáz. 
V rámci univariantní analýzy vyšly jako statisticky významné faktory objem nádorové infiltrace v době zahájení radioterapie GTV (p = 0,005), výkonnostní stav KPS horší než 80 % (p = 0,0007), jiný karcinom než orofaryngu nebo hrtanu (p = 0,047) a doba radioterapie (p = 0,02). Nebyl prokázán vliv klinického stadia III vs. IV (p = 0,117), gradingu (p = 0,462), věku v době zahájení radioterapie (p = 0,24), pohlaví (p = 0,688), fyzikální dávky záření (p = 0,885) nebo výše biologicky ekvivalentní dávky (p = 0,74) (graf 4 a 5).
Graf 4. Celkové přežití dle Karnofsky performance statusu. 
Graf 5. Celkové přežití dle origa tumoru. 
Multivariantní analýzou byly následně otestovány faktory s hodnotou p < 0,25 z univariantní analýzy. Byly zjištěny následující negativní faktory OS:
- KPS horší než 80 % (RR 2,4, 95% CI 1,3–4,2; p = 0,004), pacienti s KPS horším než 80 % mají 2,4× vyšší riziko úmrtí než pacienti s KPS lepším než 80 %.
- Karcinom jiný než orofaryngu nebo hrtanu (RR 2,0, CI 1,1–3,5; p = 0,016), pacienti s karcinomem jiným než orofaryngu nebo hrtanu mají 2× vyšší riziko úmrtí než pacienti s karcinomem orofaryngu nebo hrtanu.
- Velikost GTV (RR 1,006, CI 1,001–1,011; p = 0,018) – zvýší-li se objem nádorové infiltrace o 1 ml, zvýší se riziko úmrtí pacienta 1,006×.
- V rámci multivariantní analýzy nebyl prokázán vliv na OS u věku (p = 0,82), klinického stadia (p = 0,75) a délky radioterapie (p = 0,10) (tab. 2).
Tab. 2. Multivariantní analýza. 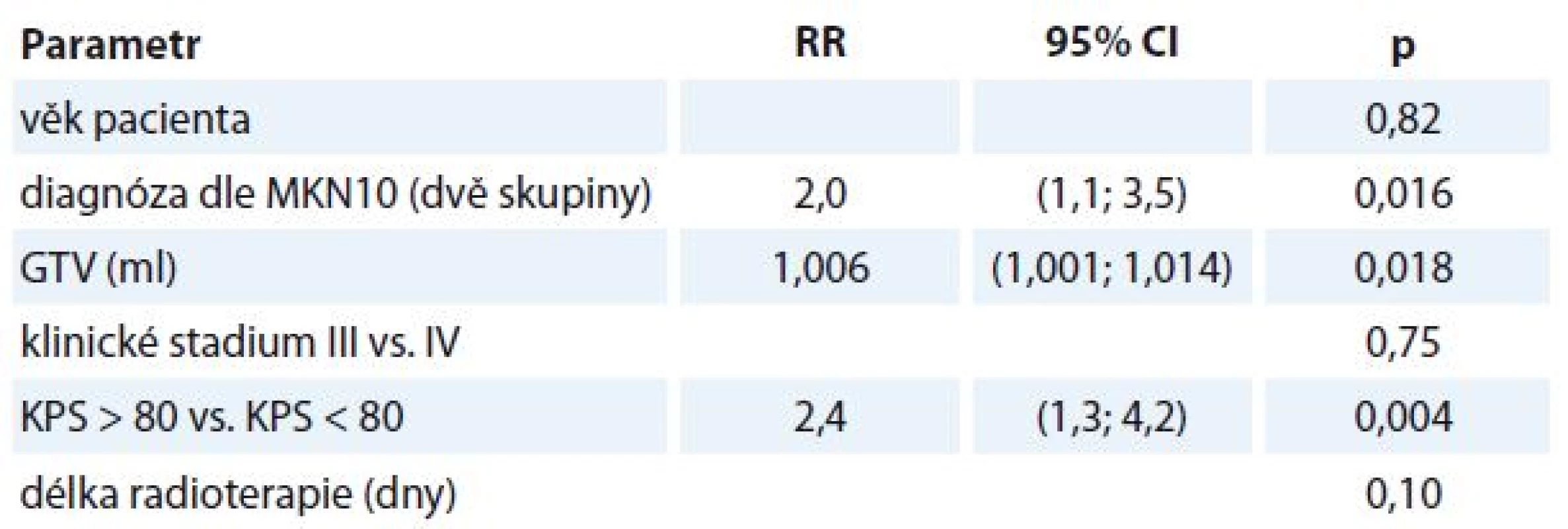
GTV – gross tumor volume, RR – relativní riziko Toxicita
Všichni pacienti dokončili naplánovanou léčbu; nebyla zaznamenána toxicita, která by vyžadovala přerušení léčby. Průměrná doba radioterapie byla 37 dní (rozsah 32–45 dní) z důvodu plánovaných a neplánovaných odstávek přístroje nebo svátků. Výskyt akutní toxicity 3. stupně byl 62 % na sliznice (dutina ústní/hltan) a 0 % na kůži. Konfluentní zánět sliznic se u všech pacientů zotavil do 21 dní. Nebyla zaznamenána žádná toxicita 4. nebo 5. stupně. Parenterální výživa kvůli závažné mukozitidě byla důvodem pro hospitalizaci v šesti případech (15 %), PEG byl zaveden před léčbou 55 pacientům (45 %).
Pozdní toxicita byla zaznamenána u pacientů v kompletní remisi. Podkožní fibróza 1. stupně byla zjištěna u 71 %, 2. stupně u 29 %, xerostomie 1. stupně u 79 % a xerostomie 2. stupně u 21 % pacientů. Vyšší stupně pozdní toxicity nebyly zaznamenány, není žádná závislost na PEG u pacientů v kompletní remisi.
Diskuze
Léčebné výsledky pokročilých nádorů hlavy a krku jsou i přes jisté zlepšení stále neuspokojivé [1,2]. Metaanalýza hodnotící intenzifikované alterované frakcionační režimy ukazuje na přínos OS v řádu několika málo jednotek procent [3]. Alternované frakcionační režimy jsou na provedení náročnější, a protože ne každý pacient z intenzifikované radioterapie profituje, jsou hledány prognostické faktory [5–9].
Silnou stránkou naší studie je velikost souboru s neměnnou technikou radioterapie. Medián OS byl v našem souboru 473 dní, rozsah nádorové infiltrace, nízký KPS a jiný než orofaryngeální či laryngeální primární nádor jsou nejsilnější negativní prediktivní faktory OS.
Zvýší-li se objem nádorové infiltrace o 1 ml, zvýší se riziko úmrtí pacienta 1,006× (p = 0,018). Zároveň nebyl prokázán vliv klinického stadia III vs. IV (p = 0,752). Objem nádorové infiltrace je lepším prediktorem než T a/nebo N stadium [10]. Tsou et al hodnotili objem u 51 pacientů, OS u pacientů s nádory menšími než 19 ml bylo dvojnásobné [11]. Podobně Chun et al stanovují v případě orofaryngeálních karcinomů kritickou velikost nádoru na 35 ml [12]. Z radiobiologického pohledu nejsou tyto závěry překvapením, účinnost radioterapie souvisí s počtem klonogenních nádorových buněk, a tedy i s velikostí nádorové infiltrace [13].
Výkonnostní stav je pro OS statisticky významný (p = 0,004), pacienti s KPS horším než 80 % mají 2,4× vyšší riziko úmrtí než pacienti s KPS lepším než 80 %. Podobné závěry plynou z podrobnějšího rozboru výsledků studie RTOG 90-03 a 91-11, KPS < 80 % před léčbou byl shledán jako silný negativní faktor OS [14]. Siddiqui et al v této práci uvádějí, že KPS může být pro návrh optimální léčebné strategie lepším parametrem než výsledek měření kvality života.
Jiný karcinom než orofaryngeální nebo laryngeální se vyznačuje dvojnásobným rizikem selhání léčby (p = 0,016). V případě karcinomů orofaryngu je zřejmou příčinou HPV, kde je dobře popsána vyšší radiosenzitivita [15]. V případě karcinomů hrtanu je výsledek překvapující, protože laryngeální karcinom je popisován jako jediný se zhoršujícím se přežitím při častějším použití radioterapie [16].
Závěr
Hyperfrakcionovaná akcelerovaná technika radioterapie s modulovanou intenzitou se vyznačuje příznivým profilem toxicity. Dva roky po léčbě přežívá přibližně 30 % pacientů a výkonnostní stav před zahájením léčby je nejsilnějším faktorem pro OS. Další prediktory přežití je potřeba hledat na molekulární úrovni.
Tato práce byla podpořena RVO-FNOs/2016 (HPV status a jeho prediktivní a prognostický význam u primárních a sekundárních karcinomů hlavy a krku).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Ing. Lukáš Knybel
Klinika onkologická
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: lukas.knybel@fno.cz
Obdrženo: 9. 3. 2017
Přijato: 19. 4. 2017
Zdroje
1. Pignon JP, Bourhis J, Domenge CO et al. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma: three meta-analyses of updated individual data. Lancet 2000; 355 (9208): 949–955.
2. Corvò R. Evidence-based radiation oncology in head and neck squamous cell carcinoma. Radiother Oncol 2007; 85 (1): 156–170.
3. Bourhis J, Overgaard J, Audry H et al. Hyperfractionated or accelerated radiotherapy in head and neck cancer: a meta-analysis. Lancet 2006; 368 (9538): 843–854.
4. Mohan R, Wu Q, Manning M et al. Radiobiological considerations in the design of fractionation strategies for intensity-modulated radiation therapy of head and neck cancers. Int J Radiat Oncol Biol Phys 2000; 46 (3): 619–630.
5. Fu KK, Pajak TF, Trotti A et al. A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: first report of RTOG 9003. Int J Radiat Oncol Biol Phys 2000; 48 (1): 7–16.
6. Overgaard J, Hansen HS, Specht L et al. Five compared with six fractions per week of conventional radiotherapy of squamous-cell carcinoma of head and neck: DAHANCA 6 and 7 randomised controlled trial. Lancet 2003; 362 (9388): 933–940.
7. Skladowski K, Maciejewski B, Golen M et al. Continuous accelerated 7-days-a-week radiotherapy for head-and-neck cancer: long-term results of phase III clinical trial. Int J Radiat Oncol Biol Phys 2006; 66 (3): 706–713.
8. Terhaard CH, Kal HB, Hordijk GJ. Why to start the concomitant boost in accelerated radiotherapy for advanced laryngeal cancer in week 3. Int J Radiat Oncol Biol Phys 2005; 62 (1): 62–69.
9. Halámka M, Feltl D, Cvek J et al. Projekt HARDROCK: parametrický sběr a analýza dat pacientů s nádory hlavy a krku na Klinice onkologické FN Ostrava – důraz na význam frakcionace a definice cílového objemu v radioterapii. Klin Onkol 2012; 25 (4): 274–281.
10. Strongin A, Yovino S, Taylor R et al. Primary tumor volume is an important predictor of clinical outcomes among patients with locally advanced squamous cell cancer of the head and neck treated with definitive chemoradiotherapy. Int J Radiat Oncol Biol Phys 2012; 82 (5): 1823–1830. doi: 10.1016/j.ijrobp.2010.10.053.
11. Tsou YA, Hua JH, Lin MH et al. Analysis of prognostic factors of chemoradiation therapy for advanced hypopharyngeal cancer – does tumor volume correlate with central necrosis and tumor pathology? ORL J Otorhinolaryngol Relat Spec 2006; 68 (4): 206–212.
12. Chung EJ, Lee NJ, Baek SK et al. Clinical efficacy of primary tumor volume measurements: comparison of different primary sites. Clin Exp Otorhinolaryngol 2009; 2 (2): 78–84.
13. Johnson CR, Thames HD, Huang DT et al. The tumor voluem and clonogen number relationship: tumor control predictions based upon tumor volume estimates derived from computed tomography. Int J Radiat Oncol Biol Phys 1995; 33 (2): 281–287.
14. Siddiqui F, Pajak TF, Watkins-Bruner D et al. Pretreatment quality of life predicts for locoregional control in head and neck cancer patients: a radiation therapy oncology group analysis. Int J Radiat Oncol Biol Phys 2008; 70 (2): 353–360.
15. Ang KK, Harris J, Wheeler R et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 363 (1): 24–35. doi: 10.1056/NEJMoa0912217.
16. Hoffman HT, Porter K, Karnell LH et al. Laryngeal cancer in the United States: changes in demographics, patterns of care, and survival. Laryngoscope 2006; 116 (2 Suppl 111): 1–13.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Zasedání Organizace evropských onkologických ústavů v Brně
- Soutěž o nejlepší práci
- Nové poznatky o patogenezi folikulárního lymfomu a koncepty cílené léčby
- Konfokální laserová mikroskopie v diagnostice onkologických onemocnění gastrointestinálního traktu
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
- Metastatické postižení hypofýzy
- Informace z České onkologické společnosti
- Hyperfrakcionovaná akcelerovaná radioterapie s modulovanou intenzitou u pokročilých nádorů hlavy a krku – prediktivní faktory celkového přežití
- Sekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty
- Reaktivní lymfoidní hyperplazie jater
- Nádor hrudnej steny ako zriedkavý klinický prejav metastázy hepatocelulárneho karcinómu
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Exprese antigenu CD20 na povrchu buňky maligního B lymfomu
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metastatické postižení hypofýzy
- Reaktivní lymfoidní hyperplazie jater
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




