-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce covid-19 u seniorů – pohled imunologa
Coronavirus infection within senior people – The immunologist’s view
Virus SARS-CoV-2 is a cause pathogen of covid-19 disease. The age represents an independent risk factor for prognosis. A key role play immunosenescence and cumulating comorbidities. In relation to covid-19 infection should be highlighted factors such as weakening of mucosal barrier, decreased response to Toll-like receptors stimulation, NK cells decline with limited interferon gamma production, deterioration of specific immunity to new antigenic challenge and leaning towards more intensive proinflammatory response.
Keywords:
COVID-19 – immunosenescence – aging – ACE2
Autoři: doc. MUDr. Pavlína Králíčková, Ph.D.
Působiště autorů: Ústav klinické imunologie a alergologie, FN Hradec Králové
Vyšlo v časopise: Geriatrie a Gerontologie 2020, 9, č. 2: 61-65
Kategorie: Přehledový článek
Souhrn
Virus SARS-CoV-2 je příčinným patogenem onemocnění covid-19. Věk je nezávislým faktorem prognózy nemocných. Klíčovou úlohu hrají imunosenescence a komorbidity kumulující se s věkem. Ve vztahu k infekci covid-19 je důležité oslabení slizničních barier, snížená odpověď po stimulaci Toll-like receptorů, snížení počtu NK buněk s omezením produkce interferonu gamma. Specifická imunita má omezenou schopnost efektivně odpovídat na nové antigenní stimuly. Imunitní systém vykazuje tendenci k významnější prozánětlivé odpovědi.
Klíčová slova:
COVID-19 – imnunosenescence – stárnutí – ACE2
Úvod
Virus SARS-CoV-2 je příčinným patogenem onemocnění zvaného covid-19. Jeho výskyt začal narůstat v druhé polovině roku 2019 a na začátku roku 2020 dosáhl charakteru pandemie (1). Mortalita vzrůstá s věkem a přidruženými komorbiditami. Za rizikové faktory závažného průběhu onemocnění jsou z klinického hlediska považovány: věk nad 60 let, neuspokojivě kompenzovaný diabetes, hypertenze, závažná plicní či kardiovaskulární choroba, body mass index nad 35, renální insuficience, aktivní malignita a imunosuprese (2).
SARS-CoV-2 patří do rodiny koronavirů, což jsou obalené, nesegmentované, poměrně velké viry (okolo 30 kb), jejichž základem je jedno vlákno RNA. Struktura je zobrazena na obr. 1. Koronaviry obecně infikují široké spektrum zvířat a působí onemocnění o rozmanité závažnosti. U lidí mohou vyvolávat onemocnění charakteru od běžného nachlazení (např. lidský CoV229E) po závažná postižení respiračního traktu (SARS-CoV-1 a MERS-CoV) (3).
Obr. 1. Stavba virionu SARS-CoV-2 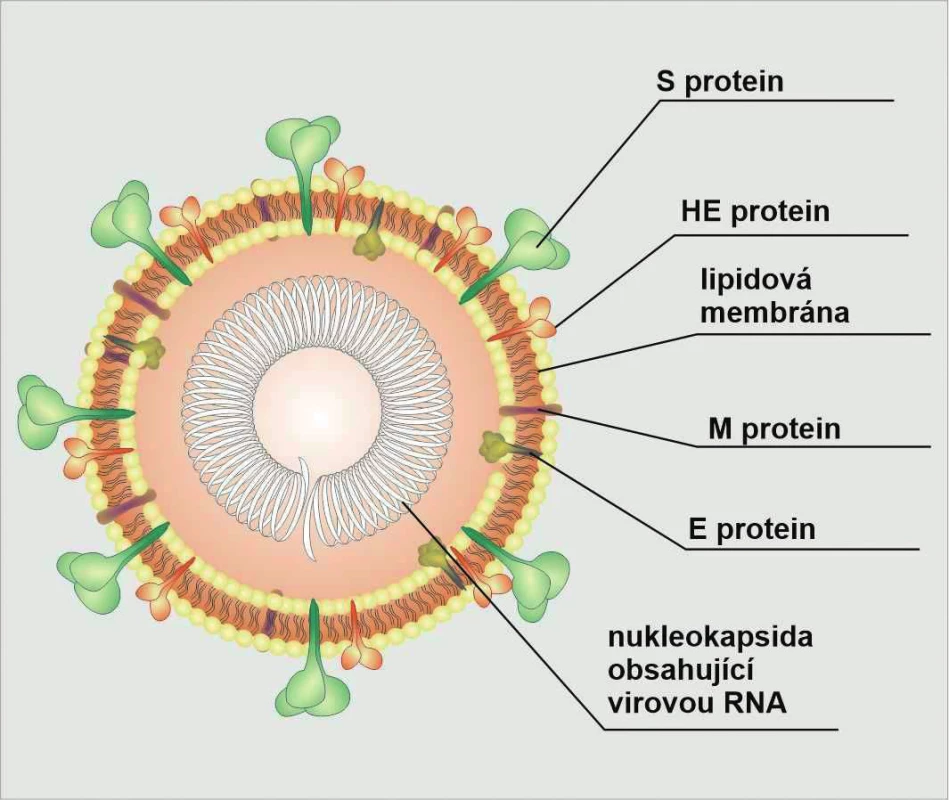
Na obrázku je vyznačen: trimer S-protein (spike) vážící se na povrchový ACE receptor cílové buňky; M-protein (membránový); dimer HE-protein (hemaglutinin-esterase); pentamer E-protein (envelope small membrane protein); uvnitř viru je virová DNA obalená nukleoproteinem Ke vstupu do buňky používá virus S protein prostřednictvím povrchového receptoru pro angiotenzin-konvertující enzym (ACE2 receptor), který je exprimován řadou orgánů (kromě buněk plicních alveolů, dále pak enterocyty, buňkami kardiovaskulární soustavy, ledvin a nervové tkáně) (4). Interindividuální rozdíly síly exprese jsou intenzivně zkoumány, zatím neznáme uspokojivé odpovědi. Při vstupu viru do buňky dochází díky transmembránové serinové proteáze ke štěpení ACE2 receptoru a tím je umožněn jeho volnější vstup (1) (obr. 2). Snížení povrchové exprese ACE2 má zásadní dopad na další průběh onemocnění. Kompenzatorně je produkován angiotenzin II, který působí na zbylé ACE1a receptory, a tím se zvyšuje cévní permeabilita a vzrůstá riziko rozvoje ARDS (3). Poté, co se virus dostává do buněčné cytoplazmy, se virová RNA uvolní. Následně začne probíhat její translace. Nově syntetizované glykoproteiny jsou inzerovány do membrány endoplazmatického retikula a Golgiho aparátu, kde je formována nová virová částice. Uvolněné vezikuly naplněné virovými částicemi posléze splývají s plazmatickou membránou buňky a jsou uvolňovány do okolí. Koronaviry obecně mají vyvinuty i obranné mechanismy, jak uniknout imunitní odpovědi hostitele. SARS-CoV a MERS-CoV jsou schopné indukovat tvorbu vezikul s dvojitou membránou, která neobsahuje žádné receptory hrozícího nebezpečí, tzv. PRR receptory (pattern recognition receptors), dokonce se v nich i nepozorovaně množí. Dále přímo snižují expresi genů podporující antigenní prezentaci buňkou, stejně tak jako snižují produkci interferonu (5).
Obr. 2. Vstup viru do buňky 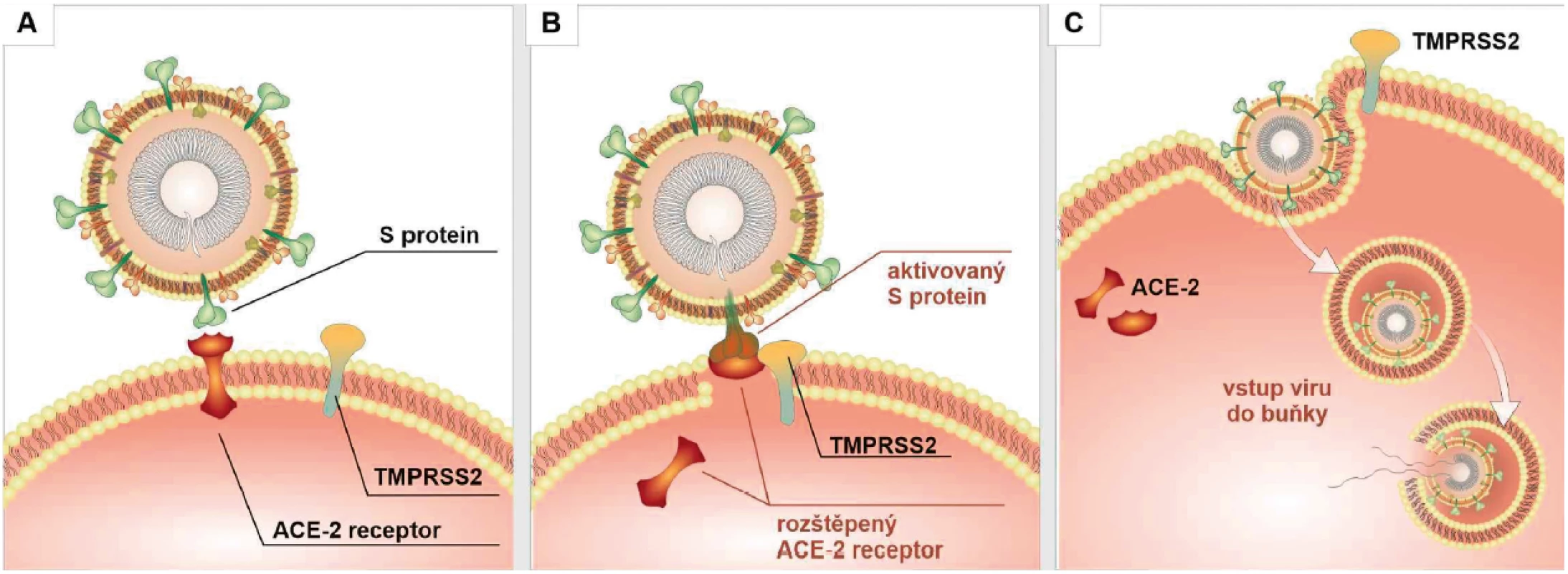
S-protein se váže na povrchový ACE2 receptor cílové buňky (A). Dochází k jeho aktivaci, současně se aktivuje transmembránová serinová proteáza typu II (TMPRSS2), která ho štěpí (B). Rozštěpený ACE2 receptor tak mizí z povrchu buňky, tím je umožněn vstup viru do buňky za podpory TMPRSS2. Virus má pravděpodobně snahu vstupovat ve formě endosomu a teprve poté uvolňovat svoji RNA do cytoplasmy. Pro imunitní systém je takto hůře identifikovatelný. Imunitní odpověď na SARS-Cov-2
Imunitní odpověď organismu je iniciována aktivací receptorů pro nebezpečné vzory PRR. Pro koronaviry jsou klíčové tři skupiny receptorů: 1. Toll-like receptor 7 (rozeznávající virovou RNA v endosomech), 2. RIG-I a MDA-5 (rozeznávající primárně dvouvláknovou RNA v cytosolu a 3. cGAS-STING (cytosolová DNA). Druhá a třetí skupina receptorů nerozpoznává virus přímo, ale až díky poškození mitochondrií. První fáze vede k aktivaci kaskády vedoucí ke zvýšené expresi interferonu I. typu a dalších prozánětlivých cytokinů. Zdá se, že by primární odpověď s dostatečně efektivním vyplavením IFN I mohla být zásadní v časné eliminaci virové infekce bez nadměrné cytokinové bouře (3).
Další děje v obecné linii kopírují imunitní odpověď na jiná virová onemocnění. Při prolomení první linie dochází k aktivaci složek nespecifické imunity. Klíčové postavení zde zastávají dendritické buňky. Dendritické buňky (DC) tvoří heterogenní skupinu buněk. Po rozpoznání hrozícího nebezpečí jsou plazmocytoidní DC schopné produkce interferonů I. a III. třídy s výrazným protivirovým účinkem. Další DC efektivně zpracovávají antigenní struktury a prezentují je na svém povrchu společně s molekulami HLA systému (proces tzv. HLA restrikce). V případě virových, tedy intracelulárních antigenů, převažuje exprese společně s molekulami HLA I. třídy, která preferenčně aktivuje CD8+ T-lymfocyty. Extracelulárně zachycené antigeny naopak vedou k prezentaci za spoluúčasti molekul HLA II. třídy s následnou aktivací CD4+ T lymfocytů. Kostimulační molekuly dané interakce zesilují. Součástí nespecifických obranných mechanismů je přítomnost buněk s přirozeně cytotoxickým potenciálem (NK buňky), makrofágů i neutrofilních granulocytů, které jsou schopny za pomoci tzv. extracelulárních pastí inaktivovat virové částice. NK buňky jsou producenty interferonu gama a mají schopnost likvidace buněk napadených virem za pomoci granzymů a perforinů (indukce apoptózy cílové buňky). V obranném zánětu sehrává důležitou úlohu i komplementový systém.
Další linii představuje specifická imunitní odpověď. Pod vlivem antigenních stimulů pocházejících z virových částic preferenčně dochází k polarizaci subsetů CD4+ T-lymfocytů z Th0 do Th1. Ten zprostředkovaně tvorbou IFNγ a IL-2 aktivuje CD 8+ T-lymfocyty schopné cytotoxického zabíjení infikovaných buněk. Vznikají i další subsety s masivní tvorbou cytokinů, které řídí další specifické procesy. Současně je zapojena i specifická protilátková odpověď. V úvodu převažuje nespecifická interakce s polyspecifickými, přirozenými protilátkami. V dalších fázích dochází k tvorbě specifických protilátek v třídě IgM, po čase následované izotypovým přepnutím těžkých řetězců a tvorbě protilátek v třídách IgG a IgA. Současně probíhají somatické mutace vedoucí k afinitnímu vyzrávání s tvorbou vysoce specifických protilátek s neutralizačními účinky. V této fázi imunitní odpověď již trvá více než týden. Její vrchol bývá dosažen přibližně za 20 dní od počátku infekce.
Při úspěšném zvládnutí infekce převážná část buněk účastnících se celého procesu umírá apoptózo. Část je přeměněna na dlouho žijící paměťové T a B lymfocyty, které jsou připraveny pro případ reinfekce. Ve fázi útlumu imunitních dějů převažuje tvorba T-regulačních lymfocytů. Makrofágy se přepínají do tlumivého M2 subsetu. Díky růstovým faktorům dochází k reparaci tkání (6, 7).
Pro infekci SARS-CoV-2 je charakteristické velmi intenzivní vyplavení celého spektra prozánětlivých cytokinů. V charakteru odpovědi hrají důležitou úlohu individuální dispozice jedince, jednak vrozené, jinak získané v průběhu života. U lidí s velmi závažným průběhem byla zaznamenána vysoká hladina IL-2, IL-6, IL-7, IL-10, GM-CSF, TNF alfa a dalších (7, 8).
S dobou a intenzitou probíhající infekce dochází k vyčerpání buněčné odpovědi, zejména se snižuje počet a funkceschopnost NK buněk a CD8+ T-lymfocytů (9, 10). Obecně lymfopenie v době přijetí nemocného k hospitalizaci představuje významný negativní prognostický marker. Současně bývá zaznamenán vzestup celkového počtu leukocytů, převážně díky vzestupu neutrofilních granulocytů, a naopak snížení monocytů, eozinofilů a bazofilů (8).
Stárnoucí imunitní systém a schopnost protivirové odpovědi
Stárnutí je komplexní proces, který postihuje nejen všechny tkáně a orgány, zahrnuje také změny imunokompetentních buněk. Tento proces je nazýván imunosenescencí. Na vysvětlení mnohých aspektů v současné době zatím bohužel nedosáhneme.
Důležitým znakem „stárnoucího fenotypu“ imunitního systému je nerovnováha mezi pro - a protizánětlivými mechanismy. V důsledku tohoto procesu vzniká stav, který je některými autory nazýván „inflammaging“. V jeho patogenezi hrají důležitou úlohu jednak chronická antigenní stimulace, jednak oxidativní stres. Oxidativní stres vede k produkci volných kyslíkových radikálů a toxických produktů. Kumulace kyslíkových radikálů přispívá k vyšší rezistenci buněk k apoptóze. Tím se v organismu zvyšuje podíl stárnoucích buněk. Chronická antigenní stimulace vede dále ke zvýšení počtu aktivovaných imunokompetentních buněk a nadprodukci prozánětlivých cytokinů. Není vyloučeno, že v urychlení procesu hraje důležitou úlohu chronická infekce cytomegalovirem (11).
Podíváme-li se přímo na buňky imunitního systému, zjistíme, že v průběhu života postupně dochází k úbytku hematopoetické tkáně. Snižuje se tak rezerva nejenom myeloidní a erytroidní řady, ale i B-lymfocytů.
T lymfocyty
Kapacita tvorby T lymfocytů zůstává zachována nejdéle. Postupně však dochází k involuci brzlíku. Mění se zcela zásadně rozložení jednotlivých T-buněčných subpopulací. Postupně ubývá naivních T lymfocytů, a tím i schopnosti potentní imunitní odpovědi na nové antigenní stimuly, včetně odpovědi na zcela nová infekční agens či vakcinaci. Zbytková populace naivních T lymfocytů je dysfunkční. Vykazuje zkrácení telomer, redukovanou schopnost produkce IL-2 se sníženou ochotou diferenciace do efektorových buněk. Výsledný repertoár je významně užší. Naopak expanduje populace C8+CD45RO+CD25+ klonů T lymfocytů (cytotoxických paměťových). Tato buněčná populace je sice schopna produkce IL-2, nicméně na svém povrchu exprimuje nižší množství kostimulačních molekul. Dochází k inverzi poměru CD4+/CD8+. Zvyšuje se podíl T-regulačních lymfocytů s tlumivými účinky, což je dáváno do souvislosti se zvýšenou pravděpodobností reaktivací chronických infekcí (11–13).
Stárnoucí imunitní systém predisponuje ke vzniku příliš intenzivní cytokinové odpovědi a zvyšuje se tak pravděpodobnost sepse. Dochází k tomu i díky narůstajícímu podílu subpopulace T lymfocytů, která na svém povrchu ztrácí expresi molekuly CD28 (14). Tato populace je odpovědná za produkci prozánětlivých cytokinů a je odolná vůči apoptóze. Zvýšeně jsou produkovány IL-1, IL-4, IL-6 a IFN gamma, které podporují izotypové přesmyknutí při tvorbě protilátek. Zvýšená cytotoxicita je dána i zvýšenou expresí molekul CD56 a CD57, které jsou jinak charakteristické pro NK buňky. Klíčovým cytokinem k rozpoutání nadměrné prozánětlivé reakce je TNF alfa. Zdá se, že i poměrně malá intenzita stimulace TLR2 a TLR4 vede k jeho nadprodukci (15).
B lymfocyty
Omezená aktivita B lymfocytů je dána nejen snížením pozitivních interakcí s T-pomocnými lymfocyty v rámci T-dependentní odpovědi, ale i snížením odpovědi na polysacharidové antigeny, která je T-nezávislá. Místo polyklonální odpovědi často dochází spíše k méně efektivní odpovědi oligoklonální. Není nikterak výjimečná tvorba paraproteinu. Častěji jsou tvořeny autoprotilátky. Při tvorbě protilátek primárně dochází ke snížení sérových koncentrací IgM jako důsledku posunu od naivních k paměťovým formám B lymfocytů. Na druhé straně dochází ke zvýšené produkci IgG (především podtříd IgG1-3) a IgA. U IgA dominuje monomerní forma IgA, a naopak dimerní podtřída IgA2 chránící sliznice je přítomna v nedostatečném množství (11,13,16,17).
Slizniční imunita
První linie obrany, bariérová funkce epitelů a sliznic, je oslabena nejen díky snížení slizničních imunoglobulinů, ale i v důsledku morfologických změn v podobě úbytku mazových žláz a ztráty kožní elasticity. Nelze opomenout ani vztah stárnoucího mikrobiomu a imunitního systému. S věkem se snižuje jeho diverzita. V důsledku těchto změn dochází ke snížení produkce mastných kyselin s krátkým řetězcem (18). Do širší první linie obrany lze započítat i dendritické buňky. Ty se potýkají s poruchou mitochondriálních funkcí. Stimulace na některé TLR receptory, zejm. TLR 7/8 je snížena (19).
Další buněčné linie
Celkové množství monocytů zůstává sice zachováno, ale počet funkčních makrofágů se snižuje. Ubývá nejen produkce prozánětlivých cytokinů IL-6 a TNF alfa, nýbrž i růstového faktoru GM-CSF. Klesá schopnost nitrobuněčného zabíjení, což může opět vést k reaktivaci např. tuberkulózy či herpetických infekcí. Množství neutrofilních granulocytů zůstává taktéž zachováno. Jejich funkční omezení vyplývá spíše z redukce povrchové exprese CD16 Fc gamma receptoru vedoucí k poruše fagocytózy. Snížena je i schopnost tvorby tzv. neutrofilních „pastí“. Stárnoucí NK buňky snižují expresi povrchové molekuly CD56 a sekrecí IFN gamma. Snížení jejich počtu či funkce je spojeno se zvýšenou morbiditou a mortalitou (11, 13).
Byl definován tzv. IRP (immunological risk factor) v průběhu stárnutí. Tento faktor predikuje mortalitu, která činí 58 % v následujících 4 letech. Bývá spojen s progresí demence. Jedná se o inverzi poměru CD4+ /CD8+, zvýšení CD8+CD28 - paměťových/efektorových buněk, zvýšení prozánětlivých cytokinů (především IL-6), redukci počtu B lymfocytů a cytomegalovirovou séropozitivitu (20).
Zdá se, že u dlouhověkých lidí nad 90 let je řada těchto procesů zpomalena. Dobře fungující imunitní systém zdravých centeriánů je charakterizován nevýrazně sníženým poolem T lymfocytů s částečně zachovaným podílem naivních T lymfocytů a nesníženým počtem NK buněk. Z hlediska funkčního je intenzita chemotaxe, fagocytózy, aktivity NK buněk, proliferace T lymfocytů a neutrofilů obdobná jako u lidí středního věku. Proč tomu tak je, není zcela jasné. Imunitní systém pravděpodobně není primární příčinou dlouhověkosti, spíše obrazem řady dějů v organismu, a tím prediktorem doby života (21). V akcentaci negativních změn hraje důležitou úlohu přítomnost dalších komorbidit, které vedou k prohloubení sekundárního imunodeficitu. Každé chronicky probíhající onemocnění vede ve svém důsledku k oslabení funkce imunitního systému. Závažné jsou zejména stavy, které akcentují chronické prozánětlivé podmínky (obezita, ateroskleróza, diabetes, psoriáza a další autoimunitní onemocnění).
Tabulky 1 a 2 shrnují prolínající se momenty mezi znaky stárnoucího imunitního systému a specifik aplikovaných na infekci covid-19.
Tab. 1. Typické rysy stárnoucího imunitního systému 
Tab. 2. Klíčové momenty ovlivňující negativní prognózu seniorů v důsledku senescence 
Specifika klinické odpovědi na SARS-CoV-2 u žen
Ženy jsou obdařeny delší střední délkou života a jsou i více odolné k virovým infekcím obecně. Zdá se, že v případě infekce covid-19 tomu není jinak. Vysvětlení lze hledat v odlišném chování nespecifické imunity, vlivu steroidních hormonů a dalších faktorech vycházejících z informací uložených na pohlavních chromozomech. Řada odlišností je nezbytná pro úspěšné mateřství. Přítomnost X chromozomů nabývá na důležitosti i přes to, že jeden z nich je inaktivován. Imunitní systém žen bývá nastaven méně prozánětlivě v porovnání s muži. Vyšší diferenciace CD4+ T lymfocytů vede k intenzivnější protilátkové odpovědi. Protilátky v krvi déle cirkulují. Nespecifická imunita vykazuje vyšší intenzity odpovědi díky zvýšené citlivosti TLR7 vedoucí k potentní produkci interferonu. Tím se zvyšuje i úvodní intenzivnější odpověď na virovou RNA. Naopak tvorba IL-6 je nižší než u mužů. Chromozom X dále reguluje tvorbu transkripčního faktoru FOXP3, charakteristického pro T-regulační lymfocyty. Ženy disponují i možností vyšší exprese TLR8, CD40L a CXCR3, což nadále zlepšuje odpověď na virové infekce či vakcinaci, byť za cenu vyšší pravděpodobnosti autoimunitních onemocnění (22, 23).
Závěrem
Věk patří k důležitým nezávislým rizikovým faktorům pro závažnost průběhu infekce virem SARS-CoV-2. S věkem je spojen proces imunosenescence, který probíhá ve zcela individuálním tempu. Jeho intenzita závisí nejen na genetických předpokladech, ale i na dalších faktorech získaných v průběhu života. Významné jsou především komorbidity. Z pohledu imunologa především ty, které akcentují chronický oxidační stres, a tím urychlují stárnutí imunitního systému.
Zdroje
1. Rabi FA, Al Zoubi MS, Kasasbeh GA, et al. SARS-CoV-2 and Coronavirus Disease 2019: What We Know So Far. Pathogens 2020;9(3): doi:10.3390/pathogens9030231.
2. ČLK / Pro lékaře / Informace / Doporučený postup SIL ČLS JEP léčby pacientů s prokázanou infekcí COVID 19 (Internet). (cited 2020 Apr 17). Available from: https://www.lkcr.cz/informace-262.html?do%5bloadData%5d=1&itemKey=cz_100062.
3. Nikolich-Zugich J, Knox KS, Rios CT, et al. SARS-CoV-2 and COVID-19 in older adults: what we may expect regarding pathogenesis, immune responses, and outcomes. Geroscience 2020; DOI: 10.1007/s11357-020-00186-0.
4. Chen L, Li X, Chen M, at al. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res 2020; DOI: 10.1093/cvr/cvaa078.
5. Li X, Geng M, Peng Y, et al. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal 2020;DOI: 10.1016/j.jpha.2020.03.001.
6. Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Garamon, s. r. o., 1. vydání, Hradec Králové, 2016.
7. Li G, Fan Y, Lai Y, et al. Coronavirus infections and immune responses. J Med Virol 2020;92(4):424–32.
8. Qin C, Zhou L, Hu Z, et al. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clin Infect Di 2020; DOI: 10.1093/cid/ciaa248.
9. Zheng M, Gao Y, Wang G, et al. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell Mol Immunol 2020;DOI: 10.1038/s41423-020-0402-2.
10. Wang F, Nie J, Wang H, et al. Characteristics of peripheral lymphocyte subset alteration in COVID-19 pneumonia. J Infect Dis 2020; DOI: 10.1093/infdis/jiaa150.
11. Ventura MT, Casciaro M, Gangemi S, et al.. Immunosenescence in aging: between immune cells depletion and cytokines up-regulation. Clin Mol Allergy 2017;15 : 21.
12. Haynes L, Eaton SM, Burns EM, et al. CD4 T cell memory derived from young naive cells functions well into old age, but memory generated from aged naive cells functions poorly. Proc Natl Acad Sci USA 2003;100(25):15053–8.
13. Krejsek J, Kopecký O. Klinická imunologie. 1. vyd. Hradec Králové: Nucleus HK, 2004
14. Vallejo AN. CD28 extinction in human T cells: altered functions and the program of T-cell senescence. Immunol Rev 2005;205 : 158–69.
15. Bailey KL, Smith LM, Heires AJ, et al. Aging leads to dysfunctional innate immune responses to TLR2 and TLR4 agonists. Aging Clin Exp Res 2019;31(9):1185–93.
16. Weksler ME, Szabo P. The effect of age on the B-cell repertoire. J Clin Immunol 2000;20(4):240–9.
17. Gibson KL, Wu Y-C, Barnett Y, et al. B-cell diversity decreases in old age and is correlated with poor health status. Aging Cell 2009;8(1):18–25.
18. Salazar N, Arboleya S, Fernández-Navarro T, et al. Age-Associated Changes in Gut Microbiota and Dietary Components Related with the Immune System in Adulthood and Old Age: A Cross-Sectional Study. Nutrients 2019;11(8). DOI: 10.3390/nu11081765.
19. Splunter MV, Perdijk O, Fick-Brinkhof H, et al. Plasmacytoid dendritic cell and myeloid dendritic cell function in ageing: A comparison between elderly and young adult women. PloS One 2019; 14(12): e0225825.
20. Wikby A, Nilsson B-O, Forsey R, et al. The immune risk phenotype is associated with IL-6 in the terminal decline stage: findings from the Swedish NONA immune longitudinal study of very late life functioning. Mech Ageing Dev 2006;127(8):695–704.
21. Csaba G. Immunity and longevity. Acta Microbiol Immunol Hung 2019;66(1):1–17.
22. Conti P, Younes A. Coronavirus COV-19/SARS-CoV-2 affects women less than men: clinical response to viral infection. J Biol Regul Homeost Agents 2020;34(2). DOI: 10.23812
23. Vasanthakumar A, Chisanga D, Blume J, et al. Sex-specific adipose tissue imprinting of regulatory T cells. Nature 2020;579(7800):581–5.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2020 Číslo 2- Vliv pH-pufrovací technologie na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Kontinuální monitorace glykemie u starších pacientů léčených inzulinem
- Doporučení Alzheimer Europe k péči o osoby s demencí v době pandemie covid-19
- Evropská geriatrická medicína v době covidu-19
- Spolupráce mladých geriatrů s Mladými praktiky: Ohlédnutí za společným workshopem a příprava dalšího ročníku
- Vážené kolegyně, vážení kolegové,
- Infekce covid-19 u seniorů – pohled imunologa
- Role výživy a intenzivní metabolické péče v podmínkách infekce covid-19 (SARS-CoV-2)
- Covid-19 a křehký pacient v následné a dlouhodobé ústavní péči
- Vliv vybraných faktorů na hodnocení důstojnosti seniorů
- Kde jsou stále lvi aneb prevence komplikací aterosklerózy statiny u asymptomatických starších osob
- Rizika terapie dabigatranem u seniorů s renální insuficiencí – klinické zkušenosti
- Senioři a elevace lipoprotein-asociované fosfolipázy A2
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Covid-19 a křehký pacient v následné a dlouhodobé ústavní péči
- Infekce covid-19 u seniorů – pohled imunologa
- Rizika terapie dabigatranem u seniorů s renální insuficiencí – klinické zkušenosti
- Vliv vybraných faktorů na hodnocení důstojnosti seniorů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



