-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapie nádorů postihujících játra metodami intervenční radiologie
Interventional radiology therapies for liver cancer
Radiological methods and procedures have become not only an inseparable part of the diagnosis of primary and secondary liver tumors, but also therapy and disease management of patients with colorectal cancer. The most common primary liver cancer, hepatocellular carcinoma, can be treated with curative intent by surgical approach as well as navigational radiological interventions. Palliative methods include transarterial chemoembolization, which is suitable for more than half of patients during treatment. extends treatment options even in patients with metastatic colorectal cancer who fail at standard therapies. In addition to thermal ablation in oligometastatic disease, intravascular procedures (chemoembolization and regional chemotherapy, preoperative portal vein embolization) can be used. By modern intervention approaches in patients with malignant biliary tract stenosis, we are able to refine and accelerate the diagnosis, to improve quality of life and to extend patients’ survival.
Keywords:
liver tumors, thermal ablation, chemoembolization
Autoři: Tomáš Andrašina; Tomáš Rohan; Jakub Hustý; Vlastimil Válek
Působiště autorů: Klinika radiologie a nukleární medicíny LF MU a FN Brno
Vyšlo v časopise: Čas. Lék. čes. 2018; 157: 195-202
Kategorie: Přehledový článek
Souhrn
Radiologické metody a postupy se staly neodmyslitelnou součástí nejen diagnostiky primárních a sekundárních nádorů jater, ale i terapie a managementu onkologických pacientů. U nejčastějšího primárního tumoru jater, hepatocelulárního karcinomu, mají termální ablační metody navigované radiologickými metodami kurativní účel stejně jako léčba chirurgická. Mezi paliativní metody se řadí transarteriální chemoembolizace, která je vhodná pro více než polovinu pacientů v průběhu léčby. Intervenční radiologie rozšiřuje možnosti léčby i u pacientů s metastatickým kolorektálním karcinomem, u kterých selhává standardní terapie. Kromě termálních ablací u oligometastatického postižení lze využít rovněž intravaskulární postupy (chemoembolizace a regionální chemoterapie, předoperační embolizace portální žíly). Moderními intervenčními přístupy u pacientů s maligními stenózami žlučových cest jsme schopni zpřesnit a zrychlit diagnostiku postižení i zkvalitnit a prodloužit přežití.
Klíčová slova:
nádory jater, termální ablace, chemoembolizace
ÚVOD
Nádory jater je možné rozdělit dle biologické povahy na benigní a maligní. Benigní nádory v naprosté většině případů nejsou cílem radiologické intervenční léčby. Výjimkou jsou velké symptomatické hemangiomy (1). Maligní nádory jater lze klasifikovat na primární a sekundární. Sekundární nádory jater jsou nejčastější příčinou mortality a morbidity onkologicky nemocných. Radiologické intervence u těchto nádorů hrají důležitou roli v případě selhání standardních postupů chemoterapie a chirurgické léčby.
Mezi primární maligní nádory jater se řadí především hepatocelulární karcinom a cholangiocelulární karcinom. Tyto dva typy nádorů se od sebe výrazně liší svým biologickým chováním a tím i způsobem léčby. U hepatocelulárního karcinomu se podobně jako u metastatického onemocnění jater z radiologických intervencí využívá termální ablace, transarteriální chemoembolizace, případně embolizace portálního řečiště při přípravě na chirurgický výkon. Všechny tyto metody lze kombinovat se systémovou chemoterapií. Cholangiocelulární karcinom, který zaujímá perihilové oblasti, je v drtivě většině případů zachycen v neoperabilním stadiu a radiologické intervence, jako perkutánní transhepatální drenáž, implantace biliárního stentu a endoluminální radiofrekvenční ablace, jsou v kombinaci s endoluminální brachyterapií téměř jedinými možnostmi léčby.
TYPY RADIOLOGICKÝCH INTERVENCÍ A JEJICH INDIKACE
Radiologické intervence používané k léčbě maligních nádorů jater lze rozdělit na perkutánní ablační metody, transarteriální výkony, zejména chemoembolizace, a paliativní metody léčby maligních stenóz žlučových cest.
Perkutánní ablační metody
Mezi nejčastěji používané perkutánní ablační metody patří radiofrekvenční ablace, mikrovlnná ablace a kryoablace, které tkáň destruují změnou teploty. V poslední době se rozvíjejí metody ireverzibilní elektroporace využívající k destrukci tkáně průchod vysokovoltážního elektrického proudu. Mezi méně využívané metody patří chemické ablace, laserová ablace nebo fokusovaný ultrazvuk. Perkutánní ablační metody mohou být prováděny pod kontrolou CT či ultrazvuku, vzácně i pod kontrolou MR. Princip spočívá v zavedení tenké jehly do blízkosti ložiska, které je za působení tepelné či elektrické energie nebo aplikací různých roztoků více či méně destruováno. Záměr perkutánních ablačních metod je vždy kurativní.
Obvyklou indikací ablačních metod jsou solitární jaterní ložiska menší než 5 cm nebo tři jaterní ložiska velikosti do 3 cm (2). Ať provádíme jakoukoliv technologii ablace, vždy je nutné ošetřit nejen samotné ložisko, ale i zdravý jaterní parenchym v okolí, tzv. bezpečnostní lem v šířce minimálně 5–10 mm. U takto správně technicky provedených ablací ložisek o velikosti do 3 cm je účinnost terapie vyjádřená dobou přežití téměř srovnatelná s výsledky chirurgické resekce (3). U pacientů podstupujících adjuvantní chemoterapii u ložisek do 3 cm může být podíl lokálních recidiv ve srovnání s chirurgickou resekcí dokonce menší (4). Nicméně pokud je bezpečnostní lem užší než 5 mm, činí lokální rekurence do 2 let 54–74 %; v případě správně technicky provedeného výkonu a lemu ošetřené zdravé tkáně širšího než 10 mm je lokální rekurence nízká (5). Lokální ablační metody v kombinaci s chemoterapií poskytují pacientům s neresekabilními metastázami kolorektálního karcinomu naději na 5leté období bez progrese onemocnění ve 24 % případů a na 5leté přežití 43 % (6).
Perkutánní ablační metody se tak stávají výhodnou alternativou chirurgické léčby u pacientů se závažnými komorbiditami nebo nepřejících si podstoupit operační výkon. Typickým kandidátem ablační metody je pacient s hepatocelulárním karcinomem v terénu cirhózy nebo s oligometastatickým postižením jater metastázami kolorektálního karcinomu. Rizikem ablace větších ložisek je menší procento kompletní remise onemocnění a vysoký počet lokálních recidiv. Kontraindikací výkonů je nespolupracující pacient, sepse, koagulopatie (INR > 1,3–1,5, počet trombocytů < 50 000/µl) a nepříznivé uložení ablovaného ložiska (7). Ablační výkony lze provádět i přímo při klasickém či laparoskopickém chirurgickém zákroku.
Nejčastěji dostupnými termálními ablačními metodami jsou radiofrekvenční ablace (RFA), mikrovlnná ablace (MWA) a kryoablace.
Radiofrekveční ablace (RFA)
Radiofrekvenční ablace je nejdostupnější metodou ablace jaterních ložisek, v současné době je využívána zejména u menších ložisek v játrech či ledvinách.
Při RFA v játrech se používá energie 50–250 W a frekvence proudu 300–500 kHz. K vlastní likvidaci tumoru dochází teplem, které vzniká při pohybu elektricky nabitých částic (iontů) uvnitř tkáně působením vysokofrekvenčního střídavého proudu. Buňky v okolí nekryté elektrody jsou zahřívány na teplotu ≥ 50 °C. Při této teplotě se začínají „rozpouštět a praskat“ buněčné membrány a dochází k postupné denaturaci bílkovin a ireverzibilnímu zničení buněk. Při RFA postupně dosahujeme v ložisku podle typu přístroje teploty 60–105 °C. Neperfundovaná tkáň je prakticky okamžitě nevratně zničena již při dosažení teploty 60–70 °C. Pokud má být tkáň zničená dostatečně, je třeba, aby celé ložisko dosáhlo teploty > 50 °C na 4–7 minut (8, 9). Čím hůře tkáň vede teplo, tím delší je čas nutný k dosažení dostatečné teploty v celém ložisku. Pokud je ložisko ochlazované (např. kvůli blízkosti velkých cév), je dosažení potřebné teploty nemožné. Velmi rychlý vzestup teplot na 100 °C v okolí elektrod není žádoucí, působil by karbonizaci tkáně v okolí hrotu aktivní elektrody a tím by nastala její elektrická izolace a ztráta vodivosti. Pokud teplota přesáhne 100–110 °C, dochází navíc i k odpařování (vaporizaci) tkáně, zvyšování teploty elektrody nad 100 °C tak nemá smysl. Výsledkem postupného zahřívání tkáně je koagulační nekróza.
Vlastní přístroj se skládá z radiofrekvenčního generátoru, aktivní a disperzní elektrody v případě monopolárních přístrojů nebo dvou a více aktivních elektrod u bipolárních či multipolárních přístrojů. Jednotlivé výrobky se liší především tvarem elektrody nebo využitím vnitřního systému chlazení elektrody, které karbonizaci brání. Pochopitelnou snahou všech těchto přístupů je zničit v játrech v co nejkratším čase co největší ložisko. Aktivní elektroda má tvar jehly 14–21 G (o průměru cca 1,6–0,7 mm). Monopolární elektroda je při RFA používána běžně. Zavádí se tak, aby se neizolovaný hrot nacházel v místě cílové léze. Přitom je nutné druhou velkou disperzní elektrodu přilepit pacientovi na kůži (většinou na stehno). Existuje více tvarů monopolárních elektrod: expandibilní, mnohadetektorové (kovové háčky, které se vysunují z hrotu elektrody) a systémy s několika elektrodami vedle sebe (tzv. cluster elektrody) či chlazené elektrody (cooled tip elektrody), jež brání uhelnatění a pro pacienta je jejich užití i méně bolestivé. I přes technické zlepšení v posledních desetiletích je však maximální velikost lézí vhodných k ablaci 5–7 cm.
Při použití systému s bipolární elektrodou elektrický proud probíhá mezi dvěma izolovanými částmi jedné elektrody, u bipolární nebo multipolární ablace s více elektrodami využíváme systém uložení elektrod v cílové tkáni. Dle komplexního protokolu ablace pak elektrický proud prochází mezi jednotlivými elektrodami, tak aby byl destruovaný celý plánovaný objem tkáně. Výhodou tohoto systému je možnost ablace i větších ložisek, nevýhodou nutnost přesné inzerce více elektrod spojené s velkou časovou náročností (celkový čas výkonu dosahuje ≥ 4 hodiny).
Ideální ložisko pro radiofrekvenční ablaci by mělo být ze všech stran ohraničeno jaterním parenchymem a nemělo by se nacházet v blízkosti velkých cév a hilu jater z důvodu snížení rizika komplikací a lokálních rekurencí. V případě, že se ložisko nachází v blízkosti tepelně citlivých struktur (žaludek, střevo), existuje řada postupů, jak tyto orgány chránit. Příkladem je instilace tekutiny či vzduchu do meziprostoru pomocí velmi tenkých jehel.
Celkově lze shrnout, že výhodou metody je velmi dobrá kontrola průběhu tepelného ničení nádorové tkáně. Morbidita a mortalita je minimální, uvádí se celkový počet komplikací mezi 2 a 9 % (8).
Obr. 1. Radiofrekvenční ablace jaterního ložiska. 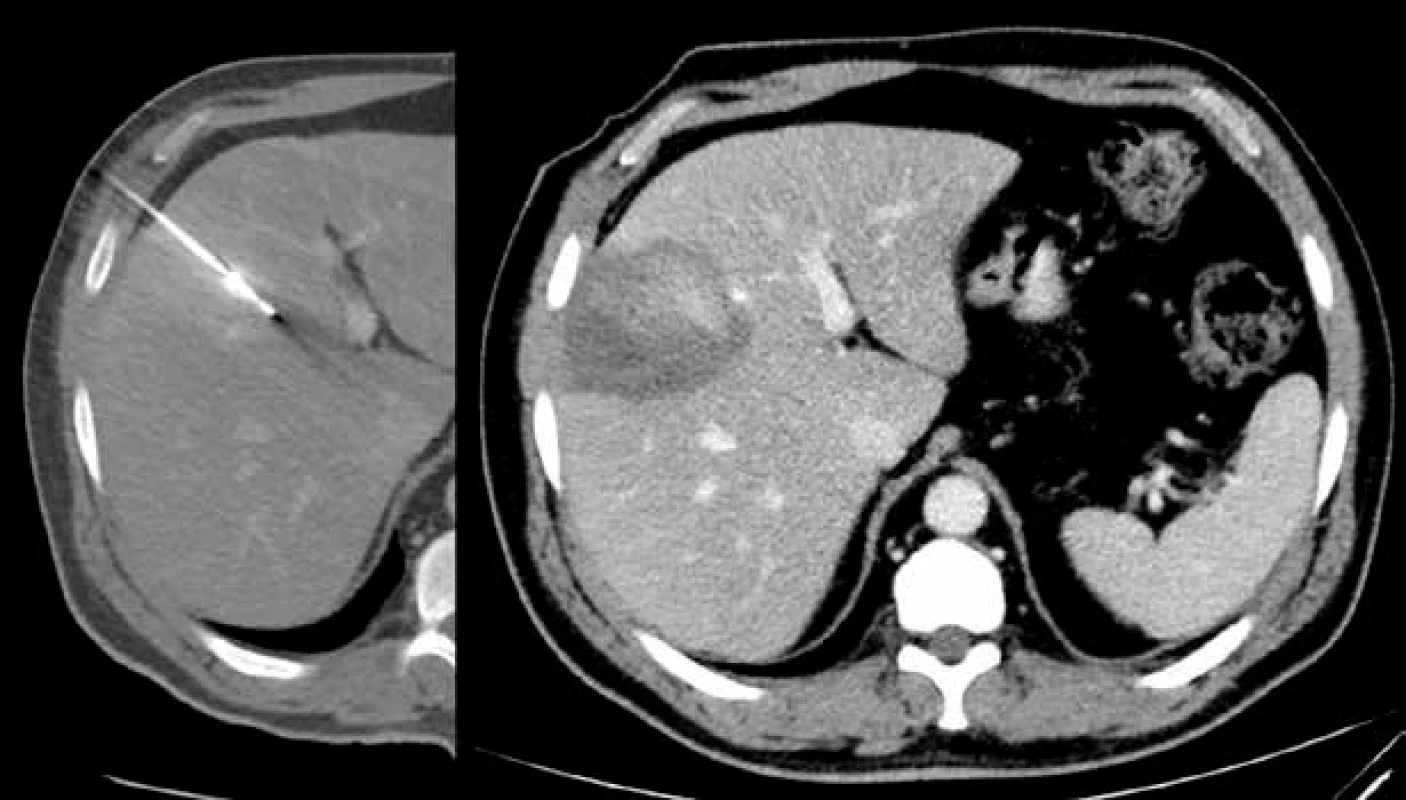
V levé polovině je na CT denzní ablační jehla zavedená do jaterního parenchymu k blízkosti ložiska. Na pravé polovině snímku je na CT v portovenózní fázi ohraničená hypodenzní ablační zóna v jaterním parenchymu. Mikrovlnná ablace (MWA)
Mikrovlnná ablace destruuje okolní tkáně účinkem tepla pomocí vysokofrekvenčního oscilujícího elektromagnetického pole generovaného anténou zavedenou do ablované zóny. Vysoká frekvence elektromagnetického pole vede ke změně uspořádání polarizovaných molekul (zejména vody), zvýšení kinetické energie těchto molekul a tvorbě tepla. Vzhledem k tomu, že nádorová tkáň obvykle obsahuje velké množství vody, je náchylná k zahřívání mikrovlnnou ablací.
Výhodou MWA je možnost vytvořit větší a pravidelnější – téměř sférické – zóny koagulační nekrózy. Dalšími výhodami oproti RFA jsou rychlejší tvorba tepla vedoucí ke zkrácení času výkonu, lepší propagace tepla do okolních tkání přes již ablované zóny a skutečnost, že šíření tepla není ovlivněno vodivostí tkání jako u radiofrekvenční ablace.
Dle dostupných studií je MWA ve srovnání s RFA méně ovlivněna tzv. efektem chladiče a má menší výskyt lokálních recidiv (10). Četnost a spektrum komplikací jsou podobné jako u RFA. V posledních letech došlo technickým vývojem k zabránění šíření tepla podél elektrody a rovněž ke zmenšení šíře elektrod na 14 G (cca 1,6 mm). I z těchto důvodů je mikrovlnná ablace v současnosti nejvhodnější ablační metodou jater.
Kryoablace
Kryoablace využívá k chlazení ablační jehly argonový plyn pod vysokým tlakem. Chlad se z ablační jehly šíří do okolních tkání. Následně je do jehly hnáno helium v plynné podobě, které působí její ohřátí. Zchlazení a následné roztátí okolních tkání vede k buněčné smrti s rozpadem cytoplazmatické membrány. K příčinám buněčné smrti patří i vytvoření mikrokrystalů ledu v malých cévách což způsobí ischemickou nekrózu tkáně.
V jaterní tkáni je použití kryoablace limitováno variabilním tvarem ablační zóny a heat sink efektem okolních cév snižující účinnost ablace. V minulosti byl uváděn i vyšší počet komplikací výkonu ve srovnání s RFA, tato nevýhoda byla dle dostupné literatury již eliminována (11). Mezi specifické komplikace pro kryoablaci se řadí extenzivní krvácení z důvodu střižného poranění okolních cév a tzv. kryošok. Ten je způsoben uvolněním cytokinů, což vede k systémové reakci projevující se horečkou, tachykardií a tachypnoí. Z výše popsaných důvodů není kryoablace jaterních ložisek příliš rozšířená a užívá se spíše k ablaci ledvinných či kostních ložisek.
Komplikace termálních ablačních metod
Komplikace lze rozdělit na případy způsobené zaváděním elektrody a spojené s vlastní ablací. Komplikace zavedení jehlové elektrody jsou extrémně vzácné. Patří mezi ně pneumothorax, pleurální výpotek, perikardiální tamponáda a poranění nitrobřišních orgánů a bránice. Lze jim předejít již zmíněnými pokročilými technikami, například tzv. hydrodisekcí (aplikací 5% roztoku glukózy mezi orgány s cílem jejich oddálení). Další komplikací je uhnízdění nádorových buněk v průběhu kanálu po vstupu jehly a vzniku implantačních metastáz. Incidence se uvádí v řádu desetin procenta (3). Komplikací vlastního ablačního výkonu mohou být jaterní infarkty, abscesy a poranění žlučových cest s leakem žluči. Specifické komplikace kryoablace byly zmíněny výše.
Význam metody
Termální ablace se staly standardní výbavou v rámci multimodální péče o onkologického pacienta. Ve vybraných případech jsou přímým konkurentem chirurgických postupů a dosahují lepších výsledků než stereotaktická radioterapie (12). V ČR mají nezastupitelnou roli v komplexní péči o pacienta s metastatickým kolorektálním karcinomem; nemocný s oligometastatickým onemocněním jater může být i opakovaně ošetřen v rámci krátké hospitalizace v odborných centrech.
Nemoc může být při spolupůsobení chemoterapie a biologické léčby dlouhodobě pod kontrolou. U ložisek nejčastějšího primárního nádoru jater – hepatocelulárního karcinomu, která jsou menší než 2–3 cm, jsou výsledky termálních ablací a chirurgické léčby srovnatelné (13), u ložisek o velikosti < 1 cm dokonce z pohledu komplikací méně rizikové než chirurgická resekce. V léčbě hepatocelulárního karcinomu tak mají termální ablační metody jednoznačné postavení v mezinárodních doporučeních.
Transarteriální metody
Mezi v současnosti nejčastěji používané transarteriální metody v léčbě onkologických pacientů patří transarteriální chemoembolizace a embolizace portální žíly.
Transarteriální chemoembolizace (TACE)
Principem této metody je kombinace embolizace přívodných tepen tumoru s následnou ischemizací tkáně a cílené aplikace chemoterapeutika do ložiska chemoterapie. Nádorová buňka je postižená jednak hypoxií, jednak je vystavena násobně vyšším koncentracím chemoterapeutika, než umožňuje jeho systémové podání. Výsledkem je lepší odpověď na léčbu a snížení vedlejších účinků chemoterapie.
Transarteriální chemoembolizace je metoda určená ke zpomalení progrese vícečetného ložiskového postižení jater, které není vhodné k chirurgické resekci ani lokální ablační metodě. Ve většině případů se jedná o metodu nekurativní, nicméně u vybraných pacientů je dosaženo kompletní odpovědi s výsledkem dlouhodobého přežití. Je vhodná zejména u hypervaskularizovaných primárních nádorů jater či metastáz. Typicky se jedná o hepatocelulární karcinom a jaterní metastázy neuroendokrinního tumoru, méně často se používá u metastatických kolorektálních karcinomů nebo intrahepatálních cholangiocelulárních karcinomů. Transarteriální embolizaci lze dále dělit dle použitého embolizačního materiálu. V případě ložisek hepatocelulárního karcinomu lze využít embolizaci pomocí lipiodolu u tzv. konvenční TACE. Podmínkou je možnost superselektivní sondáže tepen nádoru. V současnosti jsou k embolizaci častěji využívány speciální částice, tzv. drug eluting beads.
Při konvenční chemoembolizaci lipiodolem, tekutou olejovou kontrastní látkou, je výhodou ischemizace i okrajových částí nádorů průnikem cestou biliárních plexů a sinusoidů do větévek portálního řečiště. Těžko odhadnutelné je samotné trvání cévní okluze. U určité skupiny tumorů (nodulární formy HCC v cirhotickém terénu s vytvořenou pseudokapsulou) můžeme optimální efekt při retenci lipiodolu sledovat i několik let. U ostatních ložisek dochází k vymývání lipiodolu dříve. Cytostatikum s lipiodolem nevytváří aktivní vazby a je ze směsi zcela uvolněno do několika hodin či dnů. Minoritní význam cytostatika potvrzují i metaanalýzy, samotný druh či koncentrace neměl vztah k léčebné odpovědi u hepatocelulárního karcinomu (HCC). Nevýhodou je také ischemizace i zdravého parenchymu s poškozením žlučových cest.
Moderní materiály určené k chemoembolizaci, tzv. drug eluting beads (DEB), jsou synteticky utvářené neodbouratelné částice, které v souvislosti s pravidelným tvarem a elasticitou umožňují optimální okluzi cévy. Navíc jsou schopné do své struktury aktivně vázat cytostatikum a postupně ho v tumorózním ložisku uvolňovat. Struktura polymeru, založená nejčastěji na polyvinylalkoholu (PVA), je obohacena negativně nabitými sulfonovými skupinami, které pak vážou molekuly cytostatika s pozitivním nábojem, např. doxorubicin. Částice jsou kalibrovány v rozměrech 50–900 μm, což umožňuje zvolit různou míru penetrace částic do tumoru.
Příprava směsi s cytostatikem probíhá v lékárně a operatér není vystaven riziku manipulace s cytostatikem jako u klasické chemoembolizace s lipiodolem, navíc pacientovi aplikujeme přesně stanovenou dávku léčiva. Postupné uvolňování cytostatika prokázaly testy in vitro a na zvířecích modelech, DEB jsou schopny udržovat vysoké koncentrace léčiva po dobu 6–72 dní. Na rozdíl od chemoembolizace s lipiodolem prokazujeme až 30× nižší systémové koncentrace cytostatika a naopak velmi vysoké intratumorózní koncentrace cytostatika po podání. Výsledkem by měl být ještě nižší počet nežádoucích účinků a vyšší účinnost léčby. Nicméně metaanalýzy ukazují podobné výsledky s mírným snížením četnosti nežádoucích účinků (20–25 %) ve srovnání s použitím lipiodolu (14).
Vlastní výkon chemoembolizace je zahájen vstupem do arteriálního řečiště Seldingerovou technikou (nejčastěji a. femoralis v třísle). Následuje superselektivní katetrizace přívodné tepny tumoru, která se embolizuje. V případě velkého množství ložisek se embolizují větve a. hepatica dextra či sinistra neselektivně, zpravidla pouze jedna strana v jednom sezení.
Proceduru je možné opakovat v intervalech 4–8 týdnů. K hodnocení léčebné odpovědi využíváme vyšetření CT či MR s i. v. kontrastem, při kterých lze posoudit velikost nekrózy a případné reziduální sycení ložiska. Změna velikosti ložiska není zpočátku významná.
Komplikace výkonu lze rozdělit na komplikace z arteriálního přístupu a komplikace vlastního výkonu. Mezi možné komplikace vlastního výkonu patří bolesti na hrudi či epigastria, dechové potíže, zhoršení jaterních funkcí, vznik abscesu, hematomu a plicní embolie (14). Výkon je dobře tolerován pacienty při zavedené analgetické, antiflogistické a antiemetické terapii.
Obr. 2. Transarteriální chemoembolizace – před výkonem. 
Na snímku z angiografie je patrná selektivní katetrizace segmentální větve pro S6 s nepravidelným arteriálním zásobením v okolí této segmentální tepny. Obr. 3. Transarteriální chemoembolizace – po výkonu. 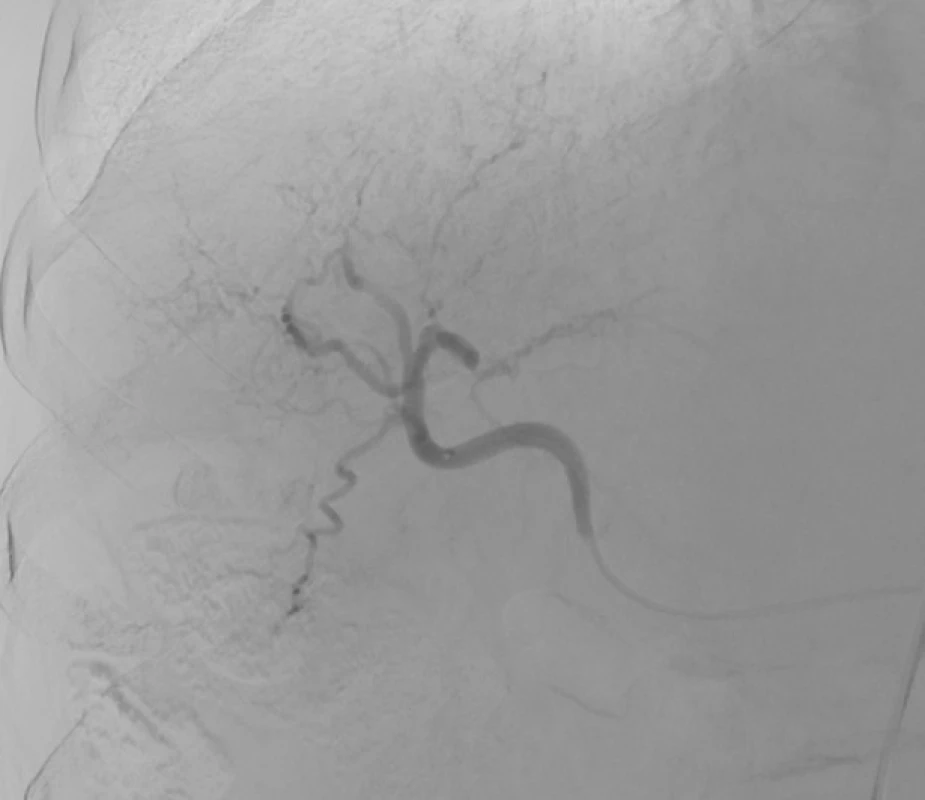
Nástřik pravé jaterní tepny. Nepravidelné arteriální zásobení v okolí segmentální tepny pro S6 vymizelo. Význam metody
Chemoembolizace, v minulosti léčba přístupná jen malé skupině pacientů na superspecializovaných pracovištích, je díky přechodu k technicky jednodušší aplikaci DEB nyní využívána ve většině krajských onkologických center. Dle mezinárodních standardů je indikována u pacientů se středně pokročilým HCC. Jedná se o téměř všechny nemocné, kteří jsou v dostatečně dobrém biologickém stavu, aby podstoupili onkologickou léčbu, ale nejsou vhodní pro kurativní výkony, jako jsou transplantace jater, resekce či ablace ložisek. Jedná se přibližně o polovinu pacientů s nově diagnostikovaným hepatocelulárním karcinomem v ČR (15).
Medián přežití pacientů, kteří podstupují chemoembolizaci, dosahuje 20–25 měsíců. Nemocní s metastatickým neuroendokrinním tumorem mohou dosáhnout dlouhodobé stabilizace onemocnění a ústupu příznaků (16). U pacientů s metastatickým kolorektálním karcinomem, cholangiocelulárním a jinými malignitami se v zásadě jedná o záchrannou terapii onemocnění limitovaného na játra neodpovídající na jiný typ onkologické léčby.
Předoperační embolizace portální žíly
U části nemocných s nádorem v játrech je resekční výkon možný pouze s velkým rizikem pooperačního selhání jater. Jedná se především o pacienty s postižením segmentů 8-5 s malým levým jaterním lalokem. V těchto případech je možné provést předoperační embolizaci portální žíly. Princip metody spočívá v zabránění přítoku portální krve k jaterním segmentům, které hodláme odstranit (resekovat). Je-li však většina tkáně jaterních segmentů, které chceme embolizovat, nahrazena nádorem, nemá výkon většinou žádný efekt. Jako embolizační materiál lze použít histoakryl, fibrinový gel, mikročástice či kovové spirály (17).
Před výkonem je nezbytné provést CT s výpočtem objemu ponechané tkáně – tzv. functional liver remnant (FLR). Tento objem by měl u pacienta se zdravými játry dosahovat nejméně 25 % celkového funkčního objemu jater a u pacientů s chronickým onemocněním jater nebo po vysokodávkové; chemoterapii nejméně 40 % (17). Změnu objemu jaterního parenchymu hodnotíme opětovným výpočtem objemu ponechané tkáně na provedeném CT (CT volumometrie) za 4 týdny.
Absolutní kontraindikací tohoto výkonu jsou vzdálené metastázy a periportální lymfadenopatie. Mezi relativní kontraindikace se řadí neřešitelná koagulopatie, portální hypertenze, nádorová trombóza v. portae, renální selhání a lokalizace tumoru znemožňující vhodný přístup do portálního řečiště (17).
Embolizaci portální žíly provádíme transhepatální cestou. Po lokální anestezii podkoží zapichujeme vpravo ve střední axilární čáře nad horním okrajem 10.–12. žebra jehlu Chiba do jaterního parenchymu. Jehlu vedeme hrotem do oblasti hilu a snažíme se zobrazit periferní větev portální žíly. Poté jehlou zavedeme vodič 0,018 inch, po něm systém koaxiálních mikrodilatátorů, po vodiči 0,038 inch pak embolizační cévku. Embolizujeme zásadně od periferie směrem k centru.
Po uzavření větví portální žíly dochází k redistribuci toků krve. Výsledkem je postupná atrofie embolizovaných segmentů a hypertrofie zdravých segmentů o 8–25 % u zdravých jater (17). U pacientů s chronickým onemocněním jater je hypertrofie zbylého jaterního parenchymu menší, postup navíc ve 20 % případů selhává zcela (17). Je nutné uzavřít více větví portální žíly (nejméně pro 3–4 segmenty). Typicky se provádí embolizace všech segmentů pravého laloku, která je někdy doplněná o embolizaci segmentu 4. Výsledkem této přípravy je hypertrofie segmentů 2 a 3 a následné provedení rozšířené pravostranné hemihepatektomie. Úspěšnost výkonu se blíží 100 %. Četnost provedených resekcí je 85 % u zdravých jater, respektive 70 % u chronicky nemocných jater. Nejčastějšími příčinami neresekability jsou progrese tumoru v mezidobí nebo zobrazovacími metodami nedetekované peritoneální metastázy (18).
Nezávažné přechodné nežádoucí účinky jako horečka, bolesti břicha a nauzea se vyskytují až u třetiny případů, závažnější komplikace jsou vzácné (cca 1 % případů) (17).
Obr. 4. Embolizace v. portae – před výkonem. 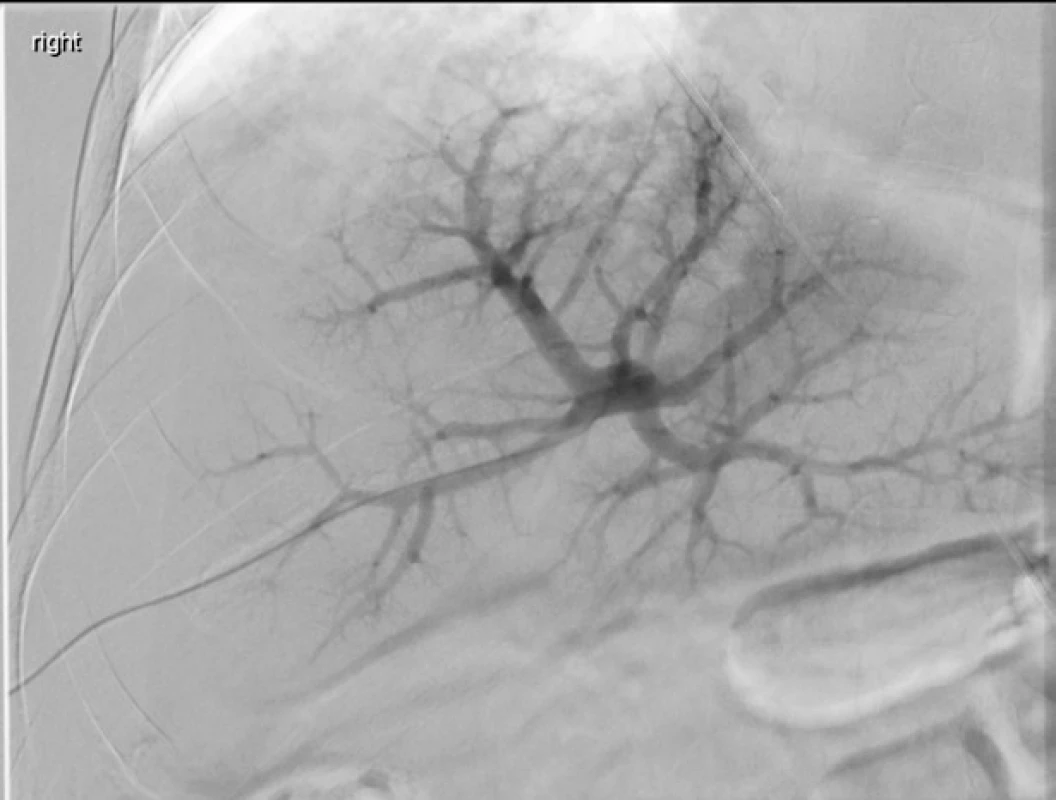
Nástřik portálního řečiště katetrem směřujícím z pravého laloku (přístupová cesta) do jaterního hilu. Nejsou patrné defekty v kontrastní náplni ani nepravidelnosti větvení. Obr. 5. Embolizace v. portae – po výkonu. 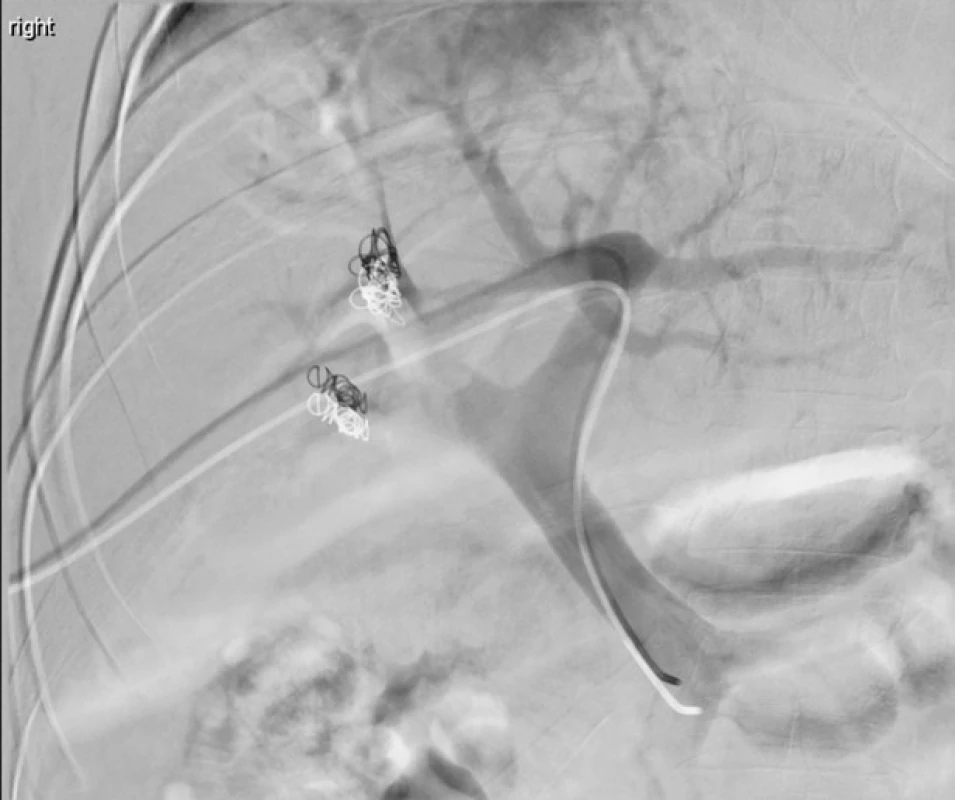
Nástřik portálního řečiště katetrem umístěným v kmeni v. portae. Plní se pouze levostranné větve portální žíly, pravostranné větve jsou embolizovány – na snímku patrné embolizační spirálky (koily). Intervenční metody v léčbě maligních stenóz žlučových cest
Maligní stenóza žlučových cest je způsobená nejčastěji nádory hlavy pankreatu a nádory žlučových cest, méně často metastázami jater či lymfadenopatií v jaterním hilu. Metodou první volby ke zprůchodnění žlučových cest je endoskopická retrográdní cholangiopankreatikografie (ERCP) se zavedením plastového drénu (19). Tento postup selhává u vysokých stenóz žlučových cest v oblasti ductus hepaticus communis, dexter et sinister z důvodu nemožnosti překlenout celou oblast stenózy duodenobiliárním drénem. Stenózy této lokalizace jsou zpravidla neoperabilní.
U vysokých biliárních perihilózních maligních stenóz je metodou volby perkutánní transhepatální drenáž (PTD) s cílem překlenout stenózu žlučových cest zavedením zevně-vnitřního drénu. U pacientů s dobrým celkovým stavem a předpokládaným přežitím delším než 3 měsíce je vhodné plastový zevně-vnitřní drén nahradit metalickým stentem a doplnit ozáření oblasti stenózy žlučových cest endoluminálně zavedeným zářičem (brachyterapie). V případě obstrukce metalického stentu je možné znova zavést zevně-vnitřní drén a stent rekanalizovat endolumiální radiofrekvenční ablací s čištěním ablovaného materiálu balónkem.
Všechny výše zmíněné výkony probíhají v analgosedaci za monitorování krevního tlaku, EKG a saturace kyslíku v krvi pod dozorem sestry. Kontraindikací k výkonu jsou koagulopatie. Očekávaným efektem léčby je pokles obstrukčních jaterních enzymů a bilirubinu.
Cílem těchto intervencí je zabránit jaternímu selhání z důvodu obstrukce žlučových cest a zajistit transport žluči do tenkého střeva, kde se účastní trávení lipidů. Výsledkem je prodloužení přežití a zlepšení kvality života zejména u pacientů se zavedenými metalickými stenty.
Perkutánní transhepatální drenáž
Iniciálním krokem perkutánní transhepatální drenáže je punkce žlučových cest pomocí jehly Chiba pod skiaskopickou kontrolou. Pozici jehly ve žlučových cestách zjistíme aplikací jódové kontrastní látky. Luminem jehly Chiba je do žlučových cest zaváděn vodič. Po výměně instrumentária je vodič přes stenózu zaveden až do duodena a následně je po něm zaveden zevně vnitřní drén, jehož zevní konec se stehem fixuje ke kůži. Zevní otvor drénu je uzavřen zátkou. Drén je opatřen vícečetnými otvory po stranách, kterými se žluč dostává ze suprastenotické části do duodena.
Po výkonu zůstává pacientovi na kůži část drénu dlouhá 5–10 cm. Slouží jako přístupová cesta k dalším procedurám (výměně drénu, odběru vzorků ze žlučových cest nebo zavedení stentu) a zejména k proplachům drénu. Pro udržení co nejdelší doby průchodnosti drénu je nutné drén proplachovat 2–3× denně fyziologickým roztokem (ve 20ml stříkačce).
Výkon se provádí za (minimálně 3denní) hospitalizace, během které je pacientovi vysvětlena péče o drén. Lze zavést až tři zevně-vnitřní drény (2× zprava a 1× zleva) s cílem minimalizovat poškození jater cholestázou. Počet zavedených drénů záleží na radiologickém a laboratorním obrazu. V případě, že se nepodaří zavést zevně-vnitřní drén hned v prvním sezení, lze krátkodobě ponechat pouze zevní drén napojený na sběrný sáček. Při druhém sezení po odeznění otoku z cholestázy se stenózou zpravidla podaří projít a drén se vymění za zevně-vnitřní.
Během zavedení drénu lze provést odběr vzorků z místa stenózy pro histologické vyšetření endoluminálními klíšťkami (20). To má význam zejména u infiltrativních cholangiocelulárních karcinomů, které jsou nevhodné pro biopsii pod CT. Senzitiva odběru vzorků se pohybuje okolo 75 %, specificita se blíží 100 %. Pozitivní prediktivní hodnota je rovněž blízká 100 %, naopak negativní prediktivní hodnota činí cca 26 % (18). V současnosti existuje možnost odběru tkáně i pod kontrolou zraku pomocí choledochoskopu, což dále zvyšuje senzitivitu metody.
Komplikací výkonu jsou poranění způsobená punkcí žlučovodů jehlou Chiba – leak žluči s vytvořením biliomu, krvácení, pneumothorax. V naprosté většině případů jsou tyto komplikace nezávažné a nevyžadují další léčbu. K dlouhodobým komplikacím zavedeného drénu patří obtékání žluči okolo zevního konce drénu při jeho ucpání. Obturace drénu je často doprovázena cholangitidou s teplotami, třesavkami, ikterem a bolestmi v pravém podžebří. V těchto případech je na místě okamžitá návštěva ošetřujícího lékaře a konzultace radiologického pracoviště, které provádělo intervenční výkon. Řešením je výměna drénu za silnější, antibiotická terapie cholangiitidy a poučení pacienta. Výskyt nezávažných komplikací spojených s perkutánní drenáží žlučových cest je bohužel vysoký a týká se až 40 % nemocných, závažné komplikace pak postihují 5–10 % pacientů.
Obr. 6. Perkutánní transhepatální drenáž (PTD). 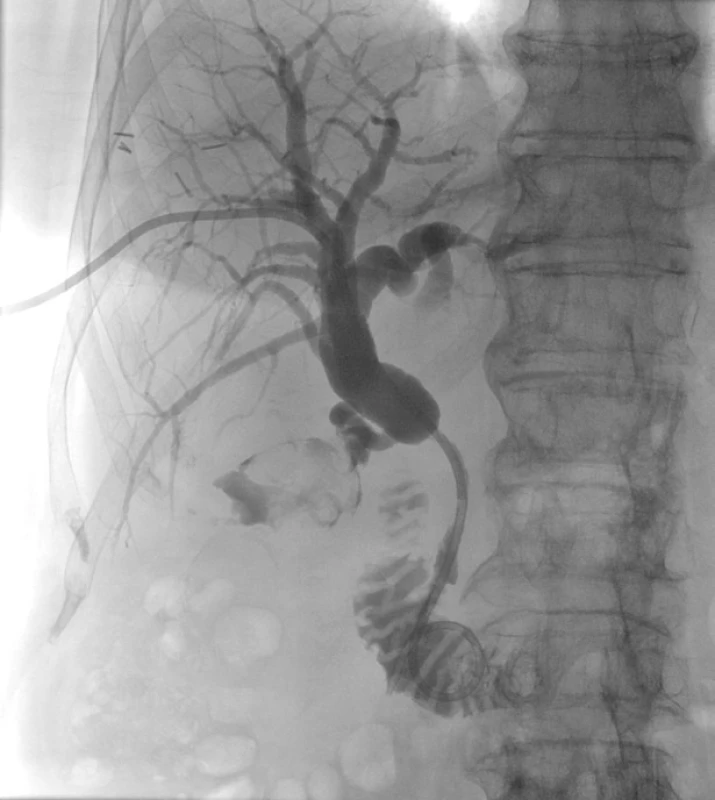
Přes pravý jaterní lalok je zaveden zevně-vnitřní drén do duodena, kde tvoří pigtail. Patrná je dilatace intrahepatálních žlučových cest a ductus hepaticus. Ductus choledochus je stenotizován nádorem hlavy pankreatu. Obr. 7. Endobiliární biopsie. 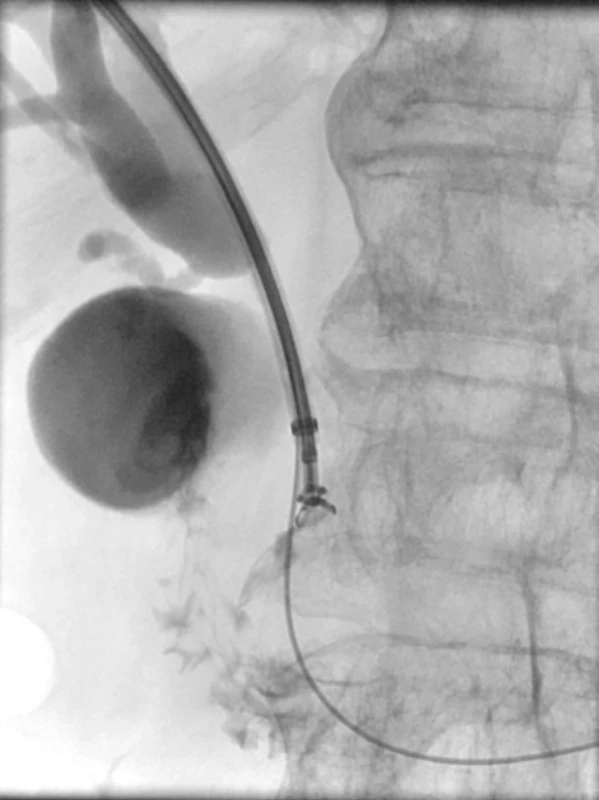
Perkutánně cestou PTD je 7 F kleštěmi proveden odběr vzorku pro histologické zpracování z místa stenózy žlučových cest. Na snímku jsou patrné dilatovaný ductus choledochus, ductus cysticus a naplněný žlučník. Další intervence u maligních stenóz žlučových cest
V případech, kdy chirurgické řešení nepřichází v úvahu, je cílem našich postupů zbavit pacienta drénů a nahradit je vnitřní drenáží pomocí kovových stentů (21). Stent zavedeme do žlučových cest cestou, kterou má pacient zavedený zevně-vnitřní drén; při standardní analgosedaci není výkon bolestivý. Kovový stent má mřížkové uspořádání a je zaveden v délce přesahující rozsah zúžení žlučových cest. Šíře stentu při zavedení nepřesahuje 4 mm. Po uvolnění se stent samovolně roztahuje až na šířku 10 mm, čímž je vytvořen dostatečné volný odtok žluče do duodena.
Obr. 8. Stent v ductus hepatocholedochus 3 dny po implantaci 
Po zavedení stentu je ve žlučových cestách ponechána velmi tenká, tzv. zajišťovací cévka. Slouží jako zabezpečení žlučových cest po zavedení stentu po dobu, než se stent plně rozvine. Pokud nejsou přítomné známky nefunkčnosti stentu (opětovné zvýšení hladiny obstrukčních jaterních enzymů a bilirubinu), doba ponechání zajišťovacích cévek nepřesahuje dva týdny. Kůže na povrchu se po zavedení drénu zcela zatáhne. Následně již není potřeba další péče o stent, nejsou nutné každodenní proplachy. Pacient nicméně musí podstupovat pravidelná ultrazvuková vyšetření jater a krevní odběry. Sledování je nutné dodržet i v případě, že klinický stav pacienta je dobrý.
Včasné odhalení problémů se zavedenou vnitřní drenáži může přispět k menší míře komplikací. Nejčastější komplikací je obturace stentu z důvodu hyperplazie sliznice nebo přerůstání nádorové tkáně, kterou lze řešit opětovným zavedením zevně-vnitřního drénu a případnou rekanalizací stentu. K obstrukci stentu dojde z důvodu progrese onemocnění dříve nebo později u všech pacientů, dle našich zkušeností průměrně za 10–12 měsíců. Délka přežití pacientů se zavedeným stentem je v našem souboru v průměru 14 měsíců od diagnózy cholangiocelulárního karcinomu, což je dramaticky více než u nemocných bez léčby.
Na rozdíl od endoskopických technik perkutánní cesta přináší široké spektrum možností, jejichž cílem je zpomalení růstu tumoru. Mezi nejdůležitější z paliativních technik patří brachyterapie před zavedením stentu (22). Výhodou vnitřního záření je maximalizace radiační dávky do oblasti tumoru, přičemž vzdálenější zdravé tkáně jsou radiace ušetřeny. Do zevně-vnitřního drénu zavedeme aplikátor. Pacient je odeslán na oddělení radiační onkologie, kde je do aplikátoru zaveden iridiový zářič, který tumor postihující žlučové cesty ozařuje ve stanoveném rozsahu. Radioterapeutický plán je stanoven radiačním onkologem, nejčastěji provádíme vnitřní záření tři po sobě následující dny. Vzhledem k tomu, že aplikátor radioterapie je umístěn ve vnitřní části drénů, může v průběhu období ozařování drén obtékat žlučí. Po ukončení brachyterapie jsou aplikátory ze žlučových cest vytaženy na oddělení radiační onkologie a pacient může pokračovat v běžné péči o drén. Cílem radioterapie není pouze usmrcení nádorových buněk, ale také prevence přerůstání sliznice u následně zavedeného metalického stentu.
Další z technik, kterou můžeme destruovat tumorózní tkáň, je endoluminální radiofrekvenční ablace (23). Princip je podobný výše popisované perkutánní radiofrekvenční ablaci. Možností je aplikovat RFA před zavedením stentu jako prevenci jeho obturace nebo použít endoluminální RFA ke zprůchodnění již obturovaného stentu přerůstající sliznicí nebo nádorovou tkání. Ablovaná tkáň se následně odloučí a odchází drénem do duodena. Tento proces můžeme urychlit čištěním endoluminálně zavedeným balónkem. Endoluminální RFA lze kombinovat s brachyterapií. Účinnost rekanalizace obturovaného stentu radiofrekvenční ablací se blíží 100 %, s výskytem komplikací do 2 % (21).
Kombinaci léčebných a paliativních perkutánních metod u nádorů postihujících žlučové cesty jsme schopni zásadně prodloužit přežití pacientů. Ve skupině pacientů s neoperabilním perihilovým cholangiokarcinomem tak medián přežití dosahuje až 14 měsíců.
ZÁVĚR
Radiologické intervence hrají v léčbě onkologických onemocnění jater nezastupitelnou roli. Standardem léčby hepatocelárního karcinomu je perkutánní ablace i chemoembolizace. U kolorektálního karcinomu jsme pomocí radiofrekvenční ablace schopni dlouhodobě kontrolovat nemoc i u neoperabilních pacientů. Komplexní terapií stenóz žlučových cest dokážeme zabránit velmi krátkému přežití pacientů. O využití a správné indikaci radiologických intervencí by měla rozhodovat multioborová onkologická indikační komise, jejíž nedílnou součásti by měl být intervenční radiolog. Výhodou těchto metod je nízká invazivita ve srovnání s chirurgickými výkony a možnost kombinace s další onkologickou léčbou. Některé z radiologických intervenčních metod mají kurativní potenciál, všechny však prodlužují přežití nebo alespoň zvyšují kvalitu života onkologicky nemocných.
Seznam zkratek
CT výpočetní tomografie
DEB drug eluting beads
EKG elektrokardiografie
ERCP endoskopická retrográdní cholangiopankreatikografie
FLR functional liver remnant
HCC hepatocelulární karcinom
INR international normalized ratio
i. v. intravenózní
MR magnetická rezonance
MWA mikrovlnná ablace
PTD perkutánní transhepatální drenáž
PVA polyvinylalkohol
RFA radiofrekvenční ablace
TACE transarteriální chemoembolizace
Adresa pro korespondenci:
MUDr. Tomáš Andrašina, Ph.D.
MUDr. Tomáš Rohan
Klinika radiologie a nukleární medicíny LF MU a FN Brno
Jihlavská 20, 625 00 Brno
Tel.: 532 233 007
Zdroje
1. Li Y, Jia Y, Li S et al. Transarterial chemoembolization of giant liver haemangioma: a multi-center study with 836 cases. Cell Biochem Biophys 2015; 73(2): 469–472.
2. Shafi B. Percutaneous radiofrequency ablation of liver tumors: background, indications, contraindications. Medscape, 2017 Nov 7. Dostupné na: https://emedicine.medscape.com/article/1390475
3. Ryan MJ. Ablation techniques for primary and metastatic liver tumors. World J Hepatol 2016; 8(3): 191.
4. Tanis E, Nordlinger B, Mauer M et al. Local recurrence rates after radiofrequency ablation or resection of colorectal liver metastases. Analysis of the European Organisation for Research and Treatment of Cancer #40004 and #40983. Eur J Cancer 2014; 50(5): 912–919.
5. Wang X, Sofocleous CT, Erinjeri JP et al. Margin size is an independent predictor of local tumor progression after ablation of colon cancer liver metastases. Cardiovasc Intervent Radiol 2013; 36(1): 166–175.
6. Ruers T, Van Coevorden F, Punt CJA et al. Local treatment of unresectable colorectal liver metastases: results of a randomized phase II trial. J Natl Cancer Inst 2017 Mar 17; 109(9), doi: 10.1093/jnci/djx015.
7. Vandenbroucke F, de Mey J. Absolute and relative contraindications of radiofrequency ablation of focal liver tumors. ECR 2009, poster C-552, doi: 10.1594/ecr2009/C-552. Dostupné na: https://posterng.netkey.at/esr/viewing/index.php?module=viewing_poster&task=&pi=40613
8. Venkatesan A, Gervais D, Mueller P. Percutaneous radiofrequency thermal ablation of primary and metastatic hepatic tumors: current concepts and review of the literature. Semin Interv Radiol 2006; 23(1): 73–84.
9. Dodd GD, Soulen MC, Kane RA et al. Minimally invasive treatment of malignant hepatic tumors: at the threshold of a major breakthrough. Radiogr Rev Publ Radiol Soc N Am Inc 2000; 20(1): 9–27.
10. Correa-Gallego C, Fong Y, Gonen M et al. A retrospective comparison of microwave ablation vs. radiofrequency ablation for colorectal cancer hepatic metastases. Ann Surg Oncol 2014; 21(13): 4278–4283.
11. Yang Y, Wang C, Lu Y et al. Outcomes of ultrasound-guided percutaneous argon-helium cryoablation of hepatocellular carcinoma. J Hepatobiliary Pancreat Sci 2012; 19(6): 674–684.
12. European Society for Medical Oncology. Hepatocellular Carcinoma: ESMO-ESDO Clinical Practice Guidelines. Dostupné z: www.esmo.org/Guidelines/Gastrointestinal-Cancers/Hepatocellular-Carcinoma
13. Livraghi T, Meloni F, Stasi MD et al. Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis: is resection still the treatment of choice? Hepatology 2008; 47(1): 82–89.
14. Song JE, Kim DY. Conventional vs drug-eluting beads transarterial chemoembolization for hepatocellular carcinoma. World J Hepatol 2017; 9(18): 808.
15. Galle PR, Forner A, Llovet JM et al. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2018; 69(1): 182–236.
16. Lencioni R, Llovet JM, Han G et al. Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC: the SPACE trial. J Hepatol 2016; 64(5): 1090–1098.
17. Loffroy R, Favelier S, Chevallier O et al. Preoperative portal vein embolization in liver cancer: indications, techniques and outcomes. Quant Imaging Med Surg 2015; 5(5): 730–739.
18. van Lienden KP, van den Esschert JW, de Graaf W et al. Portal vein embolization before liver resection: a systematic review. Cardiovasc Intervent Radiol 2013; 36(1): 25–34.
19. Boulay BR, Birg A. Malignant biliary obstruction: from palliation to treatment. World J Gastrointest Oncol 2016; 8(6): 498.
20. Park JG, Jung GS, Yun JH et al. Percutaneous transluminal forceps biopsy in patients suspected of having malignant biliary obstruction: factors influencing the outcomes of 271 patients. Eur Radiol 2017; 27(10): 4291–4297.
21. Yarmohammadi H, Covey AM. Percutaneous biliary interventions and complications in malignant bile duct obstruction. Chin Clin Oncol 2016; 5(5): 68.
22. Biagioli M, Wen BC, Patton B et al. Cholangiocarcinoma: the impact of endobiliary high-dose-rate (HDR) brachytherapy dose response on survival. Brachytherapy 2006; 5(2): 91.
23. Mizandari M, Kumar J, Pai M et al. Interventional radiofrequency ablation: a promising therapeutic modality in the management of malignant biliary and pancreatic duct obstruction. J Cancer 2018; 9(4): 629–637.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Zobrazovací metody 21. století
- Hybridní zobrazení PET/MR u karcinomu prostaty
- Ultrazvukové vyšetření s kontrastní látkou
- CT angiografie koronárních tepen – současné možnosti a budoucí perspektivy v diagnostice ischemické choroby srdeční
- Klinická kardiologie
- Endovaskulární rekanalizace a zrychlení diagnostiky vede ke zlepšení výsledků léčby ischemických cévních mozkových příhod
- Terapie nádorů postihujících játra metodami intervenční radiologie
- Vertebroplastika a epiduroskopie očima intervenčního radiologa
- Importovaná kožná parazitóza
- Standardizovaný pacient a sestavování kurikula – inspirace z konference AMEE 2017
- ISBER 2017 – mezinárodní konference o biobankách
- Biobanky – diskuse o terminologii
-
Slavnostní řeč profesora Pavla Pafka při převzetí Ceny J. E. Purkyně
(20. června 2018, zámek Libochovice) - Vzpomínka na prof. Vladimíra Pacovského
- 75 let prof. MUDr. Jana Kvasničky, DrSc.
- Zemřel prof. MUDr. Václav Zamrazil, DrSc.
- Zemřel prof. MUDr. Jaroslav Rybka, DrSc.
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hybridní zobrazení PET/MR u karcinomu prostaty
- CT angiografie koronárních tepen – současné možnosti a budoucí perspektivy v diagnostice ischemické choroby srdeční
- Ultrazvukové vyšetření s kontrastní látkou
- Terapie nádorů postihujících játra metodami intervenční radiologie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



