-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRealimentační syndrom
Refeeding syndrome
Despite being known more than 60 years, refeeding syndrome (RS) still bears many uncertainties. For example, its definition is not clear and definite, and the attitude to it varies from the complete neglect to over-prevention.
The term "refeeding syndrome" refers to electrolyte and metabolic changes occurring in malnourished patients after the readministration of nutrition. These changes concern especially to phosphates and ions. Potassium, magnesium, naturism and fluids balance are involved. The changes lead to cell energetic metabolism and electric potential disturbances, with related clinical symptoms.
Fully developed refeeding syndrome is quite rare; nevertheless it can be fatal for the patient. However, even its development can lead to many complications increasing the patient's morbidity and the length of stay in the hospital. Yet the refeeding syndrome is more or less predictable and if kept in mind also preventable.
The aim of this article is to get the reader to know more about this metabolic phenomenon and possible attitudes towards it.Keywords:
malnutrition, realimentation, hypophosphataemia, refeeding syndrome
Autoři: MUDr. Stanislav Ševela; MUDr. Ph.D. František Novák; prof. MUDr. DrSc. Antonín Kazda; MUDr. Ph.D. Helena Brodská
Působiště autorů: IV. interní klinika 1. LF UK a VFN v Praze 1; Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze 2
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 88-94
Kategorie: Přehledové články
Souhrn
Realimentační syndrom (RS, v anglické literatuře refeeding syndrome), ač v odborných kruzích známý již více než 60 let, je stále obklopen řadou nejasností – není například jednotná a ustálená jeho definice, stejně tak jeho diagnostika v klinické praxi kolísá od naprostého opomíjení až po prevenci jeho rozvoje do takové míry, že může být i zbytečně omezována realimentace pacienta.
Jako realimentační syndrom označujeme soubor klinických příznaků metabolických a elektrolytových změn, které se projevují u pacientů ve stavu podvýživy z nedostatku živin po znovuobnovení či významném zvýšení jejich příjmu. Tyto změny se týkají zejména iontů fosfátových, dále pak kalia, magnézia a natria, s nímž je také spojena změna vodního hospodářství. Nezvládnutý proces realimentace může vést k poruchám energetického metabolismu, elektrického potenciálu buněk, s příslušnými klinickými projevy.
Plně rozvinutý realimentační syndrom bývá naštěstí poměrně vzácný, nicméně může být pro pacienta fatální. Častěji se však vyskytují komplikace realimentace, které zvyšují pacientovu morbiditu a prodlužují hospitalizaci. Přitom jde o jevy snadno ovlivnitelné, a tak znalost a respektování jejich rizika může významně přispět ke zlepšení stavu pacienta. Problematikou se zabývala i řada odborných společností, jež vydaly svá doporučení.
Cílem tohoto přehledového článku je seznámit čtenáře nejen s aktuálními poznatky o podstatě, riziku a přístupu k realimentačnímu syndromu, ale také nastínit možný přínos a využití procesu realimentace v klinické praxi.Klíčová slova:
malnutrice, realimentace, hypofosfatemie, realimentační syndromÚvod
První popisy realimentačního syndromu se objevují v době po druhé světové válce, a to u dlouhodobě hladovějících a podvyživených vězňů, kteří vykazovali kardiální a neurologické poruchy poté, co začali dostávat výživu. Nejprve byly tyto problémy připisovány zejména dysfunkci gastrointestinálního traktu, nicméně bližší zkoumání přineslo poznatky týkající se zásadního vlivu iontových dysbalancí (1). Později byl tento syndrom ověřen i v případech hladovkových protestů, u jedinců s mentální anorexií nebo chronických alkoholiků. Další pozornosti se tomuto fenoménu dostalo v období 70. a 80. let 20. století, kdy se objevoval jako jedna z komplikací v té době stále více rozvíjející se parenterální výživy (2, 3).
Definovat realimentační syndrom je poměrně obtížné, resp. jeho definice stále není ujednocena, což mimo jiné komplikuje i jeho sledování a větší studie. Jeho principem, tedy i základem definice, jsou těžké elektrolytové změny a přesuny tekutin spojené s metabolickými abnormalitami u podvyživených pacientů, u nichž je znovu obnoven nebo významně posílen přísun živin, bez ohledu na to, zda se tak děje formou perorální, enterální, nebo parenterální. Definice jsou nicméně nepřesné, resp. není shoda na konkrétních kritériích nebo určení prahových hodnot dotčených elektrolytů. K tomu přistupují i velmi variabilní klinické projevy (1, 4, 5).
jejich poklesu. Lze pozorovat i další elektrolytové dysbalance, zejména pak hypokalemii, hypomagnezemii, poruchy sodíkové a vodní rovnováhy, komplexní změny v metabolismu základních živin: glukózy, tuků a proteinů. U mnoha pacientů lze prokázat i deficity vitaminů, z nichž klíčový se zdá být vitamin B1 – thiamin. Z klinických projevů jsou v popředí zejména poruchy kardiální, neuromuskulární a respirační (6).
Incidence tohoto syndromu není vzhledem k jeho chybějící jednotné definici také přesně známa. Například výskyt hypofosfatemie je dle studií v USA udáván v závislosti na její definici kolem 0,2−3,1 % v rámci obecné populace pacientů. Výrazně vyšší se udává v selektovaných skupinách, například 14−37 % u pacientů geriatrických, 25 % u onkologicky nemocných, a dokonce 44 % u pacientů na pooperačním intenzivním lůžku. Je také známo, že subnormální hodnoty fosfátu jsou spojeny s horšími klinickými výsledky (2, 4).
Incidence malnutrice v nemocnici, která je jedním z hlavních rizikových faktorů vzniku RS, činí podle jedné britské studie 1−15 % u obecné populace pacientů přijatých k hospitalizaci a až 35−65 % u dlouhodobě hospitalizovaných (7).
Tab. 1. Klinické projevy (podle 3, 12) 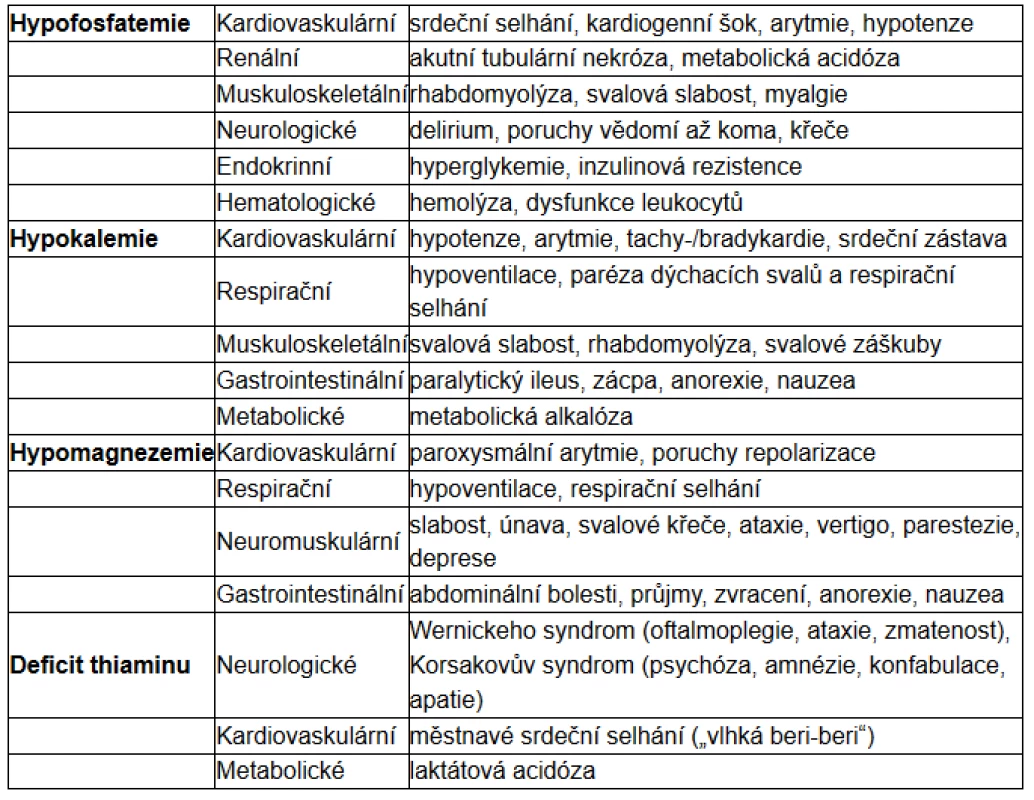
Patofyziologie
Procesy, které vedou k realimentačnímu syndromu, jakož i syndrom samotný nejlépe pochopíme, podíváme-li se blíže na metabolismus živin a klíčových iontů při hladovění a sytosti.
Primárním zdrojem energie je pro většinu buněk glukóza. Přijatá potravou se ukládá ve formě glykogenu, další přebytečný energetický příjem je poté uložen do tukových rezerv.
Při krátkodobém hladovění je, zejména vlivem hormonu glukagonu, glykogen štěpen za zisku glukózy. Při vyčerpání zásob glykogenu, k němuž dochází obvykle do 24−48 hodin, je glukóza získávána procesem glukoneogeneze, který jako své zdroje využívá aminokyselin (převážně ze svalů) a mastných kyselin (z tukové tkáně). Iniciální fáze prostého hladovění je tedy spojena se zvýšenou degradací proteinů, zvláště svalového původu.
Pakliže hladovění pokračuje, hlavním energetickým zdrojem se stávají mastné kyseliny a jejich štěpné produkty ketolátky, a to i pro orgány, které jinak primárně využívají glukózu, jako je například mozek. Některé buňky, kupříkladu erytrocyty, však potřebují glukózu i nadále. Snižuje se také bazální metabolismus o 20−25 %. Tímto nastavením organismus snižuje potřebu glukózy a šetří proteiny. Vše popsané platí pro tzv. hladovění prosté, které se vyznačuje nepřítomností významnější zánětlivé reakce v těle (8).
Souběžně s metabolickými změnami a ztrátami tělesné hmoty klesá i množství intracelulárních minerálů a vitaminů. Při dlouhodobém hladovění jsou úbytkem funkční tkáně postiženy rovněž vitálně důležité orgány jako srdce, kdy úbytek myokardu má i své klinické dopady při realimentaci (9).
Kontrolní mechanismy a redistribuce iontů mezi kompartmenty zůstávají obvykle dobře zachovány i při malnutrici, proto jsou sérové koncentrace iontů zpravidla v mezích normy. Nelze z nich tedy vyvozovat míru případného deficitu. I přes těžkou podvýživu také u prostého hladovění nemusí být nutně snížena hladina albuminu.
Situace je složitější při stresovém hladovění, které je mimo jiné charakterizováno vystupňovaným katabolismem proteinů, a dále při užívání některých léků, případně při onemocnění orgánů podílejících se na metabolismu dotčených iontů. Příkladem mohou být hypokalemie a hypomagnezemie při užívání diuretik či laxancií, při chronických průjmech u malabsorpčních onemocnění, případně naopak hyperkalemie při renálním selhání a podobně. Obecně lze také říci, že pokračující stresové nastavení metabolismu je překážkou realimentace.
Při obnovení energetického příjmu − realimentaci − pak mimo jiné dojde k nárůstu glykemie, která stimuluje sekreci inzulinu, a naopak klesá sekrece glukagonu. Tento zásadní hormonální zvrat vede ke stimulaci anabolických procesů a zvýšení metabolického obratu. Přitom stoupá potřeba intracelulárních iontů, zejména fosfátů a magnézia, podobně jako vitaminů coby enzymových kofaktorů. Inzulin dále stimuluje vstup glukózy s kaliem do buněk. Dochází k manifestaci celotělového deficitu těchto iontů, rychlým poklesům jejich koncentrací v séru, a tím i příslušným klinickým projevům.
Patofyziologie změn hladin jednotlivých iontů
Fosfáty jsou hlavním intracelulárním aniontem, který tvoří složku buněčných membrán a je zásadní pro mnoho buněčných procesů. Aktivují enzymy a posly signálních drah, ukládají energii ve formě ATP. Ovlivňují také afinitu hemoglobinu ke kyslíku, čímž mají vliv na dodávku kyslíku tkáním. Fosfáty jsou integrální součástí nukleových kyselin a podílejí se na acidobazické rovnováze jako pufr. Fosforylace glukózy je také prvním krokem samotné glykolýzy i syntézy glykogenu.
V krvi se nachází ve formě fosfátového aniontu volného a vázaného na proteiny. Normální koncentrace v séru dospělých je kolem 1 mmol/l (0,75−1,5 mmol/l). U člověka je asi 85 % fosfátu vázáno v kostech, zbytek je distribuován ve tkáních. Krev a extracelulární tekutina představují pool asi 15 mmol (465 mg) anorganického fosfátu, který tvoří rovnováhu mezi absorbovaným fosfátem z potravy, z/do kostí, do buněk a vylučovaným ledvinami (10).
Celotělová deplece fosfátu a s ní i pokles hladiny v séru se projeví při realimentaci, kdy se zejména vlivem anabolického působení inzulinu zvýší potřeba fosfátu v buňkách. Zvýší se tedy jeho absorpce buňkami a koncentrace v séru rychle klesá, dříve než je ho organismus schopen uvolnit z kostní tkáně. Symptomatické mohou být již rychlé poklesy k hodnotám < 0,35 mmol/l. Závažné projevy lze očekávat při hodnotách < 0,15 mmol/l. Vývoj hypofosfatemie bývá považován za hlavní ukazatel samotného RS. Můžeme předpokládat, že do jisté míry odráží intracelulární potřebu fosfátu s následnou poruchou energetického a signálního metabolismu buněk (11, 12).
Objevují se symptomy, které s hypofosfatemií souvisí, jako malátnost, parestezie, porucha svalové koordinace až paralýza, svalová slabost. Nebezpečné je především riziko hyperkapnického ventilačního selhávání v důsledku slabosti dýchacího svalstva. Dále se může rozvinout srdeční selhání a často bývá přítomná encefalopatie, která se projevuje zmateností až progredující poruchou vědomí do úrovně kómatu.
V erytrocytech je fosfát mimo jiné součástí 2,3-bisfosfoglycerátu (2,3-DPG), jehož snížená koncentrace zvyšuje afinitu hemoglobinu k O2, čímž přispívá ke tkáňové hypoxii. Kromě toho při poruše energetického metabolismu erytrocytů může docházet k hemolýze. Poruchou signálních drah leukocytů při depleci fosfátů je narušena jejich funkce (13).
Hypofosfatemie se samozřejmě nemusí vyskytovat jen při RS, mohou se na ní dále podílet léky jako inzulin, adrenalin, dopamin, salbutamol, xanthinové deriváty, erytropoetin či stimulační faktory granulocytů. Depleci fosfátů ještě může kromě proteinkalorické malnutrice zhoršovat i hypovitaminóza D (4).
Draslík je hlavním intracelulárním kationtem, v buňkách je udržován činností Na+/K+-ATPázy (sodíkové pumpy), která tak zásadně přispívá k vytvoření elektrického potenciálu na buněčné membráně. Tímto draselný kationt ovlivňuje neuromuskulární dráždivost (13).
Podobně jako u fosfátu i celotělové zásoby draslíku klesají při dlouhodobém hladovění. Rovněž při stresových stavech, které vedou k hyperkortikalismu/hyperaldosteronismu, dochází ke zvýšeným ztrátám draslíku v moči. Přesto jeho sérová hladina může být udržena také v relativně normálních mezích, při renálním selháním dokonce i zvýšena. Navíc je při hodnocení kalemie třeba vzít do úvahy též aktuální hodnoty acidobazické rovnováhy (každý pokles sérového pH o 0,1 zvýší kalemii přibližně o 0,6 mmol/l a naopak).
Celotělový nedostatek draslíku se projeví při přechodu do anabolického stavu jako důsledek zvýšeného vstupu do buněk, podmíněného inzulinem. Důsledkem klesající kalemie může být i život ohrožující porucha srdečního rytmu. Mezi další projevy hypokalemie patří svalová slabost, v extrémních případech až rhabdomyolýza. Může se vyvinout rovněž paralytický ileus nebo respirační selhání (13).
Hypokalemie je zřejmě nejčastější elektrolytovou dysbalancí, její příčinou jsou vedle realimentace častěji zvýšené ztráty draslíku například stolicí při průjmech nebo ledvinami vlivem diuretik.
Magnézium je dalším důležitým, převážně intracelulárním iontem, který působí jako kofaktor v mnoha enzymových systémech, včetně metabolismu sacharidů, oxidativní fosforylace a tvorby ATP. Hořčík je zásadní pro strukturální integritu nukleových kyselin a ribosomů, ovlivňuje také membránový potenciál buněk. Jeho deficit může vést k arytmiím nebo neuromuskulárním komplikacím, zejména v kombinaci s deficitem kalia.
Nízká hladina magnézia má navíc vliv i na samotnou kalemii zvýšením ztrát kalia v distálním tubulu ledvin. Hypomagnezemie tedy může být příčinou nekorigovatelné hypokalemie, jež se upraví až po substituci magnézia, ale také hypokalcemie, neboť má vliv na vylučování parathormonu (13, 14).
Kromě deplece iontů jsou významné i deficity vitaminů, zvláště thiaminu, který je důležitým kofaktorem klíčových enzymů syntézy ATP a metabolismu cukrů, například komplexu pyruvátdehydrogenázy. Nedostatek thiaminu vede k akumulaci pyruvátu, jenž je dále metabolizován na laktát a hromadí se. V důsledku těžkého deficitu se tedy může vyvinout laktátová acidóza. Zásoby thiaminu mohou být vyčerpány už po 4 týdnech nízkého příjmu, u kriticky nemocných i rychleji (15). Jeho deficit vede v extrémních formách až k Wernickeově encefalopatii (eventuálně Korsakovově syndromu), srdečnímu selhání a již zmíněné laktátové acidóze. Jde o předvídatelnou a snadno odvratitelnou komplikaci realimentace (2, 11).
Na deficit thiaminu bychom měli pomýšlet zejména v rámci diferenciální diagnostiky nevysvětlitelného srdečního selhání, laktátové acidózy a neurologických poruch u pacientů s předchozí anamnézou alkoholismu nebo těžší malnutrice bez ohledu na příčinu. Může se také vyskytovat u pacientů na dlouhodobé parenterální výživě bez adekvátní substituce, u těhotných žen s dlouhodobou nevolností a zvracením, až charakteru hyperemesis gravidarum, nebo u pacientů po bariatrických operacích. Symptomy spojené s thiaminovým deficitem jsou velmi nespecifické, zejména u kriticky nemocných. To je příčinou jeho nerozpoznání s potenciálně závažnými důsledky. Z tohoto důvodu bychom měli u rizikových pacientů vitamin B1 suplementovat ještě před zahájením realimentace. Podle několika studií jsou zvláště kritické stavy spojeny s thiaminovou deplecí nejen absolutní, ale i relativní (2, 15).
Dalším přímým důsledkem realimentace se zvýšením hladin inzulinu je snížení vylučování natria v distálním segmentu nefronu. Tento jev doprovází z osmotických důvodů retence vody (16). Ta se může podílet na vzniku otoků nebo v kombinaci se sníženou funkční kardiální rezervou, která je často jen důsledkem malnutrice (9), i na oběhovém selhávání. K dalšímu zhoršení kardiální funkce může přispět již zmíněná tkáňová hypoxie při hypofosfatemii nebo deficitu thiaminu.
Jako další možný mechanismus poruchy orgánových funkcí byl diskutován vliv podané výživy, zejména tedy glukózy, na metabolismus, kdy inzulin supresí lipolýzy a glukoneogeneze vedl ke stavu hypoglykemie a hypotriglyceridemie bez adekvátní dodávky živin (17).
Ačkoli patofyziologie realimentace je již dobře popsána, okolnosti, za nichž se projeví realimentační syndrom, a důvody, proč mají někteří pacienti tendenci k výraznějším symptomům, nejsou ještě zcela vyjasněny. Klinický obraz RS je dosti variabilní, může se poměrně rychle měnit a rozvíjet. Příznaky se objevují obvykle během prvních 5 dnů po zahájení výživy u chronicky anebo těžce podvyživených (4). Jednotlivé symptomy souvisejí převážně se změnami iontové rovnováhy (viz výše a obr. 1).
Obr. 1. Klinický obraz realimentačního syndromu 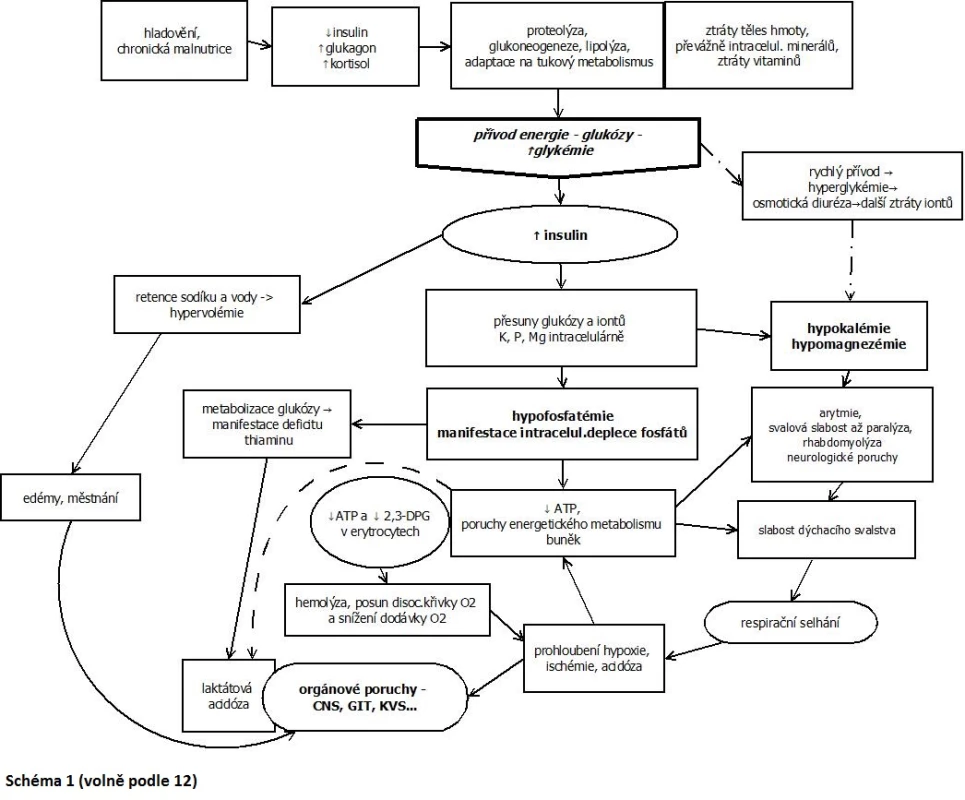
Rizikoví pacienti, markery, diagnostika
Základem prevence RS je vytipování rizikových pacientů na základě známých rizikových faktorů, především známek malnutrice a stavů, které k ní zpravidla vedou.
Rizikoví pacienti (5, 18):
- psychogenní poruchy příjmu potravy, mentální anorexie, bulimie
- onkologičtí pacienti
- chronický abúzus alkoholu
- pooperační stavy
- staří lidé, zejména žijící dlouhodobě v ústavech
- dlouhodobé hospitalizace
- chronická malnutrice – marasmus, dlouhodobé hladovění
- malabsorpční syndromy
- stresová malnutrice po odeznění inzultu
- chronické orgánové dysfunkce, těžší CHOPN, pokročilé srdeční selhání, jaterní cirhóza
- chroničtí uživatelé antacid (snížený příjem fosfátu vázáním solemi hořčíku)
- chroničtí uživatelé diuretik (vysoké dávky zejména furosemidu)
- těžká obezita s váhovým úbytkem, bariatrické výkony
- nekontrolovaný diabetes mellitus (deplece iontů)
V rozpoznání rizikového pacienta také mohou pomoci kritéria, která jsou doporučována britským National Institute for Health and Care Excellence (NICE) (19) (viz tab. 2).
Tab. 2. Rizikové faktory (dle NICE) 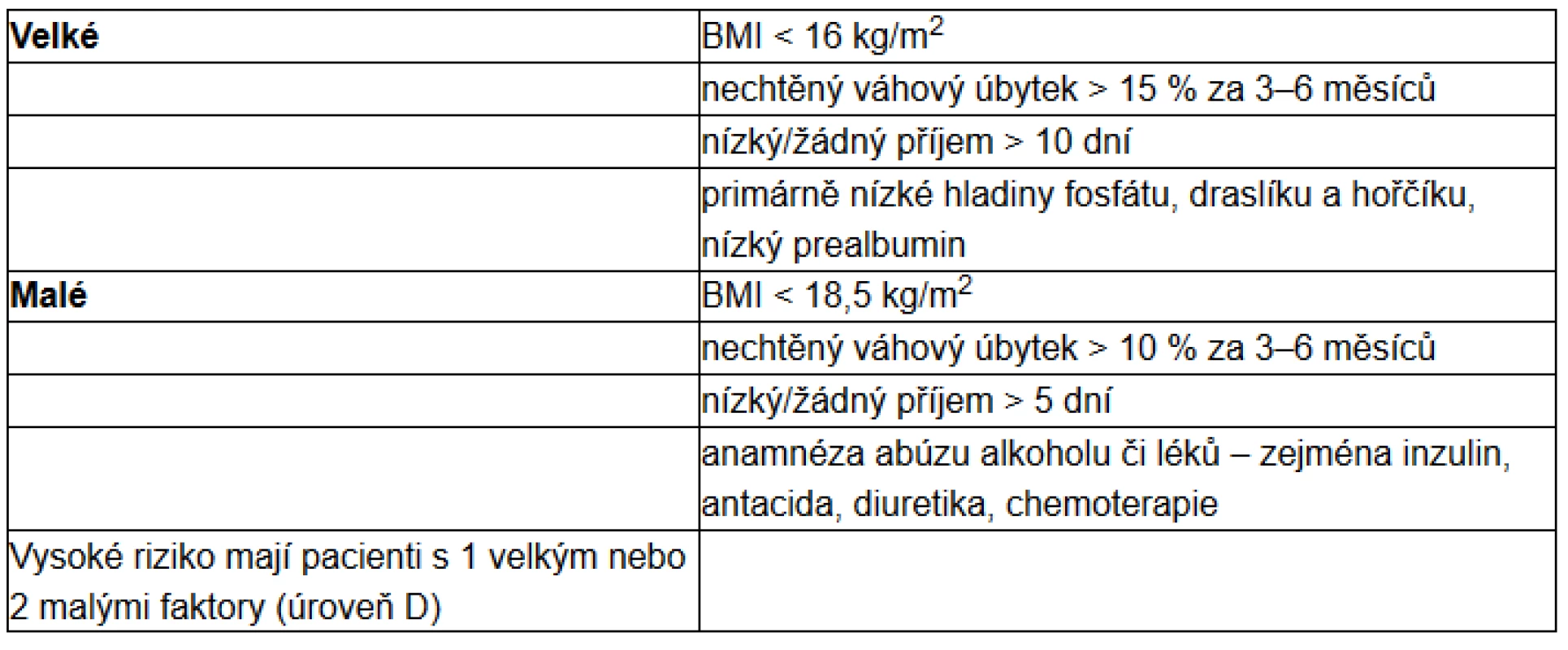
Speciální pozornost si zaslouží pacienti s dlouhodobým abúzem alkoholu. U alkoholiků je vysoký výskyt nejen iontových dysbalancí, malnutrice a hypovitaminóz, ale také hepatopatie a z ní vyplývajících metabolických poruch. Další významnou rizikovou skupinou jsou pacienti dlouhodobě nebo recentně opakovaně hospitalizovaní. Hlavními příčinami rizika u této skupiny jsou mimo jiné snížený příjem a imobilizace.
Relativně závažným problémem výše uvedených kritérií je závislost na podrobné anamnéze, která u akutně přijatých pacientů často není dostupná. Proto existuje snaha o nalezení objektivnějších kritérií, zejména laboratorních ukazatelů, jež by byly schopné predikovat riziko vývoje RS.
Za laboratorní marker samotného RS je obecně považována především hypofosfatemie (2, 6). Bohužel vstupní hodnoty sérového fosfátu stejně jako dalších iontů nejsou vhodné pro predikci rizika jeho vývoje. V případě jejich patologických hodnot je spíše než na riziko RS třeba pomýšlet na nějaké jiné komplikující onemocnění. Podobně je tomu i u rutinně vyšetřované sérové koncentrace albuminu, která nám snížením častěji ukazuje na stresový stav a stresové hladovění než na vlastní tíži malnutrice.
Prealbumin, běžně uznávaný ukazatel nutričního stavu, je mimo jiné dobrým prediktorem délky hospitalizace, mortality nebo předoperačního rizika. Vzestup prealbuminu je však spíše odrazem zotavování organismu po zánětlivém inzultu než zlepšeného stavu výživy. Nízká hladina prealbuminu s hodnotami < 0,20 g/l byla nezávislým prediktorem rozvoje hypofosfatemie a nízká hladina prealbuminu společně s velmi nízkou tělesnou hmotností také predikovala riziko vývoje hypoglykemie (20).
Dalšími možnými prediktory závažnosti rizika rozvoje RS, resp. rizika vzniku závažné hypofosfatemie, jsou hladina IGF-1 aleptinu. Tyto parametry korelují s mírou poklesu fosfátu, a tedy i s rizikem vývoje realimentačního syndromu (21). Bohužel stanovení těchto hormonů není běžně dostupné, a tak se nedá v praxi využít. Jinou možností je hodnocení nutričního stavu pomocí ultrazvukového vyšetření tělesného složení. Jedná se o měření svalové hmoty a tukové tkáně. Metody však bude nezbytné ještě standardizovat, nicméně některé studie v tomto směru se jeví jako slibné (22, 23).
Celkově jsou možnosti předpovídání rizika vzniku RS velmi omezené. Většina parametrů je podložena pouze observačními studiemi, popisy kazuistik a názory expertů (2, 21).
Prevence a léčba RS
Stále neexistuje všeobecná shoda v otázce léčby RS. Praxe a doporučení jsou často rozdílné. Většinou však převažuje konzervativní přístup, který můžeme pozorovat v doporučeních britské NICE: start low, go slow (19). V současné době však přibývá důkazů pro agresivnější postup při realimentaci za předpokladu, že důsledně monitorujeme klinický stav pacienta, jeho vnitřního prostředí a dostatečně a včas substituujeme příslušné ionty.
Tab. 3. Doporučení týkající se přístupu k pacientům v riziku 
Cílem nutriční podpory by mělo být především znovu obnovit funkční svalovou hmotu, imunitní funkce a současně předejít metabolickým komplikacím, které potenciálně vedou k vážným orgánovým selháním, zejména u těžce podvyživených pacientů v nejvyšším riziku. Tito pacienti při správném postupu nejlépe profitují z dostatečné výživy (24). Příliš konzervativní přístup u těchto nemocných vede ke zbytečnému prodlužování doby léčby a přináší vyšší riziko vzniku komplikací (25). Navíc se zdá, že vysoce rizikoví pacienti jsou stále ohroženi rozvojem realimentačního syndromu, bez ohledu na podanou dávku výživy.
Mnohem důležitější než výše energetického příjmu, resp. jeho restrikce, je monitorování změn iontů a jejich včasná korekce (26). Případné iontové dysbalance je vhodné upravit ještě před zahájením nutriční podpory výživy. Toto by však nemělo být důvodem pro zbytečný odklad adekvátní nutriční podpory. Doporučuje se před vlastním zahájením výživy podat thiamin v dávce 100−300 mg podle naléhavosti, nejlépe parenterálně (přípravek Vitamin-B1-Ratiopharm 50 mg/1 ml, celkem 2 ml/1 amp., intravenózně, v ČR je aktuálně dostupný pouze v rámci individuálního léčebného programu; alternativou je Thiamin, Léčiva, intramuskulárně/subkutánně).
V počátku realimentace je vhodný kontinuální přísun výživy. Důvodem je možná deplece zásob glykogenu a z ní plynoucí riziko rozvoje hypoglykemie při náhlém přerušení přívodu zejména glukózy. V případě možnosti monitorování pacienta a dostupnosti pravidelných laboratorních kontrol začínáme iniciální dávkou kolem 100−150 g glukózy/24 hodin, 1−1,2 g/kg/den aminokyselin a 20 g tuků (se zastoupením esenciálních mastných kyselin). Celkový energetický příjem by měl činit 20 kcal/kg/den, v případě vysoce rizikových i 15 kcal/kg/den; např. u 70 kg vážícího nemocného je to cca 1000 kcal/den.Tyto hodnoty jsou vyšší než značně konzervativní doporučení NICE. Existují však i práce prokazující bezpečnost podávání vyšších iniciálních dávek výživy (kolem 1550 kcal/den) ve vyvážené per os dietě a přídavcích (27) nebo 1500−1800 kcal enterálně se zastoupením relativně menšího množství sacharidů (26). V případě dobré tolerance a korekce vnitřního prostředí je možno dávku výživy navyšovat přibližně o 200 kcal/den tak, abychom cílových hodnot dosáhli nejpozději během jednoho týdne.
V průběhu prvních dnů realimentace pravidelně kontrolujeme sérové hladiny iontů, zvláště kalia, fosfátů a magnézia. Dále monitorujeme acidobazickou rovnováhu a laktatemii. V případě výrazných posunů i vícekrát denně až do stabilizace, dále stačí 1× denně. S výhodou stanovujeme také odpady minerálů v moči, což nám nepřímo ukazuje na míru deplece celkových zásob v organismu. Při podávání výživy a suplementaci iontů je nutné vzít do úvahy i přidružená onemocnění a jejich léčbu. Významné jsou často ztráty iontů průjmy, píštělemi, zvracením nebo při zavedené gastrické sondě, případně je důležitý vliv poruch renálních funkcí.
Nejvyšší riziko hypofosfatemie bývá v prvních 72 hodinách realimentace. Substituce by proto měla být zahájena již při sestupném trendu fosfatemie, ještě před vývojem výše popsaných klinických projevů. Hranicí pro substituci je hladina fostatemie < 0,6 mmol/l. Denní dávka fosfátů potřebná pro substituci se může zvláště v prvních dnech pohybovat okolo 0,3−0,6 mmol/kg, ale i více. Pozor však na potenciální komplikace příliš agresivního hrazení fosfátů, jako je zejména hypokalcemie nebo tvorba kalcifikací. Prokázána byla bezpečnost a efektivita podávání 50 mmol fosfátů během 24 hodin (12). Každopádně by rychlost podávání fosfátů neměla překročit 7,5 mmol/hod. U pacientů s renální nedostatečností obvykle dávku redukujeme na polovinu až třetinu (12, 28).
Z parenterálních přípravků používaných k substituci je pro častý souběh hypofosfatemie a hypokalemie při realimentaci velmi výhodný magistraliter připravovaný jednomolární roztok kalium dihydrogenfosfátu 13,6%. Pokud je riziko hyperkalemie, typicky při renálním selhání, máme k dispozici 8,6% roztok natrium hydrogenfosfátu, který v 1 ml obsahuje 0,3 mmol fosfátu, případně jednomolární roztok glukózo-1-fosfátu (Glucose-1-phosphat 1 molar, Fresenius, 1 amp./10 ml). Při intenzivní realimentaci na jednotkách intenzivní péče je výhodná možnost podávání koncentrovaných roztoků přímo do centrální žíly. Pokud jsme odkázáni jen na periferní přístup, ředíme maximálně 50 mmol fosfátu do 500 ml fyziologického roztoku. Z farmaceutického hlediska je ještě důležité, že se pro riziko vysrážení nesmějí míchat roztoky fosfátu s roztoky kalcia a magnézia.
Při hodnocení hypokalemie je nutné vzít do úvahy i aktuální hodnoty acidobazické rovnováhy (pokles sérového pH zvýší kalemii; acidóza nám tedy maskuje hypokalemii) (13). Množství roztoků draslíku potřebné k substituci vychází z úbytku celkových zásob kalia, které u zdravého člověka činí asi 35−45 mmol/kg. U těžké podvýživy může tento deficit dosáhnout až 10−15 mmol/kg. Při výpočtu suplementace vycházíme z bazální denní potřeby kalia, která u pacienta bez významných ztrát činí 0,5−1,2 mmol/kg. K tomu pak přičítáme potřebu k doplnění deficitu zásob. Velmi přibližně činí toto navýšení 40 mmol kalia na den při kalemii < 3,9 mmol/l, ale při hodnotách < 3,0 mmol/l to může být až 120 mmol kalia na den. Časté laboratorní kontroly kalemie jsou v těchto případech nutností. Průměrná potřeba substituce kalia u pacientů s intenzivní realimentací bývá kolem 3 mmol/kg/den. Korekce je také velmi závislá na funkci ledvin, upravujeme ji s ohledem na diurézu a odpady v moči. Při diuréze < 600−900 ml/den se doporučuje nepodávat více než 2/3 odhadovaného množství a při oligurii ještě méně (13).
Svízelnost korekce hypokalemie v praxi vyplývá i z bezpečnostních limitů pro podávání roztoků kalia, zejména na standardních odděleních. Do periferie podáváme koncentrace maximálně 40 mmol draslíku/litr krystaloidu, lépe pomocí infuzní pumpy. Tento postup snižuje i riziko rozvoje neinfekčního zánětu kanylované žíly. Pokud substituujeme draslík při rozvinuté hypokalemii, není vhodné používat pro ředění roztoky glukózy. Glukóza podporuje vstup kalia do buněk, a hladina draslíku tak může dále klesnout. Bezpečná rychlost podání kalia je do 20 mmol/hod v kontinuální infuzi, přičemž při rychlostech > 10 mmol/hod se doporučuje monitorovat EKG. Z bezpečnostního hlediska by však maximální denní dávka neměla, pokud to není zcela nezbytné, překročit 200 mmol kalia. Při oligurii < 300 ml/den by měla být podávaná maximální denní dávka třetinová (13).
Pro substituci máme k dispozici 7,45% roztok kalium chloridu, který je jednomolární, nebo již výše uvedený kalium dihydrogenfosfát. Tyto jsou v praxi obvykle dostačující. Pokud se potřebujeme vyhnout náloži chloridů či fosfátu, můžeme použít jednomolární roztok kalium malátu (Fresenius Kabi) s mírně alkalizujícím účinkem.
Při substituci magnézia vycházíme z faktu, že u podvyživených pacientů je deficit obvyklý. Navíc je nezbytné počítat s redistribucí magnézia ve tkáních, která trvá 36−48 hodin. Po tuto dobu nevadí, když jsou hladiny hořčíku v séru vyšší, protože při pokračujícím deficitu opět poklesnou. Navíc pokles magnezemie se objevuje spíše po několika dnech od zahájení realimentace, na rozdíl od rychleji klesajícího fosfátu (11). K parenterální substituci máme k dispozici magnézium sulfát 10% (0,42molární, 10ml ampule obsahuje 1 g magnézia) a 20% (0,84molární, 10ml ampule obsahuje 2 g). Podáváme naředěný ve 100−250 ml krystaloidu rychlostí maximálně 8 mmol za hodinu. Při vyšších rychlostech podávání je překročen renální práh vylučování a významná část takto podaného magnézia je bezprostředně vyloučena ledvinami. Obvyklá denní dávka by neměla překročit 8−10 g, zejména pokud pacient není monitorován. U nemocných s poškozením renálních funkcí opět redukujeme substituční dávky, optimálně na polovinu i více. Retenci natria a vody monitorujeme pomocí denního vážení za standardních podmínek. Bohužel ne všichni pacienti jsou schopni se vážit. Cílem je váhový přírůstek 1−1,5 kg/týden, rychlejší nebo vyšší značí zadržování tekutin.
Pokud je pacient klinicky stabilní a laboratorní parametry vnitřního prostředí jsou upraveny a rovněž stabilní, můžeme rychleji postupovat v navyšování dávky výživy až do cílových hodnot. Naopak u těžko korigovatelných, nebo dokonce symptomatických iontových dysbalancí je naprosto nezbytné podávání výživy alespoň zpomalit nebo přechodně zastavit. Zastavení realimentace nesmí být náhlé, protože hrozí hypoglykemie, jak již bylo zmíněno výše.
V rámci komplexního přístupu k pacientovi hraje zásadní roli kvalitní rehabilitace, a to nejen jako anabolický stimulus pro obnovu funkční svaloviny. S rizikem RS se lze setkat i v ambulantní péči, kde dodržování přísných kritérií NICE má své opodstatnění, neboť je omezena možnost pacienty sledovat. I v ambulantní péči je kromě vlastní nutriční podpory zásadní rovněž dostatečná substituce iontů, v těchto případech v perorální formě.
Pozitivní klinický význam projevů realimentace
RS je závažnou komplikací podávání výživy v průběhu realimentace. Proto jsou doporučení velmi konzervativní a směřují především k prevenci RS. Nicméně subklinické realimentační projevy jako hypofosfatemie a případné další iontové změny mohou sloužit i jako velmi pozitivní signál anabolismu a anabolického potenciálu organismu.
Známka anabolického potenciálu organismu je pak pro klinika významným vodítkem, zejména v případech, kdy váháme ohledně efektivity podávané nutriční podpory. Například u stavů těžké malnutrice pacientů s pokročilým onemocněním může být snížení vlastního příjmu potravy jen méně významnou částí problému vedoucího k malnutrici. Pokud organismus anabolický potenciál nemá, nutriční intervence sama velmi pravděpodobně nebude adekvátním řešením problému.
Dále detekce iontových změn náležejících k realimentaci mohou signalizovat pozitivní obrat ve stonání pacienta a přechod z katabolismu do fáze rekonvalescence s výrazně lepší tolerancí příjmu živin a s možností jejich navýšení.
Závěr
Realimentační syndrom ve své plně rozvinuté formě je komplikace potenciálně fatální, naštěstí však v této podobě vzácná. Je ovšem také komplikací, které lze při správném realimentačním postupu plně předcházet. Zejména u rizikových pacientů je třeba způsobem odpovídajícím intenzitě realimentace monitorovat sérové elektrolyty, zejména fosfáty, kalium a magnézium, s náležitou substitucí. Dynamika laboratorních změn a pečlivé sledování vývoje klinického stavu jsou dobrými vodítky. Navíc zachycení změn především v sérových koncentracích minerálů, které náležejí k projevům realimentace, jsou pro nás nespornou a veskrze pozitivní známkou nástupu anabolického stavu pacienta.
Práce byla podpořena projektem OPPK CZ.2.16/3.1.00/24012.
Seznam zkratek
RS realimentační syndrom
NICE National Institute for Health and Care Excellence
Adresa pro korespondenci
MUDr. Stanislav Ševela
IV. interní klinika 1. lékařské fakulty UK a Všeobecné fakultní nemocnice v Praze
U Nemocnice 2
128 08 Praha 2
Tel.: 224 962 506
Fax: 224 923 524
e-mail: stanislav.sevela@vfn.cz
Zdroje
1. Rio A, Whelan K, Goff L et al. Occurrence of refeeding syndrome in adults started on artificial nutrition support: prospective cohort study. BMJ Open 2013 Jan 11; 3(1); pii: e002173; doi: 10.1136/bmjopen-2012-002173.
2. Boateng AA, Sriram K, Mequid MM, Crook M. Refeeding syndrome: treatment considerations based on collective analysis of literature case reports. Nutrition 2010; 26(2): 156–167.
3. de Andrade Viana L, Burgos MG, de Andrade Silva R. Refeeding syndrome: clinical and nutritional relevance. Arq Bras Cir Dig 2012; 25(1): 56–59.
4. Skipper A. Refeeding syndrome or refeeding hypophosphatemia: a systematic review of cases. Nutr Clin Pract 2012; 27(1): 34–40.
5. Mehanna H, Nankivell PC, Moledina J, Travis J. Refeeding syndrome – awareness, prevention and management. Head Neck Oncol 2009 Jan 26; 1 : 4; doi: 10.1186/1758-3284-1-4.
6. Solomon SM, Kirby DF. The refeeding syndrome: a review. JPEN JParenter Enteral Nutr 1990; 14(1): 90–97.
7. Khan LU, Ahmed J, Khan S, Macfie J. Refeeding syndrome: a literature review. Gastroenterol Res Pract 2011;pii: 410971; doi: 10.1155/2011/410971.
8. Berg JM, Stryer L. Food intake and starvation induce metabolic changes. In: Biochemistry. W. H. Freeman, New York, 2002.
9. Alden SB et al. Left ventricular function in malnutrition. Am J Physiol 1987; 253(2 Pt 2): H380–H387.
10. Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Dietary reference intakes for calcium, phosphorus, magnesium, vitamin D, and fluoride. National Academies Press, Washington (DC), 1997.
11. Winston AS. The clinical biochemistry of anorexia nervosa. Ann Clin Biochem 2012; 49(Pt 2): 132–143.
12. Terlevich A, Hearing SD, Woltersdorf WW et al. Refeeding syndrome: effective and safe treatment with Phosphates Polyfusor. Aliment Pharmacol Ther 2003; 17(10): 1325–1329.
13. Jabor A. Vnitřní prostředí. Grada Publishing, Praha, 2008, s. 45–68.
14. Huang CL, Kuo E. Mechanism of hypokalemia in magnesium deficiency. J Am Soc Nephrol 2007; 18(10): 2649–2652.
15. Manzanares W, Hardy G. Thiamine supplementation in the critically ill. Curr Opin Clin Nutr Metab Care 2011; 14(6): 610–617.
16. DeFronzo RA, Cooke CR, Andres R et al. The effect of insulin on renal handling of sodium, potassium, calcium, and phosphate in man. J Clin Invest 1975; 55(4): 845–855.
17. Shimizu K, Ogura H, Wasa M et al. Refractory hypoglycemia and subsequent cardiogenic shock in starvation and refeeding: report of three cases. Nutrition 2014; 30(9): 1090–1092.
18. Walmsley RS. Refeeding syndrome: screening, incidence, and treatment during parenteral nutrition. J Gastroenterol Hepatol 2013; 28(Suppl 4): 113–117.
19. National Collaborating Centre for Acute Care (UK). What to give in hospital and the community. In: Nutrition Support for Adults: Oral Nutrition Support, Enteral Tube Feeding and Parenteral Nutrition. National Collaborating Centre for Acute Care, London, 2006.
20. Gaudiani JL, Sabel AL, Mehler SS. Low prealbumin is a significant predictor of medical complications in severe anorexia nervosa. Int J Eat Disord 2014; 47(2): 148–156.
21. Elnenaei MO, Alaghband-Zadeh J, Sherwood R et al. Leptin and insulin growth factor 1: diagnostic markers of the refeeding syndrome and mortality. Br J Nutr 2011; 106(6): 906–912.
22. Mourtzakis M, Wischmeyer S. Bedside ultrasound measurement of skeletal muscle. Curr Opin Clin Nutr Metab Care 2014; 17(5): 389–395.
23. Tillquist M, Kutsogiannis DJ, Wischmeyer PE et al. Bedside ultrasound is a practical and reliable measurement tool for assessing quadriceps muscle layer thickness. JPEN J Parenter Enteral Nutr 2014; 38(7): 886–890.
24. Gentile MG. Enteral nutrition for feeding severely underfed patients with anorexia nervosa. Nutrients 2012; 4(9): 1293–1303.
25. Garber AK, Mauldin K, Michihata N et al. Higher calorie diets increase rate of weight gain and shorten hospital stay in hospitalized adolescents with anorexia nervosa. J Adolesc Health 2013; 53(5): 579–584.
26. Agostino H, Erdstein J, Di Meglio G. Shifting paradigms: continuous nasogastric feeding with high caloric intakes in anorexia nervosa. J Adolesc Health 2013; 53(5): 590–594.
27. Golden NH, Keane-Miller C, Sainani KL, Kapphahn CJ. Higher caloric intake in hospitalized adolescents with anorexia nervosa is associated with reduced length of stay and no increased rate of refeeding syndrome. J Adolesc Health 2013; 53(5): 573–578.
28. Brown KA, Dickerson RN, Morgan LM et al. A new graduated dosing regimen for phosphorus replacement in patients receiving nutrition support. JPEN J Parenter Enteral Nutr 2006; 30(3): 209–214.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek EditorialČlánek Jubilanti − březen 2016
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Přerušovaný půst může mít významná zdravotní rizika
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Česká sekce International College of Surgeons a Jubilejní světový chirurgický kongres
- Prof. Gunn − remarkable 90th birthday jubilee
- 85th anniversary of professor Eugen Strouhal
- Zemřel profesor František Kölbel
- Odešel lékař, vědec a muzikant, profesor Jiří Tichý
- Jubilanti − březen 2016
- Kalendář odborných akcí – duben/květen 2016
- Přednáškové večery Spolku českých lékařů v Praze (duben − červen 2016)
- Editorial
- Připomenutí osobnosti profesora Bohumila Prusíka
- Úloha bilirubinu v prevenci kardiovaskulárních a nádorových onemocnění
- Desaturázy mastných kyselin: patofyziologie a klinický význam
- Hodnocení a léčba portální hypertenze
- Prevence kolorektálního karcinomu
- Vývoj znalostí o idiopatických střevních zánětech
- Realimentační syndrom
- History of the 4th Department of Internal Medicine of the First Faculty of Medicine at Charles University and the General University Hospital in Prague
- První elektronické volby v ČLS JEP
- Role mikroRNA u nádorů hlavy a krku se zaměřením na sinonazální karcinom
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení a léčba portální hypertenze
- Realimentační syndrom
- Desaturázy mastných kyselin: patofyziologie a klinický význam
- Česká sekce International College of Surgeons a Jubilejní světový chirurgický kongres
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




