-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Průběh těhotenství a porodu při vrozeném deficitu antitrombinu typu II
Pregnancy and Delivery in Type II Hereditary Antithrombin Deficient Patients
Antithrombin is a plasma protein that regulates haemostasis by inhibiting procoagulant serine proteases. Hereditary antithrombin deficiency is associated with an increased risk of venous thromboembolism. The risk of vessel occlusion escalates especially during the pregnancy due to hyperestrogen condition both in the maternal and in foetal circulation. Our case report describes a 24-years old gipsy-woman with severe congenital AT deficiency and recurrent foetal loss in her history. She informed us about her 4th pregnancy in the 12th gestation week therefore warfarin treatment and regular checking up INR was recommended. We didn’t have any information about the pregnancy course till the 41st gestation week. When the patient came to give birth, the entry INR value was 1.0. She has delivered a healthy male newborn by caesarean section. Two weeks after delivery when effective INR value due to peroral anticoagulant therapy was achieved, she was released from the hospital and since that we have not seen her.
Key words:
antithrombin, hereditary deficiency, pregnancy and delivery.
Autoři: Z. Hajšmanová
Působiště autorů: Hematologický úsek ÚKBH FN a LF UK, Plzeň
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 535-537
Kategorie: Kazuistika
Souhrn
Antitrombin je plazmatický protein, který reguluje hemostázu inhibicí prokoagulačních serinových proteáz. Vrozený nedostatek antitrombinu je spojen se zvýšeným rizikem žilního tromboembolismu. Riziko cévních okluzí se během těhotenství zvyšuje v důsledku hyperestrogenního stavu jak v cévním systému matky, tak i ve fetomaternální cirkulaci. Naše kazuistika popisuje případ 24leté ženy rómské národnosti s vrozeným těžkým deficitem antitrombinu a předchozími opakovanými ztrátami plodu. O svém 4. těhotenství nás informovala až po 12. gestačním týdnu, a proto jí bylo doporučeno užívat warfarin a pravidelně kontrolovat INR. Až do 41. týdne jsme neměli o průběhu těhotenství žádné informace. Při přijetí k porodu byla hodnota INR 1,0. Pacientka porodila sekcí zdravého syna. Za 2 týdny po porodu, jakmile bylo dosaženo perorální antikoagulační léčbou účinné hodnoty INR, byla propuštěna a od té doby jsme ji neviděli.
Klíčová slova:
antitrombin, vrozený deficit, těhotenství a porod.Těžký vrozený deficit antitrombinu (AT) je považován v souvislosti s graviditou za vysoce rizikovou trombofilní tendenci vyžadující účinnou antitrombotickou prevenci od okamžiku zjištění gravidity až do konce šestinedělí. Tato prevence sleduje jak zdárný vývoj plodu, tak i prevenci tromboembolických komplikací v žilním systému matky.
Antitrombin je glykoprotein s molekulovou hmotností 58 kDa regulující hemostázu inhibicí prokoagulačních serinových proteáz. Tento inhibiční účinek je fyziologicky usnadněn heparansulfátem přítomným na intaktním cévním endotelu nebo léčebně podaným heparinem. Vrozený nedostatek AT je autozomálně dominantní vrozená trombofilní dispozice, která se v populaci vyskytuje u 0,02 % osob a nese s sebou 25–50× vyšší riziko vzniku žilní trombózy a která má závažnější průběh zejména u žen v souvislosti s hyperestrogenním stavem navozeným těhotenstvím, hormonální antikoncepcí (HAK) nebo hormonální substituční léčbou (HRT).
Gen pro AT se nachází na dlouhém raménku chromozomu 1 v pozici 1q23–25 a má 7 exonů (1, 2, 3A, 3B, 4, 5, 6) a zaujímá 13,5 kb genomické DNA. 464 aminokyselinový polypeptidický řetězec je kódován 1392 bp mRNA a jeho konečná struktura je tvořena po několika posttranslačních modifikacích včetně štěpení signálního peptidu a N-glykosylaci 432 aminokyselinami (AMK), a řadí se tak do serpinové superrodiny s homologní strukturou, jakou má například alfa-1 antitrypsin. Serpiny jsou strukturálně charakterizované 3 listy β (A, B, C) a 9 spirálami α. Funkční domény antitrombinu tvoří smyčka (RCL – reactive central loop) kódovaná 6 exony a heparin vázající doména (HBS – heparin-binding site) kódovaná z velké většiny exonem 2. Serpiny neutralizují své cílové proteázy tvorbou stochiometrických stabilních komplexů tvořených serpinovou reaktivní centrální smyčkou (RCL – reactive central loop) obsahující dipeptid argininserin, který přímo reaguje s cílovým místem na aktivované proteáze. Aktivní místo AT, na které se váže heparin, tvoří několik pozitivně nabitých zbytků na spirále D.
Právě RCL oblast je pro inhibiční funkci AT stěžejní a právě tato oblast je místem různých variačních konformací umožňujících vytvářet různě stabilní formy AT. Při inhibiční reakci s proteázou je RCL oblast nativního inhibitoru rozštěpena a RCL oblast inzeruje do A listu β a reaguje s cílovou proteázou. Tato molekulární forma serpinu je pak stabilnější než molekula nativní (obr. 1A) (1–3). Za některých okolností může vést vtlačení jedné molekuly RCL do A listu β další molekuly nebo juxtapozice RCL jedné molekuly do C listu β další molekuly ke spontánní polymerizaci nativního serpinu v cirkulaci nositele, což bývá spojeno s klinickými obtížemi (např. u mutace Phe299Leu). Stejný princip se objevuje například u varianty Z alfa-1 antitrypsinu nesoucí nestabilizující substanci (Glu342Lys) v místě RCL. Mutace Z v homozygotním stavu indukuje polymerizaci a agregaci alfa-1 antitrypsinu v hepatocytech a manifestuje se cirhózou (obr. 1B) (2).
Obr. 1. 1A, B. Trojrozměrná struktura AT s klíčovými oblastmi, které ovlivňují funkci serpinu (dle 2) 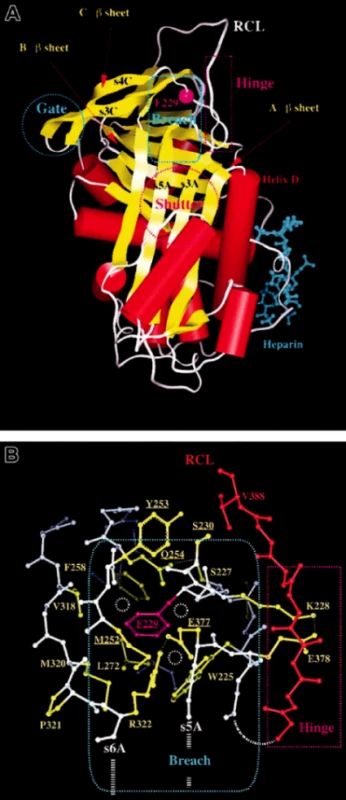
V závislosti na fenotypu, který je definován plazmatickou antigenní a funkční aktivitou, je deficit antitrombinu klasifikován do dvou typů a několika podtypů.
Deficit AT typu I je definován nízkou funkční i antigenní aktivitou (kolem 50 %), zatímco deficit typu II syntézou variantního proteinu s alterovanou funkcí. Podle toho, která část proteinu je postižena, se rozlišují 3 podtypy: reactive side defect (RS), heparin binding site defect (HBS) a pleiotropní defect způsobený mutacemi nakupenými v regionu 1C-s4B. Tato klasifikace je klinicky důležitá a každý typ mutace si nese jiné riziko tromboembolie (4, 5).
Mutace AT Leu99Phe je častá v jihovýchodní Evropě a je spojena s deficitem antitrombinu typu II. Klinicky manifestní projevy mají jedinci s homozygotní formou mutace, přestože i heterozygoti mají sníženou funkční aktivitu AT (6).
Funkční deficit je běžně diagnostikován koagulační metodou spektrofotometrickou s použitím chromogenního substrátu, kvantitativní deficit je prokazován metodou ELISA.
Účinná antitrombotická prevence teoreticky vyžaduje kromě podávání heparinu i substituci antitrombinu, poněvadž heparin jako nepřímý inhibitor trombinu potřebuje ke svému antikoagulačnímu účinku přítomnost antitrombinu. Po vazbě s heparinem se účinnost AT mnohonásobně zrychlí a inhibice serinových proteáz je díky kovalentní vazbě s antitrombinem účinná, zatímco při nedostatku AT je použití jak nefrakcionovaného heparinu (UFH), tak i nízkomolekulárního heparinu (LMWH) neúčinné. Obtížnost léčby cévních okluzí v těchto případech vyplývá i z faktu, že koncentrát AT vyrobený průmyslově z lidské poolované plazmy, který je na našem pracovišti při léčbě deficitů AT používán, má dávkovací interval 8–24 hodin a navíc se jedná o vysoce ekonomicky náročnou substituci (7).
V současné době nejsou v České republice k dispozici žádné přímé inhibitory trombinu, které ke svému antikoagulačnímu účinku antitrombin nepotřebují a které by bylo možno použít v graviditě.
Kazuistika
V kazuistice popisujeme spontánní vývoj 4. gravidity u 24leté ženy rómské národnosti, silné kuřačky, u níž byl těžký deficit antitrombinu koagulačně diagnostikován v jejích 18 letech a jejíž tři předchozí těhotenství skončila neúspěšně. Diagnostika funkčního deficitu byla provedena na našem pracovišti v roce 2000 metodou spektrofotometrickou při použití chromogenního substrátu, homozygotní forma mutace v genu pro AT produkující variantu Leu99Phe molekuly AT byla diagnostikována v roce 2004 v Ústavu hematologie a krevní transfuze Praha a stejný typ mutace byl nalezen i u bratra.
První těhotenství v roce 2003, které nebylo zajištěno preventivní antikoagulační léčbou, skončilo sekcí v 29. týdnu gestace pro abrupci placenty a sonograficky byl diagnostikován mrtvý plod.
V dubnu 2004 pacientka oznámila 8. týden 2. gravidity a stále kouřila 15 cigaret denně. Přes zajištění antitrombotickou léčbou nízkomolekulárním heparinem (LMWH), ale bez paralelní substituce antitrombinem skončila gravidita v 27. týdnu abrupcí placenty a odúmrtím plodu.
V lednu 2006 byla pacientka v 10. týdnu třetího těhotenství, které pro chybění plodového vejce skončilo spontánním abortem.
V červenci 2007 pacientka sdělila, že je ve 12. týdnu 4. gravidity a kouření pravděpodobně neomezí. Vzhledem ke skončené embryogenezi jsme jako možnou účinnou prevenci tromboembolických komplikací zvolili s ohledem na ukončený I. trimestr kumarinové antikoagulans warfarin. Pacientka byla důkladně poučena o nutnosti pravidelných kontrol INR, o režimových opatřeních včetně interference warfarinu s potravinami obsahujícími vitamin K. Pacientka i přes opakovaná upozornění na rizika léčby přestala docházet na pravidelné kontroly INR a dostavila se na gynekologicko-porodnickou kliniku až v 41. týdnu k porodu. Warfarin dle anamnestické výpovědi užívala, byl předepisován v místě bydliště, avšak v den přijetí i přes údajné užívání warfarinu byla hodnota INR = 1,0 (účinné rozmezí 2,0–3,0) a hladina antitrombinu byla 29 % (normální rozmezí je 80–120%), hladina fibrinogenu 4,15 g/l, hodnota D-dimerů nad 5 mg/l FEU. Pacientka byla po celou dobu těhotenství bez obtíží, kouřila až do porodu, přibrala 14 kg, BMI před porodem 29,0. Dopplerometrické vyšetření umbilikální arterie před porodem s charakteristikami Pl 0,64, S/D 1,93 dokumentují normální hodnotu a charakter křivky. Ultrazvukové vyšetření plodu prokazuje PPH, postavení pravé, AS pravidelná, sonoanatomie špatně přehledná, ale suspektně bez patologického nálezu. Placenta II–III st. deg., dorzálně nedosahuje, výrazné oligohydramnion AFI 4, BPD 88 AC315 FL71 odpovídá graviditě 35 + 6, dle PM 40 + 2, EFW 2700 + 200 g. Sonografický závěr svědčí pro IUGR a hmotnost plodu pod 5. percentil pro obě pohlaví.
Porod sekcí byl z hlediska prevence TEN zajištěn substitucí antitrombinu v dávce 1500 j. i.v. a aktivitou 117 % a dále v osmihodinových intervalech a aplikací nadroparinu v dávce adjustované na hmotnost pacientky ve 12hodinových intervalech. Operační porod sekcí podle Gepperta proběhl bez komplikací, plodová voda byla čirá a lůžko hodnoceno jako hrubě zbrázdělé s ojedinělými infarkty.
Novorozenec mužského pohlaví vážil 2800 g, měřil 49 cm, Apgar skóre fyziologické (10 - 10-10 bodů).
Ve 2. týdnu po porodu byla pacientka převedena na perorální antikoagulační léčbu a s nastavenou účinnou hodnotou INR byla propuštěna domů. Pacientka kouřila, i když kojila, a na další doporučené kontroly INR na našem pracovišti se nedostavila. Od té doby nemáme o zdravotním stavu pacientky a dítěte žádné informace.
Zkratky
AFI, BPD, AC, FL – parametry sonografického vyšetření
AMK – aminokyselina
AT – antitrombin
BMI – body mass index
DNA – deoxyribonukleová kyselina (deoxyribonucleotid acid)
EFW – odhadnutá hmotnost plodu (estimated foetus weight)
FEU – vyjádření koncentrace D-dimerů (fibrinogen equivalent unit)
HAK – hormonální antikoncepce
HBS – heparin-binding site
HRT – hormonální substituční léčba (hormonal replacement therapy)
INR – mezinárodní normalizovaný poměr (international normalized ratio)
IUGR – intrauterinní růstová retardace (intrauterine growth retardation)
LMWH – nízkomolekulární heparin (low molecular weight heparin)
mRNA – přenosová ribonukleová kyselina (messenger ribonucleotid acid)
PM – poslední měsíčky
PPH – poloha plodu hlavičkou
RCL – reaktivní centrální smyčka (reactive central loop)
RS – reactive side defect
TEN – tromboembolická nemoc
UFH – nefrakcionovaný heparin (unfractionated heparin)
MUDr. Zdeňka Hajšmanová
Hematologický úsek ÚKBH FN a LF UK
Alej Svobody 80, 304 60 Plzeň
fax: +420 377 104 234, e-mail: hajsmanova@fnplzen.cz
Zdroje
1. Picard, V. et al.: Molecular Bases of Antithrombin Deficiency. Twenty Two Novel Mutations in the Antithrombin Gene, Human Mutation,: Mutation in Brief #896 (2006) Online.
2. Picard, V. et al.: Antithrombin Phe 229 Leu: a new homozygous variant leasing to spontaneous antithrombin polymerization in vivo associated with severe childhood thrombosis. Blood, 2003, 102, s. 919–925.
3. Dahlbäck, B.: Advances in understanding pathogenetic mechanisms in thrombophiliac disorders. Blood, 2008, 112, s. 19–27.
4. Lane, D. A., Olds, R. R, Thein, S. L: Antithrombin and its deficienty states. Blood Coagul. Fibrin., 1992, 3, s. 315–341.
5. Kvasnička, J.: Trombofilie a trombotické stavy v klinické praxi. Praha, Grada, 2003.
6. Hrachovinová I.: Molekulární podstata vrozeného defektu antitrombinu u deseti českých rodin. Čas. Lék. čes., 2000, 139, s. 595–597.
7. Dulíček, P., Penka, M., Binder, T., Unzeitig, V.: Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví. www.thrombosis.cz
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýzaČlánek Atrézie a stenózy duodenaČlánek mikroRNA a rektální karcinomČlánek Nový pohled na protein RasČlánek Čeští lékaři a rok 1968Článek Imunologická paměť bazofilůČlánek Význam DNA polymerázČlánek Postřehy z Mayo ClinicČlánek Spolek lékařů v PlzniČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Vzácná diagnóza: CD4⁺56⁺ leukémie z dendritických buněk typu DC2
- Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýza
- Atrézie a stenózy duodena
- Diagnostika a léčba dědičných metabolických poruch
- Sebevražedné pokusy v souboru mladých dospělých – výsledky studie ELSPAC
- Nový pohled na funkce telomeráz
- mikroRNA a rektální karcinom
- Nový pohled na protein Ras
- Průběh těhotenství a porodu při vrozeném deficitu antitrombinu typu II
- Léčba hemosuccus pancreaticus embolizací obou gastrických tepen
- Čeští lékaři a rok 1968
- Imunologická paměť bazofilů
- Význam DNA polymeráz
- Clinical usefulness of fractional exhaled nitric oxide for diagnosing prolonged cough
- Cutoff point of the fraction of exhaled nitric oxide (FeNO) with the off-line method for diagnosing asthma and the effect of smoking on FeNO
- Enalapril-induced cough is associated with non-severe heart failure
- JEDNODENNÍ KONFERENCE O PRENATÁLNÍ DIAGNOSTICE
- Znovu objevený Theodor Boveri a jeho nadčasové úvahy o vzniku maligních nádorů
- World Cancer Congress UICC 2008 – pohledem medika Ženeva, 27.–31. srpna 2008
- Profesor Ivo Hána osmdesátníkem
- Postřehy z Mayo Clinic
- II. mezioborový lékařský kongres DÝCHÁNÍ – PODMÍNKA ŽIVOTA
- Slavnostní seminář k 20. výročí založení obezitologické jednotky
- Spolek lékařů českých v Praze
- Spolek lékařů v Plzni
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Atrézie a stenózy duodena
- Průběh těhotenství a porodu při vrozeném deficitu antitrombinu typu II
- Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýza
- Vzácná diagnóza: CD4⁺56⁺ leukémie z dendritických buněk typu DC2
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



