-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPrincipy systémové bezopioidní anestezie a pooperační analgezie, naše zkušenosti u bariatrických chirurgických výkonů
The principles of opioid‑free anesthesia and postoperative analgesia, our experience in bariatric surgery
Opioid-free anaesthesia and postoperative analgesia are methods of perioperative care without the use of opioids, whereas the principles of opioid-sparing anaesthesia and postoperative analgesia lie in the use of opioids in minimal doses. These methods are based on multimodal approach and reduce the influence of opioid side-effects on postoperative course. Within general opiod-free anaesthesia and systemic postoperative analgesia a combination of adjuvant, non-opioid analgetics and non-steroidal antiinflammatory drugs is used, which enables to reduce opioid consumption and the incidence of opioid side effects. NMDA receptor antagonists, local anaesthetics and α2-receptor agonists are the most frequenly used drugs. Benefit of opioid-free anaethesia and analgesia was primarily shown in patients, for whom opioid side-effects mean significant risk of postoperative complications, for example morbidly obese patients undergoing bariatric surgical procedures. In our institute opioid-free approach proved to be effective and beneficial in patients undergoing laparoscopic assisted sleeve gastrectomies. Even though it is not possible to recommend opioid-free anaesthesia and analgesia as a method of choice in general, opioid-sparing approach is a fixed part of guidelines for anaesthesia and postoperative analgesia in risk patients, who are seriously endangered by opioid side-effects.
Keywords:
opioids – opioid‑ free anaesthesia – opioid‑sparing anaesthesia – mulimodal systemic analgesia
Autoři: P. Píza; E. Uchytilová; A. Čermáková; E. Kieslichová
Působiště autorů: The principles of opioid‑‑free anesthesia and postoperative analgesia, our experience in bariatric surgery
Vyšlo v časopise: Anest. intenziv. Med., 33, 2022, č. 1, s. 25-31
Kategorie: Přehledový článek
Souhrn
Bezopioidní anestezie a pooperační analgezie jsou anesteziologické postupy v perioperační péči bez použití opioidů. Opioid ‑ šetřící anestezie a pooperační analgezie spočívají v použití opioidů v minimálních dávkách. Tyto postupy jsou založeny na multimodálním principu a umožní snížit vliv nežádoucích účinků opioidů na pooperační průběh. V rámci celkové doplňované bezopioidní anestezie a systémové pooperační analgezie je podávána kombinace adjuvantních, neopioidních analgetik a nesteroidních protizánětlivých léků, která umožní významně snížit spotřebu opioidů, a tím incidenci jejich nežádoucích účinků. Nejčastěji jsou používány antagonisté NMDA receptorů, lokální anestetika a agonisté α2-receptorů. Benefit bezopioidní anestezie a analgezie byl prokázán především u pacientů, pro které nežádoucí účinky opioidů znamenají riziko závažných komplikací, například morbidně obézních pacientů podstupujících bariatrické operační výkony. Na našem pracovišti se bezopioidní přístup ukázal jako velmi účinný a výhodný u laparoskopicky asistovaných sleeve gastrektomií. I když bezopioidní anestezii a analgezii nelze paušálně doporučit jako metodu volby, opoid‑šetřící přístup je pevnou součástí doporučení pro anestezii a pooperační analgezii rizikových pacientů, které nežádoucí účinky opioidů ohrožují závažnými pooperačními komplikacemi.
Klíčová slova:
opioidy – bezopioidní anestezie – opioid‑šetřící anestezie – multimodální systémová analgezie
Úvod
Bezopioidní anestezie (opioid‑‑free anaesthesia, OFA) je anesteziologický přístup, v rámci kterého nejsou podávány opioidy ani systémově, ani intrathekálně. Analogicky, bezopioidní analgezie je způsob pooperační analgezie bez použití opioidů. Odvozenými technikami jsou opioid‑ ‑ šetřící anestezie, případně analgezie. Jejich součástí je podávání opioidů, ale v podstatně nižších dávkách, než které jsou používány při klasicky vedené anestezii nebo analgezii na bázi opioidů [1]. OFA je založena na principu multimodální analgezie (MMA), který se stal metodou volby v léčbě pooperační bolesti před více než 25 lety [2]. MMA umožní snížit spotřebu opioidů na nezbytně nutné minimum s cílem minimalizovat vliv jejich nežádoucích účinků na pooperační průběh [3].
Perioperační a pooperační analgezie
Opioidy jsou v rámci celkové doplňované anestezie podávány nejen za účelem snížení spotřeby anestetik, ale především k zajištění efektivní perioperační analgezie, včetně tlumení reakcí oběhového systému na působící nociceptivní podněty zprostředkované sympatikem. Nicméně je třeba si uvědomit, že bolest a nocicepce jsou dva zcela odlišné fyziologické jevy. Zatímco bolest je komplexní korový vjem, přísně subjektivní, který má neoddělitelnou emoční komponentu, nocicepce je čistě senzorická odpověď periferního nociceptoru na působící podnět, tj. jeho transformace na sérii elektrických impulsů, modulace na úrovni synapsí a ascendentní transmise do vyšších center nervového systému. V průběhu anestezie dochází tudíž k nocicepci, nikoliv vnímání bolesti, a tu lze účinně ovlivnit farmakologickou blokádou nociceptivní neurotransmise prakticky na všech úrovních nervové dráhy bolesti bez nutnosti použití vysokých dávek opiodů v monoterapii [4]. Existuje široká skupina adjuvantních analgetik, které sice nepatří mezi klasická analgetika anodyna, ale svým mechanismem účinku velmi efektivně ovlivní neurální přenos nociceptivní informace, ať už blokádou nebo modulací synaptické transmise, nebo blokádou mechanismů centrální nebo periferní senzitizace nociceptivního systému.
Ani v současné době není pooperační bolest vždy efektivně léčena [5]. Je bolestí akutní nociceptivní, pro jejíž léčbu platí třístupňový analgetický žebříček WHO (World Health Organisation). Na nejvyšším stupni tohoto žebříčku stojí silné opioidy, potentní analgetika, která na akutní nociceptivní bolest spolehlivě účinkují. Avšak léčba opioidy je provázena závažnými nežádoucími účinky. Z časných jsou to například sedace, dechová deprese, retence moči, nauzea nebo porucha střevní pasáže. Tyto nežádoucí účinky významně prodlužují a komplikují pooperační rekonvalescenci, i když je možné je do jisté míry terapeuticky ovlivnit [6]. Dlouhodobé nežádoucí účinky opioidní analgetické terapie, jejichž význam v současné době vzrůstá, jsou ještě závažnější, neboť je terapeuticky ovlivnit neumíme. Spočívají v rozvoji tolerance na analgetický efekt, fyzické a psychické závislosti a opioidy indukované hyperalgezie. V literatuře je popisován tzv. opioidní paradox neboli čím víc opioidů je podáno během operačního výkonu, tím větší je jejich spotřeba v pooperačním období [7]. Bylo prokázáno, že opioidní analgetická terapie v pooperačním období zvyšuje pravděpodobnost, že bude pacientovi opioid předepsán při dimisi k domácímu užití, a to dále zvyšuje pravděpodobnost, že bude pacient vyžadovat recept na předpis opioidních analgetik opakovaně i v dalších týdnech a měsících [8].
Opioid‑šetřící a bezopioidní postupy v anestezii a analgezii
Způsoby anestezie, které se postupem času ukázaly jako optimální, jsou anestezie celková doplňovaná a kombinovaná. Oba představují přístup multimodální, tedy opioid‑šetřící. Spočívají v kombinaci metod nebo farmak, které mají synergický až aditivní efekt, což umožní snížit dávkování jednotlivých složek včetně opioidů na nezbytné minimum, a tím omezit jejich nežádoucí účinky. Anestezie bez použití opioidů je tak proveditelná [9]. Obdobně optimálním přístupem je v léčbě pooperační bolesti MMA [2]. Kombinace různých metod analgezie, z nichž každá účinkuje jiným mechanismem a blokuje nociceptivní neurální přenos na jiné úrovni, zajistí kvalitní analgezii za minimální spotřeby opioidů, které jsou v rámci MMA doporučovány jen jako záchranná medikace. Bezopioidní a opioid‑‑šetřící techniky se staly součástí ERAS protokolů pro celou řadu chirurgických intervencí [10]. Redukce dávky opioidů jako součásti celkové doplňované anestezie nemusí vždy souviset se sníženou spotřebou opioidů v pooperačním období, podle Suzan [11] hraje klíčovou úlohu načasování. Pooperační hyperalgezie indukovaná především krátkodobě působícími opioidy byla podrobně popsána [12]. Bylo prokázáno, že vysoké dávky opioidů podané peroperačně souvisí s vyšší intenzitou pooperační bolesti a zvýšenou spotřebou opioidů v pooperačním období [13]. Naopak, podání opioidů pooperačně má analgetický efekt [11].
Omezit, až úplně vynechat opioidy v rámci celkové anestezie nebo pooperační analgezie, umožňují především metody regionální. Výhody blokády primární nociceptivní aferentace regionálními technikami byly jednoznačně prokázány [14]. V případech, kdy však regionální technika není proveditelná, je druhou možností jak snížit spotřebu opioidů kombinace systémově podávaných farmak ze skupin adjuvantních, neopioidních analgetik a nesteroidních protizánětlivých léků. Adjuvantní neboli atypická analgetika tvoří různorodou skupinu farmak, která účinně blokují neurální mechanismy nocicepce a senzitizace. Patří do ní např. antagonisté NMDA (N‑methyl, D‑aspartát) receptorů, agonisté presynaptických α2-receptorů, blokátory napěťově řízených sodíkových nebo kalciových kanálů, a řada dalších. V kombinaci s klasickými analgetiky působí synergicky, tudíž potencují jejich efekt a umožní tak snížit jejich spotřebu.
Opioid‑šetřící metody systémové analgezie
NMDA receptory hrají klíčovou úlohu nejen v neurálním přenosu nociceptivní informace, ale především v mechanismech centrální senzitizace a pravděpodobně i rozvoje opioidy indukované hyperalgezie a tolerance na analgetický efekt. Ketamin (Calypsol®, Narkamon®) kompetitivně blokuje vazebné místo NMDA receptorů pro excitační aminokyseliny, navíc ovlivňuje i napěťové řízené sodíkové kanály nebo kanály draslíkové. V perioperační praxi je nejčastěji podáván jako bolus 0,25–0,5 mg/kg i. v. následovaný kontinuální infuzí 0,125–0,25 mg/kg/h. Analgetický efekt ketaminu v léčbě pooperační bolesti byl přesvědčivě prokázán. Vede ke snížení spotřeby opioidů v perioperačním období, tím k nižší incidenci jejich nežádoucích účinků, a pravděpodobně i k nižší incidenci přechodu pooperační bolesti do chronicity [15, 16]. Druhou možností ovlivnění NMDA receptorů je podání 20 %MgSO4 (např. 2,5–10 mg/kg/h kontinuálně i. v.) [17]. Magnesium sulfát je přirozeným blokátorem iontového kanálu NMDA receptoru, který zabrání influxu iontů kalcia při jeho aktivaci, a tím i synaptickému přenosu. Perioperační podání MgSO4 má v pooperačním období analgetický a opioid šetřící efekt, na kterém se podílí i jeho protizánětlivé účinky [18]. Agonisté presynaptických α2-receptorů mechanismem přímé blokády sympatického přenosu zastoupí opioidy v udržení hemodynamické stability během nociceptivní stimulace, postsynaptické ovlivnění gabaergního a glutamatergního přenosu vede k sedaci, anxiolýze, sympatikolýze a analgezii. Koanalgetikem první volby této skupiny farmak je vzhledem k výhodným farmakokinetickým vlastnostem dexmedetomidin (Dexdor®), příklad dávkování dexmedetomidinu u bariatrických operačních výkonů je indukční dávka 1 μg/kg následovaná udržovací infuzí 0,5–1 μg/kg/h [19]. V řadě metaanalýz randomizovaných studií byl prokázán efekt dexmedetomidinu ve smyslu snížení intenzity pooperační bolesti a spotřeby systémově podaného morfinu v pooperačním období [20, 21] nebo zmírnění nežádoucích účinků opioidů na motilitu trávicího traktu [22], a to bez prolongované sedace bránící extubaci nebo dechové rehabilitaci. Závažným nežádoucím účinkem může být bradykardie [23]. Podstata analgetického efektu systémově podávaných lokálních anestetik spočívá v blokádě napěťově řízených sodíkových kanálů na membránách periferních nociceptorů a inhibici kanálů pro dvojmocné kationty. Podílí se na něm i jejich imunomodulační účinky. Jako koanalgetikum se nejčastěji používá lidokain (2% Xylocain®), a to jako bolus 1,5 mg/kg i. v. následovaný kontinuální infuzí 1,5–3 mg/kg/h. Intravenózně podaný lidokain vede ke snížení intenzity pooperační bolesti a spotřeby systémových opioidů, souvisí s rychlejší rehabilitací, kratší hospitalizací a časnější obnovou gastrointestinálních funkcí [24].
Analgetická účinnost neopioidních analgetik a protizánětlivých léků, umožňující opioid‑‑šetřící přístup v léčbě pooperační bolesti spojený s nižší incidencí pooperační nauzey a zvracení (PONV), ileu, nadměrné sedace, za současně kvalitnější analgezie než samotným opioidem v monoterapii, byla jednoznačně prokázána. Např. 1 g paracetamolu podaný intravenózně s koncem operačního výkonu významně sníží intenzitu pooperační bolesti, spotřebu systémově podaných opioidů a incidenci jejich nežádoucích účinků [25]. Opioid‑šetřící účinky nesteroidních protizánětlivých léků (NSAIDs) se zdají být ještě významnější než paracetamolu [26] a nebylo jednoznačně prokázáno, že by jejich použití v léčbě pooperační bolesti vedlo k vyšší incidenci krvácivých komplikací [27] nebo souviselo s poruchou hojení chirurgických anastomóz [28]. Svým protizánětlivým působením potencují analgezii také kortikosteroidy. Dexamethazon (Dexamed®) je navíc účinným antiemetikem doporučovaným k prevenci i léčbě PONV. V pooperačním období vedou kortikosteroidy ke snížení spotřeby opioidů, incidence PONV, umožní časnější rehabilitaci, dexamethazon v dávce 0,1 mg/kg i. v. podaný se začátkem operačního výkonu je pooperačně účinný nejen v prevenci PONV, ale také jako koanalgetikum [29].
Bezopioidní anestezie v bariatrii
Je jisté, že žádné z výše uvedených farmak v monoterapii opioid nenahradí a samo o sobě bezopioidní anestezii neumožní. Ale jejich kombinace, za současného využití moderních anesteziologických a chirurgických technik, představuje vhodnou alternativu k použití opioidů. Jaký benefit tento opioid‑‑šetřící přístup přináší? Spočívá v eliminaci nežádoucích účinků opioidů na pooperační průběh, a to je důležité zejména u rizikových skupin pacientů, pro které znamenají nebezpečí závažných komplikací. Morbidně obézní pacienti a pacienti s respirační insuficiencí jsou typickým příkladem. Mechanika dýchání je u nich alterována opioidy indukovanou dechovou depresí a somnolencí, zvýšenou rigiditou dýchacích svalů, a naopak sníženým tonusem svalů faryngu vedoucím k obstrukci horních cest dýchacích, projevujícím se především u pacientů trpících syndromem obstrukční spánkové apnoe [30]. Pravděpodobně proto byly výhody OFA potvrzeny především v klinických studiích zabývajících se obézními pacienty podstupujícími bariatrické výkony [26, 29]. Bylo prokázáno, že dexmedetomidin, použitý v rámci celkové doplňované anestezie jako alternativa fentanylu u bariatrických výkonů, umožní snížit peroperační spotřebu desfluranu, spotřebu morfinu v pooperačním období, a zároveň poskytne kvalitnější pooperační analgezii [31]. Souvislost OFA s nižší incidencí PONV jako závažné komplikace bariatrických výkonů byla rovněž prokázána [32], kombinace propofol‑‑dexmedetomidin‑‑ketamin vedla podle výsledků této studie v porovnání s kombinací inhalační anestetikum‑‑opioid k významně nižšímu riziku této pooperační komplikace. Podle Muliera [33] přináší u bariatrických výkonů OFA (vedená kombinací propofol, rocuronium, dexmedetomidin, ketamin, lidokain) ve srovnání s anestezií s použitím opioidů (kombinací propofol, rocuronium, sufentanil) časnější zotavení, větší komfort pacientů, nižší intenzitu pooperační bolesti při nižší spotřebě opioidů, nižší incidenci PONV i pooperační hypoxie s desaturací. V jiné studii prokázal, že OFA u bariatrických výkonů pravděpodobně souvisí s nižší incidencí pooperačních komplikací vůbec [34]. Podle metaanalýzy klinických studií, která zkoumala široké spektrum různých chirurgických výkonů na obecné populaci pacientů, nevede anestezie s použitím opioidu ke kvalitnější analgezii v porovnání s bezopioidní, a naopak souvisí s vyšší pravděpodobností PONV [35].
Bezopioidní anestezie a jiné rizikové skupiny pacientů
Další riziková skupina, která by mohla významně profitovat z OFA, jsou pacienti s chronickou bolestí, zejména chroničtí uživatelé opioidů. Ti většinou trpí silnější pooperační bolestí a mají vyšší pooperační spotřebu opioidů než opioid‑‑naivní pacienti. Zároveň je u nich vyšší riziko přechodu akutní pooperační bolesti do chronicity [36]. Prosté navyšování dávek opioidů v tomto případě analgetický efekt nepřinese. Paradoxně, např. remifentanil, často dávaný do souvislosti s rozvojem opioidy indukované hyperalgezie, pravděpodobně vede i k chronifikaci pooperační bolesti, a to v závislosti na dávce [37]. U těchto pacientů je doporučeno v perioperačním období pokračovat v nastavené chronické opioidní terapii a multimodálním přístupem ovlivnit akutní nociceptivní složku [38]. Zejména farmakologické ovlivnění NMDA receptorů, které se podílí na nociceptivní transmisi, rozvoji tolerance na efekt i opioidy indukované hyperalgezie, umožní snížit peroperační dávky opioidů, a představuje u těchto pacientů velmi účinný způsob analgezie. V praxi se ukázalo, že perioperační podání ketaminu pacientům, kteří léčí opioidy chronickou bolest, často i s neuropatickou složkou, vedlo k významnému snížení intenzity jejich pooperační bolesti a snížení spotřeby opioidů v časném i pozdějším pooperačním období [39]. Použití ketaminu v léčbě pooperační bolesti může rovněž snížit pravděpodobnost jejího přechodu do chronicity [16]. Agonisté α2-receptorů mohou zmírnit případné příznaky syndromu z odnětí.
OFA u onkochirurgických výkonů je v současné době velmi diskutované téma. Je známo, že endogenní opioidy hrají důležitou úlohu v posttraumatické stresové reakci, zejména imunitní odpovědi na tkáňová poranění. Účinky opioidů na imunitní systém jsou velmi komplexní a různorodé, závislé na dávce, typu opioidu i typu zánětlivé reakce. V případě vysokých, analgeticky účinných dávek exogenních opioidů, převažuje jejich imunosupresivní efekt, a to především na buňkami zprostředkovanou cytotoxickou imunitu [40]. Bylo popsáno, že díky imunosupresivním účinkům mohou opiody potencovat nádorový růst a vznik metastáz, dokonce ovlivnit invazivitu malignity včetně angiogeneze [41]. Buněčné mechanismy a jejich interakce, účastnící se možné role opioidů v kancerogenezi, jsou však velmi komplexní a zdaleka ne objasněné. Současně je třeba brát v patrnosti, že neléčená akutní nociceptivní bolest je sama o sobě stresor působící imunosupresi. Metaanalýzy přináší nejednoznačné výsledky, souvislost opioid‑ ‑ šetřící anestezie s nižší rekurencí malignity nebo delším přežitím onkologických pacientů nebyla přesvědčivě prokázána [42], ale mnoho studií je limitováno retrospektivní povahou a nízkou kvalitou dat [43]. Hontoir et al. v prospektivní randomizované studii prokázal větší komfort a nižší intenzitu pooperační bolesti s nižší spotřebou opioidů u onkologických pacientek po operaci prsu [44]. I když je vliv opioidů na možnou rekurenci malignit nejasný, lze bezopioidní nebo opioid‑šetřící techniky u onkologických pacientů doporučit.
Praktické provedení OFA u plánovaných bariatrických výkonů, příprava protokolu
Na našem pracovišti jsme OFA zavedli do praxe u plánovaných bariatrických výkonů, konkrétně u laparoskopicky asistovaných sleeve gastrektomií. V odborné literatuře bylo během let 2009–2021 publikováno několik protokolů OFA [19], nejčastěji používanými farmaky jsou lidokain, dexmedetomidin, dexamethason a ketamin. Při tvorbě našeho protokolu jsme prošli vývojem od klasického schématu – ketamin, lidokain, dexmedetomidin a MgSO4 , podávaných pomocí jednotlivých lineárních dávkovačů zvlášť, ke zjednodušenému modelu s použitím jediného injektomatu (tzv. MultiMix) nebo jeho modifikované varianty (Tab. 1). Při užití modifikovaného MultiMix protokolu je směs lidokainu (20 mg/ml) a ketaminu (2,5 mg/ml) připravena v 50ml injekční stříkačce chráněné před světlem. Díky tomu je stabilní po dobu 48 hodin při 28 °C, což umožní její použití i v pooperačním období [45]. Pro obézní pacienty je nutný přepočet dávkování léčiv na tzv. adjustovanou tělesnou hmotnost (AdjBW) podle příslušného vzorce [46].
Tab. 1. OFA směs – Multimix protokol 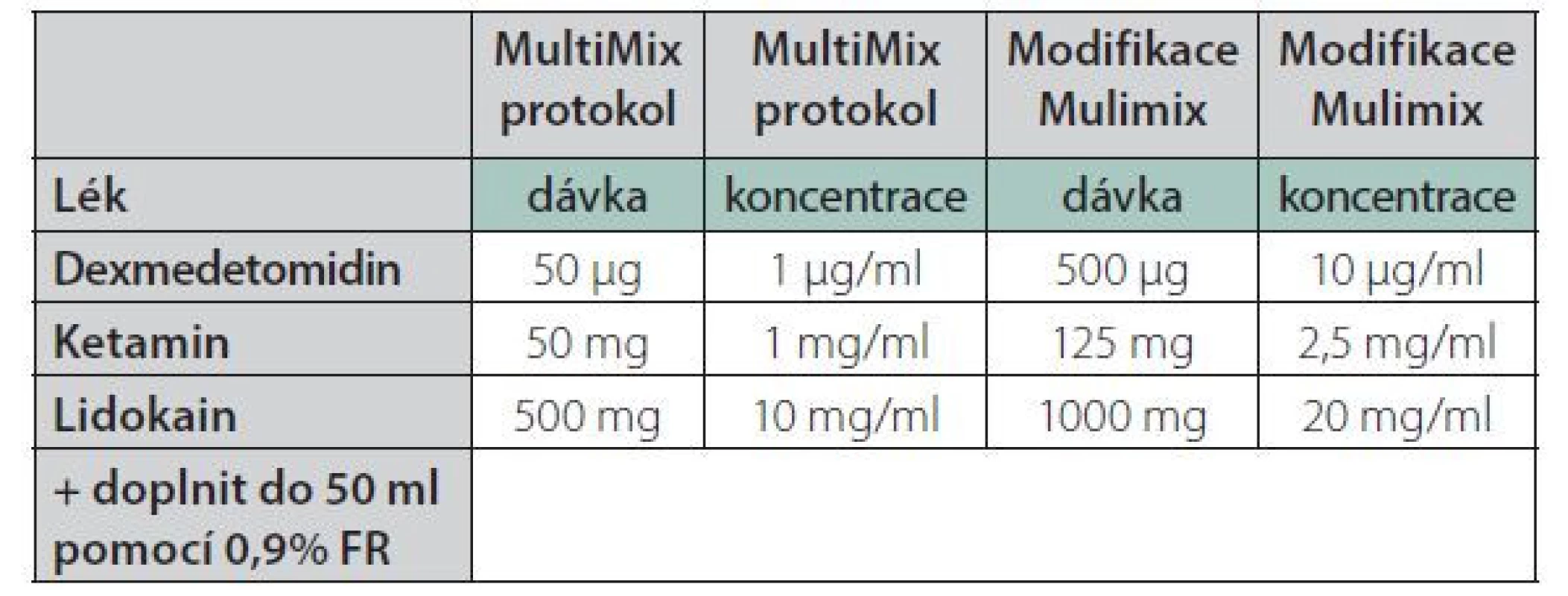
Během předoperační přípravy je pacientovi postup OFA nejprve pečlivě vysvětlen, včetně hodnocení pooperační bolesti pomocí VAS skóre a podpisu příslušného informovaného souhlasu. Jako premedikace jsou na některých pracovištích používány gabapentinoidy (gabapentin nebo pregabalin), a to za účelem snížení intenzity akutní nebo incidence chronické pooperační bolesti [47]. Avšak Americká společnost pro léčbu bolesti ani Evropská společnost pro regionální anestezii a terapii bolesti [48, 49] neposkytují jednoznačná doporučení pro jejich použití v perioperačním období, a proto na našem pracovišti, především pro riziko nežádoucích účinků, přípravu gabapentinoidy nepodáváme. V rámci prevence pooperačního deliria upouštíme rovněž od premedikace benzodiazepiny [50].
Po příjezdu na operační sál je pacientovi nejprve podán dexmedetomidin (0,25 μg/kg – během 10 minut i. v.). Bezopioidní analgetická směs obsahující 50 μg dexmedetomidinu, 50 mg ketaminu, 500 mg lidokainu a 1 g MgSO4 (10 ml) je připravena v 50ml stříkačce s fyziologickým roztokem, bezprostředně před úvodem do anestezie je aplikován bolus 1 ml/10 kg tohoto roztoku během 10 minut. Následuje vlastní úvod do anestezie pomocí i. v. anestetika a krátkodobě působícího nedepolarizujícího svalového relaxans (1–2% propofol, rocuronium) k zajištění dýchacích cest intubací a napojení na anesteziologický přístroj. Před incizí je výhodné přidat ketamin (50 mg i. v.) nebo paracetamol (1 g i. v.). Pro vlastní vedení anestezie je možné použít doplňovanou anestezii s inhalačním anestetikem (sevorane nebo desfluran, MAC 0,6–0,8) nebo TIVA pomocí TCA pumpy. Z aktuálně dostupných modelů doporučujeme použít buď Marsh [51] nebo Schnider [52] s kalkulací dle AdjBW. Standardní použití modelu Marsh s využitím aktuální tělesné hmotnosti (TBW) vede k vyšším koncentracím anestetik, než je predikováno. Optimální je titrovat cílovou koncentraci za monitorace hloubky anestezie.
Úvodní dávka OFA směsi je následně redukována na udržovací, a to na 1 ml/10 kg/h (AdjBW). Nezbytné je perioperační hodnocení hloubky anestezie a analgezie (General Electric Company Healthcare‑‑Entropy™ Module + Surgical Plethysmographic Index nebo pomocí monitoru Masimo – Sedline, Patient Safety Index). 15 minut před koncem operace se dávka dále sníží na 0,5 ml/10 kg/h, tímto způsobem je pak analgezie vedena i během extubace a následně v pooperačním období. Součástí našeho protokolu je bolus paracetamolu podaný na konci operace (1–2 g i. v.), vhodná je infiltrační anestezie rány nebo okolí zavedeného drenu (10 ml 0,125–0,25% bupivakainu). Po výkonu podáváme antiemetika k prevenci pooperační nevolnosti a zvracení, dexamethason 4–8 mg nebo ondansetron 4–8 mg i. v.
Infuze analgetické směsi pokračuje v pooperačním období na monitorovaném lůžku rychlostí 0,25–0,5 ml/10 kg/h (AdjBW) podle efektu a odpovědi pacienta. Jako koanalgetikum se běžně používá paracetamol (1 g u pacienta nad 50 kg, pod 50 kg 15 mg/kg) každých 6–8 hodin po dobu prvních 24 hodin od výkonu, alternativou může být metamizol nebo ibuprofen (600 mg i. v.) s ohledem na nežádoucí účinky a kontraindikace. Podávání analgetické směsi pokračuje s postupnou redukcí dávky do druhého pooperačního dne (Tab. 2). Jako rescue analgetikum je v záloze nalbufin (5–10 mg i. v., maximální dávka 20 mg), v případě selhání OFA režimu a nezvladatelné bolesti morphin 2,5–5 mg i. v. Na našem pracovišti jsme zatím ani jednou nezaznamenali selhání této metody s analgetickou účinností do 3/10 dle VAS, rescue opioidní analgetikum nebylo nutné použít u žádného pacienta. Nezaznamenali jsme ani jeden případ pooperačního hyperaktivního deliria, PONV nebo nežádoucích vedlejších účinků použitých farmak.
Tab. 2. Dávkování léčiv pro OFA (dospělí) 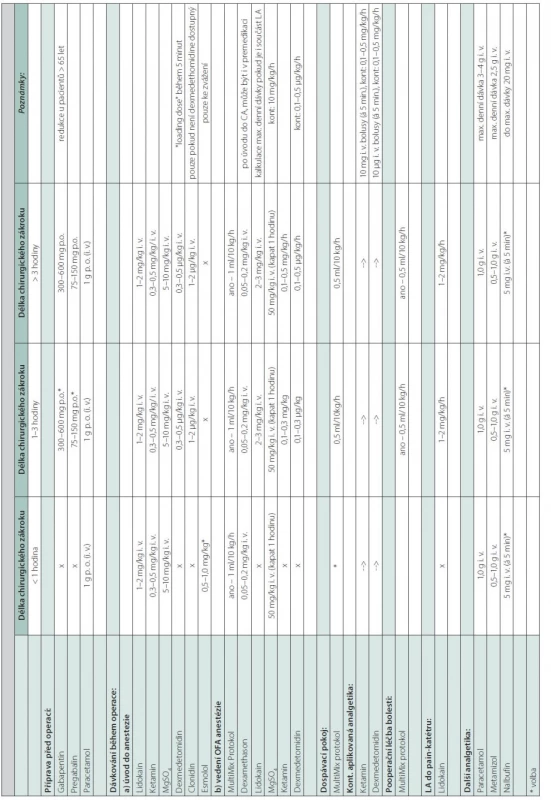
Závěr
Během celkové anestezie můžeme nocicepci účinně ovlivnit farmakologickou blokádou transmiterů nebo receptorů, které se na jejich neurálních mechanismech podílí, a to řadou různých způsobů. Vzhledem ke komplexitě a složitosti těchto dějů je optimální využít kombinaci několika farmak nebo metod pro jejich aditivní efekt. OFA je multimodální způsob anestezie kombinací farmak a anesteziologických technik umožňující celkovou anestezii bez použití opioidů. Na stejném principu je založena MMA v pooperačním období. Tyto přístupy umožní snížit spotřebu opioidů v perioperačním období a jejich výhoda spočívá v nižší incidenci pooperačních komplikací souvisejících s jejich použitím. Zatímco existují přesvědčivé důkazy o tom, že kombinovaná anestezie a multimodální analgezie přinášejí pacientům jednoznačné benefity, přínos čistě bezopioidní anestezie a její případná nadřazenost opioid‑šetřícím postupům potvrzeny nebyly. Protože klinických studií je stále relativně málo a jsou limitovány zejména nedokonalou perioperační monitorací analgezie, zásadní význam úplného vynechání opioidů v perioperační péči dosud prokázán nebyl [3]. V recentní prospektivní multicentrické randomizované studii bylo zjištěno, že při srovnatelné kvalitě analgezie měli pacienti po OFA sice nižší spotřebu morfinu a nižší incidenci PONV, ale naopak delší dobu do zotavení z anestezie umožňující extubaci a častější výskyt pooperační hypoxie s desaturací [53].
I když podle dostupné evidence zatím nelze provedení OFA v obecné rovině doporučit, vzhledem k nízkému výskytu komplikací, a zároveň jednoznačnému benefitu spočívajícímu v eliminaci nežádoucích účinků opioidů, je její význam pro praxi nezpochybnitelný. Je však potřeba, aby nové studie spolehlivě ověřily a potvrdily očekávané výhody OFA, poukázaly na možná rizika, a upřesnily tak indikační kritéria tohoto postupu. Naopak opioid‑šetřící multimodální techniky svůj benefit jasně potvrdily a jsou pevnou součástí doporučených anesteziologických postupů pro celou řadu chirurgických výkonů, zejména u rizikových skupin pacientů, pro které nežádoucí účinky opioidů představují významné riziko pooperačních komplikací [54].
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce. Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. Autoři se podíleli na tvorbě a finální podobě článku.
KORESPONDENČNÍ ADRESA AUTORKY:
Mudr. Eva Uchytilová, Ph.D.
Článek přijat redakcí: 11. 11. 2021; Článek přijat k tisku: 11. 1. 2022
Cit. zkr: Anest intenziv Med. 2022;33(1):25-31
Zdroje
1. Sultana A, Torres D and Schumann R. Special indications for Opioid Free Anaesthesia and Analgesia, patient and procedure related: Incluidng obesity, sleep apnoea, chronic obstructive pulmonary disease, complex regional pain syndromes, opioid addivtion and cancer surgery. Best Practice & Research Clinical Anaesthesiology 31 (2017) 547-560.
2. Dahl JB, Rosenberg J, Dirkes WE, Mogensen T, Kehlet H. Prevention of postoperative pain by balanced analgesia. Br J Anaesth 1990;64 : 518-520.
3. Beloeil H. Opioid‑free anesthesia. Best Practice & Research Clinical Anaesthesiology 33 (2019)353-360.
4. Egan TD. Are opioids indispensable for general anesthesia? Br J Anesth 2019;122:e127-35.
5. Kaye AD, Granier AL, Garcia AJ, Carlson SF, Fuller MC, Haroldson AR et al. Non‑Opioid Perioperative Pain Strategies for the Clinician: A Narrative Review Pain Ther. 2020 Jun;9(1):25-3.
6. Dunkman WJ, Manning MW. Enhanced Recovery After Surgery and Multimodal Strategies for Analgesia Surg Clin North AM. 2018 Dec;98(6):1171-1184.
7. Koepke EJ, Manning EL, Miller TE, Ganesh A, Williams DG, Manning MW. The rising tide of opioid use and abuse: The role of the anesthesiologist. Perioper Med. 2018;7 : 16.
8. Thota RS, Ramkiran S, Garg R, Goswami J, Baxi V, Thomas M. Opioid free onco‑anesthesia: Is it time to convict opioids? A systematic review of literature J Anaesthesiol Clin Pharmacol. Oct‑Dec 2019;35(4):441-452.
9. Lavand’homme P. Opioid‑free anaesthesia: pro: damned if you don’t use opioidsduring surgery. Er J Anaesthesiol 2019;26 : 247-249.
10. Thorell A, MacCormick A, Awad S. Guidelines for perioperative care in bariatric surgery: enhanced recovery after surgery (ERAS) society recommendations. World J Surg 2016 Sep; 40(9):2065-2083.
11. Suzan E, Pud D, Eisenberg E. A crucial administration timing separates between beneficial and counterproductive effects of opioids on postoperative pain. Pain 2018;159 : 1438-1440.
12. Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C, Alfonsi P et al. Acute opioid tolerance: intraoperative ramifentanil increases postoperative pain and morphine requirement. Anesthesiology 2000;93(2):409-417.
13. Fletcher D, MArtinez V. Opioid‑induced hyperalgesia in patients after surgery: a systematic review and meta‑analysis. Br J Anaesth 2014;112(6):991-1004.
14. Lavand’homme P. de Kock M. Waterloos H. Intraoperative epidural analgesia combined with ketamine provides effective preventive analgesia in patients undergoing major digestive surgery Anesthesiology 2005;103 : 813-820.
15. Wang L, Johnston B, Kaushal A, Cheng D, Zhu F, Martin J. Ketamine added to morphine or hydromorphone patient‑controlled analgesia for acute postoperative pain in adults: a systematic review and meta‑analysis of randomized trials. Can J Anesth. 2016;63 : 311-325.
16. Chaparro LE, Smith SA, Moore RA, Wiffen PJ, Gilron I. Pharmacotherapy for the prevention of chronic pain after surgery in adults. Cochrane Database of Systematic Reviews. 2013;7: Art.No.: CD 008307.
17. De Oliveira GS, Castro‑Alves LJ, Khan JH, McCarthy RJ. Perioperative systemic magnesium to minimize postoperative pain: a meta‑analysis of randomized controlled trials. Anesthesiology 2013;119(1):178-190.
18. Murphy JD, Paskaradevan J, Eisler LL et al. Analgesic efficacy of continuous intravenous magnesium infusion as an adjuvant to morphine for postoperative analgesia: a systematic review and meta‑analysis. Middle East J Anaesthesiol. 2013 Feb;22(1):11-20.
19. Mauermann E, Ruppen W, Bandschapp O. Different protocols used today to achieve total opiod ‑ free general anesthesia without locoregional blocks. Best Practice & Research Clinical Anesthesiology. 2017;533-545.
20. Blaudszun G, Lysakowski C, Elia N, Tramér MR. Effect of Perioperative Systemic α2 Agonists on Postoperative Morphine Consumption and Pain Intensity. Anesthesiology. 2012;116 : 1312-1322.
21. Schnabel A, Meyer‑Friessem CH, Reichl SU, Zahn PK, Pogatzki‑Zahn EM. Is intraoperative dexmedetomidine a new option for postoperative pain treatment? A meta‑analysis of randomized controlled trials. Pain 2013;154 : 1140-1149.
22. Chen C, Huang P, Lai L, Luo C, Ge M, Hei Z et al. Dexmedetomidine improves gastrointentinal motility after laparoscopic resection of colorectal cancer: a randomized clinical trial. Medicine 2016;95(29):e4295.
23. Neil L, Patel A. Effect of dexmedetomidine versus fentanyl on haemodynamic response to patients undergoing elective laparoscopic surgery: a double‑blind randomized controlled study. JClinDiagnRes 2017;11:UCO1-4.
24. Sun Y, Li T, Wang N, Yun Y, Gan TJ. Perioperative Systemic Lidocaine for Postoperative Analgesia and Recovery after Abdominal Surgery: A Meta‑nalysis of Randomized Controlled Trials. Diseases of the Colon & Rectum. 2012;55(11):1183-1194.
25. De Oliveira GS, Castro‑Alves LJ, McCarthy RJ. Single Dose Systemic Acetaminophen to Prevent Postoperative Pain. A Meta‑analysis of Randomized Controlled Trials. Clin J Pain. 2015;31 : 86-93.
26. Martinez V, Beloeil H, Marret E, Fletcher D, Ravaud P, Trinquart L. Non‑opioid analgesics in adults after major surgery: systematic review with network meta‑analysis of randomized trials. BrJAnesth 2017;118 : 22-31.
27. Gobble RM, Hoang HLT, Kachniarz B, Orgill DP. Ketoralac Does Not Increase Perioperative Bleeding. A Meta‑analysis of Randomized Controlled Trials. Plast. Reconstr. Surg. 2014;133 : 741-755.
28. Saleh F, Jackson TD, Ambrosini L, Gnanasegaram JJ, Kwong J, Quereshy F et al. Perioperative Nonselective Non‑steroidal Anti‑inflammatory Drugs Are Not Associated with Anastomotic Leakage After Colorectal Surgery. J Gastrointest Surg. 2014; 18 : 1398-1404.
29. De Oliveira Jr GS, Almeida MD, Benzon HT, McCarthy RJ. Perioperative single dose systemic dexamethasone for postoperative pain: a meta‑analysis of randomized controlled trials Anesthesiology 2012;115 : 575-588.
30. Drummond GB, Bates A, Mann J, Arvind DK. Characterization of breathing patterns during patient‑controlled opioid analgesia. Br H Anaesth 2013;111 : 971-978.
31. Feld JM, Hoffman WE, Stechert MM, Hoffman IW, Ananda RC. Fentanyl or dexmedetomidine combined with desflurane for bariatric surgery. J Clin Anesth. 2006; 18 : 24-28.
32. Ziemann ‑ Gimmel P, Goldfarb AA, Koppman J, Marema RT. Opioid‑free total intravenous anaesthesia reduces postoperative nausea and vomitting in bariatric surgery beyond triple prophylaxis. Br J Anaesth 2014;112 : 906-911.
33. Mulier JP, Wouters R, Dillemans B, Dekoc, M.A. randomized controlled, double‑blind trial evaluating the effect of opioid‑free versus opioid general anesthesia on postoperative pain and discomfort measured by the QoR40. J Clin Anesth Pain Med 2018;2 : 015.
34. Mulier JP, Dillemans B. Anesthetic factors affecting outcome after bariatric surgery, a retrospective levelled regrssion analysis. Obes Surg 2019;29 : 1841-1850.
35. Frauenknecht J, Kirkham KR, Jacot‑Guillarmod A, Albrecht E. Analgesic impact of intra ‑ operative opioids vs. Opoid‑free anaeshesia: a systematic review and meta‑analysis. Anaesthesia 2019;74 : 651-662.
36. Montes A, Roca G, Sabate S, Lao JI, Navarro A, Cantillo J et al. Genetic and clinical factors associated with chronic postsurgical pain after hernia repair, hysterectomy, and thoracotomy: a two year multicenter cohort study. Anesthesiology 2015;122 : 1123-1141.
37. Van Gulik L, Ahlers SJ, van de Garde EM, Bruins P, van Boven WJ, Tibboel D, et al. Ramifentanil during cardiac surgery is associated with chronic thoracic pain 1 year after sternotomy. Br J Anaesth 2012;109(4):616-622.
38. Huxtable CA, Roberts LJ, Somogyi AA, MacIntyre PE. Acute pain management in opioid ‑ tolerant patients: a growing challenge. Anaesth Intensive Care. 2011 Sep;39(5): 804-823.
39. Loftus RW. Yeager MP. Clark JA. Brown JR. Abdu WA. Sengupta DK. Beach ML. Intraoperative Ketamine Reduces Perioperative Opiate Consumption in Opiate‑dependent Patients with Chronic Back Pain Undergoing Back Surgery. Anesthesiology. 2010;113 : 639-646.
40. Forget P, De Kock M. Could anaesthesia, analgesia and sympathetic modulation affect neoplasic recurrence after surgery? A systematic review centred over the modulation of natural killer cells aktivity Ann Fr Anesth Reanim 2009;28(9):751-768.
41. Afsharimani B, Cabot P, Parat MO. Morphine and tumor growth and metastasis. Cancer Metastasis Rev 2011;30(2):225-238.
42. Boland JW, Pockley AG. Influence of opioids on immune function in patients with cancer pain: from bench to bedside. Br J Pharmacol 2018;175(14):2726-2736.
43. Forget P, Leonard D, Kartheuser A, De Kock M. Endpoint selection and unreported analgesic use may render oncologic studies inconclusive. Anesthesiology 2011;114(3):717.
44. Hontoir S, Saxena S, Gatto P, Khalife M, Ben Aziz AM, Paesmans M et al. Opioid‑free anesthesia: what about pain comfort? A prospective, randomized controlled trial. Acta Anaesthesiol Belg 2016;67(4):183-190.
45. Beiler B, Barraud D, Vigneron J, Demoré B. Physicochemical stability of an admixture of lidocaine and ketamine in polypropylene syringe used in opioid‑free anaesthesia. Eur J Hosp Pharm. 2020;27(e1):e79-83.
46. Christen Renée Lahner. Adult weight measurement: decoding the terminology used in literature, South African Journal of Clinical Nutrition.2019;32 : 2,28-31.
47. Arumugam SL, Lau CSM, Chamberlain RS: Use of preoperative gabapentin significantly reduces postoperative opioid consumption: A meta‑analysis. J Pain Res 2016;9 : 631-640.
48. Chou R, Gordon DB, de Leon‑Casasola OA, Rosenberg JM, Bickler S, Brennan T et al. Management of postoperative pain: A clinical practice guideline from the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists’ Committee on Regional Anesthesia, Executive Committee, and Administrative Council. J Pain 2016;17 : 131-157.
49. The European Society of Regional Anaesthesia and Pain Therapy: Prospect. Available at: https://esraeurope.org/prospect/. Accessed June 14,2020.
50. Jeon S, Lee HJ, Do W, Kim HK, Kwon JY, Hwang BY et al. Randomized controlled trial assessing the effectiveness of midazolam premedication as an anxiolytic, analgesic, sedative, and hemodynamic stabilizer. Medicine (Baltimore). 2018;97:e12187.
51. Marsh BWM, Morton N, Kenny GN. Pharmacokinetic model driven infusion of propofol in children. Br J Anaesth. 1991;67 : 41-48.
52. Schnider TW, Minto CF, Gambus PL, Andresen C, Goodale DB,Shafer SL, Youngs EJ. The influence of method of administration and covariates on the pharmacokinetics of propofol in adult volunteers. Anesthesiology. 1998;88 : 1170-1182.
53. Beloeil H, Garot M, Lebuffe G, Gerbaud A, Bila J, Cuvillon P et al. Balanced Opoid‑free Anesthesia with Dexmedetomidine versus Balanced Anesthesia with Ramifentanil for Major or Intermediate Noncardiac Surgery. Anesthesiology 2021;134 : 541-551.
54. Forget P. Opioid‑free anaesthesia. Why and how? A contextual analysis. Anaesth Crit Care Pain Med 38(2019):169-172.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2022 Číslo 1- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Základní autorskoprávní aspekty v kontextu lékařských publikací
- Nové supraglotické pomůcky v klinické praxi
- Principy systémové bezopioidní anestezie a pooperační analgezie, naše zkušenosti u bariatrických chirurgických výkonů
- ČSARIM v roce 2022 – krátké ohlédnutí zpět a pohled dopředu
- Heparinem indukovaná trombocytopenie v perioperačním období
- Význam střevní mikrobioty u kriticky nemocných pacientů a možnosti jejího ovlivnění
- Perioperační neurokognitivní porucha – advanced narrative review
- Česká intenzivní medicína – výhledy do budoucnosti
- Anesteziologické možnosti ovlivnění přehlednosti operačního pole při endonazální chirurgii
- Tracheální intubace při vědomí u dospělých za použití různých optických technik – přehledný článek a metaanalýza
- Deficit butyrylcholinesterázy aneb „Pamatuji si na intubaci“
- Botulotoxin A pro bederní sympatickou blokádu při syndromu regionální chronické bolesti
- Kombinace „hypertonický roztok NaCl a furosemid“ v léčbě srdečního selhání – 20 let od konceptu k účinné (ale stále možná opomíjené) klinické intervenci
- Předoperační POCT ultrazvuk významně zpřesňuje zhodnocení křehkosti a pooperační perspektívy
- K článku: Prevence venózní tromboembolie u pacientů v intenzivní péči
- Funkční kvalita života po zresuscitované nitronemocniční srdeční zástavě
- Odpověď autorů K článku: Prevence venózní tromboembolie u pacientů v intenzivní péči
- Doporučení Evropské kardiologické společnosti (ESC) pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2021
- Desatero přikázání pro léčbu srdečního selhání podle ESC 2021
- Praxe podávání systémových kortikosteroidů kriticky nemocným pacientům s covidem-19 v České republice – dotazníkový průzkum (studie ASAP‑ C)
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Principy systémové bezopioidní anestezie a pooperační analgezie, naše zkušenosti u bariatrických chirurgických výkonů
- Deficit butyrylcholinesterázy aneb „Pamatuji si na intubaci“
- Nové supraglotické pomůcky v klinické praxi
- Význam střevní mikrobioty u kriticky nemocných pacientů a možnosti jejího ovlivnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



