-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
Vitamin D supplementation as an important factor in COVID-19 prevention and treatment: what evidence do we have?
The immunomodulatory effect of vitamin D and its potential in prevention and treatment of acute respiratory infections have long been of interest to many scientific teams around the world. Several meta-analyses in the last 10 years have confirmed the protective (albeit of modest size) effect of vitamin D against respiratory infections. Because of many overlapping risk factors for vitamin D deficiency and severe COVID-19 infection, many experts believe that vitamin D supplementation could play an important role in prevention and treatment of the new coronavirus disease. Based on available data on the immunological action of vitamin D, it is possible that vitamin D could modulate the body‘s response to SARS-CoV-2 infection both in the early viraemic phase and in later hyperinflammatory phase typical for the severe course of the disease. The first available data from epidemiological studies suggest that low serum vitamin D levels are associated with increased susceptibility to the new coronavirus infection as well as with severe course of the disease.
Keywords:
acute respiratory infection – cathelicidin – COVID-19 – prevention – SARS -CoV-2 – treatment – vitamin D – 25(OH)D
Autoři: Juraj Smaha; Martin Kužma; Peter Jackuliak; Juraj Payer
Působiště autorů: V. interná klinika LF UK a UN Bratislava, Slovenská republika
Vyšlo v časopise: Vnitř Lék 2020; 66(8): 494-500
Kategorie: Přehledové články
Souhrn
Imunomodulačné účinky vitamínu D a jeho potenciál v prevencii a liečbe akútnych respiračných ochorení sú už dlhšie predmetom záujmu mnohých vedeckých tímov po celom svete. Viacero meta -analýz v posledných 10 rokoch potvrdilo protektívny (hoci iba mierny) účinok vitamínu D voči akvirovaniu respiračných infekcií. Vzhľadom k mnohým prekrývajúcim sa rizikovým faktorom deficitu vitamínu D a ťažkého priebehu infekcie COVID-19 mnohí odborníci uvažujú o tom, že suplementácia vitamínom D by mohla hrať dôležitú úlohu v prevencii a liečbe ochorenia vyvolaného novým koronavírusom. Na základe dostupných dát o imunologickom pôsobení vitamínu D je možné, že vitamín D by mohol modulovať odpoveď organizmu na infekciu vírusom SARS -CoV-2 tak vo včasnej viremickej fáze, ako aj v neskorej hyperinflamačnej fáze typickej pre ťažký priebeh ochorenia. Prvé dostupné dáta z epidemiologických štúdií ukazujú, že nízka koncentrácia sérového vitamínu D je asociovaná so zvýšenou vnímavosťou k akvirácii nového koronavírusu a aj s ťažším priebehom ochorenia COVID-19.
Klíčová slova:
akútna respiračná infekcia – cathelicidín – COVID-19 – liečba – prevencia – SARS -CoV-2 – vitamín D – 25(OH)D
Úvod
Záujem o vplyv vitamínu D na respiračný systém a jeho možné protektívne účinky voči respiračným nákazam možno datovať až do roku 1930, kedy sa skúmalo, či by zvýšená konzumácia oleja z treščích pečení nemohla prispieť k zníženiu počtu dní pracovnej neschopnosti u zamestnancov tovární pre respiračné infekcie horných dýchacích ciest (1). O takmer sto rokov neskôr, v čase pandémie ochorenia COVID-19, záujem o vitamín D v súvislosti s respiračnými infekciami opäť vzrastá. Momentálne sme prakticky každý týždeň svedkami narastajúceho počtu publikácií, ktoré poukazujú na vzťah medzi nízkou koncentráciou vitamínu D v sére a vyšším rizikom ochorenia na COVID-19 a jeho závažnejším priebehom. Vzhľadom k minimálnej invazívnosti, dostupnosti a cene, by mohla suplementácia vitamínu D zohrávať významnú úlohu v manažmente tohto nového infekčného respiračného ochorenia. V nasledujúcom texte uvádzame súhrn súčasných poznatkov o vplyve vitamínu D na imunitný systém respiračného traktu, vzťahu medzi vitamínom D a bežnými respiračnými ochoreniami a prvé publikované dáta o vzťahu medzi nízkou koncetráciou sérového vitamínu D a infekciou COVID-19.
Vplyv vitamínu D na imunitný systém respiračného traktu
Vitamín D by mohol ovplyvniť odpoveď organizmu na SARS‑CoV-2 vo včasnej viremickej fáze a aj v neskorej hyperinflamačnej fáze, typickej pre ťažšiu formu ochorenia COVID-19 tromi mechanizmami:
- udržiavanie a ochrana medzibunkových spojení respiračného epitelu,
- zvýšená produkcia cathelicidínov a defenzínov,
- zníženie produkcie prozápalových cytokínov (utlmenie cytokínovej búrky pri ťažkom priebehu COVID-19).
Enzým 1-α‑hydroxyláza, ktorý katalyzuje posledný krok syntézy aktívnej formy vitamínu D (1,25(OH)D3), je okrem parenchýmu obličky vo významnej miere syntetizovaný aj v respiračnom trakte: v epitelových bunkách dýchacích ciest, alveolárnych makrofágoch, dendritických bunkách a lymfocytoch (2). Alveolárne makrofágy boli dokonca prvé ľudské bunky, u ktorých sa dokázala extrarenálna aktivita 1-α‑hyd ‑ roxylázy (jednalo sa o alveolárne makrofágy izolované od niektorých pacientov so sarkoidózou, hyperkalciémiou a vysokými koncentráciami sérového vitamínu D) (3). 1,25(OH)D3 je produkovaný lokálne v respiračnom trakte a autokrinným a parakrinným spôsobom ovplyvňuje proliferáciu, diferenciáciu a maturáciu buniek. Na lokálnu produkciu aktívnej formy vitamínu D má väčší regulačný efekt dostupnosť 25(OH) D v sére a indukcia 1-α‑hydroxylázy v bunkách respiračného systému infekčným agens, než mechanizmy „klasickej“ regulácie minerálovej homeostázy: aktivita 1-α‑hydroxylázy v obličke, koncentrácia parathormónu a fibroblastového rastového faktora 23 (4). Lokálna produkcia vitamínu D priamym aj nepriamym spôsobom ovyplvňuje vrodenú (respiračný epitel, alveolárne makrofágy, dendritické bunky) aj získanú (T - a zrejme aj B‑lymfocyty) imunitnú odpoveď (5). Epitelové bunky respiračného traktu dokážu „skladovať“ vitamín D a v prípade potreby zvýšením syntézy 1-α‑hydroxylázy aj lokálne zvýšiť produkciu a koncen ‑ tráciu 1,25(OH)D3, ktorá môže lokálne presahovať koncentráciu vitamínu D v sére (6). K zvýšeniu syntézy 1-α‑hydroxylázy v respiračnom trakte dochádza napríklad v dôsledku akútne prebiehajúcej vírusovej infekcie. Odpoveď organizmu na vstup vírusu do bunky je realizovaná signálnou dráhou mediovanou cez tzv. toll‑like receptory (TLR). TLR hrajú kľúčovú úlohu pri rozpoznaní patogénu v skorej fáze vírusovej infekcie. Sú to receptory exprimované na bunkových membránach a intracelulárnych vezikulách, ktoré rozpoznávajú s patogénom a s poškodením asocio ‑ vané molekulárne vzory (PAMPs a DAMPs) (7). Imunomodulačný vplyv vitamínu D sa z veľkej miery vysvetľuje práve modulovaním funkcie týchto receptorov. Ako odpoveď na vírusové antigény heterodimér TLR 1/2 aktivuje syntézu 1-α‑hydroxylázy a receptora pre vitamín D (VDR) v makrofágu. 25(OH)D naviazaný na vitamín D viažúci proteín umožní vstup voľnej frakcie 25(OH)D intracelulárne. V mikroprostredí alveolárneho makrofágu následne dochádza ku konverzii 25(OH)D prostredníctvom aktivity 1-α‑hydroxylázy na aktívnu formu vitamínu D, ktorý sa následne viaže na VDR (8). Transkripčná odpoveď bunky vedie k indukcii syntézy cathelicidínov a beta‑defenzínov, ktorá následne stimuluje expresiu kľúčových faktorov autofágie (napr. Beclin 1, LC3) (9). Adekvátna lokálna koncentrácia vitamínu D vedie vyššie uvedeným mechanizmom v konečnom dôsledku aj k zvýšeniu syntézy NO, zvýšeniu koncentrácie intracelulárneho vápnika a stimulácii enzýmu PI3KC3, čo sú ďalšie známe mechanizmy podporujúce autofágiu a tvorbu autofagozómov (9). Autofágia je kľúčový obranný mechanizmus bunky pred vírusovou infekciou. Pri autofágii dochádza k opúzdrení vírusových častíc, ich lyzozomálnej degradácii a následnej prezentácii antigénu v snahe indukovať adaptívnu antivírusovú imunitnú odpoveď (10). Lokálna nad ‑ produkcia 1,25(OH)D3 (respiračný epitel, alveolárne makrofágy) vedie aj k zvýšeniu odolnosti bariérovej funkcie respiračného epitelu (napríklad prostredníctvom E‑cadherínu) a priamo bráni lipopolysacharidmi indukovanému akútnemu poškodeniu pľúc a rozvoju ARDS (11). Vitamín D ovpylvňuje už spomínanú syntézu defenzínov a antimikrobiálneho peptidu cathelicidínu, ktorého antimikrobiálna úloha bola opísaná najmä v súvislosti s infekciou Mycobacterium tuberculosis, ale dáta existujú aj pre antimikrobiálne pôsobenie cathelicidínu proti gram‑negatívnym a gram‑pozitívnym baktériám, vírusom a mykotickým infekciám (12). Vitamín D môže ovplyvňovať aj dendritické bunky respiračného traktu, ktoré hrajú kľúčovú úlohu v iniciácii a regulácii adaptívnej imunitnej odpovede. Aktívna forma vitamínu D inhibuje diferenciáciu a maturáciu dendritických buniek tým, že znižuje syntézu MHC molekúl II. triedy čo vedie k zníženiu syntézy IL-12 a zvýšeniu produkcie IL-10 (13). Tieto zmeny majú za následok nasmerovanie T‑bunkovej imunitnej odpovede smerom k hyporesponzivite a k tvorbe regulačných T‑lymfocytov, čo podľa viacerých autorov vysvetľuje niektoré z imunosupresívnych účinkov vitamínu D. (14) Vitamín D neovplyvňuje T‑lymfocyty iba nepriamo prostredníctvom dendritických buniek ale má priamy vplyv na T‑lymfocyty a je možné, že aj na B‑lymfocyty. Aktivované T - aj B‑lymfocyty exprimujú na svojom povrchu receptor pre vitamín D (VDR) aj 1-α‑hydroxylázu, takisto v nich dochádza ku konverzii 25(OH)D na 1,25(OH)D3. (15) Efekt 1,25(OH)D3 na adaptívny imunitný systém je komplexný a vedie najmä k produkcii IL-10 regulačnými T‑lymfocytmi a tým zrejme potencuje imunosupresívnu reakciu organizmu (IL-10 je hlavný „protizápalový“ cytokín, ktorý inhibuje Th1 aj Th2 imunitnú odpoveď) (16). Nízke sérové koncentrácie 25(OH)D sú napríklad asociované s TLR – mediovanou prehnanou autoimunitnou reakciou a ťažším priebehom ochorenia u pacientov so systémovým lupus erythematosus (17). Aktívna forma vitamínu D vedie pri odpovedi na infekciu S aureus ku zníženej syntéze s TLR2 asociovaných prozápalových cytokínov (TNF‑α, IL-1β) a zvýšeniu syntézy protizápalového cytokínu IL-10 (18). Deficit vitamínu D je asociovaný s up‑reguláciu TLR2 a TLR4 čo je spojené s patologickým pro‑inflamačným stavom pri infekcii Aspergillus fumigatus alebo infekcii Herpes simplex (19, 20). Imunosupresívny efekt vitamínu D je pravdepodobne veľmi dôležitý aj v prevencii rozvoja cytokínovej búrky pri ťažkých pľúcnych infekciách vírusovej etiológie. Cytokínová búrka je výsledkom dysregulovanej, prehnanej imunitnej odpovede organizmu na infekčný agens s nadprodukciou prozápalových cytokínov (IL-1, IL-2, IL-6, IL-12, TNF‑α, IFN‑γ). To vedie k nadmernej akumulácii prozápalových buniek (neutrofily, monocyty, makrofágy, aktivovné T‑lymfocyty), apoptóze epitelových buniek alveolov a endotelových buniek drobných ciev s rozvojom nekardiogénneho pľúcneho edému a hyperkoagulačného, protrombotického stavu (21). Recentná ex vivo štúdia napríklad preukázala, že suplementácia 4000 IU vitamínu D denne vedie prostredníctvom zníženia expresie TLR 3, TLR 7, TLR 9 k zníženiu prozápalových cytokínov IL-12 a IL-8, k zvýšeniu protizá ‑ palového cytokínu IL-10 a k miernejšiemu priebehu horúčky dengue (22). Cytokínová búrka je považovaná aj za jednu z hlavných príčin mortality a morbidity ochorenia COVID-19. Experimentálne práce, ktoré by skúmali vplyv vitamínu D špecificky v súvislosti s infekciou novým koronavírusom zatiaľ z pochopiteľných dôvodov nemáme k dispozícii. Jedna štúdia (zatiaľ nerecenzovaná) však preukázala inhibičný efekt 1,25(OH)D3 na replikáciu vírusu SARS‑CoV-2 v epitelových bunkách sliznice nosovej dutiny. (23) Niektoré štúdie na animálnych modeloch v minulosti preukázali, že imunomodulačný efekt vitamínu D je v kontexte respiračných ochorení mediovaný reguláciou renín‑angiotenzín‑aldeosterónového systému (RAAS) (24). Tento poznatok je dôležitý, pretože pri ochorení COVID-19 sa práve hyperreaktivita systému RAAS spája s veľmi zlou prognózou. V najlbižších mesiacoch môžeme určite očakávať viacero nových štúdií, ktoré sa budú snažiť bližšie objasniť vyššie uvedené patomechanizmy.
Vitamín D a respiračné infekcie
Rôzna incidencia respiračných ochorení počas jednotlivých ročných období je dobre známa. Okrem variability infekcií respiračného traktu je známa aj sezónna variabilita sérových koncentrácií vitamínu D. Vitamín D získavame v menšej miere v strave a vo väčšej miere ožiarením 7-dehydrocholesterolu v koži slnečným UVB žiarením o vlnovej dĺžke 290–315 nm. Počas zimných mesiacov v našich geografických podmienkach dochádza k nižšej expozícii slnečnému UVB žiareniu, a tým klesá syntéza vitamínu D v koži (25). Keďže diéta väčšiny európskej populácie neobsahuje dostatočné množstvo vitamínu D, ktoré by dokázalo nahradiť chýbajúcu syntézu v koži, deficit vitamínu D je v populácii častejší a jeho miera závažnejšia práve počas zimných mesiacov (26). Vzťah medzi vyšším výskytom respiračných infekcií a nízkymi sérovými koncentráciami vitamínu D počas zimných mesiacov sa preto stal predmetom výskumu. Viacero observačných štúdií v minulosti preukázalo asociáciu nielen medzi nízkou sérovou koncentráciou 25(OH)D a vyšším rizikom akvirácie akútnej respiračnej infekcie vrátane chrípky, ale aj zvýšenou mortalitou a morbiditou na respiračné infekcie, vyššou prevalenciou ARDS a dlhším trvaním umelej pľúcnej ventilácie či vyšším rizikom rozvoja sepsy u kriticky chorých pacientov (27). Existuje však málo dát z randomizovaných placebom kontrolovaných štúdií, ktoré by preukázali kauzálny vzťah medzi nízkou koncentráciou 25(OH)D a rizikom rozvoja akútnej respiračnej infekcie. K častejším respiračným infekciám počas zimných mesiacov môže prispievať viacero iných faktorov, ako napríklad väčšie množstvo času stráveného v interiéri, čo zvyšuje množstvo interpersonálnych kontaktov v relatívne obmedzenom priestore, či chladnejšie počasie s relatívne vyššou vlhkosťou, ktorá umožňuje vírusovým časticiam dlhšie pretrvať mimo tela hostiteľa (28). Deficit aj iných minerálov a stopových prvkov so známym vplyvom na imunitný systém, napríklad deficit vitamínu C, selénu, či zinku sa môže tiež podieľať na zvýšenej prevalencii respiračných infekcii počas zimných mesiacov (29, 30). Zo šiestich meta‑analýz dát z randomizovaných kontrolovaných štúdií skúmajúcich, či suplementácia vitamínom D znižuje riziko akvirácie respiračnej infekcie, tri meta‑analýzy preukázali štatisticky signifikantný protektívny efekt a tri meta‑analýzy nepreukázali žiadny protektívny efekt vitamínu D (31). V poslednej dobe v literatúre často citovaný systematický prehľad a meta‑analýza z roku 2017 ukázala, že suplementácia vitamínom D znižuje riziko akútnej respiračnej infekcie, pričom najväčší benefit majú pacienti s najťažším deficitom 25(OH)D (31). Lanham‑New a kol. vo svojej práci zdôrazňujú viaceré limitácie tejto meta‑analýzy. Rovnako ako pri ostatných meta‑analýza aj pri tej z roku 2017 je množstvo heterogénnych zistení, pričom v tejto meta‑analýze celkové výsledky ovplyvňujú aj dáta získané z dvoch štúdií z Mongolska a z Pakistanu, kde bola do štúdií zahrnutá špecifická populácia, z ktorej získané dáta by nemali byť extrapolované na populácie z rozvinutých krajín EÚ. Efektivita mnohých terapeutic ‑ kých intervencií je totiž v štúdiách konzistentne výrazne úspešnejšia u menej rozvinutých krajín v porovnaní s rozvinutejšími krajinami (26). Ďalšou významnou skutočnosťou je fakt, že samotná definícia respiračnej infekcie sa medzi jednotlivými štúdiami významne líšla,
pričom v mnohých štúdiách sa za pacientov s respiračnou infekciou považovali aj tí, ktorí si ju „samodiagnostikovali“. Najnovšia meta‑analýza randomizovaných kontrolovaných štúdií z rokov 2007–2020 potvrdila mierny protektívny efekt vitamínu D voči akvirácii akútnej respiračnej infekcie. Autori však ako limitáciu opäť zdôrazňujú rôznorodosť v dizajne jednotlivých štúdií (32). Hoci dáta o preventívnej funkcii vitamínu D voči akvirovaniu respiračnej infekcie sú sľubné, z hľadiska terapeutických možností vitamínu D u ťažko chorých pacientov s respiračnými infekciami máme zatiaľ menej presvedčivé dáta. Intervenčné štúdie doteraz nepreukázali významnejší „terapuetický“ efekt vysokých dávok vitamínu D na priebeh ochorenia. Vysoké dávky 1,25(OH)D3 (25 000–50 000 IU denne 5 dní) ani bolusová jednorazová dávka 540 000 IU podaná do 12 hod. od prijatia u vitamín D deficientných pacientov neviedla k zníženiu mortality alebo doby hospitalizácie, či času stráveného na umelej pľúcnej ventilácii (33, 34). Niektorí autori preto považujú nízku koncentráciu 25(OH)D „iba“ za marker závažnosti ochorenia, bez vplyvu na samotnú patofyziológiu ochorenia. Iní autori zdôrazňujú, že vitamín D je zrejme molekulou, ktorá nemá „akútny efekt“ na imunitné funkcie, tento benefit sa stráca, ak pacient nemá dlhodobo suficientnú hodnotu 25(OH)D. Viac informácii o tejto problematike by mohli priniesť výsledky práve prebiehajúcej štúdie VITDALIZE u kriticki chorých pacientov s ťažkým deficitom 25(OH)D v sére. Tímto pacientom je podávaná bolusová nasycovacia dávka 540 000 IU a následne udržiavacia dávka 4000 IU dlhodobo. Prvé výsledky tejto štúdie sa očakávajú v prvej polovici roku 2021 (35).
Vitamín D a ochorenie COVID-19
Okrem už spomínaných patofyziologických a imunologických údajov o pôsobení vitamínu D vo vzťahu k respiračným infekciám sa veľký záujem o vitamín D v súvislosti s ochorením COVID-19 spája aj pre pozoruhodné prekrývanie sa rizikových faktorov (napr. vyšší vek, obezita, diabetes mellitus 2. typu) ťažkého deficitu vitamínu D a ťažkého priebehu ochorenia COVID-19. Dve nedávno publikované štúdie preukázali inverznú koreláciu medzi hodnotou 25(OH)D v sére a morbiditou a mortalitou na ochorenie COVID-19. Laird et al skúmali vzťah medzi hladinou 25(OH)D v sére a prevalenciou ochorenia COVID-19 v 12 európskych krajinách (36). Pre potreby štúdie bol „deficit“ vitamínu D definovaný hodnotou < 25 nmol/l (10 ng/ml) a < 30 nmol/l (12 ng/ml) (v závislosti od krajiny) a „nízka hodnota“ vitamínu D hodnotou < 50 nmol/l (20 ng/ml). Krajiny s formálne ustanovenou zdravotnou politikou ohľadom fortifikácie potravín vitamínom D (napr. Fínsko, Nórsko) mali signifikantne nižší počet infikovaných pacientov než „slnečné“ krajiny juhu Európy. Španielsko a Taliansko (najmä jeho severná časť) mali paradoxne obyvateľstvo s najnižšími hodnotami 25(OH)D v sére. Tieto krajiny mali zároveň najvyšší počet infikovaných pacientov vírusom SARS‑CoV-2 a aj najvyšší počet obetí ochorenia COVID-19. Autori v závere štúdie uvádzajú, že koncentrácie 25(OH)D v sére sa zdajú byť asociované so zvýšenou mortalitou na ochorenie COVID-19, pričom krajiny bez formálne ustanovenej politiky ohľadom fortifikácie potravín vitamínom D sú najzávažnejšie postihnuté deficitom vitamínu D a aj pandémiou ochorenia COVID-19. Ilie et al. v podobnej štúdii na základe údajov z 20 krajín Európskej únie preukázali negatívnu koreláciu medzi priemernou hodnotou sérového 25(OH)D v populácii a počtom prípadov aj obetí na COVID-19 prepočítaných na milión obyvateľov. Napríklad na Slovensku bola priemerná hodnota 25(OH)D 81,5 nmol/l (32,65 ng/ml) a počet úmrti asociovaných s COVID-19 prepočítaných na milión obyvateľov bol 0,4, v Španielsku bola hodnota 25(OH)D 42,5 nmol/l (17,03 ng/ml) a počet úmrtí prepočítaných na milión obyvateľov bol 314. (37) Prevalencia deficitu vitamínu D v pandémiou COVID-19 najťažšie zasiahnutých oblastiach sveta k 14. aprílu 2020 je uvedená v Tab. 1. (38)
Tab. 1. Prehľad regiónov naťažšie zasiahnutých ochorením COVID-19 a statusu vitamínu D v populácii týchto regiónov k aprílu 2020. Upravené podľa Ebadi M, et al. European Journal of Clinical Nutrition, 2020 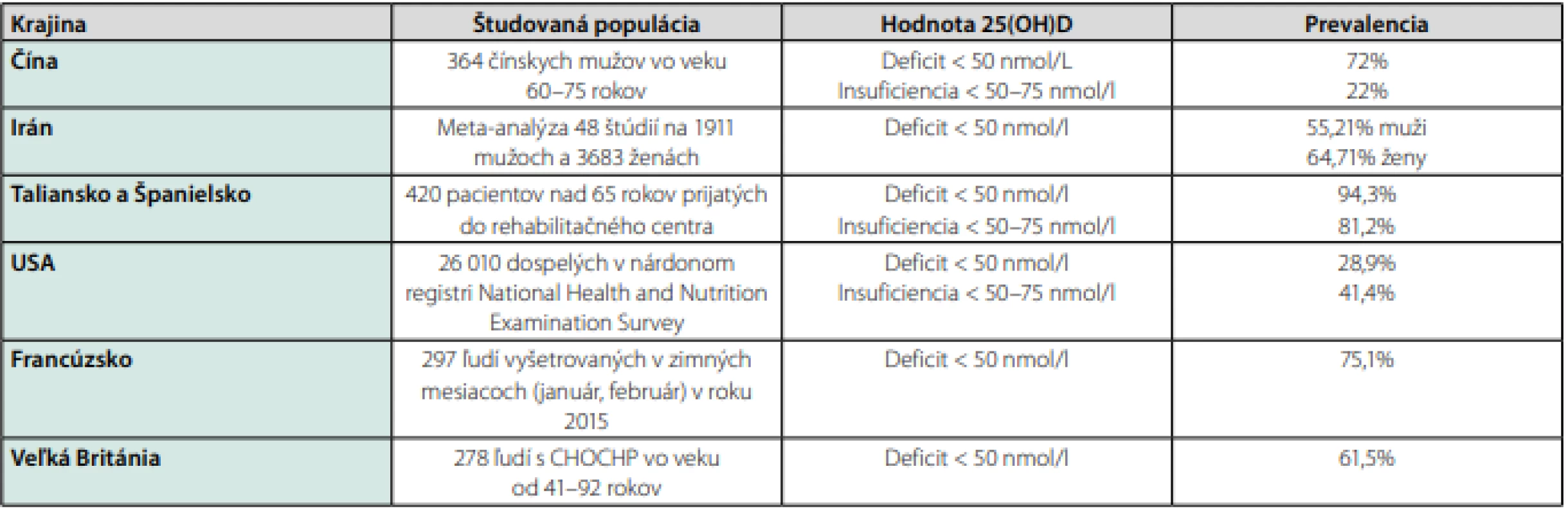
Nízka hodnota 25(OH)D sa zdá byť tiež asociovaná s vyššou vnímavosťou ku SARS‑CoV-2 a ťažším priebehom ochorenia COVID-19. V štúdií zo Švajčiarska D’Avolio et al. retrospektívne hodnotili koncentrácie 25(OH)D u pacientov s pozitívnym PCR testom na SARS‑CoV-2 a u pacientov s negatívnym PCR testom. Štúdia preukázala štatisticky významný rozdiel v koncentráciách 25(OH)D medzi pozitívne testovanými pacientmi (medián 25(OH)D 11,1 ng/ml (27,71 nmol/l)) a medzi pacientmi s negatívnym testom na SARS‑CoV-2 (medián 25(OH)D 24,6 ng/ml (61,4 nmol/l)) (39). Izraelská štúdia na pomerne veľkom súbore 7 807 testovaných pacientov na COVID-19 preukázala signifikantne vyššie riziko hospitalizácie (takmer dvojnásobné) SARS‑CoV-2 pozitívnych pacientov s nízkou hodnotou 25(OH)D v sére aj po úprave súboru z hľadiska veku pacientov, pohlavia a komorbidít. Autori preto považujú nízku koncentráciu 25(OH)D za nezávislý ri ‑ zikový faktor závažnosti priebehu ochorenia COVID-19 (40). Štúdia z Veľkej Británie (UK biobank) síce neupreukázala vzťah medzi nízkou koncentráciou 25(OH)D a zvýšeným rizikom akvirácie SARS‑CoV-2, avšak v tejto štúdii nebol preukázaný ani vzťah medzi „tradičnými“ rizikovými faktormi pre COVID-19 ako sú diabetes mellitus či artériová hypertenzia (41). Významná limitácia tejto štúdie však spočíva v tom, že dáta o hodnotách sérových koncentrácií 25(OH)D u pacientov testovaných na COVID-19 získavala z registra vedeného v rokoch 2006-2010. Za 10 rokov sa pritom mohlo zmeniť množstvo faktorov životného štýlu ovplyvňujúcich hodnoty vitamínu D a hodnoty z rokov 2006-10 nemuseli u týchto pacientov nutne reflektovať status viatmínu D v reálnom čase pandémie. Štúdia Metzlera a kol. zo Spojených štátov sa snažila vyhodnotiť čo najrecentnejšie koncentrácie 25(OH)D v sére (rok predchádzajúci začiatku pandémie COVID-19). U pacientov vitamín D deficientných bolo signifikantné, 1,77 násobne vyššie riziko pozitívneho testu na SARS‑CoV-2. Vek nad 50 rokov, deficit vitamínu D a iná ako biela rasa boli v tejto štúdii aj po úprave súboru považované za nezávislé rizikové faktory akvirácie SARS‑CoV-2 (42). Nízka hodnota sérového vitamínu D by mohla hrať rolu aj v závažnosti priebehu infekcie COVID-19. V štúdii z Anglicka Panagiotou et al merali sérové koncentrácie 25(OH)D vstupne u všetkých pacientov prijatých do nemocnice s ochorením COVID-19. Väčšina pacientov mala určitú mieru deficitu vitamínu D, pacienti prijatí na JIS mali nižšie hodnoty 25(OH) D než pacienti, ktorí boli prijatí na štandardné lôžko napriek tomu, že pacienti prijatí na JIS boli väčšinou mladší (43). U pacientov s hodnotou 25(OH)D aspoň 30 ng/ml (74,88 nmol/l), pre potreby štúdie označených ako „vitamín D suficientných“, bola preukázaná signifikantne redukovaná závažnosť priebehu ochorenia COVID-19, nemocničná mortalita aj hodnota CRP. U ľudí nad 40 rokov v sledovanom súbore ochoreniu podľahlo 9,7% pacientov „vitamín D suficientných“ a 20% pacientov „vitamín D insuficientných“ (44).
Vysoké dávky vitamínu D ako prevencia a liečba COVID-19?
Vo všeobecnosti možno povedať, že najviac ohrozenými skupinami z hľadiska akvirácie ochorenia COVID-19 a jeho závažnejšieho priebehu sú ľudia starší ako 70 rokov, obézni ľudia, pacienti s chronickými ochoreniami, seniori umiestených v domovoch sociálnych služieb – všetko skupiny obyvteľstva, u ktorých je prevalencia závažného deficitu vitamínu D dobre zdokumentovaná. Nemožno opomenúť ani zvýšené riziko pre zdravotnícky personál. K 5. júlu 2020 zomrelo v dôsledku ochorenia COVID-19 celosvetovo viac než 3 000 zdravotníckych pracovníkov (45). Nižšie hodnoty 25(OH)D môžu byť spojené s vyšším rizikom získania nozokomiálnej nákazy (46). Krátko po vypuknutí pandémie a publikovaní prvých dát o asociácii medzi deficitom vitamínu D a COVID-19 sa preto objavili práce s odporúčaniami v podávaní vysokých dávok vitamínu D za účelom rýchleho zvýšenia sérovej koncetrácie 25(OH)D ako možnej prevencie a liečbe COVID-19 u rizikových skupín pacientov. Grant a kol. vo svojej práci odporúčajú denne užívať 10 000 IU vitamínu D3 niekoľko týždňov, následne 5000 IU denne v snahe rýchlo zvýšiť koncetráciu 25(OH)D v sére. Na základe dostupných dát možno uviesť, že riziko akvirovania respiračnej infekcie významne klesá pri hodnote 25(OH)D 30 ng/ml (74,88 nmol/l), koncentrácie okolo 40–50 ng/ml (100–125 nmol) sú asociované s redukciou rizika nozokomiálnej infekcie (47). Grant a kol. počas pandémie COVID-19 odporúča udržiavať koncentrácie 25(OH)D na úrovni 40–60 ng/ml (100–150 nmol/l) u všetkých pacientov hospitalizovaných v nemocnici a u zdravotníckeho personálu (47). Ďalšia práca v snahe znížiť závažnosť ochorenia COVID-19 doporučuje schému s nasycovacou dávkou 200 000 až 300 000 IU v 50 000 IU kapsulách (48). Niketorí autori pred týmito odporúčaniami varujú, pretože nie sú založené na dostatočnom množstve kvalitných dát z intervenčných štúdií (randomizované placebom kontrolované štúdie). Martineau a kol dokonca poukázali na fakt, že bolus vysokých dávok vitamínu D môže byť menej efektívny v prevencii akútnych infekcií respiračného traktu, zrejme pre rýchlejší metabolizmus vitamínu D na neúčinné katabolity po podaní vysokej dávky (31). Veľké bolusy vitamínu D podané v relatívne krátkom čase môžu paradoxne viesť k negatívnemu imunosupresívnemu účinku (zníženie proliferatívnej schopnosti neutrofilov, zvýšenie fosfátu a FGF23 – inhibícia aktívacie preukorza aktívnej formy vitamínu D) (49, 50). Odborné spoločnosti sú v odporúčaniach pre podávanie vysokých dávok vitamínu D v prevencii a liečbe ochorenia COVID-19 zdržanlivejšie. Národný inštitút zdravia vo Veľkej Británii publikoval odporúčania v ktorých uvádza, že preparáty vitamínu D nie sú schválené pre prevenciu a liečbu žiadnych infekčných respiračných ochorení vrátane COVID-19. Zároveň však autori v týchto odporúčaniach pripúšťajú, že počas pandémie COVID-19 sa prevalencia deficitu vitamínu D môže zvýšiť najmä u starších ľudí, ktorí v rámci vyhýbania sa blízkym kontaktom strávia väčšinu dňa v interiéri (nedostatočná expozícia slnečnému žiareniu) (51). Optimalizácia prísunu vitamínu D, okrem toho, že sa vo všeobecnosti javí ako bezpečná a efektívna forma prevencie respiračných ochorení, je najmä esenciálnym komponentom manažmentu metabolických ochorení skeletu (52). Podľa konsenzu odborných spoločností môže väčšina pacientov počas pandémie za účelom zabezpečenia optimálneho fungovania muskuloskeletálneho systému bezpečne prijať 400–1 000 IU vitamínu D denne v jedle a/alebo vo forme preparátov vitamínu D (53). Treba však podotknúť, že mnohé štúdie nepreukázali účinné zvýšenie koncentrácie 25(OH)D v sére pri užívaní dávky 400–1 000 IU vitamínu D u zdravých, nieto ešte u akútne chorých, či polymorbídnych pacientov obzvlášť v oblastiach s menším počtom slnečných dní. Vo všeobecnosti možno povedať, že 1000 IU vitamínu D denne zvýši sérovú koncentráciu 25(OH)D o 10 ng/ml (25 nmol/l) (54). Na základe zatiaľ dostupných dát je preto vhodné zvážiť počas pandémie ochorenia COVID-19 suplementáciu pacientov so známou hodnotou 25(OH)D pod 10 ng/ml (25 nmol/l) dávkou 4 000 IU denne (najvyššou možnou odporúčanou dávkou podľa Institue of Medicine a Endocrine Practice Guidelines Committee z „muskuloskeletálnej indikácie“) v snahe zvýšiť koncentráciu 25(OH)D aspoň na 30 ng/ml (74,88 nmol/l) (55). V častiach populácie so známou vysokou prevalenciou deficitu vitamínu D treba zvážiť podávanie aspoň 1000-2000 IU/denne aj bez nutnosti rutinného stanovenia a monitoringu sérovej koncentrácie 25(OH)D v sére (56). V prípade užívania dávok 4000 IU denne sa doporučuje laboratórny monitoring za účelom zabránenia možnej toxicite a nežiadúcim účinkom. Práve pre potenciálnu toxicitu vitamínu D mnohí autori varujú pred podávaním vysokých dávok v prevencii/liečbe COVID-19. K intoxikácii vitamínom D však môže podľa literárnych údajov dôjsť až pri dávkach väčších ako 50 000 IU denne alebo pri dlhodobom užívaní dávok väč ‑ ších ako 10 000 IU a pri hodnotách 25(OH)D v sére viac ako 200 ng/ml (500 nmol/l) (57). Prejavy intoxikácie sú zväčša spojené s hyperkalciémiou a hyperfosfatémiou. Megadávky vitamínu D u starších mužov a žien môžu byť spojené aj s vyššou prevalenciou fraktúr a pádov (58). Vysoké dávky vitamínu D podávané v štúdií VITDAL‑ICU pacientom hospitalizovaných na jednotkách intenzívnej starostlivosti (perorálny cholekalciferol až do jednorázovej dávky 540000 IU, následne 90000 IU mesačne počas piatich mesiacov) však neviedli k významnému počtu nežiadúcich účinkov. Hyperkalciémia sa objavila iba u 1 % pacientov, pričom u všetkých pacientov išlo o asymptomatickú hyperkalciémiu. Hodnoty vitamínu D v sére však boli aj v skupine pacientov liečených megadávkami hlboko pod hodnotu asociovanou s akútnou toxicitou (150 ng/ml resp. 374 nmol/l) (59). Väčšina autorov považuje dávky do 10 000 IU denne (najviac však po dobu 5 mesiacov vzhľadom k publi ‑ kovaným dátam) za bezpečné. Rutinnú laboratórnu kontrolu však treba vždy zvažovať u pacientov s nestabilnými renálnymi parametrami, s pokročilým obličkovým ochorením, s malabsorpciou, s hypoparatyreózou a u pacientov užívajúcich slučkové diuretiká (60).
Záver
Do dnešného dňa je registrovaných viacero štúdií, ktoré sa budú v priebehu nasledujúcich mesiacov snažiť preukázať efekt vitamínu D v prevencii a liečbe infekcie COVID-19. Jednou z nich je napríklad COVIDENCE UK study s cieľom aspoň na 12000 pacientoch preskúmať vplyv diéty a životného štýlu na riziko prenosu SARS‑CoV-2, závažnosť infekcie COVID-19, dobu rekonvalescencie a neskoré následky infekcie.
Veľmi dôležité je opakovane zdôrazniť potrebu adekvátneho denného prísunu vitamínu D podľa odporúčaní odborných spoločností (400–1000 IU denne v závislosti od veku). Tieto odporúčania existujú na základe presvedčivých údajov o benefite vitamínu D na muskuloskeletálny systém (61). V kontexte prebiehajúcej pandémie COVID-19 sa však každým dňom objavuje viac dát o tom, že vitamín D by mohol zmierniť celospoločenský dopad pandémie najmä u skupín pacientov, kde je jeho deficit najzávažnejší (čo je zároveň populácia najviac náchylná na ťažký priebeh infekcie COVID-19). U týchto pacientov je rozumné počas pandémie ochorenia COVID-19 zvážiť podávanie vyšších dávok vitamínu D z „off label“ indikácie, horná hranica dennej dávky by mohla byť 4000 IU (najvyššia odporúčaná dávka z „muskuloskeletálnej“ indikácie) minimálne do objavenia sa väčšieho množstva dát z prospektívnych, intervenčných štúdií (randomizované placebom kontrolované štúdie). Vitamín D zrejme nebude „zázračnou molekulou“ ale iba jedným z viacerých faktorov ovplyvňujúcich priebeh a závažnosť ochorenia COVID-19. Adekvátna suplementácia vitamínom D je však z celospoločenského hľadiska jednoduché, lacné a bezpečné opatrenie s potenciálnym významným zdravotným benefitom.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Juraj Smaha,
V. interná klinika LF UK a UNB,
Ružinovská 6,
826 06 Bratislava , SR
Cit. zkr: Vnitř Lék 2020; 66(8): 494–500
Článek přijat redakcí: 16. 9. 2020
Článek přijat po recenzích: 5. 11. 2020
Zdroje
1. Martineau AR, Forouhi NG. Vitamin D for COVID-19: a case to answer? The Lancet Diabetes and Endocrinology 2020; 8(9): 735–736.
2. Hewison M. An update on vitamin D and human immunity. Clin Endocrinol 2012; 76(3): 315–325.
3. Barbour GL, Coburn JW, et al. Hypercalcemia in an aneprhic patient with sarcoidosis: evidence for extrarenal generation of 1,25-dihydroxyvitamin D. N Engl J Med 1981; 305(8): 440–443.
4. Haussler MR, Whitfield GK, Kaneko I, et al. Molecular mechanisms of vitamin D action. Calcified Tissue International 2013; 92 : 77–98.
5. Greiller CL, Martineau AR. Modulation of the immune response to respiratory viruses by vitamin D. Nutrients 2015; 7(6): 4240–4270.
6. Hansdottir S, Monick MM, Hinde SL, et al. Respiratory epithelial cells convert inactive vitamin D to its active form: potential effects on host defense. J Immunol 2008; 181(10): 7090–7099.
7. Arababadi MK, Nosratabadi R, Asadikaram G. Vitamin D and toll like receptors. Life sciences 2017; 203 : 105–111.
8. Liu PT, Stenger S, Li H, et al. Toll‑like receptor triggering of a vitamin D‑mediated human antimicrobial response. Science 2006; 311(5768): 1770–1773.
9. Bilezikian JO, Bikle D, Hewison M, et al. Vitamin D and COVID-19. Eur J Endocrinol 2020; 183(5): R133–R147.
10. Mao J, Lin E, He L, et al. Autophagy and viral infection. Advances in Experimental Medicine and Biology 2019; 1209 : 55–78.
11. Dancer RC, Parekh D, Lax S, et al. Vitamin D deficiency contributes directly to the acute respiratory distress syndrome (ARDS). Thorax 2015; 70(7): 617–624.
12. Herr C, Shaykhiev R, Bals R. The role of cathelicidin and defensins in pulmonary inflammatory diseases. Expert Opin Biol Ther 2007; 7(9): 1449–1461.
13. Šterzl I. D vitamin a imunita. Vnitr Lek 2012; 58(5): 405–410.
14. Hansdottir S, Monick M. Vitamin D effects on lung immunity and respiratory diseases. Vitam Horm 2011; 86 : 217–237.
15. Sigmundsdottir H, Pan J, et al. DCs metabolize sunlight‑induced vitamin D3 to „program“ T cell attraction to the epidermal chemokine CCL27. Nat Immunol 2007; 8(3): 285–293.
16. Hrubišková K, Jackuliak P, Payer J. Vitamín D a imunitný system. Klinická imunológia a alergológia 2011; 21(4): 19–24.
17. Shoenfeld Y, Giacomelli R, Azrielant S, et al. Vitamin D and systemic lupus erythematosus – The hype and the hope. Autoimmun Rev 2018; 17(1): 19–23.
18. Alva‑Murillo N, Tellez‑Perez AD, Medina‑Estrada I, et al. Modulation of the inflammatory response of bovine mammary epithelial cells by cholecalciferol during Staphylococcus aureus internalization. Microbial pathogenesis 2014; 77 : 24–30.
19. Li P, Xu X, Cao E, et al. Vitamin D deficiency causes defective resistance to Aspergillus fumigatus in mice via aggravated and sustained inflammation. PloS one 2014; 9:e99805.
20. Choi B, Lee E, Sohn S. Vitamin D3 ameliorates herpes simplex virus‑induced Behcet’s disease‑like inflammation in a mouse model through down‑regulation of Toll‑like receptors. Clin Experiment Rheumatol 2010; 29: S13–19.
21. Channappanavar R, Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Seminars in Immunopathology 2017; 39 : 529–539.
22. Martinez‑Moreno J, Hernandez JC, Urcuqui‑Inchima S. Effect of high doses of vitamin D supplementation on dengue virus replication, toll.like receptor expression, and cytokine profiles on dendritic cells. Mol Cell Biochem 2020; 464(1–2):169–180.
23. Mock CK, Ng YL, Ahidjo BA, et al. Calcitriol, the active form of a vitamin D, is a promising candidate for COVID-19 prophylaxis. bioRxiv 2020; publikované online 22. júna (preprint).
24. Xu J, Yang J, Chen J, et al. Vitamin D alleviates lipopolysaccharide induced acute lung injury via regulation of the renin‑angiotensin system. Mol Med Rep 2017; 16(5): 7432–7483.
25. Kulda V. Metabolizmus vitaminu D. Vnitr Lek 2012; 58(5): 400–404.
26. Lanham‑New SA, Webb AR, Cahman KD, et al. Vitamin D and SARS‑CoV-2 virus/CO ‑ VID-19 disease. BMJ Nutrition, Prevention and Health 2020; 0.
27. Amrein K, Papinutti A, Mathew E, et al. Vitamin D and critical illness: what endocrinology can learn from intensive care and vice versa. Endocrine Connections 2018; 7(12): R303–R315.
28. Shaman J, Pitzer VE, Vibou C, et al. Absolute humidity and the seasonal onset of in ‑ fluenza in the continental United States. PLoS Biol 2010; 8(2): e1000316.
29. Fisher BJ, Seropian IM, Kraskauskas D, et al. Ascorbic acid attenuates lipopolysaccharide‑induced acute lung injury. Crit Care Med 2011; 39(6): 1454–1460.
30. Calder PC, Carr AC, Gombart AF, et al. Optimal nutritional status for a well‑functioning immune system is an important factor to protect against viral infections. Nutrients 2020; 12(4).
31. Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acu ‑ te respiratory tract infections: Systematic review and meta‑analysis of individual participant data. BMJ 2017; 356: i6583.
32. Jolliffe D, Camargo Jr CA, Sluyter J, et al. Vitamin D supplementation to prevent acute respiratory infections: systematic review and meta‑analysis of aggregated data from randomized controlled trials. medRxiv 2020, publikované online 17. júla (preprint).
33. Han JE, Jones JL, Tangpricha V, et al. High dose vitamin D administration in ventilated intensive care unit patients: a pilot double blind randomized controlled trial. Journal of Clinical and Translational Endocrinology 2016; 4 : 59–65.
34. Ginde AA, Brower RG, Caterino JM, et al. Early high‑dose vitamin D3 for critically ill, vitamin‑D deficient patients. N Eng J Med; 381 : 2529–2540.
35. Amrein K, Parekh D, Westphal S, et al. Effect of high‑dose vitamin D3 on 28-day mortality in adult critically ill patients with severe vitamin D deficiency: a study protocol of a multicentre, placebo‑controlled double‑blind phase III RCT (the VITDALIZE study); 9(11): e031083.
36. Laird E, Rhodes J, Kenny RA. Vitamin D and inflammation: potential implications for severity of COVID-19. Ir Med J 2020; 113(5): 81.
37. Ilie PC, Stefanescu S, Smith L. The role of vitamin D in the prevention of coronavirus disease 2019 infection and mortality. Aging Clin Exp Res 2020; 32 : 1195–1198.
38. Ebadi M, Montano‑Loza. Perspective: improving vitamin D status in the management of COVID-19. European Journal of Clinical Nutrition 2020; 1–4.
39. D’Avolio A, Avataneo V, Manca A, et al. 25-hydroxyvitamin D concentrations are lower in patients with positive PCR for SARS‑CoV-2. Nutrients 2020; 12(5): e1359.
40. Merzon E, Tworowski D, Gorohovski A, et al. Low plasma 25(OH) vitamin D level is associated with increased risk COVID-19 infection: an Israeli population‑based study. medRxiv 2020; publikované online 3. júla (preptint).
41. Hastie CE, Mackay DF, Ho F, et al. Vitamin D concentrations and COVID-19 infection in UK Biobank. Diabetes Metab Syndr 2020; 14(4): 561–565.
42. Meltzer DO, Best TJ, Zhang H, et al. Association of vitamin D status and other clinical characteristics with COVID-19 test results. JAMA network open; 3(9): e2019722–e2019722.
43. Panagiotou G, Tee SA, Ihsan Y, et al. Low serum 25-hydroxyvitamin D (25(OH)D) levels in patients hospitalized with COVID-19 are associated with greater disease severity. Clin Endocrinol (Oxf) 2020, publikované online 3. júla.
44. Maghbooli Z, Sahraian MA, Ebrahimi M, et al. Vitamin D sufficiency, a serum 25-hydroxyvitamin D at least 30 ng/mL reduced risk for adverse clinical outcomes in patients with COVID-19 infection. PloS one 2020; 15(9): e0239799.
45. Exposed, silenced, attacked: Failures to protect health and essential workers during the COVID-19 pandemic. Amnesty International 2020; 14–25.
46. Youssef DA, Ranasinghe T, Grant WB, et al. Vitamin D’s potential to reduce the risk of hospital‑aquired infections. Derm Endocrinol 2012; 4(2): 167–175.
47. Grant WB, Lahore H, McDonnell SL, et al. Evidence that vitamin D supplementation cou ‑ ld reduce risk of influenza and COVID-19 infections and deaths. Nutrients 2020; 12(4):988.
48. Wimalawansa SJ. Global epidemic of coronavirus – COVID-19: What we can do to mi ‑ nimize risks. Eur J Biomed Pharm Sci 2020; 7(3): 432–438.
49. Kimball S, Vieth R, Dosch HM, et al. Cholecalciferol plus calcium suppresses abnormal PBMC reactivity in patients with multiple sclerosis. J Clin Endocrinol Metab 2011; 96(9): 2826–2834.
50. Henry HL. Regulation of vitamin D metabolism. Best Pract Res Clin Endocrinol Me ‑ tab 2011; 25(4): 531–541.
51. National Institute for Health and Care Excellence. COVID-19 rapid evidence summary: vitamin D for COVID-19. Evidence summary 2020, publikované 29. júna.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Role metabolického syndrome v indukci chronické pankreatitidy po první atace akutní pankreatitidy – multicentrická studie
- Akutní infekce, žilní trombóza a doporučená tromboprofylaxe
- Hypogonadismus obézních mužů
- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- K 100. výročí narození prof. MUDr. Jiřího Šonky, DrSc.
- Monitorování farmakokinetiky infliximabu u idiopatických střevních zánětů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Prof. Jiří Šonka a obezitologie
- Změny farmakokinetiky léčiv u obézních pacientů
- Neobvyklá manifestace CMV infekce – cirkulární stenóza žaludku
- Chirurgická léčba těžké obezity – bariatrie
- Současnost a perspektivy farmakoterapie obezity
- Fyzická aktivita v léčbě obezity v praxi
- Jak léčit obézního hypertonika?
- Suplementácia vitamínu D ako dôležitý faktor v prevencii a liečbe ochorenia COVID-19: aké máme dôkazy?
- Vplyv ageizmu na správnosť indikácie antikoagulancií u seniorov s fibriláciou predsiení v práci kardiologickej ambulancie medzi rokmi 2012 a 2017
- Protidestičková léčba v sekundární prevenci nekardioembolických ischemických mozkových cévních příhod
- Věkem podmíněná remodelace myokardu: mýtus nebo realita?
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
- Fixní kombinace rosuvastatinu s ezetimibem
- Molekula erdostein společnosti Recipharm byla s pozitivním výsledkem testována jako součást léčby pacientů s COVID-19
- Antioxidační a bronchoprotektivní účinek erdosteinu
- Zkrácená informace o přípravku ERDOMED
- Disekcia ascendentnej aorty, diagnóza na ktorú treba myslieť
- 2020: rok, kdy ambulantní internisté vzali budoucnost do svých rukou. Konečně!
- Programy kvality Q‑OSTEOPORÓZA a Q‑DYSLIPIDEMIE – cesta k dlouhodobé stabilitě v oboru
- 110. výročí narození primáře Kadeřábka
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Péče o hospitalizovaného dialyzovaného pacienta z pohledu internisty
- Změny farmakokinetiky léčiv u obézních pacientů
- Heparínom indukovaná trombocytopénia a aktuálne možnosti liečby – prehľad literatúry
- Nebezpečí číhající v mořích – komplikace setkání s jedovatou rybou ropušnicí obecnou (Scorpion fish)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



