-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zásobení jodem u těhotných žen v České republice
Iodine supply of pregnant women in the Czech Republic
Introduction:
Iodine deficiency is a global public health problem which is particularly noticeable in pregnant or breastfeeding women and their children. Even mild iodine deficiency during pregnancy can lead to damage to the developing brain and thus affecting the fetus intelligence, his cognitive and neurological function, embryogenesis and growth.Patients:
In the period 2010–2015 was determined by spectrophotometry at the Institute of Endocrinology the basal urinary iodine in 532 pregnant women at the age of 32 ± 5 (18–44) years, which came from Prague, Hradec Kralove and Mlada Boleslav. It was located 349 women in the first trimester, 112 in the second trimester, and 71 women in the third trimester. In the monitoring of pregnant women in the first trimester 218 basal urine samples of women were determined by mass spectrometry with inductively coupled plasma (ICP MS) in The National Institute of Public Health (NIPH). Women came from the 6 areas in the Czech Republic. Development of urinary iodine in the general population in the period 1994–2015 was observed in patients who underwent Institute of Endocrinology and from population studies conducted in 7 regions of the Czech Republic. It performed 52 648 spectrophotometric analysis of urinary iodine in the general population.Methods:
Urinary iodine was determined by alkali melting of urine samples, followed by spectrophotometric determination of iodine in the form of iodide using the Sandell-Kolthoff reaction in the Institute of Endocrinology or determination was performed by ICP-MS in the laboratory of NIPH.Results:
On average, only 21.8 % of pregnant women had urinary iodine values determined by spectrophotometry higher than 150 μg/L. The results of iodine nutrition of pregnant women in the first trimester analyzed using ICP-MS are better, but even so, only 50.5 % of pregnant women have urinary iodine higher than 150 μg/L.Conclusion:
The results of iodine nutrition of pregnant women are alarming, on average, only 30 % of the total of 750 examined women have urinary iodine values greater than 150 μg/L and therefore meet the requirements of the WHO for pregnant women. Our results, however, show that iodine deficiency is not major public health problem in the general population.Key words:
ICP-MS – pregnant women – Sandell-Kolthoff reaction – urinary iodine
Autoři: Radovan Bílek 1; Nataša Kaňová 1; Veronika Mindžáková 2; David Neumann 3; Jan Jiskra 4; Lydie Ryšavá 5; Václav Zamrazil 1
Působiště autorů: Endokrinologický ústav, Praha 1; Gynekologicko-porodnické oddělené Oblastní nemocnice Mladá Boleslav, a. s. 2; Dětská klinika LF UK a FN Hradec Králové 3; III. interní klinika 1. LF UK a VFN v Praze 4; Meziresortní komise pro řešení jodového deficitu při Státním zdravotním ústavu, Praha 5
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 3): 10-16
Kategorie: Původní práce
Souhrn
Úvod:
Jodový deficit je celosvětovým veřejným zdravotním problémem, který se zvlášť významně projevuje u těhotných nebo kojících žen a jejich dětí. I mírný nedostatek jodu během těhotenství může vést k poškození vyvíjejícího se mozku, a tím také k ovlivnění inteligence plodu, jeho kognitivních a neurologických funkcí, jeho embryogenese a růstu.Pacienti:
V období let 2010–2015 byla v Endokrinologickém ústavu v Praze stanovena spektrofotometricky v bazální moči jodurie u 532 těhotných žen ve stáří 32 ± 5 (18–44) let, které pocházely z Prahy, Hradce Králové a Mladé Boleslavi. V 1. trimestru se nacházelo 349 žen, ve 2. trimestru 112 a ve 3. trimestru 71 žen. V rámci sledování populace těhotných žen v 1. trimestru bylo provedeno stanovení jodurie ve Státním zdravotním ústavu (SZÚ) pomocí hmotnostní spektrometrie s induktivně vázanou plazmou (ICP MS) u 218 bazálních vzorků moče žen, které pocházely z 6 oblastí České republiky. Vývoj jodurie u obecné populace v období let 1994–2015 byl sledován u pacientů, kteří prošli Endokrinologickým ústavem v Praze a z populačních studií, které proběhly v 7 oblastech České republiky. Celkem bylo provedeno 52 648 spektrofotometrických analýz jodurie u obecné populace.Metody:
Jodurie byla stanovena v Endokrinologickém ústavu v Praze pomocí alkalického tavení vzorků moči, po kterém následovalo spektrofotometrické stanovení jodu ve formě jodidu pomocí Sandellovy-Kolthoffovy reakce, nebo bylo stanovení provedeno metodou ICP MS v laboratoři SZÚ.Výsledky:
V průměru jen 21,8 % těhotných žen mělo hodnoty jodurie stanovené spektrofotometricky vyšší než 150 μg/l. Výsledky jodového zásobení těhotných žen v 1. trimestru analyzovaných pomocí ICP MS jsou lepší, ale i tak jen 50,5 % těhotných žen má jodurii vyšší než 150 μg/l.Závěr:
Výsledky jodového zásobení těhotných žen jsou alarmující, v průměru jen 30 % z celkem 750 vyšetřených žen má hodnoty jodurie vyšší než 150 μg/l a vyhovují tedy požadavkům WHO pro těhotné ženy. Z našich výsledků je ale patrné, že v obecné populaci není jodový deficit závažným veřejným zdravotním problémem.Klíčová slova:
ICP-MS – jod – jodurie – moč – Sandellova-Kolthoffova reakce – těhotné ženyÚvod
V předkládané práci jsou uvedeny výsledky našeho sledování těhotných žen z období let 2010–2015, během nějž jsme se snažili zmapovat, zda v této republice existuje i za podmínek funkčního programu jodové profylaxe dostatečné zásobení těhotných žen jodem. Dále jsou zde uvedeny výsledky retrospektivních populačních studií stanovení jodurie, které byly prováděny v letech 1994–2006 a výsledky stanovení hodnot jodu u našich pacientů, kteří byli vyšetřeni v Endokrinologickém ústavu v Praze v období let 1994–2015. V daném období je zde znázorněn vývoj jodurie v obecné populaci.
Problematika jodového deficitu
Jodový deficit je celosvětovým veřejným zdravotním problémem, který se zvlášť významně projevuje u těhotných žen a jejich dětí [1]. Adekvátní příjem jodu v těhotenství zabraňuje u matek i u jejich plodů nemocem štítné žlázy a zajišťuje odpovídající fyzický i neurologický vývoj plodu a novorozence [1–3]. Zatímco kretenizmus je nejvíce extrémní manifestací jodového deficitu, mnohem významnější jsou při daném stavu jodového zásobení ty formy mentálních poruch, které jsou způsobeny mírným deficitem jodu. Jejich výsledkem ale může být poškození vyvíjejícího se mozku, ovlivnění inteligence plodu a jeho kognitivních a neurologických funkcí, u dětí vedou k zhoršené schopnosti učení, limituje se jejich intelektuální výkon a v delším časovém horizontu se projevují i ekonomické důsledky v takto postižené oblasti [1]. Závažný jodový deficit u těhotných žen je doprovázen snížením inteligenčního koeficientu jejich dětí až o 13 bodů [4]. V prenatálním životě může vést nedostatek jodu k potratu, ke kongenitálním abnormalitám, ke zvýšené perinatální nemocnosti a úmrtnosti, a také k endemickému kretenizmu. Jodový deficit u novorozenců způsobuje neonatální strumu, hypotyreoidizmus a zhoršený mentální a psychomotorický vývoj novorozence. Jodový deficit u dětí a dospělých způsobuje strumu, klinický nebo subklinický hypotyreoidizmus, zhoršenou mentální funkci a ovlivnění intelektuálního vývoje u dětí. Prodlužuje se reakční čas na podnět, zhoršuje se i fyzický vývoj dětí [2]. Nezbytný příjem jodu v těhotenství a při kojení je u žen vyšší (250 μg jodu na den) než u běžné populace (150 μg jodu na den) [4].
Asi 31 % světové populace má nedostatečný příjem jodu, přičemž nejvíce se tento nedostatek projevuje v Evropě a ve střední a východní Asii [4]. Přitom se v posledních desetiletích zvýšil výskyt patofyziologických poruch štítné žlázy, kterými v současné době trpí ve světě přibližně 2 miliardy lidí [5]. Týká se to hlavně hypofunkce štítné žlázy, která je přibližně 6krát častější u žen než u mužů. Subklinické poruchy štítné žlázy, které nejsou lékařsky podchyceny, ještě dále zvyšují toto číslo [6]. Onemocnění štítné žlázy je doprovázeno zvýšeným výskytem metabolických, kostních a kardiovaskulárních onemocnění a zvýšenou úmrtností těchto pacientů. Nedostatek jodu je nejdůležitějším rizikovým faktorem pro onemocnění štítné žlázy a jodový deficit je nejvýznamnější celosvětovou příčinou zbytečných poškození mozku. Světová zdravotnická organizace již dlouho upozorňuje na skutečnost, že Evropané jsou stále více ovlivňováni důsledky tohoto nedostatečného příjmu jodu. Pouze 27 % domácností má přístup k jodizované kuchyňské soli, 350 miliónů evropských obyvatel je vystaveno jodovému deficitu [7]. Hlavním ukazatelem jodového zásobení, který odráží změny v příjmu jodu v relativně krátkém období dnů, je stanovení koncentrace jodu v moči [8]. Podle WHO (World Health Organization), UNICEF (United Nations Children’s Fund) a ICCIDD (International Council for Control of Iodine Deficiency Disorders) koncentrace jodu v moči pod 20 μg/l odpovídá zvlášť závažnému jodovému deficitu, koncentrace mezi 20–49 μg/l závažnému a koncentrace mezi 50–99 μg/l mírnému jodovému deficitu u obecné populace. Adekvátního jodového zásobení je dosaženo při jodurii mezi 100–199 μg/l. Hodnoty jodurie ležící mezi 200–299 μg/l znamenají více než adekvátní příjem jodu a hodnoty jodurie vyšší než 300 μg/l odpovídají nadměrnému příjmu jodu [4]. U těhotných žen hodnoty jodurie pod 150 μg/l indikují nedostatečný příjem jodu, hodnoty mezi 150–249 μg/l jsou adekvátní, hodnoty mezi 250–499 μg/l jsou nad požadovanou úrovní a hodnoty přes 500 μg/l znamenají nadměrný příjem jodu [4]. Mediánová koncentrace jodu v moči 100 μg/l odpovídá adekvátnímu příjmu jodu u kojících žen a u dětí mladších než 2 roky [4]. Podle WHO je doporučený denní příjem jodu 90 μg pro předškolní děti (0–59 měsíců), 120 μg pro školní děti (6–12 roků), 150 μg pro dospívající a dospělé (starší než 12 roků) a 250 μg pro těhotné a kojící ženy [4].
Úloha jodu v organizmu
Úloha jodu v organizmu spočívá v tom, že je substrátem pro biosyntézu tyreoidálních hormonů, které ovlivňují metabolizmus organizmu a mají vliv na expresi genů ovlivňujících řadu fyziologických funkcí, jako je embryogeneze, růst a vývoj organizmu včetně jeho neurologických a kognitivních funkcí. Jod je absorbován v gastrointestinálním systému a ve formě jodidu vychytáván z krve štítnou žlázou. Jedná se o aktivní transport, který je realizován prostřednictvím natrium-jodidového symportéru (NIS) a je regulován jak tyreotropinem (TSH), tak i množstvím jodu v cirkulaci. V procesu organifikace je jod kovalentně navázán na tyrozin v tyreoglobulinové molekule za vzniku monojodtyrozinu (MIT) a dijodtyrozinu (DIT), které se dále vážou mezi sebou za vzniku trijodtyroninu (T3) interakcí MIT a DIT, nebo tyroxinu (T4) vznikajícího z 2 molekul DIT. Po proteolytickém štěpení tyreoglobulinu jsou tyto tyreoidální hormony uvolněny do cirkulace. T4 je prohormonem syntézovaným výhradně štítnou žlázou, T3 je jeho aktivní formou, která vzniká v menší míře ve štítné žláze, ale hlavně se vytváří na periferii konverzí T4 na T3 působením tkáňové dejodázy II. Jod odštěpený dejodázami I (nespecifická), II (konverze T4 na T3), III (konverze T4 a T3 na inaktivní metabolity) je v cirkulaci opět vychytáván štítnou žlázou, nadbytečný jod je z více než 90 % vyloučen močí [9,10].
Tyreoidální hormony se kromě základních metabolických funkcí také podílejí v nervovém systému na regulaci diferenciace buněk a na genové expresi. Vazba T3 na jaderné receptory reguluje expresi specifických genů v různých oblastech mozku ve fetálním i časném postnatálním věku. V 1. a 2. trimestru mají tyreoidální hormony vliv na zmnožení neuronů, jejich migraci a organizaci. V tomto čase je plod zásoben tyreoidálními hormony od matky, protože štítná žláza fetu ještě není plně funkční. Ve 3. trimestru až přibližně do 3 roků věku dítěte dochází v centrální nervové soustavě ke zmnožení, migraci a myelinizaci gliových buněk. Ve 3. trimestru je již fetální štítná žláza schopná produkovat dostatek tyreoidálních hormonů, od matky jich pochází jen přibližně 30 % [10,11].
K přirozeným změnám funkce štítné žlázy v těhotenství patří zvýšená produkce lidského choriového gonadotropinu (hCG) v placentě a zvýšená koncentrace estrogenů [10,12] – hCG je tyreotropinovým agonistou (účinnost je přibližně rovná 0,01 % TSH), který má společnou α-podjednotku s TSH. K maximálnímu zvýšení hCG dochází mezi 9.-14. týdnem těhotenství, což vede k zrcadlové supresi TSH, a pravděpodobně jeho vlivem dochází i k mírnému zvýšení hodnot volné frakce T4 ke konci 1. trimestru, která se ve 2. a 3. trimestru opět snižuje, aniž by došlo k podstatné změně TSH [12]. Z analytického hlediska zde může být problémem metodika stanovení volné frakce T4. Hodnoty hCG se ve 2. trimestru snižují a ke konci těhotenství mohou být i neměřitelné [13]. V důsledku stimulačního efektu estrogenů dochází u těhotných žen ke zvýšené produkci tyroxin-vázajícího globulinu (TBG) v játrech. Odhaduje se, že v 16.-20. týdnu těhotenství dochází ke zdvojnásobení sérového TBG a estrogeny rovněž redukují jeho degradaci v cirkulaci. Zvýšené hladiny TBG mají za následek vyšší produkci tyreoidálních hormonů tak, aby se udržela fyziologická koncentrace volné frakce T4. Nárůst extratyreoidálního distribučního objemu pro tyreoidální hormony u těhotných žen spolu se zvýšeným vylučováním jodu ledvinami v důsledku o 50 % zvýšené glomerulární filtrace doprovázené snížením tubulární resorpce vede k dalšímu nároku na příjem jodu do organizmu. Vzestup aktivity dejodázy III v placentě ve 3. trimestru, která degraduje T4 a T3 na inaktivní metabolity, a tak chrání plod před nadbytkem tyreoidálních hormonů po zahájení biosyntézy těchto hormonů ve fetální štítné žláze, opět zvyšuje produkci tyreoidálních hormonů štítnou žlázou matky [10]. Organizmus těhotných žen tak potřebuje přibližně 50 % navýšení příjmu jodu, aby byla udržena fyziologická produkce tyreoidálních hormonů jak u matky, tak i u jejího plodu [2]. Těhotné ženy by měly dostávat potravinové doplňky obsahující jod, jestliže žijí v oblasti, v níž je obecně medián jodurie nižší než 100 μg/l [14]. U žen žijících v oblastech s dostatečným jodovým zásobením se zvyšuje objem štítné žlázy během těhotenství o 10 %, ženy žijících v oblastech s deficitem jodu mají objem štítné žlázy zvětšen o 20–40 % [15].
Indikátory pro stanovení zásobení organizmu jodem
K stanovení míry zásobení populace jodem byla diskutována řada indikátorů, jako je objem štítné žlázy, obsah jodu v moči, v krvi cirkulující tyreotropin, tyreoglobulin a případně i hormony štítné žlázy [8]. Objem štítné žlázy odráží historii jodového příjmu, ale ne jodový status v přítomnosti [16]. Objem štítné žlázy se navrací do normálního rozmezí při korekci jodového deficitu pomocí jodizované kuchyňské soli po měsících až letech, a není tak dobrým indikátorem jodové nutrice [17]. Nedostatek jodu snižuje v cirkulaci T4 a zvyšuje TSH, ale rozdíl není příliš veliký a často dochází k překrytí mezi individuálními hodnotami. Z tohoto důvodu není doporučeno užívat TSH jako indikátoru jodového příjmu u dětí ve školním věku a u dospělých [8]. Tyreoglobulin v cirkulaci je citlivým ukazatelem jodového deficitu [18–20] a je možné ho použít i u těhotných žen [21–23]. V současné době probíhá výzkum, který by dále zpřesnil úlohu tyreoglobulinu jako ukazatele míry zásobení populace jodem. Problematická je především standardizace, protože variabilita hodnot při použití kitů různých výrobců je relativně vysoká. Jod v moči (jodurie) je vzhledem k schopnosti postihnout okamžitý stav jodového příjmu v závislosti na potravě nejužitečnějším indikátorem jodového zásobení užívaným v populačních studiích. Při dostatečném množství vzorků se eliminuje intraindividuální variabilita i kolísání obsahu jodu v moči během dne, stejně tak vztažení obsahu jodu na kreatinin není nutné a v minulosti to vedlo k chybám daným proměnlivým obsahem kreatininu v moči [4].
Soubor vyšetřených těhotných žen
V letech 2010–2015 byla stanovena spektrofotometricky na základě Sandellovy-Kolthoffovy reakce v Endokrinologickém ústavu v Praze v bazální moči jodurie u 532 těhotných žen ve stáří 32 ± 5 (18–44) let, z toho z Hradce Králové pocházelo 50 žen, z Mladé Boleslavi 65 žen a z Prahy 417 žen. V Praze bylo vyšetřeno 54 žen ošetřovaných v Ústavu pro péči o matku a dítě a 363 žen ve Všeobecné fakultní nemocnici, z toho u 258 žen byla stanovena jodurie těsně po spontánním potratu v 1. trimestru, výsledky z této studie jsou zveřejněny v literatuře [24]. U ostatních žen se jednalo o fyziologické těhotenství. Za období let 2014–2015 proběhlo v rámci sledování populace těhotných žen v 1. trimestru těhotenství z hlediska saturace jodem vyšetření jodurie ve Státním zdravotním ústavu pomocí hmotnostní spektrometrie s induktivně vázanou plazmou (ICP MS) u 218 bazálních vzorků moče žen. Soubor žen byl získán prostřednictvím lékařů gynekologických ambulancí ze 6 krajů České republiky, a to z Moravskoslezského kraje (55 vzorků), Jihomoravského kraje (40 vzorků), kraje Vysočina (25 vzorků), Středočeského kraje a hlavního města Praha (43 vzorků), Libereckého kraje (20 vzorků) a z Plzeňského kraje (35 vzorků).
Vývoj zásobení obecné populace jodem v období let 1994–2015 z pacientů, kteří byli vyšetřeni v Endokrinologickém ústavu v Praze a z populačních studií, které proběhly v období let 1995–2006 v Jindřichově Hradci (1995, 2001), Ústí nad Orlicí (1996), Klatovech (1997), Chebu (1998), Jablonci nad Nisou (1999, 2004), Příbrami (2000, 2005) a Žďáru nad Sázavou (2002, 2006) je znázorněn na grafu. V každé populační studii bylo vyšetřeno na základě náhodného výběru 500–800 účastníků ve stáří 6–65 let v přibližně stejném zastoupení pohlaví a byla u nich stanovena spektrofotometricky hladina jodu v moči.
Laboratorní metodika
Celkem 532 vzorků moči bylo skladováno při -20 °C a poté byla koncentrace jodu v moči stanovena v Endokrinologickém ústavu v Praze pomocí alkalického tavení vzorků moči, po které následovalo spektrofotometrické stanovení jodu ve formě jodidu Sandellovou-Kolthoffovou reakcí s využitím brucinu jako kolorimetrického indikátoru. Detailní postup stanovení byl zveřejněn v literatuře [25]. Dalších 218 vzorků moče skladovaných stejným způsobem bylo analyzováno v laboratoři Státního zdravotního ústavu v Praze v Centru zdraví a životního prostředí, Pracoviště pro analýzu stopových prvků metodou ICP-MS.
Veškeré statistické výpočty byly provedeny pomocí programu NCCS 2004 (Number Cruncher Statistical Systems, Kayville, Utah, USA).
Výsledky a diskuse
Výsledky jodového zásobení těhotných žen analyzovaných v Endokrinologickém ústavu jsou znázorněny v tab. 1 a bohužel jsou alarmující. V průměru jen 21,8 % žen má hodnoty jodurie vyšší než 150 μg/l, přičemž do kategorie optimálního zásobení 150–249 μg/l spadá jen 9,6 % žen. Parametry pro udržitelnost eliminace nedostatku jodu podle WHO požadují, aby byl v obecné populace podíl jedinců s jodurií pod 100 μg/l menší než 50 % a pod 50 μg/l menší než 20 % [8]. U těhotných žen musí medián jodurie přesahovat 150 μg/l [4]. Sledovaný soubor těhotných žen z Endokrinologického ústavu v Praze (tab. 1) vyhovuje pouze parametru obecné populace s jodurií nižší než 50 μg/l (11,5 % žen), parametr obecné populace s jodurií nižší než 100 μg/l je mírně překročen (52,3 %). Velmi malé procento těhotných žen (21,8 %) vyhovuje podmínce, že mají mít jodurii vyšší než 150 μg/l. Hodnoty v 1. trimestru jsou nejhorší (11,2 % žen), je to ale možná ovlivněno tím, že v přibližně 50 % případů se jednalo o ženy (n = 258), u kterých proběhl v 1. trimestru spontánní potrat. Ve 2. trimestru je pozorovatelné podstatné navýšení žen majících jodurii vyšší než 150 μg/l (52,7 %), ale ve 3. trimestru hodnoty opět padají dolů (25,3 % žen). Důvodem poklesu může být ředění moči (polyurie), které se u některých žen vyskytuje těsně před porodem a v našem sledovaném souboru se jedná o téměř 70 % takových žen ve 3. trimestru.
Tab. 1. Jodurie těhotných žen vyšetřených v Endokrinologickém ústavu v Praze spektrofotometricky pomocí Sandellovy-Kolthoffovy reakce 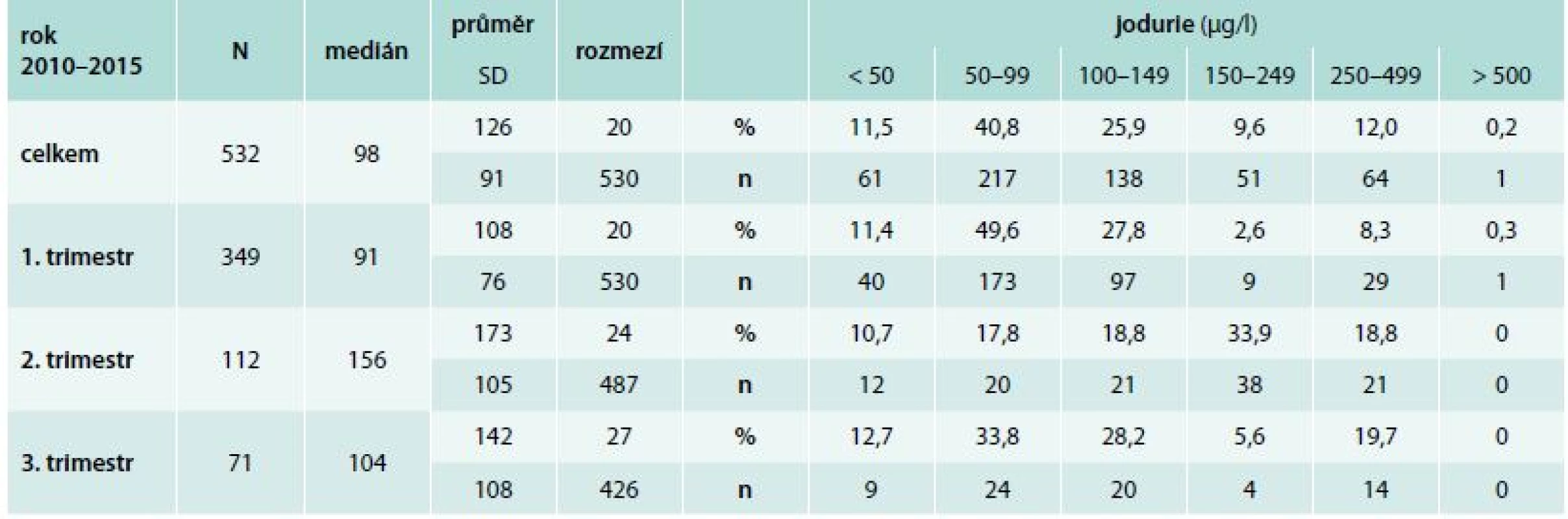
Velké N znamená celkový počet žen, malé n vyjadřuje počet žen rozdělených podle kategorie WHO na ženy spadající do oblasti zvláště závažného, závažného, mírného, optimálního, více než adekvátního a nadměrného příjmu jodu. SD je směrodatná odchylka. Výsledky jodového zásobení těhotných žen v 1. trimestru analyzovaných pomocí ICP MS v laboratoři Státního zdravotního ústavu v Praze jsou znázorněny v tab. 2. Výsledky jsou lepší v porovnání se ženami vyšetřenými v Endokrinologickém ústavu v Praze: 50,5 % těhotných žen má jodurii vyšší než 150 μg/l, 22 % žen spadá do oblasti 100–149 μg/l, 21,5 % má podle kritérií obecné populace mírný a 6 % žen závažný jodový deficit. Výsledky stanovení jodurie pomocí ICP MS žen v 1. trimestru přibližně odpovídají výsledkům spektrofotometrického stanovení jodurie u žen analyzovaných v Endokrinologickém ústavu v Praze ve 2. trimestru. Průměrně ze všech stanovovaných vzorků (n = 750) má jen 30 % žen hodnoty jodurie vyšší než 150 μg/l, které vyhovují požadavkům WHO pro těhotné ženy (> 150 μg/l).
Tab. 2. Jodurie těhotných žen v 1. trimestru vyšetřených pomocí ICP MS v laboratoři SZÚ 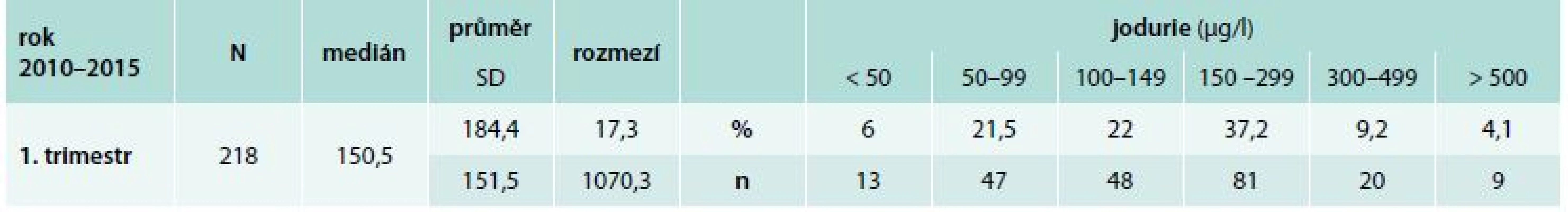
Velké N znamená celkový počet žen, malé n vyjadřuje počet žen rozdělených podle kategorie WHO na ženy spadající do oblasti zvláště závažného, závažného, mírného, optimálního, více než adekvátního a nadměrného příjmu jodu. SD je směrodatná odchylka. Česká republika patří historicky do oblastí, v nichž je z geochemického hlediska nedostatek jodu, ale podle kritérií WHO, UNICEF a ICCIDD přibližně od roku 2004 nepatří jodová nutrice mezi závažné veřejné zdravotní problémy [1,25,26]. Je to výsledkem realizace programu jodové profylaxe, který byl připraven Meziresortní komisí pro řešení jodového deficitu v České republice působící při Státním zdravotním ústavu v Praze. Legislativní opatření obsažené v zákonu č. 110/1997 Sb. a ve vyhláškách MZ ČR 446, 450/2004 uvádí, že jodování kuchyňské soli je dobrovolné, ale jestliže je uvedeno, že sůl je jodována, musí obsahovat 20–34 mg I v 1 kg soli ve formě jodidu nebo termodynamicky stabilnějšího jodičnanu. Ve vyhláškách se také specifikuje, že doporučený denní příjem jodu je 150 μg. V České republice se zhoršená funkce štítné žlázy vyskytuje u 4–8 % těhotných žen a tyreoidální autoimunita je přítomna u 6–8 % těhotných žen [27].
Vývoj jodurie v období 1994–2015 u obecné populace je znázorněn na grafu. Z tohoto obrázku je patrné, že v České republice není jodový deficit veřejným zdravotním problémem, ale přesto je třeba provádět vyšetření jodurie a pozorovat trend, který by měl přesouvat lidi ze skupin odpovídajících jodovému deficitu do skupiny s optimálním jodovým příjmem. Pozornost je třeba také věnovat skupině s nadměrným zásobením jodem, která v posledních letech vzrůstá.
Graf 1. Frekvenční distribuce jodurie u obecné populace stanovená spektrofotometricky v Endokrinologickém ústavu v Praze 
Data byla zpracována v letech 1994–2015 podle kritérií WHO, UNICEF a ICCIDD, tj. jako % populace v jednotlivých letech patřící do oblasti zvláště závažného deficitu jodu (jodurie – dále I – do 20 μg/l), závažného deficitu (20–50 μg I/l), mírného deficitu (50–100 μg I/l), přiměřeného příjmu jodu (100–200 μg I/l) a nadměrného zásobení jodem (více než 200 μg I/l). Rok a počet vyšetřených jedinců jsou uvedeny v legendě vedle obrázku. Okolní státy jsou podle mapy WHO řazeny do oblasti s optimálním jodovým zásobením. Výjimkou je Polsko charakterizované mírným deficitem jodu [1]. Přesto ale v literatuře najdeme údaje o tom, že i přes aplikaci suplementárních doplňků obsahujících jod je v těchto zemích z hlediska doporučení WHO pro těhotné ženy jodový příjem nedostatečný. V Polsku má odpovídající příjem jen 45 % žen [28], v Rakousku v oblasti Vídně jen 14 % žen [29], v Německu v oblasti Berlína 80 % žen [30], ani na Slovensku není situace příznivá [31]. Z dalších evropských zemí např. ve Francii v oblasti Lyonu má jodový deficit 77 % těhotných žen [32], medián jodové nutrice ve Velké Británii má u těhotných žen hodnotu 190 μg/den [33], ve Švédsku je medián jodurie těhotných žen roven 98 μg/l [34], také ve Španělsku jsou těhotné ženy nedostatečně zásobeny jodem [35]. Zajímavá je situace v USA, v nichž byl během posledních 3 dekád medián jodurie u těhotných žen snížen o 50 % [36] a asi třetina těchto žen spadá podle kritérií WHO pro těhotné ženy do oblasti jodového deficitu [37]. Americká pediatrická společnost doporučuje, aby se těhotné ženy vyhýbaly příjmu nitrátu a perchlorátu přítomných v pitné vodě, a tiokyanátu obsaženého v cigaretovém kouři, protože tyto látky inhibují NIS, a tak mohou dále potencovat jodový deficit [37]. Naproti tomu v Japonsku existuje přechodný hypotyroidizmus nebo trvalá hypertyreotropinemie u novorozenců, kteří se narodili ženám žijícím v oblastech s nadměrným příjmem jodu [38]. Je však zaznamenáno [39], že ačkoliv je v Japonsku vysoký příjem jodu, tak přibližně u třetiny těhotných žen z celkového počtu 563 vyšetřených žen byla jodurie nižší než 150 μg/l.
Evropskou unií (EU) byl přijat k financování v rámci strategického programu HORIZON 2020 pro výzkum a inovace EU platného pro období let 2014–2020 v prioritní oblasti Zdraví, demografická změna a životní pohoda (HEALTH) grant č. 634453 EUthyroid, jehož cílem je harmonizovat a udržitelně zlepšit příjem jodu a předcházet nemocem spojených s porušenou funkcí štítné žlázy v Evropě [40]. Projektu EUthyroid se účastní 23 členských států EU včetně České republiky reprezentované Endokrinologickým ústavem v Praze (95 % zemí EU, výjimku tvoří Kypr, Litva, Lucembursko, Malta a Rumunsko) a kromě toho je do projektu zapojeno 5 zemí ze skupiny Iodine Global Network (IGN) West Central Europe (Island, Izrael, Makedonie, Norsko, Švýcarsko). Plné znění grantu EUthyroid je „Towards the elimination of iodine deficiency and preventable thyroid-related diseases in Europe“, jeho řešení začalo dnem 1. 6. 2015, délka trvání je 36 měsíců a jednou z priorit je i provést průzkum týkající se vztahu mezi zásobením jodem a tyreoidálními poruchami u těhotných žen. Věříme, že i v rámci této mezinárodní spolupráce přispějeme k tomu, aby v České republice vzrůstal podíl těhotných žen, jejichž jodový příjem je podle kritérií WHO, UNICEF a ICCIDD optimální.
Poděkování
Tato práce je věnována prof. MUDr. V. Zamrazilovi, DrSc., při příležitosti oslav jeho 80. narozenin. Prof. V. Zamrazil patří k vůdčím osobnostem zabývajícím se řešením problematiky jodového deficitu v České republice a v období let 1991–2006 zorganizoval v rámci Endokrinologického ústavu rozsáhlé epidemiologické studie zaměřené na hodnocení jodového deficitu a stavu štítné žlázy ve 12 regionech České republiky. Na základě získaných výsledků a na doporučení Komise pro řešení jodového deficitu při Státním zdravotním ústavu, která vznikla v polovině 90. let minulého století a jejímž členem prof. V. Zamrazil je, byla postupně realizována opatření vedoucí k eliminaci jodového deficitu v České republice. O problematiku jodového deficitu se zajímá dodnes, je vedoucím českého zastoupení v grantu EUthyroid organizovaném Evropskou unií.
Práce byla podpořena grantem IGA MZ ČR NS/9837–4.
doc. Ing. Radovan Bílek, CSc.
rbilek@endo.cz
Endokrinologický ústav, Praha
www.endo.cz
Doručeno do redakce 22. 8. 2016
Přijato po recenzi 31. 8. 2016
Zdroje
1. Iodine status worldwide. In: de Benoist B, Andersson BM, Egli I et al (eds). WHO Global Database on Iodine Deficiency. Department of Nutrition for Health and Development: Geneva 2004. ISBN 92 4 159200 1. Dostupné z DOI: http://apps.who.int/iris/bitstream/10665/43010/1/9241592001.pdf.
2. Zimmermann MB. The Importance of Adequate Iodine during Pregnancy and Infancy. World Rev Nutr Diet 2016; 115 : 118–124. Dostupné z DOI: <http://dx.doi.org/10.1159/000442078>.
3. Alvarez-Pedrerol M, Guxens M, Mendez M et al. Iodine levels and thyroid hormones in healthy pregnant women and birth weight of their offspring. Eur J Endocrinol 2009; 160(3): 423–429. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-08–0716>.
4. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 3rd ed. WHO Press: Geneva 2007. ISBN 978 92 4 159582 7. Dostupné z DOI: http://apps.who.int/iris/bitstream/10665/43781/1/9789241595827_eng.pdf.
5. Bergman A, Heindel JJ, Jobling S et al (eds). [WHO-UNEP]. State of the Science of Endocrine Disrupting Chemicals – 2012. United Nations Environment Programme and the World Health Organization. WHO Press: Geneva 2013. Dostupné z DOI: http://www.unep.org/pdf/WHO_HSE_PHE_IHE_2013.1_eng.pdf.
6. McGrogan A, Seaman HE, Wright JW et al. The incidence of autoimmune thyroid disease: a systematic review of the literature. Clin Endocrinol (Oxf) 2008; 69(5): 687–696. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2265.2008.03338.x>.
7. Lazarus JH. Iodine status in Europe in 2014. Eur Thyroid J 2014; 3(1): 3–6. Dostupné z DOI: <http://dx.doi.org/10.1159/000358873>.
8. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 2nd ed. Geneva 2001. Dostupné z DOI: http://apps.who.int/iris/bitstream/10665/61278/1/WHO_NHD_01.1.pdf.
9. Ghirri P, Lunardi S, Boldrini A. Iodine supplementation in the newborn. Nutrients 2014; 6(1): 382–390. Dostupné z DOI: <http://dx.doi.org/10.3390/nu6010382>.
10. The Thyroid Gland. In: De Groot LJ, Jameson JL (eds): Endocrinology Adult and Pediatric: Reproductive Endocrinology. 6th ed. Saunders: 2013. ISBN 978–0323240604.
11. Patel J, Landers K, Li H et al. Thyroid hormones and fetal neurological development. J Endocrinol 2011; 209(1): 1–8. Dostupné z DOI: <http://dx.doi.org/10.1530/JOE-10–0444>.
12. Brucker-Davis F, Panaia-Ferrari P, Gal J et al. Iodine Supplementation throughout Pregnancy Does Not Prevent the Drop in FT4 in the Second and Third Trimesters in Women with Normal Initial Thyroid Function. Eur Thyroid J 2013; 2(3): 187–194. Dostupné z DOI: <http://dx.doi.org/10.1159/000350882>.
13. Glinoer D, de Nayer P, Bourdoux P et al. Regulation of maternal thyroid during pregnancy. J Clin Endocrinol Metab 1990; 71(2): 276–287.
14. Andersen SL, Laurberg P. Iodine Supplementation in Pregnancy and the Dilemma of Ambiguous Recommendations. Eur Thyroid J 2016; 5(1): 35–43. Dostupné z DOI: <http://dx.doi.org/10.1159/000444254>.
15. Stagnaro-Green A, Abalovich M, Alexander E et al. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011; 21(10): 1081–1125. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2011.0087>.
16. Zimmermann MB. Assessing iodine status and monitoring progress of iodized salt programs. J Nutr 2004; 134(7): 1673–1677.
17. Delange F, de Benoist B, Pretell E et al. Iodine deficiency in the world: where do we stand at the turn of the century? Thyroid 2001; 11(5): 437–447.
18. Bílek R, Zamrazil V. Thyroglobulin as an indicator of iodine intake. In: Preedy VR, Burrow GN, Watson R (eds). Comprehensive handbook on iodine: Nutritional, Biochemical, Pathological and Therapeutic Aspects. Academic Press: Oxford 2009 : 55–64. ISBN 978–0123741356.
19. Bílek R, Cerovská J, Zamrazil V. The relationship between iodine intake and serum thyroglobulin in the general population. Physiol Res 2015; 64(3): 345–353.
20. Bílek R, Čeřovská J. Jod a tyreoidální hormony. Vnitř Lék 2006; 52(10): 881–886.
21. Eltom A, Elnagar B, Elbagir M et al. Thyroglobulin in serum as an indicator of iodine status during pregnancy. Scand J Clin Lab Invest 2000; 60(1): 1–7.
22. Nohr SB, Laurberg P. Opposite variations in maternal and neonatal thyroid function induced by iodine supplementation during pregnancy. J Clin Endocrinol Metab 2000; 85(2): 623–627.
23. Ma ZF, Skeaff SA. Thyroglobulin as a biomarker of iodine deficiency: a review. Thyroid 2014; 24(8): 1195–1209. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2014.0052>.
24. Jiskra J, Fait T, Bílek R et al. Mild iodine deficiency in women after spontaneous abortions living in an iodine-sufficient area of Czech Republic: prevalence and impact on reproductive health. Clin Endocrinol (Oxf) 2014; 80(3): 452–458. Dostupné z DOI: <http://dx.doi.org/10.1111/cen.12298>.
25. Bilek R, Bednar J, Zamrazil V. Spectrophotometric determination of urinary iodine by the Sandell-Kolthoff reaction subsequent to dry alkaline ashing: Results from the Czech Republic in the period 1994–2002. Clin Chem Lab Med 2005; 43(6): 573–850.
26. Zamrazil V, Bilek R, Cerovska J et al. The elimination of iodine deficiency in the Czech Republic: the steps toward success. Thyroid 2004; 14(1): 49–56.
27. Límanová Z. Thyroid gland and pregnancy – summary of important findings. Vnitř Lék 2015; 61(10): 862–867.
28. Zygmunt A, Lewinski A. Iodine prophylaxis in pregnant women in Poland – where we are? (update 2015). Thyroid Res 2015; 8 : 17. Dostupné z DOI: <http://dx.doi.org/10.1186/s13044–015–0029-z>.
29. Lindorfer H, Krebs M, Kautzky-Willer A et al. Iodine deficiency in pregnant women in Austria. Eur J Clin Nut 2015; 69(3): 349–354. Dostupné z DOI: <http://dx.doi.org/10.1038/ejcn.2014.253>.
30. Bühling KJ, Schaff J, Bertram H et al. Supply of iodine during pregnancy-an inventory in Berlin, Germany. Z Geburtshilfe Neonatol 2003; 207(1): 12–16.
31. Tajtakova M, Capova J, Bires J et al. Thyroid volume, urinary and milk iodine in mothers after delivery and their newborns in iodine-replete country. Endocr Regul 1999; 33(1): 9–15.
32. Raverot V, Bournaud C, Sassolas G et al. Pregnant French women living in the Lyon area are iodine deficient and have elevated serum thyroglobulin concentrations. Thyroid 2012; 22(5): 522–528. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2011.0184>.
33. Combet E, Bouga M, Pan B et al. Iodine and pregnancy – a UK cross-sectional survey of dietary intake, knowledge and awareness. Br J Nutr 2015; 114(1): 108–117. Dostupné z DOI: <http://dx.doi.org/10.1017/S0007114515001464>.
34. Granfors M, Andersson M, Stinca S et al. Iodine deficiency in a study population of pregnant women in Sweden. Acta Obstet Gynecol Scand 2015; 94(11): 1168–1174. Dostupné z DOI: <http://dx.doi.org/10.1111/aogs.12713>.
35. Dominguez I, Reviriego S, Rojo-Martinez G et al. Iodine deficiency and thyroid function in healthy pregnant women. Med Clin (Barc) 2004; 122(12): 449–453.
36. Leung AM, Pearce EN, Braverman LE et al. AAP recommendations on iodine nutrition during pregnancy and lactation. Pediatrics 2014; 134(4): e1282. Dostupné z DOI: <http://dx.doi.org/10.1542/peds.2014–2111A>.
37. Rogan WJ, Paulson JA, Baum C et al. [Council on Environmental Health]. Iodine deficiency, pollutant chemicals, and the thyroid: new information on an old problem. Pediatrics 2014; 133(6): 1163–1166. Dostupné z DOI: <http://dx.doi.org/10.1542/peds.2014–0900>.
38. Nishiyama S, Mikeda T, Okada T et al. Transient hypothyroidism or persistent hyperthyrotropinemia in neonates born to mothers with excessive iodine intake. Thyroid 2004; 14(12): 1077–1083.
39. Fuse Y, Shishiba Y, Irie M. Gestational changes of thyroid function and urinary iodine in thyroid antibody-negative Japanese women. Endocr J 2013; 60(9): 1095–1106. Erratum in Endocr J 2014; 61(7): 743.
40. Völzke H, Caron P, Dahl L et al. Ensuring Effective Prevention of Iodine Deficiency Disorders. Thyroid 2016; 26(2): 189–196. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2015.0543>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo Suppl 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Zásobení jodem u těhotných žen v České republice
-
Řešení jodového deficitu v České republice – historie a současný stav
20 let práce prof. MUDr. Václava Zamrazila v Meziresortní komisi pro řešení jodového deficitu - Psycho-imuno-endokrinologie štítné žlázy
- Karcinomy štítné žlázy – současné léčebné postupy
- Vitamin D a autoimunitní tyreopatie
- Testosteron a mortalita
- Vrozená adrenální hyperplazie v dospělosti
- Polyfarmakoterapie nahlížená nejen prizmatem multimorbidity, ale jako další geriatrický syndrom
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Priebeh ochorenia u pacientov s diferencovaným mikrokarcinómom štítnej žľazy pri použití rôznych liečebných postupov
- Projekt SPACE (Stav Pacientů Akceptovaných diabetologem Cestou Exportu)
- Zásobení jodem a jodurie obyvatel v České republice v letech 1995–2016
- Prof. MUDr. Václav Zamrazil, DrSc., slaví 80. narozeniny
- Jodurie u nemocných s diabetes mellitus 1. typu Vztahy k vybraným parametrům charakterizujícím diabetický syndrom
- Nádory štítné žlázy u dětí a dospívajících a jejich molekulárně genetická podstata
- Endokrinní komplikace moderní onkologické léčby
- Václav Zamrazil osmdesátníkem
- Léčba levotyroxinem – faktory ovlivňující její úspěšnost
- Endokrinní orbitopatie – téma stále živé
- Jsou tyreoidální hormony a tyreotropin asociovány s kardiometabolickými riziky a inzulinovou rezistencí u eutyreoidních jedinců?
- Současnost a perspektivy léčby akromegalie
- Kardiorenální syndrom – biomarkery a mediátory
- TSH produkující adenomy
- Centrální poruchy funkce štítné žlázy
- Vitamín D a syndróm polycystických ovárií
- Tyreoidální hormony a kardiovaskulární systém
- Endokanabinoidný systém a kosť
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vrozená adrenální hyperplazie v dospělosti
- Mnohočetná endokrinní neoplazie I (Wermerův syndrom) – formy klinické manifestace: 5 kazuistik
- Vitamin D a autoimunitní tyreopatie
- Centrální poruchy funkce štítné žlázy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



