-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPostižení jater u nemocných s ne-Hodgkinovým lymfomem
Hepatic involvement in patients with non‑Hodgkin’s lymphoma
Non ‑ Hodgkin’s lymphoma (NHL) represent the most frequent hematological malignancy with frequent extranodal involvement. We have identified 79 pts (4.6%) out of 1,712 patients with NHL, who were diagnosed in our center between 1999–2010. Five cases were primary extranodal lymphomas and we have observed one primary hepatic lymphoma (0.015%). The most frequent (61.3%) NHL subtype in our cohort was diffuse large B ‑ cell lymphoma. B ‑ NHL formed 92.4% of all lymphomas. We have observed high number of HBsAg positive patients (10%). The whole group have poor prognostic features with high number of patients (85%) with intermediate ‑ high and high risk according to international prognostic index. The patients were treated with chemotherapy in 95%, B ‑ NHL patients recieved immunochemotherapy with rituximab in 77%. The median progression free survival, resp. overall survival 4.6, resp. 8.4 years in the whole group and 1.4, resp. 8.4 years in diffuse large B ‑ cell lymphoma were observed with median follow-up 4.5 years. The outcome of T ‑ NHL patients was significantly worse with overall survival median 1.2 vs 8.4 years (p < 0.033). The patients with B ‑ NHL treated by immunochemoterapy with rituximab had significant death risk reduction (HR 0.44, p = 0.03) compared to the patients treated with chemotherapy.
Key words:
lymphoma – non‑Hodgkin’s lymphoma – hepatic impairment – extranodal impairment – immunochemotherapy – rituximab
Autoři: M. Trněný 1; J. Šálková 1; J. Dlouhá 1; J. Stříteský 2
Působiště autorů: I. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Marek Trněný, CSc. 1; Ústav patologie 1. lékařské fakulty UK a VFN Praha, přednosta doc. MU Dr. Pavel Dundr, Ph. D. 2
Vyšlo v časopise: Vnitř Lék 2013; 59(7): 606-611
Kategorie: 80. narozeniny prof. MUDr. Marie Brodanové, DrSc.
Souhrn
Ne-Hodgkinovy lymfomy (NHL) jsou nejčastějším krevním nádorem s velmi častým extranodálním postižením. V souboru 1 712 nemocných diagnostikovaných v letech 1999 – 2010 jsme zachytili 79 nemocných (4,6 %) s postižením jater. V 5 případech se jednalo o primárně extranodální postižení, v 1 případě (0,015 %) o primární lymfom jater. Nejčastějším podtypem byl difuzní velkobuněčný lymfom (62,0 %), B ‑ NHL tvořily 92,4 %. U nemocných jsme zaznamenali v 10 % výskyt HBsAg pozitivity. Skupina nemocných byla charakterizována nepříznivou prognózou dle mezinárodního prognostického indexu, kdy vyšší riziko mělo 85 %. Nemocní byli léčeni chemoterapií (95 %), v případě B ‑ NHL v 77 % imunochemoterapií. S mediánem sledování 4,5 roku jsme pozorovali v celé skupině medián doby do progrese, resp. medián celkového přežití 4,6, resp. 8,4 roku. U nemocných s difuzním velkobuněčným lymfomem byl medián doby do progrese, resp. medián celkového přežití 1,4, resp. 8,4 roku. Nemocní s T ‑ NHL mají signifikantně kratší medián přežití proti B ‑ NHL (1,2 vs 8,4 roku, p < 0,033). Nemocní s B ‑ NHL, kteří byli léčeni imunochemoterapií, měli signifikantně nižší riziko úmrtí proti nemocným léčeným jen chemoterapií s HR 0,44 (p = 0,03).
Klíčová slova:
lymfom – ne-Hodgkinovy lymfomy – postižení jater – extranodální postižení – imunochemoterapie – rituximabÚvod
Ne-Hodgkinův lymfom (NHL) je heterogenní skupina lymfoproliferativních chorob, které vycházejí z B ‑ či T‑lymfocytů v různé fázi jejího vývoje. Tvoří ji více než 40 podtypů a v současnosti platná WHO klasifikace [1] zahrnuje do stejné skupiny chronickou lymfatickou leukemii (CLL), která je považována za stejnou jednotku jako lymfom z malých lymfocytů (SLL), či akutní lymfoblastovou leukemii (ALL), která je považována za stejnou jednotku jako lymfoblastový lymfom (LL). NHL se manifestují nejčastěji postižením mízních uzlin, ale u velké části nemocných, až v 80 %, nacházíme extranodální postižení [2,3]. Nejčastějšími místy extranodálního postižení jsou kostní dřeň, zažívací trakt, plíce, kosti, játra a další. Postižený může být prakticky jakýkoli tělesný orgán. Za zvláštní skupinu můžeme považovat NHL, které vznikají primárně extranodálně. Sem jako nejčastější skupinu řadíme lymfomy z marginální zóny primárně extranodální, které vycházejí z MALT tkáně (mucosa ‑ associated lymphoid tissue) a které postihují zejména zažívací trakt, ale mohou postihnout jakýkoli orgán.
Vývoj péče o nemocné s NHL prodělal dramatický vývoj a můžeme zaznamenat několik přelomových období. Nejprve to bylo v 70. letech minulého století, kdy byla do léčby zavedena kombinovaná chemoterapie CHOP [4], poté na přelomu století, kdy byla zavedena do léčby chimérická monoklonální protilátka rituximab (původně IDECC2B8) [5]. Současně s tím došlo k výraznému zlepšení možností hodnocení odpovědi pomocí celotělové pozitronové emisní tomografie (PET) [6] a k dalším pokrokům v oblasti znalostí týkajících se patogeneze. To vše vedlo k současnému výraznému zlepšení osudu nemocných s NHL.
Cílem tohoto sdělení je přehled zkušeností našeho pracoviště s lymfomy, které postihují játra, se zaměřením na léčebné výsledky u těchto nemocných.
Metodika
Jedná se o retrospektivní hodnocení nemocných s NHL, kteří byli na našem pracovišti diagnostikováni v letech 1999 – 2010. Z těchto nemocných byli vybráni ti, kteří měli postižená játra. Definice postižení jater byla: zvětšení jater palpačně a na zobrazovacích metodách se současnými patologickými hodnotami jaterních testů, ložiskové postižení jater při vyšetření zobrazovacími metodami, u části pacientů bylo postižení verifikováno histologicky. Stanovení diagnózy pomocí imunohistochemických metod bylo provedeno na jednom z referenčních pracovišť Kooperativní lymfomové skupiny, většina na Ústavu patologie 1. LF UK a VFN v Praze. Terapie nemocných byla volena podle histologického typu, rizikových faktorů a stavu nemocného. Sledování nemocných probíhalo podle standardních doporučení. Všichni nemocní podepsali informovaný souhlas se zpracováním dat. Pravděpodobnost přežití byla počítána metodou podle Kaplan Maiera, rozdíl v přežití log rank testem.
Výsledky
V letech 1999 – 2010 bylo na I. interní klinice 1. LF UK a VFN v Praze přijato do péče celkem 1 712 nemocných s diagnózou NHL. Nejčastějším podtypem byl difuzní velkobuněčný lymfom se 40,8 %, následovaný folikulárním lymfomem (FL) s 19,4 %. NHL vycházející z T buněk tvořily 5,8 %. Věkový medián celé skupiny byl 60 let (17 – 97). Extranodální postižení bylo zjištěno u 1 275 nemocných (74,5 %). Nejčastější extranodální lokalizací bylo postižení kostní dřeně v 620 případech (36,2 %), zažívací trakt ve 172 případech (10,4 %), plíce a pleura v 154 případech (9,0 %), kosti v 99 případech (5,8 %), CNS v 98 případech (5,7 %), kůže v 91 případech (5,3 %) a játra v 79 případech (4,6 %).
Pouze extranodální postižení bylo zaznamenáno u 326 nemocných (19,0 %). V tomto případě bylo nejčastějším místem postižení CNS v 73 případech (22,4 %), zažívací trakt v 61 případech (18,7 %), kostní dřeň v 52 případech (16,0 %), kosti ve 31 případech (9,5 %), plíce ve 13 případech (4,0 %), játra byla součástí primárně extranodálního postižení v 5 případech (1,5 %).
Jaterní postižení bylo zachyceno u 79 nemocných. V 74 případech se jednalo o postižení zároveň uzlinové, v 5 případech primárně extranodální a z toho v 1 případě představovala játra jedinou postiženou lokalizaci. Tab. 1 shrnuje základní charakteristiky. Věkový medián byl 61,5 roku (23 – 81), poměr mužů a žen byl zhruba 2 : 1 (62,5 % oproti 37,5 %). Nejčastějším histologickým podtypem byl difuzní velkobuněčný lymfom (DLBCL) u 49 nemocných (61,5 %), následovaný folikulárním lymfomem u 4 nemocných (5,0 %), Burkittovým lymfomem a lymfomem z marginální zóny po 3 nemocných (3,8 %), T lymfomy byly diagnostikovány u 6 nemocných, z toho u 2 se jednalo o hepatosplenický γ/δ lymfom. U 14 nemocných se jednalo o jiné podtypy nebo byla diagnóza stanovena obecně jako B ‑ NHL bez bližšího určení.
Tab. 1. Charakteristika nemocných s NHL a jaterním postižením. 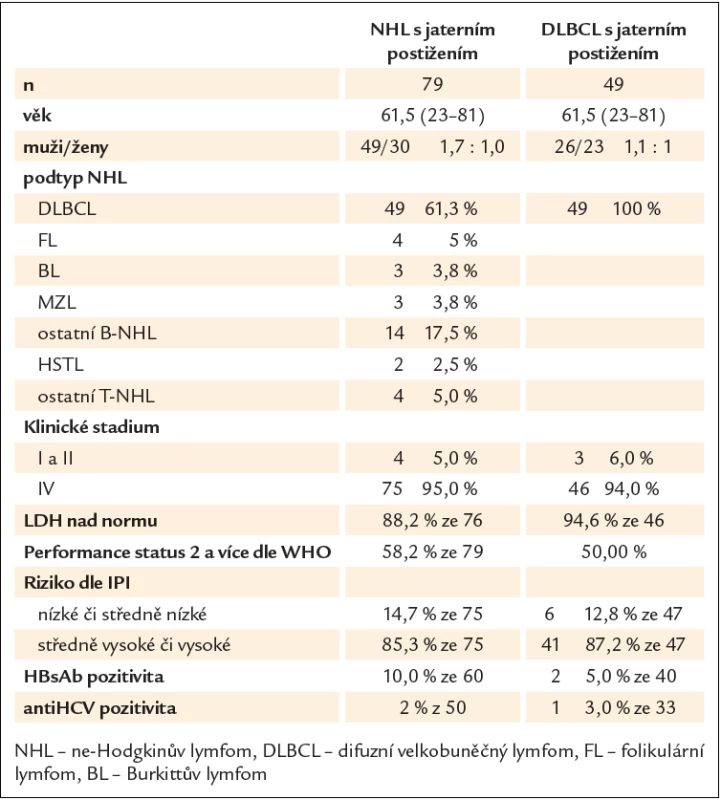
Postižení lymfomem bylo stanoveno na základě histologie z jiné lokalizace a nálezu zvětšených jater a alterací jaterních testů nevysvětlitelné jiným způsobem u 15 nemocných (19 %) a nálezu ložiskového postižení u 46 nemocných (58,2 %). Histologické vyšetření vedlo k závěru postižení jater lymfomem u 18 nemocných (22,8 %) (obr. 1). Rozsah onemocnění byl v 75 případech (96 %) hodnocen jako klinické stadium (KS) IV, ve 3 případech jako KS II a v jednom jako KS I. Hladina LDH byla hodnotitelná u 76 nemocných a z nich byla u 67 (88,2 %) zvýšená. Celkový stav hodnocený podle WHO „performance score“ (PS) byl stanoven jako 0 či 1 u 33 nemocných (41,8 %), jako 2 a vyšší u 46 nemocných (58,2 %). Riziko podle mezinárodního prognostického indexu (IPI) bylo hodnoceno jako nízké či středně nízké u 11 nemocných (14,7 %), jako středně vysoké či vysoké u 64 nemocných (85,3 %).
Obr. 1. Imunohistochemický obraz nálezu jater postižených lymfomem. a: hematoxylin-eozin (zvětšeno 20krát), b: CD20 (zvětšeno 20krát), c: MIBI1 (zvětšeno 20krát) (laskavostí as. MUDr. J. Stříteského, CSc.). 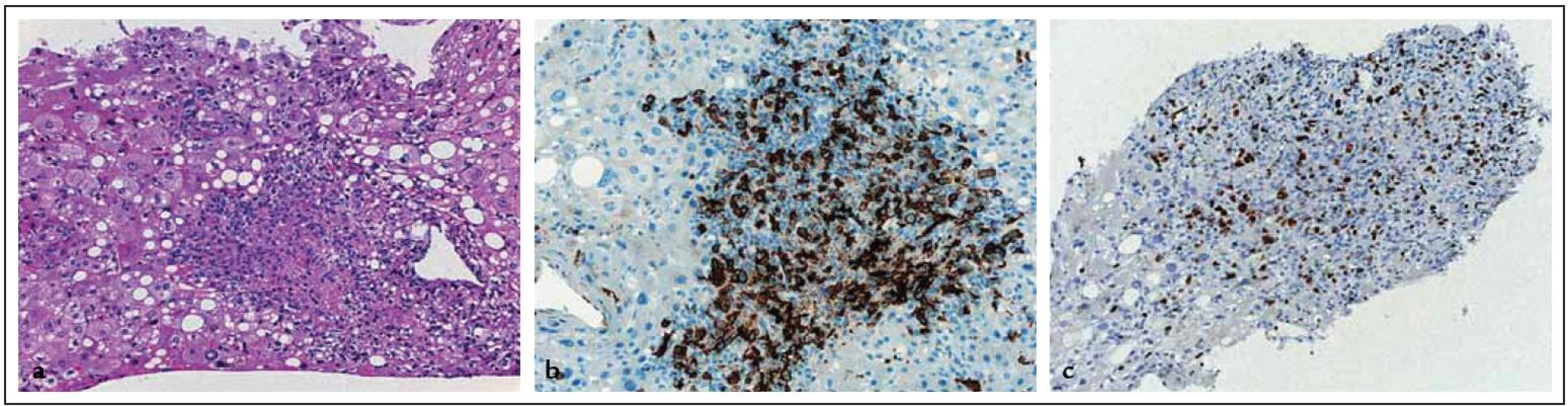
Výsledky HBsAg byly k dispozici u 60 nemocných, z nich mělo 6 (10,0 %) pozitivní nález, HCV pozitivita měřená protilátkami byla k dispozici u 50 nemocných a u 1 byl nález pozitivní (2,0 %).
Při hodnocení největší skupiny (49 nemocných) lymfomu s jaterním postižením, DLBCL, byly zaznamenány následující charakteristiky (tab. 1). Jednalo se o skupinu se srovnatelným zastoupením mužů (n = 26) a žen (n = 23) s věkovým mediánem 61,5 roku (23 – 81). Pokročilé klinické stadium IV bylo pozorováno u 94 % nemocných, vyšší hladina LDH u 44 nemocných (93,6 %), špatný PS (≥ 2) u 30 nemocných (61,2 %) a středně vysoké či vysoké riziko dle IPI u 41 nemocných (87,2 %). Pozitivita HBsAg byla zachycena u 2 ze 40 nemocných (5,0 %) a pozitivita HCV u 1 ze 33 nemocných (3,0 %).
Tab. 2. Léčba a hodnocení odpovědi u nemocných. 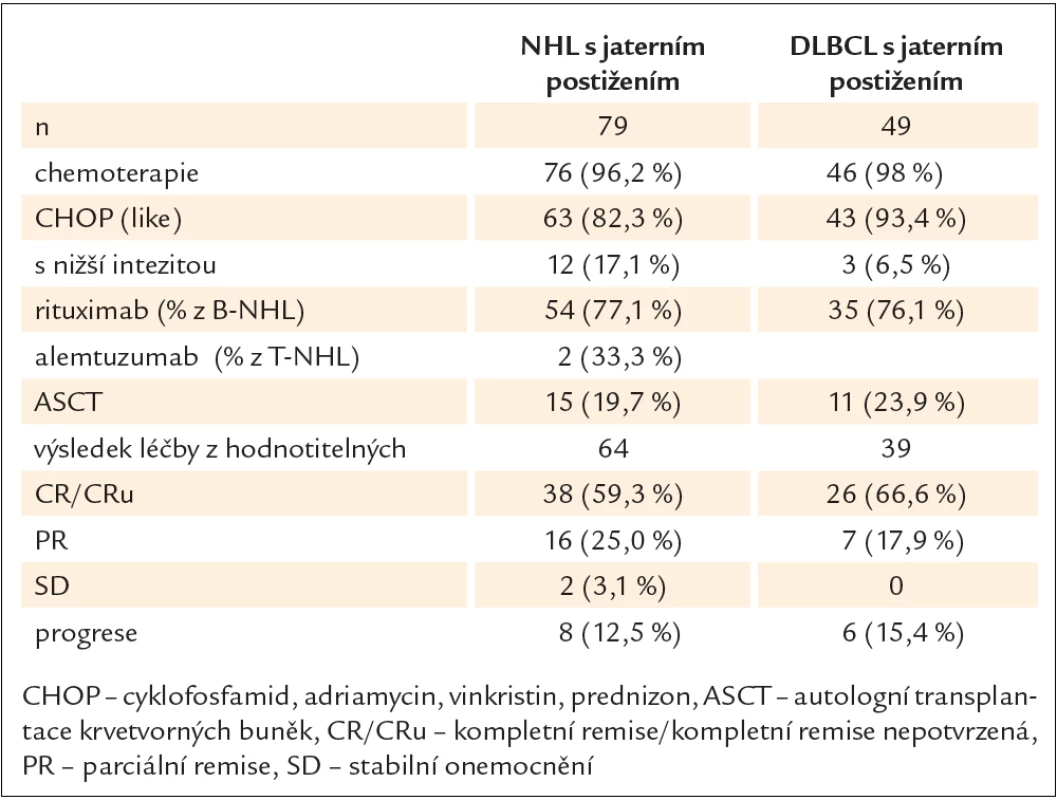
Celkem 76 nemocných bylo léčeno chemoterapií, 3 nemocní zemřeli před zahájením léčby, ze 49 nemocných s DLBCL bylo léčeno 46 nemocných. Většina nemocných byla léčena zároveň rituximabem (77 % z B ‑ NHL) nebo alemtuzumabem (33 % z T ‑ NHL) a chemoterapií založenou na podání antracyklinového režimu. Nejčastějším režimem byla chemoterapie CHOP (cyklofosfamid, adriamycin, vinkristin, prednizon), případně v eskalovaných variantách (MegaCHOP, MaxiCHOP), celkem tak bylo léčeno 82 % nemocných celého souboru a 93 % nemocných s DLBCL. Léčebná odpověď byla hodnotitelná u 64 nemocných z celého souboru (u 10 nemocných nebyla hodnotitelná z důvodu časného úmrtí, 1 z důvodu předání na jiné pracoviště) a u 39 nemocných s DLBCL. Objektivní odpověď byla dosažena u 84 % nemocných s NHL (59 % kompletních remisí – CR, nebo nepotvrzená CR – CRu) a u 85 % s DLBCL (CR u 67 %). U 13 %, resp. u 15 % byl výsledek léčby hodnocen jako časná progrese.
Medián sledování celého souboru byl 4,5 roku. Medián celkového přežití (OS) a přežití bez progrese (PFS) byl v celém souboru 8,4 a 4,6 roku. Nemocní s T ‑ NHL měli signifikantně horší pravděpodobnost celkového přežití proti nemocným B ‑ NHL s mediánem 1,2 roku oproti 8,4 roku (p = 0,033) (graf 1). Nezaznamenali jsme rozdílnou pravděpodobnost přežití u nemocných s agresivním či indolentním B ‑ NHL. Medián OS a PFS u nemocných s DLBCL byl 8,4 a 1,4 roku. U nemocných s DLBCL byly zaznamenány všechny události (progrese, resp. úmrtí) do 2 let od diagnózy (vyjma 1 pozdní za více než 8 let). Prognóza nemocných s B ‑ NHL se signifikantně zlepšila zavedením rituximabu do léčebného schématu. Nemocní léčení imunochemoterapií měli signifikantně menší riziko úmrtí (HR 0,44, p = 0,03) oproti nemocným léčeným jen chemoterapií s pravděpodobností OS ve 3 letech 70,4 % pro R ‑ chemo vs 46,7 % pro skupinu jen s chemoterapií. Stejný trend, byť ne signifikantní (p = 0,15), byl zaznamenán u DLBCL s 65,3 % vs 45,5 % (graf 2).
Graf 1. Pravděpodobnost přežití bez progrese (PFS) a celkového přežití (OS) u celé skupiny nemocných (a) a srovnání OS u B-NHL a T-NHL (b). 
Graf 2. Pravděpodobnost celkového přežití (OS) u skupiny nemocných s B-NHL (a) a skupiny nemocných s DLBCL (b) podle léčby – imunochemoterapie s rituximabem (R-chemo) proti nemocným léčeným jen chemoterapií (chemo). 
Z 5 nemocných, s primárně EN lokalizací, se ve 4 případech jednalo o nemocné s DLBCL. Jedna nemocná zemřela před zahájením léčby, 1 nemocný zemřel na primárně progredující onemocnění a 1 nemocný zemřel v kompletní remisi na toxicitu léčby. Jeden nemocný s DLBCL, u něhož byla játra jediným místem postižení, dosáhl po léčbě kompletní remise, která trvá již 7. rok.
Diskuze
Prognóza NHL je velmi heterogenní. Je dána zejména histologickým podtypem NHL [3,7], ale heterogenní je i uvnitř jednotlivých podskupin. V nich jsou stále zatím nejdůležitějším praktickým prognostickým systémem klinické skórovací indexy, zejména IPI – mezinárodní prognostický index [8], případně jeho modifikace pro jednotlivé typy lymfomů.
Mezi základní prognostické parametry patří rozsah postižení definovaný klinickým stadiem a také počet postižených extranodálních (EN) orgánů. Celkově je u nemocných s NHL nacházeno postižení EN orgánů až u 80 % nemocných [2,3]. Postižení některých z nich, jako např. primární CNS,se vydělují jako samostatné jednotky se zvláštním léčebným přístupem. Postižení jater u NHL bývá uváděno v poměrně širokém rozmezí mezi 3 a 27 % [9 – 13], když většina dat uvádí frekvenci pod 10 %. V našem souboru nemocných s NHL se jednalo o 4,6 % ze všech diagnostikovaných případů. V drtivé většině případů se jednalo o nodální lymfom spolu s extranodálním postižením. Pouze u 5 nemocných se jednalo o primárně extranodální lymfom, v 1 případě šlo o HSTL a ve 4 o DLBCL a z toho pouze v 1 případě o primárně jaterní lymfom. Tato forma postižení je vzácná a i v naší sestavě tedy představuje pouze 0,05 % ze všech NHL a 0,3 % z primárně extranodálních. Podstatně častější zastoupení měly B ‑ NHL (92,5 %). Je překvapivé, že u nemocných s hepatosplenickým γ/δ lymfomem bylo jednou detekováno i postižení uzlinové.
Etiologicky bývá se vznikem části lymfomů spojována HCV infekce, včetně primárně jaterního NHL [14,15]. V naší sestavě jsme neprokázali vyšší incidenci HCV infekce, prokázali jsme ji pouze u 1 nemocného. Částečně překvapivý byl nález vyššího záchytu HBsAg pozitivity 10 %, což je výrazně vyšší než prevalence pod 1 % udávaná pro ČR. O možné etiologické souvislosti se lze dohadovat. Nález je důležitý z praktického pohledu, všichni nemocní jsou vyšetřeni na přítomnost HBV DNA a ještě před zahájením léčby je indikováno profylaktické podávání antivirotik. U žádného nemocného jsme v průběhu léčby nezaznamenali významnější jaterní komplikace.
Z pohledu rizikových faktorů patřil soubor mezi výrazně rizikové – více než 90 % bylo diagnostikováno v pokročilém klinickém stadiu IV, téměř 90 % nemocných mělo zvýšenou hladinu LDH, performance status byl ve více než 50 % stupně 2 a vyšší, riziko dle IPI bylo středně vysoké či vysoké v 85 % případů.
NHL patří mezi choroby, kde došlo za posledních 15 let k výraznému zlepšení přežití, platí to zejména pro některé podtypy, na prvním místě pro DLBCL, který tvoří více než 40 % všech nově diagnostikovaných lymfomů v ČR [3] a v této sestavě tvořil 61,5 %. V historii léčby lymfomů došlo k prvnímu významnému přelomu před 40 lety, kdy byla zavedena kombinovaná chemoterapie s antracykliny, režim CHOP [4], a druhým zlomem bylo zavedení rituximabu do léčby lymfomů. Rituximab byl u lidí poprvé použit před 20 lety [16], do standardní léčby indolentních lymfomů byl zaveden před 15 lety [5] a jako imunochemoterapie signifikantně zlepšil osud nemocných s DLBCL [17] i s folikulárním lymfomem včetně udržovací terapie [18,19]. Naposledy bylo prokázáno signifikantní zlepšení při udržovací terapii s lymfomem z plášťových buněk [20].
V našem souboru byli všichni nemocní, kromě 3, kteří zemřeli před zahájením léčby, léčeni chemoterapií, kdy nejčastějším režimem v 82 % byl CHOP (u DLBCL v 93 %). Tři čtvrtiny nemocných s B ‑ NHL byly léčeny imunochemoterapií – kombinací s rituximabem, 2 ze 6 nemocných s T ‑ NHL byli léčeni anti‑CD52 protilátkou alemtuzumabem v kombinaci s chemoterapií. Vysokodávkovaná terapie s ASCT byla použita ve 20 %, resp. 23 %. Celková odpověď byla poměrně vysoká – 84 %, resp. 85 %, s dosažením kompletní remise u 59 %, resp. 67 %. Výsledky přežití byly signifikantně lepší u B ‑ NHL ve srovnání s T ‑ NHL, což odpovídá publikovaným údajům. Pokud jsme analyzovali B ‑ NHL samostatně, pak je nutno PFS i OS hodnotit jako neuspokojivé s hodnotami kolem 50 % v 5 letech pro oba parametry, jak pro celou skupinu B ‑ NHL, tak pro nemocné s DLBCL. Výrazné zlepšení výsledků znamenalo i v této skupině zavedení rituximabu do léčebného schématu. Výsledky jsme srovnali jednak s klíčovou studií Coiffiera et al [17], která byla zaměřena na DLBCL u nemocných starších 60 let. V naší sestavě byl nižší medián věku 61,5 roku oproti 69 letům, na druhou stranu byla naše skupina prognosticky výrazně horší – středně vysoké či vysoké riziko dle IPI bylo v 87 % oproti 53 %. Pokud srovnáme pravděpodobnost OS ve 2 letech u nemocných léčených imunochemoterapií, jsou výsledky v naší a Coiffierově studii srovnatelné, 69,1 % oproti 70 %. Výsledky jsme srovnali s nálezy naší studie zaměřené na mladší nemocné s DLBCL (věkový medián 46 let, 19 – 64, v současné kohortě byl 61,5 roku, 23 – 81), ale jinak se jednalo o nemocné s obdobným prognosticky nepříznivým profilem, léčené výrazně intenzivnějším protokolem R ‑ MegaCHOP/ ESHAP/ BEAM [21]. Při srovnání PFS, resp. OS ve 3 letech ve skupinách léčených imunochemoterapií v souboru s jaterním postižením oproti historické kohortě mladších nemocných léčených intenzivně byla pozorována pravděpodobnost PFS 52,6 % pro DLBCL s jaterním postižení vs 74 % a OS 65,3 % vs 76 %.
Za zajímavé lze považovat i pozorování nemocného s primárně jaterním DLBCL, s bulky postižením nad 10 cm, s vysokou hladinou LDH, který byl léčen imunochemoterapií R ‑ CHOP, dosáhl kompletní remise PET negativní, v níž žije již 7 let. Naopak diagnóza hepatosplenického lymfomu bývá spojena s velmi špatnou prognózou [22]. Jeden z našich nemocných zemřel na komplikace intenzivní protinádorové terapie, druhý dosáhl kompletní remise, v níž setrval překvapivě dlouho, a zemřel bez přítomnosti choroby 6 let od stanovení diagnózy.
Závěr
Můžeme shrnout, že u nemocných s NHL jsme pozorovali jaterní postižení u 4,6 % nemocných, když drtivá většina měla postižení i nodální, a pouze 6,3 % z nich mělo postižení primárně extranodální. Nejčastějším podtypem byl DLBCL s 61,2 %. Postižení jater je u NHL spojeno s dalšími rizikovými faktory a drtivá většina patří do skupiny s nepříznivou prognózou. Výsledky léčby se zejména u B ‑ NHL výrazně zlepšily po zavedení rituximabu a při srovnání s historickými daty výsledky odpovídají stejně rizikovým nemocným. Nemocní s T ‑ NHL mají signifikantně horší prognózu.
Práce byla podpořena financování ze zdroje PRVOUK ‑ 27/ LF1/ 1.
prof. MU Dr. Marek Trněný, CSc.
www.vfn.cz
e‑mail: trneny@cesnet.cz
Doručeno do redakce: 16. 5. 2013
Zdroje
1. Swerdlow SH et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon: IARC Press 2008.
2. Armitage JO, Weisenburger DD. New approach to classifying non‑Hodgkin’s lymphomas: clinical features of the major histologic subtypes. Non ‑ Hodgkin’s Lymphoma Classification Project. J Clin Oncol 1998; 16 : 2780 – 2795.
3. Trneny M, Vášová I, Pytlík R et al. Distribuce podtypů non‑hodgkinského lymfomu v České republice a jejich přežití. Klin Onkol 2007; 20 : 341 – 348.
4. Gottlieb JA, Gutterman JU, McCredie KB et al. Chemotherapy of malignant lymphoma with adriamycin. Cancer Res 1973; 33 : 3024 – 3028.
5. McLaughlin P, Grillo ‑ López AJ, Link BK et al. Rituximab chimeric anti‑CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four‑dose treatment program. J Clin Oncol 1998; 16 : 2825 – 2833.
6. Cheson BD, Pfistner B, Juweid ME et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25 : 579 – 586.
7. The Non ‑ Hodgkin’s Lymphoma Classification Project. A clinical evaluation of the International Lymphoma Study Group classification of non‑Hodgkin’s lymphoma. Blood 1997; 89 : 3909 – 3918.
8. The International Non ‑ Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model for aggressive non‑Hodgkin’s lymphoma. N Engl J Med 1993; 329 : 987 – 994.
9. Bach AG, Behrmann C, Holzhausen HJ et al. Prevalence and imaging of hepatic involvement in malignant lymphoproliferative disease. Clin Imaging 2012; 36 : 539 – 546.
10. Civardi G, Vallisa D, Berte R et al. Focal liver lesions in non‑Hodgkin’s lymphoma: investigation of their prevalence, clinical significance and the role of Hepatitis C virus infection. Eur J Cancer 2002; 38 : 2382 – 2387.
11. Baumhoer D, Tzankov A, Dimhofer S et al. Patterns of liver infiltration in lymphoproliferative disease. Histopathology 2008; 53 : 81 – 90.
12. Takahashi H, Tomita N, Yokoyama M et al. Prognostic impact of extranodal involvement in diffuse large B ‑ cell lymphoma in the rituximab era. Cancer 2012; 118 : 4166 – 4172.
13. Castellani R, Bonadonna G, Spinelli P et al.Sequential pathologic staging of untreated non‑Hodgkin’s lymphomas by laparoscopy and laparotomy combined with marrow biopsy. Cancer 1977; 40 : 2322 – 2328.
14. Noronha V, Shafi NQ, Obando JA et al. Primary non‑Hodgkin’s lymphoma of the liver. Crit Rev Oncol Hematol 2005; 53 : 199 – 207.
15. Viswanatha DS, Dogan A. Hepatitis C virus and lymphoma. J Clin Pathol 2007; 60 : 1378 – 1383.
16. Maloney DG, Liles TM, Czerwinski DK et al.Phase I clinical trial using escalating single‑dose infusion of chimeric anti‑CD20 monoclonal antibody (IDEC ‑ C2B8) in patients with recurrent B ‑ cell lymphoma. Blood 1994; 84 : 2457 – 2466.
17. Coiffier B, Lepage E, Briere J et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large ‑ B ‑ cell lymphoma. N Engl J Med 2002; 346 : 235 – 242.
18. Marcus R, Imrie K, Belch A et al. CVP chemotherapy plus rituximab compared with CVP as first‑line treatment for advanced follicular lymphoma. Blood 2005; 105 : 1417 – 1423.
19. Salles G, Seymour JF, Offner F et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet 2011; 377 : 42 – 51.
20. Kluin‑Nelemans HC, Hoster E, Hermine O et al. Treatment of older patients with mantle ‑ cell lymphoma. N Engl J Med 2012; 367 : 520 – 531.
21. Trneny M, Pytlik R, Belada D et al. Treatment of diffuse large B ‑ Cell lymphoma with rituximab, intensive induction and high‑dose consolidation: the final analysis of the Czech Lymphoma Study Group (CLSG) R ‑ MegaCHOP ‑ ESHAP ‑ BEAM (R ‑ MEB) trial. Blood 2007; 110 : 14A.
22. Ferreri AJ, Govi S, Pileri SA. Hepatosplenic gamma ‑ delta T ‑ cell lymphoma. Crit Rev Oncol Hematol 2012; 83 : 283 – 292.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Onemocnění jater u diabetikůČlánek Polypózy trávicího traktuČlánek Wilsonova chorobaČlánek Mnohočetný myelomČlánek Flavonoidy vážně i nevážně
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 7- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- K významnému životnímu jubileu prof. MUDr. Marie Brodanové, DrSc.,
- K životnímu jubileu prof. MU Dr. Marie Brodanové, DrSc.
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Pokroky v onkohematologii v 21. století
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Rifaximin v léčbě chronické divertikulózy
- Flavonoidy vážně i nevážně
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



