-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaInhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
Tyrosine kinase inhibitors – major change in the prognosis of chronic myeloid leukaemia
Chronic myeloid leukaemia (CML) is an example of a tumour disease, in which the discovery of its molecular principle resulted in the development of the specific targeted molecular treatment with the first representative being imatinib. The introduction of other tyrosine kinase inhibitors, nilotinib and dasatinib, into the clinical practice meant not only a revolutionary change in the treatment approach to CML but literally an epochal improvement of the prognosis and quality of life. The disease with an originally fatal prognosis in patients diagnosed in the chronic stage has changed into a disease with the expected survival rate median estimated to be more than 25 years.
Key words:
chronic myeloid leukaemia – tyrosine kinase inhibitors – imatinib – dasatinib – nilotinib
Autoři: H. Klamová
Působiště autorů: Ústav hematologie a krevní transfuze Praha, ředitel prof. MU Dr. Marek Trněný, CSc.
Vyšlo v časopise: Vnitř Lék 2013; 59(7): 624-626
Kategorie: 80. narozeniny prof. MUDr. Marie Brodanové, DrSc.
Souhrn
Chronická myeloidní leukemie (CML) je příkladem nádorového onemocnění, u kterého vedlo odhalení jeho molekulární podstaty k vývoji specifické cílené molekulární léčby, jejímž prvním představitelem je imatinib. Zavedení dalších inhibitorů tyrozinových kináz nilotinibu a dasatinibu do klinické praxe znamenalo nejen převratnou změnu v léčebném přístupu k CML, ale doslova revolučním způsobem zlepšilo také jeho prognózu a kvalitu života. Onemocnění s původně fatální prognózou se u pacientů diagnostikovaných v chronické fázi změnilo v onemocnění s očekávaným mediánem přežití odhadovaným na více než 25 let.
Klíčová slova:
chronická myeloidní leukemie – inhibitory tyrozinových kináz – imatinib – dasatinib – nilotinibChronická myeloidní leukemie (CML) je klonální nádorové onemocnění vznikající neoplastickou transformací hemopoetické kmenové buňky, které představuje 15 % všech leukemií, 20 – 25 % leukemií v dospělosti a 3 – 5 % v dětském věku [1]. Celková incidence je 1 – 1,5 nových onemocnění na 100 000 obyvatel za rok s mírnou predispozicí mužů (1,4 : 1). Počet nových onemocnění narůstá s přibývajícím věkem, medián věku při stanovení diagnózy je 65 let [2].
CML je vůbec první nádorovou chorobou, u které byla prokázána získaná chromozomová změna, nazvaná podle místa objevu jako Philadelphia (Ph) chromozom. Ph chromozom je výsledkem reciproké translokace mezi chromozomy 9 a 22, při které vzniká fúzní gen BCR ‑ ABL. Při translokaci t(9,22) fúzuje větší část genu ABL po zlomení 9. chromozomu s částí zlomeného genu BCR na 22. chromozomu, a vytváří tak chimérický gen BCR ‑ ABL, nesoucí vždy část informace obou genů. Ten kóduje protein p210BCR/ ABL, který vykazuje tyrozinkinázovou aktivitu proteinu c ‑ ABL. Od c ‑ ABL se však významně liší v několikanásobně zvýšené tyrozinkinázové aktivitě a tím, že je autofosforylován, což zabraňuje jeho jakékoliv regulaci. Lokalizací v cytoplazmě je umožněn přístup k substrátům, které díky své vysoké aktivitě s vysokou účinností může fosforylovat, a tím aktivovat. Při vzniku fúzního genu BCR-ABL dochází většinou ke zlomům genů v několika jejich oblastech, vždy výlučně v intronech. V genu ABL je to po obou stranách nebo mezi exony Ia a Ib, zatímco v genu BCR na třech místech, nazývaných M ‑ bcr (major), m ‑ bcr (minor) a mikro‑bcr (micro). Nejčastějším místem zlomů však jsou 2 introny v oblasti major (M) - bcr, které se také vyskytují u 99 % BCR/ ABL pozitivních CML. Výsledkem jsou pak fúzní geny označované jako b2a2 (dle novější nomenklatury e13 - a2) nebo b3a2 (resp. e14 - a2). Z hlediska klinického jsou obě tyto varianty rovnocenné a oba kódují stejný protein o hmotnosti 210 kD – p210BCR/ ABL [3].
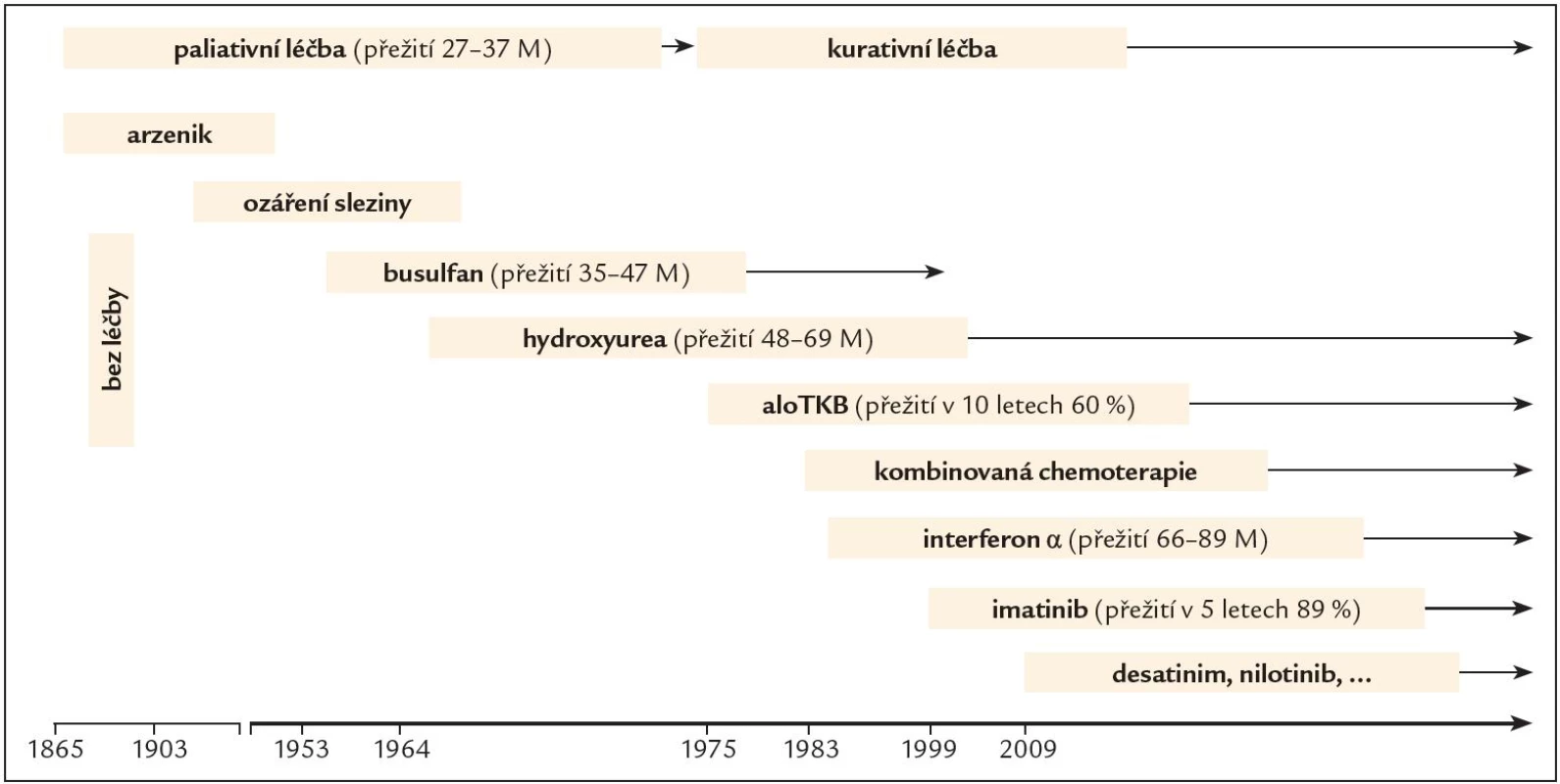
Léčba onemocnění nebyla zpočátku po dobu mnoha desetiletí úspěšná. První zprávy o léčbě CML pocházejí z roku 1885, kdy byl poprvé pacientovi podán za účelem snížení počtu leukocytů roztok, který obsahoval arzen. Poté následovalo ozáření sleziny, ve 2. polovině 20. století léčba cytoredukčními látkami typu busulfan a hydroxyurea, které sice dokázaly účinně potlačit příznaky nemoci a navodit hematologickou odpověď, ale její trvání bylo limitované, byly tedy léčbou pouze paliativní (obr. 1). Devadesátá léta minulého století byla obdobím, kdy do léčby nastoupil interferon α (IFN α), biologický mediátor, glykoprotein s inhibičním účinkem na leukemickou buňku a schopností diferenciačního efektu, obnovení apoptózy, adhezivity kmenové buňky ke stromatu a imunomodulace. Jeho rekombinantní forma byla aplikována subkutánně v dávce 3 – 5 miliónů jednotek (UI) denně za pravidelných kontrol hodnot krevního obrazu, biochemických parametrů a kvality cytogenetické odpovědi. INF byl schopen navodit kromě hematologické odpovědi u 25 – 30 % nemocných také cytogenetickou odpověď, a přežití v chronické fázi onemocnění tak prodloužit na 55 – 89 měsíců [4]. Ještě vyšší účinnosti bylo dosahováno při podávání v kombinaci s nízce dávkovaným cytosinarabinosidem. Projevy nežádoucích účinků léčby však vedly k častému redukování dávky, přerušování léčby a z toho plynoucí ztrátě účinnosti.
Alogenní transplantace kmenových buněk krvetvorby (ATKB) byla první kurativní léčbou CML datovanou rokem 1975 a byla v té době indikována a realizována co nejdříve po stanovení diagnózy u všech mladších jedinců, kteří měli HLA shodného sourozence nebo nepříbuzného dárce. V současné době je léčbou 2., event. 3. linie po selhání předchozí léčby tyrozinkinázovými inhibitory.
Nové poznatky v molekulární biologii a patofyziologii CML pohled na možnosti léčby výrazně změnily. Důležitou oblastí zájmu se stala BCR ‑ ABL tyrozinkinázová aktivita a vývoj efektivních inhibitorů tyrozinové kinázy (TKI). Zcela zásadní změnu znamenalo objevení molekuly imatinibu (IM), látky, která představuje léčbu na zcela jiném principu než terapie dosud podávaná a je prvním představitelem skutečně cílené léčby onemocnění [5].
Jedná se o látku, která blokuje funkci proteinu BCR ‑ ABL, jenž je produktem fúzního genu BCR ‑ ABL. Blokuje proliferaci buněčných linií CML, exprimujících protein BCR ‑ ABL a indukuje v nich apoptózu. Působí jako kompetitivní inhibitor vazebného místa BCR ‑ ABL pro ATP (obr. 2). Hlavní účinek vazby imatinibu spočívá v blokádě autofosforylace kinázy, zjednodušeně řečeno potlačení klíčového mechanizmu abnormální aktivace signálních drah leukemické buňky. Tento účinný perorální inhibitor TK první generace vstoupil do klinické praxe v roce 2001 na základě velmi přesvědčivých průběžných výsledků klinické studie International Randomised Study of Interferon versus STI ‑ 571 (imatinib) (IRIS studie) fáze IIII, ve které na více než 1 000 pacientů s CML v CP nyní již po více než 7 letech sledování jednoznačně prokázala vysokou účinnost léku co do počtu dosažených hematologických a cytogenetických odpovědí (97 % a 88 %) a výrazně se zvýšila také pravděpodobnost dlouhodobého přežívání nemocných a kvalita jejich života [6]. Nicméně i přes vysokou účinnost imatinibu a jeho místo v první linii léčby existuje skupina nemocných, kteří jsou vůči němu rezistentní nebo jej netolerují, a tato léčba je proto u nich neúčinná. Mezi velmi časté důvody rezistence na IM jsou mutace v kinázové doméně BCR ‑ ABL a také aktivace na BCR ‑ ABL nezávislých signálních drah např. příslušníky rodiny Src kináz. I tyto situace jsme již v současné době schopni řešit, a to změnou léčby za TKI 2. generace, kterými jsou dasatinib a nilotinib [7].
Obr. 2. Mechanizmus účinku imatinibu. 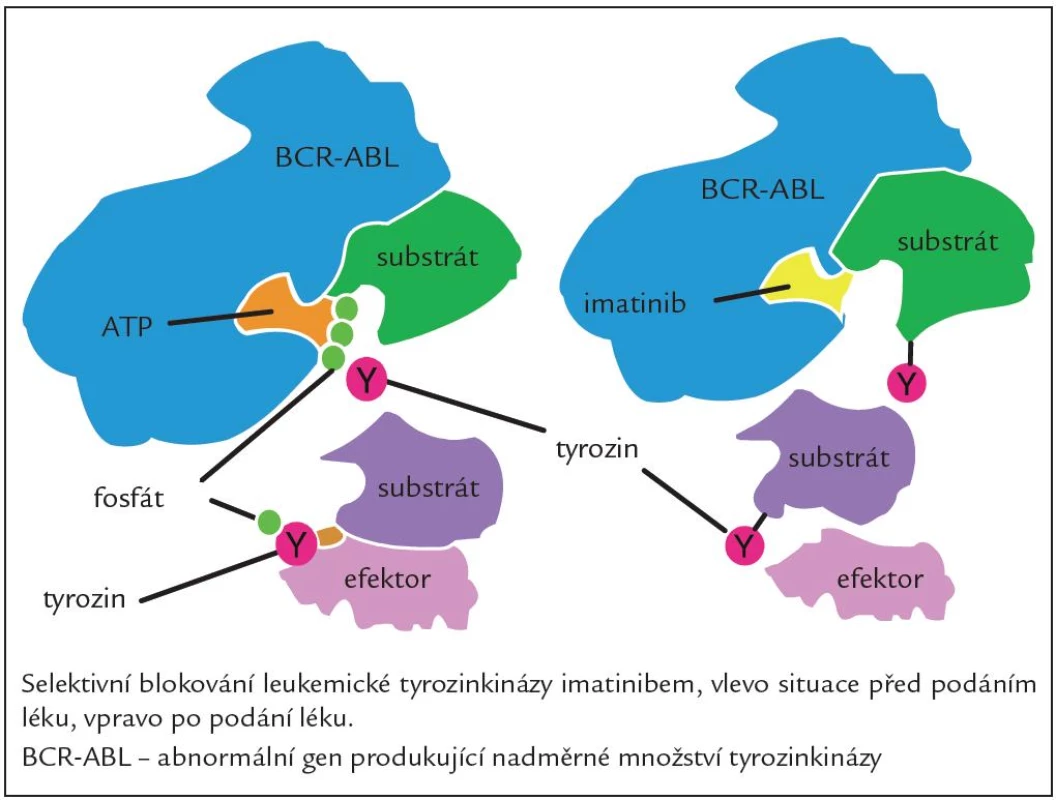
Dasatinib, látka poněkud jiné struktury než imatinib, je selektivní kompetitivní duální (SRC a ABL) inhibitor, inhibující také kinázy Src rodiny. In vitro jde zatím o nejúčinnější blokátor tyrozinové kinázy BCR ‑ ABL, 325krát účinnější než IM a 16krát účinnější než nilotinib, další TKI druhé generace. Přežití bez progrese u pacientů v chronické fázi, kde selhala léčba imatinibem, je 80 %, celkové přežití 92 % [8].
Nilotinib je strukturálně podobný imatinibu, s 20 – 30krát silnější vazbou k proteinu BCR ‑ ABL, účinný také proti většině mutací BCR ‑ ABL s výjimkou mutace T315I. Klinické studie potvrdily jeho očekávanou účinnost a toleranci, a stal se tak další významnou alternativou léčby nemocných s CML, u kterých selhala terapie TKI 1. generace imatinibem (tab. 1) [9]. Od konce roku 2012 jej lze podávat také nemocným v první linii.
Tab. 1. Možnosti léčby CML po zavedení TKI do klinické praxe. 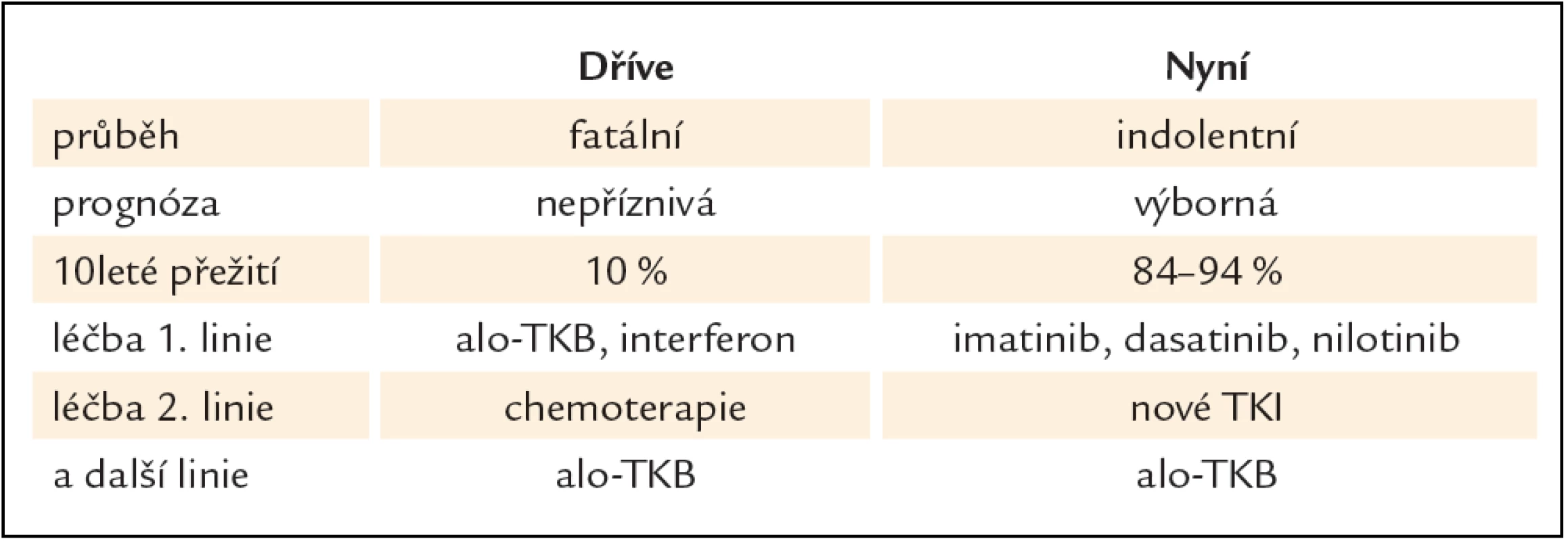
V současné době jsou již k dispozici také první nadějné výsledky klinických studií fáze III dalších TKI, a to s bosutinibem a ponatinibem, který je také jako jeden z prvních dosud známých TKI účinnou zbraní u nositelů mutace T315I [10].
Novými léčebnými možnosti CML ve fázích klinických studií fáze I, II a preklinického zkoušení jsou např. homoharingtonin (HHT) – inhibitor proteosyntézy, 4 - aza ‑ 2’deoxycytidine – hypometylační látka, inhibitory genové exprese, antisense oligonukleotidy (ASO), mediátory imunitní odpovědi, inhibitory GRB2, farnesyltransferázy (FTIs), vakcinační terapie a další [11].
Závěr
Zavedení inhibitorů tyrozinových kináz do klinické praxe znamenalo zásadní převrat v léčbě CML také v České republice, kde je tato vysoce účinná, ale současně také nákladná léčba realizována v 7 hematoonkologických centrech, vedoucích nejen vlastní léčbu, ale také pravidelnou monitoraci jejího průběhu [12]. Významně se prodloužilo přežití pacientů bez progrese nemoci, celkové přežití, výrazně se zlepšila také kvalita jejich života. Včasné odhalení nemocných, kteří na léčbu první linie nereagují optimálně, a možnost podat léčbu TKI druhé linie znamená pro pacienta v chronické fázi, který optimálně odpověděl na léčbu, pravděpodobnost přežití s odhadem mediánu 25 let a více. Je tedy splněn také další důležitý cíl moderní onkologie, kterým je návrat nemocného zpět do života, rodinného prostředí a zaměstnání, a to s léčbou vedenou efektivně v ambulancích hematoonkologických pracovišť.
MU Dr. Hana Klamová, CSc.
www.uhkt.cz
e‑mail: Hana.Klamova@uhkt.cz
Doručeno do redakce: 1. 5. 2013
Zdroje
1. Hehlmann R, Hochhaus A, Baccarani M. Chronic myeloid leukaemia. Lancet 2007; 370 : 342 – 350.
2. Rohrbacher M, Berger U, Hochhaus SA et al. Clinical trials underestimate the age of chronic myeloid leukemia (CML) patients. Incidence and median age of Ph/ BCR ‑ ABL ‑ positive CML and other chronic myeloproliferative disorders in a representative area in Germany. Leukemia 2009; 23 : 602 – 604.
3. Faderl S, Talpaz M, Estrov Z et al. Chronic myelogenous leukemia: biology and therapy. Ann Intern Med 1999; 131 : 207 – 219.
4. Kantarjian HM, OʼBrien S, Cortes JE et al. Complete cytogenetic and molecular response to interferon‑alfa‑based therapy for chronic myelogenous leukemia are associated with excellent long‑term prognosis. Cancer 2003; 97 : 1033 – 1041.
5. Drucker BJ, Tamura S, Buchdunger E et al. Effect of selective inhibitor of the Abl tyrosine kinase on the growth of Bcr ‑ Abl positive cells. Nat Med 1996; 2 : 561 – 566.
6. Hochhaus A, OʼBrien SG, Guilhot F et al. Six‑year follow‑up of patients receiving imatinib for the first‑line treatment of chronic myeloid leukemia. Leukemia 2009; 23 : 1054 – 1061.
7. Goldman JM. Treatment strategies for CML. In: Rowe JM, Hehlman R (eds). Best Practice & Research. Clinical Haematology 2009; 22 : 303 – 313.
8. Hochhaus A, Kantarjian HM, Baccarani M et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic ‑ phase chronic myeloid leukemia after failure of imatinib therapy. Blood 2007; 109 : 2303 – 2309.
9. Kantarjian HM, Giles F, Gattermann N et al. Nilotinib (formerly AMN107), a highly selective BCR ‑ ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome ‑ positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood 2007; 110 : 3540 – 3546.
10. Cortes JE, Kantarjian HM, Brümmendorf TH et al. Safety and efficacy of bosutinib (SKI ‑ 606) in chronic phase chronic Ph+ CML patients with resistance or intolerance to imatinib. Blood 2011; 118 : 4567 – 4576.
11. Bocchia M, Gentili S, Abruzzese E et al. Effect of a p210 multipeptide vaccine associated with imatinib or interferon in patients with chronic myeloid leukaemia and persistent residual disease: a multicentre observational trial. Lancet 2005; 365 : 657 – 662.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Onemocnění jater u diabetikůČlánek Polypózy trávicího traktuČlánek Wilsonova chorobaČlánek Mnohočetný myelomČlánek Flavonoidy vážně i nevážně
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 7- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- K významnému životnímu jubileu prof. MUDr. Marie Brodanové, DrSc.,
- K životnímu jubileu prof. MU Dr. Marie Brodanové, DrSc.
- Onemocnění jater u diabetiků
- Účinky GLP-1 (glucagon‑like peptide 1) na játra
- Polypózy trávicího traktu
- Vrozené hyperbilirubinemie a molekulární mechanizmy žloutenky
- Cystické nádory pankreatu – naše zkušenosti
- Wilsonova choroba
- Vliv jaterní cirhózy na farmakokinetiku a farmakodynamiku léčiv
- Katetrizace jaterních žil – vybrané aspekty hodnocení
- Reaktivace chronické hepatitidy B
- Akutní pankreatitida – novinky v léčbě
- Postižení jater u nemocných s ne-Hodgkinovým lymfomem
- Léčba chronické infekce virem hepatitidy C na začátku nové éry
- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Pokroky v onkohematologii v 21. století
- Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie
- Mnohočetný myelom
- Pokroky v léčbě chronické lymfocytární leukemie
- Myelodysplastický syndrom – pokrok v léčbě v 21. století
- Rifaximin v léčbě chronické divertikulózy
- Flavonoidy vážně i nevážně
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vztah bilirubinu k nemocem vyvolaným zvýšeným oxidačním stresem
- Cystické nádory pankreatu – naše zkušenosti
- Onemocnění jater u diabetiků
- Akutní pankreatitida – novinky v léčbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání