-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMôže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
Is thromboelastography able to influence management of patients in cardiology and cardiosurgery?
Thromboelastography (TEG) is perceived as a non‑specific test of hemostasis. It evaluates the global hemocoagulation, however by some modifications could be its diagnostic potential greater. With new inovations is TEG except more precise analysis of participation of blood components on final coagulation (for example rotational TEG) capable also to assess the antiplatelet drug nonresponsiveness (for example platelet mapping system). It gives more accurate information about prothrombotic conditions than routine laboratory techniques in state of ventricular assist device implantation.
Key words:
thromboelastography – hemocoagulation – platelets – antiplatelet drug nonresponsiveness – ventricular assist device
Autoři: I. Varga 1
; I. Olejárová 2; E. Goncalvesová 1
Působiště autorů: Oddelenie zlyhávania a transplantácie srdca Národného ústavu srdcových a cievnych chorôb, a. s., Bratislava, Slovenská republika, prednostka doc. MU Dr. Eva Goncalvesová, CSc. 1; Oddelenie anesteziológie a intenzívnej medicíny Národného ústavu srdcových a cievnych chorôb, a. s., Bratislava, Slovenská republika, primárka MU Dr. Ingrid Olejárová 2
Vyšlo v časopise: Vnitř Lék 2009; 55(11): 1070-1078
Kategorie: Přehledné referáty
Souhrn
Tromboelastografia (TEG) je chápaná ako nešpecifická diagnostická metóda pre poruchy hemostázy. Hodnotí globálny priebeh hemokoagulácie, ale pri istých modifikáciách sa jej diagnostický potenciál zvyšuje. Vďaka inováciám TEG nielenže umožňuje presnejšie hodnotenie podielu jednotlivých zložiek na konečnom stave koagulácie (napr. rotačná TEG), ale je schopná tiež posúdiť zlyhanie antiagregačnej liečby (napr. tzv. systém mapovania doštičiek). Presnejšiu informáciu o protrombotických pomeroch než rutinné laboratórne metodiky poskytuje aj v podmienkach implantácie mechanických podporných systémov srdca.
Kľúčové slová:
tromboelastografia – hemokoagulácia – krvné doštičky – zlyhanie antiagregačnej liečby – mechanické podporné systémyDefinícia a charakteristika
Tromboelastografia (TEG) ako metodika analýzy zrážania krvi bola popísaná po prvý raz v roku 1948 nemeckým hematológom Helmutom Hartertom. Výsledkom vyšetrenia plnej krvi alebo rekalcifikovanej plazmy pomocou prístroja – trombelastografu – je tromboleastogram, t.j. krivka, ktorej šírka je závislá od meniacej sa viskozity krvi v jednotlivých fázach jej zrážania sa [1,2].
Hlavnou výhodou TEG je možnosť monitorovania koagulácie v čase (od vzniku koagula až po jeho prípadný predčasný rozpad) priamo pri lôžku pacienta. Oproti protrombínovému či aktivovanému parciálnemu tromboplastínovému času (PT či aPTT) lepšie odráža konečnú pevnosť krvnej zrazeniny. Množstvo trombínu nevyhnutné na vytvorenie dlhodobo stabilného trombu (výsledok TEG) je totiž omnoho väčšie ako množstvo potrebné na samotný vznik trombu (PT, aPTT). Navyše sa PT a aPTT realizujú v plazme chudobnej na doštičky po pridaní fosfolipidov [3], čím sa nezohľadní prokoagulačný vplyv krvných doštičiek [4]. Ďalšími výhodami TEG sú reprodukovateľnosť (v rámci pracoviska a v budúcnosti pri štandardizácii postupov snáď aj medzi pracoviskami navzájom), ako aj počítačové spracovanie s možnosťou nahrávania a archivácie. Priamo v praxi je tak TEG rozhodujúcou metódou využívanou predovšetkým v pooperačnej starostlivosti, kde umožňuje efektívnu kontrolu koagulácie s minimalizáciou spotreby antikoagulancií či hemostyptík a aj transfúznych prípravkov. Naopak nevýhodou metodiky je vyšetrovanie plnej krvi, čo ju radí medzi tzv. nešpecifické testy hemostázy, ako aj fakt, že nikdy nebola zaradená v hematologických laboratóriách medzi postupy so zabezpečenou kvalitou. Inou príčinou jej zaznávania je, že nebola použitá vo veľkých, randomizovaných a porovnávacích biologických štúdiách s vysokým počtom pacientov [5]. Nezanedbateľný je aj ekonomický aspekt vyšetrenia (napr. cena prístroja Haemoscope – viď nižšie – je asi 1 mil.Kč a náklady na 1 vyšetrenie sú približne 500Kč – adekvátne v eurách). Tento faktor však určite vyvažujú vyššie uvedené výhody, nielen z ekonomického (úspora transfúznych prípravkov), ale predovšetkým z klinického hľadiska (adekvátna a bezpečná liečba pacientov).
Princíp vyšetrenia
Monitorovanie hemostázy tromboelastrografom je založené na 2 faktoch:
- a) finálnym produktom hemostatického procesu je krvná zrazenina a
- b) fyzikálne vlastnosti zrazeniny určujú, či pacient bude mať normálny priebeh hemostázy, či bude krvácať, alebo vznikne u neho trombotická komplikácia
TEG nám v zásade dáva informáciu o tom, či a ako rýchlo sa koagulum vytvorí, ako je pevné, či vydrží pevné alebo sa predčasne rozpadáva [6].
Existuje niekoľko technických riešení, z ktorých dve sú dostupné v európskych podmienkach. Prvým je tromboelastograf TEG® firmy Haemoscope (Niles, IL, USA) (obr. 1), ktorý je využívaný aj na našom pracovisku. Vzorka krvi je pri meraní umiestnená v špeciálnej valcovej kyvete rotujúcej v uhle 4°45’, každá rotácia trvá 10 s. Kovová sonda (ihlica) pripevnená na torznej tyčinke je ponorená do stredu rotujúcej kyvety a elektronický snímač sleduje veľmi presne rýchlosť otáčania sondy. Točivý moment kyvety je na sondu prenášaný iba fibrínovými formáciami vznikajúcimi medzi sondou a nádobou. Rýchlosť otáčania sondy preto koreluje so vznikom fibrínovej siete. Tromboelastogram je vytvorený z času od okamihu vloženia vzorky po vytvorenie prvého fibrínoveho vlákna (čas R), rýchlosti tvorby fibrínu a väzby vlákien (teda zvyšovanie pevnosti zrazeniny – uhol α), času K – čas, za ktorý koagulum dosiahne vopred určenú pevnosť, MA – maximálnej amplitúdy (odráža dynamiku väzby krvných doštičiek a fibrínu) a rozpustnosti zrazeniny (napr. LY30 – percento redukcie amplitúdy MA po 30 min) – parameter hodnotiaci stabilitu zrazeniny (obr. 2) (normálne hodnoty sú uvedené v tab. 1) [7]. Výsledok je známy asi do 30 min, pričom analyzátor je dvojkanálový, čiže umožňuje paralelné vyšetrenie 2 vzoriek. Vzorka plnej krvi musí byť vyšetrená do 4 min. Ako aktivátor sa využíva infuzóriová hlinka, tzv. kremelina (Celite) alebo kaolín pri podávaní aprotinínu. Ak sa pacientovi podal heparín, je možné vzorku vyšetriť v špeciálnej kyvete s obsahom heparinázy. Pre správnu interpretáciu treba poznať hodnoty fibrinogénu a krvných doštičiek [7].
Obr. 1. Tromboelastograf TEG Coagulation Analyzer 5000 series. 
Tab. 1. Normálne hodnoty tromboelastogramu pri vyšetrení prístrojom TEG Coagulation Analyzer 5000 series. 
Obr. 2. Tromboelastogram – schéma. 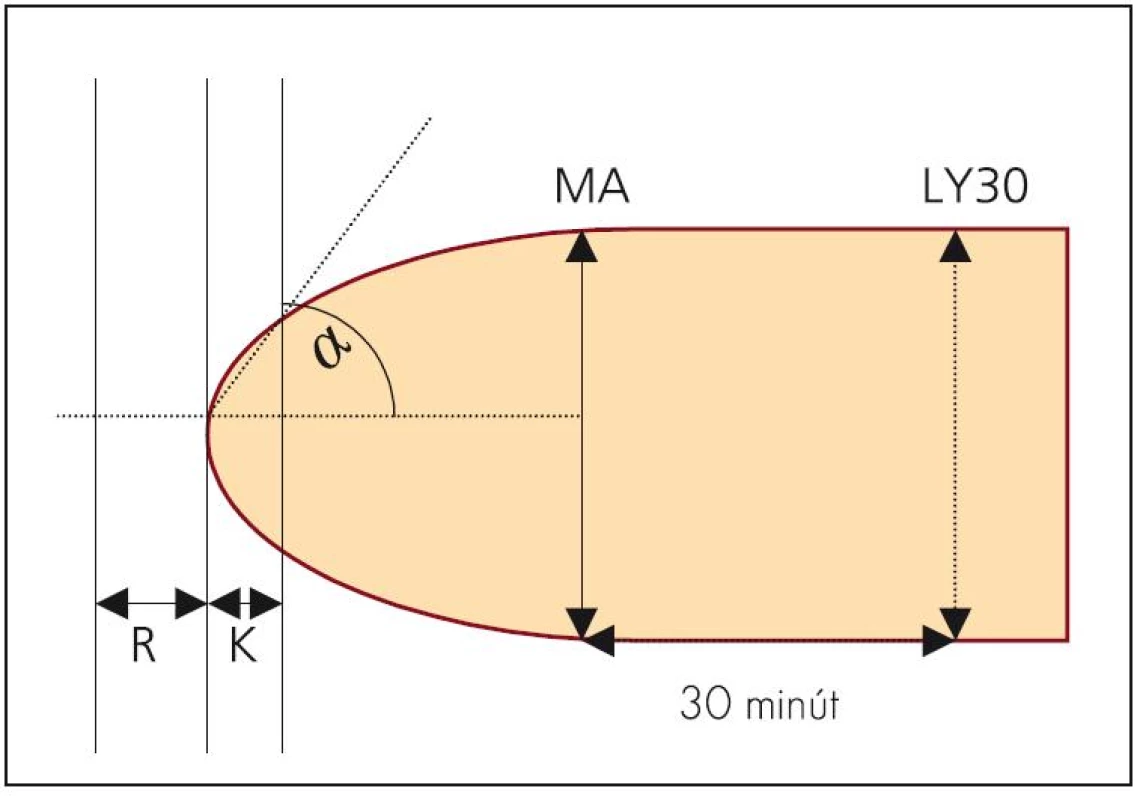
Progresívnou zmenou v „štandardnej technike“ TEG je vyvinutie tzv. rotačnej tromboelastografie – systém ROTEM® (predtým ROTEG) firmy Pentapharm (Mníchov, Spolková republika Nemecko). Ide o modifikáciu, v ktorej je v stacionárnej polohe kyveta s vyšetrovanou vzorkou krvi a osciluje naopak ihlica ponorená do vzorky. Presne definovaný pohyb ihlice je riadený systémom špeciálnych guľôčkových ložísk, a znižuje tak vplyv mechanického stresu, otrasov a vibrácií na výsledok vyšetrenia a vznik potenciálnych artefaktov. Podobne ako klasická TEG aj ROTEG využíva modifikáciu štandardných koagulačných testov a umožňuje analýzu vnútornej (InTEG) či vonkajšej (ExTEG) cesty koagulácie, ako aj porovnanie merania bez pridania (neaktivovaná – nonactivated TEG čiže NaTEG) alebo s pridaním rôznych látok (s heparinázou HepTEG, s aprotinínom ApTEG či s fibrinogénom FibTEG). Takto upravenými testami umožňuje odlíšiť krvácavý stav pri hypofibrinogenémii (FibTEG), dysfunkcii krvných doštičiek (rozdiel EXTEG a FibTEG), predávkovaní heparínom (HepTEG) alebo hyperfibrinolýze (ApTEG) [8].
Pre úplnosť je potrebné spomenúť systém SONOCLOT (Scienco, USA) – meranie viskoelastických vlastností koagula pomocou princípu akustickej impedancie, ktorého využitie v Európe je však okrajové [9].
Klinické využitie
V klinickej praxi sa používanie TEG sústreďuje na operačné sály (napr. v manažmente hyper či hypokoagulačných stavov) (obr. 3). Kardiochirurgické operácie svojou dĺžkou, medicínskou a technickou náročnosťou patria iste k tým najnáročnejším. Základným primárnym prínosom TEG v peri a včasnom pooperačnom období je zníženie spotreby transfúznych prípravkov (čerstvej zmrazenej plazmy, erytrocytových a doštičkových koncentrátov ap.), antikoagulancií či antifibrinolytík [10,11]. Výhodou TEG analýzy je predovšetkým jej negatívna prediktívna hodnota, tzn. pacienti s krvácavým stavom majú pri akceptovateľných hodnotách koagulácie vysoko pravdepodobne chirurgicky korigovateľnú príčinu tohto stavu a vyžadujú urgentnú operačnú revíziu. Sekundárnym prínosom je redukcia operačného a často hospitalizačného času, rýchlejší a bezpečnejší (nižšie riziko transfúziami prenosných infekcií) postoperačný priebeh a ušetrenie nemalej časti finančných prostriedkov [12]. Správny čas a potrebné množstvo antifibrinolytík v prípade fibrinolýzy je tiež možné oveľa presnejšie určiť pomocou rotačnej TEG. Modifikáciami ApTEG (stanovenie vplyvu aprotinínu na hyperfibrinolýzu) a FibTEG (určenie množstva fibrinogénu v procese koagulácie) je možné do 10 min zaznamenať a antifibrinolytickou liečbou zvrátiť aj fulminantnú fibrinolýzu [13].
Obr. 3. Náčrt normálneho tromboelastogramu a niektorých typických porúch koagulácie zachytených pri TEG (zdroj – obrazové materiály firmy Biovendor). 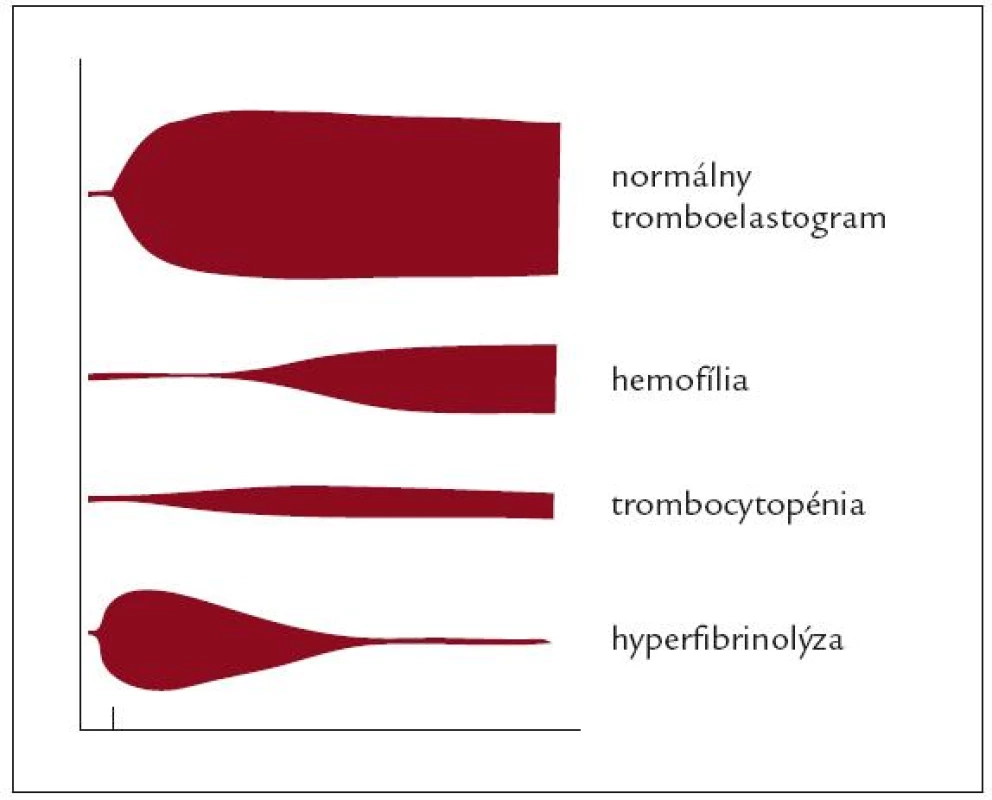
Pri masívnej transfúznej liečbe je takisto nevyhnutný monitoring koagulácie, ktorej poruchy vznikajú z 3 základných príčin: nedostatočnej pevnosti koagula v dôsledku trombocytopénie a nedostatku fibrinogénu (tzv. skorý fenomén), zhoršenej stability koagula pri hyperfibrinolýze a deficite faktora XIII (tzv. neskorý fenomén) a tiež pre predĺžený čas vzniku zrazeniny vzhľadom na nedostatok potrebných koagulačných faktorov. Je preto nevyhnutné monitorovať koaguláciu pri prijatí na chirurgické oddelenie, resp. bazálny stav pred začiatkom operačného výkonu, ďalej pri prebiehajúcom krvácaní, po každej výmene alebo doplnení objemu, po prokoagulačnej terapeutickej intervencii a postoperačne s cieľom detekcie prípadnej hyperkoagulácie [14].
Potenciál TEG v transplantológii pe-čene spočíva v zhodnotení predoperačných koagulačných pomerov (charakterizovaných predovšetkým trombocytopéniou a hypokoagulačným stavom pri pokročilej hepatopatii), v perioperačnom a pooperačnom monitoringu. Operačné obdobie je často charakterizované hyperfibrinolýzou či krvácavými stavmi (pri ischemicko reperfúznom pôsobení a vplyve kyslíkových alebo dusíkových radikálov), ale aj hyperkoagulačným stavom s embolizáciou do pľúc a vznikom intrakardiálnych trombov. Napriek faktu, že predovšetkým trombotické komplikácie nie sú časté, ich vysoká mortalita (68%) je neprehliadnuteľnou výzvou na zlepšenie manažmentu koagulácie pri týchto výkonoch, kde má TEG svoje nezastupiteľné miesto [15–17].
Sumárne možno konštatovať, že TEG a jej modifikácie sú veľmi výhodnou metodikou hodnotenia porúch koagulácie, kontrolovanej liečby týchto porúch a tiež analýzy samotných dopadov liečby na výsledný stav hemostázy [18–20].
Tromboelastografia v kardiológii
Poruchy koagulácie či trombofilné stavy sú bežnou súčasťou kardiologickej praxe, pričom sa s nimi často stretávame až v podobe závažných kardiovaskulárnych komplikácií [21]. Dominantnú úlohu vo vzniku arteriálneho trombu zohrávajú krvné doštičky, ktoré prispievajú k progresii koagulácie v zásade 4 mechanizmami:
- a) uvoľňujú prokoagulačné faktory pri degranulácii α- a δ-granúl
- b) poskytujú prokoagulačný povrch prostredníctvom membránových fosfolipidov
- c) aktivujú receptory koagulačných faktorov a
- d) vychytávajú tkanivový faktor (základný stimul tzv. vonkajšej cesty koagulácie) z okolo cirkulujúcich leukocytov [22]
Potvrdila to aj práca dánskych autorov, kde sa u pacientov so stabilnou i nestabilnou formou anginy pectoris a infarktu myokardu dokázala zvýšená hodnota tzv. trombodynamického pomeru definovaného ako podiel súčinu maximálnej amplitúdy a tangens uhla α s časom tvorby koagula (TR = MA × TANα/R). Hodnoty TR však boli zvýšené aj u pacientov s nekoronárnou prekordiálnou bolesťou, a tak význam TEG v diferenciálnej diagnostike týchto prípadov ostáva sporný [23].
Inou oblasťou potenciálneho využitia TEG je sledovanie efektívnosti antitrombotickej (antiagregačnej) liečby. Krvné doštičky môžu byť aktivované viacerými látkami a prostredníctvom viacerých receptorov (tab. 2). V súčasnosti je antitrombotická liečba založená na 3 skupinách liekov:
- a) kyseline acetylsalicylovej (ASA), ktorá účinkuje dominantne prostredníctvom ireverzibilnej blokády intracelulárnej cyklooxygenázy 1 [24]
- b) klopidogrele, ktorý vedie k blokáde receptora P2Y12 pre adenozíndifosfát (ADP) v membráne krvných doštičiek [25]
- c) antagonistoch membránového glykoproteínu IIb/IIIa využívaných pri akútnych koronárnych syndrómoch v súvislosti s intervenčnými výkonmi [26]
Tab. 2. Možné aktivátory krvných doštičiek a súčasné možnosti antitrombotickej liečby (modifi kované podľa [27]). ![Možné aktivátory krvných doštičiek a súčasné možnosti antitrombotickej liečby (modifi kované podľa [27]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/23551121e58beeca093d2c3da02211f7.jpeg)
Najzraniteľnejším miestom v problematike antiagregačnej liečby nie je výskyt krvácavých komplikácií, ale incidencia kardio a cerebrovaskulárnych príhod (vrátane uzáverov intervenčne aplikovaných stentov) napriek adekvátnej liečbe v odporúčaných dávkach. To podnietilo diskusie o tzv. rezistencii na antiagregačnú (antitrombotickú) liečbu, resp. presnejšie o zlyhaní účinku tejto liečby (možné príčiny sú uvedené v tab. 3) [27]. Tá má formu jednak klinickú (rekurentné vaskulárne príhody napriek adekvátnej liečbe v odporúčaných účinných dávkach), jednak laboratórnu (nedostatočná inhibícia sledovaného antiagregačného účinku podanej liečby definovanou laboratórnou metódou). Pri porovnaní TEG so svetelnou transmisnou agregometriou pri použití ADP sa dokázala lepšia korelácia času R a pevnosti koagula (MA) s výskytom rekurentných vaskulárnych príhod po intervenčných výkonoch [28]. Snáď najnádejnejšou možnosťou hodnotenia účinnosti, resp. zlyhania antiagregačnej liečby je však inovovaná tromboelastografická metóda pomocou tzv. mapovania krvných doštičiek [29].
Tab. 3. Niektoré potenciálne príčiny tzv. rezistencie, resp. zlyhania antitrombotickej liečby (upravené podľa [27]). ![Niektoré potenciálne príčiny tzv. rezistencie, resp. zlyhania antitrombotickej liečby (upravené podľa [27]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0b53cb80ae27d69c1597f5680810a84f.jpeg)
Metóda využíva odber krvi do skúmavky s pridaním heparínu (zablokovanie tvorby trombínu) s následným aktivovaním koagulácie pomocou batroxobínu (reptilázy) a faktora XIII. Reptiláza štiepi NH2-koniec α-reťazca fibrinogénu aj v prítomnosti heparínu, ale neaktivuje krvné doštičky. Pridaný faktor XIII vedie k vytvoreniu koagula prostredníctvom fibrínovej siete. Napokon sa do zmesi doplnia aktivátory krvných doštičiek, buď kyselina arachidónová – AA (pri analýze inhibície agregácie krvných doštičiek vplyvom ASA), alebo ADP (pri hodnotení účinku klopidogrelu). Výsledná hodnota je percentom maximálnej amplitúdy (MA) po pridaní aktivátora (MAADP, resp. MAAA s odčítaním MA bez aktivácie krvných doštičiek – MAo) oproti MA „štandardnej TEG“ s pridaním heparinázy a aktivátora kaolínu (MAKH; opäť s dočítaním MAo). Výsledný prepočet má pre analýzu vplyvu ASA (resp. klopidogrelu) potom nasledujúcu podobu:
Dôležité pri tejto metodike je, že zachováva normálnu koncentráciu vápnika vo vzorke, a umožňuje tak hodnotiť aj vplyv antagonistov glykoproteínu IIb/IIIa [30].
Aktiváciu a agregáciu krvných doštičiek je dnes možné hodnotiť početnou skupinou laboratórnych metodík (napr. svetelná transmisná agregometria, TEG, systém VerifyNow® či PFA-100®, stanovenie 11-dehydrotromboxánu B2 v moči, a i.). Faktom však ostáva, že konečné výsledky navzájom veľmi varírujú a ani jedna metodika nie je zaradená do rutinného klinického používania [31]. Získané hodnoty nedostatočnej účinnosti antiagregačnej liečby sú rôzne a často nadhodnotené (interval od 1 po 60%). Potreba štandardizácie a špecifikácie tých najpresnejších metód je preto určite namieste. Z tohto pohľadu má mapovanie krvných doštičiek pomocou TEG s cieleným použitím napr. AA perspektívne miesto v diagnostike účinnosti ASA [32]. Na viac je táto modifikácia TEG aj sľubnou alternatívou v štúdiu potenciálnych príčin zlyhania antiagregačnej liečby (napr. vplyvom transcelulárnej aktivácie inhibovaných krvných doštičiek cirkulujúcimi leukocytmi) [33]. Pomocou mapovania doštičiek môžeme odmerať aj pokles inhibičného účinku prerušenej antiagregačnej liečby pred plánovaným kardiochirurgickým výkonom ako odhad rizika krvácania z týchto príčin v peri- a pooperačnom období [34]. Vyšetrenie by preto malo byť realizované predoperačne a následne pri každej závažnejšej poruche hemostázy.
Tromboelastografia a mechanické podpory obehu
Mechanické podporné čerpadlo (VAD – ventricular assist device) je rôznym spô-sobom konštruované zariadenie, ktoré je schopné vo väčšej alebo menšej miere, na dlhší alebo kratší čas podporiť, alebo aj úplne nahradiť funkciu srdca ako pumpy. Jeho postavenie v oblasti terminálneho srdcového zlyhávania spočíva v preklenutí kritického obdobia, pre premostenie času do konečného riešenia refraktérnej srdcovej slabosti transplantáciou („bridge to transplant“) [35]. V Národnom ústave srdcových a cievnych chorôb sú takto využívané implantovateľné podporné čerpadlá Heart Mate II (produkt firmy Thoratec) (obr. 4) [36].
Obr. 4. Implantované ľavokomorové podporné čerpadlo Heart Mate II. 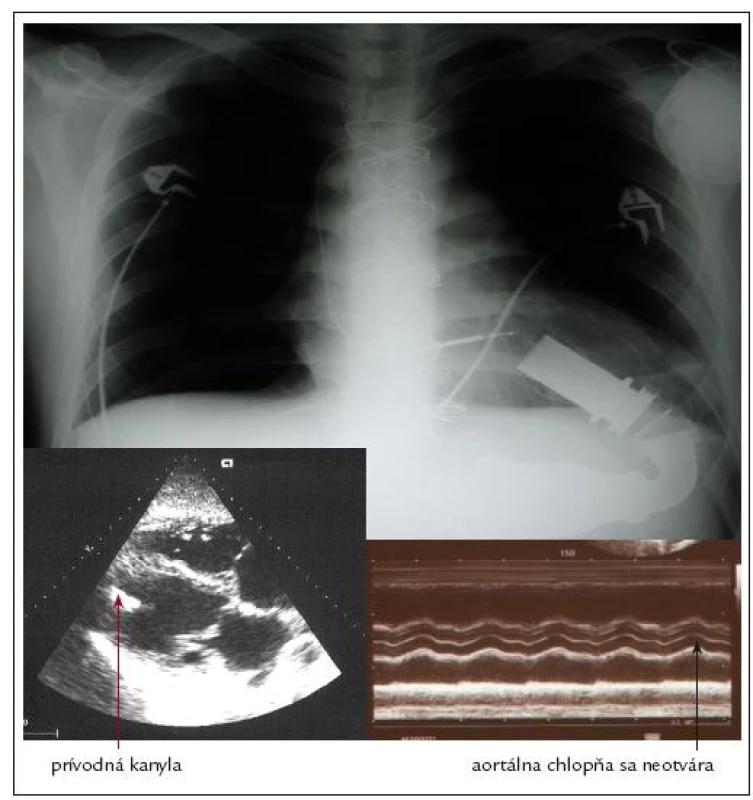
Implantácia VAD-u vedie k predĺženiu života. V štúdii s použitím HeartMate II sa dosiahlo 75% prežívanie pacientov po pol roku a 1 rok s týmto VAD-om prežilo 68% pacientov. Okrem poklesu mortality prináša táto liečba i zlepšenie fyzickej výkonnosti a kvality života (napr. podľa Minnesotského dotazníka) [37].
Krvácavé a tromboembolické komplikácie sú častými príčinami mortality a morbidity po implantácii VAD. V minulosti popisovaný 20–30% výskyt tromboembolických komplikácií bol prekážkou širšieho využitia implantácií VAD [38]. Problematika tromboembolizmu, krvácavých stavov, antiagregačnej a antikoagulačnej liečby sa úzko odvíja od zmien v samotnej cirkulácii po implantácii VAD-u. Biologické materiály a membrány vedú po kontakte k aktivácii vnútornej cesty koagulácie (štiepenie cirkulujúcich koagulačných faktorov na aktívne proteázy) a tiež k aktivácii krvných doštičiek. Tie sú okrem samotného biomateriálu stimulované aj turbulentným prúdením v mieste ohybov štruktúr VAD-u, trombínom pri aktivácii vnútornej cesty koagulácie, ADP uvoľňovaným z rozpadnutých erytrocytov pri mechanickej hemolýze a tiež zvýšeným obratom v ich tvorbe vo včasnom pooperačnom priebehu [39]. Zvýšenú aktivitu krvných doštičiek po implantácii VAD-u (dokázanú napr. detekciou zvýšenej expresie kontaktných membránových molekúl CD62P a CD63) je možné pomerne účinne eliminovať podaním heparínu [40]. Francúzski autori uvádzajú aj prítomnosť už diskutovanej tzv. rezistencie na ASA (resp. zlyhanie jej antiagregačného účinku) u pacienta s VAD-om. Okrem uvedených podnetov uvádzajú ako ďalšie stimuly aktivácie krvných doštičiek dlhodobú zápalovú reakciu a produkciu proinflamačných cytokínov [41].
Pri porovnaní výskytu náhlych cievnych mozgových príhod a tranzitórnych ischemických atakov medzi viacerými typmi VAD-ov sa ukázal vysoko priaznivý profil práve u čerpadla Heart Mate II. V odhade tromboembolických príhod sa úspešne použila práve TEG, pričom s incidenciou uvedených cerebrovaskulárnych príhod najlepšie korelovala MA tromboelastogramu [42]. TEG má vďaka svojej schopnosti globálne zhodnotiť priebeh koagulácie v čase unikátne postavenie práve v prípade implantácie VAD-ov. Umožňuje totiž kontinuálne monitorovať prechod od prokoagulačného intraoperačného stavu do žiaduceho hypokoagulačného stavu s minimalizáciou krvácavých/trombotických komplikácií a kontrolou efektu podanej liečby [43]. Dôkazom je aj práca rakúskych autorov, kde bol na rozdiel od hypokoagulačného stavu v štandardnom teste koagulácie (aPTT) pri analýze pomocou ROTEG verifikovaný extrémne hyperkoagulačný stav. Následným transezofageálnym echokardiografickým vyšetrením bol potvrdený trombus v oblasti kanyly prístroja [44]. Podobne sa ukázalo ako nedostatočné hodnotenie koagulačného stavu pomocou INR a aPTT (účinné hodnoty 2 a 125 s) v prípade existujúceho trombu u detského pacienta s biventrikulárnym podporným systémom. ROTEG odhalila zvýšenú aktivitu fibrinogénu, ktorá bola zrejme v pozadí danej komplikácie. Pomocou analýzy funkcie krvných doštičiek v plnej krvi (Multiplate®) sa navyše ukázala aj ich zvýšená agregačná pohotovosť po aktivácii trombínom napriek primeranej inhibícii v teste AA realizovanom pri liečbe ASA [45].
Všeobecne akceptované odporúčania pre typy a dávky antitrombotickej liečby u pacientov s VAD-mi zatiaľ neexistujú. Existujú však protokoly, ktoré pri použití monitorovania koagulácie umožňujú pomerne bezpečný manažment pacienta (tab. 4) [46]. TEG mala byť realizovaná predoperačne, vo včasnom pooperačnom priebehu a pri akýchkoľvek prejavoch krvácania či trombózy napriek referenčným hodnotám v rutinných vyšetreniach koagulácie. Vznik trombu je najčastejšie spôsobený vynechaním antikoagulačnej liečby, napr. z dôvodu gastrointestinálneho krvácania, ktoré je, vzhľadom na častý výskyt u pacientov s VAD, predmetom stále väčšieho záujmu [47]. V prípade už vzniknutého trombu prichádza do úvahy v liečbe úprava dávky antikoagulancia (zvýšenie INR), pridanie alebo výmena antiagregancia (napr. náhrada ASA klopidogrelom) alebo použitie fibrinolytík (napr. reteplázy) [48].
Tab. 4. Protokol antikoagulačnej liečby pri implantácii ľavokomorového podporného systému Heart Mate II (spracované podľa [46]). ![Protokol antikoagulačnej liečby pri implantácii ľavokomorového podporného systému Heart Mate II (spracované podľa [46]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/80d86da29d76c918e3ab22ac001f234f.jpeg)
Kazuistika
V nasledujúcej kazuistike chceme stručne upozorniť práve na krvácavé komplikácie u pacienta s VAD a poukázať na možný prínos TEG.
Anamnéza: 56-ročný hypertonik po náhrade aortálnej chlopne pre reumatickú chlopňovú chybu (1994) bol sledovaný na Oddelení zlyhávania a transplantácie srdca (OZaT) od septembra roku 2006. V tom čase už bola prítomná systolická dysfunkcia (ejekčná frakcia 25%) dilatovanej ľavej komory (rozmer v end diastole 76mm). Pacienta sme vzhľadom na zistenú dilatáciu chronicky disekujúcej aneuryzmy aorty (Stanford A) a ťažkú pľúcnu hypertenziu posúdili ako vysoko rizikového pre konvenčný kardiochirurgický výkon (transplantáciu srdca – HTx). V auguste roku 2007 podstúpil v IKEM Praha resekciu aneuryzmy, plastiku trikuspidálnej chlopne a implantáciu ľavokomorového VAD-u (LVAD) – Heart Mate II. Vo včasnom pooperačnom období sa u pacienta vyskytlo masívne intraabdominálne krvácanie, ktoré si vyžiadalo operačný zásah s drenážou – zdroj a príčinu krvácania sa však nepodarilo objasniť.
Dlhodobá antikoagulačná liečba pri implantovanom LVAD spočíva v užívaní warfarínu (cieľové rozmedzie INR 2–3) alebo v aplikácii heparínov s nízkou molekulovou hmotnosťou (LMWH) v terapeutickej dávke. Protokolárnou súčasťou je podávanie kyseliny acetylsalicylovej v dávke 100mg denne. Pri prvom prepustení do ambulantnej starostlivosti si pacient aplikoval subkutánne nadroparin v dávke denne 2krát 0,8ml. Okrem samotného LVAD bola potreba antikoagulačnej liečby diktovaná aj prítomnosťou mechanickej aortálnej chlopňovej protézy, ktorá sa pri správnej funkcii LVAD neotvárala.
V ďalšom priebehu bol pacient opakovane hospitalizovaný z dôvodu krvácavých komplikácií a tiež s cieľom posúdiť vývoj ochorenia z pohľadu úvahy o HTx – prehľadne v tab. 5. Je vidieť, že pacient opakovane ťažko anemizoval napriek komplexnej liečbe a postupnej redukcii dávky LMWH. Hematologickým ani klinickým vyšetrením sa neobjasnila príčina recidivujúcich poklesov v krvnom obraze. Vyšetrením TEG (máj roku 2008) sme dospeli k záveru, že u pacienta sa síce vytvorí pomerne stabilné koagulum, ale jeho vznik je extrémne oneskorený (tab. 6). TEG bola prakticky jediným vyšetrením, ktoré nás aj laboratórne podporilo v rozhodnutí redukovať antikoagulačnú liečbu LMWH až do dávok neprimerane nízkych vzhľadom k implantovanému LVAD a nahradenej aortálnej chlopni (2krát 0,4ml s.c. pri hmotnosti pacienta asi 80kg). V budúcnosti sa sústredíme aj na detekciu tzv. získaného von Willebrandovho syndrómu, t.j. dysfunkcie krvných doštičiek v súvislosti s implantáciou VAD-u. Zdá sa totiž, že práve táto porucha stojí v pozadí zvýšenej mikroembolizácie a krvácavých komplikácií u týchto pacientov [49].
Tab. 5. Prehľad krvácavých komplikácií u pacienta s implantovaným LVAD- om (Heart Mate II) zaznamenaných počas hospitalizácie na Oddelení zlyhávania a transplantácie srdca (OZaT). 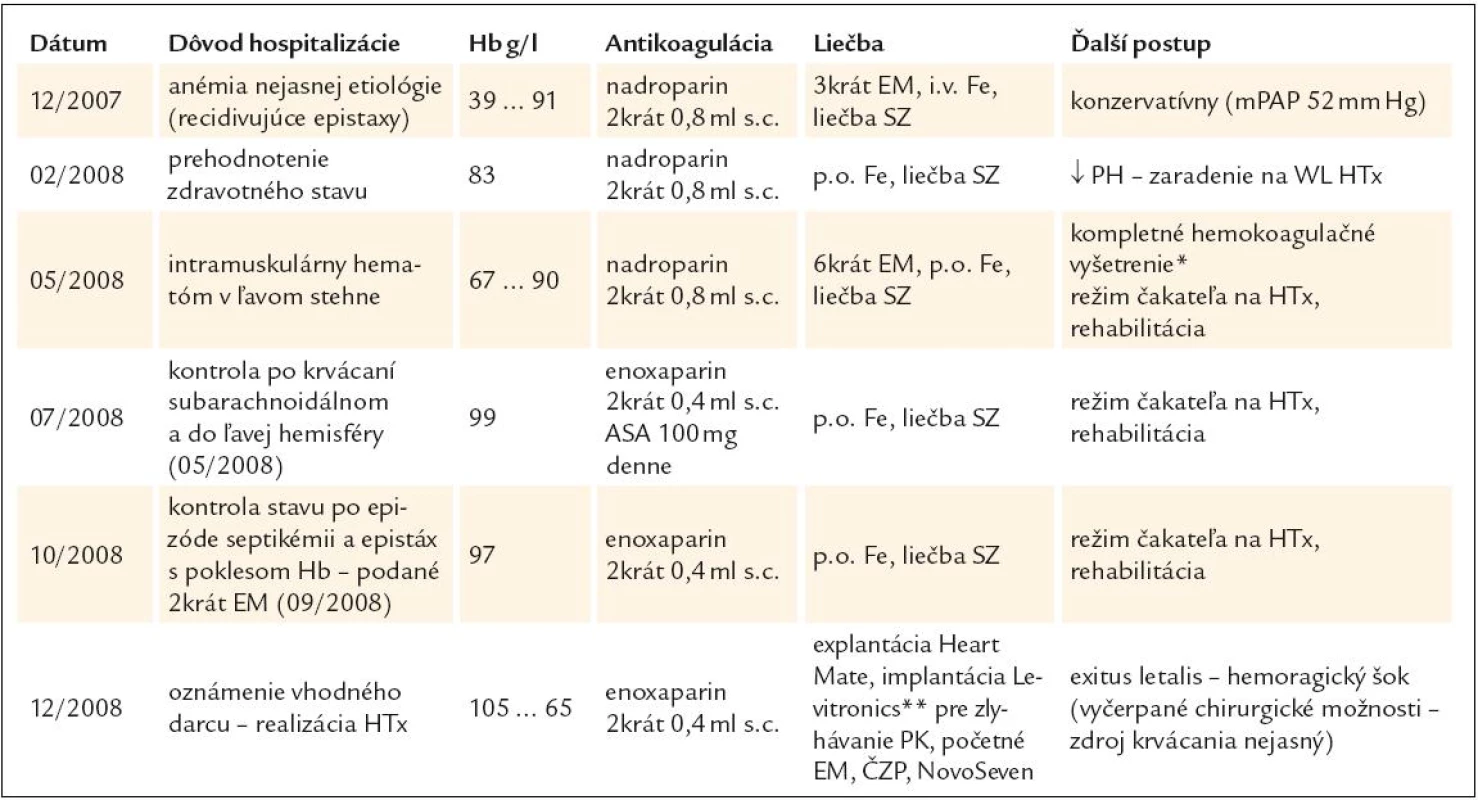
Hb – hemoglobín, s.c. – subkutánne, ASA – kyselina acetylsalicylová, EM – masa erytrocytov, i.v. – intravenózny, Fe – preparát železa, SZ – srdcového zlyhávania, mPAP – stredný tlak v a. pulmonalis, PH – pľúcna hyperenzia, WL – čakacia listina, PK – pravá komora, ČZP – čerstvá zmrazená plazma. *Záver: nevýznamný deficit faktora XI a hraničná porucha agregácie krvných doštičiek. **Levitronics – mechanické podporné čerpadlo pravej komory. Tab. 6. TEG vyšetrenie u sledovaného pacienta s Heart Mate II. 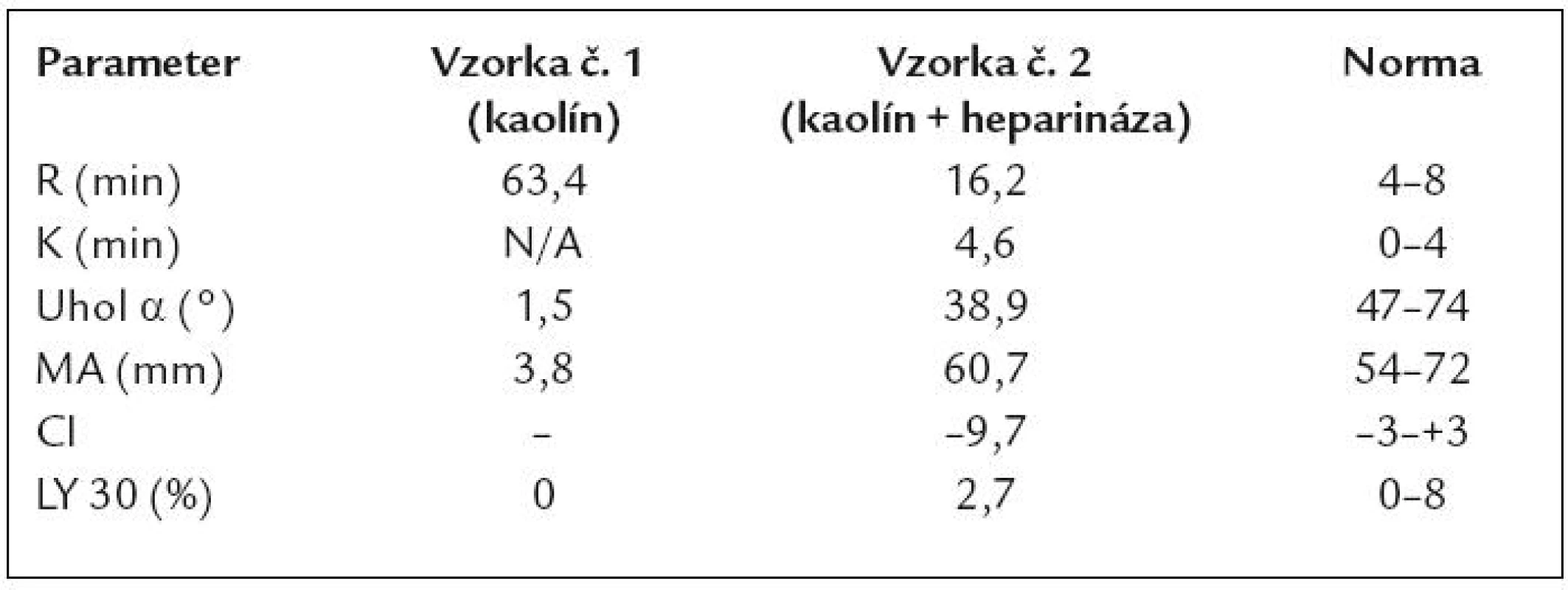
CI – koagulačný index, lineárna kombinácia vyššie uvedených parametrov, ostatné – viď vyššie v textu, časť: Princíp vyšetrenia Záver
TEG je globálny test hemokoagulácie, ktorej výsledok – krivka trombelastogramu – odráža meniace sa viskoelastické vlastnosti vyšetrovanej krvnej vzorky kontinuálne v čase. Trombelastogram je obrazom vzniku, amplifikácie, dosiahnutého maxima a tiež postupného rozpadu vyšetrovaného koagula, ktorého kvalita závisí od aktuálnych koagulačných pomerov u daného pacienta. Nové modifikácie sa snažia prekonať limitácie štandardnej TEG a postupne ju stavajú do pozície metodiky solídne hodnotiacej jednak podiel jednotlivých komponentov v procese hemostázy, jednak efektívnosť antitrombotickej liečby. Popri rutinnom využívaní na operačných sálach (nielen pri kardiochirurgických výkonoch) sa začína ukazovať jej potenciál v predikcii krvácavých a tromboembolických komplikácií u pacientov s mechanickými podpornými systémami srdca. TEG sa tak stáva sľubnou metódou, ktorá postupne svojimi kvalitami vystupuje z tieňa „len orientačného nešpecifického testu hemostázy“.
MUDr. Ivan Varga
www.nusch.sk
e mail: ivan.varga@nusch.sk
Zdroje
1. Harrison P, Keeling D. Clinical tests of platelet function. In: Michelson AD et al (eds). Platelets. 2nd ed. Oxford: Elsevier 2007 : 445 – 474.
2. Kubisz P et al. Hematológia a transfuziológia. Bratislava, Praha: Grada 2006.
3. Kawasaki J, Katori N, Kodaka M et al. Electron microscopic evaluation of clot morphology during thrombelastography®. Anesth Analg 2004; 99 : 1440 – 1444.
4. Zillmann A, Luther T, Müller I et al. Platelet‑associated tissue factor contributes to the collagen - triggered activation of blood coagulation. Biochem Biophys Res Commun 2001; 281 : 603 – 609.
5. Samama CM. Thromboelastography: the next step. Anesth Analg 2001; 92 : 563 – 564.
6. Hájek R, Zezula R, Fluger I et al. Význam tromboelastografie pro monitorování hemostázy v kardiochirurgii. Interv Akut Kardiol 2005; 4 : 224 – 228.
7. Hájek R, Růžičková J, Gwozdziewicz M et al. Hodnocení funkce trombocytů během mimotělního oběhu pomocí tromboelastografie. Cardiol 2006; 15 : 78 – 88.
8. Calatzis A, Haas S, Gödje O et al. Thromboelastographic coagulation monitoring during cardiovascular surgery with the ROTEG coagulation analyzer. In: Pifarré R (ed). Management of bleeding in cardiovascular surgery. Philadelphia: Hanley&Belfus 1999 : 215 – 226.
9. Cox D, Fitzgerald D. Monitoring antiplatelet therapy. In: Gresele P, Page C, Fuster V et al (eds). Platelets in thrombotic and non‑thrombotic disorders. Cambridge: Cambridge University Press 2002 : 471 – 484.
10. Royston D, von Kier S. Reduced haemostatic factor transfusion using heparinase - modified thrombelastography during cardiopulmonary bypass. Br J Anaesth 2001; 86 : 575 – 578.
11. Nydegger U. Transfusion dependency in cardiac surgery – update 2006. Swiss Med Wkly 2006; 136 : 781 – 788.
12. Cammerer U, Dietrich W, Rampf T et al. The predictive value of modified computerized thromboelastography and platelet function analysis for postoperative blood loss in routine cardiac surgery. Anesth Analg 2003; 96 : 51 – 57.
13. Vorweg M, Hartmann B, Knüttgen Het al. Management of fulminant fibrinolysis during abdominal aortic surgery. J Cardiothorac Vasc Anesth 2001; 6 : 764 – 767.
14. Kozek - Langenecker S. Management of massive operative blood loss. Minerva Anestesiol 2007; 73 : 401 – 415.
15. Warnaar N, Molenaar IQ, Colquhoun SD et al. Intraoperative pulmonary embolism and intracardiac thrombosis complicating liver transplantation: a systematic review. J Thromb Haemost 2008; 6 : 297 – 302.
16. Kettner SC, Gonano C, Seebach F et al. Endogenous heparin‑like substances significantly impair coagulation in patients undergoing orthotopic liver transplantation. Anesth Analg 1998; 86 : 691 – 695.
17. Nielsen VG, Crow JP, Mogal A et al. Peroxynitrite decreases hemostasis in human plasma in vitro. Anesth Analg 2004; 9 : 21 – 26.
18. Mittermayr M, Margreiter J, Velik - Salchner C et al. Effects of protamine and heparin can be detected and easily differentiated by modified thrombelastography (Rotem®): an in vitro study. Br J Anaesth 2005; 95 : 310 – 316.
19. Fenger - Eriksen C, Anker - Møller E, Heslop J et al. Thrombelastographic whole blood clot formation after ex vivo addition of plasma substitutes: improvements of the induced coagulopathy with fibrinogen concentrate. Br J Anaesth 2005; 94 : 324 – 329.
20. Ingerslev J, Christiansen K, Calatzis A et al. Management and monitoring of recombinant activated factor VII. Blood Coagul Fibrinolysis 2000; 11 (Suppl 1): S25 – S30.
21. Studenčan M, Hulíková M, Pavlíková J. Antiphospholipid syndrome in the background of severe cardiovascular complications in patients hospitalised in the cardiology ward. Cardiol 2004; 13 : 359 – 364.
22. Hemker HC. Platelet procoagulant activities: the amplification loops between platelets and the plasmatic clotting system. In: Gresele P, Page C, Fuster V et al (eds). Platelets in thrombotic and non‑thrombotic disorders. Cambridge: Cambridge University Press 2002 : 381 – 392.
23. Artang R, Jensen E, Pedersen F et al. Thrombelastography in healthy volunteers, patients with stable angina and acute chest pain. Thromb Res 2000; 97 : 499 – 503.
24. Patrono C, Bachmann F, Baigent C et al. Expert consensus document on the Use of antiplatelet agents. The task force on the use of antiplatelet agents in patients with atherosclerotic cardiovascular disease of the european society of cardiology. Eur Heart J 2004; 25 : 166 – 181.
25. Hricák V, Murín J, Kamenský G et al. Odporúčania pre používanie klopidogrelu u pacientov s akútnym koronárnym syndrómom, stabilnou angínou pektoris a pri sekundárnej prevencii aterotrombotických príhod. Cardiol 2006; 15 : 327 – 328.
26. Gitt AK, Betriu A. Antiplatelet therapy in acute coronary syndromes. In: Montalescot G (ed). Goals of effective platelet inhibition. Eur Heart J Suppl 2008; 10 (Suppl A): A4 – A12.
27. Gladding P, Webster M, Ormiston J et al. Antiplatelet drug nonresponsiveness. Am Heart J 2008; 155 : 591 – 599.
28. Gurbel PA, Bliden KP, Guyer K et al. Platelet reactivity in patients and recurrent events post‑stenting. Results of the PREPARE POST‑STENTING study. J Am Coll Cardiol 2005; 46 : 1820 – 1826.
29. Storey RF. Variability of response to antiplatelet therapy. In: Montalescot G (ed). Goals of effective platelet inhibition. Eur Heart J Suppl 2008; 10 (Suppl A): A21 – A27.
30. Craft RM, Chavez JJ, Bresee SJ et al. A novel modification of the Thromboelastograph assay, isolating platelet function, correlates with optical platelet aggregation. J Lab Clin Med 2004; 143 : 301 – 309.
31. Gurbel PA, Bliden KP, DiChiara J et al. Evaluation of dose‑related effects of aspirin on platelet function. Results from the aspirin‑induced platelet effect (ASPECT) study. Circulation 2007; 115 : 3156 – 3164.
32. Tantry US, Bliden KP, Gurbel PA. Overestimation of platelet aspirin resistance detection by thromboelastograph platelet mapping and validation by conventional aggregometry using arachidonic acid stimulation. J Am Coll Cardiol 2005; 46 : 1705 – 1709.
33. Caroll RC, Craft RM, Chavez JJ et al. A Thromboelastograph whole blood assay for clinical monitoring of NSAID - insensitive transcellular platelet activation by arachidonic acid. J Lab Clin Med 2005; 146 : 30 – 35.
34. Craft RM, Chavez JJ, Snider CC et al. Comparison of modified Thrombelastograph and Plateletworks whole blood assays to optical platelet aggregation for monitoring reversal of clopidogrel inhibition in elective surgery patients. J Lab Clin Med 2005; 145 : 309 – 315.
35. Goldstein D, Zucker M, Pagani FD et al. Rotary ventricular assist devices. In: Frazier OH, Kirklin JK et al (eds). Mechanical circulatory support. Oxford: Elsevier 2006 : 77 – 104.
36. Goncalvesová E, Hulman M, Olejárová I et al. Iniciálne skúsenosti s implantabilnými mechanickými podporami ľavej komory v programe transplantácie srdca v Národnom ústave srdcových a cievnych chorôb. Cardiol 2008; 17 : 101 – 108.
37. Miller LW, Pagani FD, Russell SD et al. HeartMate II clinical investigators. Use of continuous - flow device in patients awaiting heart transplantation. N Engl J Med 2007; 357 : 885 – 896.
38. Reilly MP, Wiegers SE, Cucchiara AJ et al. Frequency, risk factors and clinical outcomes of left ventricular assist device‑associated ventricular thrombus. Am J Cardiol 2000; 86 : 1156 – 1159.
39. Holman WA, Teitel ER, Itescu S. Biologic barriers to mechanical circulatory support. In: Frazier OH, Kirklin JK et al (eds). Mechanical circulatory support. Oxford: Elsevier 2006 : 9 – 32.
40. Matsubayashi H, Fastenau DR, McIntyre JA. Changes in platelet activation associated with left ventricular assist system placement. J Heart Lung Transplant 2000; 19 : 462 – 468.
41. Houël R, Mazoyer E, Kirsch M et al. Resistance to aspirin after external ventricular assist device implantation. J Thorac Cardiovasc Surg 2003; 126 : 1636 – 1637.
42. Tsukui H, Abla A, Teuteberg JJ et al. Cerebrovascular accidents in patients with a ventricular assist device. J Thorac Cardiovasc Surg 2007; 134 : 114 – 123.
43. Amir O, Bracey AW, Smart FW et al. A successfull anticoagulation protocol for the first HeartMate® II implantation in United States. Tex Heart Inst J 2005; 32 : 399 – 401.
44. Fries D, Innerhofer P, Streif W et al. Coagulation monitoring and management of anticoagulation during cardiac assist device support. Ann Thorac Surg 2003; 76 : 1593 – 1597.
45. Seibel K, Berdat P, Boillat C et al. Hemostasis management in pediatric mechanical circulatory support. Ann Thorac Surg 2008; 85 : 1453 – 1456.
46. Frazier OH, Gemmato C, Myers TJ et al. Initial clinical experience with the HeartMate® II axial - flow left ventricular assist device. Tex Heart Inst J 2007; 34 : 275 – 281.
47. Meyer A, Kuehn C, Weidemann J et al. Thrombus formation in a HeartMate II left ventricular assist device. J Thorac Cardiovasc Surg 2008; 135 : 203 – 204.
48. Rothenburger M, Wilhelm MJ, Hammel D et al. Treatment of thrombus formation associated with the MicroMed DeBakey VAD using recombinant tissue plasminogen activator. Circulation 2002; 106 (2 Suppl 1): I189 – I192.
49. Steinlechner B, Dworschak M, Birkenberg B et al. Platelet dysfunction in outpatients with left ventricular assist devices. Ann Thorac Surg 2009; 87 : 131 – 137.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 11- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Neuroprotekce po srdeční zástavě a časná poresuscitační péče – editorial
- Má tromboelastografie své místo v kardiochirurgii a kardiologii? – editorial
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Pavlišta D et al. Neinvazivní karcinomy prsu. Praha: Maxdorf 2008, 181 s. ISBN 978- 80-7345-173- 8
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




