-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
The results of the of patiens with essentials thrombocythemia and other myeloproliferation‑related thrombocythemia – a report of patients treated with Thromboreductin®
The registry of patients treated with Thromboreductin® (anagrelide) in the Czech Republic contains data concerning patients that have been treated using this drug since 2004. As of June 2009, the total number of patients was 549. The current analysis focused mainly on evaluation of anagrelide dosage needed to achieve a complete response in high‑risk patients: reduction in platelet count to below 400 × 109/ l, which was also considered as reaching the therapeutic goal. The outcomes of the registry confirm that although anagrelide (Thromboreductin®) is a very effective platelet - reducing agent, the administration of which is related to a low incidence of adverse effects and complications, the therapeutic goal is not achieved in all cases and or despite a quick treatment response, the therapeutic goal is achieved more slowly.
Key words:
essential thrombocythemia – myeloproliferation – Thromboreductin® – patient registry
Autoři: M. Penka 1; J. Schwarz 2; T. Pavlík 3; K. Indrák 4; M. Doubek 5; P. Ďulíček 6; D. Pospíšilová 7; J. Kissová 1; A. Jonášová 8; P. Jelínková 3; A. Hluší 4; M. Schutzova 9; O. Černá 10; Y. Brychtová 5; Lucie Nováková 2; Z. Kořístek 5; J. Segethová 10; V. Vozobulová 9; I. Hadačová 11; I. Hochová 11; J. Voglová 6; L. Walterová 12; C. Bodzásová 13; L. Dušek 3
Působiště autorů: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Miroslav Penka, CSc. 1; Ústav hematologie a krevní transfuze Praha, ředitel prof. MU Dr. Marek Trněný, CSc. 2; Institut biostatiky a analýz Lékařské a Přírodovědecké fakulty MU Brno, ředitel doc. RNDr. Ladislav Dušek, CSc. 3; Hemato- onkologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MU Dr. Karel Indrák, DrSc. 4; Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 5; Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Jaroslav Malý, CSc. 6; Dětská klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MU Dr. Vladimír Mihál, Ph. D. 7; I. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MU Dr. Marek Trněný, CSc. 8; Hematologicko‑onkologické oddělení FN Plzeň, přednosta prim. MU Dr. Vladimír Koza 9; Oddělení klinické hematologie FN Královské Vinohrady Praha, přednosta doc. MU Dr. Tomáš Kozák, Ph. D. 10; Oddělení klinické hematologie FN Motol Praha, přednostka prim. MU Dr. Ivana Hochová 11; Oddělení klinické hematologie Krajské nemocnice Liberec, přednostka MU Dr. Lenka Walterová 12; Ústav klinické hematologie FN Ostrava, přednosta prim. MU Dr. Jaromír Gumulec 13
Vyšlo v časopise: Vnitř Lék 2009; 55(11): 1-12
Kategorie: Původní práce
Souhrn
V registru pacientů léčených Thromboreductinem® (anagrelidem) v zúčastněných centrech ČR jsou zaznamenávány údaje o nemocných léčených tímto preparátem od roku 2004. Celkový počet zařazených pacientů činí k červnu roku 2009 celkem 549 osob. Pozornost při současném hodnocení byla zaměřena především na analýzu úrovně léčby z hlediska dosažení léčebné odpovědi. Za kompletní léčebnou odpověď bylo považováno snížení počtu krevních destiček pod 400 × 109/ l. Tato hodnota je zároveň terapeutickým cílem u vysokorizikových pacientů. Výstupy z registru potvrzují, že je anagrelid (Thromboreductin®) sice velmi efektivní tromboredutivní lék, jehož podávání je spojeno s nízkým výskytem nežádoucích účinků a s omezením vzniku komplikací, ale ne ve všech případech se daří dosahovat terapeutického cíle anebo i přes rychlou odezvu na léčbu je ho dosahováno v některých případech pomaleji.
Klíčová slova:
esenciální trombocytemie – myeloproliferace – Thromboreductin® – registrÚvod
Esenciální trombocytemie (ET) se vy-skytuje v asi 0,1–2,5 případů na 100 000 osob [2]. V rámci její diagnostiky lze využívat řadu klasifikačních systémů – PVSG [13,16], WHO z roku 2001 [10], ECMP z roku 2007 [15] či WHO 2008 [26]. Zatímco některá kritéria neumožňují odlišení hraničních nálezů (např. časné fáze primární myelofibrózy – PMF či prepolycytemického stadia polycythaemia vera – PV jako např. PVSG), některá jsou k určení zmíněných rozdílů detailně propracována (WHO z roku 2001, ECMP z roku 2007). Rozdíl je vyjádřen zejména histologickým nálezem v kostní dřeni [14,24], minimálně v těch případech, kdy má charakteristický obraz. Poslední klasifikační schémata využívají navíc komplexního hodnocení, které zahrnuje i výsledky molekulárně biologického vyšetření, především stanovení JAK2 mutace V617F [11,20,22].
Z klinického hlediska je významným požadavkem určení správné diferenciální diagnózy hned od počátku za účelem nastínění dlouhodobého plánu sledování a léčby [6,9,13].
Při přítomnosti trombocytemie v sou-vislosti s ET či jiným typem MPO, přesahující 1 000 × 109/l (nebo dochází li k nárůstu počtu trombocytů do 2 měsíců o více než 200 × 109/l), a zvláště za výskytu dalšího protrombotického rizika doporučujeme léčbu vedoucí ke snížení, resp. normalizaci počtu destiček [17]. Požadavek léčebné odpovědi je dán tím, zda se z hlediska nebezpečí výskytu trombohemoragických nebo kardiovaskulárních komplikací jedná o rizikového nebo nerizikového pacienta [12,21]. U rizikových nemocných je terapeutickým cílem dosažení normalizace počtu trombocytů (tj. pod 400 × 109/l), u nerizikových lze připouštět vyšší hodnoty trombocytů (< 600 × 109/l). U mladších nemocných (< 60 let) je lékem volby anagrelid, příp. interferon - α. Průměrná dávka anagrelidu (Thromboreductin®) při zavedené léčbě může činit asi 2,0–2,5mg denně [19], přičemž se nedoporučuje překračovat denní dávku 5mg [1,17].
Léčbu anagrelidem lze i kombinovat – s interferonem [5] či hydroxyureou [3], čímž se dosáhne možnosti redukce dávky obou léků proti dávce léku při monoterapii každým z nich. V některých případech je vhodné kombinovat léčbu cyto-, resp. tromboreduktivní s antiagregační léčbou – nejčastěji s kyselinou acetylsalicylovou (ASA) [4,8,12]. Jedná se o rizikové případy s počtem destiček do 1 000, u nejmladších jedinců maximálně do 1 500 × 109/l s vyšším rizikem trombózy a/nebo o případy zvýšeného kardiovaskulárního rizika – tedy hrozby tepenné (kardiaci, pacienti s cévním onemocněním mozku apod.) či mikrovaskulární trombózy. V daných případech je však nutno vyloučit možnou současně se vyskytující prokrvácivou dispozici – ať již z důvodu choroby samotné nebo náchylnosti spojené s výskytem jiné choroby či patologického stavu (např. získaný von Willebrandův syndrom, který nezřídka MPO provází). Požadavek opatrnosti současného podávání ASA či jiných antitrombocytárních léků (thienopyridiny, nesteroidní antiflogistika apod.) je umocněn i přítomností funkční poruchy krevních destiček u nemocných s trombocytemií, které se klinicky manifestují především při počtu destiček nad 1 200 × 109/l [12,14,21].
Při podávání anagrelidu je doporučována zvýšená opatrnost u kardiaků (NYHA IV, resp. III), u nemocných s jaterním (při zvýšení jaterních transamináz pětinásobně) a ledvinným selháním (clearance endogenního kreatininu pod 30ml/min). Vedle počtu trombocytů je tedy nutné sledovat i renální a jaterní ukazatele a v rámci objektivního vyšetření kardiologický stav nemocného [17].
Původním cílem registru bylo podchycení léčebných odpovědí při terapii Thromboreductinem® a nežádoucích účinků léku u pacientů s esenciální trombocytemií. Během jeho zpracovávání se však objevují i údaje o dalších Ph negativních myeloproliferacích a také údaje o jiné cytoreduktivní léčbě než výlučně jen Thromboreductinem®, včetně kombinovaných režimů.
Cílem předkládaného rozboru je především vyhodnocení léčebné odpovědi na Thromboreductin®.
V dosud prezentovaných přehledech [18] zůstávala nezodpovězená otázka, zda jsou nemocní léčeni způsobem odpovídajícím stanoveným doporučením, a pokud ne, proč tomu tak není. Právě na tento problém se zaměřila naše nynější analýza. Její součástí byl také rozbor výskytu nežádoucích projevů léčby a příčin ukončení léčby.
Při sběru dat jsme učinili oproti předchozímu období některé změny, doplnění a upřesnění, které by měly vést – pod vlivem dosavadních zkušeností – ke zdokonalení prováděných rozborů.
Soubor nemocných a metoda zpracování
V současné době jsou v registru údaje o 549 nemocných (343 ženách a 206 mužích) s věkovým mediánem 49 let (graf 1). Medián věku v době stanovení diagnózy činí rovněž 49 let a diagnóza je stanovena právě mezi 40 a 60 lety věku nemocných u více než poloviny sledovaných (graf 2). Soustavně jsou shromažďovány údaje o základních laboratorních ukazatelích, rizikových dispozicích k trombóze a kardiovaskulárních komplikacích včetně rodinné anamnézy i získaných přitěžujících okolností (graf 3) již od roku 2004. Celková doba sledování činí u některých pacientů již 97 měsíců a každý rok stoupá také vyplněnost záznamů (graf 4).
Graf 1. Popis souboru pacientů (n = 549). 
Graf 2. Popis souboru pacientů (n = 549). 
Graf 3. Vyplněnost sledovaných rizikových faktorů (n = 549). 
Graf 4. Vyplněnost záznamů o počtu trombocytů (n = 549). 
Naprostou většinu (asi 80%) tvoří pacienti s esenciální trombocytemií (podle PVSG kritérií), zbytek připadá na všechny další nemocné s Ph negativní myeloproliferací, kteří byli původně zařazeni buď pro podezření z esenciální trombocytemie, nebo byla diagnóza nejistá či bylo započato s léčbou anagrelidem (Thromboreductinem®), ať již pro jakoukoliv diagnózu MPO (graf 5). Převažující většinu (asi 3/4 nemocných celého souboru) tvořili předléčení tromboreduktivní léčbou. Jejich podíl se však snižuje při srovnání s předchozími léty (grafy 6, 7).
Graf 5. Popis souboru pacientů (n = 549). 
Graf 6. Detailní pohled na předléčení cytoredukčními terapeutiky. 
Graf 7. Předléčení dle roku diagnózy a začátku sledování. 
K samotnému hodnocení jsme podobně jako v předchozích analýzách soubor rozdělili na 3 skupiny podle dosahované odpovědi, resp. snížení počtu trombocytů – a to na skupinu s počtem destiček:
- pod 400 × 109/l (kompletní léčebná odpověď)
- s počtem kolísajícím mezi 400 a 600 × 109/l (parciální léčebná odpověď)
- s počtem přesahujícím 600 × 109/l (nedostatečná léčebná odpověď)
Hodnocení souboru bylo prováděno v období před nasazením léčby a zařazením do registru, dále za 3 měsíce, za 6 měsíců a za 12 měsíců po zařazení.
Statistické zpracování bylo provedeno na Institutu biostatistiky a analýz na Masarykově univerzitě. Ke zpřehlednění a sumarizaci dat byly použity grafy a základní popisné statistiky (průměr, medián, minimum, maximum).
Výsledky a diskuze
Kolísání odpovědi v časovém průběhu léčby Thromboreductinem®
Odpovědi na léčbu je dosahováno rychle po započetí léčby Thromboreductinem®. Od 24. měsíce je zaznamenávána průměrná hodnota krevních destiček celého souboru nemocných v hodnotách odpovídajících kritériím kompletní odpovědi (graf 8). Průměrná dávka léku přitom činí 2mg na den a během sledování se příliš nemění.
Graf 8. Vývoj počtu trombocytů v čase. 
V jednotlivých skupinách nemocných je přitom hodnoceno kolísání dávky Thromboreductinu® v periodách pravidelného sledování a z něho vyplývá, že k navyšování dávky dochází především ve skupině s nejhoršími výsledky (tedy s přetrvávajícím počtem destiček přesahujícím 600 × 109/l). I když počet nemocných v této skupině od 3. měsíce klesá (ze 159 osob 58 ... 50 a 45) a lze vysledovat vzestupný trend dávky léku – od 1,05 přes 2,36mg, zastavuje se na průměrné dávce 2,5mg/den. K dalšímu navyšování dávky pak nedochází, a tak by právě zde mohla být spatřována rezerva v případném dalším zvýšení dávky Thromboreductinu®, pokud se nejedná o individuální případy nesnášenlivosti či rezistence k léčbě.
V čase 0 – tedy před zahájením léčby – bylo pochopitelně nejvíce nemocných ve skupině dosahující počtu trombocytů nad 600 × 109/l. Spíše překvapením je, že i v čase 0 se nachází necelých 11,6% (29) nemocných s hodnotou destiček nižší než 400 × 109/l, ale jedná se zde i o pacienty již předléčené, a tudíž s korekcí počtu trombocytů specifickou léčbou. V průběhu dalšího sledování dochází k očekávanému přeskupování sledovaných skupin nemocných, přičemž ve skupině kompletní odpovědi se zvyšuje zastoupení z výchozích hodnot ve výši 11,6% (29 z celkového počtu 250) na 38,4% (96 pacientů) ve 3. měsíci sledování a na 45,6% (114 pacientů) v 6. měsíci sledování. Ve 12. měsíci sledování dosahuje kompletní odpovědi 41,2% (103 nemocných) (grafy 9–12).
Graf 9. Vývoj počtu trombocytů v prvních 3 měsících vzhledem k dávce v čase 0 (n = 250*). 
Graf 10. Vývoj počtu trombocytů mezi 3. a 6. měsícem vzhledem k dávce v čase 3 měsíce (n = 250*). 
Graf 11. Vývoj počtu trombocytů mezi 6. a 12. měsícem vzhledem k dávce v čase 6 měsíců (n = 250*). 
Graf 12. Počet trombocytů ve 12. měsíci (n = 250*). 
Ve skupině s hodnotou krevních destiček kolísající mezi 400 a 600 × 109/l byla před zařazením do registru necelá čtvrtina (62) nemocných částečné odpovědi (skupina 2), v čase 3 měsíců již 38,4% (96) nemocných, v čase 6 měsíců 34,4% (86) nemocných a ve 12. měsíci zaznamenáváme 40,8% (102) pacientů v této skupině. Ke zmíněnému vývoji přeskupování v průběhu času dochází nejspíše také z důvodu snížení dávky Thromboreductinu® z uspokojení nad dosažením zlepšení odpovědi po předchozí úpravě dávky léku u nemocných s kompletní odpovědí a také – a to naštěstí především – z důvodu přesunu určitého počtu nemocných ze skupiny s nejhorší odpovědí, resp. jejího nedosažení (grafy 9–12).
Odpovědi nebylo dosaženo (skupina č. 3) do 3 měsíců u 23,2% (58) pacientů z původních 63,6% (tedy 159 pacientů) a do 6 měsíců u 20,0% (50 pacientů). Ve 12. měsíci nedosahujeme odpovědi u 18% nemocných, což představuje 45 nemocných (grafy 9–12).
Odpověď na léčbu v závislosti na dávce Thromboreductinu®
Zajímavé je rovněž samotné kolísání dávky Thromboreductinu® z hlediska předchozího hodnocení léčebné odpovědi. Tam, kde se dosahuje odpovědi ihned, kolísá dávka od 0,75mg do 1,78mg denně. Na počátku špatně odpovídající pacienti dostávají dávku od 1,05 do 1,22mg/den (graf 9).
Ve 3 měsících sledování mají nemocní skupiny č. 1, u nichž je dále dosahováno kompletní odpovědi, 1,71mg denně, zatímco u pacientů, kteří dosahují jen parciální, 1,63mg, nebo neuspokojivé odpovědi 2,44mg na den. To by mohlo nasvědčovat tomu, že další setrvání v parciální odpovědi je výsledek poddávkování anagrelidu, zatímco nedostatečná odpověď může být již výsledkem buď nesnášenlivosti, nebo rezistence k léčbě. „Poddávkování“ nemocných střední skupinyje částečně dílem záměru, neboť u „nerizikových“ nemocných není třeba dosahovat vždy kompletní odpovědi [6], a proto se nemocní „ponechávají“ v pásmu odpovědi částečné. Důvodem k tomu je dávka léku, kterou pacient ještě bezpečně toleruje, s níž souhlasí apod. [9] (graf 10).
Kategorie částečné odpovědi se během sledování přesouvá do kompletní odpovědi. Je tomu tak u asi 40% (25) nemocných této skupiny, a to s průměrnou dávkou 1,39mg anagrelidu denně, naopak takřka 1/2 nemocných skupiny parciální odpovědi (30 pacientů) v ní s dávkou 1,18mg anagrelidu zůstává a 7 pacientů (11,3%) s dávkou 0,89mg (tedy zjevně poddávkovaných) se přesouvá do kategorie nedostatečné odpovědi.
Nemocní s počtem destiček nad 600 × 109/l se v průběhu léčby rozděluje takřka rovným dílem do všech 3 skupin léčebné odpovědi a není bez zajímavosti, že tomu tak je při nastavení na více méně stejnou dávku léčby (1,18 ... 1,05 ... 1,22mg), tedy s velmi nízkou dávkou, která neodráží vývoj kolísání počtu destiček (graf 9).
Mezi 3. a 6. měsícem od započetí léčby je překvapivý především opět fakt přetrvávání relativně vysokého počtu nemocných ve skupině parciální odpovědi, který činí mimochodem stejný počet osob, jaký je zaznamenán ve skupině kompletní odpovědi, tedy 98 pacientů (38,4%) – zjevně opět v souvislosti s poddávkováním léčby (viz i výše). Dalším, a snad i závažnějším fenoménem je nepříznivý osud většiny nemocných skupiny nedostatečné odpovědi, kteří z necelých 60% v ní zůstávají (graf 10). Stejný trend pokračuje i mezi 6. a 12. měsícem léčby, přesto je celková odpověď na konci prvního roku charakterizována kompletní odpovědí u 103 (41,8%) sledovaných a částečná u 102 (40,8%) případů. V 18% (45 nemocných) není odpovědi dosahováno. Dávka léku se pohybuje okolo 2,5mg denně, proto se dá usuzovat buď na poddávkování, nebo na to, že jedním z důvodů může být rezistence k léčbě, kterou nemocný toleruje (grafy 11 a 12) [7].
Přes polovinu nemocných skupiny parciální odpovědi zůstává mezi 3. a 6. měsícem léčby v rozmezí parciální odpovědi na dávce 1,72mg a 13,5% (13) nemocných se přesouvá s dávkou 2,29mg do rozmezí neuspokojivé odpovědi. Ve skupině neuspokojivé odpovědi se po 3 měsících sledování dostává mezi nemocné s kompletní odpovědí 12,1% (7 pacientů) s průměrnou dávkou 2,36mg, do skupiny parciální odpovědi asi 1/3 nemocných s průměrnou dávkou 2,21mg a téměř 60% (33) nemocných setrvává v nedostatečné odpovědi při průměrné dávce 1,98mg (graf 9–12). Tito pacienti jsou především ti, u nichž by dávka anagrelidu měla být zvýšena, a pouze v případě neúspěchu (nedosahování odpovědi či výskytu nežádoucích účinků) by se měli dostat do skupiny kombinované léčby [27].
Není bez zajímavosti, že se údaje příliš neliší, ať již byly získány u nemocných vyšetřených v každé fázi sledovaného období jednoho roku, nebo u nemocných v jednotlivých časových údobích sledování, a to ať již v přesně vymezených časových intervalech, nebo v intervalech s tolerančním obdobím jednoho měsíce. Jedinou výjimkou je skupina nepředléčených pacientů, kde do roka nezaznamenává odpověď „jen“ 9 z 63 (= 14%) nemocných. Tento fakt může být dán především tím, že je těmto pacientům od počátku věnována velmi soustředěná pozornost a vůle po dosažení odpovědi je prosazována účinnějšími metodami (ihned od počátku brzké „vytitrování“ léčby Thromboreductinem®, úprava souběžné medikace, nastavení režimových pravidel kontrol apod.).
Předléčených nemocných jsou v celémsouboru 3/4 a většinou se jedná o nemocné s předchozí léčbou hydroxyureou, interferonem a řadou různých kombinací. Z celého souboru dostávalo před vstupem do registrační databáze anagrelid 61 pacientů, interferon αjiž takřka dvojnásobek – 135, hydroxyureu dokonce 309 a 84 pacientů jinou léčbu (graf 6).
Ve skupině kombinované léčby zůstává 110 (20%) nemocných z celkového počtu 549, z nichž 90 (80,2%) z počtu nemocných na kombinované terapii dostává hydroxyureu (graf 13).
Graf 13. Souběžná cytoredukční léčba od 3 měsíců sledování pacientů. 
Komplikace a nežádoucí účinky léčby Thromboreductinem®
U pacientů jsme, jak již bylo řečeno, pozornost zaměřili také na přitěžující faktory rizika vzniku klinické symptomatologie, především na trombotické a kardiovaskulárních komplikace.
Komplikace byly rozděleny podle charakteru – na žilní a arteriální trombózu, krvácení a podle závažnosti – na velké nebo malé příhody. Jako velké příhody byly označeny ty, které vyžadovaly svou specifickou léčbu, jako malé ty, které samy o sobě léčbu nevyžadovaly. Příhody jsme posuzovali i ve vztahu k hodnotě trombocytů a k dávce Thromboreductinu®. Během sledování jsme zaznamenali 11 velkých arteriálních příhod, pouze jednu žilní, 24 malých arteriálních příhod. Z krvácivých komplikací bylo zaznamenáno 5 velkých a 25 malých krvácení. Je zajímavé, že ani počet trombocytů či dávka Thromboreductinu® nedokládají žádnou závislost při vzniku té které příhody.
Ukazatelem, jenž se dnes zdá být především z hlediska klinického významným, zejména stran výskytu tromboembolických komplikací, je leukocytóza [25]. Ta se v našem souboru po celou dobu sledování pohybuje v průměru v normálních nebo jen nadnormálních hodnotách nepřesahujících 13,3 × 109/l (graf 14). Podobně ani hemoglobin či hematokrit nezasahuje v průměrných hodnotách a jejich rozptylu do výrazněji patologických hodnot – a to ani u žen, ani u mužů.
Graf 14. Počet leukocytů v čase. 
Ostatní výstupy podrobné analýzy přinášejí obdobné výsledky, které byly předloženy vloni [18] a snad jen tedy pro úplnost informace – nežádoucí projevy se objevily u 84 (15,3%) nemocných. V relativním vyjádření jsou to vyšší počty než vloni, což je dáno především tím, že je podchycení nežádoucích projevů podrobnější (tab. 1).
Tab. 1. Progrese, transformace v průběhu léčby, komplikace spojené s MPD a nežádoucí účinky léčby. 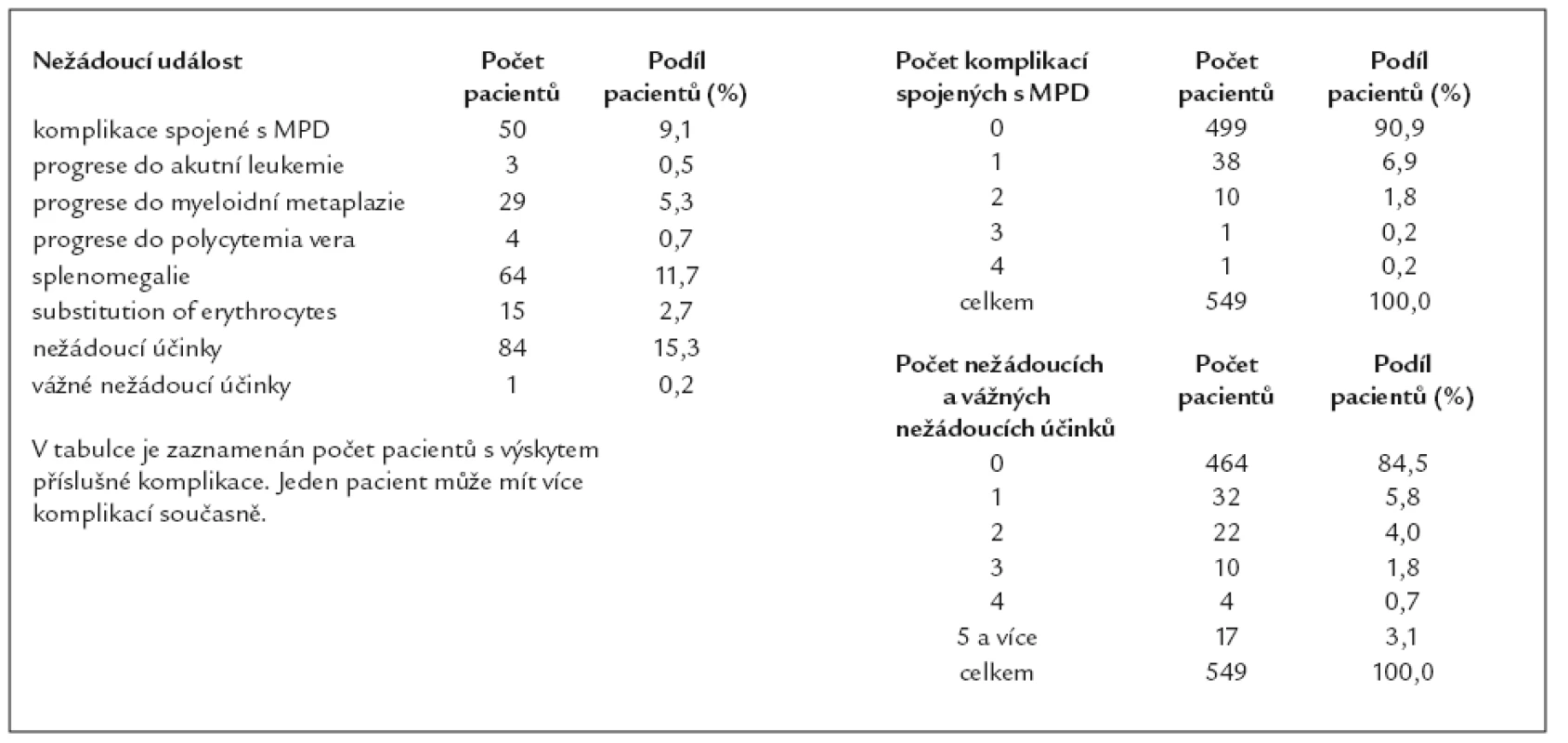
Z parametrů odrážejících možné nežádoucí účinky [23] ve smyslu ovlivnění funkce některých orgánů jsme při sledování kolísání hodnot kreatininu nacházeli jen ojediněle patologické hodnoty korespondující se známým (resp. předcházejícím) renálním selháním. Totéž platí i pro hodnot urey. Hodnoty jaterních parametrů (ALT, AST) se pohybují v normálním rozmezí v celém průběhu sledování u všech nemocných v dané periodě zařazených, hladina LD je naopak sice v průměrných hodnotách v mezích normálu, v průběhu sledování však vykazuje dosti značné procento zvýšených hodnot. Podobný profil nalézáme i u kyseliny močové. Dochází zde ke kolísání k vyšším hodnotám, i když průměrná hodnota se ve všech intervalech sledovaného období pohybuje v normálním rozmezí. Podobně je pozorováno zvýšení draslíku, což je možno pokládat spíše za laboratorní fenomén (vlastní pozorování).
K ukončení léčby došlo u 67 (12,2%) nemocných. V 19 (28,4%) případech se jednalo o komplikace nemoci, ve 12 případech (17,9% – asi 2% z celkového počtu sledovaných) se nedostavila léčebná odpověď. U 8 pacientů (11,9%) byla léčba přerušena na jejich žádost, ve 3 případech pro těhotenství. V 16 (23,9%) případech byla léčba ukončena z jiných důvodů (graf 15). Příčiny neúspěšnosti léčby (tab. 2) a příčiny úmrtí jsou uvedeny v přiložených tabulkách (tab. 3). Lze konstatovat, že při hodnocení příčin úmrtí lze v některých případech klást do souvislosti s úmrtím základní onemocnění myeloproliferativní chorobou, aniž by bylo lze tvrdit, že MPO bylo bezprostřední příčinou smrti (např. infarkt myokardu).
Tab. 2. Pacienti bez odpovědi na léčbu v detailu. 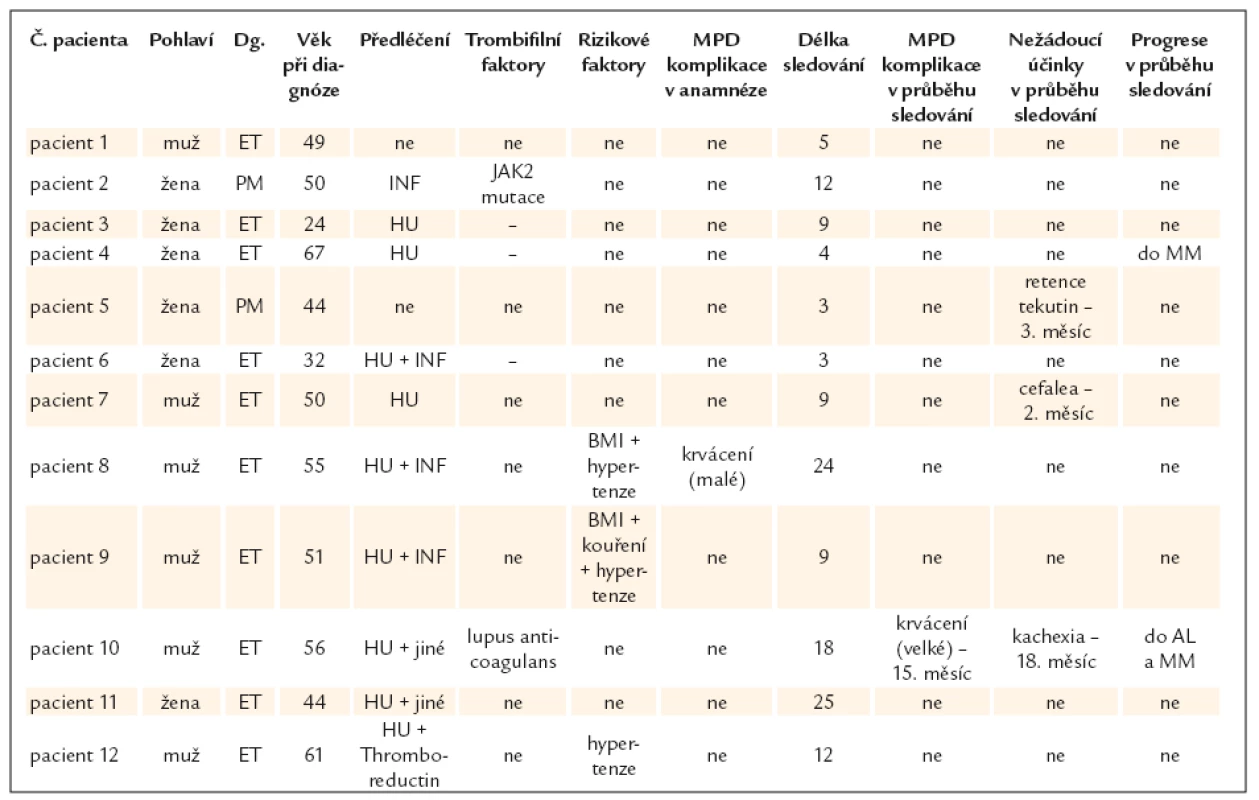
Graf 15. Ukončení terapie a jeho důvody. 
Tab. 3. Zemřelí pacienti v detailu. 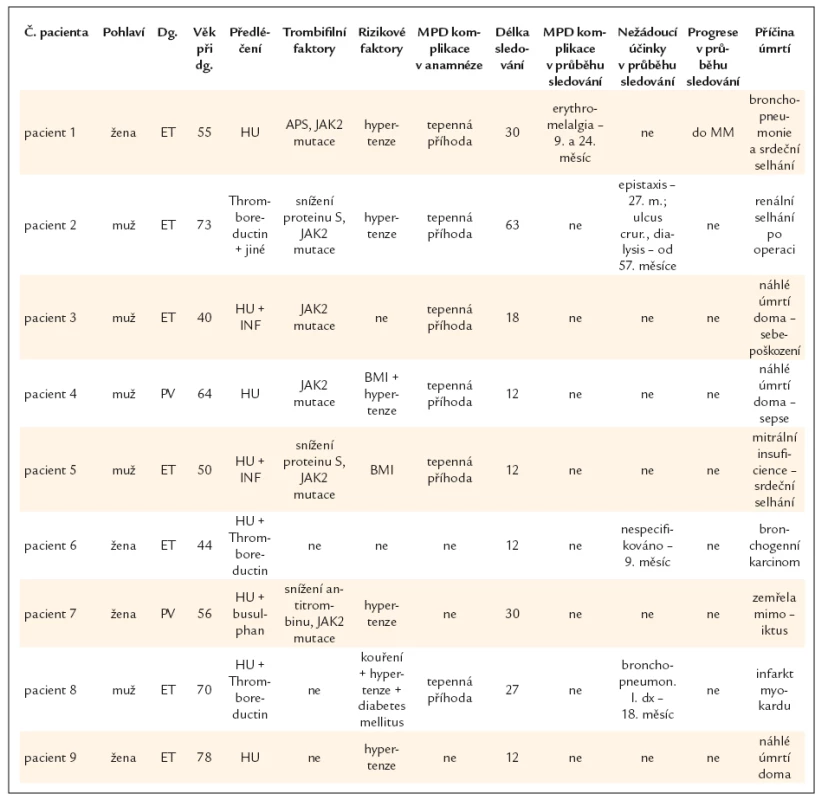
Závěr
Závěrem lze shrnout, že se stále významně zvyšuje objem dat registrační databáze a jejich jednotlivých oddílů. Podrobný rozbor léčebné odpovědi včetně dávkování Thromboreductinu® ukazuje, že se velmi přiléhavě léčba zahajuje, že se dosahuje brzké odpovědi, že se dávka léku zvyšuje, je li to dle dosahované odpovědi a s ohledem na riziko pacienta nutné, a že se pacienti tam, kde nelze běžným způsobem kýžené odpovědi dosáhnout, přesouvají do skupiny kombinované léčby. Zde je využito především hydroxyurey.
Je možno konstatovat, že léčba Thromboreductinem® je dlouhodobě stabilní a téměř 90% pacientů v ní po jednom roce dále pokračuje. Zároveň je však nutno zdůraznit, že existují stále značné rezervy v nedostatečném zvyšování dávky Thromboreductinu® jak v souvislosti s jejím načasováním, tak i v závislosti na typu odpovědi na léčbu a jejím požadavkem.
Nežádoucí projevy jsou zaznamenávány v o něco vyšším počtu, než jak jsou udávány v loňské analýze, což je dáno především lepším dozorem souboru a větší vyplněností databáze registru. Ukazuje se přitom, že nežádoucí účinky nesouvisejí se zvyšováním dávky při nedostatečné léčebné odpovědi a ani aktuální počet krevních destiček na jejich výskyt nemá jednoznačný a určující vliv. Nicméně právě v tomto směru bude nutno zajistit podrobnější zkoumání souboru. Dalším směrem musí být také analýza skupiny nemocných s parciální odpovědí, resp. jejího přeskupování, z hlediska záměrného ponechání nemocných v této skupině v závislosti na nerizikovém profilu nemocných a upuštění od záměru dosažení kompletní odpovědi.
Detailní analýza příčin ukončení léčby a nežádoucích účinků vykazuje ve srovnání s literaturou srovnatelné spektrum a zdůvodnění smrti pacientů sledovaného souboru nepřináší žádné překvapivé souvislosti.
Je zřejmé, že podrobná kontinuální analýza dat sledovaného souboru nemocných přináší užitečné a stále nové údaje, které lze využít nejen ke zlepšení péče samotné, ale i ke směrování dalšího sledování pacientů.
prof. MUDr. Miroslav Penka, CSc.
www.fnbrno.cz
e mail: m.penka@fnbrno.cz
Zdroje
1. Barbui T, Barosi G, Grossi A et al. Practice guidelines for the therapy of essential thrombocythemia. A statement from the Italian Society of Hematology, the Italian Society of Experimental Hematology and Italian Group for Bone Marrow Transplantation. Haematologica 2004; 89 : 215 – 232.
2. Brière JB. Essential thrombocythemia. Orphanet J Rare Dis 2007; 2 – 3 : 1 – 17.
3. Cortelazzo S, Finazzi G, Ruggeri M et al. Hydoxyurea for patients with essential thrombocythemia and a high risk of thrombosis. N Engl J Med 1995; 332 : 113.
4. Costello R, Callaghan TO, Sébahoun G. Traitement de la thrombocythemie essentielle. Rev Med Intern 2005; 26 : 947 – 955.
5. Elliott MA, Tefferi A. Interferon‑alfa therapy in polycythemia vera and essential Thrombocythemia. Semin Thromb Hemost 1997; 23 : 463.
6. Finazzi G, Barbui T. Risk‑adapted therapy in essential thrombocythemia and polycythemia vera. Blood Rev 2005; 19 : 243 – 252.
7. Fruchtman SM, Petitt RM, Gilbert HS et al. Anagrelide Study Group: Anagrelide: analysis of long‑term efficacy, safety and leukemogenic potential in myeloproliferative disorders. Leuk Res 2005; 29 : 481 – 491.
8. Green A, Campbell P, Buck G et al. The Medical Research Council PT1 Trial in Essentials Thrombocythemia. Blood 2004; 104/ 11 : 5a – 6a (Abstract 6).
9. Hoffman R, Prchal JT, Samuelson S et al. Philadelphia Chromosome - Negative Myeloproliferative Disorders: Biology and Treatment. Biol Blood Marrow Transplant 2007; 13 : 64 – 72.
10. Jaffe ES, Harris NL, Stein H et al (eds). World health organization classification of tumours. Pathology and genetics of tumours of haematopoietic and lymphoid tissues. IARC Press, Lyon 2001 : 352 s.
11. Kralovics R, Teo SS, Li S et al. Acquisition of the V617F mutation of JAK2 is a late genetic event in a subset of patient with myeloproliferative disorders. Blood 2006; 108 : 1377 – 1380.
12. Landolfi R, Cipriani MC, Novarese L. Thrombosis and bleeding in polycythemia vera and essential thrombocythemia: Pathogenetic mechanism and prevention. Best Pract Res Clin Haematol 2006; 19/ 3 : 617 – 633.
13. Michiels JJ, Barbui T, Finazzi G et al. Diagnosis and treatment of polycythemia vera and possible future study designs of the PVSG. Leuk Lymphoma 2000; 36 : 239 – 253.
14. Michiels JJ, Thiele J. Clinical and pathological criteria for the diagnosis of essential thrombocythemia, polycythemia vera and idiopathic myelofibrosis (agnogenic myeloid metaplasia). Int J Hematol 2002; 76 : 133 – 145.
15. Michiels JJ, DeRaeve H, Hebeda K et al. WHO bone marrow features and European clinical, molecular, and pathological (ECMP) criteria for the diagnosis of myeloproliferative disorders. Leuk Res 2007; 31 : 1031 – 1038.
16. Murphy S, Peterson P, Iland H et al. Experience of the Polycythemia Vera Study Group with essential thrombocythemia: a final report on diagnostic criteria, survival, and leukemic transition by treatment. Semin Hematol 1997; 34 : 29 – 39.
17. Penka M, Schwarz J, Pytlík R et al. Doporučený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející myeloproliferativní onemocnění. Vnitř Lék 2005; 51 : 741 – 751.
18. Penka M, Schwarz J, Pavlík T et al. Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2007. Vnitř Lék 2008; 54 : 775 – 782.
19. Petrides PE. Anagrelid: decade of clinical experiences with its use for the treatment of primary thrombocythaemia. Expert Opin Pharmacother 2004; 5 : 1781 – 1798.
20. Puigdecanet E, Spinet B, Villa O et al. Detection of abnormalities of PRV - 1, TPO, and c‑MPL genes detected by fluorescence in situ hybridization in essencial thrombocythemia. Cancer Genet Cytogenet 2006; 167 : 39 – 42.
21. Schwarz J, Hrachovinova I, Vorlova Z et al. Thromboembolism in thrombocythemia patients with an additional thrombophilic state (Abstract 974). Hematol J 2004; 5 (Suppl 2): S321.
22. Speletas M, Katodritou E, Daiou C et al. Correlations of JAK2 – V617F mutation with clinical and laboratory findings in patients with myeloproliferative disorders. Leuk Res 2007; 31 : 1053 – 1062.
23. Steurer M, Gastl G, Jedrzejczak W et al. Anagrelide for Thrombocytosis in myeloproliferative disorders: a prospective study to assess efficacy and adverse event profile. Cancer 2004; 101 : 2239 – 2246.
24. Thiele J, Kvasnicka HM, Vardiman J. Bone marrow histopathology in the diagnosis of chronic myeloproliferative disorders. A forgotten pearl. Best Pract Res Clin Haematol 2006; 19 : 413 – 437.
25. Tefferi A, Gangat N, Wolanskyj A. The interaction between leukocytosis and other risk factors for thrombosis in essentials thrombocytahemia. Blood 2007; 109 : 4105 – 4110.
26. Tefferi A, Vardiman JW. Classification and diagnosis of myeloproliferative neoplazma: The 2008 World Health Organization criteria and point - of - care diagnostic algorithms. Leukemia 2008; 22 : 14 – 22.
27. Tsimberidou MA, Colburn DE, Welch MA et al. Anagrelid and imatinib mesylate combination therapy in patients with chronic myeloproliferative disorders. Cancer Chemother Pharmacol 2003; 52 : 229 – 234.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Neuroprotekce po srdeční zástavě a časná poresuscitační péče – editorial
- Má tromboelastografie své místo v kardiochirurgii a kardiologii? – editorial
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Pavlišta D et al. Neinvazivní karcinomy prsu. Praha: Maxdorf 2008, 181 s. ISBN 978- 80-7345-173- 8
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



