-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBazický fibroblastový růstový faktor (bFGF) a cévní endotelový růstový faktor (VEGF) jsou zvýšeny v plazmě periferní krve nemocných s chronickou lymfocytární leukemií a klesají po intenzivní léčbě obsahující fludarabin
Basic fibroblast growth factor (bFGF) and vascular endothelial growth factor (VEGF) are elevated in peripheral blood plasma of patients with chronic lymphocytic leukemia and decrease after intensive fludarabine-based treatment
Chronic lymphocytic leukemia (CLL) is characterized by extraordinary heterogeneity in terms of clinical course with overall survival ranging from several months to dozens of years. It is currently not possible to accurately predict the future clinical course in an individual patient. Angiogenesis has been recently reported as a potential prognostic factor in various hematological malignancies including CLL. The objective of the present study was to quantify plasma levels of key angiogenic activators vascular endothelial growth factor (VEGF) and basic fibroblast growth factor (bFGF) in patients with CLL and determine their potential change after intensive fludarabine-based treatment. Peripheral blood EDTA plasma concentrations of bFGF and VEGF were measured using comercially available enzyme-linked immunosorbent assay in 73 patients with untreated CLL (43 males, 30 females, median age, 65 years, range 31–88) and 80 healthy donors serving as control group. We found statistically significant increase in concentrations in patients with chronic lymphocytic leukemia compared to the control group (p < 0.0001 for both cytokines). No differences in angiogenic factors were noted between subgroups with low vs. intermediate vs. high-risk stage according to modified Rai staging or males vs. females. In twelve patients who achieved at least partial response after intensive fludarabine-based treatment, levels of bFGF as well as VEGF decreased significantly (bFGF, p = 0.0005; VEGF, p = 0.0068); in addition, they were no more significantly different from controls (bFGF, p = 0.524; VEGF, p = 0.728). Our data showed that key angiogenic activators bFGF and VEGF were elevated in plasma of CLL patients. Furthemore, treatment with intensive fludarabinecontaining regimens resulted in significant decrease of both cytokines. These data suggest that angiogenic cytokines may indeed play a significant role in CLL biology and that treatment with combination of fludarabine, cyclophosphamide ± rituximab may exhibit antiangiogenic properties. Further studies with longer follow-up are necessary for evaluation of a possible association between angiogenic markers and progression-free survival or overall survival.
Keywords:
angiogenesis – chronic lymphocytic leukemia – bFGF – VEGF – prognosis – treatment – fludarabine
Autoři: L. Smolej 1; C. Andrýs 2
; J. Krejsek 2; D. Belada 1; P. Žák 1; O. Široký 1; J. Malý 1
Působiště autorů: Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 1; Ústav klinické imunologie a alergologie Lékařské fakulty UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc. 2
Vyšlo v časopise: Vnitř Lék 2007; 53(11): 1171-1176
Kategorie: Původní práce
Souhrn
Chronická lymfocytární leukemie (CLL) je charakteristická výraznou různorodostí prognózy s celkovým přežitím v řádu několika měsíců až desítek let. V současné době není možné přesně určit budoucí klinický průběh u jednotlivého pacienta. Angiogeneze se ukazuje v posledních letech jako potenciální prognostický faktor u řady hematologických malignit včetně CLL. Cílem naší studie bylo změřit klíčové angiogenní faktory bFGF a VEGF (basic fibroblast growth factor, vascular endothelial growth factor) metodou ELISA v plazmě periferní krve u 73 nemocných s neléčenou chronickou lymfocytární leukemií (43 mužů, 30 žen, medián věku 65 let, rozmezí 31-88 let) a 80 zdravých dobrovolníků. Zjistili jsme signifikantně zvýšenou koncentraci u nemocných s CLL v porovnání s kontrolní skupinou (p < 0,0001 pro oba cytokiny). Nebyly nalezeny významné rozdíly v angiogenních faktorech mezi podskupinami s nízkým vs středním vs vysokým rizikem dle Raie či závislost angiogenních faktorů na pohlaví. U skupiny 12 pacientů došlo po intenzivní léčbě založené na fludarabinu k významnému poklesu u obou těchto faktorů (bFGF: p = 0,0005; VEGF: p = 0,0068), které již nebyly signifikantně odlišné od kontrolní skupiny (bFGF: p = 0,524; VEGF: p = 0,728). Naše data prokázala zvýšení zásadních angiogenních aktivátorů bFGF a VEGF u chronické lymfocytární leukemie. Intenzivní léčba kombinující fludarabin a cyklofosfamid ± rituximab by mohla mít také antiangiogenní účinky. Další studie s delší dobou sledování jsou nutné k vyhodnocení vlivu angiogenních ukazatelů na dobu do progrese či celkové přežití.
Klíčová slova:
chronická lymfocytární leukemie - angiogeneze - bFGF - VEGF - prognóza - léčba - fludarabinÚvod
Angiogeneze, tedy novotvorba cév z již existující vaskulatury, je zásadním procesem při rozvoji malignit [1-4]. Zatímco význam angiogeneze u solidních nádorů je znám již od počátku 70. let 20. století [1], teprve v 90. letech 20. století dochází k výzkumu neovaskularizace u maligních onemocnění krvetvorby. Zvýšená angiogeneze byla zjištěna u akutních a chronických leukemií, maligních lymfomů, mnohočetného myelomu, myeloproliferací i myelodysplazií [3-9]. Některé studie u maligních onemocnění krvetvorby prokázaly souvislost mezi zvýšenou angiogenezí a nepříznivým klinickým průběhem [7-9]. Chronická lymfocytární leukemie (CLL] je nejčastějším leukemickým onemocněním dospělých v západní populace. Toto lymfoproliferativní onemocnění je typické neobyčejnou různorodostí prognózy (s celkovým přežitím od několika měsíců až po desítky let), která neumožňuje dopředu odhadnout klinický průběh u individuálního pacienta [10]. S cílem zpřesnění prognózy CLL jsou hledány nové prognostické parametry, jako v posledních letech např. genetické aberace detekované fluorescenční in situ hybridizací (FISH) či mutační stav genů kódujících variabilní část těžkého řetězce imunoglobulinu (IgVH) [11]. V posledních letech bylo publikováno, že lymfocyty CLL mají schopnost vyrábět angiogenní aktivátory i inhibitory [12] a že ukazatele angiogeneze by mohly mít u CLL prognostický význam [13-16]. Pouze jediná studie zkoumala vývoj koncentrací angiogenních cytokinů při léčbě CLL [17]. Za nejdůležitější aktivátory angiogeneze jsou pokládány cévní endotelový růstový faktor (vascular endothelial growth factor - VEGF) a bazický fibroblastový růstový faktor (basic fibroblast growth factor - bFGF) [3-4,18-20]. Cílem naší práce bylo 1. stanovení těchto angiogenních faktorů v periferní krvi u nemocných s CLL, 2. zhodnocení jejich vztahu ke klinickému stadiu a 3. porovnat jejich hodnoty v závislosti na intenzivní léčbě na bázi fludarabinu.
Nemocní a metody
Do studie bylo zařazeno 73 nemocných s neléčenou chronickou lymfocytární leukemií diagnostikovanou podle klasických kriterií National Cancer Institute - Sponsored Working Group [21]. Jednalo se o 43 mužů a 30 žen, medián věku 65 let, rozmezí 31-88 let. Nízké (Rai 0)/střední (Rai I - II)/vysoké (Rai III - IV) riziko dle modifikovaného Raiova stagingu [22] bylo přítomno u 37/31/5 nemocných. Kontrolní skupinu tvořilo 80 zdravých dobrovolníků. Jako antikoagulans ethylendiamintetraoctová kyselina (EDTA) byla použita. Všechny vzorky plazmy byly po centrifugaci zamraženy při teplotě -70 ºC až do měření. bFGF i VEGF byly stanoveny pomocí komerčně dostupného ELISA kitu (Human VEGF/bFGF Quantikine ELISA kit, R & D Systems, MN, USA). Měření bylo provedeno podle standardní metodiky doporučené výrobcem. Studie byla provedena dle zásad Helsinské deklarace, schválena etickou komisí a nemocní podepsali informovaný souhlas. Statistická analýza byla provedena pomocí softwaru Analyse-it (Analyse-it Software Ltd, Velká Británie). Všechna data byla testována na normalitu Shapirovým-Wilkovým testem. Pokud bylo rozdělení dat normální, byl k testování rozdílů koncentrací vůči kontrolní skupině užit parametrický t-test. Pokud neměla data normální rozdělení, byl použit neparametrický Mannův-Whitneyův U test. K testování změny angiogenních faktorů po léčbě byl proveden Wilcoxonův test. Korelace byla stanovena pomocí Spearmanova korelačního koeficientu. Všechny výsledky p hodnot jsou pro dvoustranné testy. P hodnoty nižší než 0,05 byly považovány za statisticky signifikantní.
Výsledky
Deskriptivní statistika i výsledky testování rozdílů v koncentracích bFGF a VEGF mezi jednotlivými skupinami a kontrolami jsou uvedeny v tab. 1. Koncentrace obou cytokinů u nemocných s CLL byly signifikantně vyšší oproti kontrolní skupině (bFGF: průměr ± standardní odchylka 177,1 ± 167,3 pg/ml, 95% IS - interval spolehlivosti - průměru 140,9-213,5 pg/ml vs 11,1 ± 11,3 pg/ml, 95% IS 8,6-13,6 pg/ml, p < 0,0001; VEGF: 144,2 ± 141,6 pg/ml, 95 % IS 113,4-174,9 pg/ml vs 64,2 ± 59,6 pg/ml, 95% IS 51,0-77,5 pg/ml, p < 0,0001), obr. 1. Počet leukocytů v době odběru nekoreloval s koncentracemi angiogenních faktorů (bFGF: r = 0,1; VEGF: r = 0,17), z čehož vyplývá, že hodnoty angiogenních cytokinů nejsou prostým ukazatelem nádorové masy (tab. 2). Z hlediska prognostických faktorů nebyly nalezeny rozdíly v koncentracích bFGF či VEGF u nemocných s nízkým vs středním vs vysokým rizikem dle Raie (což také hovoří proti lineární souvislosti intenzity angiogeneze a nádorové nálože) či u mužů vs u žen (obr. 2 a 3). U 12 nemocných, kteří podstoupili intenzivní léčbu obsahující fludarabin (režim FCR - fludarabin + cyklofosfamid + rituximab, n = 9; protokol FC - fludarabin + cyklofosfamid, n = 3) došlo po léčbě k signifikantnímu poklesu koncentrace bFGF (p = 0,0005) i VEGF (p = 0,0068), aniž by pokles angiogenních cytokinů po léčbě koreloval s počtem leukocytů (obr. 4, tab. 2). Hodnoty bFGF i VEGF u CLL pacientů po léčbě byly již bez statisticky významného rozdílu vůči zdravým kontrolám (p = 0,524, resp. 0,728).
Graf 1. Statisticky významné zvýšení bFGF (a) i VEGF (b) u skupiny nemocných s CLL vs kontrol. 
Koncentrace jsou uvedeny v pg/ml. Graf 2. Plazmatické koncentrace bFGF (a) a VEGF (b) se neliší mezi muži a ženami. 
Koncentrace jsou uvedeny v pg/ml. Graf 3. Hodnoty bFGF (a) ani VEGF (b) nejsou závislé na klinickém stadiu dle Raie. 
Koncentrace jsou uvedeny v pg/ml. Graf 4. Statisticky významný pokles koncentrací bFGF (a) i VEGF (b) po intenzivní léčbě založené na fludarabinu. 
Koncentrace jsou uvedeny v pg/ml. Tab. 1. Angiogenní aktivátory bFGF a VEGF jsou signifikantně zvýšeny u CLL a významně klesají po léčbě založené na fludarabinu. 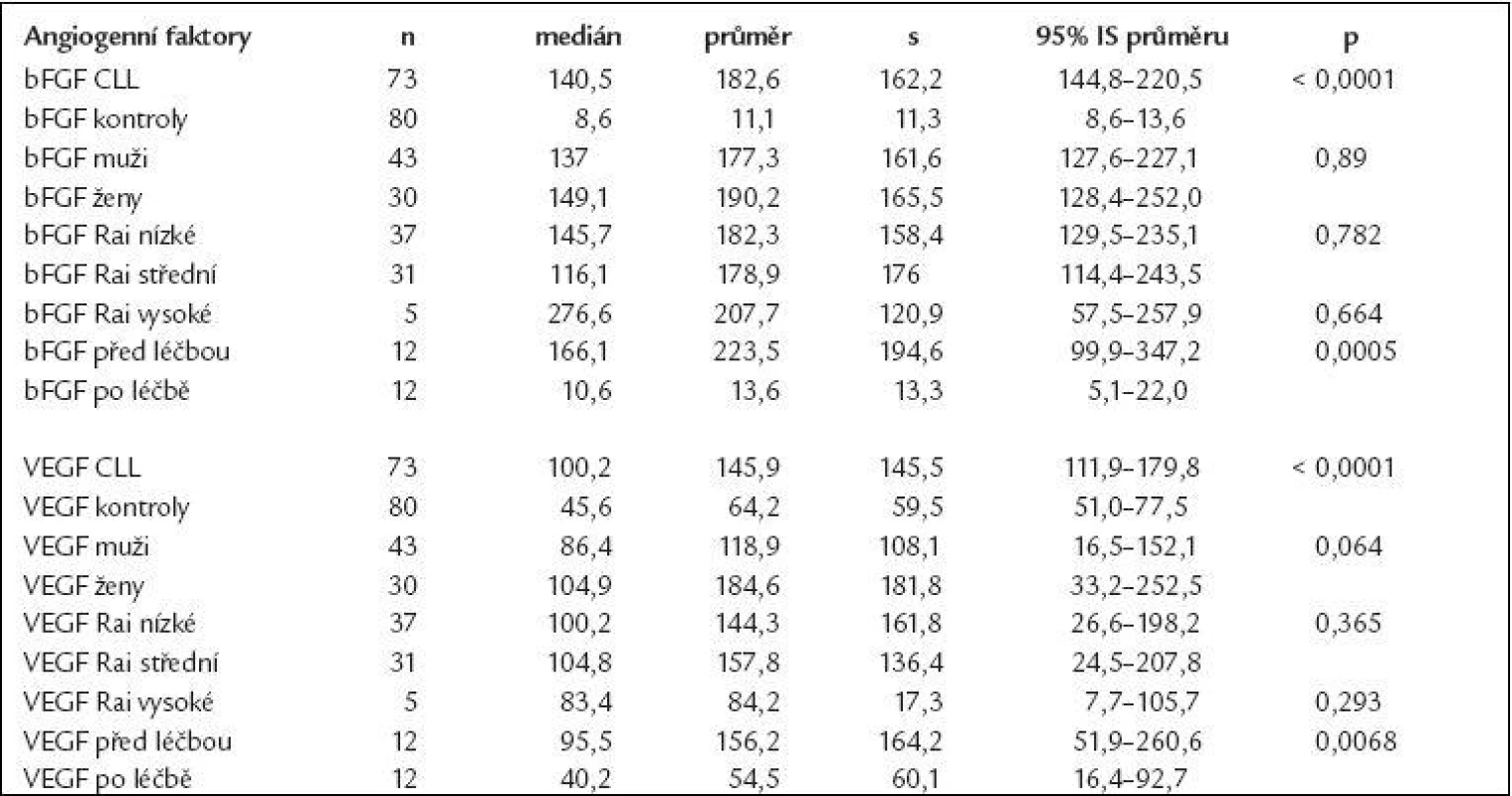
Hodnoty bFGF i VEGF jsou uvedeny v pg/ml. CLL – chronická lymfocytární leukemie, s – standardní odchylka, IC – interval spolehlivosti. Tab. 2. Koncentrace angiogenních faktorů ani jejich pokles po léčbě nekorelují s hodnotou leukocytů. 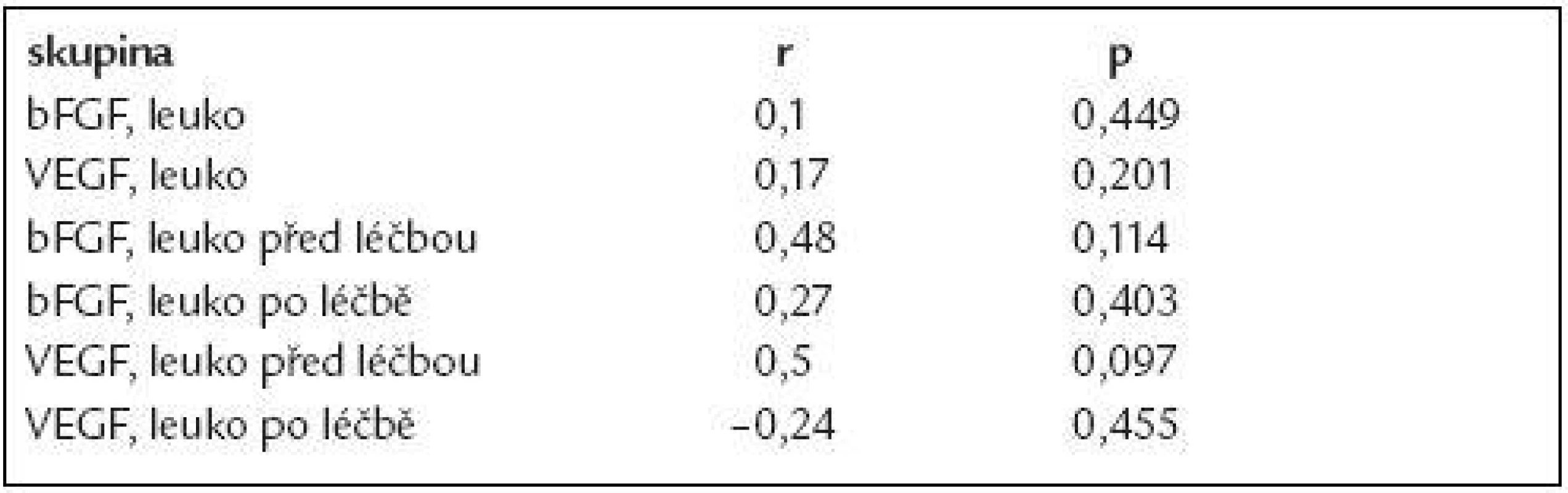
Leuko – leukocyty, r – Spearmanův korelační koeficient Diskuse
V posledních letech přibývá důkazů o významu angiogeneze u hematologických malignit. Zvýšené koncentrace angiogenních aktivátorů v periferní krvi byly zjištěny u prakticky všech maligních krevních onemocnění [3-9]. První zmínka o angiogenních ukazatelích u chronické lymfocytární leukemie pochází z roku 1995, kdy Duensing et al prokázali zvýšení bFGF v séru u pilotního souboru 18 pacientů s CLL [23]. V pozdějších letech bylo publikováno několik prací zkoumajících cirkulující bFGF i VEGF [5,13,24-29], některé však vykazovaly metodické nedostatky v podobě naprosté absence či nedostatečného rozsahu kontrolní skupiny [5,23,25,29], ev. zařazení i nemocných, kteří před hodnocením angiogeneze již podstoupili cytoredukční léčbu [5,23,25,29]. V naší práci jsou proto zařazeni výhradně nemocní s neléčenou CLL a kontrolní skupina 80 zdravých dobrovolníků (největší ze všech publikovaných prací na dané téma) prakticky vylučuje chybu malých čísel. V naší práci jsme v souladu s literaturou zjistili statisticky významné zvýšení klíčových aktivátorů angiogeneze bFGF a VEGF v periferní krvi ve srovnání s kontrolní skupinou. Co se týče prognostického významu ukazatelů angiogeneze, ve 3 studiích byly nalezeny vyšší koncentrace bFGF u pokročilých vs časných stadií [13,26,28]. Molica et al navíc zjistili souvislost mezi vyšší koncentrací VEGF a časnější progresí nemocných z časných stadií [13]. Bairey et al publikovali korelaci mezi sérovým bFGF a antiapoptotickým proteinem bcl-2 [25]. V našem souboru jsme neshledali signifikantních rozdílů v bFGF či VEGF mezi nemocnými různých klinických stadií. Jednou z možných příčin je odlišné spektrum pacientů (pouze 5 nemocných v pokročilém stadiu) a také použití odlišného materiálu pro hodnocení angiogenních faktorů (plazma vs sérum). Z technického hlediska je zajímavé, že naprostá většina studií hodnotila angiogenní aktivátory v krevním séru periferní krve [14,24-27], pouze ve2 pracích byla použita krevní plazma [5,29]. Otázka, zda je vhodnější měřit ukazatele angiogeneze v séru či plazmě, je kontroverzní a dosud nedořešená, nicméně řada prací dokazuje, že zejména v případě VEGF je kvantifikace v séru zatížena chybou způsobenou uvolněním tohoto faktoru z trombocytů při tvorbě krevní sraženiny, z čehož vyplývají vyšší hodnoty v séru ve srovnání s plazmou a pozitivní korelace s počtem trombocytů [30-33]. Z tohoto důvodu považujeme za přesnější stanovení angiogenních faktorů v plazmě.
Naše pilotní data prokázala významné snížení bFGF i VEGF po chemo(imuno)terapii na bázi fludarabinu, na základě čehož vyslovujeme hypotézu, že tato léčba by mohla mít také antiangiogenní účinky. Tuto domněnku nepřímo podporují publikace dokazující antiangiogenní efekt u některých klasických cytostatik [34,35]. V jediné předchozí studii hodnotící vliv léčby na angiogenní faktory u CLL zjistila Gora-Tybor et al signifikantní pokles bFGF a TGF-β (transformujícího růstového faktoru β) u 18 nemocných léčených monoterapií kladribinem [17]. Dosud neexistuje práce hodnotící angiogenní faktory v závislosti na kombinované léčbě obsahující fludarabin, stejně tak nebyla dosud publikována studie hodnotící vývoj koncentrací VEGF po léčbě CLL. V tomto jsou naše výsledky prioritní. Nedostatkem naší studie je absence srovnání angiogenních faktorů s moderními prognostickými faktory (mutační stav IgVH, genetické aberace vyšetřované pomocí FISH). Souvislost mutačního stavu IgVH a angiogenních aktivátoru jsme již publikovali jako pilotní studii u 46 nemocných [36]. V nynější rozšířené kohortě však nebylo možné z finančních důvodů tato vyšetření provést u starých či polymorbidních nemocných vzhledem k tomu, že velmi drahé stanovení mutačního stavu IgVH či genetických aberací u nich neovlivní volbu terapie.
Závěr
Závěrem shrnujeme, že v naší studii jsme prokázali signifikantní zvýšení zásadních angiogenních cytokinů bFGF a VEGF u skupiny nemocných s dosud neléčenou CLL. Nebyla prokázána souvislost koncentrací těchto faktorů s klinickým stadiem dle Raie, či pohlavím. Agresivní léčba složená z fludarabinu, cyklofosfamidu ± rituximabu vedla k významnému snížení koncentrací těchto angiogenních aktivátorů na hodnoty srovnatelné s kontrolní skupinou. Tyto výsledky by tedy mohly ukazovat na antiangiogenní působení této terapie. Delší doba sledování je nutná k posouzení eventuální spojitosti mezi angiogenními ukazateli parametry jako doba do progrese či celkové přežití; rozsáhlejší kohorta nemocných pak k potvrzení pilotních dat týkajících se poklesu angiogenních faktorů po léčbě. Další výzkum angiogeneze u CLL je cenný nejen z prognostického, ale také léčebného hlediska, neboť v současné době jsou již k dispozici nadějná data z klinických studií využívajících antiangiogenní léky, jako je thalidomid či lenalidomid [37,38].
Tato práce byla podpořena grantem NR/8373 - 3 IGA MZ ČR.
MUDr. Lukáš Smolej
www.fnhk.cz
e-mail: smolej@seznam.cz
Doručeno do redakce: 18. 5. 2007
Přijato po recenzi: 17. 7. 2007
Zdroje
1. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med 1971; 285 : 1182-1186.
2. Folkman J. Seminars in Medicine of the Beth Israel Hospital, Boston. Clinical applications of research on angiogenesis. N Engl J Med 1995; 333 : 1757-1763
3. Pour L, Hájek R, Büchler T et al. Angiogeneze a antiangiogenní léčba u nádorů. Vnitř Lék 2004; 50(12): 930-938.
4. Smolej L, Benešová P. Význam angiogeneze u maligních nádorů. Acta Medica (Hradec Králové) Suppl 2005; 48 : 69-72.
5. Aguayo A, Kantarjian H, Manshouri T et al. Angiogenesis in acute and chronic leukemias and myelodysplastic syndromes. Blood 2000; 96 : 2240-2245.
6. Moehler TM, Ho AD, Goldschmidt H et al. Angiogenesis in hematologic malignancies. Crit Rev Oncol Hematol 2003; 45 : 227-244.
7. Rajkumar SV, Witzig TE. A review of angiogenesis and antiangiogenic therapy with thalidomide in multiple myeloma. Cancer Treat Rev 2000; 26 : 351-362.
8. Salven P, Teerenhovi L, Joensuu H. A high pretreatment serum vascular endothelial growth factor concentration is associated with poor outcome in non-Hodgkin’s lymphoma. Blood 1997; 90 : 3167.
9. Perez-Atayde AR, Sallan SE, Tedrow U et al. Spectrum of tumor angiogenesis in the bone marrow of children with acute lymphoblastic leukemia. Am J Pathol 1997; 150 : 815-821.
10. Shanafelt TD, Geyer SM, Kay NE. Prognosis at diagnosis: integrating molecular biologic insights into clinical practice for patients with CLL. Blood 2004; 103 : 1202-1210.
11. Papajík T, Jarošová M, Pikalová Z et al. Chronická B-lymfocytární leukemie. Část II: Diagnostická kritéria a význam stanovení individuální prognózy nemocného. Trans Hemat dnes 2006; 12 : 132-139.
12. Kay NE, Bone ND, Tschumper RC et al. B-CLL cells are capable of synthesis and secretion of both pro - and anti-angiogenic molecules. Leukemia 2002; 16 : 911-919.
13. Molica S, Vitelli G, Levato D et al. Clinicoprognostic implications of increased serum levels of vascular endothelial growth factor and basic fibroblastic growth factor in early B-cell chronic lymphocytic leukaemia. Br J Cancer 2002; 86 : 31-35.
14. Menzel T, Rahman Z, Calleja E et al. Elevated intracellular level of basic fibroblast growth factor correlates with stage of chronic lymphocytic leukemia and is associated with resistance to fludarabine. Blood 1996; 87 : 1056-1063.
15. Konig A, Menzel T, Lynen S et al. Basic fibroblast growth factor (bFGF) upregulates the expression of bcl-2 in B-cell chronic lymphocytic leukemia cell lines resulting in delaying apoptosis. Leukemia 1997; 11 : 258-265.
16. Ferrajoli A, Manshouri T, Estrov Z et al. High levels of vascular endothelial growth factor receptor-2 correlate with shortened survival in chronic lymphocytic leukemia. Clin Cancer Res 2001; 7 : 795-799.
17. Gora-Tybor J, Blonski JZ, Robak T. Cladribine decreases the level of angiogenic factors in patients with chronic lymphocytic leukemia. Neoplasma 2002; 49 : 145-148.
18. Auguste P, Javerzat S, Bikfalvi A. Regulation of vascular development by fibroblast growth factors. Cell Tissue Res 200; 314 : 157-166.
19. Šimíčková M, Dubská L, Kocáková I et al. Angiogeneze a antiangiogenní terapie se zaměřením na cirkulující vaskulární endotelový růstový faktor (VEGF). Klin Onkol 2006; 19 : 212-216.
20. Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Nat Rev Drug Discov 2004; 3 : 391-400.
21. Cheson BD, Bennett JM, Grever M et al. National Cancer Institute–sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood 1996; 87 : 4990-4997.
22. Rai KR. A critical analysis of staging in CLL. In: Gale RP, Rai KR (eds). Chronic Lymphocytic Leukemia. Recent Progress and Future Direction. New York (NY): AR Liss 1987 : 253.
23. Duensing S, Atzpodien J. Increased intracellular and plasma levels of basic fibroblast growth factor in B-cell chronic lymphocytic leukemia. Blood 1995; 85 : 1978-1980.
24. Molica S, Vitelli G, Levato D et al. Increased serum levels of vascular endothelial growth factor predict risk of progression in early B-cell chronic lymphocytic leukaemia. Br J Haematol 1999; 107 : 605-610.
25. Bairey O, Zimra Y, Shaklai M et al. Bcl-2 expression correlates positively with serum basic fibroblast growth factor (bFGF) and negatively with cellular vascular endothelial growth factor (VEGF) in patients with chronic lymphocytic leukaemia. Br J Haematol 2001; 113 : 400-406.
26. Gora-Tybor J, Blonski JZ, Robak T. Circulating proangiogenic cytokines and angiogenesis inhibitor endostatin in untreated patients with chronic lymphocytic leukemia. Mediators Inflamm 2003; 12 : 167-171.
27. Gora-Tybor J, Blonski JZ, Robak T. Circulating vascular endothelial growth factor (VEGF) and its soluble receptors in patients with chronic lymphocytic leukemia. Eur Cytokine Netw 2005; 16 : 41-46.
28. Wolowiec D, Dybko J, Wrobel T et al. Circulating sCD138 and some angiogenesis-involved cytokines help to anticipate the disease progression of early-stage B-cell chronic lymphocytic leukemia. Mediators Inflamm 2006; 3 : 1-6.
29. Krejci P, Dvorakova D, Krahulcova E. FGF-2 abnormalities in B cell chronic lymphocytic and chronic myeloid leukemia. Leukemia 2001; 15 : 228-237.
30. Werther K, Christensen IJ, Nielsen HJ. Determination of vascular endothelial growth factor (VEGF) in circulating blood: significance of VEGF in various leucocytes and platelets. Scand J Clin Lab Invest 2002; 62 : 343-350.
31. Webb NJ, Bottomley MJ, Watson CJ et al. Vascular endothelial growth factor (VEGF) is released from platelets during blood clotting: implications for measurement of circulating VEGF levels in clinical disease. Clin Sci (Lond) 1998; 94 : 395-404.
32. George ML, Eccles SA, Tutton MG et al. Correlation of plasma and serum vascular endothelial growth factor levels with platelet count in colorectal cancer: clinical evidence of platelet scavenging? Clin Cancer Res 2000; 6 : 3147-3152.
33. Banks RE, Forbes MA, Kinsey SE et al. Release of the angiogenic cytokine vascular endothelial growth factor (VEGF) from platelets: significance for VEGF measurements and cancer biology. Br J Cancer 1998; 77 : 956-964.
34. Vacca A, Iurlaro M, Ribatti D et al. Antiangiogenesis is produced by nontoxic doses of vinblastine. Blood 1999; 94 : 4143-4155.
35. Kerbel KS, Viloria-Petit A, Klement G et al. “Accidental” anti-angiogenic drugs: anti-oncogene directed signal transduction inhibitors and conventional chemotherapeutic agents as examples. Eur J Cancer 2000; 36 : 1248-1257.
36. Smolej L, Andrys C, Pekova S et al. Plasma levels of basic fibroblast growth factor and vascular endothelial growth factor and their association with IgVH mutation status in patients with B-cell chronic lymphocytic leukemia. Haematologica 2006; 91 : 1432-1433.
37. Chanan-Khan A, Miller KC, Takeshita K et al. Results of a phase 1 clinical trial of thalidomide in combination with fludarabine as initial therapy for patients with treatment-requiring chronic lymphocytic leukemia (CLL). Blood 2005; 106 : 3348-3352.
38. Chanan-Khan A. Targeting the microenvironment: a new treatment paradigm for chronic lymphocytic leukaemia. Haematologica Reports 2006; 2 : 22-27.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- Využití implantabilních monitorovacích zařízení v diagnostice synkop nejasné etiologie - editorial
- N-terminální peptid pro-BNP a endotelin u hemodialyzovaných nemocných - editorial
- Adiponektin a inzulinová rezistence - editorial
- Vplyv obezity na genovú expresiu adiponektínu a jeho receptoru v subkutánnom tukovom tkanive - editorial
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Dlouhodobé výsledky srdeční resynchronizační léčby u pacientů s těžkým srdečním selháním
- Využití stanovení glykogenfosforylázy BB v diagnostice algické formy akutních koronárních syndromů
- Bazický fibroblastový růstový faktor (bFGF) a cévní endotelový růstový faktor (VEGF) jsou zvýšeny v plazmě periferní krve nemocných s chronickou lymfocytární leukemií a klesají po intenzivní léčbě obsahující fludarabin
- Variabilita plazmatických hladin big endotelinu a NT-proBNP u nemocných se srdečním selháním v chronickém hemodialyzačním programu
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
- Vliv obezity na genovou expresi adiponektinu a jeho receptorů v subkutánní tukové tkáni
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Význam endoskopické cytoskopie u vyšetření trávicího traktu
-
Diagnostika a léčba chronické hepatitidy B
Doporučený postup České hepatologické společnosti České lékařské společnosti J. E. Purkyně a Společnosti infekčního lékařství České lékařské společnosti J.E. Purkyně - Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom horní duté žíly: definice, etiologie, fyziologie, symptomy, diagnostika a léčba
- Rituximab (MabThera®) - nový biologický lék v terapii revmatoidní artritidy
- Diagnostický prínos použitia implantovaného slučkového rekordéra (Reveal Plus) u pacientov so synkopou nejasnej etiológie
- Endoskopická diagnostika a léčba biliárních komplikací po laparoskopické cholecystektomii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



