-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou poruchou funkcie štítnej žľazy
Affection of cardiovascular system in diabetic patients with thyroid dysfunctions
Affection of cardiovascular system is one of the most frequent and – especially in higher age groups – the most serious clinical manifestations of thyroid dysfunction. Moreover, diabetics, mainly type 2 diabetes patients, have a marked predisposition to cardiovascular diseases, especially to atherosclerosis and its visceral complications. Simultaneous occurrence of diabetes mellitus (DM) and thyroid dysfunctions involves a very high risk of development and progression of various forms of cardiovascular diseases. There are two basal aspects of the influence of hypothyreosis on cardiovascular system. Decreasing basal metabolism in the whole organism reduces requirements on the cardiovsuclar system. The second aspect of the influence of hypothyreosis on the cardiovascular system is its atherogenic effect. Hypothyreosis in diabetics accelerates the development of chronic, primarily macroangiopathic complications. As opposed to hypothyreosis, the clinical picture of which is not characterised by cardiovascular system disorders, cardiac involvement in patients with hyperthyreosis is more pronounced. In older diabetics hyperthyreosis is often manifested only by cardiovascular symptomatology. Subclinical hyperthyreosis in DM patients may stimulate cardiac function and increase the risk of atrial fibrillation.
Key words:
cardiovascular system – diabetes mellitus – hypothyreosis – hyperthyreosis
Autoři: Z. Schroner 1; I. Lazúrová 2
Působiště autorů: NZZ interná a diabetologická ambulancia, Moldava nad Bodvou, Slovenská republika 1; I. interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura, Košice, Slovenská republika, prednostka prof. MUDr. Ivica Lazúrová, CSc. 2
Vyšlo v časopise: Vnitř Lék 2006; 52(11): 1069-1076
Kategorie: Přehledný referát
Souhrn
Postihnutie kardiovaskulárneho systému patrí k najčastejším a predovšetkým vo vyšších vekových skupinách k najzávažnejším klinickým prejavom porúch funkcie štítnej žľazy. Takisto diabetici, obzvlášť diabetici 2. typu, majú významný sklon ku kardiovaskulárnym ochoreniam, predovšetkým ateroskleróze a jej orgánovým komplikáciám. Pri súčasnom výskyte diabetes mellitus (DM) a funkčných porúch štítnej žľazy je riziko vzniku a vývoja rôznych foriem kardiovaskulárnych ochorení veľmi vysoké. Pôsobenie hypotyreózy na kardiovaskulárny systém u pacientov s DM má dva základné aspekty. Tým, že sa znižuje bazálny metabolizmus v celom organizme, znižujú sa aj nároky na kardiovaskulárny systém. Druhým aspektom pôsobenia hypotyreózy na kardiovaskulárny systém je jej aterogénny vplyv. Hypotyreóza u diabetikov urýchľuje rozvoj dlhodobých predovšetkým makroangiopatických komplikácií. Na rozdiel od hypotyreózy, u ktorej poruchy obehového systému nebývajú v popredí klinického obrazu, pri hypertyreóze patria naopak k najnápadnejším. U starších diabetikov sa hypertyreóza často prejavuje len kardiovaskulárnou symptomatológiou. Už subklinická hypertyreóza u pacientov s DM môže stimulovať kardiálnu funkciu a zvyšovať riziko fibrilácie predsiení.
Kľúčové slová:
kardiovaskulárny systém – diabetes mellitus – hypotyreóza – hypertyreózaÚvod
Kardiovaskulárne (KV) ochorenia sú v súčasnosti vo vyspelých krajinách, ale aj v Slovenskej republike (SR) najčastejšou príčinou mortality, závažným spôsobom sa tiež podieľajú na zvýšenej morbidite a invalidite.
Postihnutie kardiovaskulárneho systému patrí k najčastejším a predovšetkým vo vyšších vekových skupinách k najzávažnejším klinickým prejavom porúch funkcie štítnej žľazy [1].
Takisto diabetici, obzvlášť diabetici 2. typu, majú významný sklon ku kardiovaskulárnym ochoreniam, predovšetkým ateroskleróze a jej orgánovým komplikáciám. Diabetes mellitus (DM) dnes považujeme za komplexné, generalizované kardiovaskulárne ochorenie, najmä s prihliadnutím na skutočnosť, že morbidita a mortalita sa u týchto pacientov viaže s kardiovaskulárnymi problémami [2].
Pri súčasnom výskyte DM a funkčných porúch štítnej žľazy je riziko vzniku a vývoja rôznych foriem kardiovaskulárnych ochorení veľmi vysoké.
V tab. 1 je porovnanie výskytu niektorých vybraných kardiovaskulárnych ochorení pri hypertyreóze, hypotyreóze a diabetes mellitus [3].
Tab. 1. Porovnanie výskytu niektorých vybraných kardiovaskulárnych ochorení pri hypertyreóze, hypotyreóze a diabetes mellitus. 
Účinky hormónov štítnej žľazy na kardiovaskulárny systém
Účinky tyreoidálnych hormónov na kardiovaskulárny systém sú známe už viac ako 200 rokov od doby, kedy bol prvýkrát popísaný klinický obraz ochorení štítnej žľazy. Zmeny obehovej sústavy patria ku klinicky najnápadnejším prejavom tyreopatií a poruchy srdcovej činnosti môžu ohrozovať život pacienta s tyreoidálnym ochorením [4].
Hormóny štítnej žľazy ovplyvňujú kardiovaskulárny aparát komplexne. Pôsobia na KV systém priamym aj nepriamym mechanizmom.
V tab. 2 sú tri potencionálne mechanizmy účinku tyreoidálnych hormónov na kardiovaskulárny systém [5,6].
Tab. 2. Tri potencionálne mechanizmy účinku tyreoidálnych hormónov na kardiovaskulárny systém. 
1. Priame pôsobenie tyreoidálnych hormónov v bunke srdcového svalu sa dotýka tak ako u všetkých buniek génovej expresie v jadre, tak aj nejadrových štruktúr. K nejadrovým účinkom patrí ovplyvnenie transportu aminokyselín, cukrov, kalciových iónov cez bunkovú membránu. Jadrové účinky sa týkajú génovej expresie. Tyreoidálne hormóny exprimujú myozínový gén v srdci aj v kostrovom svale. Tyreoidálne hormóny sa viažu na špeciálne receptory v jadre buniek. Trijódtyronín (T3) má približne 10krát vyššiu afinitu k jadrovým receptorom ako tyroxín (T4), a preto je biologicky oveľa účinnejší [5,7]. Doteraz sú známe 4 izoformy tyreoidálnych receptorov. V rôznych tkanivách sú prítomné α - a β - izoformy tyreoidálnych receptorov [6].
T3 ovplyvňuje pomer myozínových izoenzýmov. Myozín-adenozíntrifosfát-( ATP)-áza izoenzýmu V1 je účinnejšia ako myozín-ATP-áza izoenzýmu V3. Srdce pri hypertyreóze obsahuje výlučne izoenzým V1, čo sa prejaví zvýšením kontrakčnej schopnosti srdca pri hypertyreóze. Pri hypotyreóze je prevaha izoenzýmu V3.
Ďalším dôležitým účinkom tyreoidálnych hormónov je ovplyvnenie dĺžky diastolického relaxačného času stimulovaním kódovania mediátorovej ribonukleovej kyseliny (mRNA), ktorá je zodpovedná za tvorbu Ca-dependentnej ATP-ázy v sarkoplazmatickom retikule. Ca-dependentná ATP-áza sarkoplazmatického retikula je iónová pumpa zodpovedná za pohyb vápnika z cytozolu a jeho sekvestráciu do membranóznych štruktúr sarkoplazmatického retikula počas diastoly. Čím vyššie je množstvo tohto enzýmu, tým viac klesá koncentrácia kalcia v cytoplazme, a tým kratšia je relaxačná doba. Navyše hormóny štítnej žľazy indukujú zvýšenie počtu kalciových kanálov vmembráne sarkoplazmatického retikula, a tým prispievajú k ešte intenzívnejšej a rýchlejšej sekvestrácii vápnika počas diastoly.
Tyreoidálne hormóny zvyšujú aj aktivitu Na+/K+ ATP-ázy. Tento enzým je lokalizovaný v membráne srdcovej bunky. Aj v tomto prípade T3 stimuluje tvorbu mRNA zodpovednú za syntézu Na+/K+ ATP-ázy. Tyreoidálne hormóny celkovo ovplyvňujú enzýmy zodpovedné za výmenu iónov. Tieto enzýmy spôsobujú defosforyláciu bunkového ATP a okrem iného vysvetľujú stimulujúci efekt hormónov štítnej žľazy na spotrebu kyslíka [8].
T3 stimuluje aj tvorbu guanín-nukleotid - regulačného proteínu (GNRP).
Priamy efekt tyreoidálnych hormónov na srdcový sval je realizovaný vo všetkých prípadoch zvýšením proteosyntézy.
2. Interakcia so sympatikovým nervovým systémom. Tyreoidálne hormóny majú podobné účinky na srdce ako sympatikomimetiká, t.j. zvýšenie srdcovej frekvencie a vzostup kontrakčnej schopnosti myokardu. Vminulosti predpokladaný efekt hormónov štítnej žľazy na zvyšovanie novotvorby katecholamínov nebol viacerými štúdiami potvrdený. Dnes sa predpokladá, že tyreoidálne hormóny spôsobujú zvýšený počet adrenergných β-receptorov, ako aj zvýšenú citlivosť kardiovaskulárneho systému na katecholamíny [9]. Otázka vzťahu tyreoidálnych hormónov a adrenergného systému však ešte dodnes nie je úplne zodpovedaná [5,6].
Dôsledkom týchto zmien je, že pri hypertyreóze dochádza k skráteniu diastolickej relaxácie a systolickej kontrakcie myokardu, zvýšeniu systolického a minútového objemu a hypertrofii myokardu [13].
Hypertrofia myokardu pri hypertyreóze môže viesť k 30–50% vzostupu hmotnosti srdca. Stav je však plne reverzibilný dosiahnutím eutyreózy [5,10]. Hypertrofia myokardu je dôsledkom jednak vyššie popísaných metabolických zmien, ale aj zvýšením systolickej nálože pri zvýšenom minútovom objeme pri hypertyreóze [1].
Účinky nedostatku hormónov štítnej žľazy na obehový systém – vmyokarde dochádza k zložitým zmenám, z ktorých je najdôležitejší pokles Ca-dependentnej ATP-ázy, pokles mRNA Postihnutie kardiovaskulárneho systému u diabetikov so súèasne prítomnou poruchou funkcie štítnej ¾azy www.vnitrnilekarstvi.cz 1071 pre tento enzým a zníženie citlivosti adrenergných receptorov. Dôsledkom týchto a ďalších zmien je predĺženie diastolickej relaxácie a zníženie systolického a minútového objemu [1].
V tab. 3 sú zhrnuté možné molekulárne aspekty vplyvu hormónov štítnej žľazy na myokard [8].
Tab. 3. Možné molekulárne aspekty vplyvu hormónov štítnej žľazy na myokard. 
3. Zmeny periférnej cirkulácie a energetického metabolizmu. Tyreoidálne hormóny ovplyvňujú cievny systém zvýšením spotreby kyslíka, poklesom arteriálnej rezistencie a vzostupom venózneho návratu. Pri hypertyreóze je zvýšená spotreba kyslíka v periférnych tkanivách, dochádza k akcelerácii bunkového metabolizmu, a tým k zvýšeným nárokom na krvné zásobenie tkanivami, a teda aj k zvýšenému srdcovému výkonu [11].
V tab. 4 sú uvedené základné hemodynamické zmeny pri hypotyreóze a hypertyreóze [12].
Tab. 4. Základné hemodynamické zmeny pri hypotyróze a hypertyreóze. 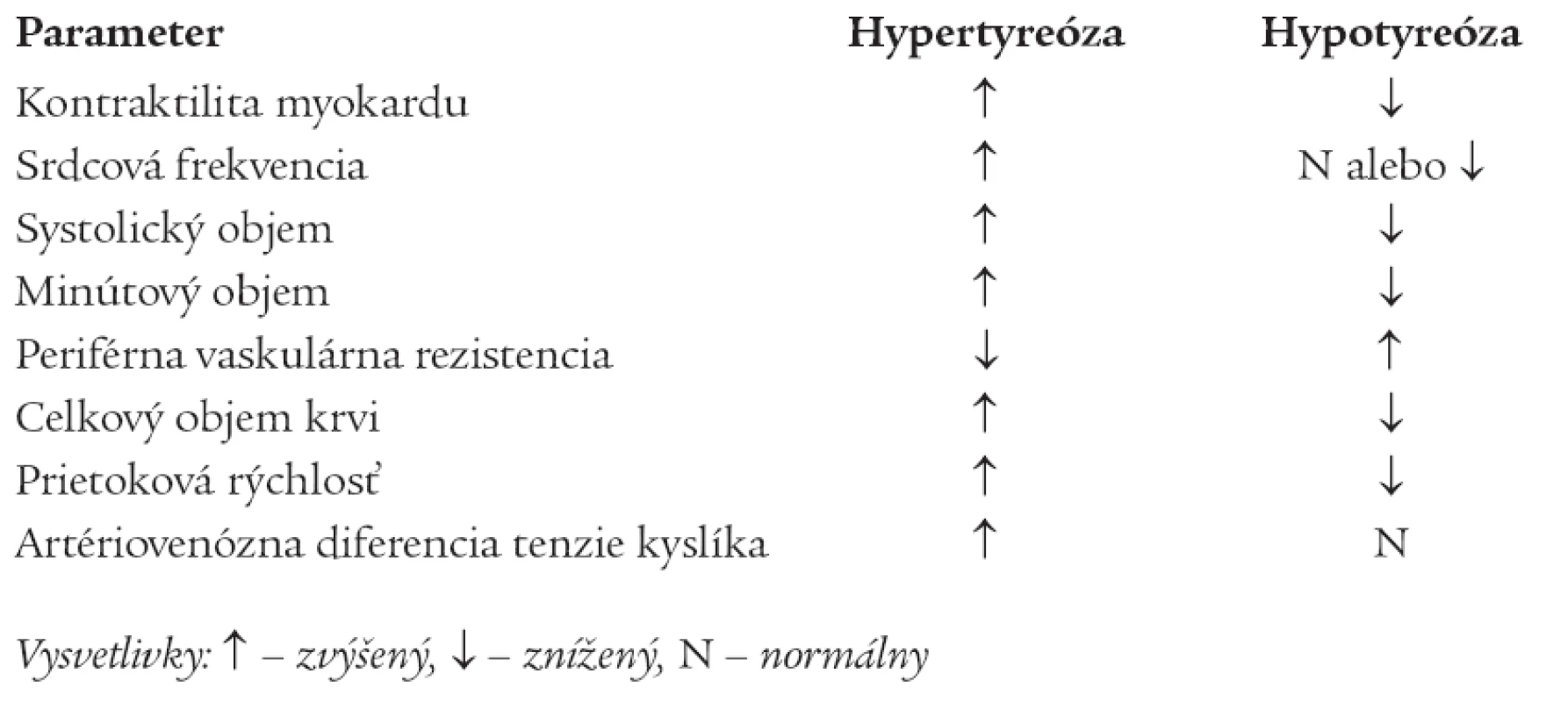
Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou hypotyreózou
Klinické prejavy postihnutia kardiovaskulárneho systému u diabetikov so súčasne prítomnou hypotyreózou
Pôsobenie hypotyreózy na kardiovaskulárny systém u pacientov s DM má dva základné aspekty. Tým, že sa znižuje bazálny metabolizmus v celom organizme, znižujú sa aj nároky na kardiovaskulárny systém. To znamená, že niektoré prejavy kardiovaskulárnych ochorení sa pri hypotyreóze manifestujú neskôr než v eutyreóze. Platí to napr. pre vznik anginóznych bolestí pri ischemickej chorobe srdca (ICHS), alebo ako dekompenzácia rôznych srdcových vád a porúch. Preto sa v minulosti ojedinele doporučovalo u chorých s neovplyvniteľnými obehovými poruchami vyvolanie hypotyreózy k zmierneniu prejavov týchto chorôb.
Druhým aspektom pôsobenia hypotyreózy na kardiovaskulárny systém je jej aterogénny vplyv [1]. Hypotyreóza u diabetikov urýchľuje rozvoj dlhodobých predovšetkým makroangiopatických komplikácií [14]. Makroangiopatické (kardiovaskulárne) komplikácie sa vyskytujú pri DM 1. typu, ale prednostne u diabetikov 2. typu. Diabetická makroangiopatia je súhrnné označenie pre aterosklerotické prejavy na veľkých a stredných, elastických a muskulárnych tepnách diabetikov. V klinickom obraze diabetickej makroangiopatie prevládajú postihnutia koronárnych ciev (ICHS), mozgových ciev (cievna mozgová príhoda) a končatinových ciev (ischemická choroba dolných končatín), aj keď ateroskleróza je lokalizovaná aj v iných častiach cievneho riečiska, ako sú renálne tepny (renovaskulárna hypertenzia) amezenterické tepny (abdominálna angína, vaskulárny ileus) [15].
V súčasnosti sú aterosklerózou podmienené kardiovaskulárne ochorenia hlavne ICHS a cievne mozgové príhody (CMP) hlavnou príčinou zvýšenej morbidity a mortality takmer vo všetkých vyspelých krajinách sveta, ale aj na Slovensku [16]. Diabetici majú dvojnásobne až štvornásobne zvýšenú morbiditu a mortalitu na aterosklerózou podmienené kardiovaskulárne ochorenia v porovnaní s rovnako starými jedincami bez diabetu a KV ochorenia predstavujú až v 80 % príčinu smrti u diabetikov. Viac ako 50 % diabetikov 2. typu má známu ICHS už v čase zistenia diagnózy diabetu. Diabetici bez klinických prejavov aterosklerózy majú rovnaké kardiovaskulárne riziko ako nediabetici s klinickými prejavmi aterosklerózy. Z toho dôvodu je diabetes označovaný ako ekvivalent aterosklerózy, a teda diabetici aj bez makrovaskulárnych ochorení sú považovaní za cieľovú skupinu sekundárnej prevencie [16,17]. Napr. v slovenskom detekčnom programe vaskulárnych komplikácií diabetu bol zistený výskyt kardiovaskulárnych ochorení u 27,8 % z 3 424 novozistených diabetikov 2. typu [18].
Zmeny metabolizmu lipidov a hladín lipidových frakcií v plazme jednoznačne podporujú rozvoj aterosklerózy nielen v experimentoch, ale v súčasnosti existujú už jednoznačné dôkazy, že aj ľahká hypotyreóza má nepriaznivý vplyv na rozvoj aterosklerózy u človeka [1]. Hak et al v svojej práci dokázali, že už subklinická hypotyreóza negatívne ovplyvňuje lipidový metabolizmus a je nezávislým rizikovým faktorom pre vznik infarktu myokardu [19]. Tento vplyv je u diabetikov závažnejší než u nediabetikov, obzvlášť vo vyššom veku. Bakker et al vo svojej práci našli pozitívnu asociáciu medzi tyreostimulačným hormónom (TSH) a LDL-cholesterolom u jedincov s inzulínovou rezistenciou. Teda TSH postihuje tento dôležitý kardiovaskulárny rizikový faktor, akým nesporne LDL-cholesterol je, ešte viac u pacientov, ktorí pre súčasne prítomnú inzulínovú rezistenciu už majú vysoké kardiovaskulárne riziko. Podľa autorov vysokorizikoví pacienti s inzulínovou rezistenciou by mali byť liečení hormónmi štítnej žľazy už vo fáze subklinickej hypotyreózy s cieľom dosiahnuť TSH na dolnej hranici fyziologického rozmedzia [20]. Lien et al vo svojej práci dokázali pozitívnu koreláciu medzi zvýšenými hodnotami TSH a homocysteínu [21]. Význam lipidov pre rozvoj aterosklerózy je dnes nespochybniteľný. Dyslipoproteinémie (vysoký LDL-cholesterol, nízky HDL-cholesterol, vysoké triacylglyceroly, prípadne kombinácia týchto faktorov) zaujímajú významné miesto medzi tzv. ovplyvniteľnými rizikovými faktormi aterosklerózy. Je dokázané, že vzostup LDL-cholesterolu o 1 % spôsobuje vzostup incidencie ICHS o 2 % [22]. Z tohto hľadiska je teda vyvolanie hypotyreózy u kardiakov z dlhodobých aspektov nevýhodné.
Hypotyreóza je jedným z klasických zástupcov sekundárnych dyslipoproteinémií (DLP). Incidencia manifestnej hypotyreózy u pacientov s celkovým cholesterolom viac ako 8 mmol/l sa pohybuje okolo 4 %. Subklinická hypotyreóza sa zisťuje až u 20 % žien starších ako 40 rokov s celkovým cholesterolom viac ako 8 mmol/l. Tyroxín zasahuje do metabolizmu plazmatických lipidov komplexne. Zvyšuje aktivitu lipoproteínovej lipázy a tým zrýchľuje clearance na triacylglyceroly bohatých častíc z plazmy. Tyroxín zvyšuje tiež biosyntézu LDL receptorov v hepatocytoch a zvyšuje biliárnu exkréciu cholesterolu do žlče. Znižuje transfer esterov cholesterolu z častíc HDL do ostatných lipoproteínov. V dôsledku zníženého účinku tyroxínu nachádzame pri hypotyreóze predovšetkým zvýšené hladiny LDL-cholesterolu v plazme, hodnoty triacylglycerolov sú tiež často zvýšené, je určitá tendencia k zvyšovaniu HDL, ktorá však nie je výrazná. Podľa staršej Fredericksonovej klasifikácie dyslipoproteinémií nachádzame pri hypotyreóze najčastejšie typ IIa, ale môže sa vyskytnúť aj typ IIb. Nasadenie hypolipidemickej liečby pacientovi so sekundárnou DLP následkom hypotyreózy je veľmi rizikové z hľadiska zhoršenia myopatie, ktorá môže byť súčasťou klinického obrazu manifestnej hypotyerózy, až do štádia ireverzibilného svalového poškodenia [23,24].
Aj DM 1. a 2. typu vedú k alterácii metabolizmu lipidov a lipoproteínov. DLP pri DM 1. typu je sekundárna, indukovaná je nedostatočnou kompenzáciou alebo dekompenzáciou DM 1. typu. Pre DM 1. typu je charakteristický tesný vzťah medzi kompenzáciou a zmenami koncentrácie (najmä) triacylglycerolov (TAG) a cholesterolu. Patogenéza DLP pri DM 2. typu je iná, jej zaradenie medzi sekundárne DLP je diskutabilné. Charakterizuje ju inzulínová rezistencia spojená s hyperinzulinémiou a obezitou. Pre diabetickú (inzulinorezistentnú) DLP je typické zvýšenie TAG, zníženie HDL-cholesterolu a prítomnosť malých denzných LDL častíc. Pri dekompenzácii DM 2. typu sa koncentrácie lipidov zvyšujú, ale často ani veľmi dobrá kompenzácia nevedie k absolútnej normalizácii lipidového spektra. Aj zhoršenie diabetickej mikroalbuminúrie vedie k zvýšeniu koncentrácie TAG, pri zachovaní dobrej kompenzácie DM 2. typu. Diabetická DLP je často súčasťou prítomného metabolického syndrómu [25,26].
Hypotyreózna kardiomyopatia spolu s často prítomným perikardiálnym výpotkom vedú k obrazu tzv. „myxedémového srdca“. Vzhľadom k vyššie spomínanému urýchleniu rozvoja aterosklerotických cievnych zmien pri hypotyreóze sa často nakoniec ischemická choroba srdca a myxedémová kardiomyopatia vzájomne kombinujú [27].
Situáciu ohľadom ochorení srdca u diabetikov so súčasne prítomnou hypotyreózou (ale aj hypertyreózou) môže ďalej komplikovať tiež tzv. diabetická kardiomyopatia (KMP). Diabetická KMP sa vyskytuje pri DM 1. aj DM 2. typu. Jedná sa o špecifické postihnutie myokardu. Aby sme mohli hovoriť o diabetickej KMP, vyžaduje sa negatívna koronarografia, rovnako nie sú prítomné zmeny mikrocirkulácie potvrdené biopticky. Príčinou diabetickej KMP teda nie je ICHS ani choroba malých ciev. Histologicky je prítomná instersticiálna fibróza a arteriolárna hyalinizácia. Príčinou diabetickej KMP je pravdepodobne nadmerná glykácia mezenchýmových buniek stromatu v myokarde, čo vedie k zmene syntézy bielkovín a poruche diastolickej funkcie ľavej komory. Jej hemodynamickou charakteristikou je zníženie komorovej poddajnosti pri normálnej veľkosti ľavej komory. Neskôr sa pridruží systolická dysfunkcia amôže dôjsť k dilatácii ľavej komory (ĽK). Abnormality funkcie ĽK odhalíme pomocou echokardiografie (Echokg), kde zistíme poruchu diastolickej funkcie ĽK. Echokg vyšetrenie, negatívny koronarografický nález u pacienta s opakovaným srdcovým zlyhaním podporuje túto diagnózu. Väčšinou sa však diabetická KMP kombinuje s ICHS, čím pravdepodobne možno čiastočne vysvetliť aj to, že u diabetikov srdcové zlyhanie vzniká skôr a má ťažší klinický priebeh [2].
Z obehových príznakov je u diabetikov s hypotyreózou častá bradykardia, zisťuje sa spomalený pulz. Znížená činnosť štítnej žľazy býva sprevádzaná znížením srdcového výdaja v pokoji a poklesom srdcovej frekvencie, čo môže u časti pacientov viesť k vzostupu diastolického krvného tlaku. Na vzostupe diastolického krvného tlaku sa spolupodieľa aj retencia tekutín pri hypotyreóze, spolu so zvýšením rezistencie vaskulárneho systému. Hypertenzia okrem DLP môže tiež prispievať k akcelerácii aterosklerotických zmien u diabetikov so súčasne prítomnou hypotyreózou [3]. U známych hypertonikov vedie súčasne prítomná hypotyreóza často k zvýšeniu krvného tlaku, ktorý sa môže vrátiť k pôvodným hodnotám po kompenzácii hypotyreózy [1,28]. Pri vzniku zvýšeného diastolického tlaku pri hypotyreóze sa zrejme tiež uplatňujú aj zvýšené hladiny katecholamínov, hlavne noradrenalínu, v cievnom riečisku [29].
Liečba postihnutia kardiovaskulárneho systému u diabetikov so súčasne prítomnou hypotyreózou
U diabetikov s hypotyreózou, so súčasným postihnutím kardiovaskulárneho systému, predovšetkým s prítomnou ischemickou chorobou srdca, zahajujeme substitúciu hormónmi štítnej žľazy veľmi opatrne, inak hrozí riziko výrazného zhoršenia prejavov ICHS, dokonca k vzniku akútneho infarktu myokardu. Obvykle začíname s dávkou 25 μg tyroxínu denne, niekedy len ob deň. Dávku zvyšujeme po 4–6 týždňoch o 25 μg. Plnú kompenzáciu dosahujeme až za niekoľko mesiacov. Chorého sledujeme klinicky, kontrolujeme okrem TSH, hormónov štítnej žľazy, reflexu Achillovej šľachy tiež elektrokardiogram (EKG). Niekedy však pri závažnom postihnutí kardiovaskulárneho systému nie je možné zvyšovať dávku tyroxínu a preto sme nútení sa zastaviť na rozhraní hypotyreózy a eutyreózy [1,27].
Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou hypertyreózou
Klinické prejavy postihnutia kardiovaskulárneho systému u diabetikov so súčasne prítomnou hypertyreózou
Na rozdiel od hypotyreózy, kde poruchy obehového systému nebývajú v popredí klinického obrazu, pri hypertyreóze patria naopak k najnápadnejším. Väčšina pacientov so zvýšenou činnosťou štítnej žľazy udáva palpitácie, často pocit nepravidelnej činnosti srdca, neskôr môže byť prítomná aj námahová dušnosť. Hypertyreóza môže tiež navodiť zhoršenie preexistujúceho kardiálneho ochorenia. U diabetikov so súčasne častou prítomnou ischemickou chorobou srdca môže hypertyreóza zhoršiť anginózny syndróm. Vzácne môže byť prvým klinickým prejavom hypertyreózy akútny infarkt myokardu [30]. Je to zrejme dôsledok zvýšenej práce myokardu navodenej hypertyreózou. U mladších diabetikov, a to predovšetkým dievčat a žien s DM 1. typu, je najčastejšou príčinou hypertyreózy Graves-Basedowova choroba. Táto je obzvlášť obávanou komplikáciou v popôrodnom období. U mladších diabetikov sú zvyčajne prítomné plne rozvinuté príznaky tyreotoxikózy. U starších diabetikov tyreotoxikózy mávajú často neautoimunitný pôvod. Tu sa obvykle stretávame s oligosymptomatickým priebehom hypertyreózy. Môže sa prejavovať iba subkompenzáciou diabetu a často len kardiovaskulárnou symptomatológiou (napr. fibriláciou predsiení, obehovou nedostatočnosťou). Už subklinická hypertyreóza u pacientov s DM môže stimulovať kardiálnu funkciu a zvyšovať riziko fibrilácie predsiení [31].
Veľmi častým sprievodným javom pri hypertyreóze sú rôzne poruchy rytmu. Pozitívny chronotropný účinok tyreoidálnych hormónov spôsobuje skrátenie akčného potenciálu a refraktérnej periódy. Okrem toho hormóny štítnej žľazy urýchľujú vedenie vzruchov. Priamy chronotropný efekt je zrejme spôsobený sarkolémovým nátriovým transportom a kalciovým influxom. Zvyšuje sa tvorba vzruchov v sinoatriálnom uzle, klesá prah elektrickej excitácie a skracuje sa refraktérna perióda vodivého tkaniva [5,6]. Srdcová frekvencia je zvýšená počas celého dňa a pretrváva aj v noci. Cirkadiánna rytmicita však zostáva zachovaná [6,32]. Na zvýšenej dráždivosti myokardu sa tiež podieľa aj zvýšená citlivosť adrenergných receptorov, čo vysvetľuje aj priaznivé účinky betablokátorov. Situáciu u hypertyreóznych diabetikov môže komplikovať často prítomná kardiovaskulárna autonómna neuropatia (KAN), ktorá sa vyskytuje až u približne 30 % zo všetkých diabetikov. Pre KAN je typická strata variability srdcovej frekvencie, tachykardia prítomná aj v kľude, predĺženie QT intervalu na EKG, ortostatická hypotenzia. KAN prispieva k zlej prognóze ICHS u diabetikov 2. typu, pri ťažkom stupni poškodenia môže spôsobiť totálnu kardiálnu denerváciu. Pacienti s KAN majú znížené prežívanie s vysokým rizikom náhlej smrti nielen u pacientov s ICHS, ale aj u pacientov bez ICHS [2].
Najčastejšou dysrytmiou, ktorá sa vyskytuje u pacientov s hypertyreózou, je fibrilácia predsiení. Jej výskyt u pacientov s hypertyreózou sa podľa rôznych autorov udáva v rozmedzí 9–22 % [13], či už ako paroxyzmálna alebo perzistujúca porucha rytmu. Riziko vzniku fibrilácie predsiení stúpa s vekom. U pacientov mladších ako 40 rokov je zriedkavá, ale jej výskyt u pacientov nad 60 rokov je až okolo 25 %. Častejšie sa vyskytuje u mužov a u pacientov s tzv. T3 toxikózou (vysoké T3 pri relatívne nízkom T4). Častejšia je u pacientov s autonómnymi uzlami (až 43 %) než u pacientov s autoimunitne podmienenou hypertyreózou (10 %), naopak, hypertyreóza býva asi v 10–15 % prípadov príčinou novovzniknutej fibrilácie predsiení [5]. Frekvenciu výskytu tejto dysrytmie je u pacientov s hypertyreózou problematické všeobecne kvantifikovať pre rozdielnosť spracovania získaných výsledkov rôznymi autormi [13].
Riziko trombembólie, predovšetkým cerebrálnej, je u pacientov s hypertyreózou a fibriláciou predsiení v porovnaní s pacientmi s hypertyreózou, ktorí mali sínusový rytmus, vyššie. Výskyt náhlych cievnych mozgových príhod, tranzitórnych ischemických aták počas tyreotoxikózy sa udáva od 6–25 % [33]. Príčina prítomnosti hyperkoagulačného stavu pri hypertyreóze nie je známa, potvrdila sa zvýšená koncentrácia faktora VIII a zníženie koncentrácie K-vitamín dependentných zrážacích faktorov. Nepotvrdila sa predpokladaná abnormálna aktivita krvných doštičiek [13].
V mladšom veku sa častejšie stretávame s extrasystolami, obvykle supraventrikulárnymi.
Častá tiež býva sinusová tachykardia, ktorú zisťujeme až u 40 % pacientov. Z intraventrikulárnych porúch vedenia vzruchov sa častejšie stretávame s blokádou pravého Tawarovho ramienka, ktoré sa pozorovalo asi u 15 % pacientov s hypertyreózou bez preexistujúceho kardiálneho ochorenia. Biagini et al vyšetrovali metabolizmus tyreoidálnych hormónov u eutyreóznych pacientov s a bez komorovej extrasystólie. Zistili, že v skupine pacientov s komorovu extrasystóliou je prítomná vyššia konverzia T4 na T3, znížená produkcia T4 a väčšia dostupnosť T3 pre srdcové metabolické pochody. Na základe zistených výsledkov autori postulujú, že zmeny v kinetike a metabolizme hormónov štítnej žľazy môžu zohrávať dôležitú úlohu v patogenéze komorovej extrasystólie [5].
Channick v roku 1981 prvýkrát popísal koreláciu medzi hypertyreózou a prolapsom mitrálnej chlopne. Prolaps mitrálnej chlopne nachádzame u pacientov s autoimunitne podmienenou hypertyreózou (Graves - Basedowova choroba) častejšie ako u zdravých a ostatných foriem hypertyreózy [8].
Na hypertyreózu ako možnú príčinu kardiálneho postihnutia by sme mali vždy myslieť pri fibrilácii predsiení nejasnej genézy, nevysvetliteľnom zhoršení angíny pectoris a nevysvetliteľnej progresii kardiálneho zlyhania.
Liečba postihnutia kardiovaskulárneho systému u diabetikov so súčasne prítomnou hypertyreózou
Rýchle ovplyvnenie hypertyreózy u diabetikov pomocou antityreoidálnych liekov predstavuje základ úspešného zvládnutia kardiovaskulárneho postihnutia a predpoklad správneho definitívneho liečenia. Vždy sa v liečbe uplatňujú tyreostatiká. Nasadzujeme vysoké dávky tyreostatík. Vzhľadom aj k tomu, že hypertyreózou poškodené srdce sa často vyskytuje u starších ľudí s autonómnym uzlom, býva stav väčšinou definitívne riešený operačne alebo rádiojódom. Z pohľadu prevencie kardiálnych komplikácií je definitívne chirurgické odstránenie štítnej žľazy najvhodnejšie. Pri liečbe floridnej tyreotoxikózy možno v liečbe použiť aj anorganický jodid, ktorý rýchlo inhibuje sekréciu T4 a T3. Je nutné pred podaním anorganického jodidu začať liečbu tyreostatikami. Podaniu anorganického jodidu sa vyhýbame u pacientov s hypertyreózou, ktorí majú už prítomné závažné kongestívne zlyhanie srdca, fibriláciu predsiení s rýchlou odpoveďou komôr alebo instabilnú angínu pektoris [5,13]. V súčasnosti sa však pred podávaním jódu (aj pri liečbe floridnej tyreotoxikózy) preferuje parenterálne podávanie tyreostatík s dosiahnutím rýchleho účinku. Betablokátory sú automatickou súčasťou liečby hypertyreózy u diabetikov so súčasne prítomnou kardiálnou manifestáciou. Betablokátory účinne blokujú prenos signálov na β-adrenergných receptoroch, aj keď pomocou nich neovplyvníme vyvolávajúcu príčinu hypertyreózy. Vzhľadom na zvýšený plazmatický clearance je potrebná vyššia dávka betablokátora. Ideálne je použitie, ak nie sú prítomné kontraindikácie ich podania, neselektívnych betablokátorov s malým endogénnym stimulačným účinkom, ako je napr. trimepranol [7,13]. U pacientov, kde je podanie betablokátorov kontraindikované, môžeme podať blokátory kalciových kanálov (BKK).
Pri prejavoch zlyhávania srdca, hlavne ak je spojené s fibriláciou predsiení s rýchlou odpoveďou na komory, indikujeme liečbu digoxínom. Digoxín účinne spomalí rýchlu frekvenciu komôr. Niektorí pacienti vyžadujú vysoké dávky digoxínu. Príčinou relatívnej rezistencie na bežné dávky digoxínu je možné vysvetliť zvýšením plazmatického clearance a potrebou inhibovať väčšie množstvo jednotiek nátriového transportu v myokarde. V liečbe sa samozrejme uplatňujú aj ostatné terapeutické postupy ako pri kardiálnom zlyhaní.
Terapia fibrilácie predsiení u hypertyreóznych diabetikov spočíva len v kontrolovaní komorovej frekvencie. Spontánnu úpravu na sínusový rytmus možno očakávať asi do 6 týždňov po obnovení normofunkcie štítnej žľazy u pacientov do 60 rokov veku a bez preexistujúceho ochorenia srdca [34]. Pacienti s hypertyreózou a fibriláciou predsiení majú aj po dosiahnutí eutyreózy a verzii na sínusový rytmus vyššie riziko výskytu opätovnej fibrilácie predsiení. Asi u 50 % pacientov so súčasným výskytom hypertyreózy a angíny pectoris dôjde po liečbe hypertyreózy k vymiznutiu stenokardií [5].
Ovplyvnenie rizika možnej arteriálnej trombembólie u diabetikov s hypertyreózou a fibriláciou predsiení pomocou antikoagulancií je potrebné vždy individuálne zvažovať pri zohľadnení veku pacienta, kardiálneho postihnutia a ostatných chorôb. Vzhľadom k zníženej koncentrácii K-dependentných zrážacích faktorov pri hypertyreóze je odporúčaná dávka warfarinu nižšia. Ak sa dosiahne eutyreóza, je nutné zvýšenie dávky warfarinu na udržanie protrombínového času v terapeutickom rozmedzí [13].
Diabetici sú často liečení pre rôzne poruchy srdcového rytmu antiarytmikom amiodaronom. V klinickej praxi treba myslieť na pomerne častý nepriaznivý vplyv amiodaronu na štítnu žľazu. Veľmi obávanou komplikáciou pri liečbe amiodaronom je predovšetkým tzv. amiodaronová tyreotoxikóza, ktorá môže až ohroziť život pacienta. Rozlišujeme dva typy tyreotoxikózy po amiodarone. I. typ sa objavuje u pacientov už s predtým poškodenou štítnou žľazou. II. typ sa vyskytuje u pacientov s predtým neporušenou štítnou žľazou. Tento typ je vyvolaný vyplavovaním tyreoidálnych hormónov z deštruovanej štítnej žľazy. Pred nasadením amiodaronu u pacienta je vždy nutné pátrať po rizikových faktoroch (tyreopatie v rodinnej aj v osobnej anamnéze, struma). Liečba amiodarónovej tyreotoxikózy je veľmi ťažká a vyžaduje úzku spoluprácu diabetológa, kardiológa a endokrinológa. Pri tyreotoxikóze I. typu je základom tyreostatická liečba. Je pritom však nutné preklenúť pomerne dlhé obdobie (2–4 mesiace) do nástupu účinku liečby. V prípade, ak sa pri konzervatívnej liečbe stav zhoršuje, je indikovaná chirurgická liečba – najčastejšie totálna tyreoidektómia. Tu je však najväčším problémom adekvátna príprava pacienta k operácii. Samo kardiovaskulárne ochorenie, pre ktoré je amiodaron pacientovi indikovaný, zvyšuje celkové riziko, stav je tiež zhoršovaný floridnou tyreotoxikózou a možnou instabilitou diabetu. Pri tyreotoxikóze II. typu sa za najúčinnejšiu liečbu považuje podávanie glukokortikoidov v stredných až vyšších dávkach [35].
MUDr. Zbynek Schroner, Ph.D.
e-mail: zbynek.schroner@pobox.sk
Doručeno do redakce: 12. 5. 2006
Přijato po recenzi: 20. 7. 2006
Zdroje
1. Zamrazil V, Váňa S, Němec J. Štítná žláza a kardiovaskulárny systém. In: Stárka L et al. Aktuální endokrinologie. Praha: Maxdorf 1999 : 468–477.
2. Belicová M, Smatanová S, Lilgová M et al. Diabetes mellitus a srdce. Diabetes a obezita 2003; 3 : 8–16.
3. Klein I, Ojama K Cardiovascular manifestations of endocrine diseases. J Clin Endocrin Metab 1992; 75 : 339–342.
4. Běhanová M, Nedvídková J. Periférní účinky tyreoidálních hormonu. In: Stárka L et al. Aktuální endokrinologie. Praha: Maxdorf 1999 : 283–295.
5. Payer J. Kardiálne prejavy hypertyreózy. Kardiológia 1997; 6 : 71–74.
6. Polikar R, Burger AG, Scherrer U et al. The thyroid and the heart. Circulation 1993; 87 : 1435–1441.
7. Klein J, Hong C. Effects of thyroid hormone on cardiac size and myosin content of the heterotypically transplanted rat heart. J Clin Invest 1986; 77 : 1694–1698.
8. Kahaly G, Beyer J. Kardiale beteiligung bei Functionsstorungen der Schilddruse. Dtsch Med Wschr 1991; 116 : 1559–1562.
9. Klein I, Levy GS. New perspectives on thyroid hormone, catecholamines and heart. Am J Med 1984; 76 : 167–172.
10. Forfar J, Caldwell G. Hyperthyroid heart disease. J Clin Endocrin Metab 1985; 14 : 491–508.
11. De Groot WJ, Leonard J. Hyperthyreoidism as a high cardiac output state. Am Heart J 1970; 79 : 265–275.
12. Král J, Hradec J et al. Heart in thyroid diseases. Cor Vasa 1992; 34 : 108–114.
13. Woeber KA Thyrotoxicosis and the heart. N Engl J Med 1992; 327 : 94–98.
14. Vondra K, Zamrazil V. Onemocnění štítné žlázy u nemocných s diabetes mellitus. DMEV 2002; 5 : 78–84.
15. Schroner Z, Pella J. Diabetes mellitus v skratke. Košice: Oriens 2002.
16. Rašlová K, Flipová G, Mikeš Z et al. Odporúčania pre optimálnu diagnostiku a liečbu dyslipoproteinémií u dospelých. Lipidový konsenzus – 2. Interná med 2002; 3 : 10–18.
17. Tkáč I Možnosti prevencie aterosklerózy pri diabetes mellitus 2. typu. Interná Med 2003; 3 : 149–153.
18. Krahulec B. Inzulínová rezistencia a kardiovaskulárne následky – významaná úloha endotelovej dysfunkcie. Diabetes a obezita 2003; 3 : 9–15.
19. Hak AE, Pols HAP et al. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: The Rotterdam Study. Ann Int Med 2000; 132 : 270–278.
20. Bakker SJL, Maaten JC, Popp-Snijders C et al. The relationship between thyrotropin and low density lipoprotein cholesterol is modified by insulin sensitivity in healthy euthyroid subjects. J Clin Endocrinol Metab 2001; 86 : 1206–1211.
21. Lien EA, Nedrebo BG, Varhaug JE et al. Plasma total homocystein levels during short term iatrogenic hypothyroidism. J Clin Endocrinol Metab 2000; 85 : 1049–1053.
22. Pella D, Rybár R et al. Ateroskleróza a artériová hypertenzia. Interná med 2001; 1 : 86–90.
23. Češka R. Cholesterol a ateroskleróza. Praha: Maxdorf, 1990.
24. Vrablík M, Češka R. Sekundární dyslipoproteinémie. Via Practica 2004; 1 : 14–17.
25. Fabryová Ľ. Manažment kardiovaskulárneho rizika u pacientov s metabolickým syndrómom. Interná Med 2004; 4 : 35–42.
26. Fabryová Ľ. Dyslipoproteinémie. In: Kreze A, Langer P, Klimeš I et al. Všeobecná a klinická endokrinológia. Bratislava: Academic Electronic Press 2004 : 553–567.
27. Límanová Z. Choroby štítné žlázy. In: Klener P et al. Vnitřní lékařství. Praha: Galén 2001 : 763–777.
28. Kiňová S. Endokrinné formy hypertenzie. Interná Med 2004; 4 : 286–290.
29. Vavrejnová V, Nedvídková J et al. Zvýšení hladiny noradrenalinu při hypotyreoze a jeho souvislosti s činností kardiovaskulárního systému. Vnitř Lék 1992; 38 : 1195–1200.
30. Phull PS, Collins CE et al. Variant angina in thyrotoxicosis. Br J Clin P 1993; 47 : 17–19.
31. Němec J, Stárka L Preklinické poruchy tyreoidální funkce. In: Stárka L et al. Aktuální endokrinologie. Praha: Maxdorf 1999 : 392–399.
32. Límanová Z, Němec J, Zamrazil V. Nemoci štítné žlázy. Praha: Galén 1997.
33. Presti CHF, Hart R Thyrotoxicosis, atrial fibrillation and embolism revisited. Am Heart J 1989; 4 : 975–976.
34. Nakazawa HK, Sakuri K et al. Management of atrial fibrillation in the post thyrotoxic state. Am J Med 1982; 72 : 903–906.
35. Zamrazil V, Němec J. Vliv amiodaronu na štítnou žlázu. In: Stárka L et al. Aktuální endokrinologie. Praha: Maxdorf 1999 : 415–424.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 11- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Mým kolegům!
- Pozitronová emisní tomografie v diagnostice vaskulitid velkých cév – jedné z příčin horeček neznámého původu: editorial
- C−reaktivní protein – editorial
- Mitrální regurgitace 2006
- Mužská hormonální antikoncepce – editorial
- Klinické důsledky TRIM (Transfusion related immunomodulation) - editorial
- Riziková medikace a kontrastní látkou indukovaná nefropatie u pacientů s diabetem a hypertenzí
- Pozdní komplikace chronických zánětů respiračního traktu u nemocných s běžnou variabilní imunodeficiencí
- Význam anamnézy v diferenciálnej diagnostike reflexných a kardiogénnych synkopálnych stavov
- 18F-FDG PET v diagnostice vaskulitid velkých cév
- Prevalence hladin C−reaktivního proteinu u dospělé populace dvou regionů České republiky a jejich vztah k tělesnému složení
- Dyslipidemie u nemocných léčených peritoneální dialýzou
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Tako tsubo syndrom - nový přírůstek do rodiny akutních stavů v kardiologii: aktuální sdělení
- Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou poruchou funkcie štítnej žľazy
- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
-
XIII. sjezd České internistické společnosti, Brno, 1.–4. listopadu 2006
Sborník abstrakt k přednáškám
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



