-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dyslipidemie u nemocných léčených peritoneální dialýzou
Dyslipidemia in patients being treated with peritoneal dialysis
Dyslipidemia endangers nephrological patients by its aterogenic effect as well as by the possibility of acceleration of renal damage progression.
The aim of our work was:
1. to determine the influence of peritoneal dialysis (PD) with glucose dialysis solution on concentration of blood lipids during 30 months of treatment. 2. To compare these results with a group of patients on hemodialysis (HD) and in pre-dialysis with creatinine 250 - 400 µmol/l.Methods:
There was estimated the concentration of total cholesterol, LDL-cholesterol, HDL-cholesterol, non-HDL-cholestreol, triglycerides, lipoproteins(a), apolipoprotein A-1 and B, albumin, glucose, HbA1c and CRP. There was investagated 24 patients on PD, 20 patients on HD and 20 patients in predialysis.Results:
In patients on PD there was statistically significant increase of total, non-HDL and LDL-cholesterol, lipoprotein(a) (p < 0.005), triglycerides (p < 0.05) and decrease of HDL-cholesterol (p < 0.005), we observed also significant increase of CRP (p < 0.05) and body mass index BMI (p < 0.05) within 6 months. After 30 months of PD was detected decrease of total cholesterol as well as decrease of triglycerides to the level before commencing PD (p < 0.005). In patients on PD there were significantly higher values of non-HDL-cholesterol, LDL-cholesterol lipoprotein(a), glucose, HbA1c, CRP and BMI in comparison to the group of patients on hemodialysis and patients in pre-dialysis (p < 0,05). HDL-cholesterol has reamind significantly decreased even after 30 months (p < 0.05).Conclusion:
Higher values of lipoprotein(a), LDL-cholesterol and decreased value of HDL-cholesterol in patients on peritoneal dialysis can have a negative influence of the prognosis of these patients comparing to the patients on hemodialysis and in pre-dialysis and may contribute to the high risk for atherosclerosis in ESRD, especially in patient treated by CAPD.Keywords:
peritoneal dialysis - dyslipidemia - lipoprotein(a)
Autoři: A. Zharfbin
Působiště autorů: II. interní klinika Lékařské fakulty MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Miroslav Souček, CSc.
Vyšlo v časopise: Vnitř Lék 2006; 52(11): 1051-1057
Kategorie: Původní práce
Souhrn
Dyslipidemie ohrožuje nefrologické pacienty jednak svým aterogenním působením a jednak tím, že může urychlovat progresi renálního postižení.
Cílem naší práce bylo:
1. zjistit vliv peritoneální dialýzy (PD) se standardním (glukózovým) dialyzačním roztokem na koncentraci krevních lipidů a lipoproteinů v průběhu 30měsíční léčby, 2. porovnat tyto výsledky se souborem pacientů v pravidelném hemodialyzačním programu (HD) a v predialýze (pacientů s plazmatickým kreatininem 250 – 400 µmol/l).Soubor a metodika:
Byla měřena koncentrace celkového cholesterolu, LDL-cholesterolu, HDL-cholesterolu, non-HDL-cholesterolu, triglyceridů, lipoproteinu(a), apolipoproteinu A-1 a B, albuminu, glukózy, glykovaného hemoglobinu (HbA1c) a C-reaktivního proteinu (CRP). Bylo vyšetřeno 24 pacientů v PD, 20 pacientů v HD programu a 20 pacientů v predialýze.Výsledky:
U pacientů na PD se během 6 měsíců statisticky významně zvýšil celkový cholesterol, non-HDL-cholesterol a LDL-cholesterol, lipoprotein(a) (p < 0,005), triglyceridy (p < 0,05), snížil HDL-cholesterol (p < 0,005) a signifikantně také zvýšil CRP (p < 0,05) a body mass index (BMI) (p < 0,05). Po 30 měsících PD byl zjištěn pokles celkového cholesterolu a triglyceridů na hodnoty, jež měli pacienti před zahájením PD (p < 0,005). U pacientů na PD zůstal signifikantně vyšší non-HDL-cholesterol, LDL-cholesterol, lipoprotein(a) (p < 0,005). Došlo k signifikantnímu zvýšení glykemie, HbA1c, CRP a BMI po 30 měsících ve srovnání se souborem nemocných na HD a v predialýze (p < 0,05). HDL-cholesterol zůstal signifikantně nižší i po 30 měsících sledování (p < 0,005).Závěr:
Vyšší hodnoty lipoproteinu(a), LDL-cholesterolu a nižší hodnoty HDL-cholesterolu u pacientů na PD oproti pacientům na HD a v predialýze mohou nepříznivě ovlivnit další prognózu těchto nemocných.Klíčová slova:
peritoneální dialýza - dyslipidemie - lipoprotein(a)Úvod
Dyslipidemie je rizikovým faktorem pro vznik aterosklerózy a rozvoj kardiovaskulárních komplikací a může být příčinou předčasného vzniku ischemické choroby srdeční. Na rozvoji dyslipidemie se většinou podílí vlivy genetické a vlivy zevního prostředí. K tomu se mohou připojit i vlivy jiných onemocnění (sekundární dyslipidemie), které pak potencují vlivy genetické. Sekundární dyslipidemie sama o sobě může být pro nemocného závažné onemocnění, vyžadující adekvátní léčbu. K sekundárním dyslipidemiím patří i dyslipidemie nemocných s chorobami ledvin: dyslipidemie u nefrotického syndromu, u chronického selhání ledvin a u pacientů léčených dialyzačními metodami, jak hemodialýzou, tak peritoneální dialýzou a u nemocných po transplantaci ledvin [19]. U pacientů s chronickou renální insuficiencí bývá často zvýšena koncentrace triglyceridů, lipoproteinů VLDL, IDL a LDL, často dochází k poklesu HDL-cholesterolu a zvyšuje se koncentrace lipoproteinu(a) - Lp(a). Podobné změny lze nalézt také u nemocných v chronickém dialyzačním programu, tj. při hemodialýze a peritoneální dialýze.
Nemocní léčení jakoukoliv formou dialýzy mají zvýšené riziko vzniku aterosklerózy. Kardiovaskulární komplikace (ischemická choroba srdeční, infarkt myokardu, cévní mozková příhoda) jsou hlavními příčinami jejich úmrtí. Hypertriglyceridemie a vyšší Lp(a) jsou rovněž rizikovými faktory aterosklerózy [8]. Dyslipidemie u uremických pacientů pravděpodobně přispívá k vaskulárním komplikacím.
Soubor nemocných a metodika
Celkem bylo vyšetřeno 64 nemocných, z toho 24 léčených peritoneální dialýzou (PD; 19 léčených kontinuální ambulantní peritoneální dialýzou - CAPD a 5 léčených automatickou peritoneální dialýzou - APD). Kontrolní skupinou bylo 20 pacientů léčených hemodialýzou (HD) a 20 pacientů s chronickou renální insuficiencí v predialýze. V průběhu sledování 4 nemocní ze skupiny PD vypadli (2 zemřeli a 2 byli transplantováni) a z skupiny HD 1 pacient byl transplantován ke konci sledování. Charakteristiku souboru pacientů ukazuje tab. 1. Délka dialýzy byla u PD a HD pacientů obdobná, průměrná doba dialýzy byla 36 měsíců. Průměrný věk byl vyšší o 3,5 roku ve skupině HD a o 4,7 roku ve skupině predialýzy oproti souboru pacientů v PD. Celkem 39,4 ± 11 % nemocných bylo léčeno fluvastatinem již před zařazením do sledování. Pacienti, kteří užívali jiné statiny před zařazením do sledování, byli převedeni na fluvastatin již 45 ± 15 dnů před 1. odběrem. Pacienti užívali Lescol 40 mg, resp. Lescol XL 80 mg. Po dobu sledování nebyla dávka hypolipidemik měněna a ostatním nebyla hypolipidemika podávána. U 2 pacientů ze skupiny PD byl fluvastatin vysazen pro nežádoucí účinky. Ze skupiny predialýzy 3 pacienti užívali fluvastatin nepravidelně a vynechávali dávky.
Charakteristiky jednotlivých skupin pacientů jsou uvedeny v tab. 1.
Tab. 1. Charakteristika jednotlivých skupin pacientů. 
Naši nemocní nebyli léčeni Nutrinealem, tj. roztokem s obsahem směsi aminokyselin 1,1 %. Celkem 95 % našich pacientů používalo standardní dialyzační roztoky na bázi glukózy s koncentrací 1,36 %. Zbývajících 5 % pacientů mělo jednu prodlevu pomocí Icodextrinu, tj. 7,5% polymeru glukózy, v průběhu 30měsíců léčby. Pouze 3 z nich použili při noční výměně 2,3% roztok glukózy. Během sledování jsme zaznamenali u 3 pacientů z PD výskyt akutní peritonitidy.
Do sledování nebyli zařazeni pacienti léčení glukokortikoidy a jinými imunosupresivy a pacienti s proteinurií přes 3 g/24 hod, protože nefrotický syndrom sám o sobě vyvolává poruchu lipidového metabolizmu. Základní onemocnění, která vedla k selhání ledvin u nemocných léčených PD a v kontrolních skupinách, jsou uvedena v tab. 2.
Tab. 2. Přehled základních onemocnění. 
Žilní krev k laboratornímu vyšetření byla odebírána po 12hodinovém lačnění, u pacientů léčených HD vždy před zahájením dialyzační procedury. U nemocných léčených PD a HD bylo provedeno vyšetření před zařazením do dialyzační léčby, 6 měsíců a 30 měsíců po zařazení do PD, eventuálně HD. U pacientů v predialyzačním období bylo provedeno vyšetření před vstupem do sledování a dále pak v odstupu 6 a 30 měsíců.
Nikdo z pacientů nebyl vyšetřen při akutní infekci nebo za akutního pooperačního stavu.
Ve všech vzorcích byla provedena tato laboratorní vyšetření: celkový cholesterol - T-C, HDL-cholesterol - HDL-C), triglyceridy - TG, apolipoprotein A-1 - Apo-A1, apolipoprotein B - Apo B, lipoprotein(a) - Lp(a). Vypočteny byly tyto parametry: LDL-cholesterol (LDL-C), poměr T-C/HDL-C, non-HDL-C. Dále byla měřena glykemie, glykovaný hemoglobin (HbA1c), albumin, C-reaktivní protein (CRP) a byl stanoven body mass index (BMI). Koncentrace TC, TG, HDL-C byla stanovena enzymovými metodami na automatickém analyzátoru ADVIA 1650. Koncentrace apoA-1, apo B, Lp(a) a CRP byla měřená imunoturbidimetricky, albumin fotometricky (vše analyzátor ADVIA 1650). Koncentrace LDL-cholesterolu byla vypočtena dle Friedewaldovy rovnice. HbA1c byl stanoven metodou vysokotlaké kapalinové chromatografie (analyzátor TOSOH).
Pro srovnání hodnocených parametrů mezi skupinami PD, HD a predialýzy byl použit neparametrický nepárový Mannův-Whitneyův U-test. Pro srovnání parametrů před vstupem do PD, HD a po 6 měsících a po 30 měsících byl použit neparametrický párový Wilcoxonův test. Data byla hodnocena na hladině významnosti α = 5 %.
Výsledky
Výchozí hodnoty měřených laboratorních parametrů před zařazením do PD, HD a predialýzy před vstupem do sledování jsou uvedeny v tab. 3.
Tab. 3. Výchozí hodnoty měřených laboratorních parametrů před zařazením do PD, HD a predialýzy před vstupem do sledování. 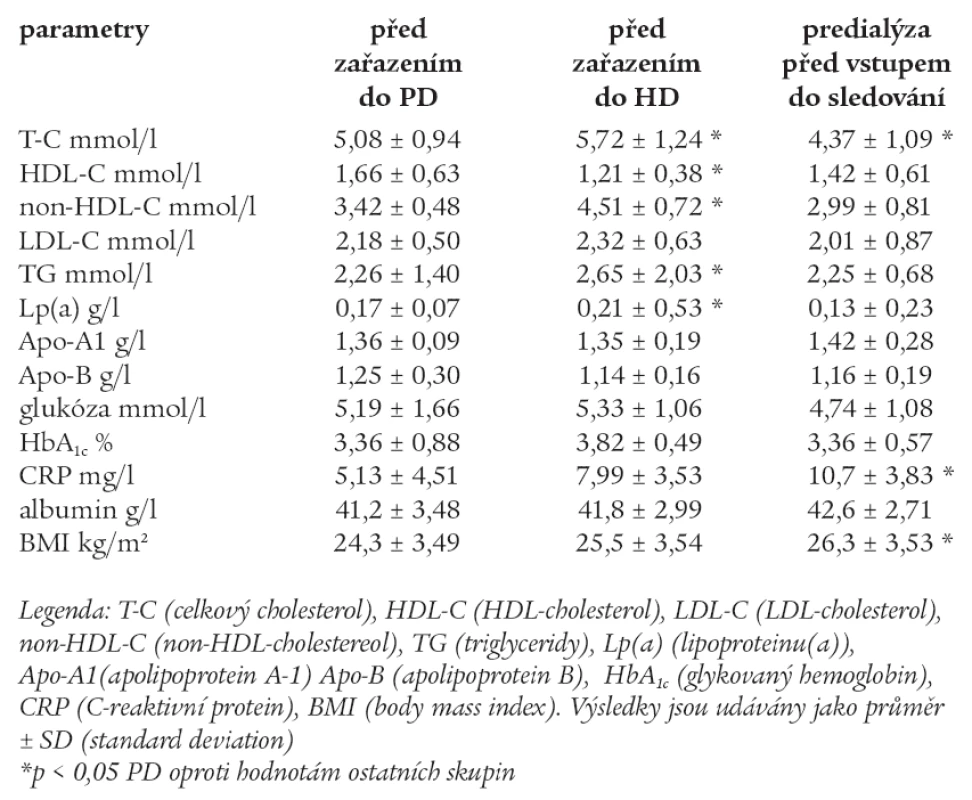
U skupiny HD byly signifikantně vyšší hodnoty T-C, non-HDL-C, TG a Lp(a) před zařazením do pravidelního dialyzačního programu.
HDL-C byl nejnižší u skupiny HD a T-C byl nejnižší ve skupině predialýzy. CRP a BMI byly vyšší signifikantně ve skupině predialýzy a byly nejnižší ve skupině PD před zařazením do sledování. Ostatní parametry byly srovnatelné ve všech skupinách jak u PD, tak u HD a predialýzy.
Hodnoty měřených laboratorních parametrů před zařazením do PD, po 6 měsících a po 30 měsících na PD jsou uvedeny v tab. 4.
Tab. 4. Hodnoty měřených laboratorních parametrů před zařazením do PD, po 6 měsících a po 30 měsících na PD. 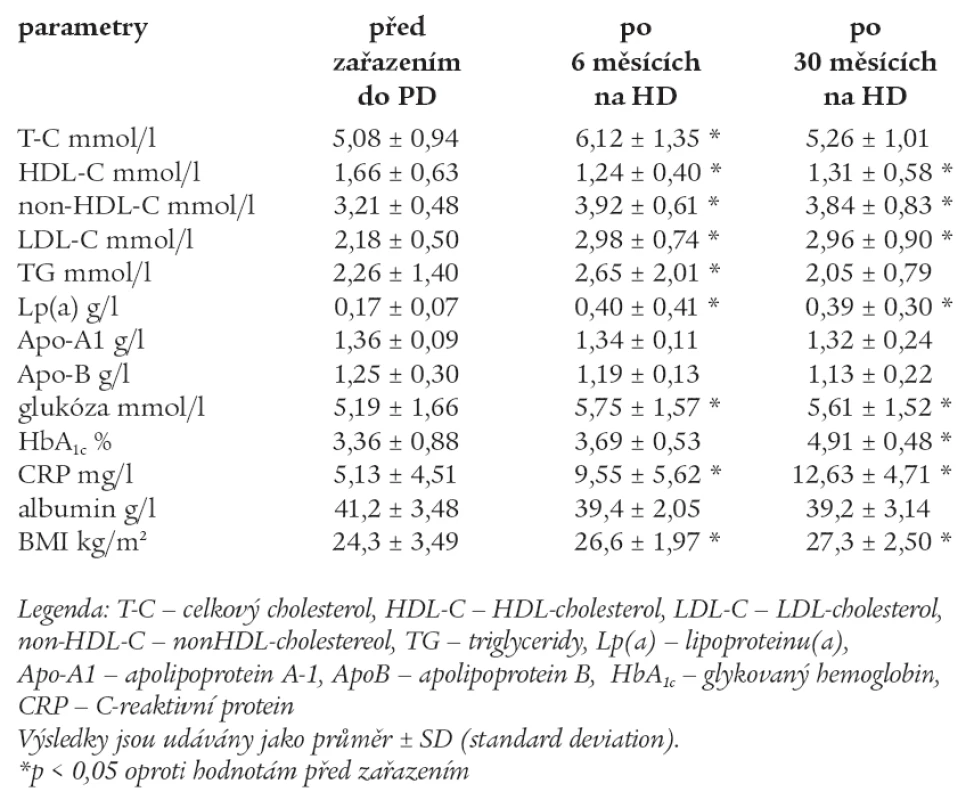
U skupiny PD po 6 měsících sledování byly signifikantně vyšší hodnoty T-C, non-HDL-C, LDL-C, TG, glukózy, CRP, BMI a snížily se hodnoty HDL-C.
U skupiny PD po 30 měsících došlo k poklesu T-C a TG na hodnoty, jež měli pacienti před zahájením PD, ale u této skupiny pacientů zůstaly signifikantně vyšší hodnoty non-HDL-C, LDL-C, Lp(a), glukózy, CRP a BMI. Zvýšil se signifikantně HbA1c.
Pacienti na PD v průběhu sledování byli zváženi s dialyzačním roztokem v dutině břišní (intraperitoneálně), což představuje v průměru 2 litry při jedné výměně, a tato hodnota nebyla odečtena z celkové tělesné hmotnosti.
Hodnoty měřených laboratorních parametrů před zařazením do HD, po 6 měsících a 30 měsících na HD jsou uvedeny v tab. 5.
Tab. 5. Hodnoty měřených laboratorních parametrů před zařazením do HD, po 6 měsících a 30 měsících na HD. 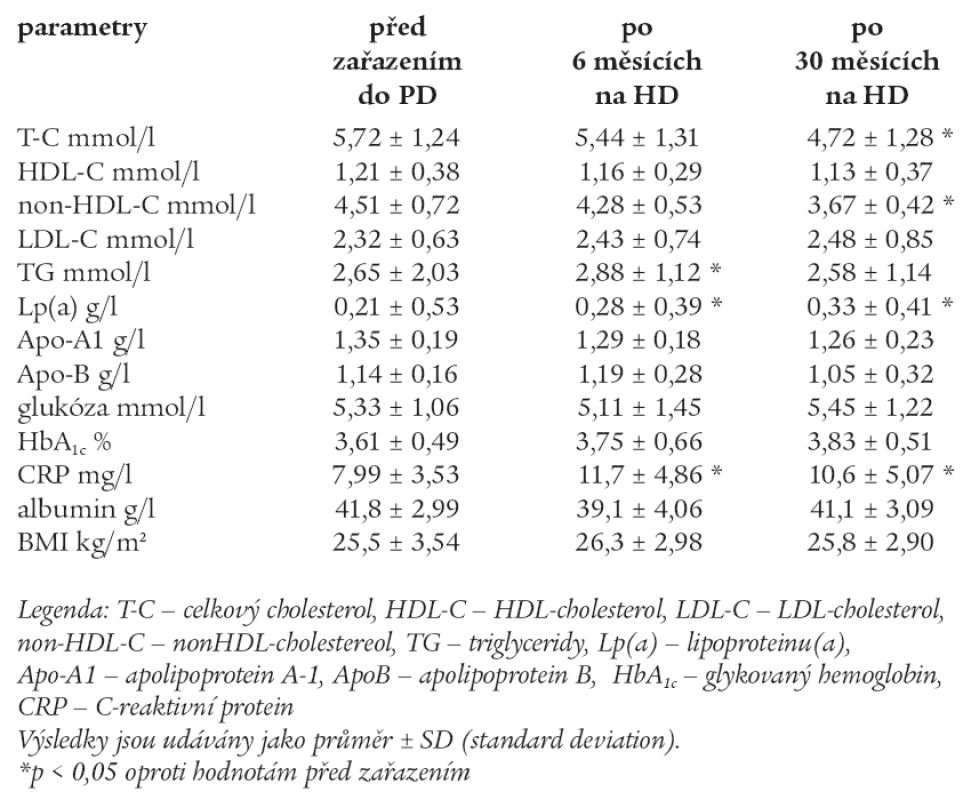
U skupiny HD po 6 měsících byly signifikantně vyšší TG, Lp(a) a CRP, snížily se hodnoty non-HDL. Po 30 měsících došlo k signifikantnímu poklesu T-C, non-HDL-C. Lp(a) a CRP zůstaly signifikantně vyšší. Ostatní parametry se signifikantně nezměnily oproti hodnotám před zařazením do HD.
Hodnoty měřených laboratorních parametrů pacientů predialýzy před vstupem do sledování, po 6 měsících a po 30 měsících sledování jsou uvedeny v tab. 6.
Tab. 6. Hodnoty měřených laboratorních parametrů pacientů predialýzy před vstupem do sledování, po 6 měsících a 30 měsících sledování. 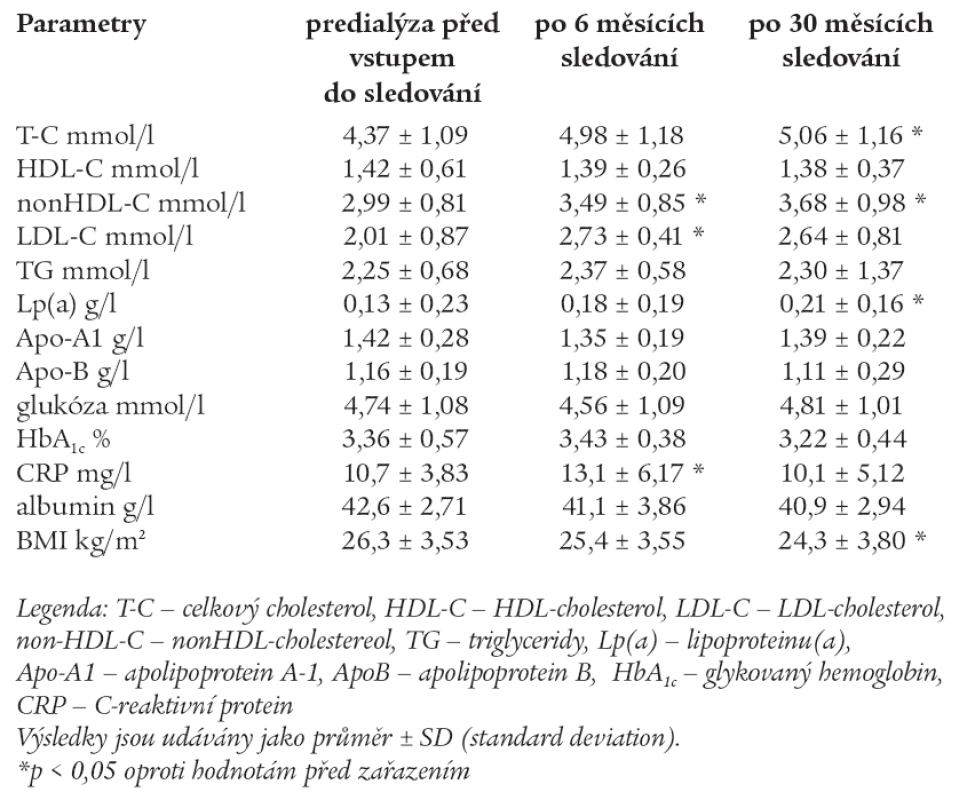
Ve skupině predialýzy došlo v průběhu 6 měsíců sledování k signifikantnímu zvýšení non-HDL-C, LDL-C a CRP. Po 30 měsících sledování došlo k signifikantnímu zvýšení TC. Non-HDL-C a LDL-C zůstaly statisticky významně vyšší i po 30 měsících. HDL-C zůstal prakticky beze změn, TG byly nesignifikantně zvýšeny po celou dobu sledování a nedošlo k změně ani po 30 měsících. Lp(a) se signifikantně zvýšil po 30 měsících sledování. CRP byl oproti druhým skupinám signifikantně vyšší, jinak byl vyšší již na začátku sledování a po přechodném signifikantním zvýšení byl zjištěn jeho pokles k hodnotám, jaké byly před zahájením sledování. BMI se oproti vstupní hodnotě signifikantně snížil po 30 měsících. Ostatní parametry zůstaly bez signifikantních změn.
Srovnání krevních lipidů a dalších parametrů mezi skupinami PD, HD a predialýzou po 30 měsících sledování jsou uvedeny v tab. 7.
Tab. 7. Srovnání krevních lipidů a dalších parametrů mezi skupinami PD, HD a predialýzou po 30 měsících sledování. 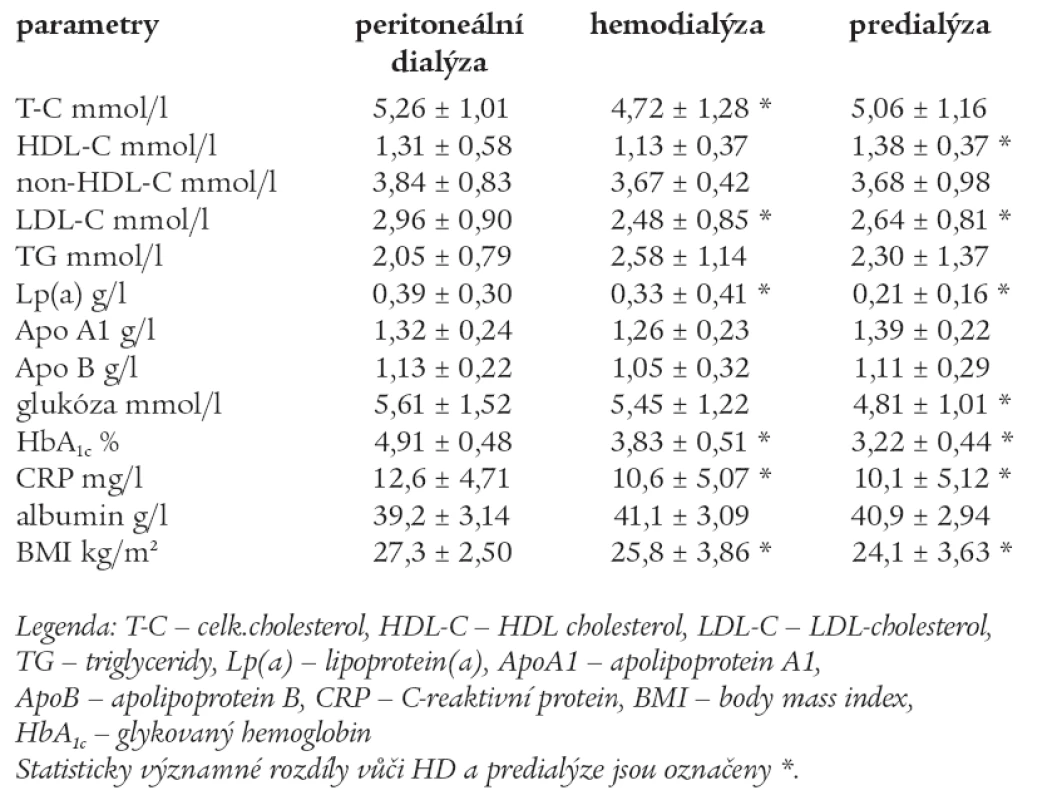
Po 30 měsících sledování byly ve skupině PD zjištěny signifikantně vyšší hodnoty T-C vůči HD (p < 0,05). Ve skupině predialýzy signifikantně vyšší hodnoty HDL-C vůči HD (p < 0,05). Ve skupině PD byly zjištěny nejvyšší hodnoty LDL-C a Lp(a) oproti HD a predialýze, rozdíly dosáhly statistické významnosti (p < 0,05). Mezi skupinami byly zjištěny signifikantně vyšší HbA1c, CRP a BMI ve skupině PD (p < 0,05). Ve skupině PD byla signifikantně vyšší glukóza vůči predialýze (p < 0,05). Albumin byl vyšší ve skupině HD, ale rozdíl nedosáhl statistické významnosti. Pacienti léčení HD a v predialýze měli normální hladinu T-C.
Diskuse
Dyslipidemie se u chronické renální insuficience (CHRI) manifestuje již v časné fázi choroby a u pacientů s lepší zbytkovou funkcí má mírnější formu [1]. Dyslipidemie u CHRI má multifaktoriální etiologii a na jejím rozvoji se podílí několik mechanizmů: snížená aktivita lipoproteinové a jaterní lipázy, periferní inzulinová rezistence, hyperparatyreoidizmus a nedostatek L-karnitinu [27].
U PD se podílí na rozvoji dyslipidemie také kontinuální absorpce glukózy, která zvyšuje tvorbu TG (ta je zřejmě důsledkem zvyšující se koncentrace lipoproteinů bohatých na triglyceridy) [7]. Poruchu může potencovat nízká aktivita enzymů zodpovědných za katabolizmus lipoproteinů bohatých na TG. U nemocných léčených PD byla prokázána nižší aktivita jaterní lipázy [17].
Změny v koncentracích krevních lipidů a lipoproteinů jsou také závislé na způsobu léčby (HD, PD, transplantace ledvin). U PD bývá častější zvýšení T-C, LDL-C, Lp(a), apo-B a větší pokles HDL-C a apo-A1 ve srovnání s HD [19,20].
Po transplantaci ledviny často dochází k vzestupu LDL, někdy i VLDL, čímž se mění typ hyperlipoproteinemie - vedle typu IV nacházíme typ IIb, vzácně II podle Fredricksona. Významnou roli zde hraje přírůstek tělesné hmotnosti, časté poruchy sacharidového metabolizmu a dlouhodobá imunosupresivní léčba [25).
U našich pacientů se ve skupině PD v průběhu 6 měsíců zvýšila hodnota T-C o 1,04 mmol/l, non-HDL-C o 0,71 mmol/l, hodnota LDL-C o 0,75 mmol/l, TG o 0,39 mmol/l a Lp(a) o 0,23 g/l, což je statisticky významné pro tyto sledované parametry za toto období.
Po 30 měsících PD byl zjištěn pokles celkového cholesterolu a triglyceridů na hodnoty, jež měli pacienti před zahájením PD. U pacientů na PD zůstal signifikantně vyšší non-HDL-C, LDL-C, Lp(a). HDL-C zůstal signifikantně nižší a došlo k nesignifikantnímu poklesu ApoB, hodnota ApoA1 se nezměnila.
Je známo, že u nemocných léčených PD, bývá koncentrace TG, T-C vyšší v prvních měsících léčby, a to díky absorpci glukózy z dialyzačního roztoku. Pak však dochází ke stabilizaci, a dokonce k poklesu na výchozí hodnoty [28]. Vzhledem k tomu, že absorpce glukózy z dialyzátu v průběhu PD má kontinuální charakter, stabilizace toho stavu a následný pokles v hladinách cholesterolu a TG je zajímavý fenomén. V tomto případě lze předpokládat metabolickou a dietní adaptaci nemocných na zátěž glukózou [5,26].
Nízký HDL-C může být důsledkem ztrát apo-AI a AII dialyzátem [3].
Snížená hladina HDL-C u diabetiků na PD je také ovlivněna podáním hypertonického dialyzačního roztoku s glukózou. CAPD s použitím hypertonických roztoků má nežádoucí účinky na systémovou hemodynamiku, má také negativní dopad na glykemii a na životnost peritoneální membrány [16].
Již před zařazením do PD vykazuje 68 % pacientů mírnou hypercholesterolemii a 47 % pacientů lehkou hypertriglyceridemii [5]. Restrikcí karbohydrátů v dietě na 240 - 250 g/24 hod lze u pacientů léčených PD snížit hladiny triglyceridů [26].
Hypertriglyceridemie může být způsobena také akcentací poruchy metabolizmu lipidů při chronickém selhání ledvin a může být jednou z příčin urychlené aterosklerózy [10]. Nemocní léčení PD mají v séru zvýšené aterogenní lipoproteiny bohaté na TG [7]. Hodnota LDL je vyšší u 48 % pacientů léčených PD ve srovnání s 23 % nemocných léčených hemodialýzou a u 7 % zdravých dobrovolníků. Zvýšení LDL-C je spojeno se zvýšeným rizikem výskytu infarktu myokardu u nemocných s renálním selháním [14].
Hypertriglyceridemie je provázena zvýšením trombogenity, výskytem malých denzních LDL-částic, které jsou snáze oxidovatelné. Ze studií poslední doby to dokládá například 8letá studie mužské populace v Kodani (København, Dánsko) [9], do níž bylo zařazeno 2 906 mužů ve věku 53-74 let bez ICHS. V této studii byla hladina TG významným rizikovým faktorem vzniku ICHS nezávisle na dalších hlavních rizikových faktorech včetně HDL-C. Metaanalýza 17 populačních studií prokázala, že každé zvýšení hladiny TG o 1 mmol/l bylo spojeno se zvýšením kardiovaskulárního rizika o 32 % u mužů a o 76 % u žen [2]. Po vyloučení vlivu hodnot HDL-C a ostatních rizikových faktorů kleslo riziko u mužů na 14 % a u žen na 37 %, nicméně zůstalo statisticky významné. Vysoká koncentrace TG se jeví též nezávislým rizikovým faktorem ischemických cévních mozkových příhod a tranzitorní ischemické ataky (TIA příhod) podle analýzy registru studie BIP (Bezafibrate Infarction Prevention study) u 11 177 pacientů s ICHS [25].
U souborů našich pacientů léčených PD se po zahájení PD statisticky významně zvýšil CRP jako marker zánětlivých procesů a došlo k dalšímu nárůstu CRP během 30 měsíců léčby pomocí PD. Toto může svědčit o tom, že pacienti léčení PD mohou být pro způsobu léčení ohroženější intraperitoneálně mikrozánětlivým prostředím [15]. Důvodem zvýšení hladiny CRP u našich pacientů pravděpodobně nebyl výskyt peritonitidy, protože u těchto pacientů nebyly provedeny odběry během akutního zánětu.
Při PD dochází ke vstřebání 100-200 g glukózy denně. Tato absorpce glukózy může potenciálně přispět k aterogenním změnám v metabolizmu lipidů a lipoproteinů v séru, ale některé změny jsou přechodné a podporují adaptaci peritonea na zátěž glukózou [12]. Zvýšený příjem glukózy může vést k hyperglykemii, hypertriglyceridemii, hyperinzulinemii, k obezitě, k omezení chuti k jídlu, a tím ke sníženému příjmu bílkovin [22]. Tím jsou především postihováni diabetici a mnohdy je u nich zapotřebí zvyšovat dávky inzulinu nebo perorálních antidiabetik.
U skupiny PD došlo k signifikantním zvýšení hladiny krevního cukru a glykovaného hemoglobinu, a to hlavně u diabetiků. Byly také zvýšeny dávky inzulinu a perorálních antidiabetik. U 1 diabetika bylo nutné zvýšit dávky inzulinu o 4 - 6 j denně.
Albumin byl v normálním rozmezí hodnot jak před zařazením do PD, tak během PD. Jeho průměrná koncentrace byla 39,2 g/l. To dosvědčuje, že naši nemocní netrpí malnutricí, i když představují ztráty bílkovin při PD v průměru 5 - 10 g za den a během peritonitid se mohou zvýšit až o 100 % [22].
U našich pacientů byl průměrný BMI signifikantně vyšší u skupiny PD a toto zvýšení tělesné hmotnosti patří k metabolickým komplikacím PD, které zahrnují kromě zvýšení tělesné hmotnosti, hyperglykemii, hypercholesterolemii a hypertriglyceridemii. Tyto metabolické poruchy jsou spojeny pravděpodobně s metodou léčby, při níž může samotná glukóza, která se používá při peritoneální dialýze v roztocích jako osmotické agens, sloužit jako substrát pro syntézu lipoproteinů. Také chronická hyperhydratace u některých z pacientů na PD má spolupodíl na zvyšování BMI. Použití Icodextrinu jako polymeru glukózy s nižší absorpcí glukózy bylo spojeno s nižší hladinou T-C a LDL. Použití Icodextrinu bylo dokonce spojeno s nižší hladinou leptinu u PD pacientů [11].
V predialýze se BMI oproti vstupní hodnotě snížil pravděpodobně díky nízkoproteinové dietě, při které někteří pacienti snižují celkový příjem potravy a tím i celkové energie, ale nedošlo k statisticky významnému poklesu albuminu v séru.
39,4 % pacientů ze všech skupin bylo léčeno hypolipidemiky, která mohla ovlivnit výchozí hodnoty T-C a další parametry lipidového metabolizmu. U skupiny pacientů před zařazením do HD byla léčba hypolipidemiky zastoupena nejméně, resp. u většiny pacientů z této skupiny nebylo její nasazení indikováno. Největší zastoupení v léčbě fluvastatinem měla skupina pacientů z predialýzy.
Hladiny Lp(a) u PD pacientů bývají výrazně vyšší v těch případech, v nichž je vyšší koncentrace Lp(a) v dialyzátu. To je zapříčiněno zvýšenou exkrecí Lp(a) do dialyzátu a hyperprodukcí Lp(a) játry. Vyšší hladina Lp(a) u PD ve srovnání s HD naznačuje možný vliv typu dialyzační procedury. Existuje souvislost mezi Lp(a) a parametry týkajícími se dialyzační procedury (dávka dialýzy, absorpce glukózy peritoneem, ztráty bílkovin a clearance bílkovin) [23]. V longitudinální studii 1 200 PD pacientů se Lp(a) signifikantně zvýšil po zahájení CAPD a po 3-5 měsících léčby. Korelace významně se zvyšující hladiny Lp(a) s peritoneální clearance albuminu a β2-mikroglobulinu naznačuje, že za mechanizmem zvýšení hladiny Lp(a) stojí velké ztráty bílkovin dialyzátem, a to i přes zvýšenou syntézu Lp(a) v játrech a snížení katabolizmu Lp(a) u PD. Konečně, korelace mezi Lp(a) a peritoneální absorpcí glukózy také potvrzuje například souvislost mezi zvýšenou hladinou Lp(a) a dialyzační procedurou - zejména v transportu bílkovin a glukózy peritoneem [6].
Lp(a) byl identifikován začátkem 90. let 20. století jako nezávislý faktor pro aterosklerotické cévní choroby [18].
Statiny mají benefiční efekt na hladiny lipidů a na trombogenitu u PD pacientů, ovlivňují agregaci trombocytů a vnější koagulační cestu, zlepšují fibrinolýzu a také endoteliální dysfunkci [13].
Metabolizmus proteinů i přes ztráty bílkovin dialyzátem nebyl u našich pacientů významně ovlivněn.
Závěr
U našeho souboru PD pacientů jsme nalezli statisticky významně zvýšené hodnoty LDL-C a Lp(a) vůči pacientům v HD a v predialýze. Je zřejmě, že peritoneální dialýza má jako metoda náhrady funkce ledvin vliv na zhoršování metabolizmu lipidů a lipoproteinů. Tento nález přispívá ke zvyšování rizika aterosklerózy a může nepříznivě ovlivnit také další prognózu těchto pacientů.
Konvenční glukózové roztoky mohou mimo jiné nepříznivě ovlivňovat metabolizmus sacharidů a lipidů a mohou vyvolat sacharidy indukovanou hypertrigylceridemii, která byla pozorovaná také u našich pacientů.
K potvrzení těchto nálezů by přispěly studie s větším počtem pacientů, které by byly statisticky přesvědčivější, zaznamenaly by i možný vztah k celkové a kardiovaskulární nemocnosti a úmrtnosti.
MUDr. Assad Zharfbin
II. interní klinika LF MU a FN u sv. Anny
www.fnusa.cz
e-mail: assadullah.zharfbin@fnusa.cz
Doručeno do redakce: 16. 4. 2004
Přijato po recenzi: 26. 7. 2006
Zdroje
1. Attman PO, Alaupovic P. Lipid and apolipoprotein profile, dyslipoproteinemia-relation to renal function and dialysis. Nephron 1991; 57 : 401-410.
2. Austin MA, Hokanson JE, Edwards KL. Hypertriglyceridemia as a cardiovascular risk factor. Am J Cardiology 1998; 81: suppl. 4A: 7B-12B.
3. Cancarini G, Constation E, Brunori G et al. Nutritional status of long term CAPD patients. Adv Perit Dial 1992; 8 : 84-86.
4. Davidson MH on behalf of the Fluent Investigation Group. Fluvastatin Long-Term Extention Trial (FLUENT): Summary of efficacy and safety. Am J Med 1994; 96 (Suppl 6A): 41A-44A.
5. Davidson MH, Hauptman J, Digirlamo O. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat a randomized controlled trial. JAMA 1999; 13 : 278-280.
6. Heimburger O, Stenvinkel P, Berglund L et al. Increased plasma lipoprotein(a) in continuous ambulatory peritoneal dialysis is related to peritoneal transport of proteins and glucose. Nephron 1996; 72 : 135-140.
7. Hodis HN, Mack WJ. Triglyceride-rich lipoproteins and progression of atherosclerosis. European Heart Journal 2003; 24(Suppl A): 81-85.
8. Janicki K, Solski J, Janicka L et al. Lipid and apolipoproteins disturbances in hemodialysis, peritoneal dialysis and renal transplant patients. Ann Univ Mariae Curie Sklodowska (Med) 2004; 59 : 459-466.
9. Jeppesen J, Hein HO, Suadicani P et al. Triglyceride concentrations and ischemic heart disease. An eight-year follow-up in the Copenhagen male study. Circulation 1998; 97 : 1029-1036.
10. Kimak E, Solski J, Janicka L Lipoprotein profiles at different stages of chronic renal insufficiency. Renal failure 2000; 22 : 63-71.
11. le Poole CY, van Ittersum FJ, Weijmer MC et al. Clinical effects of a peritoneal dialysis regiment low in glucose in new peritoneal dialysis patients: a randomized crossover study. Adv Perit Dial 2004; 20 : 170-176.
12. Lindholm B, Norbeck HE Serum lipids and lipoproteins during continuous ambulatory peritoneal dialysis. Acta Med Scand 1986; 220 : 143-151.
13. Malyszko J, Malyszko JS, Hryzsko T et al. Influence of simvastatin on aspects of thrombogensis in CAPD patients. Perit Dial Int 2003; 23 : 260-266.
14. O'Neal DN, Best JD, Petri M et al. Initial hypoalbuminemia and hyperlipidemia persist during chronic peritoneal dialysis. Nephron 2003; 76 : 56-61.
15. Park SH, Lee EG, Kim IS et al. Effect of glucose degradation products on the peritoneal membrane in a chronic inflammatory infusion model of peritoneal dialysis in the rat. Perit Dial Int 2004; 24 : 115-122.
16. Selby NM, Fonseca S, Hulme L et al. Hypertonic glucose-based peritoneal dialysate is associated with higher blood pressure and averse hemodynamics as compared with icodextrin. Nephrol Dial Transplant 2005;20 : 1848-1853.
17. Shoji T, Nishizawa Y, Nishitani H et al. Roles of hypoalbuminemia and lipoproteins lipase on hyperlipoproteinemia in continuous ambulatory peritoneal dialysis. Metabolisms 1991; 40 : 1002-1008.
18. Siamopoulos KC, Elisaf MS, Bairaktari HT et al. Lipid parameters including lipoprotein(a) in patients undergoing CAPD and hemodialysis. Perit Dial Int 1995; 15 : 342-347.
19. Soška V. Sekundární hyperlipoproteinémie - přehled a význam. Abstr. IV: kongres o ateroskleróze, Špindlerův Mlýn, 7.-9. 12. 2000. DMEV 2000; 3: Suppl. 2 : 30.
20. Soška V. Poruchy metabolismu lipidů, diagnostika a léčba. Praha: Grada Publishing 2001, 166.
21. Soška V, Lojek A, Sobotová D. Vliv jednorázové hemodialýzy na koncentraci krevních lipidů a lipoproteinů. Klin Biochem Metab 2000; 8 : 114-117.
22. Sulková S et al. Peritoneální dialýza. Syllabova knižnice sv. 1, Jessenius Praha 1993
23. Tanaka S. Alterations of serum lipoprotein(a) levels in continus ambulatory peritoneal dialysis (CAPD) patients. Nippon Jinzo Gakkai Shi 1994; 36 : 746-751.
24. Tanne D, Koren-Morag N, Graff E et al (for the BIP Study Group). Blood lipids and first-ever ischemic stroke/transient ischemic attack in the Bezafibrate Infarction Prevention (BIP) registry. High triglycerides constitue an independent risk factor. Circulation 2001; 104 : 289-297.
25. Teplan V. Metabolismus a ledviny. Praha: Grada Publishing 2000 : 59.
26. Turgan C, Feehally J, Bennet S et al. Accelerated hypertriglyceridemia in patients on continuous ambulatory peritoneal dialysis and proventable abnormality. Int J Artif Organs 1981; 4 : 158-160.
27. Wanner C, Frommherz K, Horl WH. Hyperlipoproteinemia in chronic renal failure, pathophysiological and therapeutic aspects. Kardiology 1991; 78 : 202-217.
28. Zharfbin A, Soška V, Sobotová D. Změny krevních lipidů u nemocných léčených peritoneální dialýzou. XXX. nefrologický kongres, Luhačovice, 17. - 19. 6. 2004. Aktuality v nefrologii 2004; Suppl 10 : 36-37 (Abstr).
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Mým kolegům!
- Pozitronová emisní tomografie v diagnostice vaskulitid velkých cév – jedné z příčin horeček neznámého původu: editorial
- C−reaktivní protein – editorial
- Mitrální regurgitace 2006
- Mužská hormonální antikoncepce – editorial
- Klinické důsledky TRIM (Transfusion related immunomodulation) - editorial
- Riziková medikace a kontrastní látkou indukovaná nefropatie u pacientů s diabetem a hypertenzí
- Pozdní komplikace chronických zánětů respiračního traktu u nemocných s běžnou variabilní imunodeficiencí
- Význam anamnézy v diferenciálnej diagnostike reflexných a kardiogénnych synkopálnych stavov
- 18F-FDG PET v diagnostice vaskulitid velkých cév
- Prevalence hladin C−reaktivního proteinu u dospělé populace dvou regionů České republiky a jejich vztah k tělesnému složení
- Dyslipidemie u nemocných léčených peritoneální dialýzou
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Tako tsubo syndrom - nový přírůstek do rodiny akutních stavů v kardiologii: aktuální sdělení
- Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou poruchou funkcie štítnej žľazy
- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
-
XIII. sjezd České internistické společnosti, Brno, 1.–4. listopadu 2006
Sborník abstrakt k přednáškám
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



