-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
proLékaře.cz / Odborné časopisy / Urologické listy / 2012 - EAU Guidelines pro léčbu symptomů dolních močových cest u mužů5. Operační léčba
Autoři: M. Oelke; A. Bachmann; A. Descazeaud; M. Emberton; S. Gravas; M. C. Michel; J. N’dow; J. Nordling; J. J. De La Rosette
Působiště autorů: European Association of Urology 2012
Vyšlo v časopise: Urol List 2012; 10(EAU Guidelines pro léčbu symptomů dolních močových cest u mužů): 28-46
5.1 Transuretrální resekce prostaty (TURP) a transuretrální incize prostaty (TUIP)
5.1.1 Mechanizmus účinku
Transuretrální resekce prostaty (TURP) byla poprvé provedena v roce 1932. Zatímco materiál se od prvního výkonu podstatně změnil, základní princip techniky TURP zůstal stejný. Stále spočívá v odstranění tkáně z přechodové zóny prostaty s cílem snížit benigní prostatickou obstrukci (BPO) a poté redukovat symptomy dolních cest močových (LUTS).
Technika TURP je stále považována za zlatý standard v léčbě symptomů LUTS doprovázejících BPO u pacientů s prostatou o objemu 30–80 ml. V literatuře však neexistují žádné solidní důkazy týkající se horní hranice objemu prostaty pro indikaci TURP. Navrhované prahové hodnoty odrážejí stanovisko skupiny odborníků, kteří se domnívali, že tento limit závisí na zkušenosti chirurga, rychlosti resekce a velikosti resektoskopu. V posledním desetiletí dochází k neustálému poklesu počtu provedených TURP. V roce 1999 představovala technika TURP v USA 81 % všech operací benigní prostatické hypertrofie (BPH), zatímco v roce 2005 tvořila již pouze 39 % operačních výkonů pro BPH, a to díky kombinovanému efektu menšího počtu operací prostaty a nárůstu minimálně invazivních léčebných postupů [1].
Transuretrální incizi prostaty (TUIP) poprvé popsal Orandi v roce 1969. Technika TUIP zmírňuje symptomy LUTS doprovázející BPO tak, že se v oblasti výtoku z močového měchýře provede incize, aniž by však docházelo k odstranění tkáně. TUIP byla znovuobjevena a může nahradit TURP jako technika první volby v léčbě vybraných mužů s benigním zvětšením prostaty, zejména mužů s objemem prostaty £ 30 ml bez středního laloku.
5.1.2 Operační postup
Během TURP se endoskopicky odstraní hyperplastická prostatická tkáň přechodové zóny za pomoci speciálních resektoskopů a kliček umožňujících postupnou resekci prostatické tkáně po malých částech, které se pak na závěr operace odstraní z močového měchýře. Resekce prostatické tkáně a elektrokoagulace cév se provádí za pomoci vysokofrekvenčního proudu.
Během TUIP se provedou jedna nebo dvě incize do prostatického parenchymu a prostatické kapsuly, čímž se sníží uretrální odpor (BPO). Tato technika byla několika autory modifikována. Nejoblíbenější jednostranná incize se provádí na čísle 6 a nejběžnější oboustranné incize pak na číslech 5 a 7.
Před provedením TURP nebo TUIP je třeba léčit infekce močových cest [2,3]. Rutinní profylaxe antibiotiky při TURP byla dobře vyhodnocena na významném počtu randomizovaných kontrolovaných studií. Tři systematická přezkoumání dostupných randomizovaných kontrolovaných studií dospěla k obdobným závěrům a podpořila používání antibiotické profylaxe [4–6]. Antibiotická profylaxe významně snižuje bakteriurii, horečku, riziko sepse a nutnost podávání dalších antibiotik po provedení TURP. Byla pozorována tendence vyšší účinnosti krátkodobého podávání antibiotik v porovnání s jednodávkovým režimem [4]. Je však nutné provést další studie a určit optimální režim a ceno-vou efektivitu antibiotické profylaxe při TURP.
5.1.3 Účinnost
5.1.3.1 Zlepšení symptomů
Studie s dlouhodobým sledováním po dobu 8–22 let ukazují, že TURP zajišťuje trvalý klinický efekt. Obdobné údaje týkající se trvání efektu nejsou k dispozici pro žádnou jinou operační léčbu BPO [7]. Jedna studie s průměrnou dobou sledování 13 let uváděla významné a trvalé zmírnění většiny symptomů a zlepšení urodynamických parametrů po TURP. Studie také zjistila, že subjektivní a objektivní selhání bylo spojeno se sníženou kontraktilitou detruzoru spíše než s BPO [8]. Studie zahrnující 577 mužů, kteří prodělali TURP, uváděla po 10 letech sledování vynikající funkční výsledek s průměrnou hodnotou IPSS 4,9 a průměrným skóre kvality života 1,2 [9]. Metaanalýza 29 randomizovaných kontrolovaných studií uváděla průměrné zlepšení symptomů LUTS o 70,6 % (95% interval spolehlivosti: 66,4–75,5 %) po TURP [10].
5.1.3.2 Porovnání TUIP a TURP v rámci randomizovaných kontrolovaných studií
V současnosti je k dispozici jedenáct randomizovaných kontrolovaných studií porovnávajících TUIP a TURP [10–14] (tab. 15). Tyto studie zaznamenaly obdobné zlepšení symptomů LUTS u pacientů s menší prostatou (< 20–30 ml) bez středního laloku [10–14]. Zjištění jsou uvedena níže.
Tab. 1. Účinnost transuretrální resekce prostaty (TURP) nebo transuretrální incize prostaty (TUIP) ve studiích úrovně 1 po 12 a 24 měsících. Absolutní a relativní změny v porovnání s výchozím stavem, pokud jde o symptomy (Madson-Iverson nebo IPSS) a maximální rychlost průtoku moči. 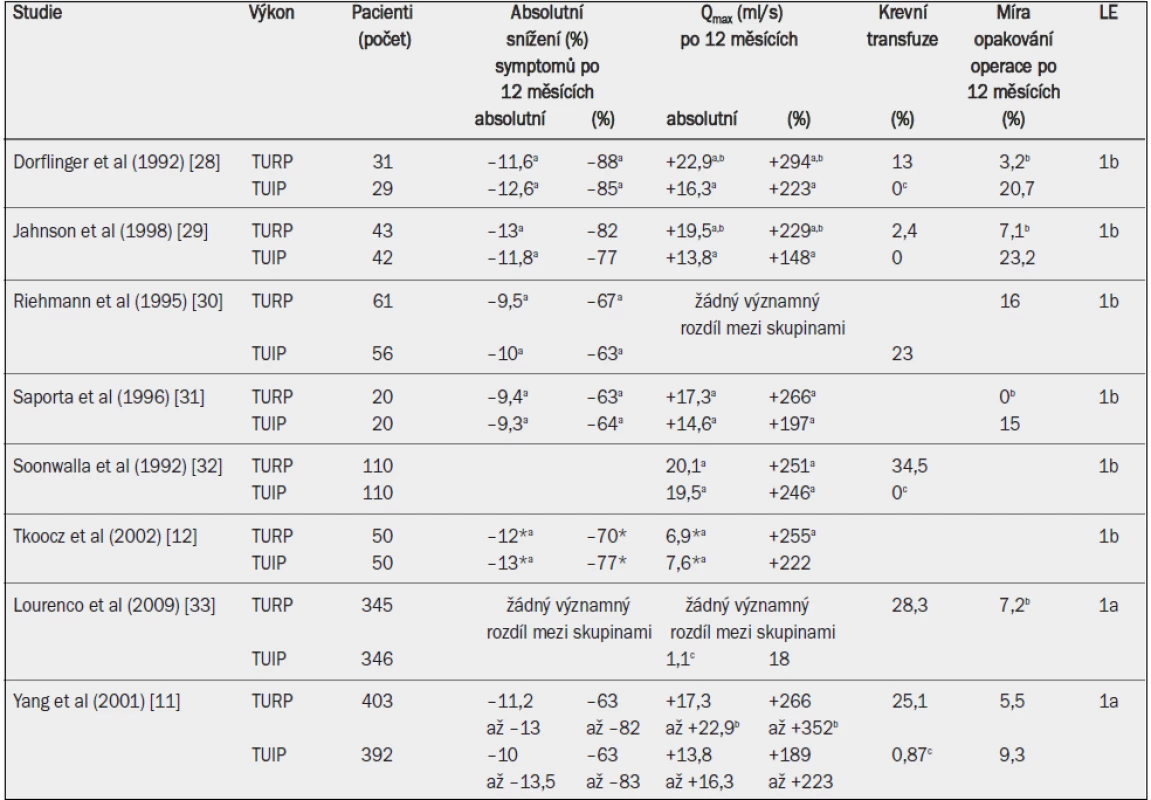
*24 měsíců po operaci; a = významný rozdíl v porovnání s výchozím stavem; b = významný rozdíl ve prospěch TURP; c = významný rozdíl ve prospěch TUIP. Uroflowmetrie: Průměrné zvýšení Qmax po TURP činilo 125 % s absolutním průměrným zlepšením +9,7 ml/s (95% interval spolehlivosti: 8,6–11,2 ml/s) [10]. Všechny randomizované kontrolované studie porovnávající TUIP a TURP 12 měsíců po výkonu uváděly nižší průměrnou hodnotu nebo medián Qmax po TUIP, s celkovým průměrným zlepšením Qmax o 70 % (95% interval spolehlivosti: 27–112) [10,13].
Postmikční reziduum (PVR): Postmikční reziduální objem se snížil o 60,5 % (95% interval spolehlivosti: 48–71 %) po TURP [10]. Snížení PVR po TUIP se v jednotlivých dostupných studiích lišilo, ale vždy bylo nižší než v případě TURP [10,13].
Míra opakování léčby: Byla uváděna konstantní míra provádění druhé operace prostaty, obvykle znovu technikou TURP, přibližně 1–2 % ročně. Přezkoumání analyzující 29 randomizovaných kontrolovaných studií zjistilo 2,6% míru opakování léčby (96% interval spolehlivosti: 0,5–4,7) po průměrné době sledování 16 měsíců [10]. V nedávné rozsáhlé studii zahrnující 20 671 mužů, kteří prodělali TURP v Rakousku, byly celkové uváděné míry opakování léčby (zahrnující sekundární TURP, uretromii a incizi hrdla močového měchýře) 5,8 % po roce, 12,3 % po pěti letech a 14,7 % po osmi letech sledo-vání [14]. Incidence sekundární TURP dosahovala pro stejná období sledování 2,9 %, 5,8 % a 7,4 % [14]. Analýzy randomizovaných kontrolovaných studií porovnávající TURP a TUIP ukázaly, že opakování léčby bylo pravděpodobnější u TUIP (17,5 %) než u TURP (9 %) [13].
5.1.4 Snášenlivost a bezpečnost
5.1.4.1 Peroperační a pooperační komplikace
Mortalita po prostatektomii se v posledních desetiletích konstantně a významně snižovala a v současných studiích dosahuje méně než 0,25 % [10,15,16]. V dosud poslední studii zahrnující 10 564 mužů, kteří prodělali TURP, dosáhla pooperační mortalita (během prvních 30 dní) 0,1 % [17]. Riziko syndromu transuretrální resekce (TUR) se v posledních desetiletích rovněž snížilo na méně než 1,1 % [10,16]. Mezi rizikové faktory spojené se syndromem TUR patří nadměrné krvácení s otevřením venózních sinů, delší doba operace, velká prostata a předchozí nebo současné užívání nikotinu [17]. U pacientů, kteří prodělali TUIP, nebyly zaznamenány žádné případy syndromu TUR. Míra nutnosti krevní transfuze po TURP dosahovala v analýze 29 randomizovaných kontrolovaných studií hodnoty 8,4 % (95% interval spolehlivosti: 3,9–13,4) [10]. Současné reálné údaje vycházející z 10 564 provedených TURP uvádějí krvácení spojené s výkonem vyžadující krevní transfuzi u 2,9 % pacientů. Riziko krvácení po TUIP je zanedbatelné [10].
5.1.4.2 Dlouhodobé riziko mortality
Na možnost zvýšeného dlouhodobého rizika mortality po TURP v porovnání s otevřenou prostatektomií upozornili Roos et al [15]. Jiní autoři však tato zjištění nepotvrdili [18–20]. V poslední době ukázaly údaje vycházející z 20 671 provedených TURP a 2 452 otevřených prostatektomií (OP), že osmiletá incidence infarktu myokardu je stejná po TURP (4,8 %) i po OP (4,9 %). Stejně tak byla téměř identická míra mortality po 90 dnech (0,7 vs 0,9 %), po roce (2,8 vs 2,7 %), po pěti letech (12,7 vs 11 8 %) a po osmi letech (20 vs 20,9 %) [14].
5.1.4.3 Dlouhodobé komplikace
Močová inkontinence: Střední pravděpodobnost vzniku pooperační stresové inkontinence se pohybovala v rozmezí od 1,8 % po TUIP do 2,2 % po TURP [1–6,13,15]. Metaanalýza tří studií zkoumajících inkontinenci neukázala žádný statisticky významný rozdíl mezi TUIP a TURP, ačkoli ve skupině TUIP se vyskytlo méně příhod inkontinence[13].
Retence moči a infekce močových cest (IMC): pokud jde o vznik retence moči a IMC, nedávno provedená metaanalýza nezjistila mezi TURP a TUIP žádné statisticky významné rozdíly [13].
Stenóza hrdla močového měchýře a uretrální striktura: Riziko vzniku uretrálních striktur dosahuje 3,8 % (95% interval spolehlivosti: 1,7–5,8) po TURP a 4,1 % po TUIP [10]. Riziko stenózy hrdla močového měchýře je 4,7 % (95% interval spolehlivosti: 0,3–9,2) po TURP [10]. Systematické přezkoumání uvádělo celkovou incidenci striktury po TUIP 8,7 %, ale nerozlišovalo mezi uretrálními strikturami a stenózami hrdla močového měchýře [13].
Sexuální funkce: Retrográdní ejakulace vzniká následkem resekce/destrukce hrdla močového měchýře a byla zaznamenána u 65,4 % (95% interval spolehlivosti: 53,4–77,5) pacientů po TURP a 18,2 % pacientů po TUIP [10]. Pokud jde o dopad prostatektomie, zejména TURP, na erektilní funkci, jsou dlouhodobě k dispozici protichůdné údaje. Jediná randomizovaná kontrolovaná studie s dobou sledování 2,8 let, která porovnávala TURP s přístupem pozorného vyčkávání, uváděla stejné procento erektilní dysfunkce v obou ramenech studie (19 a 21 %) [21]. V analýze 29 randomizovaných kontrolovaných studií dosahovala incidence erektilní dysfunkce po TURP 6,5 % (95% interval spolehlivosti: 0,2–12,7 %) [10]. Často uváděné zvýšení incidence erektilní dysfunkce po TURP pravděpodobně není přímým důsledkem TURP, ale je spíše způsobeno průvodními faktory (např. věkem).
5.1.5 Praktické úvahy
TURP i TUIP jsou účinnými primárními léčebnými metodami pro muže s BPO, BPE a středně závažnými až závažnými symptomy LUTS. Volba mezi TURP a TUIP by měla primárně vycházet z objemu prostaty, přičemž u prostat < 30 ml se upřednostňuje zejména TUIP a u prostat o objemu 30–80 ml naopak TURP. Mezi výhody TUIP patří menší rozsah krvácení, kratší operační doba, vyloučení syndromu TUR, minimální nebo kratší doba trvání pooperační iritace močového měchýře, nízké riziko retrográdní ejakulace a kratší doba katetrizace a hospitalizace. Nevýhodami jsou vyšší míra recidivy symptomů a nutnost další operace.
5.1.6 Modifikace TURP: bipolární transuretrální resekce prostaty
5.1.6.1 Mechanizmus účinku
Jedním z nejdůležitějších zlepšení TURP v poslední době je zavedení plazmakinetické bipolární technologie (B-TURP). Doposud bylo vyvinuto pět typů zařízení pro bipolární resekci: plazmakinetický systém (Gyrus), systém Vista Coblation/CTR (řízená resekce tkání) (ACMI) (staženo), systém transuretrální resekce v prostředí fyziologického roztoku (TURis) (Olympus), Karl Storz a Wolf [22]. Tato zařízení se liší ve způsobu, jakým je přiváděn bipolární proud pro dosažení plazmakinetického efektu.
5.1.6.2 Operační postup
Odstranění prostatické tkáně během B-TURP je stejné jako v případě monopolární TURP. Na rozdíl od monopolární TURP používá B-TURP resektoskop se speciální kličkou, jejíž součástí je elektroda s aktivní i vratnou částí. Umožňuje elektrochirurgickou resekci tkáně ve vodivém prostředí fyziologického roztoku. Po aktivaci vysokofrekvenčního proudu se fyziologický roztok kolem kličky zahřeje až na bod varu. Vznikající bubliny vytvářejí prostředí s vysokým elektrickým odporem; napětí mezi elektrodou a fyziologickým roztokem vytvoří oblouk. Tkáň se zahřívá nepřímo teplem vznikajícím při zažehnutí oblouku; to umožňuje resekci i koagulaci. Stejně jako v případě ostatních endoskopických operací je zapotřebí před výkonem léčit infekce močových cest a doporučuje se profylaxe antibiotiky.
5.1.6.3 Účinnost
Účinnost zařízení pro bipolární TURP byla prokázána v případových studiích i randomizovaných kontrolovaných studiích. Důležité informace o účinnosti bipolární TURP poskytla tři systematická přezkoumání [23–25]. Pokud jde o zlepšení Qmax a AUA-SS/IPSS, byly pro monopolární i bipolární TURP uváděny téměř identické výsledky: 10,5 vs 10,8 ml/s (Qmax) a –15,2 vs –15,1 (AUA-SS/IPSS) [23].
Na dlouhodobé výsledky B-TURP se stále čeká. V randomizované kontrolované studii porovnávající B-TURP s plazmakinetickou energií s průměrnou dobou sledování 18,3 měsíců činila míra opakování operace 4,1 % v případě plazmakinetického systému a 2,1 % v případě TURP [26]. V nedávno provedené studii s dobou sledování tři roky se na počátku pozorované významné zlepšení IPSS a Qmax udrželo v bipolárním i monopolárním rameni studie: 6,8 vs 6,2 (IPSS) a 20,5 vs 21,5 ml/s (Qmax) [27].
5.1.6.4 Snášenlivost a bezpečnost
Celková míra nežádoucích účinků byla v případě B-TURP významně nižší než v případě monopolární TURP (28,6 vs 15,5 %) [23]. Mezi hlavní výhody techniky B-TURP patří nižší ztráta krve a snížená incidence pooperační retence krevních sraženin a krevních transfuzí. Doba pooperační katetrizace i hospitalizace byla u bipolární TURP kratší než u monopolární TURP; předpokládá se, že důvodem byl menší rozsah krvácení související s lepšími koagulačními schopnostmi. Pooperační jímací symptomy, zejména dysurie, byly méně časté po B-TURP. Většina těchto výsledků však představovala spíše trendy upřednostňující B-TURP než statisticky významné rozdíly [23].
Syndrom TUR nebyl v souvislosti s B-TURP zaznamenán díky použití fyziologického roztoku jako irigační tekutiny a díky snížené absorpci tekutin během výkonu [23,24]. Několik randomizovaných kontrolovaných studií nasvědčuje tomu, že uretrální striktury jsou častější v případě B-TURP s tím, že k tomuto stavu mohou přispívat větší velikost resektoskopu (27F), typ vratné elektrody a vyšší proudová hustota [22]. Doposud poslední provedené systematické přezkoumání randomizovaných kontrolovaných studií však neodhalilo žádné statisticky významné rozdíly mezi monopolární TURP a bipolární TURP (1,7 vs 2,4 %; p = 0,280) [24]. Nicméně rozsáhlejší stude s větším počtem pacientů a/nebo delší dobou sledování mohou tyto výsledky změnit. Pokud jde o dopad techniky B-TURP na sexuální funkci, bylo zjištěno, že při porovnání B-TURP a monopolární TURP se pooperační retrográdní ejakulace (57 vs 60 %) [24] ani erektilní dysfunkce (v obou případech přibližně 14 %) [23] významně nelišily.
5.1.6.5 Praktické úvahy
B-TURP nabízí lákavou alternativu k monopolární TURP u pacientů se symptomy LUTS doprovázejícími BPO, která vykazuje obdobnou účinnost, avšak nižší morbiditu. Bezpečnost techniky B-TURP navíc poskytuje více času pro odbornou přípravu a zaškolení urologů. Jelikož však stále chybí dostatečné dlouhodobé údaje, není možné vyvodit definitivní závěry, pokud jde o dobu trvání zlepšení a výhody techniky B-TURP v porovnání s monopolární TURP. Volba techniky B-TURP by měla v současné době vycházet z dostupnosti nástrojů pro bipolární TURP, zkušeností chirurga a preferencí pacienta.
5.1.7 Doporučení
Monopolární TURP je aktuálně standardně používanou operační metodou pro léčbu mužů s objemem prostaty 30–80 ml a středně závažnými až závažnými symptomy LUTS doprovázejícími BPO. Monopolární TURP nabízí vyšší míru subjektivního i objektivního zlepšení než medikamentózní nebo minimálně invazivní léčba. Morbidita monopolární TURP je však vyšší než při použití bipolární TURP, léčiv nebo jiných minimálně invazivních postupů. (úroveň důkazu / stupeň doporučení: 1a/A).
Krátkodobé výsledky bipolární TURP jsou srovnatelné s monopolární TURP (úroveň důkazu / stupeň doporučení: 1a/A).
TUIP je operační metodou volby u mužů se symptomy LUTS doprovázejícími BPO a s objemem prostaty < 30 ml bez středního laloku (úroveň důkazu / stupeň doporučení: 1a/A).
5.1.8 Literatura
- Yu X, Elliott SP, Wilt TJ et al. Practice patterns in benign prostatic hyperplasia surgical therapy: the dramatic increase in minimally invasive technologies. J Urol 2008; 180(1): 241–245.
- Elmalik EM, Ibrahim AI, Gahli AM et al. Risk factors in prostatectomy bleeding: preoperative urinary tract infection is the only reversible factor. Eur Urol 2000; 37(2): 199–204.
- Scholz M, Luftenegger W, Harmuth H et al. Single--dose antibiotic prophylaxis in transurethral resection of the prostate: a prospective randomised trial. Br J Urol 1998; 81(6): 827–829.
- Berry A, Barratt A. Prophylactic antibiotic use in transurethral prostatic resection: a meta-analysis J Urol 2002; 167(2 Pt 1): 571–577.
- Qiang W, Jianchen W, MacDonald R et al. Antibiotic prophylaxis for transurethral prostatic resection in men with preoperative urine containing less than 100,000 bacteria per ml: a systematic review J Urol 2005; 173(4): 1175–1181.
- Bootsma A, Laguna Pes M, Geerlings S et al. Antibiotic prophylaxis in urologic procedures: a systematic review. Eur Urol 2008; 54(6): 1270–1286.
- Reich O, Gratzke C, Stief CG. Techniques and long--term results of surgical procedures for BPH. Eur Urol 2006; 49(6): 970–978.
- Thomas AW, Cannon A, Bartlett E et al. The natural history of lower urinary tract dysfunction in men: minimum 10-year urodynamic followup of transurethral resection of prostate for bladder outlet obstruction. J Urol 2005; 174(5): 1887–1891.
- Varkarakis J, Bartsch G, Horninger W. Long-term morbidity and mortality of transurethral prostatectomy: a 10 - year follow-up. Prostate 2004; 58(3): 248–251.
- Madersbacher S, Marberger M. Is transurethral resection of the prostate still justified? Br J Urol 1999; 83(3): 227–237.
- Yang Q, Peters TJ, Donovan JL et al. Transurethral incision compared with transurethral resection of the prostate for bladder outlet obstruction: a systematic review and meta-analysis of randomised controlled trials. J Urol 2001; 165(5): 1526–1532.
- Tkocz M, Prajsner A. Comparison of long-term results of transurethral incision of the prostate with transurethral resection of the prostate, in patients with benign prostatic hypertrophy. Neurourol Urody 2002; 21(2): 112–116.
- Lourenco T, Armstrong N, N’Dow J et al. Systematic review and economic modelling of effectiveness and cost utility of surgical treatments for men with benign prostatic enlargement. Health Technol Assess 2008; 12(35): 1–146.
- Madersbacher S, Lackner J, Brossner C et al. Reoperation, myocardial infarction and mortality after transurethral and open prostatectomy: a nation-wide, long-term analysis of 23,123 cases. Eur Urol 2005; 47(4): 499–504.
- Roos NP, Wennberg JE, Malenka DJ et al. Mortality and reoperation after open and transurethral resection of the prostate for benign prostatic hyperplasia.N Engl J Med 1989; 320(17): 1120–1124.
- Rassweiler J, Teber D, Kuntz R et al. Complications of transurethral resection of the prostate (TURP)-ncidence, management, and prevention. Eur Urol 2006; 50(5): 969–979.
- Hahn RG. Smoking increases the risk of large scale fluid absorption during transurethral prostatic resection. J Urol 2001; 166(1): 162–165.
- Holman CD, Wisniewski ZS, Semmens JB et al. Mortality and prostate cancer risk in 19,598 men after surgery for benign prostatic hyperplasia. BJU Int 1999; 84(1): 37–42.
- Hahn RG, Farahmand BY, Hallin A et al. Incidence of acute myocardial infarction and cause-specific mortality after transurethral treatments of prostatic hypertrophy. Urology 2000; 55(2): 236–240.
- Shalev M, Richter S, Kessler O et al. Long-term incidence of acute myocardial infarction after open and transurethral resection of the prostate for benign prostatic hyperplasia. J Urol 1999; 161(2): 491–493.
- Wasson JH, Reda DJ, Bruskewitz RC et al. A comparison of transurethral surgery with watchful waiting for moderate symptoms of benign prostatic hyperplasia. The Veterans Affairs Cooperative Study Group on Transurethral Resection of the Prostate. New Engl J Med 1995; 332(2): 75–79.
- Rassweiller J, Schlze M, Stock C et al. Bipolar transurethral resection of the prostate – technical modifications and early clinical experience. Minim Invasive Ther Allied Technol 2007; 16(1): 11–21.
- Issa MM. Technological Advances in Transurethral Resection of the Prostate: Bipolar versus Monopolar TURP. J Endourol 2008; 22(8): 1587–1595.
- Mamoulakis C, Trompetter M, de la Rosette J. Bipolar transurethral resection of the prostate: the ‘golden standard’ reclaims its leading position. Curr Opin Urol 2009; 19(1): 26–32.
- Mamoulakis C, Ubbink DT, de la Rosette J. Bipolar versus Monopolar Transurethral Resection of the Prostate: A Systematic Review and Meta-analysis of Randomised Controlled Trials. Eur Urol 2009; 56(5): 798–809.
- Tefekli A, Muslumanoglu AY, Baykal M et al. A hybrid technique using bipolar energy in transurethral prostate surgery: a prospective, randomised comparison. J Urol 2005; 174(4): 1339–1343.
- Autorino R, De Sio M, D’Armiento M. Bipolar plasmakinetic technology for the treatment of symptomatic benign prostatic hyperplasia: evidence beyond marketing hype? BJU Int 2007; 100(5): 983–985.
- Dorflinger T, Jensen FS, Krarup T et al. Transurethral prostatectomy compared with incision of the prostate in the treatment of prostatism caused by small benign prostate glands. Scand J Urol Nephrol 1992; 26(4): 333–338.
- Jahnson S, Dalen M, Gustavsson G et al. Transurethral incision versus resection of the prostate for small to medium benign prostatic hyperplasia. Br J Urol 1998; 81(2): 276–281.
- Riehmann M, Knes JM, Heisey D et al. Transurethral resection versus incision of the prostate: a randomised, prospective study. Urology 1995; 45(5): 768–775.
- Saporta L, Aridogan IA, Erlich N et al. Objective and subjective comparison of transurethral resection, transurethral incision and balloon dilatation of the prostate. A prospective study. Eur Urol 1996; 29(4): 439–445.
- Soonawalla PF, Pardanani DS. Transurethral incision versus transurethral resection of the prostate. A subjective and objective analysis. Br J Urol 1992; 70(2): 174–177.
- Lourenco T, Shaw M, Fraser C et al. The clinical effectiveness of transurethral incision of the prostate: a systematic review of randomised controlled trials. World J Urol 2010; 28(1): 23–32.
5.2 Otevřená prostatektomie
5.2.1 Mechanizmus účinku
Otevřená prostatektomie je nejstarší operační metodou pro léčbu symptomů LUTS doprovázejících BPO. Obstruktivní prostatické adenomy se enukleují ukazovákem buď z vnitřní strany močového měchýře (Freyerův přístup), nebo přes přední stranu prostatické kapsuly (Millinův přístup), což zajistí močení bez obstrukce.
5.2.2 Operační postup
Indikace k operaci: Nejčastější indikací pro operační léčbu jsou obtěžující symptomy LUTS refrakterní na medikamentózní léčbu [1,2]. Za závažné indikace k operaci lze považovat tyto komplikace BPH/BPE/BPO:
- refrakterní močová retence
- recidivující močová infekce
- recidivující hematurie refrakterní na medikamentózní léčbu inhibitory 5-alfa-reduktázy
- renální insuficience z důvodu BPE/BPO
- konkrementy v močovém měchýři
Indikací k operaci může být i zvýšený postmikční reziduální objem. V tomto případě je však velká intraindividuální variabilita a dosud nebyla stanovena horní hranice pro indikaci operační léčby. Faktory, které s největší pravděpodobností předurčují výsledek prostatektomie, zahrnují závažnost LUTS, stupeň obtížnosti symptomů a přítomnost BPO.
Postup: Zavede se transuretrální balonkový katétr a močový měchýř se naplní fyziologickým roztokem. Přístup do močového měchýře nebo k přední straně prostatické kapsuly se získá pomocí incize ve střední čáře nebo pomocí příčné suprapubické incize.
Transvezikální přístup (Freyer): Příčná incize se provádí v přední stěně močového měchýře. Ukazovák se zavede do uretry a vyvíjením tlaku dopředu směrem k symfýze se přeruší sliznice uretry a vymezí se plocha mezi chirurgickou kapsulou a adenomy. Prostatické adenomy se pak prstem tupě oddělí od kapsuly. Zvláštní pozornost je třeba věnovat při oddělování uretry na apexu, aby nedošlo k poranění uretrálního sfinkteru. Hemostatické sutury se provedou v zadních rozích dutiny a na zadním okraji, přičemž je třeba se vyhnout uretrálnímu ústí. Pooperační hemostáze lze dosáhnout pomocí gázových tamponů a/nebo trakcí na velkém balonkovém katétru. Pro dostatečnou drenáž se zavádí transuretrální i suprapubický katétr.
Transkapsulární přístup (Millin): Příčná incize se provádí na přední straně prostatické kapsuly a adenomy se uvolňují tupě nůžkami a ukazovákem. Pozornost je třeba věnovat při oddělování uretry. Mnozí chirurgové provádějí resekci zadní strany hrdla močového měchýře, aby se vyhnuli striktuře hrdla močového měchýře. Prostatická kapsula se po zavedení transuretrálního balonkového katétru pro drenáž uzavře.
Perioperační antibiotika: Známou infekci močových cest je třeba léčit před operací [10,11]. Rutinní profylaxe antibiotiky zůstává kontroverzní. Antibiotika se však doporučují u pacientů, kterým byl katétr zaveden již před operací.
5.2.3 Účinnost
Otevřená prostatektomie je léčbou volby u pacientů s velkou prostatickou žlázou (> 80–100 ml). Související komplikace zahrnují velké konkrementy v močovém měchýři nebo divertikl močového měchýře [4–6]. Tři nedávné randomizované kontrolované studie ukázaly, že enukleace pomocí holmium laseru a fotoselektivní vaporizace prostaty (PVP) přináší u mužů s velkou prostatickou žlázou (> 70, 80 a 100 ml) obdobné výsledky jako otevřená prostatektomie, ovšem s významně nižší mírou výskytu komplikací [7–9].
5.2.3.1 Výsledek léčby
Výsledky studií zabývajících se otevřenou prostatektomií pro léčbu BPH-LUTS nebo BPO jsou shrnuty v tab. 16.
Tab. 2. Výsledky studií otevřené prostatektomie pro léčbu BPH-LUTS nebo BPO. 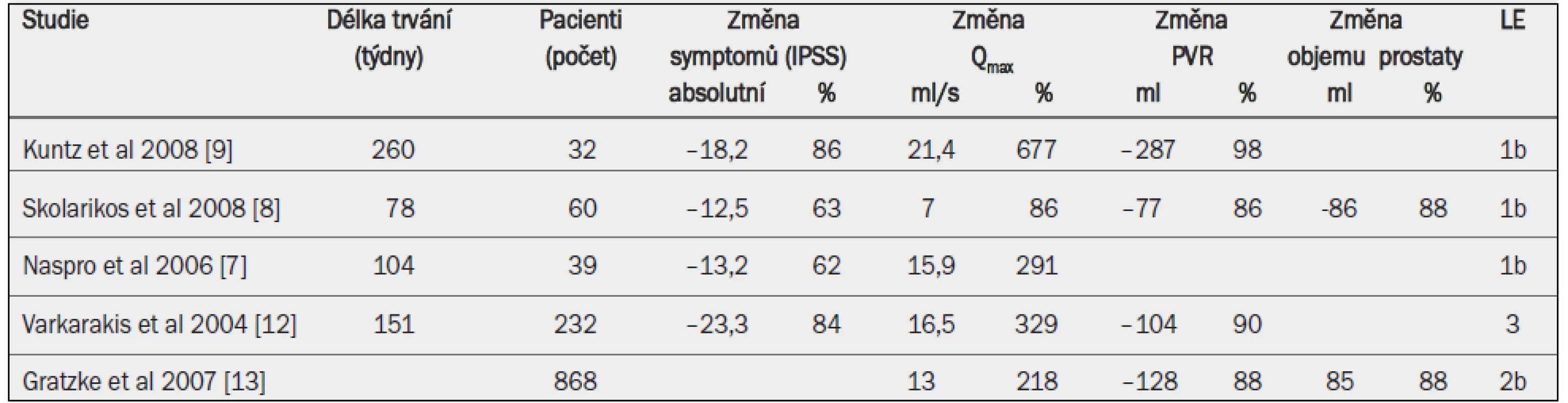
IPSS = mezinárodní skóre prostatických symptomů; PVR = postmikční reziduální objem; Qmax = maximální rychlost průtoku moči (volná uroflowmetrie). LUTS: Otevřená prostatektomie přináší zlepšení symptomů LUTS o 63–86 % a skóre kvality života podle IPSS o 60–87 % [8,9,12].
Uroflowmetrie: Průměrné zvýšení Qmax po otevřené prostatektomii činí 375 % (rozmezí 88–677 %) [8,9,12], což v absolutních číslech znamená +16,5–20,2 ml/s [6,8,9,12].
PVR: Po otevřené prostatektomii je patrné snížení postmikčního reziduálního objemu o 86–98 % [8,9,12].
5.2.3.2 Dlouhodobý výsledek a míra opakování léčby
Otevřená prostatektomie běžně dosahuje příznivého dlouhodobého výsledku. V randomizovaných studiích nebyla v rameni OP zaznamenána nutnost další operace až po dobu pětiletého sledování [8,9,12] (tab. 17).
Tab. 3. Snášenlivost a bezpečnost otevřené prostatektomie. 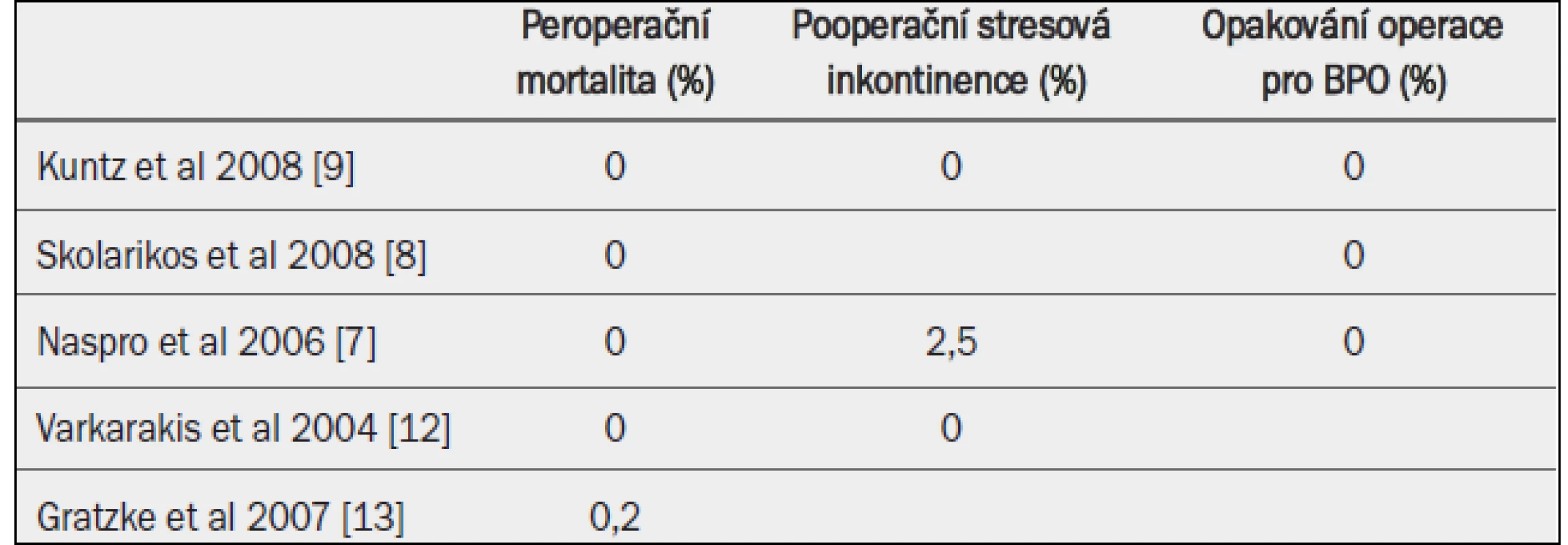
BPO = benigní prostatická obstrukce.
5.2.4 Snášenlivost a bezpečnost
Peroperační a pooperační komplikace: Mortalita po otevřené prostatektomii se v posledních dvou desetiletích významně snížila a v současných studiích dosahuje méně než 0,25 % [13] (tab. 17). Odhadovaná nutnost krevní transfuze činí přibližně 7–14 % [9,12,13].
Dlouhodobé komplikace: Dlouhodobé komplikace zahrnují inkontinenci a kontrakturu hrdla močového měchýře a uretrální strikturu. Riziko vzniku stresové inkontinence je až 10 % [4], zatímco riziko vzniku kontraktury hrdla močového měchýře a uretrální striktury je přibližně 6 % [7–9].
5.2.5 Praktické úvahy
Otevřená prostatektomie je nejinvazivnější, ale zároveň nejúčinnější a nejtrvanlivější metodou léčby symptomů LUTS doprovázejících BPO. Obdobné výsledky, ovšem s nižší morbiditou, přináší pouze enukleace holmium laserem. Nejsou-li k dispozici endourologické nástroje ani holmium laser, zdá se být otevřená prostatektomie léčebnou metodou volby pro muže s prostatou > 80–100 ml a se symptomy LUTS doprovázejícími BPO rezistentními na medikamentózní léčbu. Volba mezi Freyerovým a Millinovým přístupem závisí na preferencích chirurga.
5.2.6 Doporučení
Otevřená prostatektomie je metodou první volby chirurgické léčby u mužů se symptomy LUTS doprovázejícími benigní prostatickou obstrukci a refrakterními na medikamentózní léčbu a u mužů s prostatou o velikosti > 80–100 ml, pokud není k dispozici holmium laser (úroveň důkazu / stupeň doporučení: 1b/A).
5.2.7 Literatura
- Borboroglu PG, Kane CJ, Ward JF et al. Immediate and postoperative complications of transurethral prostatectomy in the 1990s. J Urol 1999; 162(4): 1307–1310.
- Pickard R, Emberton M, Neal DE. The management of men with acute urinary retention. National Prostatectomy Audit Steering Group. Br J Urol 1998; 81(5): 712–720.
- Bruskewitz RC, Reda DJ, Wasson JH et al. Testing to predict outcome after transurethral resection of the prostate. J Urol 1997; 157(4): 1304–1308.
- Tubaro A, Carter S, Hind A et al. A prospective study of the safety and efficacy of suprapubic transvesical prostatectomy in patients with benign prostatic hyperplasia. J Urol 2001; 166(1): 172–176.
- Mearini E, Marzi M, Mearini L et al. Open prostatectomy in benign prostatic hyperplasia: 10-year experience in Italy. Eur Urol 1998; 34(6): 480–485.
- Serretta V, Morgia G, Fondacaro L et al. Open prostatectomy for benign prostatic enlargement in southern Europe in the late 1990s: a contemporary series of 1800 interventions. Urology 2002; 60(4): 623–627.
- Naspro R, Suardi N, Salonia A et al. Holmium laser enucleation of the prostate versus open prostatectomy for prostates >70 g: 24-month follow-up. Eur Urol 2006; 50(3): 563–568.
- Skolarikos A, Papachristou C, Athanasiadis G et al. Eighteen-month results of a randomised prospective study comparing transurethral photoselective vaporisation with transvesical open enucleation for prostatic adenomas greater than 80 cc. J Endourol 2008; 22(10): 2333–2340.
- Kuntz RM, Lehrich K, Ahyai SA. Holmium laser enucleation of the prostate versus open prostatectomy for prostates greater than 100 grams: 5-year follow-up results of a randomised clinical trial. Eur Urol 2008; 53(1): 160–166.
- ElMalik EM, Ibrahim AI, Gahli AM et al. Risk factors in prostatectomy bleeding: preoperative urinary infection is the only reversible factor. Eur Urol 2000; 37(2): 199–204.
- Scholz M, Luftenegger W, Harmuth H et al. Single-dose antibiotic prophylaxis in transurethral resection of the prostate: a prospective randomised trial. Br J Urol 1998; 81(6): 827–829.
- Varkarakis I, Kyriakakis Z, Delis A et al. Long-term results of open transvesical prostatectomy from a contemporary series of patients. Urology 2004; 64(2): 306–310.
- Gratzke C, Schlenker B, Seitz M et al. Complications and early postoperative outcome after open prostatectomy in patients with benign prostatic enlargement: results of a prospective multicenter study. J Urol 2007; 177(4): 1419–1422.
5.3 Transuretrální terapie pomocí mikrovln (TUMT)
5.3.1 Mechanizmus účinku
Základním principem mikrovlnné termoterapie prostaty je vysílání mikrovlnného záření prostřednictvím intrauretrální antény, kterou se do prostaty přivádí teplo. K destrukci tkáně dochází při jejím zahřátí na teplotu přesahující cytotoxické prahové hodnoty (> 45 °C) (koagulační nekróza). Teplo vytvářejí zejména elektrické dipóly (molekuly vody) oscilující v mikrovlnném poli a nosiče elektrického náboje (ionty), které se v mikrovlnném poli pohybují dozadu a dopředu. Má se rovněž za to, že teplo vytvářené technikou TUMT způsobuje také apoptózu a denervaci alfa receptorů, čímž se snižuje tonus hladkého svalstva prostatické uretry.
5.3.2 Operační postup
Transuretrální terapie pomocí mikrovln je registrovanou ochrannou známkou společnosti Technomed Medical Systems, která je průkopníkem mikrovlnné termoterapie. V současné době patří mezi hlavní zařízení v oblasti mikrovlnné termoterapie tato: Prostatron™ (Urologix, Minneapolis, MN, USA), Targis™ (Urologix, Minneapolis, MN, USA), CoreTherm™ (ProstaLund, Lund, Švédsko) a TMx-2000™ (TherMatrx Inc, Northbrook, ILL, USA). Nejvíce údajů o termoterapii bylo doposud zveřejněno v souvislosti se zařízením Prostatron.
Koncepčně jsou zařízení pro TUMT založena na obdobném principu přivádění mikrovlnné energie do prostaty, vždy za pomocí nějakého typu systému zpětné vazby (feedback). Všechna zařízení pro TUMT se skládají z léčebného modulu, který obsahuje mikrovlnný generátor se systémem měření teploty a chladicím systémem. Hlavní rozdíl mezi zařízeními pro mikrovlnnou terapii spočívá v designu uretrálního aplikátoru. Aplikátor tvoří mikrovlnný katétr spojený s modulem, který se zavádí do prostatické uretry. Rozdíly ve vlastnostech aplikátorů mají významný vliv na tepelný profil [1]. Další méně důležité rozdíly mezi zařízeními pro TUMT spočívají v konstrukci katétru, chladicích systémech, době léčby a sledování účinků techniky TUMT [2].
5.3.3 Účinnost
5.3.3.1 Klinické výsledky
Bylo provedeno systematické přezkoumání všech dostupných randomizovaných kontrolovaných studií TUMT, jehož snahou bylo posoudit terapeutickou účinnost (tab. 18) [3] různých zařízení a různého softwaru pro TUMT, včetně zařízení Prostatron (Prostatsoft 2.0 a 2.5) a ProstaLund Feedback. Pro rozdíly mezi různými metodami léčby (agregované údaje) byly vypočteny vážené průměrné hodnoty s 95% intervalem spolehlivosti. Přezkoumáním bylo zjištěno, že s ohledem na zmírňování symptomů LUTS je technika TUMT o něco méně účinná než transuretrální resekce prostaty (TURP). Skóre symptomů (agregované údaje) se u mužů, kteří podstoupili TUMT, za 12 měsíců snížilo o 65 % v porovnání se 77 % u mužů, kteří podstoupili TURP, což představuje vážený průměrný rozdíl –1,83 ve prospěch TURP. Technikou TURP bylo dosaženo výraznějšího zlepšení Qmax (119 %) než technikou TUMT (70 %), přičemž vážený průměrný rozdíl činil 5,44 ml/s ve prospěch TURP [3].
Tab. 4. Účinnost techniky TUMT. Absolutní a relativní změny v porovnání s výchozím stavem jsou uvedeny pro symptomy (IPSS), maximální rychlost průtoku moči (Qmax), postmikční reziduum (PVR) a objem prostaty (Pvol). 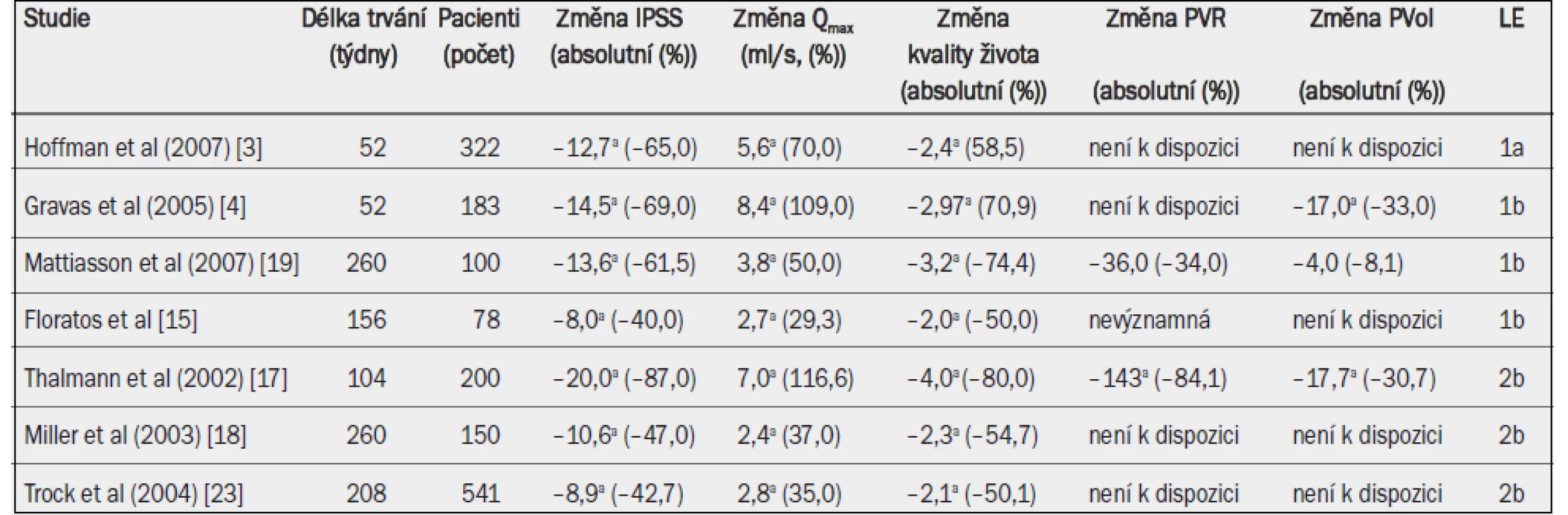
a = významná v porovnání s výchozím stavem (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení). Obdobně analýza agregovaných údajů tří studií (dvou randomizovaných kontrolovaných studií a jedné otevřené studie) TUMT s použitím technologie ProstaLund Feedback (PLFT) s dobou sledování 12 měsíců ukázala, že míra odpovědi na léčbu činila 85,3 % ve skupině PLFT a 85,9 % ve skupině TURP [4]. Agregované údaje IPSS navíc naznačily subjektivní neinferiorní zlepšení při použití PLFT v porovnání s TURP [4]. Jednostranná analýza s 95% intervalem spolehlivosti však ukázala, že neinferiorita PLFT v porovnání s TURP nedosahuje předem stanovené úrovně, ačkoli se zdálo, že PLFT i TURP hodnotu Qmax významně zlepšují.
Dříve se mělo za to, že retence moči je kontraindikací TUMT. Současné studie (úroveň důkazů 2b) uvádějí 80–93% míru úspěšnosti TUMT definovanou jako procento pacientů, u nichž se obnovila schopnost spontánně močit [5–7]. Tyto studie však zahrnovaly pouze krátkodobé sledování (≤ 12 měsíců), což znesnadňuje odhad trvání účinku léčby technikou TUMT u pacientů s retencí. Ve studii s delší dobou sledování až pět let představo-valo selhání léčby ve skupině pacientů s retencí 37,8 %, přičemž kumulativní riziko činilo 58,8 % po pěti letech [8]. Jedna randomizovaná kontrolovaná stu-die porovnávala techniku TUMT s podáváním alfa-1 blokátoru terazosin [9]. Po 18 měsících sledování byla míra selhání léčby u pacientů, kterým byl podáván terazosin (41 %), významně vyšší než u pacientů, kteří podstoupili TUMT (5,9 %), přičemž technikou TUMT bylo navíc dosaženo výraznějšího zlepšení IPSS a Qmax [10].
5.3.3.2 Trvání účinku léčby
Pokud jde o trvání účinku léčby, dosahuje nízkoenergetická TUMT neuspokojivých výsledků. Některé studie uvádějí míru opakování léčby po nízkoenergetické TUMT až 84,4 % po pěti letech [11–14]; po vysokoenergetické TUMT uvádějí jiné studie míru opakování léčby 19,8–29,3 %, ačkoli tyto studie se vyznačovaly kratší průměrnou dobou sledování 30–60 měsíců [15–18]. Míra opakování léčby z důvodu jejího selhání byla odhadována také na základě systematického přezkoumání randomizovaných studií TUMT [3]. Studie zahrnovaly různé doby sledování a míra opakování léčby byla vyjádřena jako počet případů na osobu a rok sledování. Míra opakování léčby činila 0,075/100 osoboroků u pacientů léčených technikou TUMT a 0,010/100 osoboroků pro TURP.
Prospektivní randomizovaná multicentrická studie však po pěti letech dosáhla u techniky TUMT srovnatelných klinických výsledků s technikou TURP. Tato studie porovnávala TUMT (PLFT; zařízení Core-Therm) a TURP [19]. Mezi oběma skupinami léčby nebyly po pěti letech zjištěny žádné statisticky významné rozdíly Qmax a IPSS. Ve skupině TUMT byla další léčba nutná v 10 % případů, zatímco v rameni TURP ve 4,3 % případů. Tyto údaje naznačují, že po pěti letech jsou klinické výsledky dosažené technikou PLFT-TUMT srovnatelné s výsledky TURP. Je třeba uvést, že většina studií zkoumajících trvání účinku léčby vykazuje vysoké procento pacientů, kteří léčbu ukončili; v této studii byla po 4–5 letech analyzována méně než polovina původní skupiny léčených pacientů. Navíc pacienti, kteří ve studii zůstali, pravděpodobně reprezentovali nejlepší údaje (pacienti reagující na léčbu).
5.3.4 Snášenlivost a bezpečnost
Léčba je dobře snášena, ačkoli většina pacientů pociťuje dyskomfort v perineální oblasti a močovou urgenci a před terapií nebo během ní je nutné aplikovat analgetika. Byly zveřejněny agregované údaje o morbiditě vyplývající ze studií, které porovnávaly TUMT a TURP [3,4,20]. Doba katetrizace, incidence dysurie/urgence a močové retence byly významně nižší u TURP, zatímco nutnost hospitalizace, incidence hematurie, retence krevních sraženin, transfuzí, syndromu transuretrální resekce (TUR) a uretrálních striktur byly významně nižší u TUMT. V systematickém přezkoumání randomizovaných studií [3] byla odhadnuta míra opakování léčby z důvodu striktur během následného sledování, přičemž tato míra byla vyjádřena jako počet případů na osobu a rok sledování. U pacientů, kteří podstoupili TURP (5,85/100 osoboroků), existovala větší pravděpodobnost nutného opakování operační léčby z důvodu striktury (meatu, uretry nebo hrdla močového měchýře) než u pacientů, kteří podstoupili TUMT (0,63/ /100 osoboroků). Agregované údaje ukázaly, že technika TUMT má menší dopad na sexuální funkci (erektilní dysfunkce, retrográdní ejakulace) než TURP [3,4,20].
5.3.5 Praktické úvahy
Endoskopie má zásadní význam, neboť je důležité určit přítomnost izolovaného zvětšeného středního laloku nebo nedostatečnou délku prostatické uretry. Uváděná nízká morbidita a absence nutnosti anestezie (spinální nebo celkové) činí z techniky TUMT skutečně ambulantní výkon, který je skvělou příležitostí pro starší pacienty s komorbiditami, u nichž je operace velkým rizikem a kteří tedy nejsou vhodnými kandidáty pro invazivní léčbu [21]. Mezi nezávislé výchozí parametry predikující nepříznivý výsledek patří pokročilý věk pacienta, malý objem prostaty, mírná až středně závažná obstrukce výtoku z močového měchýře a nízké hladiny energie aplikované během léčby [22]. Je však třeba mít na paměti, že prediktivní faktor pro určitý přístroj se nemusí nezbytně vztahovat na další přístroje.
5.3.6 Doporučení
Transuretrální terapie pomocí mikrovln dosahuje zlepšení symptomů srovnatelného s technikou TURP, ale je spojena s nižší morbiditou a méně výrazným zlepšením rychlosti průtoku (úroveň důkazu / / stupeň doporučení: 1a/A).
Trvání účinku léčby je ve prospěch transuretrální resekce prostaty s nižší mírou opakování léčby v porovnání s transuretrální terapií pomocí mikrovln (úroveň důkazu / stupeň doporučení: 1a/A).
5.3.7 Literatura
- Bolmsjo M, Wagrell L, Hallin A et al. The heat is on – but how? A comparison of TUMT devices. Br J Urol 1996; 78(4): 564–572.
- Walmsley K, Kaplan SA. Transurethral Microwave Thermotherapy for Benign Prostatic Hyperplasia: Separating truth from marketing hype. J Urol 2004; 172 (4 Pt 1): 1249–1255.
- Hoffman RM, Monga M, Elliot S et al. Microwave thermotherapy for benign prostatic hyperplasia. Cochrane Database Syst Rev 2007 Oct; (4): CD004135.
- Gravas S, Laguna P, Ehrnebo M et al. Seeking for evidence that cell kill guided thermotherapy gives results not inferior to transurethral resection of prostate: results of a pooled analysis of 3 studies on feedback transurethral microwave thermotherapy. J Urol 2005; 174(3): 1002–1006.
- Schelin S. Microwave thermotherapy in patients with benign prostatic hyperplasia and chronic urinary retention. Eur Urol 2001; 39(4): 400–404.
- Naqvi SA, Rizvi SA, Hasan AS. High-energy microwave thermotherapy in patients in urinary retention. J Endourol 2000; 14(8): 677–681.
- Kellner DS, Armenakas NA, Brodherson M et al. Efficacy of high-energy transurethral microwave thermotherapy in alleviating medically refractory urinary retention due to benign prostatic hyperplasia. Urology 2004; 64(4): 703–706.
- Gravas S, Laguna P, Kiemeney LA et al. Durability of 30 minutes high-energy transurethral microwave therapy for the treatment of BPH: a study of 213 patients with and without urinary retention. Urology 2007; 69(5): 854–858.
- Djavan B, Roehrborn CG, Shariat S et al. Prospective randomised comparison of high energy transurethral microwave thermotherapy versus a-blocker treatment of patients with benign prostatic hyperplasia. J Urol 1999; 161(1): 139–143.
- Djavan B, Seitz C, Roehrborn CG et al. Targeted transurethral microwave thermotherapy versus alpha-blockade in benign prostatic hyperplasia: outcomes at 18 months. Urology 2001; 57(1): 66–70.
- Keijzers CB, Francisca EAE, D’Ancona FC, et al. Long-term results of lower energy TUMT. J Urol 1998 Jun; 159(6): 1966–1973.
- Tsai YS, Lin JSN, Tong YC et al. Transurethral microwave thermotherapy for symptomatic benign prostatic hyperplasia: Long term durability with Prostcare. Eur Urol 2001; 39(6): 688–692.
- Terada N, Aoki Y, Ichioka K et al. Microwave thermotherapy for benign prostatic hyperplasia with the Dornier Urowave: response durability and variables potentially predicting response. Urology 2001; 57(4): 701–706.
- Ekstrand V, Westermark S, Wiksell H et al. Long--term clinical outcome of transurethral microwave thermotherapy (TUMT) 1991-1999 at Karolinska Hospital, Sweden. Scand J Urol Nephrol 2002; 36(2): 113–118.
- Floratos DL, Kiemeney LA, Rossi C et al. Long-term followup of randomised transurethral microwave thermotherapy versus transurethral prostatic resection study. J Urol 2001; 165(5): 1533–1538.
- D’Ancona FC, Francisca EA, Witjes WP et al. Transurethral resection of the prostate vs high-energy thermotherapy of the prostate in patients with benign prostatic hyperplasia: long-term results. Br J Urol 1998; 81(2): 259–264.
- Thalmann GN, Mattei A, Treuthardt C et al. Transurethral microwave therapy in 200 patients with a minimum followup of 2 years: urodynamic and clinical results. J Urol 2002; 167(6): 2496–2501.
- Miller PD, Kastner C, Ramsey EW et al. Cooled thermotherapy for the treatment of benign prostatic hyperplasia: durability of results obtained with the Targis System. Urology 2003; 61(6): 1160–1164.
- Mattiasson A, Wagrell L, Schelin S et al. Five-year follow-up of feedback microwave thermotherapy versus TURP for clinical BPH: a prospective randomised multicenter study. Urology 2007; 69(1): 91–96.
- de la Rosette JJ, Laguna MP, Gravas S et al. Transurethral Microwave Thermotherapy: The Gold Standard for Minimally Invasive Therapies or Patients with Benign Prostatic Hyperplasia? J Endourol 2003; 17(4): 245–251.
- D’Ancona FC, van der Bij AK, Francisca EA et al. The results of high energy transurethral microwave thermotherapy in patients categorized according to the American Society of Anaesthiologists operative risk classification (ASA). Urology 1999; 53(2): 322–328.
- D’Ancona FC, Francisca EAE, Hendriks JC et al. High energy transurethral thermotherapy in the treatment of benign prostatic hyperplasia: criteria to predict treatment outcome. Prostate Cancer Prostatic Dis 1999; 2(2): 98–105.
- Trock BJ, Brotzman M, Utz WJ et al. Long-term pooled analysis of multicenter studies of cooled thermotherapy for benign prostatic hyperplasia results at three months through four years. Urology 2004; 63(4): 716–721.
- Horasanli K, Silay MS, Altay B et al. Photoselective potassium titanyl phosphate (KTP) laser vaporisation versus transurethral resection of the prostate for prostates larger than 70 mL: a shortterm prospective randomised trial. Urology 2008; 71(2): 247–251.
5.4 Transuretrální ablace prostaty pomocí jehly (TUNA™)
5.4.1 Mechanizmus účinku
Technika TUNA™ funguje na principu koagulační nekrózy v přechodové zóně prostaty. Následkem maturace jizev může docházet ke zmenšování objemu přechodové zóny, a tedy ke zmenšování BPO. Může se projevit i dosud málo prozkoumaný neuromodulační efekt.
5.4.2 Operační postup
Zařízení TUNA™ přenáší radiofrekvenční energii o nízké intenzitě do prostaty prostřednictvím jehel transuretrálně zavedených do parenchymu prostaty. Jehly jsou s výjimkou špičky izolovány tak, aby se energie přenášela pouze do parenchymu prostaty, a nikoli do uretry. Jehly se pomocí úchytu nasadí na standardní cystoskop za přímé zrakové kontroly. TUNA™ se provádí v anestezii (lokální nebo celkové) nebo v sedaci.
5.4.3 Účinnost
Několik nerandomizovaných klinických studií zdokumentovalo klinickou účinnost techniky TUNA™ s celkem shodnými výsledky [3–7]. Zlepšení symptomů se pohybovalo v rozmezí 40–70 %. Zlepšení Qmax se u pacientů bez retence pohybuje v širokém rozmezí 26–121 %. Nedávná studie zahrnující 188 pacientů sledovaných po dobu pěti let prokázala zlepšení symptomů u 58 % pacientů a zlepšení rychlosti průtoku u 41 %. Avšak 21,2 % pacientů vyžadovalo další léčbu [8].
5.4.3.1 Randomizované klinické studie
TUNA™ byla porovnávána s technikou TURP v randomizovaných studiích [8–11] s různou dobou sledování. Tyto studie zjistily, že TUNA™ i TURP vedou ke zlepšení symptomů. Použitím techniky TURP však bylo dosaženo výraznějšího zlepšení symptomů a lepší kvality života než při použití techniky TUNA™ a rovněž Qmax bylo významně lepší po TURP než po TUNA™(tab. 19). Podrobnější srovnání mezi technikami TUNA™ a TURP lze najít v některých vysoce kvalitních a komplexních systematických přezkoumáních a metaanalýzách [12,13].
Tab. 5. Shrnutí důkazů 1. úrovně (LE) (TUNA™ vs TURP) [12]. ![Shrnutí důkazů 1. úrovně (LE) (TUNA™ vs TURP) [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6883b1fb9ea2eed7a3f02725e05d832e.png)
IPSS = mezinárodní skóre prostatických symptomů; Qmax = maximální rychlost průtoku moči; PVR = postmikční reziduum; a = TURP významně lepší v porovnání s TUNA™. 5.4.3.2 Vliv na obstrukci výtoku z močového měchýře
Vliv techniky TUNA™ na BPO byl hodnocen v sedmi klinických studiích [14,15], které prokázaly statisticky významné snížení maximálního tlaku detruzoru nebo tlaku detruzoru při Qmax, ačkoli u řady pacientů obstrukce přetrvávala i po terapii TUNA™.
Neexistuje žádný přesvědčivý důkaz, že velikost prostaty se po TUNA™ významně zmenší [6]. Nedávné studie naznačily, že pro hodnocení účinků léčby technikou TUNA™ lze použít magnetickou rezonanci využívající gadolinium jako kontrastní látku [16].
5.4.3.3 Trvání účinku léčby
Jelikož většina studií byla krátko - až střednědobých, objevily se obavy ohledně trvání účinku léčby. Dokonce i v krátkodobém horizontu (12 měsíců) vyžaduje až 20 % pacientů léčených technikou TUNA™ další léčbu technikou TURP [1]. Nedávná francouzská studie uváděla míru selhání (zahrnující opakování léčby) až 50 % za období 20 měsíců [17].
5.4.4 Snášenlivost a bezpečnost
TUNA™ se obvykle provádí ambulantně v lokální anestezii, ačkoli někdy může být nutná intravenózní sedace [1]. Pooperační retence moči postihuje 13,3–41,6 % pacientů a trvá v průměru 1–3 dny; během jednoho týdne je u 90–95 % pacientů možné odstranit katétr [1]. Běžné jsou iritační mikční symptomy, které přetrvávají po dobu 4–6 týdnů [2]. Stav kontinence není ovlivněn.
5.4.5 Praktické úvahy
Pro výběr pacientů neexistuje mnoho kri-térií. TUNA™ však není vhodnou technikou pro pacienty s objemem prostaty > 75 ml ani pro pacienty s izolovanou obstrukcí hrdla močového měchýře. Jelikož technikou TUNA™ nelze účinně léčit střední laloky, není jasné, zda budou muži s významnými středními laloky ve zveřejněných studiích pociťovat zlepšení. Existuje anekdotický důkaz pro TUNA™ u mužů užívajících aspirin a antikoagulancia. Techniku TUNA™ lze provádět ambulantně a je spojena s méně vedlejšími účinky než TURP (např. krvácení, erektilní dysfunkce, močová inkontinence). Přetrvávají však obavy o trvání účinku dosahovaného při léčbě technikou TUNA™.
5.4.6. Doporučení
Transuretrální ablace prostaty jehlou™ je alternativou k transuretrální resekci prostaty pro pacienty, kteří chtějí oddálit nebo se vyhnout komplikacím spojeným s transuretrální resekcí prostaty. Pacienti by však měli být informováni o vysoké míře opakování léčby a o méně výrazném zlepšení symptomů a kvality života (úroveň důkazu / / stupeň doporučení: 1a/A).
5.4.7 Literatura
- Chapple CR, Issa MM, Woo H. Transurethral needle ablation (TUNA). A critical review of radiofrequency thermal therapy in the management of benign prostatic hyperplasia. Eur Urol 1999; 35(2): 119–128.
- Schatzl G, Madersbacher S, Lang T et al. The early postoperative morbidity of transurethral resection of the prostate and of four minimally invasive treatment alternatives. J Urol 1997; 158(1): 105–110.
- Ramon J, Lynch TH, Eardley I et al. Transurethral needle ablation of the prostate for the treatment of benign prostatic hyperplasia: a collaborative multicentre study. Br J Urol 1997; 80(1): 128–134.
- Roehrborn CG, Issa MM, Bruskewitz RC et al. Transurethral needle ablation for benign prostatic hyperplasia: 12-month results of a prospective, multicenter US study. Urology 1998; 51(3): 415–421.
- Schulman CC, Zlotta AR. Transurethral needle ablation of the prostate for treatment of benign prostatic hyperplasia: early clinical experience. Urology 1995; 45(1): 28–33.
- Minardi D, Garafolo F, Yehia M et al. Pressure-flow studies in men with benign prostatic hypertrophy before and after treatment with transurethral needle ablation. Urol Int 2001; 66(2): 89–93.
- Zlotta AR, Giannakopoulos X, Maehlum O et al. Long-term evaluation of transurethral needle ablation of the prostate (TUNA) for treatment of symptomatic benign prostatic hyperplasia: clinical outcome up to five years from three centers. Eur Urol. 2003; 44(1): 89–93.
- Bruskewitz R, Issa MM, Roehrborn CG et al. A prospective randomised 1-year clinical trial comparing transurethral needle ablation to transurethral resection of the prostate for the treatment of symptomatic benign prostatic hyperplasia. J Urol 1998; 159(5): 1588–1593.
- Chandrasekar P, Virdi JS, Kapasi F. Transurethral needle ablation of the prostate(TUNA) in the treatment of benign prostatic hyperplasia; a prospective, randomised study, long term results. J Urol 2003; 169: s468.
- Cimentepe E, Unsal A, Saglam R. Randomised clinical trial comparing transurethral needle ablation with transurethral resection of the prostate for the treatment of benign prostatic hyperplasia: results at 18 months. J Endourol 2003; 17(2): 103–107.
- Hill B, Belville W, Bruskewitz R et al. Transurethral needle ablation versus transurethral resection of the prostate for the treatment of symptomatic benign prostatic hyperplasia: 5-year results of a prospective, randomised, multicenter clinical trial. J Urol 2004; 171 (6 Pt 1): 2336–2340.
- Bouza C, Lopez T, Magro A et al. Systematic review and meta-analysis of of transurethral needle ablation in symptomatic benign prostatic hyperplasia. MBC Urology 2006; 6 : 14.
- Lourenco T, Armstrong N, N‘Dow J et al. Systematic review and economic modelling of effectiveness and cost utility of surgical treatments for men with benign prostatic enlargement. Health Technol Assess 2008; 12(35): iii, ix-x, 1-146, 169–515.
- Campo B, Bergamaschi F, Corrada P et al. Transurethral needle ablation (TUNA) of the prostate: a clinical and urodynamic evaluation. Urology 1997; 49(6): 847–850.
- Steele GS, Sleep DJ. Transurethral needle ablation of the prostate: a urodynamic based study with 2-year follow-up. J Urol 1997; 158(5): 1834–1838.
- Mynderse LA, Larson B, Huidobro C et al. Characterizing TUNA ablative treatments of the prostate for benign hyperplasia with gadolinium-enhanced magnetic resonance imaging. J Endourol 2007; 21(11): 1361–1366.
- Benoist N, Bigot P, Colombel P et al. Tuna: Clinical retrospective study addressing mid-term outcomes. Prog Urol 2009; 19(1): 54–59.
5.5 Léčba prostaty laserem
5.5.1 Enukleace prostaty pomocí holmium laseru (HoLEP) a resekce prostaty pomocí holmium laseru (HoLRP)
5.5.1.1 Mechanizmus účinku
Holmium-YAG (yttrium-aluminium-granát) laser (Ho:YAG laser; vlnová délka 2 140 nm) je pulzní pevný laser, který se v urologii používá při řadě endourologických výkonů na měkkých tkáních a při dezintegraci močových konkrementů [1]. Vlnová délka Ho:YAG laseru je významně absorbována ve vodě. To znamená, že zóna koagulace tkáně a s tím související nekróza tkáně je omezena na 3–4 mm, což postačuje k dosažení adekvátní hemostázy [2]. Maximální dosažená energie způsobuje intenzivní, netepelnou, lokalizovanou destrukci tkáně, a dává tak možnost přesné a účinné incize v prostatické tkáni. Resekce se zpravidla provádí u prostat menších než 60 ml, zatímco enukleace se provádíu větších prostatických žláz.
5.5.1.2 Operační postup
Vybavení pro tuto techniku zahrnuje křemenné vlákno (550 µm) s vyzařováním energie na jeho konci a Ho:YAG laser o výkonu 80 W. Dále je zapotřebí průtokový resektoskop s pracovní částí a jako irigační tekutina se používá fyziologický roztok. Základním principem techniky HoLRP je retrográdní resekce prostaty a fragmentace resekované tkáně uvnitř močového měchýře, aby bylo možné její následné odstranění operačním kanálem resektoskopu [2,3]. Významné zlepšení představovalo zavedení enukleace holmium laserem (HoLEP). Stejně jako při otevřené prostatektomii jsou prostatické laloky zcela enukleovány a zatlačeny do močového měchýře. Následně se fragmentují a odstraňují morcelátorem [8].
5.5.1.3 Účinnost
Gilling et al [4] publikovali výsledky prospektivní randomizované kontrolo-vané studie porovnávající techniky TURP a HoLRP. Doposud bylo do studie zařazeno 120 pacientů s BPO potvrzenou urodynamickým vyšetřením (stupeň ≥ 2 podle Schäfera) a prostatou o velikosti < 100 ml (tab. 20). Předběžná analýza odhalila výrazně delší průměrnou dobu resekce (42,1 vs 25,8 min) u pacientů léčených technikou HoLRP, zatímco zlepšení symptomů a urodynamických parametrů bylo v obou léčebných skupinách rovnocenné. V roce 2004 byly zveřejněny dlouhodobé výsledky s minimální dobou sledování čtyři roky [7], které ukázaly, že po 48 měsících není mezi HoLRP a TURP v urodynamických parametrech žádný rozdíl.
Tab. 6. Pooperační výsledky resekce holmium laserem (HoLRP) nebo enukleace holmium laserem (HoLEP) vs transuretrální resekce prostaty (TURP), otevřená prostatektomie (OP) a vaporizace pomocí laseru Greenlight (KTP) vs TURP. Absolutní a relativní změny v porovnání s výchozím stavem pro symptomy (AUA-SI/IPSS), maximální rychlost průtoku moči (Qmax), postmikční reziduum (PVR) a objem prostaty. 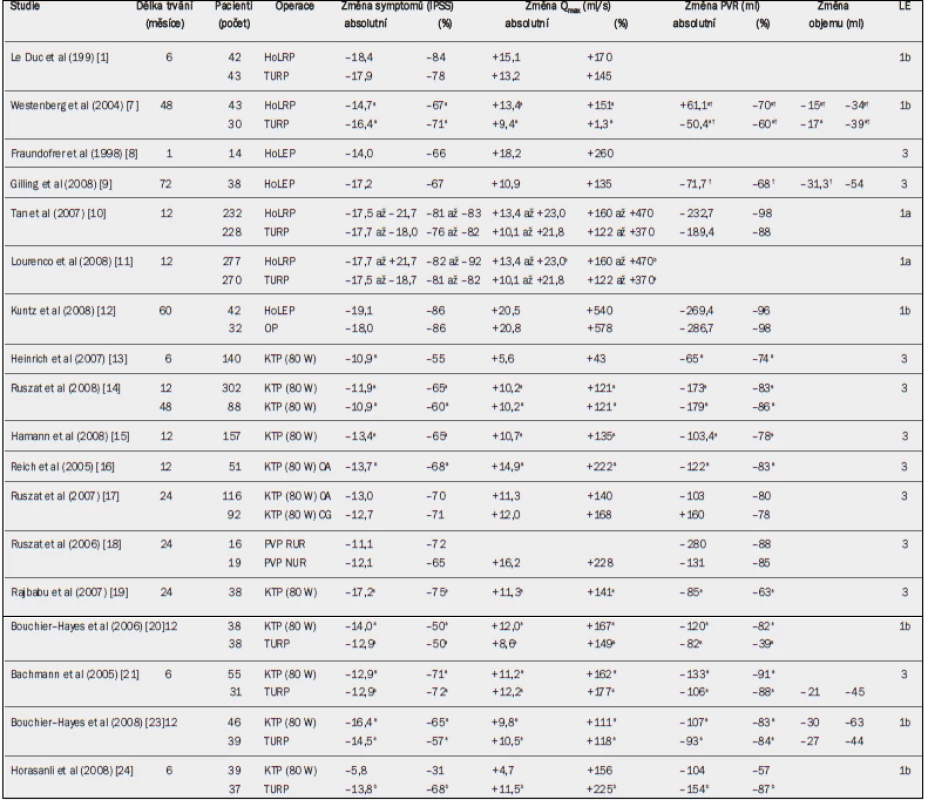
CG = kontrolní skupina; RUR = refrakterní močová retence; PA = perorální antikoagulace; NUR = bez močové retence; a = významná v porovnání s výchozím stavem (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); b =významný rozdíl ve prospěch uvedené léčby; † údaje za 6 měsíců. Gilling et al [9] zveřejnili dlouhodobé údaje s průměrnou dobou sledování 6,1 let, které nasvědčují tomu, že účinky léčby HoLEP jsou trvalé a většina pacientů je s výkonem spokojena. Dvě metaanalýzy, které analyzovaly dostupné randomizované kontrolované studie porovnávající HoLEP a TURP [10,11], uváděly v případě HoLEP výrazně delší operační dobu (tab. 20). Zlepšení symptomů bylo srovnatelné, ale hodnota Qmax po 12 měsících byla výrazně lepší po HoLEP [11]. U prostat > 100 ml se technika HoLEP ukázala být pro zlepšení mikce stejně účinnou jako otevřená prostatektomie, přičemž míra opakování operace s dobou sledování pět let byla stejně nízká [12].
5.5.1.4 Snášenlivost a bezpečnost
Žádné významné operační komplikace nejsou popsány; tato technika však patří k chirurgickým výkonům, které vyžadují značnou endoskopickou zručnost. Daný operační výkon nemá žádná zvláštní omezení. Touto technikou je možné bezpečně léčit pacienty užívající antikoagulační preparáty i pacienty s močovou retencí [6]. Nejčastější pooperační komplikací byla dysurie, která se vyskytla u přibližně 10 % pacientů [2,4,5]. V porovnání s technikou TURP vykazuje HoLRP výrazně kratší dobu katetrizace (20,0 vs 37,2 hod), kratší dobu hospitalizace (26,4 vs 47,4 hod) [4] a menší pooperační morbiditu [7]. Potence, kontinence, skóre symptomů a závažná morbidita po 48 hod byly stejné u obou technik: HoLRP i TURP [7]. Retrográdní ejakulace se vyskytla u 75–80 % pacientů; není popsán žádný případ pooperační impotence [2]. Obě metaanalýzy uvádějí, že použití techniky HoLEP má v porovnání s technikou TURP za následek výrazně kratší dobu katetrizace a hospitalizace, nižší ztrátu krve a méně krevních transfuzí, ale delší operační dobu [10,11].
5.5.2 Vaporizace prostaty pomocí laseru GreenLight 532 nm
5.5.2.1 Mechanizmus účinku
Vaporizace prostatické tkáně se dosahuje prudkým zvýšením teploty tkáně z 50 °C na 100 °C po aplikaci laserové energie. Prudkým zvýšením teploty tkáně se vytvářejí intracelulární vakuoly (bubliny) a následně dochází ke zvýšení tlaku uvnitř buňky. Jakmile tlak v buňce přesáhne tlak slučitelný s integritou buňky, vakuoly se uvolní, což lze vidět během výkonu. Díky způsobu interakce mezi tkání a oxyhemoglobinem se laserová vaporizace zvyšuje v rozmezí vlnové délky 500–580 nm. Kvůli vyzařovanému zelenému světlu (X = 532 nm) se tento laserový výkon nazývá vaporizace pomocí laseru „Greenlight“ (zelené světlo).
Při popisu uplatňovaného typu laserové vaporizace je důležité uvést vlnovou délku nebo krystal použité pro generování laserové energie. Tkáňová interakce vyvolaná laserovou energií se totiž liší podle vlnové délky, použité energie, struktury vlákna a vlastností tkáně. To také znamená, že klinické výsledky různých vlnových délek nejsou srovnatelné.
5.5.2.2 Operační postup
Vaporizace prostaty laserem o výkonu 80 W (vlnová délka 532 nm) se provádí za pomoci vlákna (600 µm) s postranním vyzařováním (vychýlení laserového paprsku 70°) a laserového cystoskopu (vychýlení 30°). Pro irigaci lze během výkonu používat studený sterilní fyziologický roztok nebo studenou sterilní vodu. Vaporizace se provádí pod přímou zrakovou kontrolou technikou rotačního pohybu vlákna, přičemž se zpravidla postupuje od hrdla močového měchýře přes laterální laloky k apexu [13]. Viditelný laserový paprsek s postranním vyzařováním způsobuje okamžitou a viditelnou ablaci tkáně.
5.5.2.3 Účinnost
V posledních letech byly zveřejněny četné studie, zejména s lasery o výkonu 80 W (tab. 20). Nedostatek dlouhodobých údajů znamená, že zatím není možné vyvodit definitivní závěry týkající se trvání účinku této léčby. Studie zahrnující 500 pacientů, kteří byli sledováni po dobu pěti let, uváděla významné zlepšení symptomů a mikčních parametrů a míru opakování operace srovnatelnou s technikou TURP [14]. Navzdory podávání perorálních antikoagulačních preparátů nebyly u 45 % pacientů (n = 225) pozorovány žádné závažné peroperační komplikace. Průměrná doba katetrizace činila 1,8 (0–10) dnů a průměrná doba pooperační hospitalizace 3,7 (0–35) dnů.
Tři roky po fotoselektivní vaporizaci laserem u mužů s průměrným objemem vaporizované prostaty 28 ± 42 ml byly pozorovány tyto hodnoty: průměrné IPSS 8,0, skóre kvality života 1,3 a Qmax 18,4 ml/s. Míra opakování léčby dosahovala 6,8 %. Uretrální striktury byly pozorovány u 4,4 % pacientů a striktury hrdla močového měchýře u 3,6 % pacientů. Údaje z následného sledování však byly k dispozici pouze u několika málo pacientů. Významné zlepšení mikčních parametrů po dobu sledování 12 měsíců bylo prokázáno urodynamickým vyšetřením [15]. V rámci sledování po dobu 12 měsíců byl průměrný uretrální otevírací tlak (Pdetopen; 76,2 vs 37,4 cm H2O) a tlak detruzoru při Qmax (Pdetmax; 75 vs 36,6 cm H2O) v porovnání s výchozím stavem výrazně nižší. Hodnota Qmax se v porovnání s hodnotou Qmax před operací (průměr 7,9 ml/s) zlepšila o 113 % (průměr 18,6 ml/s).
Doposud byly zveřejněny pouze dvě prospektivní randomizované kontrolované studie a tři nerandomizované studie. Nejdelší dostupná doba sledování v randomizované kontrolované studie je pouze 12 měsíců; tato studie uváděla, že vaporizace laserem o vlnové délce 532 nm je při zlepšování symptomů rovnocennou alternativou k technice TURP [20]. V obou skupinách bylo prokázáno významné zvýšení Qmax oproti výchozímu stavu. Ve skupině TURP se rychlost průtoku zvýšila z 8,7 na 17,9 ml/s (149 %) a ve skupině léčené laserovou vaporizací z 8,5 na 20,6 ml/s (167 %). Skóre IPSS se snížilo z 25,4 na 12,4 (50 %) ve skupině TURP a z 26 na 12 (50 %) ve skupině léčené laserovou vaporizací. Laserová vaporizace rovněž vedla k významnému snížení postmikčního rezidua na 37 ml ve skupině TURP a 27 ml ve skupině léčené laserovou vaporizací (průměr před operací ve skupině TURP 119 ml a ve skupině léčené laserovou vaporizací 147 ml). Obdobné trendy byly pozorovány pro skóre obtížnosti symptomů a skóre kvality života.
5.5.2.4 Snášenlivost a bezpečnost
Bezpečnost byla prokázána v různých prospektivních nerandomizovaných studiích zahrnujících pacienty užívající perorální antikoagulační preparáty a pacienty s močovou retencí nebo prostatou > 80 ml [16–19]. Pokud jde o bezpečnost během operace, nerandomizované studie uváděly, že vaporizace laserem o vlnové délce 532 nm je bezpečnější než TURP [21,22]. Při porovnání s TURP v randomizované studii je to i účinná technika, která přináší rovnocenné zlepšení rychlosti průtoku moči a IPSS s výhodou výrazně kratší doby hospitalizace, kratší doby katetrizace a méně nežádoucích účinků. Doba katetrizace byla u laserové vaporizace výrazně kratší než ve skupině TURP, přičemž průměr (rozmezí) činil 13 (0–24) hod vs 44,7 (6–192) hod. Kromě toho byla laserová vaporizace spojena s výrazně kratší dobou hospitalizace, kdy průměr (rozmezí) činil 1,09 (1–2) dní ve skupině léčené laserovou vaporizací a 3,6 (3–9) dní ve skupině TURP [23].
5.5.2.5 Praktické úvahy
Ačkoli je technika TURP z hlediska odstraňování tkáně a zmenšování BPO účinná, z důvodu perioperačních komplikací se neustále hledají méně invazivní a bezpečnější chirurgické techniky. V závislosti na vlnové délce a výkonu lze laser použít ke koagulaci, vaporizaci nebo resekci („enukleaci“). K destrukci tkáně vedou rovněž netepelné účinky známé také jako „ablace“. Funkční výsledky se tedy budou lišit z hlediska peroperačního zvládání různých laserových zařízení, včetně učební křivky, otázky resekce nádorových mas („debulking“), trvání účinků léčby a typu komplikací. Volba léčby pro zmenšení BPO závisí na dostupnosti nástrojů, volbě pacienta, průvodní morbiditě nebo užívání léků a zkušenosti chirurga.
V posledním desetiletí se objevilo několik typů laserů nové generace pro operaci prostaty, mezi něž patří holmium:YAG, kalium titanyl fosfát:yttrium aluminium granát (KTP:YAG), thulium:yttrium aluminium granát (thulium:YAG), litium triborát: yttrium aluminium granát (LBO:YAG) a diodové lasery. Energii lze přenášet obnaženým, pravoúhlým nebo intersticiálním vláknem. U každého laseru dochází k interakci mezi vlnovou délkou, specifikovanou energií a tkání. Destrukce prostatické tkáně je následkem jak tepelných, tak netepelných účinků. V roce 2009 byly zveřejněny údaje pouze pro HoLEP, fotoselektivní vaporizaci laserem Greenlight o výkonu 80 W a prostatektomii pomocí thulium:YAG laseru. Na téma prostatektomie pomocí thulium:YAG laseru, který lze použít pro vaporizaci, koagulaci nebo resekci, bylo zveřejněno pouze několik málo článků. Nedostatek zveřejněných údajů znamená, že pokud jde o léčbu pomocí různých laserů, není zatím možné vyvodit definitivní závěry.
5.5.2.6 Doporučení
HoLEP a vaporizace prostaty laserem o vlnové délce 532 nm jsou minimálně invazivními alternativami k technice TURP u mužů se symptomy LUTS doprovázejícími BPO, které vedou k okamžitému objektivnímu a subjektivnímu zlepšení srovnatelnému s technikou TURP (úroveň důkazu / stupeň doporučení: 1b/A).
Pokud jde o bezpečnost během operace, vaporizace laserem o vlnové délce 532 nm je bezpečnější než TURP a měla by být zvážena u pacientů, kteří užívají antikoagulační preparáty, nebo u pacientů, u nichž existuje vysoké kardiovaskulární riziko (úroveň důkazu / stupeň doporučení: 3/B).
Pokud jde o míru dlouhodobých komplikací, jsou k dispozici výsledky pouze pro HoLEP, které jsou srovnatelné s technikou TURP (úroveň důkazu / stupeň doporučení: 1b/A).
5.5.3 Literatura
- Le Duc A, Gilling PJ. Holmium laser resection of the prostate. Eur Urol 1999; 35(2): 155–160.
- Gilling PJ, Cass CB, Malcolm AR et al. Combination Holmium and Nd: YAG laser ablation of the prostate: initial clinical experience. J Endourol 1995; 9(2): 151–153.
- Chun SS, Razvi HA, Denstedt JD. Laser prostatectomy with the holmium:YAG laser. Tech Urol 1995; 1(4): 217–221.
- Gilling PJ, Fraundorfer MR, Kabalin JB. Holmium: YAG laser resection of the prostate (HoLRP) versus transurethral electrocautery resection of the prostate (TURP): a prospective randomised, urodynamicbased clinical trial. J Urol 1997; 157 : 149A.
- Le Duc A, Anidjar M, Teillac P et al. The Holmium YAG laser in the transurethral resection of prostate. Br J Urol 1997; 80 (Suppl 2): A773.
- Kabalin JN, Mackey MJ, Cresswell MD et al. Holmium: YAG laser resection of prostate (HoLRP) for patients in urinary retention. J Endourol 1997; 11(4): 291–293.
- Westenberg A, Gilling P, Kennett K et al. Holmium laser resection of the prostate versus transurethral resection of the prostate: results of a randomised trial with 4-year minimum long-term followup. J Urol 2004; 172(2): 616–619.
- Fraundorfer MR, Gilling PJ. Holmium:YAG laser enucleation of the prostate combined with mechanical morcellation: preliminary results. Eur Urol 1998; 33(1): 69–72.
- Gilling PJ, Aho TF, Frampton CF et al. Holmium laser enucleation of the prostate: results at 6 years. Eur Urol 2008; 53(4): 744–749.
- Tan A, Liao C, Mo Z et al. Meta-analysis of holmium laser enucleation versus transurethral resection of the prostate for Symptomatic prostatic obstruction. Br J Surg 2007; 94(10): 1201–1208.
- Lourenco T, Pickard R, Vale L et al. Benign Prostatic Enlargement team. Alternative approaches to endoscopic ablation for benign enlargement of the prostate: systematic review of randomised controlled trials BMJ 2008; 337: a449.
- Kuntz RM, Lehrich K, Ahyai SA. Holmium laser enucleation of the prostate versus open prostatectomy for prostates greater than 100 grams: 5-year follow-up results of a randomised clinical trial. Eur Urol 2008; 53(1): 160–166.
- Heinrich E, Schiefelbein F, Schoen G. Technique and short-term outcome of green light laser (KTP, 80W) vaporisation of the prostate. Eur Urol 2007; 52(6): 1632–1637.
- Ruszat R, Seitz M, Wyler SF et al. GreenLight Laser Vaporisation of the Prostate: Single-Center experience and long-term results after 500 procedures. Eur Urol 2008; 54(4): 893–901.
- Hamann MF, Naumann CM, Seif C et al. Functional outcome following photoselective vaporisation of the prostate (PVP): Urodynamic findings within 12 months follow-up. Eur Urol 2008; 54(4): 902–907.
- Reich O, Bachmann A, Siebels M et al. High power (80W) potassium-titanyl-phosphate laser vaporisation of the prostate in 66 high risk patients. J Urol 2005; 173(1): 158–160.
- Ruszat R, Wyler S, Forster T et al. Safety and effectiveness of photoselective vaporisation ot the prostate (PVP) in patients on ongoing oral anticoagulation. Eur Urol 2007; 51(4): 1031–1038.
- Ruszat R, Wyler S, Seifert HH et al. Photoselective vaporisation ot the prostate: subgroup analysis of men with refractory urinary retention Eur Urol 2006; 50(5): 1040–1049.
- Rajbabu K, Chandrasekara SK, Barber NJ et al. Photoselective vaporisation of the prostate with the potassium-titanyl-phosphate laser in men with prostates of > 100 mL BJU Int 2007; 100(3): 593–598.
- Bouchier-Hayes DM, Anderson P, Van Appledorn S et al. KTP laser versus transurethral resection: early results of a randomised trial J Endourol 2006; 20(8): 580–585.
- Bachmann A, Schürch L, Ruszat R et al. Photoselective vaporisation (PVP) versus transurethral resection of the prostate (TURP): a prospective bi-centre study of perioperative morbidity and early functional outcome. Eur Urol. 2005; 48(6): 965–971.
- Ruszat R, Wyler SF, Seitz M et al. Comparison of potassium-titanyl-phosphate laser vaporisation of the prostate and transurethral resection of the prostate: update of a prospective non-randomised two centre study. BJU Int 2008; 102(10): 1432–1438.
- Bouchier-Hayes DM, Van Appledorn S, Bugeja P et al. A randomised trial of photoselective vaporisation of the prostate using the 80-W potassium-titanyl--phosphate laser vs transurethral prostatectomy, with a 1-year follow-up. BJU Int. 2010; 105(7): 964–969.
5.6 Prostatické stenty
5.6.1 Mechanizmus účinku
Používání endoprotézy k zachování průsvitu je dobře zavedeným konceptem. V roce 1980 Fabian poprvé popsal zavádění stentů do prostatické uretry k uvolnění BPO [1]. Prostatické stenty byly primárně konstruovány jako alternativa k zavádění katétru u pacientů, kteří nejsou vhodnými kandidáty pro operaci z důvodu komorbidity. Prostatické stenty však byly v několika studiích posuzovány také jako primární léčebná možnost u pacientů bez významných komorbidit [2,3].
Prostatický stent vyžaduje funkční detruzor tak, aby byl močový měchýř ještě schopen se sám vyprázdnit. V tom se liší od zavedeného katétru, který zajišťuje pasivní drenáž močového měchýře [4]. Stenty mohou být dočasné nebo permanentní. Permanentní stenty jsou biokompatibilní a umožňují epitelizaci, takže se nakonec stanou součástí uretry. Dočasné stenty neepitelizují a mohou být buď biostabilní, nebo biodegradabilní. Dočasné stenty mohou poskytovat krátkodobou úlevu od BPO u pacientů, kteří dočasně nejsou vhodnými kandidáty pro operaci, nebo po minimálně invazivní léčbě [4].
5.6.2 Operační postup
Zavádění stentů se většinou provádí ambulantně v lokální anestezii. Před zavedením stentu se změří délka prostatické uretry, aby se stanovila délka stentu. Jakmile je pacient v litotomické poloze, stent se protáhne uretrou tak, aby se hrot prostatického uretrálního segmentu dostal do močového měchýře. Je důležité, aby stent nebyl umístěn uvnitř zevního sfinkteru uretry, protože by mohl způsobovat stresovou inkontinenci. Správné umístění se potvrdí abdominální ultrasonografií nebo cystoskopií. Vyjmutí dočasného stentu se provádí potahováním extrakční sutury až do úplného vytažení stentu nebo endoskopicky za pomoci grasperů. Odstranění permanentních stentů může být obtížné v případech migrace stentu, inkrustace stentu nebo vrůstání epitelu a obecně je zpravidla nutná anestezie. Obecně je profylaxe antibiotiky nezbytná pouze v případě pozitivní kultivace moči.
5.6.3 Účinnost
Bylo provedeno několik malých případových studií testujících nejrůznější stenty různé konstrukce a z různých materiálů, které poskytly nízkou úroveň důkazů pro jejich použití. Nejdůležitější studie jsou uvedeny v tab. 21 [2,5–9]. Ve všech studiích byla během následného sledování pozorována významná míra předčasného ukončení studie. Existuje pouze jedna randomizovaná kontrolovaná studie, která porovnávala dvě verze naslepo zaváděného prostatického stentu (BPS) u pacientů s BPO [10], a nebyly provedeny žádné studie, které by porovnávaly stenty s placebo léčbou (kontrolní skupinou) nebo jinými léčebnými možnostmi. Systém BPS je dočasný stent, který je tvořen měkkým silikonovým stentem, exktrakčním vláknem a zavaděčem, přičemž rozdíl mezi BPS-1 a BPS-2 spočívá v přídavném 2cm bulbárním segmentu. Tento segment zajišťuje výrazně nižší míru migrace BPS-2 (5 %) v porovnání s BPS-1 (85 %), ale zároveň má za následek značný dyskomfort [10]. BPS-2 rovněž vykazuje lepší skóre symptomů a mikční funkci než BPS-1, ale pouze hodnota Qmax dosáhla statistické významnosti. Výsledky této studie podle všeho ukazují, že konstrukce stentu má zásadní vliv na účinnost a bezpečnost prostatických stentů [10].
Tab. 7. Účinnost stentů: klíčové studie. 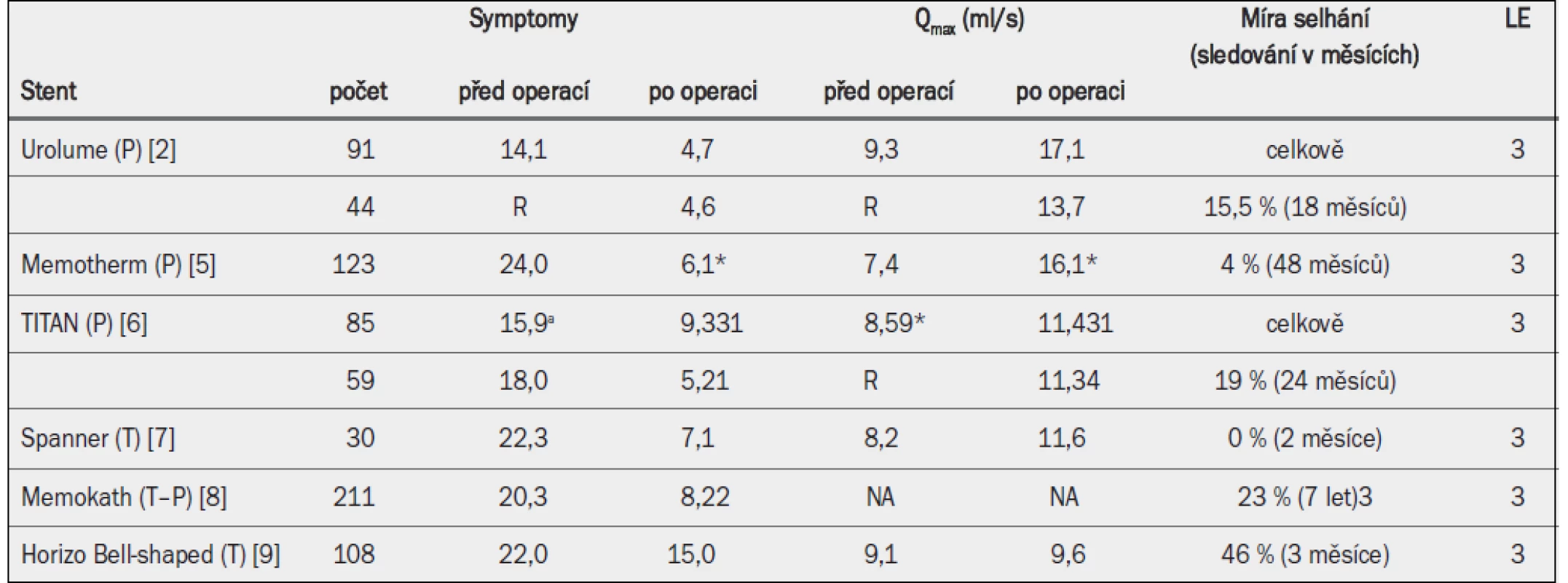
Qmax = maximální rychlost průtoku moči (volná uroflowmetrie); (P) = permanentní stent; R = retence; (T) = dočasný stent; NA = není k dispozici *Bezprostředně po zavedení; a = Madsenovo skóre; 1 po 2 letech; 2 po 3 měsících.
5.6.3.1 Permanentní stenty (endouretrální protéza UroLume)
Hlavním zástupcem permanentních stentů je endouretrální protéza UroLume. Nedávno provedené systematické přezkoumání zahrnovalo 20 případových studií s celkem 990 pacienty, kterým byl zaveden stent UroLume [11]. 10 studií, které uváděly skóre symptomů, prokázalo zlepšení symptomů po zavedení stentu, ačkoli hodnocení probíhalo v jednotlivých studiích v různou dobu. Uváděné snížení Madsen--Iversenova skóre se pohybovalo v rozmezí 7,9–14,3 bodů, zatímco skóre IPSS se snížilo o 10–12,4 bodů [11]. Kromě toho se po zavedení stentu zvýšila průměrná hodnota Qmax o 4,2–13,1 ml/s. Agregované údaje ze studií zahrnujících pacienty s permanentním transuretrálním katétrem ukázaly, že 84 % pacientů (148/176) bylo po zavedení stentu UroLume znovu schopno spontánně močit, přičemž průměrná hodnota Qmax se pohybovala v rozmezí 8,8–20 ml/s. Po 12 letech sledování byly pozorovány tyto průměrné hodnoty: 10,82 pro IPSS, 11,5 ml/s pro Qmax a 80 ml pro PVR [12].
5.6.3.2 Neepitelizující (dočasný) prostatický stent (Memokath)
Nejlepší údaje o neepitelizujícím prostatickém stentu poskytuje systematické přezkoumání účinnosti stentu Memokath, samoexpandibilního kovového prostatického stentu [13]. Celkem bylo přezkoumáno 14 případových studií s 839 pacienty. Analýza 7 studií uvádějících skóre symptomů zjistila, že zavádění stentu Memokath je spojeno se snížením skóre IPSS o 11–19 bodů a snížením Madsen--Iversenova skóre o 9 bodů. Je však důležité poznamenat, že hodnocení bylo prováděno v různou dobu po zavedení stentu. Obdobně vedlo zavedení stentu ke zvýšení hodnoty Qmax o 3–11 ml/s, ačkoli i v tomto případě se doba hodnocení po zavedení stentu lišila [13].
5.6.4 Snášenlivost a bezpečnost
Obecně je zavádění stentů spojeno s rizikem špatného umístění, migrace, špatné snášenlivosti z důvodu zhoršení symptomů LUTS a inkrustace [4]. Mezi hlavní nežádoucí účinky, které se objevují bezprostředně po zavedení stentu, patří bolest v perineální oblasti nebo iritační mikční symptomy u většiny pacientů.
Systematické přezkoumání stentu UroLume uvádělo míru selhání 16 % (104/666) do 12 měsíců od zavedení, zejména z důvodu špatného umístění nebo migrace stentu (37 %) nebo recidivujících obstrukčních či iritačních mikčních symptomů (14 %). Celková míra selhání po pěti letech dosahovala 27 % (50/188 stentů), ačkoli mnozí pacienti sledování předčasně ukončili nebo zemřeli se stentem in situ [11]. Ve studii s nejdelší dobou sledování dokončilo dvanáctileté sledování se stentem UroLume in situ 18 % pacientů (11 mužů), zatímco 29 stentů bylo vyjmuto (míra selhání 47 %) a 22 pacientů (34 %) zemřelo v důsledku onemocnění nesouvisejících se symptomy LUTS u mužů.
5.6.5 Praktické úvahy
Při hledání ideálního prostatického stentu byla vyvinuta řada různých typů, které byly použity v klinických studiích. Z důvodu vedlejších účinků a vysoké míry migrace mají prostatické stenty v léčbě BPO omezenou roli. Prostatické stenty zůstávají alternativou k transuretrální katetrizaci pro muže, kteří trpí (recidivující) močovou retencí a pro něž je operace vysoce riziková.
5.6.6 Doporučení
Prostatické stenty jsou alternativou ke katetrizaci pro muže, kteří nejsou vhodnými kandidáty pro operaci. Stenty mohou vést k dočasné úlevě od benigní prostatické obstrukce po minimálně invazivní léčbě (úroveň důkazu / stupeň doporučení: 3/C).
5.6.7 Literatura
- Fabian KM. [The intra-prostatic “partial catheter” (urological spiral) (author’s transl)]. Urologe A 1980; 19(4): 236–238. [Article in German].
- Guazzoni G, Montorsi F, Coulange C et al. A modified prostatic UroLume Wallstent for healthy patients with symptomatic benign prostatic hyperplasia: a European Multicenter Study. Urology 1994; 44(3): 364–370.
- Corica AP, Larson BT, Sagaz A et al. A novel temporary prostatic stent for the relief of prostatic urethral obstruction. BJU Int 2004; 93(3): 346–348.
- Vanderbrink BA, Rastinehad AR, Badlani GH. Prostatic stents for the treatment of benign prostatic hyperplasia. Curr Opin Urol 2007; 17(1): 1–6.
- Gesenberg A, Sintermann R. Management of benign prostatic obstruction in high risk patients: longterm experience with the Memotherm stent. J Urol 1998; 160(1): 72–76.
- Kaplan SA, Chiou RK, Morton WJ et al. Long-term experience utilizing a new balloon expandable prostatic endoprosthesis: the Titan stent. North American Titan Stent Study Group. Urology 1995; 45(2): 234–240.
- Corica AP, Larson BT, Sagaz A et al. A novel temporary prostatic stent for the relief of prostatic urethral obstruction. BJU Int 2004; 93(3): 346–348.
- Perry MJA, Roodhouse AJ, Gidlow AB et al. Thermo-expandable intraprostatic stents in bladder outlet obstruction: an 8-year study. BJU Int 2002; 90(3): 216–223.
- van Dijk MM, Mochtar CA, Wijkstra H et al. The bell-shaped Nitinol prostatic stent in the treatment of lower urinary tract symptoms: experience in 108 patients. Eur Urol 2006; 49(2): 353–359.
- Kijvikai K, van Dijk M, Pes PL et al. Clinical utility of “blind placement” prostatic stent in patients with benign prostatic obstruction: a prospective study. Urology. 2006; 68(5): 1025–1030.
- Armitage JN, Cathcart PJ, Rashidian A et al. Epithelializing Stent for Benign Prostatic Hyperplasia: A Systematic Review of the Literature. J Urol 2007; 177(5): 1619–1624.
- Masood S, Djaladat H, Kouriefs C et al. The 12-year outcome analysis of an endourethral wall-stent for treating benign prostatic hyperplasia. BJU Int 2004; 94(9): 1271–1274.
- Armitage JN, Rashidian A, Cathcart PJ et al. The thermo-expandable metallic stent for managing benign prostatic hyperplasia: a systematic review. BJU Int 2006; 98(4): 806–810.
5.7 Nové operační postupy
5.7.1 Injekční aplikace etanolu do prostaty
5.7.1.1 Mechanizmus účinku
Pro léčbu LUTS doprovázejících BPO se do parenchymu prostaty injekčně aplikuje absolutní (bezvodý, 95–98%) etanol. Přesný mechanizmus účinku jak u člověka, tak u zvířat zůstává nejasný. Používání etanolu se zkoumalo na psím modelu a byla prokázána schopnost etanolu způsobovat záněty, koagulační nekrózu s denaturací proteinů a lýzou buněčné membrány a nakonec atrofii a ablaci prostatické tkáně vedoucí k tvorbě kavity [1–4]. Tkáňová nekróza byla obvykle klínovitého tvaru [4]. Objem injekčně aplikovaného etanolu jen mírně koreloval s rozsahem tkáňové nekrózy [4]. Intraprostatická kavita se na psím modelu objevila po sedmi dnech [3].
5.7.1.2 Operační postup
Kapalný bezvodý etanol nebo etanolový gel se injekčně aplikuje do parenchymu prostaty pomocí jehly (20–22 G), a to transuretrálně, transperineálně nebo transrektálně. Transuretrální přístup (TEAP nebo TUEIP) se používá častěji [5–14] než transperineální [11,15,16] nebo transrektální přístup [11].
Pro transuretrální aplikaci etanolu byla vyvinuta speciální zařízení (InecTx™ v USA a Prostaject™ v Evropě) [17]. Neexistuje konsenzus ohledně počtu injekčních míst nebo injekčního objemu, které závisejí na celkovém objemu prostaty, délce uretry a/nebo přítomnosti středního laloku a v různých studiích se pohybují v rozmezí od 2–25 ml etanolu na pacienta (přičemž injekční objem může činit až 42 % objemu prostaty).
Je možné uvážit lokální anestezii doplněnou o sedaci při vědomí, ačkoli většina pacientů volila lokální nebo celkovou anestezii. Tento výkon obvykle trvá přibližně 30 min. U většiny pacientů je po výkonu zapotřebí zavést katétr.
5.7.1.3 Účinnost
Doposud bylo zveřejněno 12 studií [5–16] (tab. 22), z nichž většina zkoumala muže refrakterní na medikamentózní léčbu. Pouze jedna studie zkoumala pacienty s retencí moči [10]. Žádná z těchto studií nebyla randomizována oproti TURP nebo jiným minimálně invazivním postupům pro BPH--LUTS nebo BPO. Průměrná doba sledování se u jednotlivých skupin lišila a pohybovala se od 12–208 týdnů (3–48 měsíců).
Tab. 8. Výsledky injekční aplikace etanolu do prostaty pro léčbu BPH-LUTS nebo BPO u mužů refrakterních na medikamentózní léčbu nebo mužů s retencí moči. 
Absolutní a relativní změny v porovnání s výchozím stavem jsou uvedeny pro symptomy (IPSS), maximální rychlost průtoku moči (Qmax), postmikční reziduum (PVR) a objem prostaty. a = významná v porovnání s výchozím stavem (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); † = pacienti s retencí moči; *tři ramena studie porovnávající transuretrální, transrektální a transperineální injekční aplikaci. Většina studií prokázala výrazné zlepšení symptomů (IPSS –41 % až –71 %) a PVR (–6 % až –99 %) a rovněž výrazné zlepšení maximální rychlosti průtoku moči (Qmax +35 % až +155 %) a kvality života (IPSS-QoL -47 % až -60 %). Objem prostaty se významně zmenšil přibližně v polovině studií (–4 % až –5 %). Prostata se po počátečním výrazném zmenšení svého objemu opět zvětšila 1–2 roky po operaci, ačkoli výrazné zlepšení symptomů LUTS a maximální rychlosti průtoku moči zůstalo zachováno [8]. Nebyl zjištěn žádný parametr pro predikci účinnosti nebo vztah mezi dávkou a odpovědí [9,12].
Několik studií prokázalo významný počet pacientů, kteří během prvního roku po výkonu podstoupili další léčbu (zpravidla druhou injekční aplikaci etanolu, TURP nebo otevřenou prostatektomii). O trvání klinického efektu po uplynutí jednoho roku od operace existuje jen velmi málo informací; jedna studie s průměrnou dobou sledování tři roky ukázala míru opakování léčby 41 % [8].
5.7.1.4 Snášenlivost a bezpečnost
Mezi často uváděné nežádoucí účinky patřily:
- dyskomfort/bolest v perineální nebo abdominální oblasti
- jímací symptomy močového měchýře (≤ 40 %)
- hematurie (≤ 40 %)
- infekce močových cest nebo epididymitida
- retence moči
Mezi méně často uváděné (< 5 %) nežádoucí účinky patřily:
- snížené libido
- retrográdní ejakulace
- urgentní močová inkontinence
- uretrální stenóza
- erektilní dysfunkce
Studie na zvířatech odhalily vysoké procento poškození sfinkteru uretry a stresové inkontinence při injekční aplikaci etanolu perineální cestou [1]; tyto komplikace však nebyly zaznamenány u člověka [15,16]. U jednoho muže se šest měsíců po léčbě vytvořil velký konkrement v močovém měchýři, s největší pravděpodobností z důvodu kalcifikace nasáklé nekrotické prostatické masy [18]. Po injekční aplikaci etanolu byly uváděny dva případy závažných komplikací; nekróza močového měchýře vyžadovala cystektomii a derivaci moči [9].
5.7.1.5 Praktické úvahy
Injekční aplikace etanolu do prostaty je považována za minimálně invazivní léčebnou možnost pro pacienty s LUTS doprovázejícími BPO. Mechanizmus účinku, výběr pacientů a aplikace etanolu (počet míst aplikace a objem) zatím nebyly dobře prozkoumány. U některých pacientů se vyskytují závažné nežádoucí účinky a je k dispozici jen velmi málo dlouhodobých údajů. Injekční aplikace etanolu do prostaty se tedy stále považuje za experimentální a měla by být používána pouze v rámci studií.
Je zapotřebí provést randomizované kontrolované studie s dlouhodobým sledováním, které by porovnávaly injekční aplikaci etanolu s technikou TURP, jinými minimálně invazivními postupy nebo medikamentózní léčbou, aby bylo možné odpovídajícím způsobem posoudit hodnotu této léčebné modality.
5.7.1.6 Doporučení
Injekční aplikace etanolu do prostaty pro léčbu LUTS způsobených BPO je stále experimentální (úroveň důkazu: 3).
Injekční aplikace etanolu do prostaty by měla být prováděna pouze v rámci klinických studií (stupeň doporučení: C).
5.7.1.7 Literatura
- Littrup PJ, Lee F, Borlaza GS et al. Percutaneous ablation of canine prostate using transrectal ultrasound guidance. Absolute ethanol and Nd:YAG laser. Invest Radiol 1988; 23(10): 734–739.
- Levy DA, Cromeens DM, Evans R et al. Trans-rectal ultrasound-guided intraprostatic injection of absolute ethanol with and without carmustine: a feasibility study in the canine model. Urology 1999; 53(6): 1245–1251.
- Zvara P, Karpman E, Stoppacher R et al. Ablation of canine prostate using transurethral intraprostatic absolute ethanol injection. Urology 1999; 54(3): 411–415.
- Plante MK, Gross AL, Kliment J et al. Intraprostatic ethanol chemoablation via transurethral and transperineal injection. BJU Int 2003; 91(1): 94–98.
- Goya N, Ishikawa N, Ito F et al. Ethanol injection therapy of the prostate for benign prostatic hyperplasia: preliminary report on application of a new technique. J Urol 1999; 162(2): 383–386.
- Ditrolio J, Patel P, Watson RA, et al. Chemo-ablation of the prostate with dehydrated alcohol for the treatment of prostatic obstruction. J Urol 2002; 167(5): 2100–2103.
- Plante MK, Bunnell ML, Trotter SJ et al. Transurethral prostatic tissue ablation via a single needle delivery system: initial experience with radio-frequency energy and ethanol. Prostate Cancer Prostatic Dis 2002; 5(3): 183–188.
- Goya N, Ishikawa N, Ito F et al. Transurethral ethanol injection therapy for prostatic hyperplasia: 3-year results. J Urol 2004; 172(3): 1017–1020.
- Grise P, Plante M, Palmer J et al. Evaluation of the transurethral ethanol ablation of the prostate (TEAP) for symptomatic benign prostatic hyperplasia (BPH): a European multi-center evaluation. Eur Urol 2004; 46(4): 496–501.
- Mutaguchi K, Matsubara A, Kajiwara M et al. Transurethral ethanol injection for prostatic obstruction: an excellent treatment strategy for persistent urinary retention. Urology 2006; 68 : 307–311.
- Larson BT, Netto N, Huidobro C et al. Intraprostatic injection of alcohol gel for the treatment of benign prostatic hyperplasia: preliminary clinical results. ScientificWorldJournal 2006; 6 : 2474–2480.
- Plante MK, Marks LS, Anderson R et al. Phase I/II examination of transurethral ethanol ablation of the prostate for the treatment of symptomatic benign prostatic hyperplasia. J Urol 2007; 177(3): 1030–1035.
- Magno C, Mucciardi G, Galì A et al. Transurethral ethanol ablation of the prostate (TEAP): an effective minimally invasive treatment alternative to traditional surgery for symptomatic benign prostatic hyperplasia (BPH) in high-risk comorbidity patients. Int Urol Nephrol 2008; 40(4): 941–946.
- Sakr M, Eid A, Shoukry M et al. Transurethral ethanol injection therapy of benign prostatic hyperplasia: four-year follow-up. Int J Urol 2009; 16(2): 196–201.
- Savoca G, De Stefani S, Gattuccio I et al. Percutaneous ethanol injection of the prostate as minimally invasive treatment for benign prostatic hyperplasia: preliminary report. Eur Urol 2001; 40(5): 504–508.
- Chiang PH, Chuang YC, Huang CC et al. Pilot study of transperineal injection of dehydrated ethanol in the treatment of prostatic obstruction. Urology 2003; 61(4): 797–801.
- Ditrolio J, Patel P, Watson RA et al. An endoscopic injection device: a potential advance in the transurethral treatment of benign prostatic obstruction. BJU Int 2003; 92(1): 143–145.
- Ikari O, Leitao VA, D’Ancona CA et al. Intravesical calculus secondary to ethanol gel injection into the prostate. Urology 2005; 65(5): 1002. e24–25.
5.7.2 Injekční aplikace botulotoxinu do prostaty
5.7.2.1 Mechanizmus účinku
BTX je exotoxinem bakterie Clostridium botulinum. Tento toxin s molekulární hmotností 150 kDA je nejsilnějším neurotoxinem známým u člověka a způsobuje botulizmus (potravinový, raný nebo kojenecký). Je známo sedm subtypů BTX (A–G), z nichž subtypy A a B se vyrábějí pro použití u člověka.
Zkušenosti s injekční aplikací do prostaty pro léčbu LUTS/BPO jsou pouze u BTX-A. Přesný mechanizmus účinku byl hodnocen na pokusných zvířatech, ale nebyl dosud zcela pochopen. BTX-A blokuje uvolňování neurotransmiterů (např. acetylcholinu nebo norepinefrinu) z presynaptických nervů [1]. BTX-A přímo, nebo nepřímo zmírňuje symptomy LUTS indukcí apoptózy prostatických (epiteliálních) buněk, což vede ke tkáňové atrofii a zmenšení velikosti prostaty [2–4], inhibici senzorických neuronů v prostatě a redukci aferentních signálů do centrálního nervového systému [3] a/nebo relaxaci buněk hladkého svalstva v parenchymu prostaty a zmenšení BPO [4–6]. Down-regulace alfa-1 adrenergních receptorů v prostatě může přispívat k relaxaci buněk hladkého svalstva [3]. Poslední dva mechanizmy lze stručně popsat jako chemickou denervaci, která může mít negativní vliv na růst prostaty.
5.7.2.2 Operační postup
Při ultrazvukové vizualizaci může být BTX-A injekčně aplikován do parenchymu prostaty transperineálně, transuretrálně nebo transrektálně za pomoci jehly (21–23 G). Nejčastěji je popisován transperineální přístup [7–13]; méně často se užívají i transuretrální [5] a transrektální cesty [14,15]. Ve všech studiích kromě jedné byl použit Botox™ (Allergan, Irving, CA, USA) [13].
V různých studiích byly použity různé terapeutické dávky (100–300 jednotek Botox™ nebo 300–600 jednotek Dysport™) a různá ředění (25–50 jednotek Botox™/ml nebo 75 jednotek Dysport™/ml). Dávky a ředění však nebyly testovány systematicky. Pro prostaty < 30 ml byla navržena dávka 100 jednotek Botox™, pro prostaty o velikosti v rozmezí od 30–60 ml byla navržena dávka 200 jednotek a pro prostaty > 60 ml dávka 300 jednotek [9]. V případě Dysport™ bylo použito 300 jednotek pro prostaty < 30 ml a 600 jednotek pro prostaty > 30 ml (13). Většina pacientů byla léčena bez anestezie, lokální anestezie nebo sedace.
5.7.2.3 Účinnost
Doposud bylo zveřejněno 11 studií (tab. 23) zkoumajících injekční aplikaci BTX-A do prostaty u pacientů s BPH-LUTS, kteří vyžadovali medikamentózní léčbu nebo k ní byli rezistentní, nebo u pacientů se zavedeným uretrálním katétrem z důvodu akutní nebo chronické retence moči [5,14,15]. Pouze dvě studie byly randomizované, jedna oproti injekční aplikaci fyziologického roztoku [7], druhá oproti terapii alfa-1 blokátory [12].
Tab. 9. Výsledky injekční aplikace botulotoxinu do prostaty (Botox™) pro léčbu LUTS/BPH, BPO nebo retence moči. 
Absolutní a relativní změny v porovnání s výchozím stavem jsou uvedeny pro symptomy (IPSS), maximální rychlost průtoku moči (Qmax), postmikční reziduum (PVR) a objem prostaty. a = významná v porovnání s výchozím stavem (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); b = významná v porovnání s placebem (fyziologický roztok) nebo alfa–1 blokátory; † = pacienti s akutní nebo chronickou retencí moči; *Botox™; ‡ = Dysport™. Většina pacientů ve zveřejněných studiích podstoupila pouze jednu injekční aplikaci BTX-A a průměrná doba sledování se pohybovala v rozmezí od 12–120 týdnů (3–30 měsíců). Všechny studie uváděly významné zlepšení symptomů (IPSS –39 % až –79 %) a rychlosti průtoku moči (Qmax +27 % až +122 %) nebo zmenšení objemu prostaty (–11 % až –61 %). Postmikční reziduum se ve všech studiích snížilo, ale toto snížení bylo významné pouze přibližně v polovině studií. V randomizované kontrolované studii byla injekční aplikace BTX-A významně účinnější než injekční aplikace fyziologického roztoku, pokud jde o zlepšení symptomů a Qmax a rovněž snížení PVR a zmenšení objemu prostaty; všechny parametry se významně lišily od výchozího stavu nebo od aplikace fyziologického roztoku během prvního měsíce léčby [7].
Mezi pacienty s retencí moči před injekční aplikací BTX-A bylo 80–100 % mužů schopno spontánně močit do jednoho měsíce od operace a tuto schopnost si udrželi po celou dobu sledování.
O dlouhodobém efektu a trvání účinku léčby existuje jen velmi málo informací; zdá se, že objem prostaty se znovu zvětší po 6–12 měsících [11,14] i přes stabilní zlepšení symptomů, Qmax a PVR. Míra opakování léčby dosahovala u BTX-A až 29 % [11].
5.7.2.4 Snášenlivost a bezpečnost
Injekční aplikace BTX-A byla dobře snášena ve všech studiích a nebyly uváděny žádné systémové nežádoucí účinky vyvolané aplikací BTX-A. Pooperační analgezie nebyla nutná.
Nežádoucí účinky zahrnovaly dysurii (≤ 19 %), hematurii (≤ 14 %) a akutní prostatitidu u jednoho pacienta (2 %). Retence moči se objevila u ≤ 6 % pacientů, ale mnohým pacientům byl brzy po operaci (jeden týden až jeden měsíc) zaveden transuretrální katétr nebo provedena čistá intermitentní katetrizace [8,14].
5.7.2.5 Praktické úvahy
Injekční aplikace BTX-A do parenchymu prostaty se zdá být slibnou a rychlou minimálně invazivní léčebnou modalitou s nízkou morbiditou pro pacienty, kteří jsou refrakterní na medikamentózní léčbu nebo trpí retencí moči. Navzdory vynikajícím a konzistentním výsledkům zveřejněných studií však byl BTX-A zatím injekčně aplikován pouze malému počtu pacientů a všechny studie mají omezenou dobu sledování. Doposud byly zveřejněny pouze dvě randomizované kontrolované studie. Je proto nezbytné provést studie s větším počtem pacientů, randomizované oproti injekční aplikaci fyziologického roztoku, léčivům, TURP nebo jiným minimálně invazivním postupům a s dlouhodobým sledováním, aby bylo možné odpovídajícím způsobem posoudit hodnotu injekční aplikace BTX-A do prostaty v kontextu jiných dostupných medikamentózních nebo operačních možností léčby LUTS/BPO.
5.7.2.6 Doporučení
Injekční aplikace botulotoxinu do prostaty pro léčbu symptomů dolních cest močových způsobených benigní prostatickou obstrukcí nebo retencí moči je stále experimentální (úroveň důkazu: 3).
Injekční aplikace botulotoxinu do prostaty by měla být prováděna pouze v rámci klinických studií (stupeň doporučení: C).
5.7.2.7 Literatura
- Smith CP, Franks ME, McNeil BK et al. Effect of botulinum toxin A on the autonomic nervous system of the rat lower urinary tract. J Urol 2003; 169(5): 1896–1900.
- Doggweiler R, Zermann DH, Ishigooka M et al. Botox-induced prostatic involution. Prostate 1998; 37(1): 44–50.
- Chuang YC, Huang CC, Kang HY et al. Novel action of botulinum toxin on the stromal and epithelial components of the prostate gland. J Urol 2006; 175 (3 Pt 1): 1158–1163.
- Chuang YC, Tu CH, Huang CC et al. Intraprostatic injection of botulinum toxin type-A relieves bladder outlet obstruction in human and induces prostate apoptosis in dogs. BMC Urology 2006; 6 : 12.
- Kuo HC. Prostate botulinum A toxin injection – an alternative treatment for benign prostatic obstruction in poor surgical candidates. Urology 2005; 65(4): 670–674.
- Lin AT, Yang AH, Chen KK. Effects of botulinum toxin A on the contractile function of dog prostate. Eur Urol 2007; 52(2): 582–589.
- Maria G, Brisinda G, Civello IM et al. Relief by botulinum toxin of voiding dysfunction due to benign prostatic hyperplasia: results of a randomised, placebo--controlled study. Urology 2003; 62(2): 259–264.
- Chuang YC, Chiang PH, Huang CC et al. Botulinum toxin type A improves benign prostatic hyperplasia symptoms in patients with small prostates. Urology 2005; 66(4): 775–779.
- Chuang YC, Chiang PH, Yoshimura N et al. Sustained beneficial effects of intraprostatic botulinum toxin type A on lower urinary tract symptoms and quality of life in men with benign prostatic hyperplasia. BJU Int 2006; 98(5): 1033–1037.
- Park DS, Cho TW, Lee YK et al. Evaluation of short term clinical effects and presumptive mechanism of botulinum toxin type A as a treatment modality of benign prostatic hyperplasia. Yonsei Med J 2006; 47(5): 706–714.
- Brisinda G, Cadeddu F, Vanella S et al. Relief by botulinum toxin of lower urinary tract symptoms owing to benign prostatic hyperplasia: earl and long-term results. Urology 2009; 73(1): 90–94.
- Kuo HC, Liu HT. Therapeutic effects of add-on botulinum toxin A on patients with large benign prostatic hyperplasia and unsatisfactory response to combined medical therapy. Scand J Urol Nephrol 2009; 43(3): 206–211.
- Nikoobakht M, Daneshpajooh A, Ahmadi H et al. Intraprostatic botulinum toxin type A injection for the treatment of benign prostatic hyperplasia: initial experience with Dysport. Scand J Urol Nephrol 2010; 44(3): 151–157.
- Silva J, Silva C, Saraiva L et al. Intraprostatic botulinum toxin type A injection in patients unfit for surgery presenting with refractory urinary retention and benign prostatic enlargement. Effect on prostate volume and micturition resumption. Eur Urol 2008; 53(1): 153–159.
- Silva J, Pinto R, Carvalho T et al. Intrapros-tatic botulinum toxin type A injection in patients with benign prostatic enlargement: duration of the effect of a single treatment. BMC Urology 2009; 9 : 9.
5.8 Přehled léčebných možností
Volba léčby závisí na:
- nálezech posuzovaných během počátečního hodnocení
- léčebných preferencích pacienta
- schopnosti léčebné modality změnit posuzované nálezy
- očekávání, která mají být splněna, z hlediska rychlosti nástupu účinku léčby, její účinnosti, vedlejších účinků, kvality života a progrese onemocnění
První volbou je zpravidla behaviorální terapie s medikamentózní léčbou, či bez ní. Schéma 3 prezentuje možnosti konzervativní a medikamentózní léčby podle medicíny založené na důkazech a profilu pacientů.
Operační léčba je zpravidla vyžadována u pacientů s recidivující nebo refrakterní retencí moči, inkontinencí z přeplnění, recidivujícími infekcemi močových cest, konkrementy v močovém měchýři nebo divertiklem močového měchýře, makroskopickou hematurií způsobenou BPH/BPE rezistentní na léčbu nebo s dilatací horních cest močových způsobenou BPO, s renální insuficiencí, nebo bez ní (absolutní indikace k operaci, nutnost chirurgického zákroku). Operace je obvykle nezbytná také v případě, kdy pacienti pociťují nedostatečnou úlevu od symptomů LUTS nebo PVR po konzervativní nebo medikamentózní léčbě (relativní indikace k operaci). Volba operační techniky závisí primárně na velikosti prostaty, komorbiditách pacienta a schopnosti podstoupit anestezii, ale zároveň na preferencích pacienta, ochotě akceptovat vedlejší účinky spojené s operací, dostupnosti chirurgických nástrojů a zkušenosti chirurga s těmito operačními technikami. Schéma 4 prezentuje možnosti operační léčby podle medicíny založené na důkazech a profilu pacientů.
Štítky
Dětská nefrologie Dětská urologie Chirurgie všeobecná Nefrologie Urologie
Článek 1. ÚvodČlánek 2. HodnoceníČlánek 3. Konzervativní léčbaČlánek 4. Medikamentózní léčbaČlánek 6. Následné sledováníČlánek 7. Zkratky použité v textu
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo EAU Guidelines pro léčbu symptomů dolních močových cest u mužů- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
Nejčtenější v tomto čísle
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



