-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití monoklonální protilátky daratumumab v léčbě mnohočetného myelomu
The monoclonal antibody daratumumab in the treatment of multiple myeloma
The monoclonal antibody daratumumab is a new and effective drug for the treatment of multiple myeloma. Results of clinical trials have demonstrated a high efficacy in monotherapy and an even higher when used in combination. Daratumumab monotherapy in heavily-pre-treated patients showed a 30% overall response rate with response persisting for more than six months. Combination of daratumumab and immunomodulatory drugs has shown a more than 90% response rate and significant extension of progression-free survival versus standard care in relapsed patients. This review summarizes current preclinical and clinical data on daratumumab treatment in multiple myeloma.
Key words:
multiple myeloma – daratumumab – CD38 – monoclonal antibody
Autoři: M. Štork; L. Pour; V. Sandecká; M. Krejčí; Z. Adam; Z. Král
Působiště autorů: Interní hematologická a onkologická klinika, FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 4, p. 230-237.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Zavedení monoklonální protilátky daratumumabu je zásadním přínosem pro léčbu mnohočetného myelomu. Analýzy výsledků klinických studií ukazují vysokou efektivitu léčby jak v monoterapii, tak v kombinacích s imunomodulačními léky a proteasomovými inhibitory u pacientů s relabovaným mnohočetným myelomem. V klinických studiích s výrazně předléčenými pacienty odpověděla na monoterapii daratumumabem třetina léčených a trvání léčebné odpovědi bylo déle než půl roku. Výsledky randomizovaných studií fáze 3 pro relaps ukazují více než 90 % léčebných odpovědí a signifikantní prodloužení přežití bez progrese u pacientů léčených daratumumabem oproti standardní léčbě. Tento článek přináší souhrn dosavadních preklinických a klinických dat o léčbě mnohočetného myelomu daratumumabem.
Klíčová slova:
mnohočetný myelom – daratumumab – CD38 – monoklonální protilátkaÚVOD
Mnohočetný myelom je maligní onemocnění krvetvorby způsobné proliferací nádorově změněných plazmocytů. V historii léčby mnohočetného myelomu bylo zásadním průlomem zavedení tzv. „nových léků“ – thalidomidu, bortezomibu a lenalidomidu. Klinické aplikace těchto léků v průběhu minulých dvou desetiletí významně zlepšily prognózu jak mladších nemocných, schopných podstoupit vysokodávkovanou chemoterapii spojenou s autologní transplantací kostní dřeně, tak starších nemocných nesměrovaných k intenzivní terapii [1]. Efektivita těchto léků dokonce vedla některé autory k přehodnocení názoru, že je myelom nevyléčitelné onemocnění [2].
V současnosti můžeme sledovat dramatický vývoj možností léčby mnohočetného myelomu. Léčebné možnosti se rozrůstají o nové preparáty vycházející ze známých skupin léků (pomalidomid, carfilzomib a ixazomib) a taktéž jsou testovány zcela nové skupiny léků s odlišným mechanismem účinku. V klinických studiích fáze 3 jsou testovány monoklonální protilátky, checkpoint-inhibitory (Anti-PD-1/PD-L1) a inhibitory histon-deacetyláz. Ve fázích 1 a 2 je analyzována efektivita protinádorových vakcín, T-lymfocytů s chimérickým receptorem (CAR-T), oligodeoxynukleotidů ovlivňujících plazmocytoidní dendritické buňky a inhibitorů chemokinů (NOX-A12) ovlivňujících nádorové mikroprostředí [3].
Použití monoklonálních protilátek v léčbě hematologických malignit má za sebou již bezmála dvacet let úspěšné historie. První a dodnes široce používaná protilátka rituximab (anti-CD20) znamenala zásadní průlom v léčbě CD20 pozitivních non-Hodgkinských lymfomů [4] a chronické lymfocytární leukemie [5]. S postupem času se do klinické praxe dostala celá řada dalších monoklonálních protilátek s větším či menším dopadem na úspěšnost léčby jednotlivých krevních malignit [6]. Obdobná situace provázela i léčbu mnohočetného myelomu. Efekt prvních klinicky testovaných monoklonálních protilátek (anti-CD20, anti-CD38) byl pouze minimální. Slibnější výsledky v časných klinických studiích vykazovaly protilátky proti jiným cílům (CD40, CD56, TRAIL-R1, CD74, CD317), nicméně zásadního přínosu v léčbě mnohočetného myelomu nedosáhly a k jejich rozšíření do klinické praxe nedošlo [7]. Podstatně větší účinnost vykazuje protilátka anti-SLAMF7 (elotuzumab). Ačkoliv nevykazovala léčebný účinek v monoterapii [8], kombinace elotuzumabu s lenalidomidem a dexametazonem signifikantně zvýšila počet léčebných odpovědí a prodloužila medián bezpříznakového přežití oproti samotnému lenalidomidu a dexametazonu o 6 měsíců [9]. Nová protilátka proti antigenu CD38, daratumumab, je podle dostupných výsledků klinických studií vysoce efektivním lékem s přijatelným a dobře zvladatelným profilem nežádoucích účinků [27, 28]. Tato práce má za cíl shrnutí současných poznatků o léčbě mnohočetného myelomu daratumumabem.
ANTIGEN CD38 – CÍL VAZBY DARATUMUMABU
Lidský antigen CD38 je transmembránový glykoprotein o molekulární hmotnosti 46 kDa. Převážná část (258 aminokyselin) se nachází extracelulárně, zatímco intracelulární část je poměrně malá (21 aminokyselin). Fyziologicky je CD38 exprimován především na krevních buňkách. Nachází se jak na kmenových buňkách hematopoézy, tak na zralých buňkách lymfoidní či myeloidní linie (NK buňky, monocyty, dendritické buňky, erytrocyty a trombocyty) [10]. V malé míře je také exprimován na nehematopoetických tkáních (Purkyňovy buňky v kůře mozečku, epitelové buňky prostaty, β buňky pankreatu, osteoklasty a jiné) [11]. Molekula CD38 funguje na povrchu buňky jako receptor, který zprostředkuje slabé adhezní interakce mezi cirkulujícími lymfocyty a endoteliálními buňkami. Děje se tak prostřednictvím interakce s molekulou CD31 (PECAM 1) na buňkách endotelu [12]. Dále má CD38 funkci enzymatickou, kdy prostřednictvím metabolismu cyklické adenosin difosfát ribózy (cADPR) ovlivňuje množství Ca2+ iontů v cytosolu, a tím řadu jiných drah buněčné signalizace [13].
Molekula CD38 se nachází na povrchu buněk různých hematologických onemocnění. Především se jedná o buňky mnohočetného myelomu [14], chronické lymfocytární leukemie [15] a dalších onemocnění (Waldenströmova makroglobulinemie, primární AL amyloidóza, lymfom plášťových buněk a akutní leukemie) [16].
Struktura a mechanismus účinku daratumumabu
Daratumumab je humánní monoklonální protilátka typu IgG1 kappa, která se specificky váže na epitop nacházející se na extracelulární doméně molekuly CD38 [17].
V souvislosti s poznatky preklinických testování se předpokládá kombinovaný mechanismus účinku daratumumabu na buňky mnohočetného myelomu. Jako zásadní se jeví schopnost aktivovat cytotoxickou reakci závislou na komplementu (complement-dependent cytotoxicity – CDC). Komplement je aktivován klasickou cestou, navázáním podjednotky C1q na Fc fragment daratumumabu. Výsledkem této komplexní reakce je poškození cytoplazmatické membrány nádorových buněk, tvorba dalších opsoninů, chemoatraktantů a anafylatoxinů, rozvíjejících zánětlivou reakci [18]. Dalším důležitým mechanismem účinku je protilátkově zprostředkovaná cytotoxicita (antibody-dependent cell-mediated cytotoxicity – ADCC). Po navázání Fc fragmentu daratumumabu na FcγRIIIa receptor efektorové buňky dochází k cytotoxické reakci a následné lýze nádorových buněk [19]. Výsledky preklinických studií ukazují, že současné použití lenalidomidu augmentuje vlastní ADCC efekt daratumumabu [18]. Další překvapivý nález z in vitro testů prokázal, že efektivita jak CDC, tak ADCC zřejmě nezávisí na „předléčenosti“ buněk pacientů s mnohočetným myelomem. Nebyl prokázán signifikantní rozdíl v efektivitě CDC a ADCC u nádorových buněk pacientů s nově diagnostikovaným mnohočetným myelomem oproti nádorovým buňkám pacientů rezistentních na kortikosteroidy, konvenční chemoterapii, bortezomib a lenalidomid. Autoři studie předpokládají, že určujícím faktorem efektivity obou mechanismů účinků je míra exprese molekuly CD38 [19]. Taktéž je v in vitro testech předpokládán synergní účinek při současném podání all-trans retinové kyseliny (ATRA) založený na zvýšení exprese CD38 a naopak snížení exprese komplement-inhibičních molekul (CD55 a CD59) [20]. Dalším známým mechanismem účinku daratumumabu je protilátkou vyvolaná fagocytóza (antibody-dependent cellular phagocytosis – ADCP) [21]. Bylo prokázáno, že vazba daratumumabu na extracelulární doménu molekuly CD38 ovlivňuje její enzymatickou aktivitu. Výsledkem je snížení hladiny cADPR a Ca2+ iontů v cytosolu, což může vést k indukci buněčné smrti [22]. Předpokládá se také, že více komplexů daratumumab–CD38 na povrchu buňky propojených pomocí anti-Fc protilátky či buněk exprimujících Fcγ-receptory může indukovat u nádorových buněk apoptózu [23].
Použití daratumumabu v léčbě relabovaného mnohočetného myelomu
Efektivitu daratumumabu v monoterapii jako první analyzovala studie fáze 1/2 pro relabovaný/refrakterní myelom (GEN501). V první fázi studie bylo zahrnuto 32 pacientů. V rozmezí dávkování od 4–24 mg/kg bylo dosaženo 33 % (4/12) parciálních remisí. Nebyla stanovena maximální tolerovaná dávka. V druhé fázi studie bylo zahrnuto celkem 72 pacientů, kteří byli rozděleni do ramene léčeného dávkou 16 mg/kg (42 pacientů) a ramene léčeného dávkou 8 mg/kg (30 pacientů). Jednalo se o velmi výrazně předléčené pacienty, medián podaných linií léčby byl u obou skupin 4 a medián času od stanovení diagnózy byl zhruba 5,5 roku. Z obou skupin absolvovalo vysokodávkovanou chemoterapii s autologní transplantací kostní dřeně celkem 76 % pacientů. Ve skupině léčené dávkou 16 mg/kg bylo dosaženo celkově 36 % celkových léčebných odpovědí (PR a lepší) oproti 10 % u pacientů léčených dávkou 8 mg/kg (HR: 0,36 (95% CI, 0,22–0,52). Dva pacienti léčení ve skupině s 16 mg/kg daratumumabu dosáhli kompletní remise (CR). Medián přežití bez progrese (PFS) byl ve skupině léčené dávkou 16 mg/kg 5,6 měsíce (95% CI, 4,2–8,1) a 2,4 měsíce u skupiny léčené 8 mg/kg (95% CI, 1,4–3,5). Po 12 měsících léčby přežívalo v obou skupinách shodně 77 % pacientů. V ramenu léčeném dávkou 16 mg/kg byl medián času dosažení léčebné odpovědi 0,9 měsíce. Nejčastěji se vyskytujícími nežádoucími účinky léčby byly reakce při prvním infuzním podání daratumumabu. Reakci gr. 1–2 (podle NCI) prodělaly téměř tři čtvrtiny pacientů, reakce se projevila jako rinitida, kašel, bolest hlavy, teplota a dyspnoe. Počet byl u obou ramen srovnatelný (71 % vs. 70 %). Další nežádoucí účinky gr. 3–4 byly popsány u 26 % léčených 16 mg/kg a u 53 % léčených 8 mg/kg. Jednalo se nejčastěji o pneumonii, trombocytopenii, neutropenii, anémii a hyperglykemii [24].
Další klinickou studií fáze 2 hodnotící monoterapii daratumumabem u refrakterních/relabovaných pacientů byl SIRIUS (MMY2002). V první fázi této studie bylo randomizováno 36 pacientů do 2 ramen, léčených buď dávkou 8 mg/kg, nebo 16 mg/kg. Vzhledem k nedosažení kritérií pro pokračování v druhé fázi, byla léčba dávkou 8 mg/kg po proběhlé první fázi ukončena. Celkově tedy bylo dávkou 16 mg/kg daratumumabu léčeno 106 pacientů. Jednalo se o velmi předléčené nemocné, kdy medián linií předchozí léčby byl 5 a 95 % pacientů bylo rezistentních na bortezomib a lenalidomid.
Ze všech léčených dosáhlo 29 % (31/106) léčebné odpovědi (PR a lepší). Stringentní kompletní remise (sCR) dosáhla 3 % (3/106) pacientů, velmi dobré parciální remise (VGPR) 9 % (10/106) a 17 % (18/106) dosáhlo parciální remise (PR). V podskupině nemocných, kteří byli refrakterní na lenalidomid, pomalidomid, bortezomib a carfilzomib, dosáhlo PR a lepší léčebné odpovědi 21 % (7/33) léčených.
Medián trvání léčebné odpovědi (DOR) byl 7,4 měsíce (95% CI, 5,5 – nedosaženo). Medián přežití bez progrese (PFS) byl 3,7 měsíce (95% CI, 2,8–4,6). Ve 12 měsících od zahájení léčby přežívalo 65 % léčených (95% CI, 51–76). Medián celkového přežití (OS) byl 17,5 měsíců (95% CI, 13,7 – nedosaženo). Infuzní reakce gr. 1–2 se vyskytly u 43 % pacientů, závažnou infuzní reakci (gr. 3) mělo pouze 5 % (5/106) pacientů. Pouze 6 % (6/106) pacientů mělo infuzní reakci opakovaně. Nejčastější hematologický nežádoucí účinek léčby byla anémie v 33 % (35/106), trombocytopenie v 25 % (27/106) a neutropenie v 23 % (24/106). Z nehematologických nežádoucích účinků se vyskytla nejčastěji únava u 40 % (42/106) a nevolnost u 29 % (31/106). Závažné (gr. 3–4) nežádoucí účinky léčby mělo celkově 23 % (24/106) nemocných. Léčba byla dobře tolerována, žádný z nemocných nepřerušil léčbu z důvodu intolerance léku (tab. 1) [25].
Tab. 1. Účinnost daratumumabu v monoterapii u pacientů s relabovaným mnohočetným myelomem ve studii fáze II (SIRIUS) 
Vysvětlivky: ORR – celková léčebná odpověď (overal response rate); CR – kompletní remise (complete response); VGPR – velmi dobrá parciální remise (very good partial response); PR – parciální remise (partial response); DOR – trvání léčebné odpovědi (duration of response); PFS – přežití bez progrese (progression free survival); OS – celkové přežití (overall survival) V současnosti jsou známy výsledky dvou randomizovaných multicentrických studií fáze 3 pro relabovaný či refrakterní mnohočetný myelom.
První studie, CASTOR, srovnávala kombinaci daratumumab-bortezomib-dexametazon (DVd) oproti kombinaci bortezomib-dexametazon (Vd). Randomizováno bylo celkem 498 pacientů, do ramene s daratumumabem 251 a do ramene se standardní léčbou 247. Medián předchozích linií léčby je 2 a 48 % bylo již léčeno inhibitorem proteasomu či imunomodulačními léky. Daratumumab signifikantně zvýšil četnost celkových léčebných odpovědí (PR a lepší, 83,0 % vs. 63,0 %, p < 0,0001), velmi dobrých parciálních remisí (VGPR a lepší; 59 % vs. 29 %; p < 0,0001) a kompletních remisí (CR a lepší; 19,0 % vs. 9,0 %; p < 0,0012). V jednom roce přežívalo bez progrese signifikantně více pacientů léčených v ramenu s daratumumabem (60,7 % vs. 26,9 %; p < 0,001, HR: 0,39 (95% CI, 0,28–0,53). V podskupině pacientů s jednou předchozí linií léčby přežívalo bez progrese v prvním roce 77,5 % v ramenu léčeném režimem DVd oproti 29,4 % pacientů v ramenu Vd (p < 0,0001; HR: 0,31 (95% CI, 0,18–0,52). V rameni léčeném daratumumabem bylo signifikantně prodlouženo trvání léčebné odpovědi (DOR), medián pro režim DVd nebyl dosažen, pro Vd byl 7,9 měsíce. Medián času do progrese (TTP) pro rameno s daratumumabem nebyl dosažen, pro Vd byl 7,3 měsíce. Po 12 měsících sledování bylo bez progrese 65,4 % léčených režimem DVd oproti 28,8 % léčených Vd (p < 0,0001; HR: 0,30 (95% CI, 0,21–0,43). Nejčastější závažné (gr. 3–4) nežádoucí účinky léčby režimem DVd byly trombocytopenie (45 %), anémie (14 %) a neutropenie (7 %). Pro tyto nežádoucí účinky přerušilo léčbu celkem 7 % léčených daratumumabem. Infuzní reakce se vyskytla v 45 %, závažnější reakce (gr. 3) byly však pouze v 9 % případů. Infuzní reakce se vyskytla v 98 % při prvním podání. Tato studie probíhá též v České republice, nábor do studie je však již ukončen [26].
Studie POLLUX (MMY3003) srovnává kombinaci daratumumab-lenalidomid-dexametazon (DRd) s kontrolní skupinou léčenou standardní léčbou relapsu lenalidomid-dexametazon (Rd). Celkově bylo randomizováno 569 pacientů, do skupiny léčené daratumumabem 286 pacientů a do skupiny léčené režimem Rd 283 pacientů, medián předchozích linií léčby byl 1. První výsledky byly publikovány v červnu tohoto roku na kongresu EHA (European Hematology Association). Režim DRd vykazoval signifikantně vyšší účinnost, celkové léčebné odpovědi (PR a lepší) dosáhlo 93 % oproti 76 % léčených režimem Rd (p < 0,0001). Dále pacienti léčeni v ramenu s daratumumabem dosahovali vyššího počtu velmi dobrých parciálních remisí (VGPR a lepší; 76 % vs. 44 %; p < 0,0001) a kompletních remisí (CR a lepší; 43 % vs. 19 %; p < 0,0001). Medián přežití bez progrese (PFS) nebyl u režimu DRd dosažen, u Rd byl 18,4 měsíce. V 18měsíčním sledování přežívalo 78 % léčených režimem DRd oproti 52 % léčených v režimem Rd (HR: 0,37 (95% CI, 0,27–0,52; p < 0,0001). Prodloužení PFS bylo nezávislé na věku, stadiu choroby, počtu předchozích linií léčby a předchozí léčbě lenalidomidem. Medián trvání léčebné odpovědi nebyl u daratumumabu dosažen, ve skupině léčené Rd byl 17,4 měsíce. V 18 měsících sledování přežívalo více pacientů léčených daratumumabem (86 % vs. 76 %; HR: 0,64 (95% CI, 0,40–1,01; p = 0,0534). Mezi nejčastější závažné (gr. 3–4) nežádoucí účinky režimu DRd patřila neutropenie (52 %), trombocytopenie (13 %) a anémie (12 %). Kvůli nežádoucím účinkům bylo nuceno přerušit léčbu 7 % léčených. Infuzní reakce (gr. 1–2) se vyskytly u 48 % pacientů, závažné reakce (gr. 3) se vyskytly u 5 % léčených. Infuzní reakce se v 92 % vyskytly v průběhu prvního podání dratumumabu (tab. 2) [27].
Tab. 2. Efektivita kombinované léčby daratumumabem – výsledky randomizovaných studií fáze III – POLLUX a CASTOR 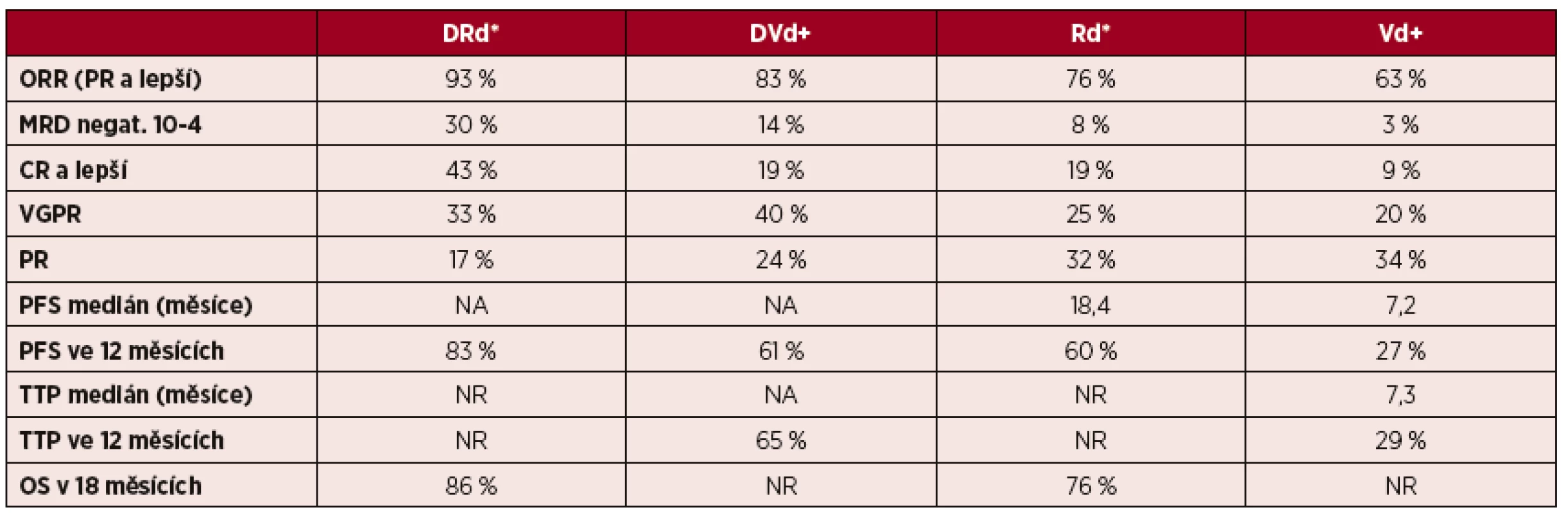
Vysvětlivky: ORR – celková léčebná odpověď (overall response rate); CR – kompletní remise (complete response); MRD negat. – negativní minimální zbytková choroba (minimal residual disease); VGPR – velmi dobrá parciální remise (very good partial response); PR – parciální remise (partial response); TTP – čas do progrese (time to progression); PFS – přežití bez progrese (progression free survival); OS – celkové přežití (overall survival); NA – nelze použít (not applicable); NR – není uvedeno (not reported); *ve studii POLLUX; +ve studii CASTOR. Použití daratumumabu v léčbě nově diagnostikovaného mnohočetného myelomu
Vzhledem k vysoké efektivitě daratumumabu u relabovaných pacientů byly zahájeny klinické studie s cílem vyhodnotit efekt daratumumabu u nově diagnostikovaných pacientů s mnohočetným myelomem. V současnosti hodnotí efektivitu daratumumabu v primoterapii 3 randomizované multicentrické studie fáze 3.
Pro pacienty nesměrované k vysokodávkované chemoterapii a autologní transplantaci kostní dřeně je nyní i v České republice dostupná studie ALCYONE (MMY3007). Srovnává kombinaci daratumumab-bortezomib-melfalan-prednizon (D-VMP) oproti standardní léčbě bortezomib-melfalan-prednizon (VMP) [28]. Další studií pro primoterapii nemocných nesměrovaných k intenzivní léčbě je MAIA. Ve dvou ramenech srovnává kombinaci daratumumab-lenalidomid-dexametazon (DRd) oproti téže kombinaci bez daratumumabu (Rd) [29].
Třetí studie, CASSIOPEIA, je určená pro nemocné schopné absolvovat vysokodávkovanou chemoterapii s transplantací periferních kmenových buněk (PBSCT). Srovnává daratumumab ve čtyřkombinaci s režimem bortezomib-thalidomid-dexametazon (D-VTD) oproti trojkombinaci VTD. Po PBSCT bude následovat další fáze srovnávající přínos konsolidační terapie daratumumabem oproti sledování [30].
Interference daratumumabu při laboratorním vyšetření
Vzhledem ke skutečnosti, že daratumumab je monoklonální IgG protilátka a na erytrocytech je slabě exprimován antigen CD38, lze očekávat interference daratumumabu při předtransfuzním vyšetření či při monitorování paraproteinu produkovaného mnohočetným myelomem [10, 17].
Interferenci daratumumabu při rutinním předtransfuzním vyšetření popisuje práce amerických autorů z loňského roku. U pacientů léčených ve studii GEN5001 byla při rutinním předtransfuzním vyšetření náhodně zjištěna pozitivita nepřímého antiglobulinového testu (NAT). Pan-reaktivitu vyvolávaly volné molekuly daratumumabu v séru pacienta reagující s erytrocyty v reagencii. Autoři této práce navrhují několik možných metodik, jak zabránit těmto falešně pozitivním výsledkům NAT. Nejefektivnějším způsobem je ošetřit erytrocyty v reagencii dithiothritolem (DTT), který způsobí denaturaci extracelulární domény antigenu CD38. Daratumumab se na denaturovaný epitop nenaváže a tím nezpůsobí falešně pozitivní NAT. DTT na povrchu erytrocytů rovněž mimo jiné denaturuje antigen Kell, což může naopak vést k falešně negativnímu výsledku NAT při současné koexistenci anti-Kell protilátek. Tato koincidence je však velmi nepravděpodobná a navíc Kell antigen se vyskytuje v kavkazské populaci jen v 9 % [34]. Jiným přístupem je ošetřit vzorek séra pacienta solubilním CD38 či anti-idiotypovými protilátkami proti daratumumabu, což je však velmi nákladné [31]. Při posouzení hloubky léčebné odpovědi je nutné rozlišit, zda přítomnost monoklonální linie v zóně pro IgG při elektroforéze anebo pozitivní záchyt imunofixace molekuly IgG kappa je dán přítomností hladiny daratumumabu v séru anebo zbytkovou aktivitou choroby. Vzhledem k faktu, že k naplnění kritérií dosažení kompletní remise (CR) je nutná právě negativní imunofixace, nabývá metodika odlišení falešně pozitivních výsledků velké důležitosti [32]. Vysoce specifická a efektivní metoda k odlišení vlastního paraproteinu od daratumumabu při sledování léčebné odpovědi je DIRA (Daratumumab-specific immunofixation electrophoresis rexlex assay). Metoda je založená na přidání myší anti-daratumumab protilátky, která se vysoce specificky váže na daratumumab bez interference s jinými monoklonálními imunoglobuliny. Komplexy daratumumabu a anti-daratumumab protilátky se přesouvají v elektroforetickém gelu mimo zónu IgG a tím odhalují vlastní paraprotein. Metoda DIRA je schopna spolehlivě zachytit daratumumab ve vzorku již od koncentrací 0,2 g/l, kdy zřejmě již interferuje s paraproteinem. Limitace této metody spočívají v tom, že není kvantitativní a výsledky musí interpretovat odborník zkušený v této problematice. Dále při vysoké koncentraci polyklononálních imu-noglobulinů může být obtížně rozpoznatelná přítomnost komplexu daratumumab-anti-daratumumab protilátky mezi ostatními polyklonálními pásy. Vysoké koncentrace polyklonálních imunoglobulinů však nejsou u pacientů s mnohočetným myelomem běžné [33].
ZÁVĚR A DISKUSE
Monoklonální protilátka daratumumab je novým vysoce účinným a perspektivním lékem, který nabízí možnost zasáhnout buňky mnohočetného myelomu zcela odlišným mechanismem než doposud používané preparáty. Efektivita daratumumabu je značná již v monoterapii. Ve studiích s velmi předléčenými nemocnými na léčbu odpověděla třetina nemocných a léčebnou odpověď udržela po dobu zhruba 6 měsíců [24, 25].
Při nepřímém srovnání výsledků klinických studií s jinými vysoce efektivními léky mají studie hodnotící monoterapii daratumumabem podobné či dokonce příznivější výsledky. Bylo zaznamenáno vyšší procento léčebných odpovědí a delší přežití bez progrese než u srovnatelné skupiny nemocných léčených monoterapií pomalidomidem [35], carfilzomib v monoterapii u podobně předléčených nemocných vykazuje ve výsledcích klinických studií srovnatelnou efektivitu jako daratumumab, a to jak v procentu dosažených léčebných odpovědí, tak v jejich délce [36]. Nutno však dodat, že dávka metylprednizolonu k prevenci infuzních reakcí daratumumabu byla značná. Odpovídala ekvivalentní dávce dexametazonu jako u klasické kombinované léčby s pulzními kortikosteroidy [25]. Tento fakt výrazně limituje objektivitu porovnání monoterapie daratumumabem s monoterapií jinými vysoce efektivními preparáty mimo přímé srovnání, které však není dostupné. Je také zřejmé, že kombinovaná léčba je podstatně efektivnější než monoterapie, a to u pomalidomidu, carfilzomibu i daratumumabu [26, 27, 35, 40]. Toto potvrzují i výsledky randomizovaných studií fáze 3 FOCUS a ENDEAVOR. U výrazně předléčených pacientů carfilzomib v monoterapii dosáhl srovnatelných výsledků s konvenční chemoterapií (cyklofosfamid + dexametazon), zatímco přidání dexametazonu ke carfilzomibu výrazně zlepšuje dlouhodobé parametry přežití oproti kombinaci bortezomibu s dexametazonem [39, 40].
Velkou výhodou se zdá být fakt, že rezistence na předchozí léčbu nejspíše neovlivňuje výsledný léčebný efekt daratumumabu [20, 24, 25]. Odlišný mechanismus účinku daratumumabu nabízí široké možnosti použití v kombinaci se standardními léčebnými protokoly. Očekávatelnou synergii s IMiDy [18] potvrzují výsledky randomizované studie, kdy v kombinaci s lenalidomidem a dexametazonem na léčbu odpovědělo více než devět desetin relabovaných pacientů a kompletní remise dosáhla téměř polovina [27]. Tyto výsledky jsou v léčbě myelomu zcela převratné. Například režim VTD, který je v České republice používán jako nejefektivnější standardní režim pro léčbu nově diagnostikovaných nemocných, vykazoval v primoterapii srovnatelné množství celkových léčebných odpovědí a paradoxně o polovinu méně kompletních remisí než kombinovaná léčba daratumumabem (DRd) v relapsu [37]. Kombinace daratumumabu s bortezomibem vykazuje vyšší účinnost, je-li použita u prvního relapsu [26].
Z výsledků u relabovaných pacientů očekáváme též vysokou efektivitu daratumumabu v kombinaci se standardní léčbou u nově diagnostikovaných pacientů. Tuto otázku analyzují 3 randomizované klinické studie fáze 3 [28, 29, 30]. Ačkoliv kompletní výsledky budou dostupné nejdříve až po roce 2020, již nyní očekáváme, že pilotní výsledky těchto studií potvrdí názor řady expertů, považujících čtyřkombinaci daratumumabu s IMiDem, inhibitorem proteasomu a kortikosteroidy za nejefektivnější známou indukční léčbu nově diagnostikovaného mnohočetného myelomu. Tato kombinace bude schopna zásadním způsobem ovlivnit hloubku léčebné odpovědi a tímto dramaticky prodloužit celkové přežití [38].
Bez přehnaného optimismu nelze vyloučit, že indukční léčba čtyřkombinací daratumumabu s inhibitorem proteasomu, IMiDem a kortikosteroidy bude zásadním krokem k vyléčení mnohočetného myelomu. Lze zcela jistě očekávat, že limitujícím prvkem pro široké využití tohoto léku bude jeho cena. Vzhledem ke skutečně průlomovým výsledkům klinických studií pro relabované pacienty je velmi pravděpodobné, že se daratumumab v dohledné době stane součástí standardů léčby jak pro relabované pacienty, tak pro primoterapii.
Seznam použitých zkratek
ADCC – antibody dependent cellular cytotoxicity
ADCP – antibody dependent cellular phagocytosis
ATRA – all-trans retinová kyselina
cADPR – cyklická adenosin difosfát ribóza
CAR-T – Chimeric-antigen-receptor T cells
CD – cluster of differentiation
CDC – complement dependent cytotoxicity
CI – confidence interval
CR – complete response
DIRA – daratumumab-specific immunofixation electrophoresis rexlex assay
DOR – duration of response, trvání léčebné odpovědi
DRd – daratumumab-Revlimid(lenalidomid)-dexametazon
DTT – dithiothritol
DVd – daratumumab-Velcade(bortezomib)-dexametazon
DVMP – daratumumab-Velcade(bortezomib)-melfalan-prednizon
FcγRI-III – receptor pro Fc fragment IgG imunoglobulinu (typ I-III)
IMiDy – imunomodulační léky
MRD – minimal residual disease
NAT – nepřímý antiglobulinový test
NCI – National Cancer Institute
ORR – overall response rate, celková léčebná odpověď, v tomto textu jako PR a lepší
OS – overall survival, celkové přežití
PBSCT – peripheral blood stem cell transplantation
PD-1/PD-L1 – programmed cell death receptor1/ligand
PECAM1 – platelet endothelial cell adhesion molecule 1
PFS – progression free survival, přežití bez progrese
PR – partial response
Rd – Revlimid(lenalidomid)-dexametazon
sCR – stringent complete response
SLAMF7 – signaling lymphocytic activation molecule F7
TRAIL-R1 – TNF-related apoptosis-inducing ligand-Receptor 1
TTP – time to progression, čas do progrese
Vd – Velcade(bortezomib)-dexametazon
VGPR – very good partial response
VMP – Velcade(bortezomib)-melfalan-prednizon
VTD – Velcade(bortezomib)-thalidomid-dexametazon
Podíl autorů na rukopisu
MŠ – napsání rukopisu
LP – kontrola rukopisu, konzultace problematiky
VS – kontrola rukopisu
MK – kontrola rukopisu
ZA – kontrola rukopisu
ZK – kontrola rukopisu
Poděkování
Tato publikace vznikla na Masarykově univerzitě v rámci projektu „Nové přístupy ve výzkumu, diagnostice a terapii hematologických malignit III“, číslo MUNI/A/1028/2015 podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2016.
Tato publikace vznikla za podpory grantu AZV 15-29508A.
Prohlášení o konfliktu zájmů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce dne 24. 8. 2016.
Přijato po recenzi dne 10. 10. 2016.
MUDr. Martin Štork
Interní hematologická a onkologická klinika FN Brno
Jihlavská 20
625 00 Brno
e-mail: Stork.Martin@fnbrno.cz
Zdroje
1. Kumar S, Rajkumar S, Dispenzieri A, et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008; 111 : 2516–2520.
2. San-Miguel JF, Mateos MV. Can multiple myeloma become a curable disease? Haematologica 2011; 96 : 1246–1248.
3. Bianchi G, Richardson PG, Anderson KC. Promising therapies in multiple myeloma. Blood 2015; 126(3): 300–310.
4. Cabanillas F. Rituximab in DLBCL: 6 years on. Lancet Oncol 2011; 12 : 984–985.
5. Casak SJ, Lemery SJ, Shen YL, et al. U.S. Food and Drug Administration approval: rituximab in combination with fludarabine and cyclophosphamide for the treatment of patients with chronic lymphocytic leukaemia. Oncologist 2011; 16 : 97–104.
6. Nelson AL, Dhimolea E, Reichert JM, et al. Development trends for human monoclonal antibody therapeutics. Nat Rev Drug Discov 2010; 9(10): 767–774.
7. Tai YT, Anderson KC. Antibody-based therapies in multiple myeloma. Bone Marrow Res 2011; 2011 : 924058.
8. Zonder JA, Mohrbacher AF, Singhal S, et al. A phase 1, multicenter, open-label, dose escalation study of elotuzumab in patients with advanced multiple myeloma. Blood 2012; 120(3): 552–559.
9. Lonial S, Dimopoulos M, Palumbo A, et al. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med 2015; 373 : 621–631.
10. Zocchi E, Franco L, Guida L, et al. A single protein immunologically identified as CD38 displays NAD+ glycohydrolase, ADP-ribosyl cyclase and cyclic ADP-ribose hydrolase activities at the outer surface of human erythrocytes. Biochem Biophys Res Commun 1993; 196 : 1459–1465.
11. Deaglio S, Mehta K, Malavasi F, et al. Human CD38: a (r)evolutionary story of enzymes and receptors. Leuk Res 2001; 25 : 1–12.
12. Deaglio S, Morra M, Mallone R, et al. Human CD38 (ADP-ribosyl cyclase) is a counter-receptor of CD31, an Ig superfamily member. J Immunol 1998; 160 : 395–402.
13. Aarhus R, Graeff RM, Dickey DM, et al. ADP-ribosyl cyclase and CD38 catalyze the synthesis of a calcium-mobilizing metabolite from NADP. J Biol Chem 1995; 270 : 30327–30333.
14. Lin P, Owens R, Tricot G, et al. Flow cytometric immunophenotypic analysis of 306 cases of multiple myeloma. Am J Clin Pathol 2004; 121 : 482–488.
15. Damle R, Wasil T, Fais F, et al. IgV gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94 : 1840–1847.
16. van de Donk NW, Janmaat ML, Mutis T, et al. Monoclonal antibodies targeting CD38 in hematological malignancies and beyond. Immunol Rev 2016; 270(1): 95–112.
17. de Weers M, Tai YT, van der Veers MS, et al. Daratumumab, a novel therapeutic human CD38 monoclonal antibody, induces killing of multiple myeloma and other hematological tumors. J Immunol 2011; 186 : 1840–1848.
18. Diebolder CA, Beurskens FJ, de Jong RN, et al. Complement is activated by IgG hexamers assembled at the cell surface. Science 2014; 343 : 1260–1263.
19. van der Veer MS, de Weers M, van Kessel B, et al. Towards effective immunotherapy of myeloma: enhanced elimination of myeloma cells by combination of lenalidomide with the human CD38 monoclonal antibody daratumumab. Haematologica 2011; 96 : 284-290.
20. Nijhof IS, Groen RW, Lokhorst HM, et al. Upregulation of CD38 expression on multiple myeloma cells by all-trans retinoic acid improves the efficacy of daratumumab. Leukemia 2015; 29 : 2039–2049.
21. Overdijk MB, Verploegen S, Bögels M, et al. Antibody-mediated phagocytosis contributes to the anti-tumor activity of the therapeutic antibody daratumumab in lymphoma and multiple myeloma. MAbs 2015; 7 : 311–321.
22. Preyat N, Leo O. Complex role of nicotinamide adenine dinucleotide in the regulation of programmed cell death pathways. Biochem Pharmacol 2016; 101 : 13–26.
23. Jansen JH, Boross P, Overdijk MB, et al. Daratumumab, a human CD38 antibody induces apoptosis of myeloma tumor cells via Fc receptor-mediated crosslinking. American Society of Hematology Proceedings 2012. Blood 2012; 120(21): 2974.
24. Lokhorst HM, Plesner T, Laubach JP, et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 2015; 373 : 1207–1219.
25. Lonial S, Weiss BM, Usmani SZ, et al. Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. Lancet 2016; 387 : 1151–1160.
26. Palumbo A, Chanan-Khan A, Wiesel K, et al. Phase 3 randomised controlled study of daratumumab, bortezomib a dexamethasone versus bortezomib and dexamethasone in patients with relapsed or refractory multiple myeloma: CASTOR. Haematologica 2016; 101(S1): Abstract LB 2236.
27. Dimopulos M. Daratumumab shows remarkable benefit in relapsed or refractory multiple myeloma in the POLLUX Study. Haematologica 2016; 101(S1): Abstract LB 2238.
28. Mateos MV, Cavo M, Jakubowiak AJ, et al. A randomized open-label study of bortezomib, melphalan, and prednisone (VMP) versus daratumumab (DARA) plus VMP in patients with previously untreated multiple myeloma (MM) who are ineligible for high-dose therapy: 54767414MMY3007 (Alcyone). J Clin Oncol 2015; 33(15 Suppl): Abstract TPS8608.
29. Janssen Research & Development LLC. Study comparing daratumumab, lenalidomide, and dexamethasone with lenalidomide and dexamethasone in participants with previously untreated multiple myeloma (Nahlíženo 20. 7. 2016). Dostupné na https://clinicaltrials.gov/show/NCT02252172.
30. Intergroupe Francophone du Myelome. A study to evaluate daratumumab in transplant eligible participants with previously untreated multiple myeloma (Cassiopeia) (Nahlíženo 20.7.2016) Dostupné na https://clinicaltrials.gov/show/NTC02541383.
31. Mohandas N, Narla A. Blood group antigens in health and disease. Curr Opin Hematol 2005; 12 : 135–140.
32. Chapuy CI, Nicholson RT, Aguad MD, et al. Resolving the daratumumab interference with blood compatibility testing. Transfusion 2015; 55(6Pt 2): 1545-1554.
33. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15 : 538–548.
34. McCudden C, Axel A, Slaets D, et al. Assessing clinical response in multiple myeloma (MM) patients treated with monoclonal antibodies (mAbs): validation of a daratumumab IFE reflex assay (DIRA) to distinguish malignant M-protein from therapeutic antibody. J Clin Oncol 2015; 33(15 Suppl): 8590.
35. Richardson PG, Siegel DS, Vij R, et al. Pomalidomide alone or in combination with low-dose dexamethasone in relapsed and refractory multiple myeloma: a randomized phase 2 study. Blood 2014; 123 : 1826–1832.
36. Siegel DS, Martin T, Wang M, et al. A phase 2 study of single-agent carfilzomib (PX-171-003-A1) in patients with relapsed and refractory multiple myeloma. Blood 2012; 120(14): 2817–2825.
37. Cavo M, Pantani L, Pettruci MT, et al. Bortezomib-thalidomide-dexamethasone is superior to thalidomide-dexamethasone as consolidation therapy after autologous hematopoietic stem cell transplantation in patients with newly diagnosed multiple myeloma. Blood 2012; 120 : 9–19.
38. Gay F, Larocca A, Vijermans P, et al. Complete response correlates with long-term progression-free and overall survival in elderly myeloma treated with novel agents: analysis of 1175 patients. Blood 2011; 117 : 3025–3031.
39. Hájek R, Masszi T, Petrucci MT, et al. A randomized phase III study of carfilzomib vs low-dose corticosteroids with optional cyclophosphamide in relapsed and refractory multiple myeloma (FOCUS). Leukemia 2016 Elektronická verze zveřejněna 15.7.2016; doi: 10.1038/leu.2016.176.
40. Dimopoulos MA, Moreau P, Palumbo A, et al. Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR): a randomised, phase 3, open-label, multicentre study. Lancet Oncol 2016; 17(1): 27–38.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2016 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Využití monoklonální protilátky daratumumab v léčbě mnohočetného myelomu
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Vplyv ibrutinibu na doštičkovú agregáciu
- Kryokonzervované trombocyty v klinické praxi: srovnávací studie s nativními trombocyty
- Hodnocení nátěru aspirátu kostní dřeně
- Životní jubileum doc. MUDr. Adély Bártové, CSc.
- OBSAH ROČNÍKU 22/2016
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Hodnocení nátěru aspirátu kostní dřeně
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



