-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
Apheresis platelets versus pooled platelets – comparison of quality and safety
Platelet transfusions have an important place in haemotherapy thanks to the progress in oncological and intensive care treatment. Apheresis platelets as well as pooled platelets – platelet concentrates derived from whole blood are available in the Czech Republic, although the use of these two product types may vary. There is a widely accepted opinion among clinicians that apheresis platelets are of a higher quality and are safer compared to pooled platelets. Many studies have compared both of these types and these assumptions have not confirmed. This review presents the existing information on apheresis and pooled platelets and compares them from various aspects. The first part of this work describes platelet transfusion products, how they are prepared and stored. The second part compares platelet concentrates from apheresis with platelets derived from whole-blood donations from the aspect of adverse post-transfusion events, risk of alloimmunization and refractoriness.
Key words:
apheresis platelets – pooled platelets – adverse events – alloimmunization – refractoriness
Autoři: H. Lejdarová 1,2
Působiště autorů: Transfuzní a tkáňové oddělení, Fakultní nemocnice Brno 1; Katedra laboratorních metod, Lékařská fakulta Masarykovy univerzity, Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 4, p. 244-253.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Léčba trombocyty zaujímá v oblasti hemoterapie významné místo, a to díky pokroku v léčbě onkologických onemocnění i v intenzivní medicíně. V České republice jsou dostupné jak trombocyty z aferézy, tak směsné z odběrů plné krve, názory na jejich použití se však liší. Mezi lékaři je stále rozšířený názor, že aferetické trombocyty převyšují směsné přípravky kvalitou i bezpečností. Srovnáním obou typů přípravků se zabývala řada studií, které zmíněné předpoklady nepotvrdily. Toto souhrnné sdělení předkládá dostupné informace o trombocytech z aferézy a směsných z plné krve a srovnává je z různých hledisek. První část popisuje způsob výroby a skladování trombocytových transfuzních přípravků. V druhé části jsou porovnány trombocyty z aferézy a směsné z plné krve z pohledu výskytu nežádoucích reakcí po podání transfuze, zejména s ohledem na riziko aloimunizace a vzniku refrakternosti.
Klíčová slova:
trombocyty z aferézy – trombocyty směsné – nežádoucí reakce – aloimunizace – refrakternostÚVOD
Transfuze trombocytů mají nezastupitelnou roli v profylaxi a léčbě krvácení pacientů s trombocytopenií, méně často trombocytopatií. Trombocytové transfuzní přípravky lze vyrobit aferetickou technikou pomocí separátorů krevních elementů nebo z odběrů plné krve. Oba typy jsou v klinické praxi široce rozšířené [1]. Jednotlivé státy se v produkci a spotřebě aferetických a směsných trombocytů značně liší, např. v Nizozemsku představují trombocyty z plné krve přibližně 95 % produkce, zatímco ve Spojených státech amerických (USA) jsou vyráběny převáženě trombocyty aferetické [2]. V České republice (ČR) je podíl produkce aferetických a směsných přípravků u konkrétních výrobců trombocytů rozdílný, a to v závislosti na zavedených postupech, velikosti produkce a požadavcích indikujících lékařů. Směsné trombocyty z odběrů plné krve jsou často považovány za méně bezpečné z hlediska rizika přenosu infekce a aloimunizace, protože obsahují materiál od více dárců. Je to zřejmě jedním z důvodů, proč představují trombocyty z plné krve v ČR pouze asi čtvrtinu celkové spotřeby trombocytových transfuzních přípravků, ačkoliv jsou s aferetickými přípravky kvalitou srovnatelné a cenově výhodnější (graf 1) [3].
Graf 1. Produkce trombocytových transfuzních přípravků v České republice v roce 2014* 
TBSD – trombocyty z buffy-coatu směsné deleukotizované TBS – trombocyty z buffy-coatu směsné TAD – trombocyty z aferézy deleukotizované TA – trombocyty z aferézy *V době vzniku tohoto souhrnného článku nebyla data z roku 2015 zpracována Celkem existují tři způsoby výroby trombocytů určených ke klinickému použití. Dva z nich využívají jako vstupní materiál plnou krev. Touto metodou lze získat trombocyty z buffy-coatu (BC) nebo z plazmy bohaté na destičky (PRP) [4, 5]. V Evropě převažuje výroba z BC, v USA se směsné trombocyty získávají převážně z PRP [1]. Třetí metodou je odběr krevních destiček přímo od dárce technikou aferézy. Trombocyty lze resuspendovat v dárcovské plazmě nebo v náhradních roztocích určených pro výrobu trombocytových transfuzních přípravků (PAS – platelet aditive solutions). Lze je ošetřit deleukotizací zařazenou přímo do procesu výroby nebo před výdejem transfuzního přípravku ke klinickému použití v laboratorních podmínkách nebo u lůžka pacienta (bed-side filtrace). Poslední jmenovaný způsob je nejméně účinný. Podle souhrnných výročních zpráv Ministerstva zdravotnictví ČR a Ústavu zdravotnických informací a statistiky ČR tvoří již většinu celorepublikové produkce deleukotizované trombocyty, což představuje významný krok ke zvýšení bezpečnosti podaných transfuzí (graf 1) [3].
VÝROBA A SKLADOVÁNÍ TROMBOCYTOVÝCH TRANSFUZNÍCH PŘÍPRAVKŮ
Postupy pro výrobu transfuzních přípravků uvádí různá mezinárodní doporučení. Dále jsou pak konkretizovány legislativními normami jednotlivých zemí, které udávají i kvalitativní parametry vyrobených produktů [6, 7, 8].
Kritéria pro výběr dárců plné krve jsou v ČR stanovena Vyhláškou o lidské krvi a dále upřesněna v Doporučení Společnosti pro transfuzní lékařství ČLS JEP. Pro výběr dárců k odběru trombocytů metodou aferézy platí některé další požadavky, jako například limit pro hodnoty trombocytů nebo dočasná vyřazení z důvodu užívání léků, které ovlivňují funkce krevních destiček [8, 9].
Výroba směsných trombocytů z plné krve je založena na dvoustupňové centrifugaci s meziproduktem PRP nebo BC [10]. V ČR jsou směsné trombocyty získávány pouze z BC, pro přehlednost je však uvedena i technologie z PRP. Aferetické trombocyty jsou odebírány přímo dárci pomocí separátorů krevních elementů [4].
PRP metoda
Plná krev se odebírá do antikoagulačního roztoku (CPD nebo CPDA-1). Nejprve se provede tzv. nízkoobrátková (soft-spin) centrifugace (~ 1000 g), kterou se plná krev rozdělí na dvě vrstvy – erytrocyty a PRP. Získaná PRP se pak v druhém kroku centrifuguje při vysokých otáčkách (~ 3000 g) za vzniku koncentrátu trombocytů. Vysoce aktivované destičky se nechají 1–2 hodiny ustálit v klidu a následně se resuspendují [4]. V USA, kde se směsné trombocyty připravují právě touto metodou, je možné podle standardů AABB (American Association of Blood Banks) skladovat vaky s plnou krví k výrobě trombocytů maximálně 8 hodin po odběru při pokojové teplotě [6], ačkoliv je prokázáno, že plná krev může být skladována 24 hodin, aniž by byla ovlivněna kvalita trombocytů [10, 11].
BC metoda
Plná krev se odebírá, stejně jako v předchozím případě, do antikoagulačního roztoku (CPD nebo CPD-A1). Podle platných evropských doporučení ji lze před zpracováním skladovat 24 hodin při pokojové teplotě [7]. Při přípravě trombocytů z BC se plná krev nejprve centrifuguje při vysokých otáčkách, čímž se docílí rozdělení plné krve do tří vrstev – erytrocytů, BC a plazmy, které jsou následně odděleny. Vzniklý BC obsahuje přibližně 90 % trombocytů a 70 % leukocytů původního vstupního materiálu a následná nízkoobrátková centrifugace umožní získat jednu transfuzní jednotku (T.U. – transfusion unit) trombocytů. K přípravě jedné terapeutické dávky (T.D. – therapeutic dose) se obvykle používá 4–6 BC [4]. Zpočátku byly BC zpracovávány individuálně, později bylo zjištěno, že smísení trombocytů ze 4–6 transfuzních jednotek je z hlediska výroby efektivnější a usnadňuje i vlastní aplikaci trombocytů [10]. Bezprostředně po výrobě je míra aktivace trombocytů vyrobených z BC výrazně menší v porovnání s metodou z PRP, během skladování se však tyto rozdíly stírají [4].
Aferetický odběr trombocytů
Trombocyty z aferézy jsou získávány od jednoho dárce prostřednictvím systémů pro aferézu tvořených separátorem krevních elementů a soupravou krevních vaků. Odebraná krev je ihned mísena s antikoagulačním roztokem ACD. Cílové komponenty jsou sbírány do samostatných sběrných vaků, zatímco ostatní složky krve jsou dárci navráceny zpět do oběhu. Součástí procedury může být deleukotizace [4].
Trombocyty lze resuspendovat v dárcovské plazmě nebo v PAS. Jednotlivé typy PAS mohou být používány jak pro přípravu aferetických destiček, tak destiček směsných. Podle aktuální terminologie ISBT (The International Society of Blood Transfusion) jsou PAS rozděleny do osmi kategorií PAS-A až PAS-G, jejichž složení uvádí tabulka 1. Obvyklé zastoupení plazmy v celkovém objemu transfuzního přípravku je 20–50 % a PAS 50–80 % [12].
Tab. 1. Kategorie náhradních roztoků pro výrobu trombocytů a jejich složení 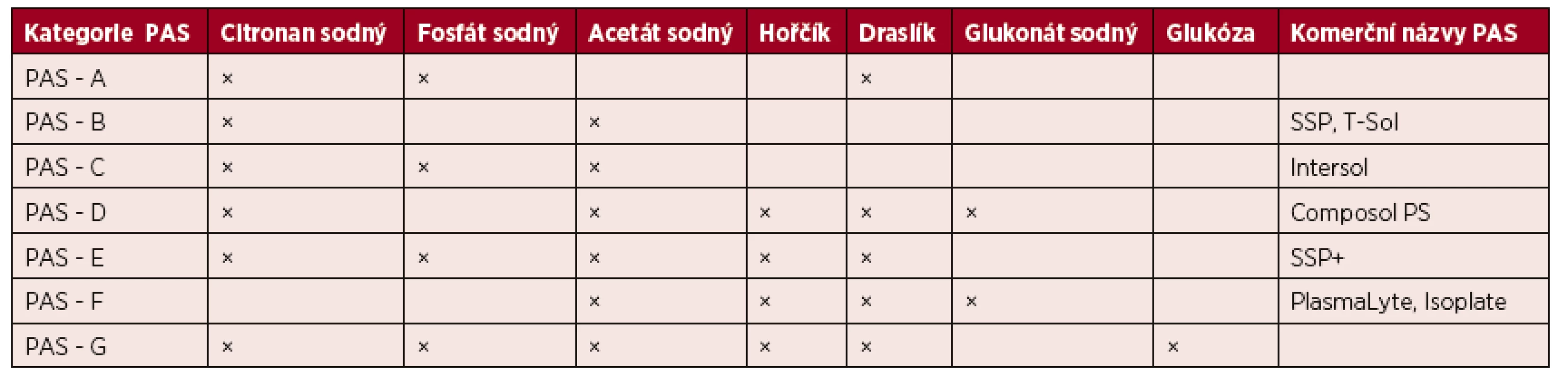
(Upraveno podle Gulliksson H. Platelet storage media. Vox Sang 2014; 107: 205–2012) Minimální obsah trombocytů v 1 T.D. trombocytového transfuzního přípravku je stanoven na 2 x 1011 [7]. V současné době je již většina trombocytů vyrobených v ČR ošetřena deleukotizací, která je součástí procesu výroby a je ze všech uvedených způsobů nejúčinnější. Obsah reziduálních leukocytů v 1 T.D. přípravku je tak snížen na méně než 1 x 106 a riziko výskytu některých nežádoucích reakcí po podání transfuze výrazně klesá.
Trombocytové transfuzní přípravky se skladují při teplotě 20–24 °C za nepřetržitého promíchávání na agitátorech po dobu 5 dnů. Mohou být skladovány až 7 dnů, je-li provedeno vyšetření případné nežádoucí bakteriální kontaminace nebo je-li proveden postup snižující riziko této kontaminace [8]. Trombocyty se uchovávají ve speciálních vacích s dostatečnou propustností pro kyslík a oxid uhličitý [8, 13, 14].
Orientační posouzení kvality trombocytů v běžné praxi umožňuje tzv. swirling (vířivý) fenomén. Trombocyty jsou fragmenty megakaryocytů a v krevním oběhu se nacházejí v diskoidním tvaru, kde průměrně přežívají 7–10 dní. Právě tento diskoidní tvar neaktivovaných trombocytů umožňuje odrážet paprsky dopadajícího světla, což se projevuje pozorovatelným vířivým efektem. Pokud jsou krevní destičky vystaveny aktivačním podnětům, snadno změní tvar z diskoidního na sférický s ostnatými výběžky. V závislosti na intenzitě podnětu je aktivace reverzibilní nebo ireverzibilní. Aktivované trombocyty v transfuzních přípravcích mohou snižovat účinnost transfuze. Z tohoto důvodu je nutné jejich aktivaci během odběru, zpracování i skladování předcházet [4].
SROVNÁNÍ TROMBOCYTŮ Z AFERÉZY A SMĚSNÝCH Z PLNÉ KRVE
Parametry kvality
Kvalita trombocytů je první oblastí, která by měla být hodnocena při porovnávání aferetických a směsných přípravků, protože zásadním způsobem ovlivňuje účinnost a dobu přežití trombocytů v cirkulaci příjemce transfuze. Kvalitu trombocytových transfuzních přípravků ovlivňuje celá řada faktorů, z nichž nejdůležitějšími jsou výrobní postupy, včetně posouzení způsobilosti dárce krve k odběru, druh protisrážlivého roztoku, který byl při jejich přípravě použit, koncentrace trombocytů v transfuzním přípravku, způsob resuspenze, kontaminace leukocyty a podmínky, za jakých byly přípravky skladovány [14]. Zatímco plná krev je odebírána do antikoagulačního roztoku CPD (citronan sodný–fosfát–dextróza), při trombocytaferéze se jako protisrážlivý roztok obvykle používá ACD (kyselina citrónová–citronan sodný–dextróza), protože fosfát stimuluje glykolýzu v trombocytech, což by mohlo mít negativní vliv na vlastnosti krevních destiček během skladování [5].
Existují jen minimální rozdíly v kvalitě trombocytů z plné krve a z aferézy. Obsah a koncentrace trombocytů v jedné terapeutické dávce aferetických i směsných destiček z BC, stejně jako počet reziduálních leukocytů, je obdobný. Signifikantní rozdíl nebyl zaznamenán ani při sledování pH, markerů aktivace CD62P (P-selectinu) a CD63 a markerů apoptózy (fosfatidylserinu, annexinu V), agregace nebo obsahu ATP [1, 5].
Účinnost transfuze trombocytů
Jednou z možností, jak hodnotit účinnost podané transfuze krevních destiček, je potransfuzní vzestup trombocytů u příjemce vyjadřovaný pomocí CCI (Corrected Count Increment). Hodnotou CCI u aferetických a směsných přípravků se v minulosti zabývala řada studií [15, 16, 17, 18, 19]. Aferetické trombocyty, ve srovnání se směsnými destičkami z plné krve, vykazovaly vyšší hodnotu CCI za 1 hodinu po transfuzi, pokud nebyly rozlišeny směsné přípravky z BC a PRP. Jakmile však byly destičky z plné krve z BC a PRP rozděleny do samostatných skupin, byl zaznamenán signifikantní rozdíl mezi aferetickými a PRP, zatímco aferetické a směsné z BC se neodlišovaly. Podobné výsledky byly pozorovány i po 18 až 24 hodinách [1, 18, 20]. Stejně tak nebyl prokázán statisticky významný rozdíl v incidenci krvácení 2. a vyššího stupně podle klasifikace WHO (World Health Organization) [2, 21]. Neexistují tedy přesvědčivé důkazy o tom, že by se CCI, klinický efekt nebo interval mezi transfuzemi u aferetických a směsných destiček z BC zásadně odlišovaly. Účinnost podaných transfuzí je srovnatelná [1].
Nežádoucí reakce po podání trombocytů
Transfuze trombocytů může vyvolat nežádoucí reakci u příjemce, tzv. potransfuzní reakci. Porovnáním aferetických a směsných přípravků se zaměřením na výskyt těchto reakcí se zabývala řada studií, které nepřinášejí z hlediska bezpečnosti příjemce zásadní důkazy o rozdílech mezi oběma typy. Na základě dostupných informací lze shrnout, že obsah reziduálních leukocytů, obsah plazmy, doba skladování a rovněž faktory spojené s konkrétním pacientem, se jeví jako důležitější pro vznik akutní potransfuzní reakce, než typ destičkového produktu [1].
Febrilní nehemolytická potransfuzní reakce
Febrilní nehemolytická potransfuzní reakce (FNHTR) patří k nejčastějším potransfuzním reakcím obecně a k nejčastějším reakcím po podání trombocytů [2, 21]. Je způsobena cytokiny, které se uvolňují z leukocytů přítomných v transfuzním přípravku v průběhu jeho skladování. V některých případech bývá příčinou FNHTR přítomnost protilátek proti leukocytům (často anti-HLA protilátek) v plazmě pacienta [22]. Proto mohou být z hlediska výskytu FNHTR srovnávány pouze přípravky s obdobným obsahem leukocytů [1]. V zemích, kde byla zavedena plošná deleukotizace, se výskyt FNHTR výrazně snížil [22]. V rozsáhlé britské prospektivní randomizované studii autorů Anderson et al. bylo prokázáno, že pravděpodobnost výskytu FNHTR po podání aferetických (3,1 %) a směsných z BC (3,8 %) je srovnatelná, pokud jsou deleukotizovány, a zároveň signifikantně nižší ve srovnání s PRP metodou (17,1 %) [15].
Alergická reakce
Alergická reakce po podání trombocytů je vedle FNHTR, další často se vyskytující nežádoucí reakcí. Je způsobena reakcí protilátek příjemce transfuze s plazmatickými bílkovinami a alergeny přítomnými v transfuzním přípravku [23]. Je velmi obtížné ji předvídat či přijmout účinná preventivní opatření. Mnohé klinické studie dokládají, že premedikace bývá neefektivní a její role u pacientů s opakovanými reakcemi je stále diskutována. Nejúčinnější prevencí těžkých a opakovaných alergických reakcí se jeví promytí trombocytového transfuzního přípravku, při kterém však dochází k nežádoucímu úbytku trombocytů. Výskyt alergické reakce je závislý zejména na atopické predispozici příjemce a na množství podané plazmy [2, 24]. Použití náhradních roztoků pro výrobu trombocytů snižuje obsah plazmy od konkrétního dárce v transfuzním přípravku a vede k signifikantnímu snížení výskytu alergických reakcí. Pokud je náhradní roztok použit pro výrobu aferetických trombocytů, obsah plazmy od jednoho dárce se pohybuje kolem 60 – 120 ml. V případě směsných trombocytů z BC nebo PRP činí obsah plazmy od jednoho dárce pouze 15–25 ml [1]. Statisticky významný rozdíl ve výskytu alergické potransfuzní reakce u aferetických a směsných trombocytů z BC však prokázán nebyl [1, 20, 5].
Bakteriální a virová kontaminace
Postupy při výrobě transfuzních přípravků jsou zaměřeny na snížení rizika přenosu bakteriálních a virových infekcí transfuzí. Teplota, při níž se trombocyty skladují (20–24 °C), poskytuje ideální podmínky pro růst řady bakterií [4]. V rozsáhlé prospektivní multicentrické studii, zabývající se výskytem bakteriální kontaminace trombocytových transfuzních přípravků autorů Schrezenmeier et al., byl podíl pozitivně konfirmovaných jednotek u aferetických přípravků 0,09 % a u směsných 0,06 %, čili bez významného rozdílu [25].
Rezervovaný postoj vůči směsným trombocytům často vyplývá z teoretického předpokladu vyššího rizika kontaminace krví přenosnými infekcemi. Tento předpoklad však dosud žádnou ze studií nebyl potvrzen. Dále je nutné vzít v úvahu fakt, že pokud je odebrán za účelem výroby transfuzního přípravku infikovaný dárce v tzv. diagnostickém okně, v případě trombocytů z plné krve je ohrožena pouze jedna terapeutická dávka trombocytů, zatímco v rámci aferetického odběru mohou být vyrobeny terapeutické dávky až tři. Dárci podstupující aferetické odběry mají také ve srovnání s dárci plné krve, s ohledem na kratší povolený interval mezi odběry, výrazně větší pravděpodobnost opakovaného odběru v imunologickém okně [1, 8, 9]. Ačkoliv je v ČR, v rámci zvýšení bezpečnosti hemoterapie, podporováno bezplatné dárcovství krve a krevních složek, trombocytaferetické odběry jsou většinou výrobců transfuzních přípravků propláceny, a to pro omezenou dostupnost vhodných dárců a organizační i časovou náročnost zajištění tohoto typu dárcovských odběrů.
Uvedené skutečnosti dokládá případ z přelomu srpna a září 2015 zachycený ve Všeobecné fakultní nemocnici v Praze, kdy byla jedním dárcem trombocytů přenesena hepatitida C na tři hematoonkologicky nemocné děti a následně v rámci profesionální nákazy onemocněla touto infekcí i jedna zdravotní sestra. Kontaminované transfuzní přípravky pocházely ze dvou aferetických odběrů v odstupu necelého měsíce, přičemž dárce byl v obou případech vyšetřen na přítomnost anti-HCV s negativním výsledkem. Na základě této události byla v ČR zahájena diskuse o povinné detekci krví přenosných infekcí u dárců krve na úrovni nukleových kyselin, tzv. NAT metodami (nucleic acid test), čímž by došlo k žádoucímu zkrácení tzv. diagnostického okna infekce HIV, hepatitidy B a C a následně ke zvýšení bezpečnosti hemoterapie.
TRALI
TRALI (Transfusion Related Acute Lung Injury) představuje akutní poškození plic transfuzí. Jedná se o závažnou reakci, která se klinicky projevuje těžkou dušností nastupující obvykle v průběhu 6 hodin od zahájení transfuze, těžkým oboustranným otokem plic a hypoxií. Příčinou je přítomnost antileukocytových protilátek (anti-HLA nebo anti-HNA) v plazmě dárce, méně často pak v krvi příjemce. Leukocyty aktivované protilátkami adherují k endotelu plicních kapilár, a tím způsobují obstrukci plicní mikrocirkulace [22]. Prevencí vzniku TRALI je vyloučení dárců se zvýšeným rizikem aloimunizace, v případě výskytu protilátek u příjemce je účinným preventivním opatřením deleukotizace. Klinické projevy TRALI se mohou vyskytnout i v případech, kdy HLA protilátky u dárce ani u příjemce prokázány nejsou. Směsné trombocyty sice obsahují ve srovnání s aferetickými menší množství plazmy od jednoho dárce, zejména jsou-li resuspendovány v náhradním roztoku, je však prokázáno, že TRALI může být zapříčiněna i velmi malými objemy plazmy. Současně je příjemce směsných destiček vystaven vyššímu riziku přenosu antileukocytových protilátek z důvodu obsahu plazmy od více dárců. Pro porovnání mezi oběma typy z hlediska rizika TRALI neexistuje v současné době dostatek dat, nelze tedy v tomto směru učinit jednoznačný závěr [1, 2].
Aloimunizace a refrakternost k trombocytům
Aloimunizace a refrakternost k trombocytům patří ke komplikacím, které limitují léčbu a mohou být i život ohrožující [21]. Refrakternost k léčbě trombocyty může mít příčinu imunní nebo neimunní [26]. Neimunní příčiny v etiologii klinických projevů refrakternosti na trombocyty výrazně převažují a jsou asociovány se zvýšenou konzumpcí trombocytů, popř. kvalitou a způsobem aplikace transfuzního přípravku [27, 28].
Jednou z nejrozsáhlejších studií, které se problematikou aloimunizace zabývaly, byla multicentrická randomizovaná studie TRAP (The Trial to Reduce Alloimmunization to Platelets). Jejím cílem bylo popsat vliv deleukotizace a patogen – redukčních technik na prevenci vzniku aloimunizace a refrakternosti v souvislosti s léčbou trombocyty. Všichni zařazení pacienti podstoupili indukční chemoterapii pro akutní myeloidní leukemii, nebyly u nich před zařazením do studie detekovány aloprotilátky a byli randomizováni do následujících čtyř skupin podle typu podávaných trombocytů: 1. neupravené směsné trombocyty (kontrolní skupina), 2. deleukotizované směsné, 3. ošetřené redukcí patogenů UV-B směsné a 4. deleukotizované aferetické [17]. Největší výskyt aloprotilátek byl zaznamenán v 1. skupině, kde si aloprotilátky vytvořilo 13 % pacientů (pozitivita LCT testu), míra aloimunizace v ostatních skupinách byla srovnatelná (3 % ve 2. skupině, 5 % ve 3. skupině a 4 % ve 4. skupině). Klinické projevy refrakternosti byly zaznamenány celkem u 27 % pacientů z nejrůznějších příčin [1, 17]. Data shromážděná díky studii TRAP přinesla cenné informace o klinickém dopadu aplikace trombocytů. Záchyt aloimunizace byl, ve srovnání s kontrolní skupinou, ve všech skupinách nižší. Studie tedy nepřinesla, z pohledu rizika aloimunizace, důkazy o rozdílu mezi aferetickými a směsnými trombocyty, výskyt aloimunizace závisel na absenci nebo provedení deleukotizace, nikoli na typu trombocytů [1].
K novějším multicentrickým studiím, které se zabývaly sledováním míry imunizace a refrakternosti po podání trombocytů, patří studie PLADO (The Platelet Dose Trial). Část pacientů byla léčena výhradně deleukotizovanými aferetickými trombocyty, část deleukotizovanými trombocyty z plné krve. Celkem 5 % pacientů se v průběhu studie imunizovalo, ve 4 % ve skupině aferetických trombocytů a v 8 % ve skupině směsných. Signifikantně vyšší výskyt aloimunizace byl pozorován v souvislosti s těhotenstvím, chemoterapií a nízkou dávkou trombocytů. Klinické projevy refrakternosti byly zaznamenány celkem u 14 % pacientů, ve 13 % po aferetických přípravcích a v 18 % po směsných. Imunní příčina však byla prokázána jen u 8 % pacientů s klinickými projevy refrakternosti, což dokládá vysoký výskyt neimunních příčin [21]. Studie PLADO tedy určitý rozdíl mezi aferetickými a směsnými přípravky zaznamenává, vykazuje však značnou nesourodost zařazených pacientů z hlediska diagnózy, věku a dávek podaných trombocytů. Skupina pacientů léčených výhradně aferetickými trombocyty byla výrazně početnější než skupina léčená pouze destičkami směsnými.
Přístup k léčbě se u aloimunizovaných pacientů s klinickými projevy refrakternosti značně liší v závislosti na možnostech a zvyklostech konkrétního pracoviště. Optimální je zajištění HLA shodných přípravků. Nevýhodou je však vysoká cena a omezená dostupnost. Má-li pacient určenu specifitu dané HLA protilátky, je možné rozšířit výběr trombocytů z plné HLA shody na negativitu v daném antigenu, proti němuž je vytvořena daná protilátka. Zvyšuje se tak však riziko imunizace proti dalším antigenům. Nejběžněji a nejrychleji jsou kompatibilní trombocyty zajišťovány pomocí testů „cross-match“. Poslední možností je podání transfuze směsných trombocytů. Obsah krevních destiček od více dárců ve srovnání s aferetickými přípravky zvyšuje naději na převod kompatibilních trombocytů [2]. Efekt tohoto postupu je však podle našich zkušeností značně nejistý a měl by být použit pouze v případě, kdy nejsou dostupné jiné možnosti.
RhD aloimunizace
Trombocyty, na rozdíl od antigenů AB0, antigeny Rh systému na svém povrchu neexprimují. Riziko RhD aloimunizace souvisí výhradně s příměsí erytrocytů v trombocytových transfuzních přípravcích. Obsah erytrocytů je vyšší v trombocytech vyrobených z plné krve než v odebraných aferetickou technikou [29].
Starší studie uváděly incidenci RhD aloimunizace u RhD negativních příjemců po podání RhD pozitivních trombocytů až 19 % [30, 31, 32]. Recentní data však dokládají, že riziko aloimunizace po podání RhD inkompatibilních trombocytů je velmi nízké [33, 34, 35].
Ke studiím s největším rozsahem a s nejdelším sledováním RhD aloimunizace u RhD negativních pacientů po podání RhD pozitivních trombocytů patří studie ADAPT (The Anti-D Alloimmunization after D-incompatible Platelet Transfusions study). Do studie byli zahrnuti příjemci transfuze jak z evropských center (46 %), tak i z amerických (54 %). Data byla získávána retrospektivně z let 2010, 2011 a 2012. Do studie nebyli zařazeni pacienti, kteří dostali v minulosti imunoglobulin anti-D nebo již měli před rokem 2010 anti-D protilátku, či byli transfundováni RhD pozitivními transfuzními přípravky. U všech zařazených pacientů byl screening antierytrocytových protilátek proveden nejdříve za 28 dní po podání RhD pozitivních trombocytů. Výsledkem studie byl velmi nízký záchyt RhD aloimunizace, což bylo zřejmě dáno třemi důvody [36]. Prvním byla minimální příměs erytrocytů v podaných trombocytech. Údaje o kontrole kvality ze zúčastněných center prokázaly, že obsah erytrocytů v aferetických přípravcích byl 0,00043 ml a ve směsných 0,036 ml. Přesto nebyl podán průkazný rozdíl ve schopnosti aferetických a směsných trombocytů imunizovat příjemce. Pravděpodobně souvisí s minimálním objemem erytrocytů přítomných v trombocytovém přípravku schopném způsobit vznik imunizační odpovědi, a tím je objem 0,03 ml [29, 36, 37]. Dalším důvodem byl fakt, že schopnost tvořit protilátky je značně ovlivněna stupněm imunosuprese pacienta. Zatímco imunokompetentní jedinci po RhD inkompatibilních erytrocytech tvoří protilátky až v 80 %, u pacientů po transplantaci krvetvorných buněk, HIV pozitivních a příjemců solidních orgánů se jedná o situaci nepříliš častou a v případě podání RhD inkompatibilních trombocytů zcela výjimečnou [36, 38]. Třetí příčinou bylo vyloučení jedinců, jejichž anti-D protilátka by mohla být projevem sekundární imunizační odpovědi. Vyšší výskyt imunizace v některých studiích v minulosti byl dán právě záchytem i sekundární imunitní odpovědi, nikoli pouze primární. Celkový výskyt imunizace antigenem D po podání inkompatibilních trombocytů byl v této studii 1,44 % [36].
Zdrojem imunizace nemusí být vždy příměs erytrocytů samotných, ale mnohdy postačuje přítomnost erytrocytových mikročástic. Jedná se o odloučené části erytrocytové membrány nesoucí antigenní struktury schopné vyvolat imunitní odpověď. Ve studii, která se zabývala problematikou non-D imunizace v souvislosti s příměsí erytrocytů v trombocytových transfuzních přípravcích, byl odhadnut objem erytrocytů v aferetických přípravcích v rozmezí od 0,4 až 0,8 μl a objem erytrocytových mikročástic s menší přesností 0,1–1 μl. Autoři vyjádřili hypotézu, že menší, ale pravděpodobně početnější mikročástice mohou být imunogennější než samotné erytrocyty, protože mohou být snadněji fagocytovány antigen prezentujícími buňkami příjemce. Nicméně uzavírají, že aloimunizační potenciál tak malého objemu erytrocytových mikročástic je spíš teoretický, jejich existence by si však měla vyžádat podrobnější výzkum vedený snahou minimalizovat imunologické vedlejší efekty podaných transfuzí [39].
Výskyt anti-D aloimunizace po podání RhD pozitivních trombocytů RhD negativním příjemcům je nízký. Přesto je přijato doporučení předcházet imunizaci žen ve fertilním věku a dětí dodržením RhD kompatibility, eventuálně aplikovat imunoglobulin anti-D, pokud není zajištění kompatibilní transfuze možné [29, 40].
AB0 neshoda
V praxi má být preferováno podání trombocytů AB0 shodných, shodu ale není nezbytné dodržet, pokud to naléhavost požadavku a aktuální dostupnost přípravku nedovolují. Doposud není sjednoceno, zda je vhodnější upřednostnit kompatibilitu antigenů nebo protilátek v AB0 systému. Podání trombocytů neshodných v AB0 antigenech s příjemcem má za následek zkrácení doby přežití transfundovaných trombocytů v cirkulaci, zatímco podání trombocytů resuspendovaných v plazmě, která obsahuje protilátky proti AB0 antigenům příjemce, může vést k hemolýze erytrocytů příjemce transfuze. Použití PAS pro resuspenzi trombocytů toto riziko významně zmírňuje snížením titru anti-A a anti-B přítomných v transfuzním přípravku. V Evropě je použití PAS již standardem, v USA se zatím nejedná o běžnou praxi [29, 40].
Dlouho přetrvával názor, že při jinoskupinovém podání aferetické trombocyty krevní skupiny 0 nesou vyšší riziko vzniku intravaskulární hemolýzy u příjemce ve srovnání se směsnými produkty. V roce 2008 publikoval Cooling et al. práci, která tento předpoklad vyvrací a dokládá, že titry anti-A a anti-B protilátek v aferetických trombocytech jsou obdobné jako ve směsných přípravcích [2, 41]. Příklady neshody při jinoskupinovém podání trombocytových transfuzních přípravků předkládá tabulka 2.
Tab. 2. Příklady AB0 neshody mezi krevní skupinou dárce/trombocytového transfuzního přípravku a příjemce transfuze 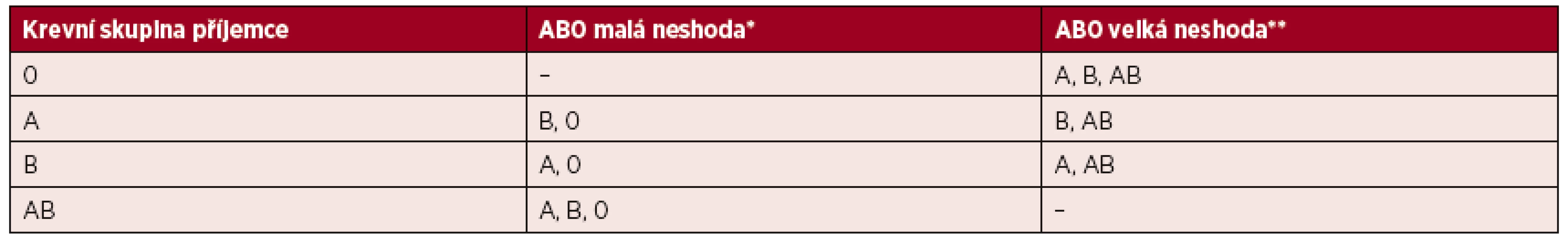
(Upraveno podle Cid J, Harm SK, Yazer MH. Platelet transfusion – the Art and Science of Compromise. Transf Med Hemother 2013; 40: 160–171.) *Dárce má protilátky proti AB0 antigenům erytrocytů příjemce. **Příjemce má protilátky proti AB0 antigenům trombocytů dárce. Bezpečnost dárce
Nežádoucí reakce může vyvolávat jak dárcovství plné krve, tak dárcovství krevních složek technikou aferézy. Klinické projevy těchto reakcí mohou být nejrůznější, nejčastěji se jedná o nevolnost, bolesti hlavy, zvracení, event. kolaps se ztrátou vědomí, případně může dojít k lokálním komplikacím v souvislosti s vpichem (hematom, iritace nervu, iritace šlachy, punkce arterie apod.). Dostupné studie dokládají nižší výskyt mírných i závažných nežádoucích reakcí u dárcovství plné krve ve srovnání s aferetickými odběry.
Opakované trombocytaferézy mohou vést k relativnímu vyčerpání trombopoézy a poklesu trombocytů. Přesto však klinicky významná trombocytopenie nebývá u dárců krevních destiček pozorována. Pokles ionizovaného vápníku, v souvislosti s použitím citronanu sodného jako antikoagulantu u aferetických odběrů, může vést u dárců k projevům citrátové toxicity (parestezie, bolesti hlavy, třes, křeče). Profylaktické podání kalcia p. o. zmírňuje projevy této nežádoucí reakce jen mírně. Některé studie dokládají u dárců krevních destiček zvýšené projevy kostního metabolizmu a radiologické známky osteopenie jsou pozorovatelné zhruba u třetiny z nich. Citronan sodný rovněž váže hořčík, který může být snížen až o 30 %. Klinicky se pokles hladiny hořčíku projevuje slabostí, svalovými spasmy a oslabením myokardiální kontraktility [1]. Je však třeba zmínit, že uvedené nežádoucí projevy, kromě citrátové toxicity, přicházejí v úvahu spíše u častých aferetických odběrů v krátkých intervalech, které nejsou v ČR obvyklé, a proto jsou tyto reakce pozorovány sporadicky.
ZÁVĚR
Dosavadní poznatky a publikované studie, které se srovnáním trombocytů z aferézy a z plné krve zabývaly, nepotvrzují významné rozdíly mezi oběma typy transfuzních přípravků. Jsou srovnatelné z pohledu kvality, účinnosti i bezpečnosti podaných transfuzí. Nebylo potvrzeno ani vyšší riziko směsných přípravků z plné krve v oblasti aloimunizace a přenosu infekcí, což by se, s ohledem na obsah materiálu od většího počtu dárců, dalo předpokládat. Souhrnné srovnání aferetických a směsných trombocytů s odkazem na citovanou literaturu obsahuje tabulka 3.
Tab. 3. Srovnání deleukotizovaných trombocytů resuspendovaných v náhradním roztoku z aferézy a z plné krve ve vybraných parametrech 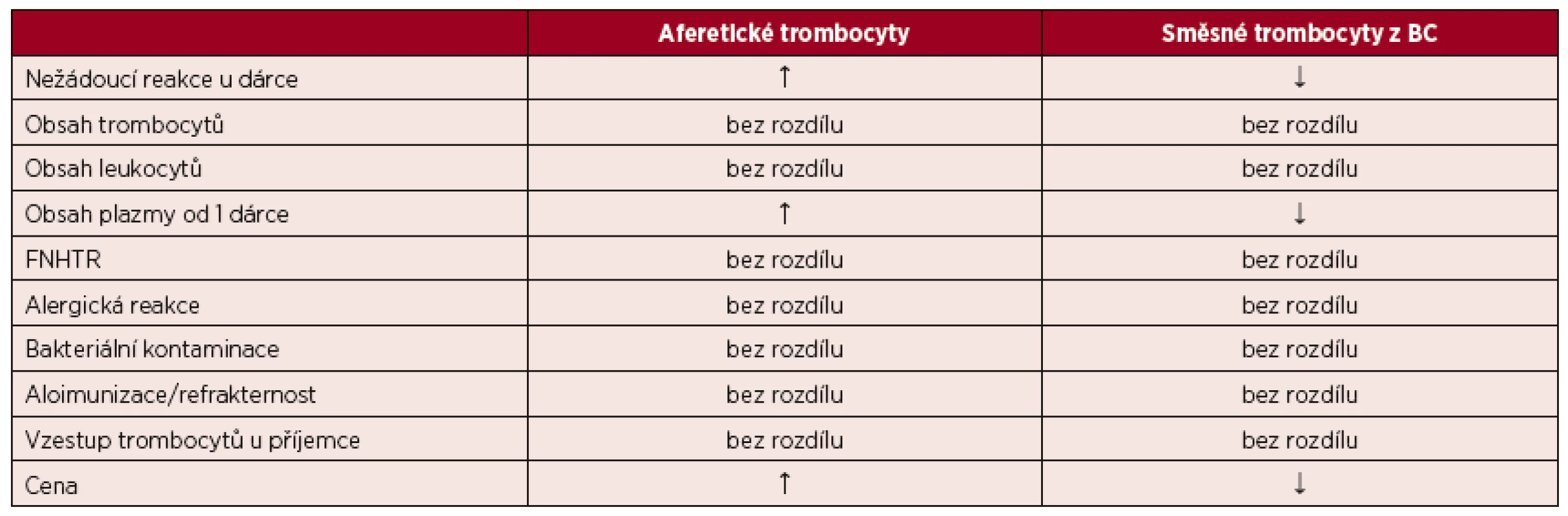
Nespornou výhodou směsných trombocytů z plné krve, v porovnání s aferetickými přípravky, je jejich nižší cena a snazší dostupnost. Za zmínku stojí i skutečnost, že se jedná o transfuzní přípravky pocházející výhradně od bezplatných dárců krve. Bezpečnost podaných transfuzí směsných destiček lze dále zvýšit vyloučením prvodárců z jejich výroby, kteří jsou z hlediska výskytu krví přenosných infekcí rizikovější než opakovaní dárci.
Zmíněná, v zahraniční literatuře často zdůrazňovaná dostupnost je však relativní a bývá zdůrazňována zejména v souvislosti s velkými zpracovatelskými centry. V podmínkách naší transfuzní služby s velkým počtem zpracovatelů jsou z hlediska dostupnosti stálým problémem méně časté krevní skupiny, kdy počet dárců v odběrovém dni nemusí být dostačující pro přípravu požadované terapeutické dávky, resp. terapeutických dávek a transfuze trombocytů v dané krevní skupině pak musí být zajištěny pouze aferetickými přípravky. I přes tento limit je výroba směsných trombocytů ideálním způsobem, jak maximálně efektivně využít odběry plné krve a omezit nákladnější a organizačně náročnější aferetické odběry. Buffy-coaty, ze kterých jsou směsné destičky získávány, jsou produkty zpracování plné krve, které by jinak k výrobě transfuzních přípravků využity nebyly. Výroba aferetických trombocytů v ČR však nadále výrazně převažuje a podíl přípravků z plné krve na celkové produkci je u jednotlivých výrobců trombocytů různý.
Poděkování
Prim. MUDr. Daniele Duškové, Ph.D., za souhlas s uvedením kazuistiky.
Čestné prohlášení autora
Prohlašuji, že v souvislosti s tématem, vznikem a publikací článku nejsem ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 11. 8. 2016.
Přijato po recenzi dne 25. 11. 2016.
MUDr. Hana Lejdarová
Transfuzní a tkáňové oddělení Fakultní nemocnice Brno
Katedra laboratorních metod Lékařské fakulty Masarykovy univerzity v Brně
Jihlavská 20
625 00 Brno
e-mail: lejdarova.hana@fnbrno.cz
Zdroje
1. Schrezenmeier H, Seifried E. Buffy-coat-derived pooled platelet concentrates and apheresis platelet concentrates: which product type should be preferred? Vox Sang 2010; 99 : 1–15.
2. Katus MC, Szczepiorkowski ZM, Dumont LJ, Dunbar NM. Safety of platelet transfusion: past, present and future. Vox Sang 2014;107 : 103–113.
3. Turek P. Přehled produkce transfuzní služby ČR za rok 2014 (transfuzní přípravky i plazma k frakcionaci). Transfuze a hematologie dnes 2015; 21 : 158–160.
4. Pietersz RNI. Pooled platelet concentrates: An alternative to single donor apheresis platelets? Transfusion and apheresis science 2009; 41 : 115–119.
5. Van der Meer PF. Platelet concentrates, from whole blood or collec-ted by apheresis? Transfusion and apheresis science 2013; 48 : 129–131.
6. Standards for blood banks and transfusion services, 29th edn. Bethesda (MD): AABB Press, 2014.
7. Guide to the preparation, use and quality assurance of blood components, 18th ed. Strasbourg: Council of Europe Pub., 2015.
8. Vyhláška MZ ČR č. 143/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidské krve a jejích složek (vyhláška o lidské krvi).
9. Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2007_03: Posuzování způsobilosti k dárcovství krve a krevních složek, verze 7, 12.4.2007, dostupné na: http://www.transfuznispolecnost.cz/index.php?page=dokumenty&identifikator_kategorie=DOPORUCENE_POSTUPY.
10. Lozano M, Cid J. Recent advances in platelet processing and storage. ISBT Science series 2016; 11(Suppl. 1): 34–38.
11. Moroff G, AuBuchon JP, Pickard C, Whitley PH, Heaton WA, Holme S. Evaluation of the properties of components prepared and stored after holding of whole blood units for 8 and 24 hours at ambient temperature. Transfusion 2011; 51(Suppl. 1): 7S–14S.
12. Gulliksson H. Platelet storage media. Vox Sang 2014; 107 : 205–212.
13. Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2015_11: Skladování a přeprava krve, krevních složek, suroviny pro další výrobu a transfuzních přípravků, verze 1, 2.11.2015, dostupné na: http://www.transfuznispolecnost.cz/index.php?page=dokumenty&identifikator_kategorie=DOPORUCENE_POSTUPY.
14. Tynngård N. Preparation, storage and quality control of platelet concentrates. Transfusion and apheresis science 2009; 41 : 97–104.
15. Anderson NA, Gray S, Copplestone JA, et al. A prospective rando-mized study of three types of platelet concentrates in patients with haematological malignancy: corrected platelet count increments and frequency of nonhaemolytic febrile transfusion reactions. Transfus Med 1997; 7 : 33–39.
16. Kluter H, Dorges L, Maass E, Wagner T, Bartels H, Kirchner H. In-vivo evaluation of random donor platelet concentrates from pooled buffy coats. Ann Haematol 1996; 73 : 85–89.
17. The Trial to Reduce Alloimmunization to Platelets Study Group: Leukocyte reduction and ultraviolet B irradiation of platelets to prevent alloimmunization and refractoriness to platelet transfusions. N Engl J Med 1997; 337 : 1861–1870.
18. Heddle NM, Blajchman MA, Meyer RM, et al. A randomized controlled trial comparing the frequency of acute reactions to plasma-removed platelets and prestorage WBC-reduced platelets. Transfusion 2002; 42 : 556–566.
19. Gurkan E, Patah PA, Saliba RM, et al. Efficacy of prophylactic transfusions using single donor apheresis platelets versus pooled platelet concentrates in AML/MDS patients receiving allogeneic haematopoietic stem cell transplantation. Bone Marrow Transplant 2007; 40 : 461–464.
20. Heddle NM, Arnold DM, Boye D, Webert KE, Resz I, Dumont LJ. Comparing the efficacy and safety of apheresis and whole blood-derived platelet transfusions: a systematic review. Transfusion 2008; 48 : 1447–1458.
21. Hess JR, Trachtenberg FL, Assmann SF, et al. Clinical and laboratory correlates of platelet alloimmunization and refractoriness in the PLADO trial. Vox Sang 2016; publikováno elektronicky 17. května 2016. DOI 10.1111/vox.12411.
22. Penka M, Tesařová E, et al. Hematologie a transfuzní lékařství II. In: Tesařová E. Hemoterapie. 1. vyd. Praha, Grada Publishing, 2012; 131–177.
23. Řeháček V, Masopust J, et al. Transfuzní lékařství. In: Procházková R., Turek P. Potransfuzní reakce. 1. vyd. Praha, Grada Publishing, 2013; 105–118.
24. Tobian AAR, Fuller AK, Uglik K, et al. The impact of platelet additive solution apheresis platelets on allergic transfusion reactions and corrected count inkrement. Transfusion 2014; 54 : 1523–1529.
25. Scherezenmeier H, Walther-Wenke G, Müller TH, et al. Bacterial contamination of platelet concentrates: results of a prospective multicenter study comparing pooled whole blood-derived platelets and apheresis platelets. Transfusion 2007; 47 : 644–652.
26. Kopko PM, Warner P, Kresie L, Pancoska C. Methods for the selection of platelet products for alloimmune-refractory patients. Transfusion 2015; 55 : 235–244.
27. Vassallo RR, Norris PJ. Can we terminate alloimmune platelet transfusion refractoriness? Transfusion 2016; 56 : 19–22.
28. Slichter Sj, Davis K, Enright H, et al. Factors affecting posttransfusion platelet increments, platelet refractoriness, and platelet transfusion intervals in thrombocytopenic patients. Blood 2005; 105(10): 4106–4114.
29. Cid J, Harm SK, Yazer MH. Platelet transfusion – the Art and Science of Compromise. Transf Med Hemother 2013; 40 : 160–171.
30. McLeod BC, Piehl MR, Sassetti RJ. Alloimmunization to RhD by platelet transfusions in autologous bone marrow transplant recipients. Vox Sang 1990; 59 : 185–189.
31. Heim MU, Bock M, Kolb HJ, Schleuning M, Mempel W. Intravenous anti-D gammaglobulin for the prevention of rhesus isoimmunization caused by platelet transfusions in patients with malignant diseases. Vox Sang 1992; 62 : 156–168.
32. Zeiler T, Wittmann G, Zingsem J, Weisbach V, Zimmermann R, Eckstein R. A dose of 100 IU intravenous anti-D gammaglobulin is effective for the prevention of RhD immunisation after RhD-incompatible single donor platelet transfusion. Vox Sang 1994; 66 : 243.
33. Cid J, Carbasse G, Pereira A, et al. Platelet transfusions from D+ donors to D - patients: a 10-year follow-up study of 1014 patients. Transfusion 2011; 51 : 1163–1169.
34. Moncharmont P, Barday G, Meyer F. Red blood cell alloimmunisation after platelet transfusion: a 5-year study. Blood Transfusion 2014; 12 (Suppl. 1): 147–148.
35. O’Brien KL, Haspel RL, Uhl L. Anti-D alloimmunization after D-incompatible platelet transfusions: a 14-year single-institution retrospective review. Transfusion 2014; 54 : 650–654.
36. Cid J, Lozano M, Ziman A, et al. Low frequency of anti-D alloimmunization following D+ platelet transfusion: the Anti-D Alloimmunization after D-incompatible Platelet Transfusions (ADAPT) study. British Journal of Hematology 2015; 168 : 598–603.
37. Lozano M, Cid J. The clinical implications of platelet transfusions associated with ABO or Rh(D) incompatibility. Transfusion Medicine Reviews 2003; 17 : 57–68.
38. Gunson HH, Stratton F, Phillips PK. The use of modified cells to induce an anti-Rh response. British Journal of Haematology 1971; 21 : 683–694
39. Kitazawa J, Nollet K, Morioka H, et al. Non-D Rh antibodies appearing after apheresis platelet transfusion: stimulation by red cells or microparticles? Vox Sang 2011; 100 : 395–400.
40. Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2015_12: Doporučené postupy pro podání transfuzních přípravků, verze 1, 1.9.2015, dostupné z: http://www.transfuznispolecnost.cz/index.php?page=dokumenty&identifikator_kategorie=DOPORUCENE_POSTUPY.
41. Cooling LL, Downs TA, Butch SH, Davenport RD. Anti-A and anti-B titers in pooled group 0 platelets are comparable to apheresis platelets. Transfusion 2008;48 : 2106–2113.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2016 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Využití monoklonální protilátky daratumumab v léčbě mnohočetného myelomu
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Vplyv ibrutinibu na doštičkovú agregáciu
- Kryokonzervované trombocyty v klinické praxi: srovnávací studie s nativními trombocyty
- Hodnocení nátěru aspirátu kostní dřeně
- Životní jubileum doc. MUDr. Adély Bártové, CSc.
- OBSAH ROČNÍKU 22/2016
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Hodnocení nátěru aspirátu kostní dřeně
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



