-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTransformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
Transformation of follicular lymphoma – the rarity or the rule? Review and single center experience
Transformation of indolent follicular lymphoma (FL) designates its evolution into a more aggressive type of lymphoproliferation (in most cases diffuse large B-cell lymphoma) and represents a serious problem because together with therapy resistance it is the most frequent cause of death due to FL. Transformation is confirmed above all by the histological examination of involved tissue. Histological transformation may be suspected when indirect clinical and laboratory signs are present (hypercalcaemia, rapid lactate dehydrogenase elevation, rapid tumour growth, atypical or extranodal involvement, new intensive B-symptomatology). The reported incidence of transformation ranges from 10 to 70%. Compared with de-novo transformed follicular lymphoma, patients with transformation of follicular lymphoma during therapy have a poor prognosis. The tumour is characterized by rapid progression, therapy resistance and the majority of patients die within one year.
Autoři: Michalka J.ihash2ihash4ihash6ihash8ihash10ihash12 1 1 1 2 1 3 1
Působiště autorů: Interní hematoonkologická klinika FN Brno a Lékařská fakulta Masarykovy Univerzity Brno, Patologicko-anatomický ústav FN Brno a Lékařské fakulty Masarykovy Univerzity Brno, Chirurgická klinika FN Brno a Lékařská fakulta Masarykovy Univerzi 1
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 3, p. 137-143.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Transformace indolentního folikulárního lymfomu (FL) znamená jeho přechod do agresivnějšího typu lymfoproliferace (zpravidla do difuzního velkobuněčného B-lymfomu) a představuje závažný léčebný problém, neboť je spolu s rezistencí k léčbě nejčastější příčinou úmrtí pacientů s FL. Diagnóza transformace FL se opírá především o histologii postižené tkáně. K podezření na histologickou transformaci nás mohou vést některé klinicko-laboratorní ukazatele (hyperkalcemie, výrazná elevace laktátdehydrogenázy, rychlý růst nádorů, atypická nebo extranodální lokalizace, nové zjevné B-symptomy). Incidence transformace se pohybuje od 10 do 70 %. Ve srovnání s již vstupně zachyceným transformovaným folikulárním lymfomem mají pacienti s transformací vyvíjející se v průběhu léčby extrémně špatnou prognózu. Nádor se vyznačuje rychlou progresí, rezistencí k léčbě a převážná většina pacientů umírá do jednoho roku od stanovení transformace.
Klíčová slova:
folikulární lymfom, difuzní velkobuněčný B-lymfom, transformace, nezralá progenitorová buňka, transplantaceÚvod
Folikulární lymfom (FL) tvoří asi 20 % všech nehodgkinských lymfomů (NHL) a je po difuzním velkobuněčném B-lymfomu druhým nejčastějším typem NHL v Evropě a Severní Americe (1). V České republice dle registru Kooperativní lymfomové skupiny (KLS) tvořil v letech 1999–2006 FL 19 % všech NHL (2). V pokročilém stadiu (klinické stadium III-IV) je FL konvenčními metodami nevyléčitelný, jedinou potenciálně kurativní metodou je alogenní transplantace krvetvorných buněk, která je však pro svou toxicitu a riziko závažných komplikací vhodná jen pro malou část pacientů s refrakterním a rekurentním FL (3). Průběh nemoci je většinou pomalý a projevuje se obvykle nebolestivou lymfadenopatií, která zvolna narůstá. Folikulární lymfom je svým chováním málo agresivní (indolentní), avšak značně chemo - i radiosenzitivní. Léčbou je dosaženo kompletní nebo parciální remise (CR nebo PR) u většiny nemocných, opakované relapsy jsou však pravidlem (4).
Histopatologicky, podle počtu zastoupení centroblastů a zachování původní folikulární struktury v postižené tkáni rozlišujeme FL stupně malignizace (grade) 1–3 (5). Zatímco grade 1–3A se považují za indolentní formy FL, grade 3B je tvořen téměř zcela centroblasty a postrádá folikulární strukturu. Biologickými vlastnostmi se blíží agresivním lymfomům, považuje se za transformovaný a léčí se podle pravidel pro difuzní velkobuněčný B-lymfom (DLBCL) (6).
Transformace je proces, při kterém se dosud indolentní FL změní v biologicky agresivní lymfoproliferaci, téměř vždy se jedná o DLBCL, raritně je diagnostikována jiná agresivní lymfoproliferace (7, 10, 41). FL není jediný lymfom, který může transformovat. Tento jev je známý u všech nízce maligních lymfomů, například u chronické lymfatické leukemie / malobuněčného lymfomu (Richterův syndrom), u MALT lymfomů, lymfoplazmocytárního lymfomu nebo u Hodgkinova lymfomu typu nodulární lymfocytární predominance (8, 42, 43, 44). Z klinického hlediska lze rozlišit transformovaný FL (t-FL) již primárně diagnostikovaný ve stadiu transformace a t-FL transformující až v průběhu léčby. Druhý případ představuje velmi nepříznivý stav se špatnou prognózou, který je charakterizován značnou rezistencí k léčbě u pacienta navíc často již značně předléčeného. Transformace folikulárního lymfomu v průběhu léčby je jednou z hlavních příčin úmrtí na tuto nemoc. V následujícím přehledu autoři shromáždili data týkající se výskytu, rizika, prognózy a zkušeností s aplikací různých léčebných přístupů u t-FL. Text je doplněn o vlastní výsledky a sledování.
Diagnostika a obraz transformace
Při podezření na relaps či transformaci u FL je histologické vyšetření vždy žádoucí, jedině tak lze s určitostí transformaci prokázat. Histologický obraz transformace se vyznačuje ztrátou typicky folikulárního uspořádání v postižené tkáni a vzestupem počtu centroblastů s vysokou proliferační aktivitou (obr. 1–4). Nejčastějším morfologickým typem je difuzní velkobuněčný B-lymfom (DLBCL), který si ve většině případů udržuje fenotyp buněk germinálního centra s expresí CD10 a bcl-6. Asi čtvrtina t-FL/DLBCL však exprimuje antigeny germinálního centra, ale bez CD10 a naopak s expresí MUM-1. Existuje i velmi malá část t-FL s imunofenotypem typickým pro aktivované B-buňky (9). Vzácně lze nalézt transformaci FL do Burkittova lymfomu, plazmablastického lymfomu, nebo do B-lymfoblastického lymfomu/leukemie (7, 10, 11, 36, 41).
Obr. 1. Folikulární lymfom G1, hematoxylin – eosin, zvětšení 50x. 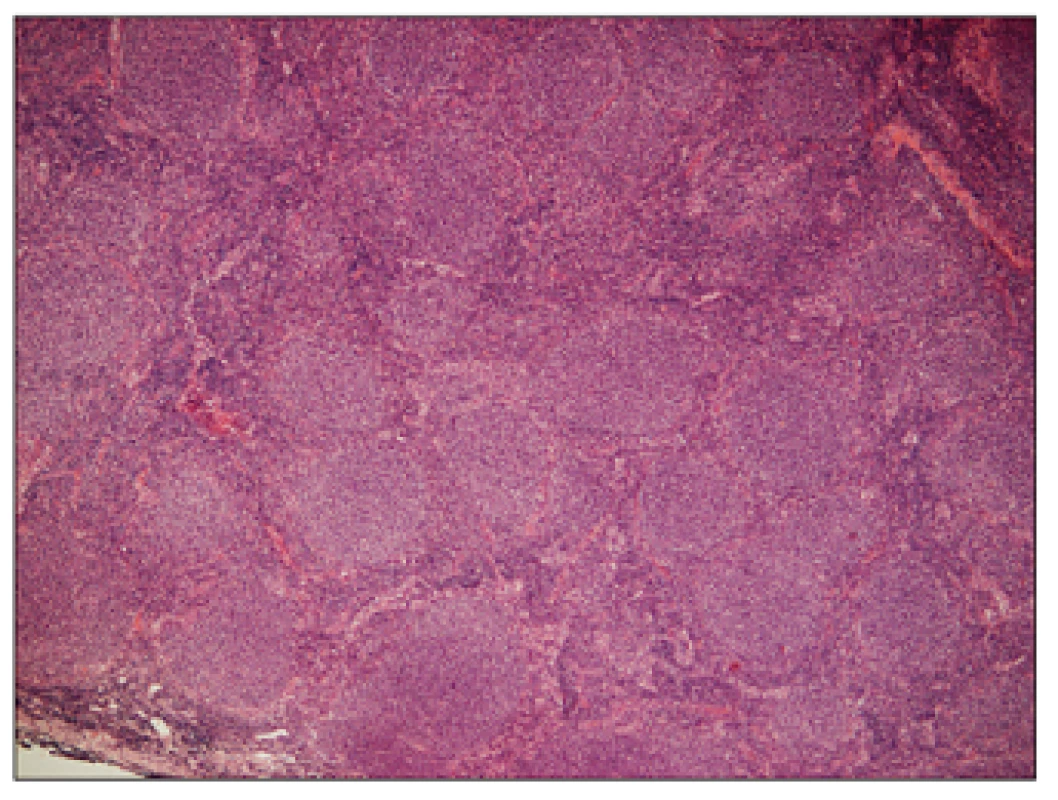
Přehledný snímek znázorňující setření struktury lymfatické uzliny vágně nodulární (folikulární, více než 75%) nádorovou infiltrací. Obr. 2. Folikulární lymfom G1, hematoxylin – eosin, zvětšení 200x. 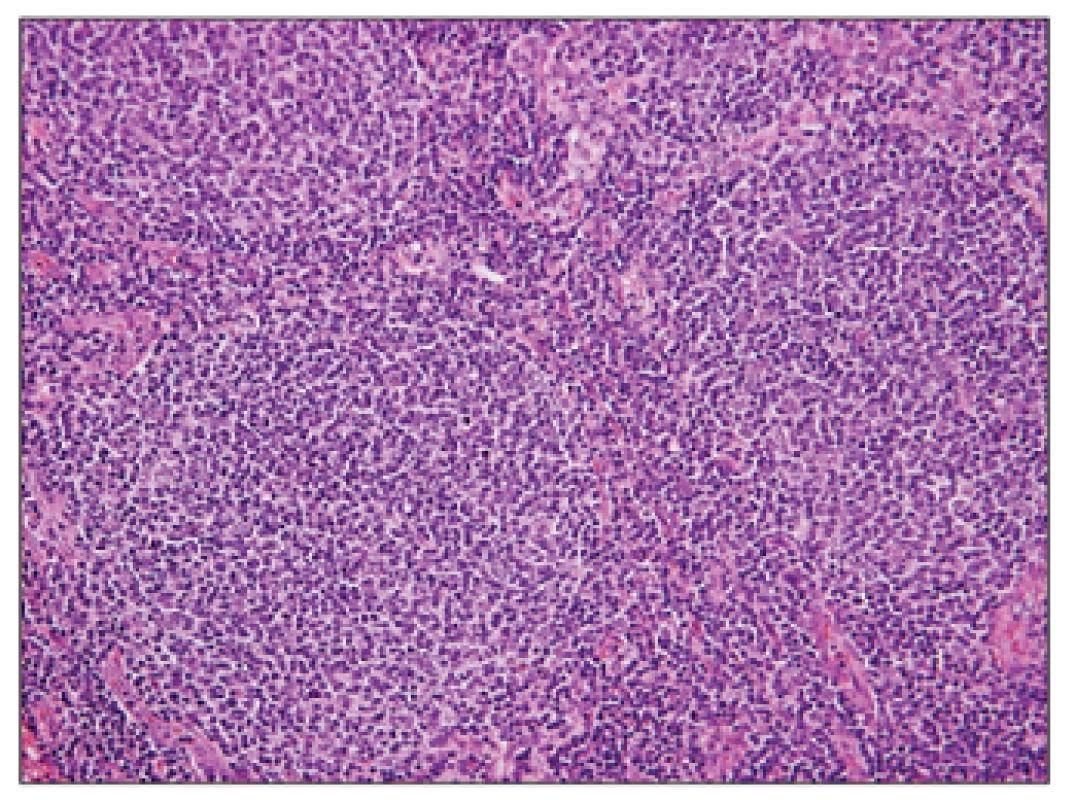
Detail nádorových folikulů, které jsou tvořeny především menšími až středně velkými buňkami charakteru centrocytů s přítomností zcela oj. velkých centroblastů v počtu 0-2/HPF (odpovídá FL grade 1). Obr. 3. Folikulární lymfom transformovaný do DLBCL, hematoxylin – eosin, zvětšení 50x. 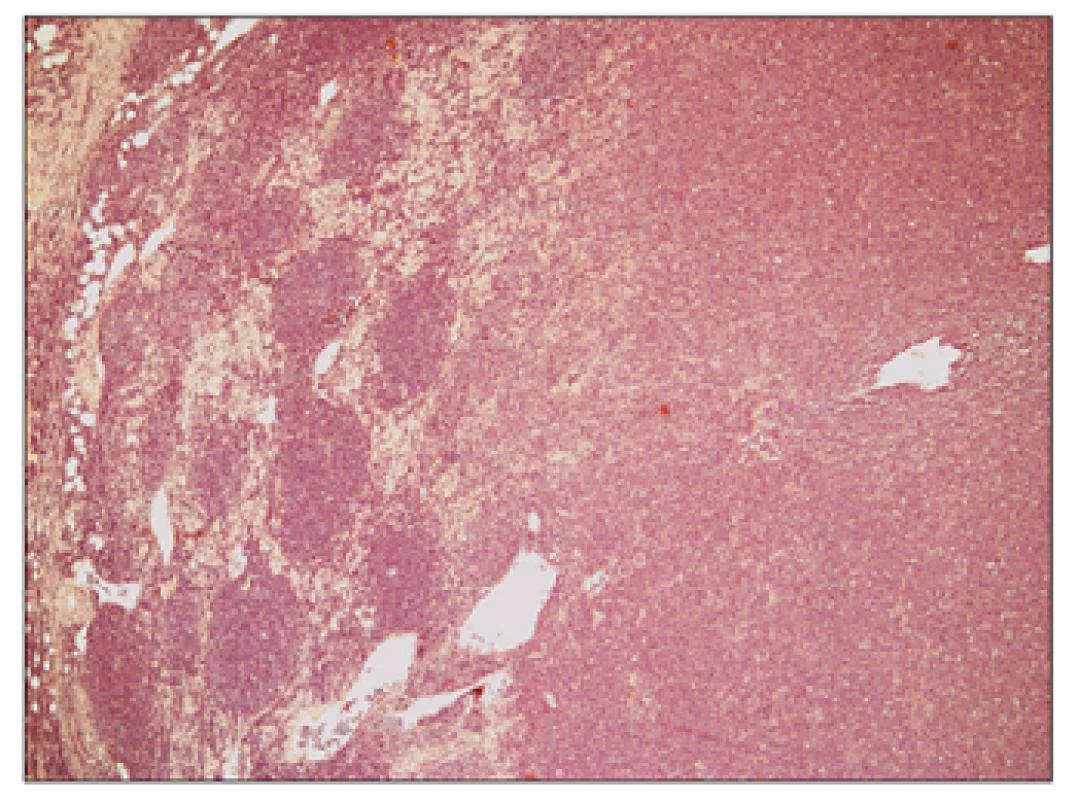
Přehledný snímek znázorňující jednak struktury původního folikulárně uspořádaného folikulárního lymfomu grade 1 vlevo a dále transformaci do DLBCL vpravo. Obr. 4. Folikulární lymfom transformovaný do DLBCL, hematoxylin – eosin, zvětšení 200x. 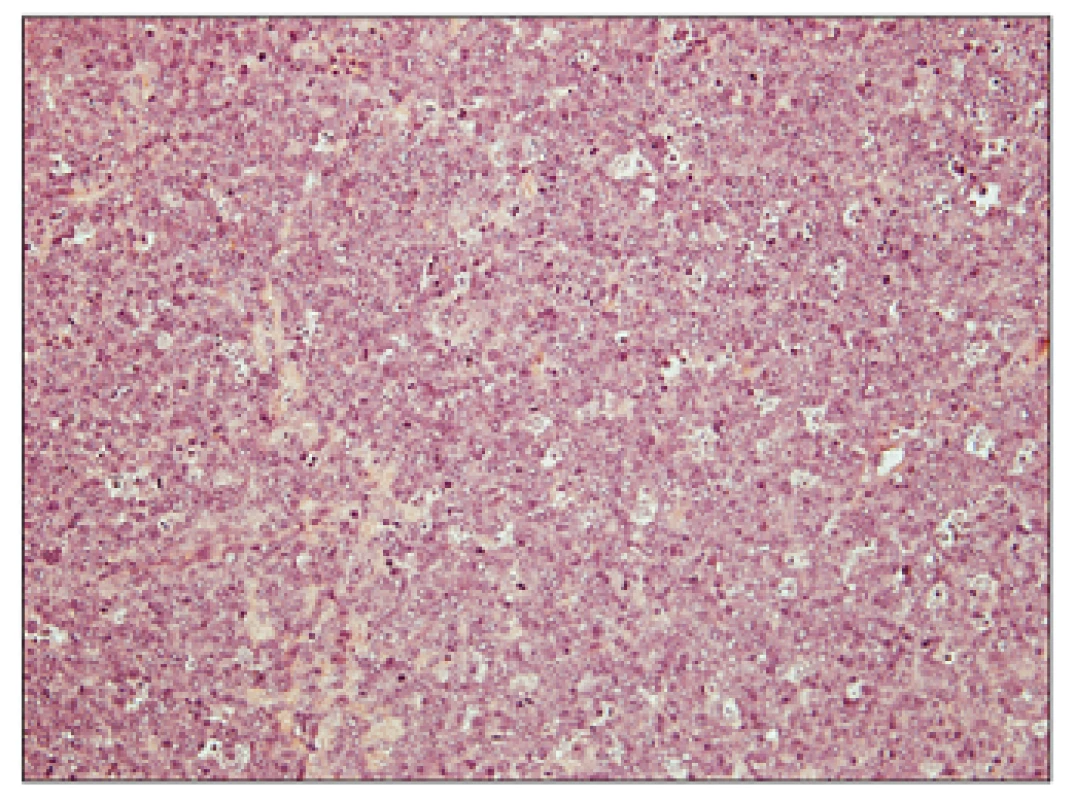
Detailní snímek znázorňující komponentu DLBCL, tvořenou difuzním nádorovým infiltrátem (bez patrného vágně nodulárního/folikulárního uspořádání), který je tvořený výhradě mitoticky vysoce aktivními velkými buňkami charakteru centroblastů, bez přítomnosti centrocytů. K podezření na transformaci folikulárního lymfomu mohou vést některé nepřímé klinicko-laboratorní ukazatele, které dle publikovaných údajů vysoce korelují s histologickým obrazem transformace (11); výrazný vzestup sérové laktátdehydrogenázy (LDH) o více než dvojnásobek horní hranice normy, prudký lokalizovaný nárůst lymfadenopatie detekovatelný klinicky nebo pomocí zobrazovacích vyšetření, nové postižení v nezvyklé, zpravidla extranodální lokalitě (kosti, játra, mozek, svaly), nová B-symptomatologie, nová, jinak nevysvětlitelná hyperkalcemie. Některé studie ukazují přínos PET v diagnostice transformace, která je ve významné většině případů spojena s vyšší SUV aktivitou ve srovnání s indolentními lymfomy, a tedy může podporovat diagnózu transformace při nemožnosti biopsie postižené tkáně nebo diskrepanci mezi klinickým a histologickým nálezem (45, 46).
Patogeneze FL a transformovaných FL
FL si udržuje genovou expresi odpovídající B-buňce germinálního centra (12). Nádorové buňky jsou obvykle sIg pozitivní a exprimují antigeny typické pro B-lymfocyty (CD19, CD20, CD22, CD79a), markery germinálního centra Bcl-6, CD10, CD38 a kostimulační molekuly CD95 (FAS), CD86 a CD40. Na rozdíl od normálních GC-buněk většina FL exprimuje bcl-2 jako důsledek translokace t(14;18), která činí tyto buňky rezistentními vůči apoptóze (13, 14, 15). K vlastní translokaci t(14;18) dochází v průběhu časné fáze vývoje B-lymfocytu v kostní dřeni a pravděpodobně mechanismem rezistence k apoptóze zvýhodňuje v přežívání naivní t(14;18)-pozitivní buňky. Z hlediska vývoje FL je klíčový pobyt t(14;18)-pozitivní buňky v germinálním centru, kde dochází ke vzniku sekundárních genetických změn (16). U 90 % FL lze zpravidla detekovat alespoň jednu další abnormalitu karyotypu s průměrem 6 chromozomálních alterací (17). Počet přídatných alterací karyotypu stoupá s histologickým grade a transformací; komplexní karyotyp typicky koreluje s velmi špatnou prognózou (17, 18). U FL (především indolentních) jsou nádorové B-lymfocyty v těsné interakci s Th buňkami a folikulárními dendritickými buňkami (FDC). Zdá se, že buňky FL (podobně jako jejich fyziologické protějšky) vyžadují pro svůj život a růst zásadní podporu ostatních buněčných populací germinálního centra (19, 20).
Mechanismy řídící transformaci FL jsou komplexní, heterogenní a zůstávají předmětem diskusí. S transformací je asociována celá řada sekundárních genetických alterací zahrnujících přestavbu c-myc, mutaci p53 a bcl-6, inaktivaci p16/p15 a jiných chromozomálních změn (21, 22, 23, 24, 25, 41). Srovnáním cytogetických změn a změn v expresním profilu pre - a posttransformovaných vzorků bylo zjištěno, že k transformaci mohou vést různé mechanismy, které se nakonec projeví deregulací genů pod vlivem c-myc a p53, což má obecně za následek zvýšení proliferační aktivity a metabolismu. Ačkoli hrubé genetické a biologické odchylky spojené s transformací vypadají relativně homogenně, při detailnějším rozkrývání na molekulárně biologické úrovni nelze tyto změny jednoznačně definovat (24, 26).
Studiem somatických hypermutací a konstrukcí genealogických schémat klonů párových vzorků před a po transformaci se předpokládají tři možné modely procesu transformace.
- První „cesta“ k histologické transformaci vede od prekurzorové dosud nenádorové buňky (tzv. common progenitor cell; CPC) přes klonální evoluci do buňky FL a další selekcí do t-FL. CPC přežívají různé typy léčby a koexistují spolu buňkami FL a t-FL v jedné lymfatické uzlině.
- Druhou možností je, že CPC jsou přítomny pouze v prelymfomové uzlině a uzlině indolentního FL, přičemž klon t-FL vzniká nezávisle z prekurzorových buněk. Je zajímavé, že t-FL klony byly identifikovány jak ve vzorcích pacientů s FL léčených různými režimy, tak i ve vzorcích pacientů pouze observovaných. Na základě tohoto pozorování by tedy terapie neměla mít zásadní vliv na vývoj transformace.
- Třetí model předpokládá, že CPC se dostávají z uzlin zpět do kostní dřeně a odtud opět migrují do sekundárních lymfatických orgánů. Kostní dřeň poskytuje vhodné útočiště („niches“), kde mohou CPC přežívat, aniž by získávaly další genomické léze. Zdrojem každého následujícího relapsu včetně transformace je nový, odlišný klon buněk mající původ v dlouhověkých prekurzorových buňkách (27, 28, 29).
Incidence a predikce transformace
Transformace vyvíjející se během léčby je prognosticky velmi nepříznivý stav, bylo by tedy velmi užitečné rozpoznat dopředu pacienty ohrožené tímto jevem.
Incidence transformace FL se v literatuře udává od 10–70 % v závislosti na délce sledování a způsobu verifikace (7, 11, 30, 31). Riziko vzniku transformace po 10 letech od stanovení diagnózy se pohybuje v rozmezí 28–31 % (7, 11, 30, 32). Poznatky o incidenci a rizikových faktorech transformace vycházejí zejména z retrospektivní analýzy velkých souborů pacientů. Velká retrospektivní analýza 600 pacientů s FL a mediánem sledování 109 měsíců (11) ukázala, že riziko transformace v průběhu 15 let sledování roste o 3 % ročně bez dosažení fáze plató. Jako rizikový faktor transformace bylo identifikováno vstupně jen pokročilé stadium FL. Riziko transformace bylo signifikantně vyšší u pacientů léčených dvěma a více různými terapeutickými režimy než u pacientů observovaných nebo léčených jednou léčebnou modalitou. Pacienti léčení kombinací alkylačního cytostatika s purinovým analogem (cyklofosfamid + fludarabin / kladribin) měli vyšší riziko transformace (30 % vs. 18 % během 10 let) oproti skupině pacientů léčených chemoterapií jinou než fludarabinem (bleomycin, cisplatina, etoposid, doxorubicin, cyklofosfamid, vinkristin a prednison) (11). Jiná práce hodnotila 325 pacientů s mediánem sledování 15 let (7). Incidence transformace po 10 letech byla 28 %, na rozdíl od předchozí analýzy však po 16, 2 letech sledování byla pozorována fáze plató. Toto pozorování by mohlo podporovat hypotézu, že část pacientů nemá predispozici k rozvoji transformace a k transformaci asi nikdy nedospěje. Obdobné výsledky byly pozorovány i v jiné menší studii (30). Vyšší riziko transformace bylo pozorováno u pacientů s pokročilým stadiem FL a vysokým FLIPI (follicular lymphoma international prognostic index) a IPI (international prognostic index) v době diagnózy. V některých dalších publikacích se jako rizikové faktory uvádějí také FL grade 3 (33), nedosažení remise iniciální léčbou, nízká hodnota sérového albuminu či vysoká hodnota beta-2-mikroglobulinu (30). Všechna uvedená data pocházejí z doby před zavedením rituximabu (anti CD20 protilátky) do léčby folikulárního lymfomu.
Riziko transformace může být v biologické rovině definováno jako pravděpodobnost kumulace genomických změn a přežívání mutovaných nádorových klonů. Pokud jde o změny v genomu buněk, nebyl dosud identifikován žádný univerzální faktor nebo alterace, která by byla jednoznačným prediktorem transformace. Srovnáním genové exprese pacientů s časnou transformací (do 3 let od stanovení diagnózy) a pacientů s indolentním FL (více než 7 let bez transformace) byly zjištěny zřejmé změny v profilech genové exprese, které se promítaly dominantně do kompozice či genové exprese buněk mikroprostředí (34). Předpokládá se, že pro-inflamatorní typ mikroprostředí s vysokým množstvím aktivních radikálů působí větší genovou nestabilitu nádorových buněk a tím akceleruje proces transformace (35). Zda je charakter mikroprostředí určen vlastnostmi nádorových buněk, zůstává dosud nevyřešenou otázkou.
Léčba transformovaných folikulárních lymfomů
Konvenční léčba (chemoterapie a radioterapie)
Výsledky pocházejí z různých registrových databází a mají retrospektivní charakter, data jsou většinou z období před zavedením rituximabu. Obecně byly nejčastěji hodnoceny „CHOP-like“, neboli antracyklinové režimy (cyklofosfamid, doxorubicin, vinkristin, prednizon +/ - rituximab). Ve studii se sledováním 25 let byla u 24 pacientů s t-FL po chemoterapii CHOP dosažena léčebná odpověď (CR nebo PR) u 63 % nemocných, medián přežití byl pak 24 měsíců, avšak u pacientů, u kterých bylo dosaženo CR, byl medián celkového přežití až 62 měsíců (36).
Antracyklinový režim měl účinnost 61% celkových léčebných odpovědí i v další velké studii, avšak 75 % těchto pacientů relabovalo s mediánem 6 měsíců (0,08 až 13 let) a 32 pacientů zemřelo na progresi lymfomu. Pacienti, kteří se po léčbě t-FL dostali do CR, měli medián přežití 5,6 roku, medián přežití všech pacientů byl však pouze 1,2 roku (7). Podobné výsledky po režimech s doxorubicinem u t-FL s 40% CR byly publikovány i jinými autory, v některých studiích u vybraných skupin pacientů bylo pozorováno velmi dobré celkové přežití s dosažením CR až 81 měsíců, stejně tak u lokalizovaných t-FL léčených pouze radioterapií, kde bylo dosaženo až kolem 70 % CR (32).
Vysokodávkovaná léčba
Pacientům v dobrém klinickém stavu s chemosenzitivním t-FL lze po záchranném režimu nabídnout vysokodávkovanou chemoterapii s autologní transplantací krvetvorby (ASCT). Jako záchranné režimy publikované v literatuře jsou CHOP (pro pacienty neléčené dosud antracykliny), DHAP (cis-platina, cytosar, dexamethazon) nebo miniBEAM (carmustin, etoposid, cytosar, dexametazon, melphalan) (37, 38), či jiné režimy na bázi antracyklinů, platiny, nebo etoposidu (39).
Jako přípravný režim byl ve starších pracích použit etoposid + melfalan + celotělové ozáření (TBI) (37, 49), v novějších pracích pak CBV (carmustin, cyklofosfamid, etoposid), BEAM (carmustin, etoposid, cytosar, melphalan), nebo BuCy (busulfan, cyklofosfamid) (38, 39, 49). Bez ohledu na přípravný režim či předchozí záchrannou léčbu bylo 5leté období bez nemoci referováno v rozmezí 25–36 % a 5leté celkové přežití kolem 37–56 % nemocných. Kolem 25 % pacientů zemřelo v přímé souvislosti s progresí lymfomu a 18–25 % v souvislosti s toxicitou léčby (37, 38, 39, 49, 51).
Srovnání léčebných výsledků konvenční a vysokodávkované léčby je obtížné. Není randomizovaná studie, která by oba přístupy srovnávala, a registrovaná data poskytují značně nehomogenní skupiny pacientů. Přestože některé studie v rámci léčby t-FL vysokodávkovanou chemoterapii s ASCT velmi doporučují (37, 49, 51), jiné poukazují na velmi dobré přežití u vybraných pacientů s t-FL léčených konvenční chemoterapií samotnou (32). Jedná se zejména o nemocné s limitovaným postižením t-FL. Je třeba si také uvědomit, že již chemosenzitivita během podání záchranné léčby působila jistou selekci pacientů vstupujících do transplantačního programu.
Alogenní transplantace kostní dřeně
Alogenní transplantace kostní dřeně je jednou z možností léčby, kterou lze nabídnout především mladším nemocným s t-FL (pod 60 let) v dobré celkové kondici, navíc je to modalita potenciálně kurativní. Obecně lze nalézt v literatuře jen velmi málo prací s výsledky alogenních transplantací u transformovaných folikulárních lymfomů. Práce s alogenní transplantací a přípravou myeloablativním režimem (BuCy) u t-FL (n = 8, medián věku 56 let) ukázala 4leté přežití bez nemoci 56 % a celkové přežití 66 %, celková mortalita byla 25 %. Pacienti po myeloablativním režimu byli po dobu sledování (medián 60 měsíců) bez relapsu (50). Jiná práce s použitím režimu s redukovanou intenzitou (TBI 2Gy +/-fludarabin) sledovala účinnost alogenní transplantace u pacientů s relabujícím, refrakterním a transformovaným FL. Z celkového počtu 62 pacientů bylo 16 s t-FL, přičemž tito měli signifikantně horší prognózu, 3leté přežití bez nemoci bylo pozorováno u 18 % a celkové přežití jen u 21 %, přičemž 38 % pacientů zrelabovalo s mediánem 1,6 měsíců (40).
Lze tedy říci, že alogenní transplantace je možnou léčebnou alternativou, ovšem zatíženou významnou toxicitou a mortalitou. I když jsou uvedené soubory poměrně malé, lze konstatovat, že lepší výsledky jsou pravděpodobně spojeny spíše s podáním myeloablativního přípravného režimu. Alogenní transplantaci je přesto vhodnější považovat za experimentální přístup u nemocných s t-FL.
Prognóza
Je třeba odlišovat pacienty již iniciálně diagnostikované s transformovaným folikulárním lymfomem, kteří jsou buď zařazeni pod diagnózu folikulární lymfom grade 3B, nebo jsou zahrnuti pod diagnózu difuzní velkobuněčný B-lymfom někdy se zmínkou, že může jít o transformovaný FL. Léčba se v obojím případě řídí pravidly pro DLBCL. Prognóza primárně transformovaných FL je však vcelku dobrá, relativně často po několika letech dochází k relapsu právě oné původní indolentní složky FL.
Transformovaný FL vzniklý během léčby u rekurentního onemocnění má výrazně horší prognózu. Publikovaných dat týkajících se léčby a prognózy transformace FL není mnoho a téměř všechna pocházejí z doby před zavedením rituximabu. Celkový medián přežití bez ohledu na typ podané léčby se dle různých prací pohybuje od 10 do 22 měsíců a přežití v 5 letech se pohybovalo pod 25 % (7, 11, 32, 36). Z některých novějších publikací lze usuzovat, že použití rituximabu se v léčbě odrazí i na zlepšení prognózy pacientů s t-FL (47, 48).
Zkušenosti z našeho pracoviště
Na našem pracovišti evidujeme od roku 1990 do října 2010 celkem 261 pacientů s FL. Retrospektivně jsme hodnotili 8 pacientů s transformací FL vzniklou v průběhu léčby. Celková doba jejich sledování (follow up) je 13,5 roku (162 měsíců), medián sledování těchto nemocných od stanovení diagnózy folikulárního lymfomu byl 43 měsíců. U všech pacientů byla transformace histologicky potvrzena (DLBCL), přičemž u 7/8 pacientů byly současně identifikovány minimálně tři nepřímé klinicko-laboratorní ukazatele svědčící pro transformaci (tab. 1). Všichni pacienti byli vstupně v pokročilém stadiu nemoci s mediánem FLIPI byl 3 (FLIPI 1-5), medián věku byl 60 let (40-69 let). Doba od stanovení diagnózy indolentního FL do zjištění transformace se pohybovala od 12 do 71 měsíců (medián 37,5 měsíců), u poloviny z nich byla zjištěna transformace do 3 let od diagnózy. Medián přežití od stanovení transformace byl pouhých 5, 5 měsíců (tab. 2). Vzhledem k iniciální léčbě CHOP/R-CHOP byl jako záchranný podán některý z platinových režimů ICE/R-ICE (ifosfamid, carboplatina, etoposid +/ - rituximab) nebo ESHAP (cis-platina, etoposid, cytosar, metylprenisolon +/ - rituximab). Kromě dvou nemocných, kteří absolvovali záchrannou léčbu a byli konsolidováni vysokodávkovanou chemoterapií (BEAM) s autologní transplantací periferních kmenových buněk, dalších šest nemocných zemřelo v průběhu podání záchranné léčby na progresi lymfomu nebo na toxicitu léčby. Naše výsledky tedy odpovídají výše citovaným literárním údajům.
Tab. 1. Průkaz nepřímých klinicko-laboratorních nálezu u pacientů s histologicky verifikovanou transformací folikulárního lymfomu na našem pracovišti 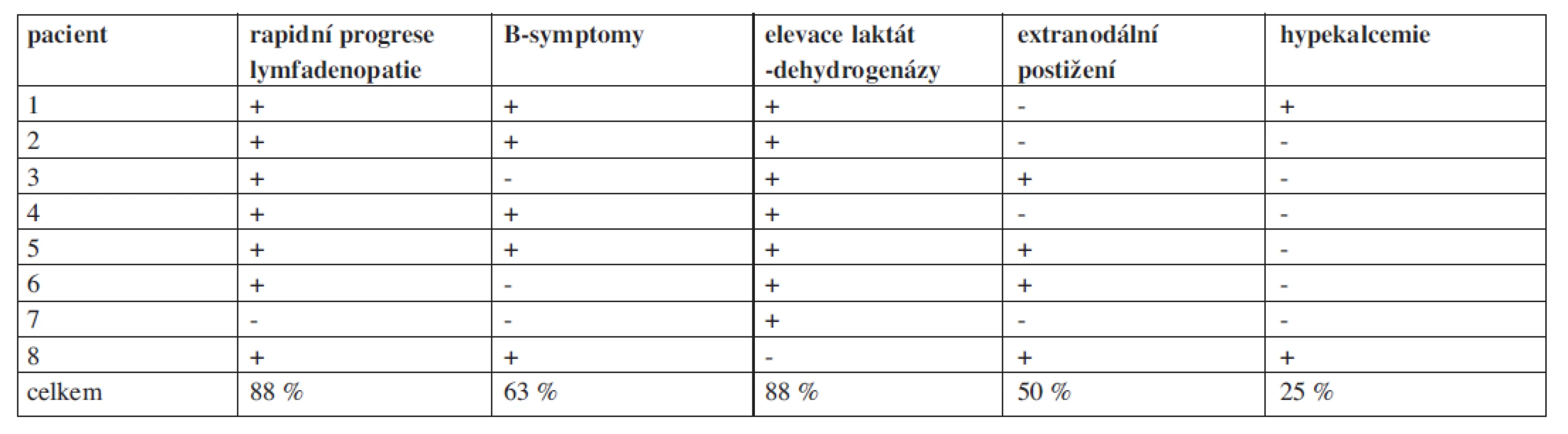
Tab. 2. Soubor pacientů s prokázanou transformací folikulárního lymfomu, použitá léčba a její efekt. 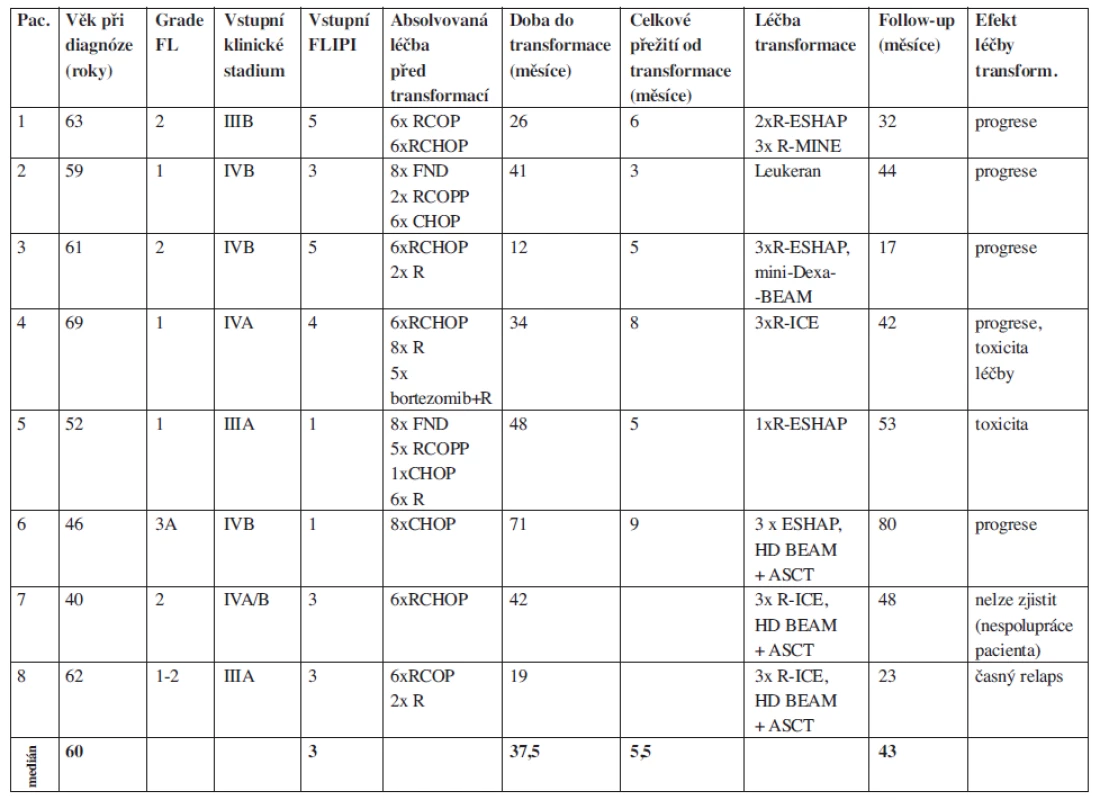
Použité zkratky: R (rituximab), COP (cyklofosfamid, vincristin, prednizon), CHOP (cyklofosfamid, doxorubicin, vincristin, prednizon), COPP (cyklofosfamid, vincristin, procarbazin, prednizon), FND (fludarabin, mitoxantron, dexametazon), MINE (mitoxantron, ifosfamid, etoposid), ESHAP (etoposid, metylprednizolon, cis-platina, cytarabin), ICE (ifosfamid, carboplatina, etoposid), mini-dexa-BEAM (dexametazon, BCNU, etoposid, cytarabin, melfalan), HD BEAM (vysokodávkovaná chemoterapie BCNU, etoposid, cytarabin, meflalan), ASCT (autologní transplantace periferních kmenových buněk) Shrnutí a závěr
Transformace FL je jev, který postihne významnou část pacientů léčených s FL. Na druhou stranu je pravděpodobné, že v rámci skupiny FL existuje část pacientů, kteří k transformaci ani po mnoha letech nedospějí. Zdá se také, že cytostatická léčba (snad jen s výjimkou fludarabinu) nemá na vývoj transformace vliv.
Patogenetické mechanismy tohoto procesu jsou stále předmětem diskusí a stanovit riziko transformace u konkrétního pacienta prozatím prakticky nelze. Nejohroženější skupinu představují pacienti s rekurentním t-FL s celkovým trváním nemoci kratším 15 let, diseminovaným postižením a vstupně vysokým FLIPI. K podezření na histologickou transformaci lze využít některé nepřímé klinicko-laboratorní ukazatele vysoce korelující s procesem transformace a přínosem může být i FDG-PET vyšetření, zejména v případech, kdy histologická verifikace není možná. Globální prognóza t-FL vzniklého v průběhu léčby je velmi neuspokojivá, pokud se však podaří navodit u pacienta kompletní remise, mohou být dlouhodobé výsledky relativně dobré. V rámci záchranných režimů lze podat jakýkoli typ chemoterapie s ohledem na předchozí použitou léčbu. U nemocných, kteří jsou toho schopni a vykazují chemosenzitivní onemocnění, bychom doporučili konsolidaci vysokodávkovanou léčbou s ASCT nebo u vybraných mladších pacientů alogenní transplantaci po myeloablativním režimu.
MUDr. Jozef Michalka
Interní hematoonkologická klinika FN Brno
Jihlavská 20
625 00 Brno
e-mail: jozef.michalka@gmail.com
Doručeno do redakce: 29. 4. 2011
Přijato po recenzi: 16. 8. 2011
Zdroje
1. Anderson JR, Armitage JO, Weisenburger DD, et al. Epidemiology of the non-Hodgkin’s lymphomas: distribution of the major subtypes differ by geographic locations. Non - Hodgkin’s Lymphoma Classification Project. Ann Oncol 9 : 717-720.
2. Trněný M, Vášová I, Pytlík R, et al. Distribuce podtypů Nonhodgkinského lymfomu v České republice a jejich přežití. Klin Onkol 2007; 20 : 341–348.
3. Gribben JG, Hosing C, Maloney DG, et al. Stem cell transplantation for indolent lymphoma and chronic lymphocytic leukemia. Biol Blood Marrow Transplant 2011; 17: S63-70.
4. Dreyling M, et al. Current clinical aspects of follicular lymphoma. Ther Umsch 2010; 67 : 511-6.
5. Mann R, Berard C, et al. Criteria for cytologic subclassification of follicular lymphomas: a proposed alternative method. Hematol Oncol 1982;1 : 187-192.
6. Rodriguez J, McLaughlin P, Hagemeister FB, et al. Follicular large cell lymphoma: an aggressive lymphoma that often presents with favorable prognostic features. Blood 1999; 93 : 2202-2207.
7. Montoto S, Davies AJ, Matthews J, et al. Risk and clinical implications of transformation of follicular lymphoma to diffuse large B-cell lymphoma. J Clin Oncol 2007; 25 : 2426-2433.
8. Jaffe ES, Harris NL, Stein H, et al. Pathology and genetics of tumours of haematopoietic and lymphoid tissues. IARC Press, Lyon, 2001, 351 s.
9. Glas AM, Knoops L, Delahaye L, et al. Blood ASH Annual meeting 2006. Blood 2006 (108): Abstrakt: 823.
10. de Jong D, de Boer J, et al. Predicting transformation in Follicular lymphoma. Leukemia & Lymphoma, September 2009; 50(9): 1406-1411.
11. Al-Tourah AJ, Gill KK, Chhanabhai M, et al. Population-based analysis of incidence and outcome of transformed non-Hodgkin’s lymphoma. J Clin Oncol 2008; 26 : 5165-5169.
12. Dave SS, Wright G, Tan B, et al. Prediction of survival in follicular lymphoma based on molecular features of tumor - infiltrating immune cells. N Engl J Med 2004; 351 : 2159-69.
13. Bakshi A, Wright JJ, Graninger W, et al. Mechanism of the t(14;18) chromosomal translocation: structural analysis of both derivative 14 and 18 reciprocal partners. Proc Natl Acad Sci USA 1987; 84 : 2396-2400.
14. Cleary ML, Sklar J, et al. Nucleoside sequence of a t(14;18) chromosomal breakpoint in follicular lymphoma and demonstration of breakpoint-cluster region near a transcriptionally active locus on chromosome 18. Proc Natl Acad Sci USA 1985; 82 : 7429-43.
15. Tsujimoto Y, Croce CM, et al. Analysis of the structure, transcripts, and protein products of bcl-2, the gene involved in human follicular lymphoma. Proc Natl Acad Sci USA1986; 83 : 5214-18.
16. Roulland S, Navarro JM, Grenot P, et al. Follicular lymphoma-like B cells in healthy individuals: a novel intermediate step in early lymphomagenesis. J Exp Med 2006; 203 : 2425-31.
17. Horsman DE, Connors JM, Pantzar T, et al. Analysis of secondary chromosomal alterations in 165 cases of follicular lymphoma with t(14;18). Gen Chrom Cancer 2001; 30 : 375-82.
18. Yunis JJ, Frizzera G, Oken MM, et al. Multiple reccurent genomic defects in follicular lymphoma: a possible model for cancer. N Engl J Med 1987; 316 : 79-84.
19. Goval JJ, Thielen C, Bourguignon C, et al. The prevention of spontaneous apoptosis of follicular lymphoma B cells by a follicular dendritic cell line: involvement of caspase-3, caspase-8 and c-FLIP. Haematologica 2008; 93 : 1169-77.
20. Kagami Y, Jung J, Choi YS, et al. Establishment of a follicular lymphoma cell line (FLK-1) dependent on follicular dendritic cell line HK. Leukemia 2001; 15 : 148-156.
21. Elenitoba-Johnson KSJ, Jenson SD, Abbott RT, et al. Involvement of multiple signaling pathway in follicular lymphoma transformation: p38-mitogen-activated protein kinase as a target for therapy. PNAS 2003; 100 : 7259-7264.
22. Martinez-Climent JA, Alizadeh AA, Segraves R, et al. Transformation of follicular lymphoma to diffuse large cell lymphoma is associated with heterogenous set of DNA copy number and gene expression alterations. Blood 2003; 101 : 3109-17.
23. Lo Cocco F, Gaidano G, Louie DC, et al. P53 mutation are associated with histological transformation of follicular lymphoma. Blood 1993; 82 : 2289-2295.
24. Lossos IS, Alizadeh AA, Diehn M, et al. Transformation of follicular lymphoma to diffuse large-cell lymphoma: Alternative patterns with increased or decreased expression of c-myc and its regulated genes. PNAS 2002; 99 : 8886-8891.
25. Lossos I, Levy R, et al. Higher grade transformation of follicular lymphoma: phenotypic tumor progression associated with diverse genetic lesions. Seminars in Cancer Biology 2003; 13 : 191-202.
26. Davies AJ, Rosenwald A, Wright G, et al. Transformation of follicular lymphoma to diffuse large B-cell lymphoma proceeds by distinct oncogenic mechanisms. Blood 2007; 136 : 286-293.
27. Carlotti E, Wrench D, Matthews J, et al. Transformation of follicular lymphoma to diffuse large B-cell lymphoma may occur by divergent evolution from a common progenitor cell or by direct evolution from the follicular lymphoma clone. Blood 2009; 113(15): 3553-3557.
28. Gentles A, Alizadeh A, Lee S, et al. A pluripotency signature predicts histologic transformation and influences survival in follicular lymphoma patients. Blood 2009; 114 : 3158-3166; prepublished online as DOI 10.1182/blood-2009-02-202465
29. Brodtkorb Eide M, LiestŅl K, Lingjĺrde OC, et al. Genomic alterations reveal potential for higher grade transformation in follicular lymphoma and confirm parallel evolution of tumor cell clones. Blood 2010; 116 : 1489 - 1497.
30. Bastion Y, Sebban C, Berger F, et al. Incidence, predictive factors, and outcome of lymphoma transformation in follicular lymphoma patients. J Clin Oncol 1997;15(4): 1587-1594.
31. Bernstein SH, Burack WR, et al. The incidence, natural history, biology, and treatment of transformed lymphomas. Hematology Am Soc Hematol Educ Program 2009 : 532-541.
32. Yuen AR, Kamel OW, Halpern J, et al. Longterm survival after histologic transformation of low-grade follicular lymphoma. J Clin Oncol 1995; 13 : 1726-1733.
33. Gine E, Montoto S, Bosch F, et al. The Follicular Lymphoma International Prognostic Index (FLIPI) and the histological subtype are the most important factors to predict histological transformation in follicular lymphoma. Ann Oncol 2006; 17 : 1539 - 1545.
34. Glas AM, Knnops L, Delahaye L, et al. Gene-expression and immunohistochemical study of specific T-cell subsets and accessory cell types in the transformation and prognosis of follicular lymphoma. J Clin Oncol 2007; 25 : 390-398.
35. De Jong D, et al. Molecular pathogenesis of follicular lymphoma: a Gross talk of genetic and immunologic factors. J Clin Oncol 2005; 23 : 6358-6363.
36. Morley NJ, Evans LS, Goepel J, et al. Transformed follicular lymphoma: The 25-year experience of a UK provincial lymphoma treatment centre. Oncology reports 2008; 20 : 953-956.
37. Chen CI, Crump M, Tsang R, Stewart AK and Keating A. Autotransplants for histologically transformed follicular non-Hodgkin’s lymphoma. British Journal of Haematology 2001; 113: 202–208. doi: 10.1046/j.1365-2141.2001.02705.x
38. Sabloff M, Atkins HA, Bence-Bruckler I, et al. A 15-year analysis of early and late autologous hematopoietic stem cell transplant in relapsed, aggressive, transformed, and nontransformed follicular lymphoma. Biology a Blood and marrow Transplantation 2007; 13 : 956-964.
39. Hamadani M, Benson Jr, D M, Lin, et al. High-dose therapy and autologous stem cell transplantation for follicular lymphoma undergoing transformation to diffuse large B-cell lymphoma. European Journal of Haematology 2008; 81: 425–431. doi: 10.1111/j.1600-0609.2008.01146.x
40. Rezvani AR, Norasetthada L, Gooley, et al. Non-myeloablative allogeneic haematopoietic cell transplantation for relapsed diffuse large B-cell lymphoma: a multicentre experience. BJH 2008; 143: 395–403. doi: 10.1111/j.1365-2141.2008.07365.x
41. Ouansafi I, He B, et al. Transformation of follicular lymphoma to plasmablastic lymphoma with c-myc rearrangement. Am J Clin Pathol 2010; 134(6): 972-81.
42. Biasoli I, Stamatoullas A, Meignin V, et al. Nodular, lymphocyte-predominant Hodgkin lymphoma: A long-term study and analysis of transformation to diffuse large B-cell lymphoma in a cohort of 164 patients from the Adult Lymphoma Study Group. Cancer 2010; 116 : 631-639.
43. Al-Mansour M, Connors JM, Gascoyne RD, et al. Transformation to aggressive lymphoma in nodular lymphocyte-predominant Hodgkin’s lymphoma. J Clin Oncol 2010; 28 : 793-799.
44. Montoto S, Fitzgibbon J, et al. Transformation of Indolent B-Cell Lymphomas. JCO 2011; 1827-1834; published online on April 11, 2011
45. Schoder H, Noy A, Gonen M, et al. Intensity of 18fluorodeoxyglucose uptake in positron emission tomography distinguishes between indolent and aggressive non-Hodgkin’s lymphoma. J Clin Oncol 2005; 23 : 4643-4651.
46. Noy A, Schoder H, Gonen M, et al. The majority of transformed lymphomas have high standardized uptake values (SUVs) on positron emission tomography (PET) scanning similar to diffuse large B-cell lymphoma (DLBCL). Ann Oncol 2009; 20 : 508-512.
47. Al-Tourah AJ, Savage KJ, Gill KK, et al. Addition of rituximab to CHOP chemotherapy significantly improves survival of patients with transformed lymphoma. American Society of Hematology, Annual Meeting, Atlanta, GA, 2007
48. Tan D, Rosenberg SA, Lavori P, et al. Improved prognosis after histologic transformation (HT) of follicularlymphoma (FL): The Stanford experience 1960-2003. 10th International Conference on Malignant lymphoma, Lugano, Switzerland, 2008.
49. Williams C.D, Harrison C.N. et al. High-Dose Therapy and Autologous Stem-Cell Support for Chemosensitive Transformed Low-Grade Follicular Non-Hodgkin’s Lymphoma: A Case-Matched Study From the European Bone Marrow Transplant Registry. JCO Feb 1, 2001; 727-735.
50. Hamadani M, Awan FT, et al. Feasibility of allogeneic hematopoietic stem cell transplantation for follicular lymphoma undergoing transformation to diffuse large B-cell lymphoma. Leuk Lymphoma 2008; 49(10): 1893-8.
51. Eide MB, Lauritzsen GF, et al. High dose chemotherapy with autologous stem cell support for patients with histologically transformed B-cell non-Hodgkin lymphomas. A Norwegian multi centre phase II study. BJH 2010; 152: 600–610. doi: 10.1111/j.1365-2141.2010.08519.x
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2011 Číslo 3- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Léčebná studie Relapsed AML 2001/01, 02 pro děti s relapsem akutní myeloidní leukemie nebo primárně rezistentní nemocí zlepšila jejich naději na vyléčení
- Who is fit for allogeneic transplantation? (PERSPECTIVES)
- Úloha alogenní transplantace buněk krvetvorby v léčbě získané aplastické anémie u dětí – zkušenost v České republice v letech 1991–2007
- A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin (ATG), cyclosporine, with or without G-CSF: a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation
- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Symptomatický myeloidný sarkóm uteru v čase diagnózy akútnej myeloblastovej leukémie – kazuistika
- Hematopoietic cell transplantation comorbidity index predicts transplantation outcomes in pediatric patients
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Oznámení o nové knize
- Incidence of factor VIII inhibitors throughout life in severe hemophilia A in the United Kingdom
- Long-term clinical outcomes of patients with primary chronic immune thrombocytopenia: a Danish population-based cohort study
- Monosomal karyotype in primary myelofibrosis is detrimental to both overall and leukemia-free survival
- New insights into childhood autoimmune hemolytic anemia: a French national observational study of 265 children
- A randomized, double-blind study of romiplostim to determine its safety and efficacy in children with immune thrombocytopenia
- Významná data z historie československé a české hematologie
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Významná data z historie československé a české hematologie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



