-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTerapie závažných raných infekcí u pacientů se zavedenou mechanickou srdeční podporou pomocí V.A.C systému
Management of Deep Device Related Infection in Patient Implanted with Mechanical Cardiac Support Device Using V.A.C. System
Infection remains the most significant cause of morbidity and mortality in pacients implanted with mechanical circulatory support devices (MCSD), reaching prevalence of 40–60% according various authors [1, 2]. Successful treatment of the whole spectrum of infectious complications is the basic determinant in archieving good results in MCSD patients. The treatment involves standard surgical procedures, as well as the use of vacuum assisted closure (V.A.C.) therapy in the last few years. We demonstrate successful management of deep device related infection using V.A.C therapy in a patient with MCSD, giving him the opportunity to heart transplantation, and thereafter successful treatment of poststernotomy mediastinitis in this imunosupressed pacient after heart transplantation.
Key words:
mechanical circulatory support device (MCSD) – infection – Vacuum assisted closure system (V.A.C.) – heart transplantation – poststernotomy mediastinitis
Autoři: D. Turek; I. Netuka; J. Malý; O. Szárszoi; J. Bešík; M. Urban; J. Pirk; V. Petkov *
Působiště autorů: Klinika Kardiovaskulární chirurgie IKEM Praha, přednosta: prof. MUDr. Jan Pirk, DrSc. ; Oddělení klinické mikrobiologie IKEM Praha, vedoucí: MUDr. Vladimír Petkov *
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 12, s. 693-696.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Infekční komplikace u pacientů se zavedenou mechanickou srdeční podporou (MSP), jejichž popisovaný výskyt se pohybuje mezi 40–60 % [1, 2], zůstávají nejvýznamnější příčinou morbidity a mortality těchto nemocných. Úspěšné zvládnutí celého spektra infekčních komplikací je základním předpokladem pro dosažení dobrých výsledků terapie pomocí MSP. V léčbě se uplatňují jednak standardní chirurgické postupy, v poslední době se však dostává u této specifické skupiny pacientů do popředí použití vakuem asistované terapie – V.A.C. (Vacuum Assisted Closure). Na příkladu pacienta se zavedenou biventrikulární mechanickou srdeční podporou demonstrujeme úspěšné použití V.A.C. systému při léčbě hluboké lokální infekce v oblasti implantovaného přístroje s počínající sepsí a následně i úspěšnou terapii poststernotomické mediastinitis u téhož, již imunosuprimovaného, pacienta po provedené transplantaci srdce.
Klíčová slova:
mechanická srdeční podpora (MSP) – infekce – vakuem asistovaná terapie (V.A.C.) – transplantace srdce (TxS) – mediastinitidaÚVOD
Chronické srdeční selhání (CHSS) je definováno jako stav postižení srdce, u kterého přetrvává i při dostatečné náplni komor nízký minutový srdeční výdej a srdce tak není schopno krýt metabolické potřeby tkání. V evropských zemích se vyskytuje u 0,4–2 % populace s výrazným nárůstem ve vyšších věkových skupinách. Na základě výsledků průzkumu EUROHEART Survey je pro východní Evropu udávána prevalence 1,3 % [3]. Neméně významnou je pak skupina nemocných s náhle vzniklým akutním srdečním selháním, zejména na podkladě akutního infarktu myokardu, nebo myokarditidy.
Terminální stadium obou těchto forem srdečního selhání je zatíženo výraznou mortalitou. Vedle rutinních možností komplexní farmakologické léčby, resynchronizační terapie a zavedení intraaortální balonkové kontrapulzace (IABK) si již své pevné místo obhájilo i použití MSP. Ty můžeme definovat jako čerpadla krve, která jsou schopna u pacientů s pokročilým, život ohrožujícím, srdečním selháním částečně nebo úplně převzít úlohu srdce v krevním oběhu s cílem obnovení dostatečného srdečního výdeje. Pro jejich klasifikaci používáme celou řadu kritérií [4], v kontextu diskutované problematiky je pak nejdůležitější hledisko 1. laterality MSP a dále pak 2. umístění čerpadla systému.
Ad 1. Přístroje mohou být použity pro podporu činnosti levé komory (LVAD – left ventricular assist device), pravé komory (RVAD – right ventricular assist device) nebo pro podporu oboustranných srdečních oddílů (BIVAD – biventricular assist device). V těchto případech je systém umístěn paralelně se srdečními oddíly, se kterými je spojen pomocí vtokových a výtokových kanyl. Ty jsou při LVAD nejčastěji zavedeny do hrotu levé komory (alternativně levé síně) a do vzestupné aorty, při použití jako RVAD pak do pravé síně a plicnice.
Ad 2. Z pohledu umístění hnací komponenty MSP rozeznáváme systémy parakorporální, kdy je umístěna vně organismu pacienta a se srdečními oddíly je spojena transkutánně zavedenými kanylami. Druhou, v současnosti již převažující skupinou jsou implantabilní MSP, zavedené uvnitř těla pacienta a to nejčastěji preperitoneálně pod bránicí, méně frekventní je varianta intraperitoneální implantace. V tomto případě prochází přes kůži pacienta pouze napájecí kabel přístroje o průměru 9 mm.
Implantovaná MSP může být pro pacienta přechodným řešením do obnovení dostatečné čerpací funkce srdce (bridge to recovery – BTR), nebo do úspěšné transplantace srdce (bridge to transplantation – BTT), event. může být řešením definitivním (destination therapy – DT),
Komplikace terapie pomocí MSP podle četnosti výskytu jsou: infekce, krvácení, trombembolické příhody a u moderních přístrojů již poměrně ojedinělé mechanické selhání přístroje. U levostranných MSP je navíc vždy zcela zásadní aktivní prevence a přístup vzhledem k riziku pravostranného srdečního selhání.
Jak je uvedeno, infekční komplikace zůstávají i přes veškeré pokroky v konstrukci přístrojů, operační technice a perioperační péči nejvýznamnější příčinou mortality a morbidity pacientů s MSP. Podle výsledků randomizované prospektivní studie REMATCH (The Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure) z roku 2002 prodělalo 42 % pacientů s implantovaným LVAD v indikaci DT do jednoho roku od implantace sepsi [1]. Toto procento se při dvouletém sledování zvýšilo na 52 %. Sepse byla současně nejčastější příčinou smrti ve skupině pacientů s LVAD (38,5 % celkové mortality) [1].
Význam důrazu na úspěšné a radikální řešení infekčních komplikací dokumentují následující data. U septických pacientů se zavedenou levostrannou mechanickou podporou (LVAD) v indikaci BTT je výrazně nižší pravděpodobnost dožití se transplantace srdce a to 31.8 % vs. 81,1 %, p = 0,01, nicméně po úspěšné transplantaci srdce je jejich jednoroční přežívání stejné jako u skupiny pacientů s LVAD bez sepse před transplantací [5]. Rovněž lokální infekce v oblasti implantovaného přístroje sice prodlužuje celkovou délku hospitalizace, ale nezvyšuje jednoroční mortalitu pacientů v potransplantačním období [5].
Infekce u pacientů s MSP mohou být 1. spojené s přístrojem: infekce napájecího kabelu nebo kanyl, infekce lůžka přístroje, infekční endokarditis přístroje a sepse, nebo 2. bez souvislosti s přístrojem: respirační, močové, gastrointestinální, katétrové a jiné. Příčinou zvýšené vnímavosti pacientů s MSP k infekci ve srovnání s elektivními kardiochirurgickými pacienty může být celkové oslabení, malnutrice, až kardiální kachexie, dlouhodobá předchozí hospitalizace a kolonizace nozokomiálními kmeny, mnohočetné invazivní vstupy, v počátečních fázích terapie většinou přítomné renální a hepatální selhání a porucha specifické imunity v oblasti T - a B-lymfocytů u pacientů na dlouhodobé mechanické srdeční podpoře [6].
V léčbě infekcí spojených s přístrojem se uplatňuje několik postupů. Kromě cílené celkové antibiotické terapie se jedná o chirurgickou excizi nekrotických a infikovaných tkání v okolí přístroje, irigace povrchu přístroje antiseptiky, kontinuální proplachová laváž kapsy přístroje, zavedení antibiotiky impregnovaných materiálů do okolí přístroje za monitorace hladin antibiotika v séru i v sekretu z drénů, plastika muskulárním lalokem (nejčastěji m. rectus abdominis), omentoplastika a vzájemná kombinace všech výše uvedených postupů. Další nadějnou metodou je pak použití vakuem asistované terapie (V.A.C.).
V.A.C. systém (Vacuum assisted wound closure, KCL, Inc., San Antonio, Texas, USA) je originální systém ošetřování ran za použití kontinuální, nebo intermitentní aplikace vakua do oblasti akutního nebo chronického defektu s cílem kontinuálního odsávání raného sekretu, redukce mikrobiálního osídlení a promoce hojení per secundam. V současnosti je V.A.C. systém již široce používán v léčbě poststernotomické mediastinitidy v kardiochirurgii [7], ale i v léčbě hlubokých raných infekcí v břišní a plastické chirurgii, dermatologii i ortopedii.
Na příkladu pacienta s biventrikulárním MSP prezentujeme úspěšné použití V.A.C terapie při kontrole hlubokého lokálního infektu v oblasti kanyl MSP v předtransplantačním období a následné řešení poststernotomické mediastinitis pomocí V.A.C. terapie u již imunosuprimovaného nemocného se srdečním alotransplantátem.
KAZUISTIKA
Muž, 45 let, s rizikovými faktory ICHS, po opakovaných intervencích v povodí obou koronárních tepen (celkem 7 perkutánních intervencí v období osmi let) byl přeložen ze spádového Kardiocentra k implantaci mechanické srdeční podpory pro progredující kardiogenní šok při rozsáhlém STEMI spodní stěny. Předoperačně byl pacient bez klinických známek infekčního fokusu, nicméně již 16 hodin na umělé plicní ventilaci, se zavedenou IABK, endovasální stimulační elektrodou a S-G katétrem. Vzhledem k těžké dysfunkci obou srdečních komor a přítomnosti multiorgánového selhání byla indikována implantace biventrikulární MSP Thoratec VAD (Thoratec Corporation, Pleasanton, USA). Výkon byl proveden standardní technikou v chráněném koagulu (Vancomycin + Ciprofloxacin), pro výrazné krvácení při přítomné koagulopatii byla zvolena odložená definitivní sutura sterna po 24 hodinách od implantace. Časný pooperační průběh byl příznivý, pacient extubován, pomocí MSP dosaženo dobrých oběhových parametrů umožňujících ukončení inotropní podpory a byla zahájena rehabilitace.
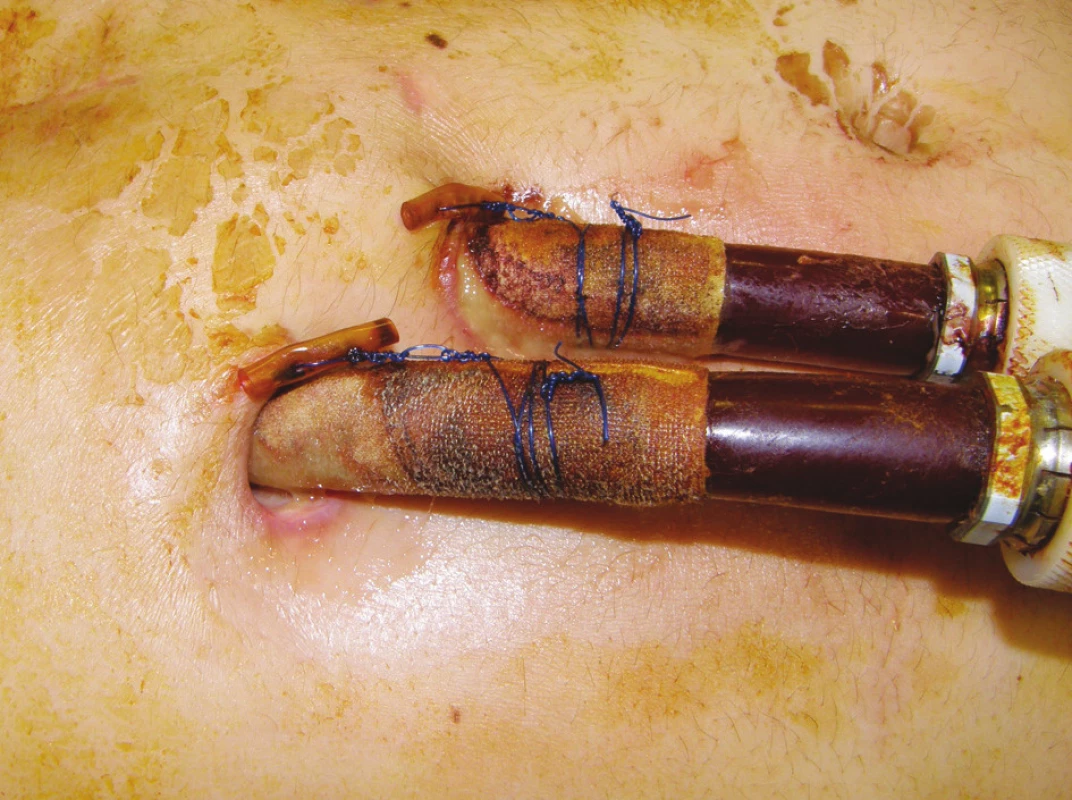
V dalším průběhu si sekrece podél kanyl pravostranné MSP (Obr. 1) a suspektní absces v dolním polu sternotomické rány vyžádal 21. pooperační den chirurgickou revizi ze subxiphoidálního přístupu. Kultivačně z rány i z hemokultur Staphylococcus aureus produkující beta-laktamázu. Proveden chirurgický debridement, excize abscesové dutiny, výplach perikardu antiseptiky. Zaveden drén do perikardu, adaptační sutura podkoží a kůže v jedné vrstvě. Změna ATB podle citlivosti (Cotrimoxazol). Postupně úprava stavu, pacient afebrilní, laboratorně postupná normalizace zánětlivých markerů. Rána klidná, drén odstraněn 7. den po revizi. Pro kultivační nález ze sekretu z drénu (Staphylococcus aureus produkující beta laktamázu) přidán Oxacillin ve vysokých dávkách.
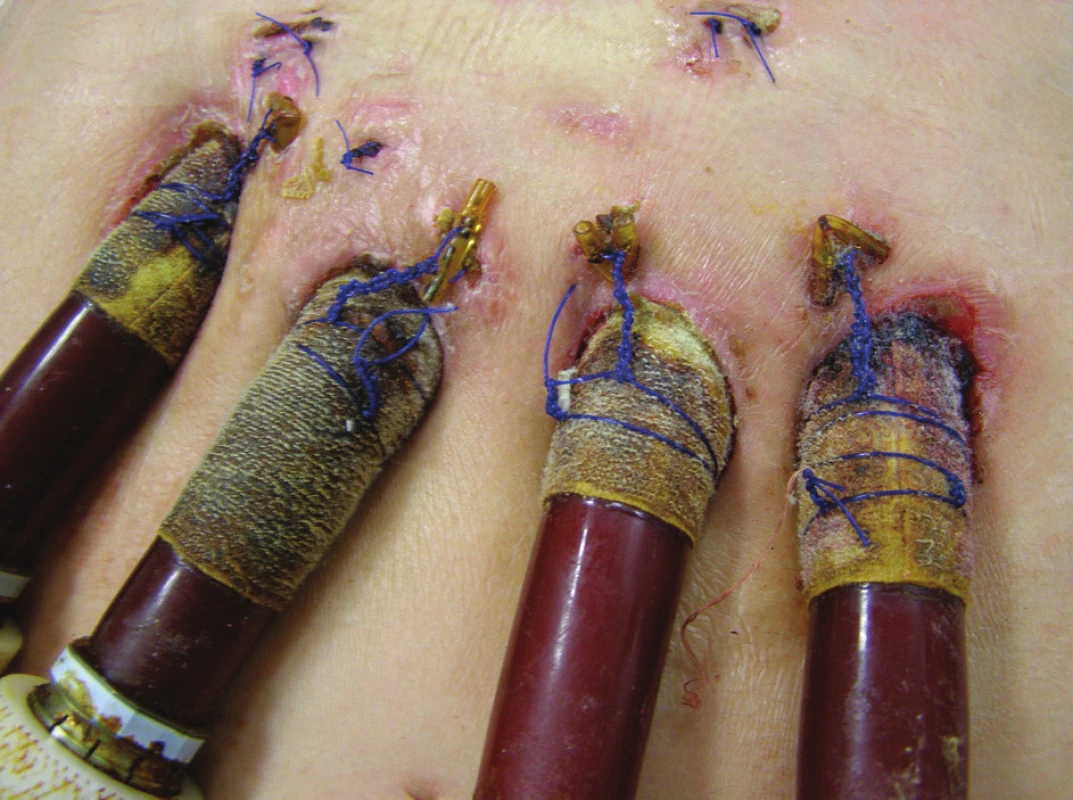
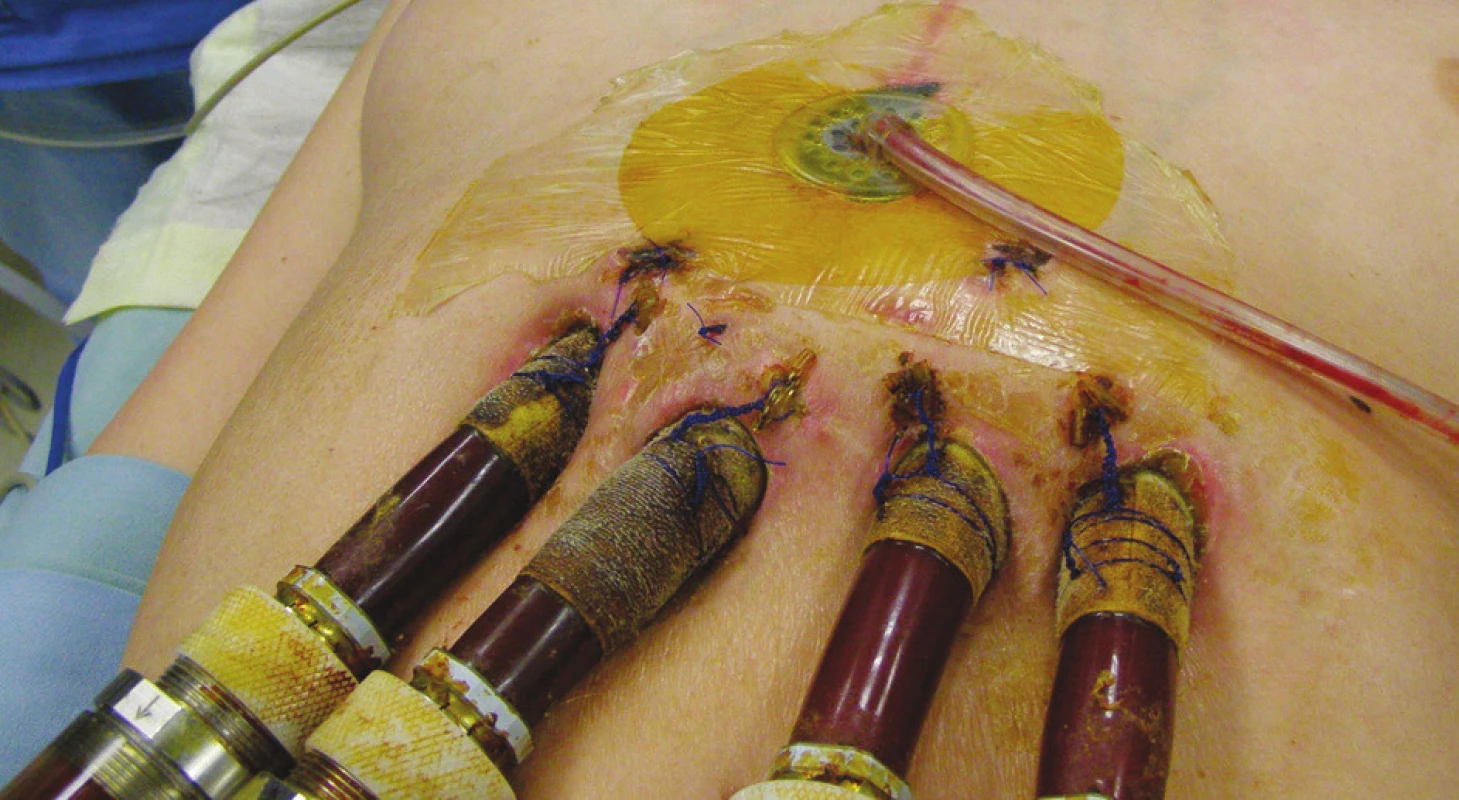
Třicátý den po implantaci MSP byl pacient zařazen na čekací listinu k transplantaci srdce (TxS) v urgentním pořadí. Při absenci známek lokální i celkové infekce byla 45. den ukončena antibiotická terapie. V dalším průběhu hospitalizace byl gastroskopicky argonovou plazmakoagulací úspěšně ošetřen krvácející polyp gastroezofageální junkce. Padesátý pátý den od zavedení MSP byl pacient opětovně revidován pro nově vzniklou hnisavou sekreci podél pravostranných kanyl MSP doprovázenou výrazným vzestupem zánětlivých markerů. CT vyšetření nepotvrdilo zánětlivé ložisko v mediastinu. Kultivačně z okolí pravostranných kanyl MSP nález Staphylococcus aureus (jiný typ), hemokultury negativní. Změna antibiotik podle citlivosti (Vankomycin). Původní ránou subxiphoidálně proniknuto ke kanylám RVAD, proveden chirurgický debridement a zaveden V.A.C systém. Pacient byl přechodně opět vyřazen z čekací listiny TxS. V.A.C přístroj byl nastaven v kontinuálním režimu, podtlak 125 mm Hg, převazy prováděny za sterilních kautel na operačním sále v intervalech 3–4 dnů podle intenzity sekrece a makroskopického vzhledu rány. Při každém převazu defekt opakovaně vyplachován antiseptikem (Skinsept). Současně prováděny pravidelné převazy okolí kanyl MSP za použití lokálního antiseptika (Betadine). Postupně dochází k vymizení sekrece v okolí pravostranných kanyl (Obr. 2), poklesu zánětlivých markerů. Defekt v subxiphoidální oblasti se zavedeným V.A.C systémem (Obr. 3) se čistí, patrná je vysoká tendence k hojení per secundam. Nicméně ani při účinné celkové ATB terapii za monitorace sérových hladin Vankomycinu a renálních funkcí se nedaří dosáhnost sterilních kultivací z defektu. Ve shodě s transplantačními kardiology byl proto pacient při absenci celkových známek zánětu po dalším měsíci opětovně zařazen na čekací listinu, nicméně bylo pokračováno v antibiotické cloně podle citlivosti.
Sto čtvrtý den po implantaci MSP byla u pacienta v chráněném koagulu (Ceftriaxon) provedena ortotopická transplantace srdce s nekomplikovaným časným pooperačním průběhěm, peroperační stěry z mediastina, perikardu a okolí kanyl byly kupodivu negativní. Nicméně pozitivní imunologický cross-match si vynutil v časném potransplantačním období zesílenou imunosupresi.
Osmnáctý pooperační den po TxS si podezření na mediastinitidu vyžádalo operační revizi, kdy byla nalezena zánětlivá infiltrace v dolním pólu sternotomie s komunikací do perikardu, zánět shledán rovněž v okolí původních ran po průchodu kanyl MSP. Sternum pevné, bez dehiscence. Proveden debridement a excize infikované tkáně v dolním pólu sternotomie a v okolí incizí po kanylách, do všech míst aplikován V.A.C. systém. Infekční agens Klebsiella pneumoniae produkující ESBL (enhanced spectrum betalactamasis – širokospektrá betalaktamáza), nasazen Meropenem. Při kontinuální terapii V.A.C systémem s převazy rány v třídenních intervalech dochází postupně i přes nutnou imunosupresi ke zlepšení lokálního nálezu, vyčištění defektu a poklesu zánětlivých markerů. Po opakovaně negativních kultivacích i makroskopicky příznivém vzhledu rány bylo přistoupeno po 12 dnech aplikace V.A.C terapie k resutuře. Byla provedena resutura zbytků fascie v jedné vrstvě, podkoží a kůže rovněž v jedné vrstvě, zaveden drén do perikardu a nad fascii. Drény byly odstraněny čtvrtý den, rána postupně zhojena per primam a pacient následně propuštěn do ambulantní péče. Po 6 měsících od definitivní resutury je rána zhojena, sternum pevné. Pacient je kardiálně kompenzován ve funkční třídě NYHA II. a bez známek infekčního fokusu.
DISKUSE
Riziko vzniku sepse u pacientů s MSP je nejvyšší v období kolem 3. týdne po implantaci [1, 8].
U našeho pacienta byla první revize pro známky sepse 21. pooperační den. Etiologicky se uplatňují především biofilm produkující druhy bakterií a hub [2] (Staphylococcus, Pseudomonas, Enterococcus, Candida). Polysacharidový biofilm zamezuje přístupu aktivovaných leukocytů, protilátek, komplementu a antibiotik, a spolu se snížením metabolismu bakterií uvnitř kolonie omezuje úspěšnost antibiotické léčby.
Situace je oproti jiným chirurgickým infekcím komplikována přítomností rozsáhlé plochy implantovaného umělého materiálu a dále pak komunikací systému přes kožní kryt pacienta s vnějším prostředím. Při prevenci infekčních komplikací proto klademe maximální důraz na rychlou, šetrnou, a pokud možno fyziologickou operační techniku a tím na minimalizaci množství koagul v oblasti kanyl a kapsy implantovaného MSP, které se mohou sekundárně infikovat a bránit postupu hojení. Drény ponecháváme v mediastinu dostatečně dlouho a do oblasti kapsy přístroje zavádíme Redonovy drény. Zároveň je třeba provádět pečlivé lokální ošetřování oblasti prostupu kabelu či kanyl, a to včetně stabilizace místa vstupu k dosažení minimální iritace vrůstající okolní tkáně. V neposlední řadě se pak v rámci indikačních možností pokoušíme preferenčně volit implantabilní MSP, u nichž prostupuje přes kožní kryt pouze jediný flexibilní napájecí kabel (průměr 9 mm) a tak se výrazně zmenšuje plocha pro vstup infekce. Dalším faktorem je pak možnost lepší rehabilitace a renutrice pacientů díky jejich mobilitě při použití jednostranných miniaturních MSP, což také pozitivně přispívá k odolnosti proti infekci.
Z mezinárodní literatury i našich vlastních zkušeností je zřejmé, že eradikace infekce z oblasti komponent MSP je při vytvořeném bakteriálním biofilmu za použití standardních chirurgických postupů prakticky nemožná. Zásadním problémem zůstává zejména stagnace sekretu v oblasti rány i při intenzivních převazech. Proto má i v této oblasti použití vakuem asistované terapie několik nepochybných předností: kontinuální odsávání sekretu zvyšuje hojivou schopnost okolních tkání a průnik antibiotik, zmenšuje tkáňový otok, přispívá k postupnému uzavírání defektu a zároveň podporuje tvorbu granulační tkáně.
Naše povzbudivé zkušenosti podporují hypotézu, že využití uváděného postupu umožňuje dobrou lokální i celkovou kontrolu hlubokých infekčních komplikací u pacientů s MSP, kteří pak mohou podstoupit transplantaci srdce za výrazně příznivějších výchozích podmínek. Tyto závěry jsou tak do značné míry v rozporu s dosavadní mezinárodně uznávanou praxi, že pacienti s lokální infekcí v oblasti MSP a počínající sepsí jsou indikování k urgentní TxS [5], jejíž výsledky nejsou vzhledem k rozsáhlému výkonu v infekčním terénu s nutností následné imunosuprese zdaleka optimální.
K potvrzení správnosti této hypotézy jsou však bezpochyby nezbytná sledování a studie na rozsáhlejších počtech pacientů.
MUDr. Daniel Turek
Vídeňská 1116
140 21 Praha 4
e-mail: daniel.turek@ikem.cz
Zdroje
1. Holman, W. L., Park, S. J., Long, J. W., et al. Infection in Permanent Circulatory Support: Experience From the REMATCH Trial. J. Heart Lung Transplant., 2004; 23 : 1359–1365.
2. Holman, W. L., Rayburn, B. K., McGiffin, D. C., et al. Infection in Ventricular Assist Devices: Prevention and Treatment. Ann. Thorac. Surg., 2003; 75[Suppl]: S48–S57
3. Špinar, J., Hradec, J., Meluzín, J., et al. Doporučení pro diagnostiku a léčbu chronického srdečního selhání ČKS 2006. Cor. Vasa, 2007; 49(1): K5–K34, Supplementum Cor. Vasa, 2007; 49(11): 75–104.
4. Netuka, I., Malý, J., Szárszoi, O. Mechanické srdeční podpory v terapii terminálního srdečního selhání. Cor. Vasa, 2008; 50(5): 207–214.
5. Schulman, A. R., Martens, T. P., Russo, M. J., et al. Effect of left ventricular assist device infection on post-transplant outcomes. J. Heart Lung Transplant., 2009; 28 : 237–242.
6. Itescu, S., John, R. Interactions between the recipient immune system and the left ventricular assist device surface: immunological and clinical implications. Ann. Thorac. Surg., 2003; 75: S58.
7. Raja, S. G., Berg, G. A. Should vacuum-assisted closure therapy be routinely used for management of deep sternal wound infection after cardiac surgery? Interact. CardioVasc. Thorac. Surg., 2007; 6 : 523–527.
8. Holman, W. L., Pae, W. E., Teutenberg, J. J., et al. INTERMACS: Interval Analysis of Registry Data. J. Am. Coll. Surg., 2009; 208 : 755–762.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek VĚCNÝ REJSTŘÍKČlánek OBSAHČlánek Tupé poranění karotidyČlánek Řešení diafyzárních zlomenin předloktí pomocí úhlově stabilní dlahy LCP a nitrodřeňového hřebováníČlánek Cystadenom jater
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 12- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- VĚCNÝ REJSTŘÍK
- OBSAH
- Terapie závažných raných infekcí u pacientů se zavedenou mechanickou srdeční podporou pomocí V.A.C systému
- Poranenie zadnej steny duodena
- Může být krvácení ze spongiózy sakra fatální komplikací nestabilní zlomeniny pánve?
- Tupé poranění karotidy
- Řešení diafyzárních zlomenin předloktí pomocí úhlově stabilní dlahy LCP a nitrodřeňového hřebování
- Úrazový registr České republiky – zkušenosti s vedením databáze ve FN Brno
- Porovnanie hybridného operačného postupu – intraoperačnej angioplastiky a cross-over bypassu s aortobifemorálnym bypassom v revaskularizácii iliakálnych artérií
- Srovnání onkologických výsledků laparoskopického a otevřeného přístupu u nemetastazujícího karcinomu kolon
- Cystadenom jater
- Malignómy kólonu a rekta z pohľadu hemokoagulácie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Řešení diafyzárních zlomenin předloktí pomocí úhlově stabilní dlahy LCP a nitrodřeňového hřebování
- Cystadenom jater
- Tupé poranění karotidy
- Porovnanie hybridného operačného postupu – intraoperačnej angioplastiky a cross-over bypassu s aortobifemorálnym bypassom v revaskularizácii iliakálnych artérií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání