-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMá amygdalin své místo v integrativní protinádorové léčbě?
Can Amygdalin Provide any Benefit in Integrative Anticancer Treatment?
Background: Amygdalin is a natural compound primarily found in seeds of fruit trees. In the human body, it is hydrolyzed to benzaldehyde, glucose, and cyanide, which is considered the active component of amygdalin. The semi-synthetic form of amygdalin is known under the commercial name Laetrile® or as vitamin B17.
Purpose: This review aims to provide a comprehensive overview of studies that evaluated the potential therapeutic effects of amygdalin in oncology. Preclinical studies provided information about the mechanisms of action of amygdalin in vitro and in vivo and its toxicity. Recent in vitro studies demonstrated the effects of amygdalin on the cell cycle, apoptosis, and synthesis of cyclooxygenase-2, inducible nitric oxide synthase, E-cadherin, and integrins β1 and β4. However, amygdalin exhibited no or low treatment efficiency in preclinical in vivo studies. Conversely, many case studies describe the anti-tumor effects of amygdalin, but these have not been confirmed in clinical trials. Only two clinical studies published almost 40 years ago focused on the safety of amygdalin administered orally and intravenously. Although these studies reported that amygdalin had no benefit in 178 cancer patients, this compound has recently come to the attention of both scientists and patients. The results of recent in vitro studies are promising and indicate that amygdalin has a oncopreventive effect, although this must be confirmed by in vivo studies and clinical trials. Considering its proven toxicity and unconvincing clinical effects, amygdalin cannot currently be recommended to oncology patients as a supportive treatment.
Keywords:
toxicity – side effects – malignancy – amygdalin
Autoři: Alžběta Třísková; Jana Rudá-Kučerová
Působiště autorů: Farmakologický ústav, LF MU, Brno
Vyšlo v časopise: Klin Onkol 2019; 32(5): 360-366
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2019360Souhrn
Východiska: Amygdalin je přírodní sloučenina, která se nachází především v semenech ovocných stromů. V lidském těle je postupně hydrolyzován až na benzaldehyd, glukózu a kyanid, který je považován za účinnou látku amygdalinu. Semisyntetická forma amygdalinu je známa pod komerčním názvem Laetrile® nebo jako vitamin B17.
Cíl: Cílem této přehledové práce je poskytnout ucelený obraz o výsledcích studií, které se věnují potenciálnímu léčebnému účinku amygdalinu v onkologii. Preklinické studie poskytují informace především o mechanizmech účinku in vitro, in vivo a toxicitě. V nedávných studiích in vitro byla prokázána aktivita na úrovni buněčného cyklu, apoptózy a syntézy COX-2, iNOS, E-cadherinu a integrinů β1, β4. Preklinické studie in vivo však zaznamenaly slabý, nebo žádný efekt. Naopak existenci protinádorových účinků amygdalinu popisuje množství případových studií in vivo, avšak pozitivní efekt léčby amygdalinem nebyl potvrzen klinickými studiemi. Ty existují dosud pouze dvě a jsou téměř 40 let staré. Zabývaly se především bezpečností amygdalinu podávaného perorálně i intravenózně. Ačkoliv tyto klinické studie neprokázaly na 178 léčených onkologických pacientech žádný efekt, amygdalin se dnes dostává znovu do popředí zájmu vědců i pacientů. Výsledky posledních studií in vitro jsou optimistické a současné poznatky přisuzují amygdalinu jistý onkopreventivní efekt, jehož zhodnocení však vyžaduje potvrzení dalšími studiemi in vivo a klinickým hodnocením. Vzhledem k jeho nepřesvědčivým účinkům a prokazatelné toxicitě nelze jeho používání jako podpůrného přípravku v onkologii doporučit.
Klíčová slova:
amygdalin – nádorová onemocnění – nežádoucí účinky – toxicita
Úvod
Amygdalin představuje jeden z přírodních kyanogenních glykosidů původně izolovaný z jader hořkých mandlí (Prunus dulcis) v 30. letech 19. století. Jedná se o široce rozšířenou sloučeninu s molekulárním vzorcem C20H27NO11 nacházející se především v semenech meruněk, jablek, třešní, broskví a švestek. Chemickou strukturou jde o D-mandelonitril-β-D-glukosid-6-β-glukosid (obr. 1) [1–3]. Za aktivní formu amygdalinu je považována pravotočivá konfigurace (R-amygdalin), zatímco levotočivý S-izomer, který se v přírodě nevyskytuje, je považován za inaktivní [4].
Obr. 1. Chemická struktura amygdalinu [2]. ![Chemická struktura amygdalinu [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/34c5f11070e586fd36aa8ee5e88e43c6.png)
Amygdalin je v těle postupně enzymaticky hydrolyzován na benzaldehyd, dvě molekuly glukózy a kyanovodík (HCN), který je pro tělo toxický [5,6].
Amygdalin je často zaměňován se svou semisyntetickou formou (laevomandelonitril), komerčně pojmenovanou „Laetrile®“, nebo je též známý pod pojmem vitamin B17, ačkoli se o vitamin nejedná [3]. Modifikovaná forma amygdalinu byla poprvé vytvořena Krebsem ml. v roce 1952, který mandelonitril s jednou navázanou molekulou glukózy pojmenoval laetrile, název vznikl spojením slov laevorotatory a mandelonitrile [7,8]. Milníky v historii výzkumu a používání amygdalinu shrnuje tab. 1.
Tab. 1. Stručný přehled historie amygdalinu. 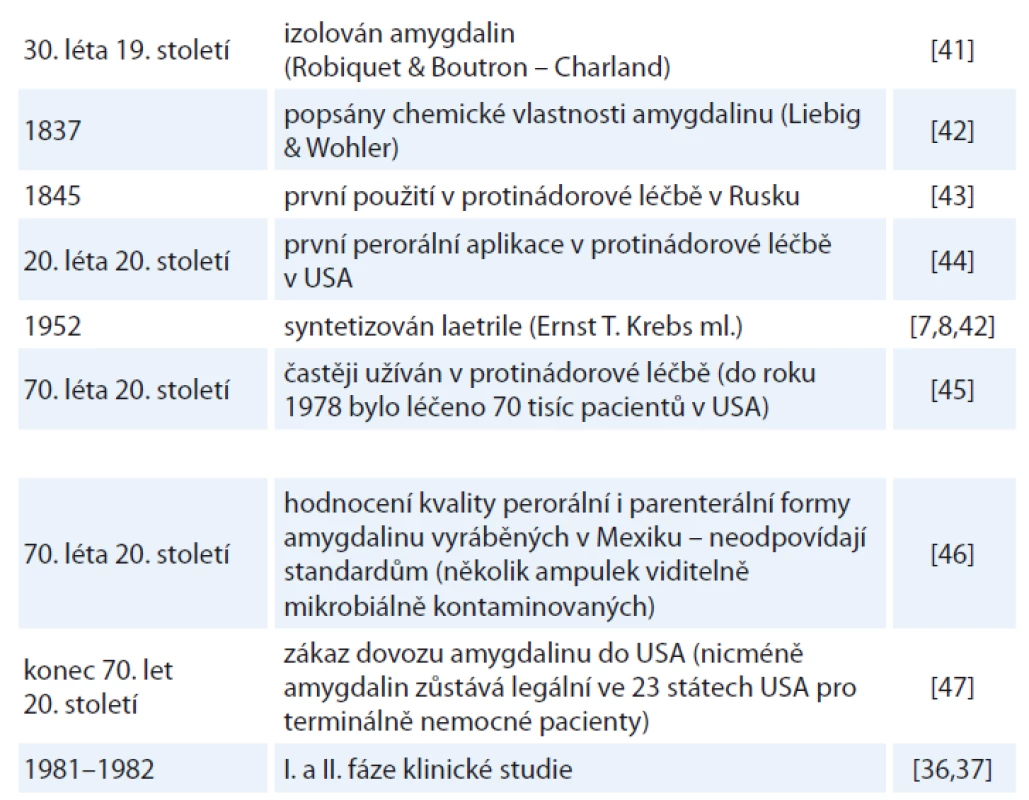
Obr. 2. Chemická struktura laetrile [2]. ![Chemická struktura laetrile [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6efd9604cdc46a4d54115f425dd27233.png)
Amygdalin je už dlouho znám a využíván tradiční čínskou medicínou pro své expektorační a protinádorové účinky [9]. V posledních dvou desetiletích je alternativní medicína více vyhledávána pacienty [10], nejrozšířenější praktikou je užívání přírodních produktů. V USA má až 80 % onkologických pacientů zkušenosti s alternativní medicínou [11], v Evropě více než 50 % onkologických pacientů využívá alternativní medicínu buď v kombinaci, nebo i místo konvenční terapie. O možnostech alternativní medicíny se pacienti nejčastěji dozvídají od rodinných příslušníků, přátel, ale čím dál více i ze zdrojů z internetu [12]. Amygdalin bývá pacienty užíván v kombinaci s urinoterapií, metabolickou terapií či intravenózní aplikací β glukosidázy [5].
Ve studiích byly prokázány antitusické a antiastmatické účinky amygdalinu, dále působí antiaterogenně, protizánětlivě, antiulcerózně, také inhibuje renální intersticiální a plicní fibrózu. Tradiční medicínou je používán k léčbě astmatu, bronchitidy, emfyzému, lepry, kolorektálního karcinomu a vitiliga [5,13].
Předpokládaný mechanizmus účinku
Samotný amygdalin není po perorálním podání ze střeva vstřebáván, ale rozkládá se dvěma odlišnými cestami v tenkém a tlustém střevě. V proximálním jejunu je amygdalin enzymaticky hydrolyzován β (1,6) glukosidázou na glukózu a prunasin (D-mandelonitril-β-D-glukosid), který je v nezměněné podobě transportován do krevního řečiště aktivním Na+ dependentním monosacharidovým transportérem SGLT1 (sodium-glucose co-transporter 1) [14,15]. Absorbovaný prunasin je z těla vylučován ledvinami [16]. Prunasin, který zůstává v gastrointestinálním traktu, je degradován β glukosidázou na mandelonitril. Mandelonitril je velmi nestabilní sloučenina, a proto může být buď ve střevě hydroxylován na hydroxymandelonitril, který prochází střevní stěnou, nebo může disociovat na benzaldehyd a kyanid, který je považován za účinnou látku amygdalinu [17]. V tlustém střevě je amygdalin úplně hydrolyzován bakteriální mikroflórou na benzaldehyd, glukózu a kyanid [14]. Kyanid snadno prochází střevní stěnou a dosahuje maximální hladiny v krvi během 1,5–2 hodin. Dále je pomocí rhodanázy (thiosulfát sulfurtransferáza) a 3-merkaptopyruvát sulfurtransferázy rychle přeměněn na thiokyanát (SCN−), který je vylučován ledvinami. Tyto enzymy nejsou v buňkách rozloženy homogenně. 3-merkaptopyruvát sulfurtransferáza se nachází z větší části v cytoplazmě, ale i v mitochondriích, zatímco rhodanáza je přítomna pouze v mitochondriích [18].
Mechanizmy účinku amygdalinu prokázané in vitro
In vitro studie prokázaly indukci apoptózy v lidských nádorových buňkách prsu. Na základě měření hladiny Bcl-2, Bcl-2 associated x protein (Bax), rozštěpené poly (ADP-ribóza) polymerázy (PARP) a prokaspázy-3 v triple-negative breast cancers (TNBC Hs578T) buňkách bylo dokázáno, že amygdalin zvyšuje expresi proapoptického proteinu Bax a hladinu rozštěpeného PARP, dále snižuje expresi antiapoptického proteinu Bcl-2 a hladinu prokaspázy-3. Amygdalin také působí fosforylaci proapoptické signální molekuly p38 mitogenem aktivované proteinové kinázy (p38 MAPK), čímž ji aktivuje (Pp38 MAPK) [19]. Stejný mechanizmus indukce programované buněčné smrti byl prokázán i v kultuře lidských prostatických nádorových buněk a v kultuře HeLa buněk [20,21].
Amygdalin ovlivňuje buněčný cyklus, jeho efekt se liší v závislosti na typu buněčné linie a době užívání. Dále snižuje hladinu proteinů zodpovědných za přechod mezi jednotlivými fázemi, čím brání proliferaci buněk. Krátkodobá aplikace podle studií vedla ke zvýšení počtu nádorových buněk močového měchýře UMUC-3 a TCCSUP ve fázi G0/G1 a snížení nádorových buněk v S fázi. Naopak u nádorových buněk močového měchýře RT112 došlo po krátkodobé aplikaci k nárůstu počtu buněk v S fázi a snížení počtu buněk v G2/M fázi [22].
Mezi další pozitivní účinky amygdalinu patří protizánětlivý a analgetický efekt, který je založen na zásahu do metabolizmu kyseliny arachidonové na úrovni indukovatelné cyklooxygenázy (COX-2), která je v buňkách exprimována pouze v reakci na zánětlivé signály, jako jsou např. prozánětlivé cytokiny, lipopolysacharid nebo bakteriální endotoxin. Je prokázáno, že amygdalin inhibuje v myších mikrogliích vystavených lipopolysacharidu expresi COX-2, což vede k potlačení syntézy prostaglandinu E2, hlavního metabolitu COX-2. Aktivita COX-2 úzce souvisí s radikály NO, který vzniká pomocí NO-syntázy, jejíž expresi inducibilní formy (iNOS) inhibuje amygdalin, a tím nepřímo potlačuje tvorbu prostaglandinu E2 (PGE2) [13].
Antimetastatické a antiproliferační účinky amygdalinu byly zkoumány na vysoce metastatických buňkách plicního nádoru. Amygdalin pozitivně ovlivňuje expresi E-cadherinu, jehož ztráta by vedla k uvolnění spojů s okolními buňkami a snadnější migraci bazální membránou. Dále snižuje expresi integrinu β1 a β4, která je charakteristická pro metastatické buňky. β1 a β4 integriny mohou například aktivovat fokální adhezivní kinázu (FAK), a tím následně zvýšit hladinu β-cateninu, který podporuje růst buňky a syntézu proteinů zodpovědných za buněčný pohyb. Dále může β1 integrin aktivovat kinázu spojenou s integriny (ILK) a spustit tak Akt-mTOR signalizační dráhu (aktivace proteinkinázy B (Akt) vede k aktivaci proteinové kinázy mTOR (mammalian target of rapamycin)), která ovlivňuje další osudy buňky na úrovni apoptózy, adheze a proliferace buněk [23].
Po užití amygdalinu byla dokumentována nižší hladina transformujícího růstového faktoru β a růstového faktoru pojivové tkáně v Itových buňkách v játrech a na tomto podkladě byl amygdalinu připsán antifibrotický účinek [24].
Preklinické hodnocení protinádorového účinku amygdalinu
Preklinické zkoumání potenciálního protinádorového účinku amygdalinu využilo buňky z kultivovaných lidských nádorových linií i buňky z nádorových modelů. Byla zjišťována protinádorová aktivita samotného amygdalinu, jeho účinnost v kombinaci s jinými látkami a míra toxicity. Ve dvou studiích byly myším a potkanům transplantovány různé hlodavčí tumory (osteogenní sarkom, melanom, leukemie, karcinom plic a karcinosarkom) a následně jim byl intraperitoneálně aplikován amygdalin samotný nebo v kombinaci s β glukosidázou. V žádných z testovaných solidních nádorů ani leukemií nebyla zaznamenána protinádorová aktivita amygdalinu, také nebylo pozorováno žádné statisticky významné prodloužení života zvířat [25,26]. Podobné výsledky byly zaznamenány v jiné studii na lidských nádorových buňkách prsu a tlustého střeva implantovaných do myší [27]. Na myších nádorech (B16 melanom a BW5147 leukemie) nebyla při parenterálním podávání pozorována žádná protinádorová účinnost amygdalinu [28]. Stock et al zveřejnili shodné výsledky pro tytéž transplantabilní nádory potkanů jako jejich předchůdci (Wodinsky a Swiniarski, 1975 [25]; Laster and Schabel, 1975 [26]), protinádorový efekt amygdalinu nebyl prokázán ani u DMBA-indukovaného potkaního karcinomu prsu [29].
Naopak v roce 1978 byla na myším adenokarcinomu prsu prokázána protinádorová aktivita amygdalinu podávaného v kombinaci s vitaminem A a enzymy [30]. V další studii vypozorovali po intraperitoneální aplikaci slabě inhibující efekt amygdalinu na růst HeLa buněk implantovaných myším [21]. Detailní přehled preklinických studií a jejich výsledků uvádí tab. 2.
Tab. 2. Přehled vybraných studií in vivo a jejich výsledky. 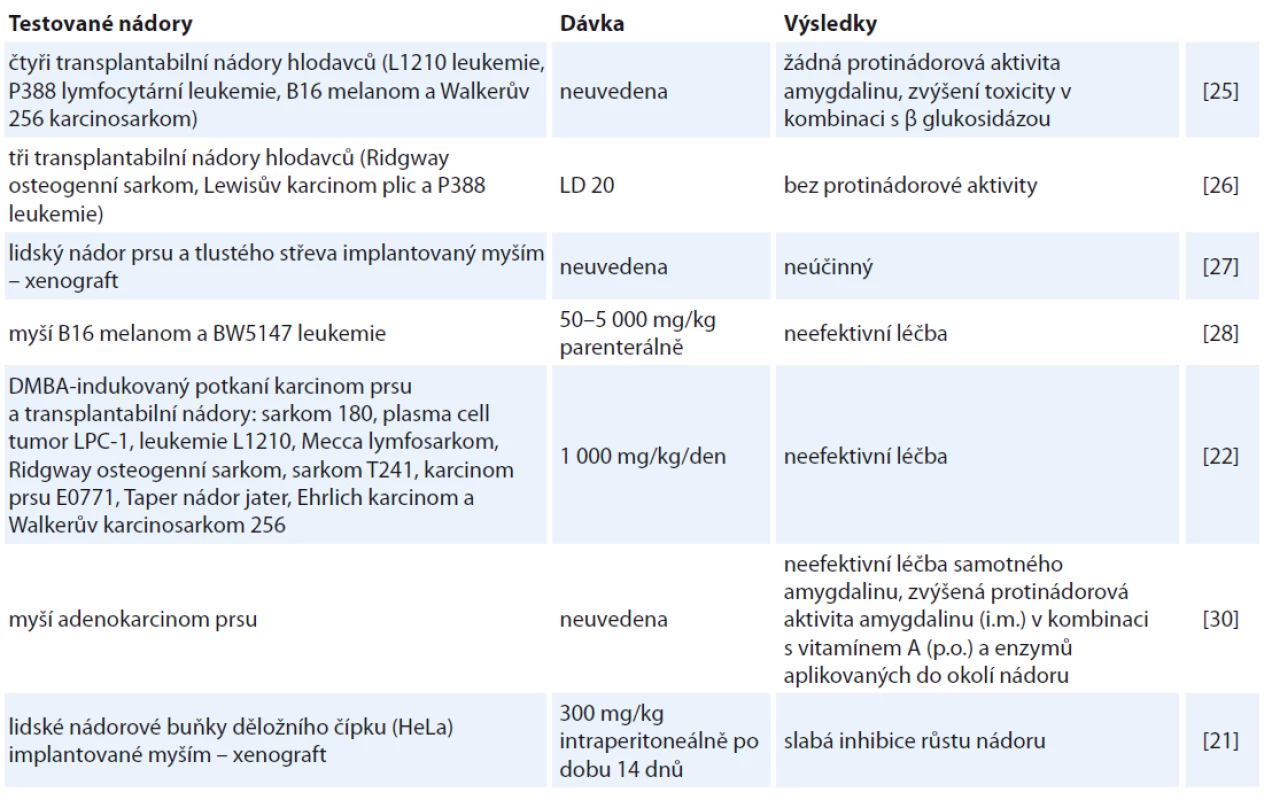
i.m. – intramuskulárně, p.o. – perorálně Klinické studie protinádorové účinnosti amygdalinu
Od 2. poloviny 20. století bylo publikováno mnoho případových studií o pozitivních účincích amygdalinu, ale klinické studie existují doposud pouze dvě, a to z let 1981 a 1982, které nepotvrdily očekávaný protinádorový efekt amygdalinu.
V případové studii publikované v roce 1962 bylo sledováno 10 osob s odlišnými neoperabilními nádory a vzdálenými metastázami. Osobám byl podáván 1 g amygdalinu intravenózně po dobu 4–43 týdnů. U všech 10 pacientů byla zaznamenána úleva od bolesti a u 8 z nich možná regrese maligních lézí [31]. V jiné studii na Filipínách popsal Navarro po podávání 0,1–0,5 g/den amygdalinu (intravenózně a perorálně) prodloužené přežití u pacientů s nádorem [32,33]. V další studii vedlo podávání 0,1–1 g/den amygdalinu k subjektivnímu zlepšení u 21 pacientů s nádorovým onemocněním ze 30 sledovaných a u 5 z nich došlo k regresi onemocnění [34]. V roce 1966 byla publikována studie, ve které bylo léčeno 150 osob v terminálním stadiu rakoviny 0,1–1 g/den amygdalinu a u 21 % byla sledována regrese tumoru nebo zastavení růstu nádoru [35].
Během fáze I klinického testování bylo na 6 pacientech s pokročilým stavem rakoviny stanoveno bezpečné dávkování a program pro intravenózní a perorální podávání amygdalinu. Intravenózně aplikované množství 4,5 g/m2/den po dobu 21 dnů nevedlo k detekovatelnému zvýšení kyanidu v krvi ani k žádnému z projevů toxicity. Po intravenózním podání byl amygdalin velmi rychle vylučován ledvinami v nezměněné formě. Naopak perorální podávání 0,5 g amygdalinu 3× denně vedlo k signifikantnímu zvýšení hladiny kyanidu v krvi na 2,1 µg/ml. Při tomto denním dávkování nebyly zaznamenány žádné známky toxicity [36].
Fáze II klinického testování se účastnilo 178 pacientů s různými nádorovými onemocněními (především nádory prsu, plic a tlustého střeva), pro které nebyly další standardní postupy léčby považovány za účinné. Účastníci nesměli být minimálně 1 měsíc před studií léčeni formou chemoterapie ani radioterapie, přičemž třetina pacientů nepodstoupila před studií žádnou z konvenčních terapií. Počty jednotlivých typů nádorů, jejich předešlou terapii a dávku amygdalinu podávaného během studie prezentuje tab. 3. Amygdalin byl pravidelně podáván společně s vitaminy a pankreatickými enzymy. Dávkovací schéma léčby je shrnuto v tab. 4. Během studie byla dodržována speciální dieta s omezením kofeinu, cukru, vajec, masa a alkoholu. Celkem 165 pacientů bylo léčeno standardními dávkami amygdalinu, nejprve racemickou směsí 4,5 g/m2/den po dobu 3 týdnů, poté perorálně po dobu 7 týdnů R-epimerem o dávce 0,5 g 3× denně. Zbývajících 14 testovaných bylo léčeno vyššími dávkami amygdalinu (i.v. 7 g/m2/den, p. o. 0,5 g 4× denně) i vitaminů. Studii dokončilo 175 pacientů, přičemž pouze 1 částečně splňoval kritéria účinnosti. Jednalo se o pacienta s nádorem žaludku s metastázami do krčních lymfatických uzlin, u kterého byla pozorována částečná odezva po dobu 10 týdnů při léčbě amygdalinem. U 54 % účastníků byla pozorována zjevná progrese onemocnění po ukončení intravenózní aplikace amygdalinu a u všech testovaných byla zaznamenána progrese onemocnění po 7 měsících po ukončení intravenózní aplikace. Při léčbě amygdalinem nebyl pozorován žádný podstatný přínos z hlediska vyléčení, stabilizace nebo zlepšení stavu nemoci či prodloužení délky života [37].
Tab. 3. Zastoupení pacientů s jednotlivými nádory a jejich terapií před studií [37]. ![Zastoupení pacientů s jednotlivými nádory a jejich terapií před studií [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e36b35ef533541d0ff4ff83d7abe6d17.png)
Tab. 4. Léčebný program amygdalinu ve studii [37]. ![Léčebný program amygdalinu ve studii [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/046d8d6b5cfa04cb8ff21124173b0aab.png)
R – R-epimer (pravotočivá konfi gurace amygdalinu), RS – racemická směs Nežádoucí účinky a toxicita zaznamenané v klinických hodnoceních
Nežádoucí účinky se vyskytují převážně v souvislosti s perorálním užitím amygdalinu a souvisí s hladinou kyanidu v krvi. Mezi nežádoucí účinky popsané v klinických studiích patří bolesti hlavy, závratě, nauzea, zvracení, dermatitida [37], horečka, posturální hypotenze [36]. V případových studiích byly popsány další nežádoucí účinky – zmatenost, cyanóza, ptóza, poškození jater, ataxická neuropatie, ve vzácných případech kóma až smrt. Tyto nežádoucí účinky mohou být zesíleny současným podáváním amygdalinu s ovocem a zeleninou obsahujícím β glukosidázu (např. celer, broskve, fazole, mrkev) [38]. Vysoké dávky vitaminu C (více než 3 g/den) per os podporují hydrolýzu amygdalinu ve střevě a potencují nežádoucí účinky amygdalinu [39].
Amygdalin může způsobit akutní i systémovou toxicitu. Experimenty akutní toxicity prokázaly po perorálním podání amygdalinu silnější toxicitu než po podání intravenózním, kdy je amygdalin velmi omezeně hydrolyzován a hladina kyanidu v krvi je velice nízká až neměřitelná. Mezi klinické projevy toxicity patří bolest hlavy, tachykardie, zmatenost, slabost, cyanóza, kóma, křeče, arytmie. Toxicita může vést k oběhovému a dechovému selhání, srdeční zástavě. U lidí se maximální toxická dávka pohybuje v rozmezí 0,5–3 g/kg váhy člověka. Systémová toxicita se objevuje po půl měsíci podávání 4 g/den per os a po 1 měsíci podávání stejného množství amygdalinu intravenózně. Dřívější toxicita po perorálním podání souvisí se štěpením amygdalinu na toxický kyanid bakteriální mikroflórou, může být doprovázena předčasnými síňovými stahy a změnami na EKG ve vlně T. Snížením dávky per os na 0,6–1 g se můžeme vyhnout výše zmíněné toxické reakci [2,5,39].
Závěr
Amygdalin je už dlouho znám a využíván tradiční čínskou medicínou pro své expektorační a protinádorové účinky [9]. V dnešní době získává pozornost ze strany onkologicky nemocných pacientů ubírajících se cestou alternativní terapie a bývá pacienty užíván v kombinaci s urinoterapií, metabolickou terapií či intravenózní aplikací glukosidázy [5]. Jeho protinádorovou účinnost hodnotily dosud pouze dvě téměř 40 let staré otevřené klinické studie, které neprokázaly žádný efekt [36,37]. Jednadvacáté století přineslo novou vlnu zájmu vědeckých pracovníků o amygdalin a jeho protinádorové účinky na úrovni in vitro [3,19–21,40]. V roce 2017 byly pozorovány možné antimutagenní a antirekombigenní účinky amygdalinu in vitro, tudíž by amygdalinu mohl být přisouzen potenciální onkopreventivní efekt [40], jehož zhodnocení však vyžaduje potvrzení dalšími studiemi. Na základě dostupných výsledků lze shrnout, že terapeutická hodnota amygdalinu nebyla dosud prokázána, a tudíž začlenění amygdalinu do standardní či integrativní léčby není možné. Četné nežádoucí účinky související především s perorálním užitím vyšších dávek amygdalinu a neprokázaný protinádorový efekt staví amygdalin do pozice, v níž pro pacienta převažuje risk nad možným benefitem.
Tato publikace vznikla na Masarykově univerzitě v rámci projektu „Farmakologický výzkum v oblasti farmakokinetiky, neuropsychofarmakologie a onkologie“ číslo MUNI/A/1550/2018 podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2019.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato/Accepted: 12. 8. 2019
doc. PharmDr. Jana Rudá-Kučerová, Ph.D.
Farmakologický ústav LF MU
Kamenice 5
625 00 Brno
e-mail: jkucer@med.muni.cz
Zdroje
1. Savic IM, Nikolic VD, Savic-Gajic IM et al. Optimization of technological procedure for amygdalin isolation from plum seeds (Pruni domesticae semen). Front Plant Sci 2015; 6 : 276. doi: 10.3389/fpls.2015.00 276.
2. Liczbiński P, Bukowska B. Molecular mechanism of amygdalin action in vitro: review of the latest research. Immunopharmacol Immunotoxicol 2018; 40 (3): 212–218. doi: 10.1080/08923973.2018.1441301.
3. Zhou C, Qian L, Ma H et al. Enhancement of amygdalin activated with β-D-glucosidase on HepG2 cells proliferation and apoptosis. Carbohydr Polym 2012; 90 (1): 516–523. doi: 10.1016/j.carbpol.2012.05.073.
4. Milazzo S, Lejeune S, Ernst E. Laetrile for cancer: a systematic review of the clinical evidence. Support Care Cancer 2007; 15 (6): 583–595. doi: 10.1007/s00520-006-0 168-9.
5. Song Z, Xu X. Advanced research on anti-tumor effects of amygdalin. J Can Res Ther 2014; 10 (Suppl 1): 3–7. doi: 10.4103/0973-1482.139743.
6. Suchard JR, Wallace KL, Gerkin RD. Acute cyanide toxicity caused by apricot kernel ingestion. Ann Emerg Med 1998; 32 (6): 742–744. doi: 10.1016/s0196-0644 (98) 70 077-0.
7. Unproven methods of cancer management. Laetrile. CA Cancer J Clin 1991; 41 (3): 187–192. doi: 10.3322/canjclin.41.3.187.
8. Milazzo S, Horneber M. Laetrile treatment for cancer. Cochrane Database Syst Rev 2015; (4): CD005476. doi: 10.1002/14651858.CD005476.pub4.
9. Milazzo S, Ernst E, Lejeune S et al. Laetrile treatment for cancer. Cochrane Database Syst Rev 2011; (11): CD005476. doi: 10.1002/14651858.CD005476.pub3.
10. Fischer FH, Lewith G, Witt CM et al. High prevalence but limited evidence in complementary and alternative medicine: guidelines for future research. BMC Complement Altern Med 2014; 14 : 46. doi: 10.1186/1472-6882-14-46.
11. Saghatchian M, Bihan C, Chenailler C et al. Exploring frontiers: use of complementary and alternative medicine among patients with early-stage breast cancer. Breast 2014; 23 (3): 279–285. doi: 10.1016/j.breast.2014.01. 009.
12. Huebner J, Micke O, Muecke R et al. User rate of complementary and alternative medicine (CAM) of patients visiting a counseling facility for CAM of a German comprehensive cancer center. Anticancer Res 2014; 34 (2): 943–948.
13. Chang HK, Yang HY, Lee TH et al. Armeniacae semen extract suppresses lipopolysaccharide induced expressions of cyclooxygenase correction of cycloosygenase. 2 and inducible nitric oxide synthase in mouse BV2 microglial cells. Biol Pharm Bull 2005; 28 (3): 449–454. doi: 10.1248/bpb.28.449.
14. Strugala GJ, Stahl R, Elsenhans B et al. Small-intestinal transfer mechanism of prunasin, the primary metabolite of the cyanogenic glycoside amygdalin. Hum Exp Toxicol 1995; 14 (11): 895–901. doi: 10.1177/096032719501401107.
15. Wagner B, Galey WR. Kinetic analysis of hexose transport to determine the mechanism of amygdalin and prunasin absorption in the intestine. J Appl Toxicol 2003; 23 (5): 371–375. doi: 10.1002/jat.934.
16. Rauws AG, Olling M, Timmerman A. The pharmacokinetics of prunasin, a metabolite of amygdalin. J Toxicol Clin Toxicol 1982; 19 (8): 851–856. doi: 10.3109/15563658208992518.
17. Shim SM, Kwon H. Metabolites of amygdalin under simulated human digestive fluids. Int J Food Sci Nutr 2010; 61 (8): 770–779. doi: 10.3109/09637481003796 314.
18. Blaheta RA, Nelson K, Haferkamp A et al. Amygdalin, quackery or cure? Phytomedicine 2016; 23 (4): 367–376. doi: 10.1016/j.phymed.2016.02.004.
19. Lee HM, Moon A. Amygdalin regulates apoptosis and adhesion in Hs578T triple-negative breast cancer cells. Biomol Ther (Seoul) 2016; 24 (1): 62–66. doi: 10.4062/biomolther.2015.172.
20. Chang HK, Shin MS, Yang HY et al. Amygdalin induces apoptosis through regulation of Bax and Bcl-2 expressions in human DU145 and LNCaP prostate cancer cells. Biol Pharm Bull 2006; 29 (8): 1597–1602. doi: 10.1248/bpb.29.1597.
21. Chen Y, Ma J, Wang F et al. Amygdalin induces apoptosis in human cervical cancer cell line HeLa cells. Immunopharmacol Immunotoxicol 2013; 25 (1): 43–51. doi: 10.3109/08923973.2012.738688.
22. Makarevic J, Rutz J, Juengel E et al. Amygdalin blocks bladder cancer cell growth in vitro by diminishing cyclin A and cdk2. PLoS One 2014; 9 (8): e105590. doi: 10.1371/journal.pone.0105590.
23. Qian L, Xie B, Wang Y et al. Amygdalin-mediated inhibition of non-small cell lung cancer cell invasion in vitro. Int J Clin Exp Pathol 2015; 8 (5): 5363–5370.
24. Luo H, Li L, Tang J et al. Amygdalin inhibits HSC-T6 cell proliferation and fibrosis through the regulation of TGF-β/CTGF. Mol Cell Toxicol 2016; 12 (3): 265–271. doi: 10.1007/s13273-016-0031-0.
25. Wodinsky I, Swiniarski JK. Antitumor activity of amygdalin MF (NSC-15780) as a single agent and with beta-glucosidase (NSC-128056) on a spectrum of transplantable rodent tumors. Cancer Chemother Rep 1975; 59 (5): 939–950.
26. Laster WR Jr, Schabel FM Jr. Experimental studies of the antitumor activity of amygdalin MF (NSC-15780) alone and in combination with beta-glucosidase (NSC-128056). Cancer Chemother Rep 1975; 59 (5): 951–965.
27. Ovejera AA, Houchens DP, Barker AD et al. Inactivity of DL-amygdalin against human breast and colon tumor xenografts in athymic (nude) mice. Cancer Treat Rep 1978; 62 (4): 576–578.
28. Hill GJ, Shine TE, Hill HZ et al. Failure of amygdalin to arrest B16 melanoma and BW5147 AKR leukemia. Cancer Res 1976; 36 (6): 2102–2107.
29. Stock CC, Tarnowski GS, Schmid FA et al. Antitumor tests of amygdalin in transplantable animal tumor systems. J Surg Oncol 1978; 10 (2): 81–88. doi: 10.1002/ jso.2930100202.
30. Manner HW, DiSanti SJ, Maggio MI et al. Amygdalin, vitamin A and enzyme induced regression of murine mammary adenocarcinomas. J Manipulative Physiol Ther 1978; 1 (4): 246–248.
31. Morrone JA. Chemotherapy of inoperable cancer: preliminary report of 10 cases treated with laetrile. Exp Med Surg 1962; 20 : 299–308.
32. Navarro MD. Five years experience with laetrile therapy in advanced cancer. Acta Unio Int Contra Cancum 1959; 15 (Suppl 1): 209–221.
33. Navarro MD. Laetrile therapy in cancer. Acta Unio Int Contra Cancrum 1964; 20 : 392–394.
34. Weber P. Influence of amygdalin treatment on clinical progress and tumor relevant serum enzymes in 29 cancer patients. In: Doctoral thesis. Medical Faculty of the Georg August-University Göttingen. Germany 1975.
35. Rossi B, Guidetti E, Deckers C. A clinical trial of chemotherapeutic treatment of advanced cancers with L-mandelonitrile -diglucoside (abstract). In: 9th International Cancer Congress. Japan: Tokyo 1996.
36. Moertel CG, Ames MM, Kovach JS et al. A pharmacologic and toxicological study of amygdalin. JAMA 1981; 245 (6): 591–594.
37. Moertel CG, Fleming TR, Rubin J et al. A clinical trial of amygdalin (Laetrile) in the treatment of human cancer. N Engl J Med 1982; 306 (4): 201–206. doi: 10.1056/NEJM198201283060403.
38. PDQ Integrative, Alternative, and Complementary Therapies Editorial Board. Laetrile/Amygdalin (PDQ®): Patient Version. [online]. Available from http: //www.ncbi.nlm.nih.gov/books/NBK65722/.
39. Bromley J, Hughes BG, Leong DC et al. Life-threatening interaction between complementary medicines: cyanide toxicity following ingestion of amygdalin and vitamin C. Ann Pharmacother 2005; 39 (9): 1566–1569. doi: 10.1345/aph.1E634.
40. Todorova A, Pesheva M, Iliev I et al. Antimutagenic, antirecombinogenic, and antitumor effect of amygdalin in a yeast cell-based test and mammalian cell lines. J Med Food 2017; 20 (4): 360–366. doi: 10.1089/jmf.2016.0 108.
41. Wisniak J, Robiquet PJ. Emergent topics on chemistry education. Educ Quimica 2013; 24 (1): 139–149.
42. Dorr RT, Paxinos J. The current status of laetrile. Ann Intern Med 1978; 89 (3): 389–397. doi: 10.7326/0003-4819-89-3-389.
43. Moss RW. The laetrile controversy. In: Moss RW (ed). The Cancer Industry: The Classic Expose on the Cancer Establishment. New York: First Equinox Press 1996 : 131–152.
44. Curt GA. Unsound methods of cancer treatment. Princ Pract Oncol Updates 1990; 4 (12): 1–10.
45. Moss RW. Patient perspectives: Tijuana cancer clinics in the post-NAFTA era. Integr Cancer Ther 2005; 4 (1): 65–86. doi: 10.1177/1534735404273918.
46. Davignon JP, Trissel LA, Kleinman LM. Pharmaceutical assessment of amygdalin (Laetrile) products. Cancer Treat Rep 1978; 62 (1): 99–104.
47. Curran WJ. Law-medicine notes. Laetrile for the terminally ill: Supreme Court stops the nonsense. N Engl J Med 1980; 302 (11): 619–621. doi: 10.1056/NEJM198 003133021108.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Peritoneální nádoryČlánek Pseudomyxom peritoneaČlánek LymfangioleiomyomatózaČlánek Aktuality z odborného tiskuČlánek Onkologie v obrazech
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo 5- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Peritoneální nádory
- Maligní nádory peritonea – úvod do problematiky
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Léčba a profylaxe peritoneálních metastáz kolorektálního karcinomu
- Možnosti léčby peritoneální karcinomatózy u karcinomu žaludku
- Peritoneální karcinomatóza ovariálních nádorů – současný pohled na efekt cytoredukční chirurgie a intraperitoneální hypertermické chemoterapie
- Alopecie a poškození vlasů indukované onkologickou terapií
- Má amygdalin své místo v integrativní protinádorové léčbě?
- Lymfangioleiomyomatóza
- Asociace polymorfizmů MTHFR 677C>T, 1298A>C a MTR 2756A>G s rizikem rozvoje retinoblastomu
- Lymfo/plazmocytární infiltrace chemoterapií neovlivněných triple negativních karcinomů prsu – koreláty s morfologickými a klinicko-patologickými parametry
- Použití regorafenibu a SBRT při léčbě plicních metastáz kolorektálního karcinomu
- 68Ga-DOTA-TOC PET/CT vyšetření u pacienta s gastroenteropankreatickým neuroendokrinním nádorem – první vyšetření v České republice
- Aktuality z odborného tisku
- Onkologie v obrazech
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Alopecie a poškození vlasů indukované onkologickou terapií
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Maligní nádory peritonea – úvod do problematiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



