-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPrognostické faktory konvenčního osteosarkomu dospělých pacientů
Analysis of Prognostic Factors in Osteosarcoma Adult Patients, a Single Institution Experience
Background:
The objective of this report was to estimate long-term outcome and prognostic factors in adult patients with high-grade osteosarcoma. The intended therapeutic strategy included preoperative and/or postoperative chemotherapy as well as surgery of all operable lesions.Patients and Metods:
We reviewed the clinical data of 36 newly diagnosed adult patients (aged 19–82, average 37.5, median 28.5 years) with high-grade osteosarcoma of the trunk or limbs evaluted by a multidisciplinary team and treated between 1999 and 2010 in Brno. Forty-five percent of patients were over thirty, more than 36% over forty. Thirty-one percent of patients had metastasis at the time of diagnosis. Demographic parameters, tumor-related and treatment-related variables included possible prognostic factors and their impact on response, overall survival (OS) and event-free survival (EFS) were analyzed.Results:
All the patients were followed up after treatment. Seventy-three percent of patients were poor responders to chemotherapy. Sixteen patients are alive, and twenty patients died. The survival time ranged from 2 to 177 months (average 45 months, median survival 23 months). The 5-year OS of all patients was 52.4%. OS of patients without metastasis was 68.12%, while 2-year OS with metastasis was 26% only. 5-year EFS was 38.7%. Univariate analysis revealed that the prognosis of adult osteosarcoma patients was significantly related to distant metastasis (p = 0.006), surgical stage (p = 0.00582), serum alkaline phosphatase (ALP) level (p = 0.00841) and serum lactatdehydrogenase (LD) level (p = 0.047). The other analyzed prognostic factors including age had no statistically significant influence on outcome of osteosarcoma in adult patients.Conclusion:
The prognosis of osteosarcoma in adult patients was significantly correlated to surgical stage, distant metastasis, serum ALP and LD.Key words:
osteosarcoma – adult – prognostic factors – therapySubmitted:
20. 6. 2012Accepted:
7. 8. 2012
Autoři: D. Adámková Krákorová 1,2; K. Veselý 2,3; I. Zambo 2,3; Š. Tuček 1,2; J. Tomášek 1,2
; A. Jurečková 1,2; P. Janíček 2,4; J. Černý 2,4; L. Pazourek 2,4; Š. Ondrůšek 2,4; I. Selingerová 5
Působiště autorů: Klinika komplexní onkologické péče, MOÚ Brno 1; Lékařská fakulta, MU Brno 2; I. patologicko-anatomický ústav, FN u sv. Anny v Brně 3; I. ortopedická klinika, FN u sv. Anny v Brně 4; Ústav matematiky a statistiky, PřF MU Brno 5
Vyšlo v časopise: Klin Onkol 2012; 25(5): 346-358
Kategorie: Původní práce
Souhrn
Východiska:
Cílem analýzy bylo zhodnocení dlouhodobého přežití ve vztahu k prognostickým faktorům u dospělých pacientů léčených pro konvenční osteosarkom. Současná léčebná strategie spočívá v podání předoperační a/nebo pooperační chemoterapie a chirurgické resekci všech operabilních lézí.Soubor pacientů a metody:
Byla vyhodnocena klinická data 36 pacientů dospělého věku (rozmezí 19–82 let, průměr 37,5 roku, medián 28,5 roku), kteří byli nově diagnostikováni cestou mezioborového týmu a léčeni pro konvenční osteosarkom končetin či trupu v letech 1999–2010 v Brně. 45 % pacientů bylo starších 30 let, 36 % starších 40 let. 31 % pacientů mělo vzdálené metastázy v době stanovení diagnózy. Analýza se týkala demografických dat, lokalizace, velikosti, rozsahu onemocnění, byl hodnocen histopatologický efekt chemoterapie, rozsah chirurgického řešení, hladina alkalické fosfatázy (ALP) a laktátdehydrogenázy (LD) v séru, index proliferační aktivity Ki 67 a další možné prognostické faktory ve vztahu k léčebné odpovědi, přežití (OS) a přežití bez známek onemocnění (EFS).Výsledky:
Po ukončení léčby byli všichni pacienti sledováni. 73 % pacientů mělo nedostatečnou odpověď na předoperační chemoterapii. Dosud žije 16 pacientů, 20 pacientů zemřelo. Přežití kolísá mezi hodnotami 2–177 měsíců (průměr 45 měsíců, medián 23 měsíců). 5leté přežití celého souboru činí 52,4 %. Přežití pacientů s lokalizovanou formou dosahuje 68,12 %, 2 let se dožívá pouze 26 % pacientů s primárně metastatickým onemocněním. 5leté přežití bez známek nemoci činí 38,7 %. Univariační analýza prokázala statisticky signifikantní vztah k celkovému přežití pouze v případě rozsahu (lokalizovaný versus metastatický, p = 0,006), operability (ano – ne, p = 0,00582), výchozí hodnoty ALP (p = 0,00841) a LD (p = 0,047). Ostatní sledované faktory včetně věku neměly v souboru dospělých pacientů statistickou významnost.Závěr:
Prognóza dospělých pacientů léčených pro high-grade osteosarkom signifikantně koreluje s rozsahem postižení, operabilitou, iniciální sérovou hodnotou ALP a LD v séru.Klíčová slova:
konvenční osteosarkom – dospělí – prognostické faktory – výsledky léčbyÚvod
Osteosarkom je nejčastější primární maligní kostní nádor. Představuje pouhé 0,2 % ze všech zhoubných nádorů. Incidence se pohybuje kolem 3 případů na 1 milion obyvatel za rok [1–3].
Obecně se osteosarkomy dělí na nízce a vysoce maligní. U nízce maligních je metodou volby radikální chirurgický výkon bez nutnosti adjuvantní onkologické léčby. Prognóza je příznivá s 5letým přežitím kolem 90 % [1–5].
Vysoce maligní, konvenční, high--grade osteosarkomy jsou velmi agresivním systémovým onemocněním. Charakteristická je bimodální věková distribuce, první vrchol křivky nastává ve druhé dekádě života, druhý, nižší, po 60. roce života [1,6–9].
Nad 30, resp. 40 let věku je z celkového počtu zaznamenáno méně než 30 % případů [1,7]. S touto věkově specifickou subpopulací je z hlediska léčby mnohem méně zkušeností. V klinické praxi jde tedy o dětský typ nádoru u dospělých pacientů.
Predilekčním místem je postižení metafýz dlouhých kostí, s vyšším věkem narůstá procento lokalizací v oblasti axiálního skeletu včetně pánve [1,6,7,8]. Jde o nádor s časnou hematogenní diseminací. Pětina pacientů má vzdálené metastázy v době stanovení diagnózy, nejčastěji v plicích, vzácněji v kostech či jiných lokalizacích [1,6,7].
Před érou systémové chemoterapie byla prognóza nepříznivá. Dlouhodobě přežívalo do 10 % pacientů s lokalizovaným onemocněním, bezvýhradně šlo o chirurgické výkony amputační [1,3–5].
Zařazení systémové chemoterapie (CHT) počátkem 70. let minulého století výrazně zlepšilo léčebné výsledky [1,3,6,7,11]. Na rozdíl od jiných malignit je spektrum používaných cytostatik v léčbě osteosarkomu relativně omezené. Cisplatina, adriamycin a metotrexát ve vysokých dávkách tvoří základ standardní léčby osteosarkomu [6,12]. Navýšení dávkové denzity či zařazení nových látek se zatím neprojevily zásadním zlepšením léčebných výsledků [8].
V současné době je standardním léčebným postupem aplikace předoperační/neoadjuvantní/indukční CHT (NCHT) s následným chirurgickým výkonem [12]. Dobrý efekt systémové chemoterapie je základem pro možnost provedení končetinu šetřícího výkonu, navíc histopatologický efekt léčby stanovený procentem nekrotické tkáně umožňuje predikovat léčebné výsledky [7,10]. Existuje korelace mezi stupněm nekrózy a celkovým přežitím [7], i když výsledky studií modifikující adjuvantní chemoterapii dle předchozího efektu NCHT další zlepšení přežití neprokázaly [13,14]. Pouze v případě, kdy není radikální chirurgické řešení možné, například při blízkosti rizikových struktur (páteřní kanál, aorta, jiné), následuje po neoadjuvantní chemoterapii léčba zářením, jejímž cílem je zajištění lokální kontroly nádoru. Radioterapie je indikována také v případě pozitivních resekčních okrajů, není-li možná reresekce [15].
Po chirurgickém výkonu, případně záření, pokračuje léčba cytostatiky.
Pacienti především vyššího věku v některých případech profitují z primárně provedeného chirurgického výkonu, po kterém následuje adjuvantní chemoterapie většinou dvojkombinací cytostatik. Důvodem jsou především komorbidity a také fakt, že případná toxicita léčby by mohla oddálit chirurgický výkon [16]. Publikované studie dosud neprokázaly zásadní rozdíl v přežití u pacientů operovaných primárně s následnou adjuvantní chemoterapií proti pacientům, kteří před - a pooperační systémovou léčbu absolvovali [17].
V současné době udávají velká onkologická centra ve světě 5leté přežití lokalizované nemoci u dětí a adolescentů nad 70 % [18–20], méně než 20 % pacientů s metastatickým onemocněním přežívá 5 let [7,20]. Vzhledem k obecně výrazně horším léčebným výsledkům u dospělých pacientů (5leté přežití kolem 50 %) [7,21,22] panuje snaha o optimalizaci léčebných protokolů, kdy většina dospělých pacientů je vyjma lokální léčby chirurgií léčena systémovou chemoterapií dle agresivních pediatrických protokolů, s nutností větší či menší úpravy pro toxicitu a komorbidity [12].
Nezbytností je léčba v rámci multidisciplinárního týmu a na pracovišti, které má s léčbou této vzácné malignity zkušenosti [4].
Zhodnotili jsme výsledky léčby konvenčního osteosarkomu dospělých pacientů se zaměřením na identifikaci prognostických faktorů v klinické praxi.
Soubor pacientů a metody
Do retrospektivního hodnocení bylo zařazeno 36 dospělých pacientů s konvenčním osteosarkomem, kteří byli diagnostikováni a léčeni na základě rozhodnutí brněnského multidisciplinárního týmu v letech 1999–2010 s následným sledováním (tab. 1).
Tab. 1. Charakteristika souboru. 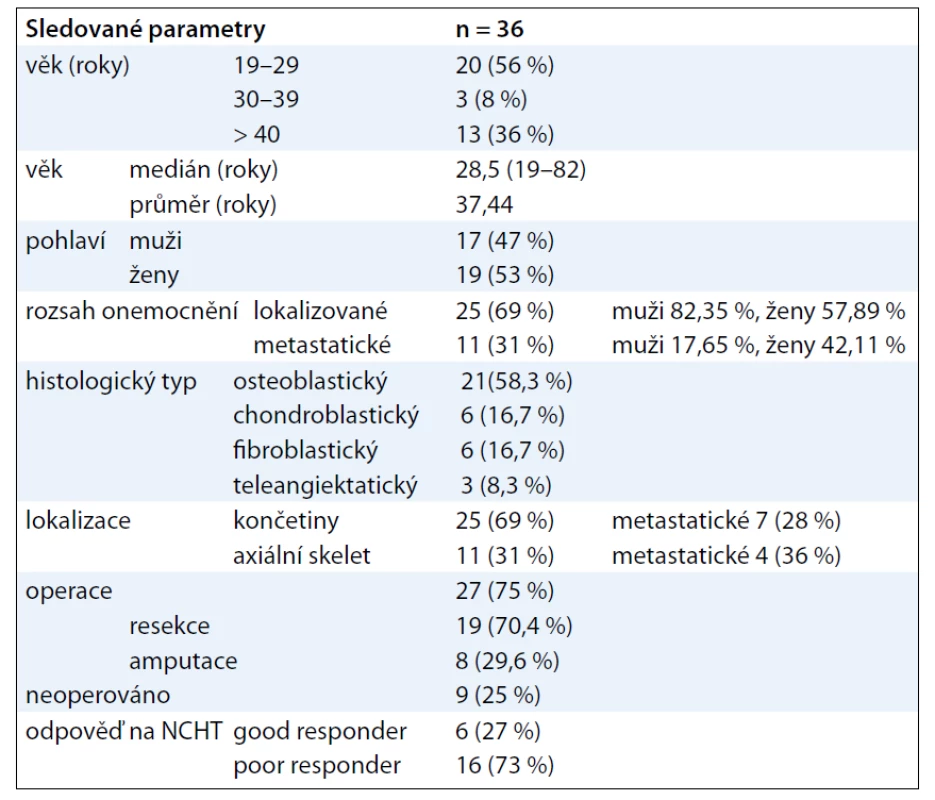
Soubor tvořilo 17 mužů a 19 žen s mediánem věku 28,5 roku (průměrný věk 37,44 roku, rozmezí 19–82 let). 45 % pacientů bylo starších 30 let, 36 % bylo starších 40 let (graf 1). Performance status 0, maximálně 2 u pacientů s pánevní lokalizací nádoru.
Graf 1. Věkové rozložení souboru (v letech). 
Všichni pacienti měli první obtíže více než 3 měsíce před stanovením diagnózy. Dominovala bolest (97 %), otok (55 %), hmatná rezistence (53 %), patologická zlomenina (11 %).
U 25 pacientů (69 %, 14 mužů, 11 žen) šlo o onemocnění lokalizované, 11 pacientů (31 %, 3 muži, 8 žen) mělo zjištěno metastatické postižení v době stanovení diagnózy (1 pacient multifokální kostní, 1 pacientka současně kostní, plicní a jaterní, 1 pacient kostní a plicní, 8 pacientů plicní). Pouze jeden pacient měl nález skip metastázy, tedy ložiska odděleného od primárního nádoru zdravou tkání. Byl zařazen do skupiny pacientů s lokalizovaným onemocněním.
V celém souboru měli muži lokalizované onemocnění v 82,35 %, metastatické onemocnění v 17,65 % proti ženám, u kterých bylo onemocnění lokalizované v 57,89 % a primárně metastatické v 42,11 %.
U 25 pacientů (69 %) byla postižena končetina (femur 14×, tibie 6×, humerus 3×, talus 2×), z toho v 7 případech (28 %) s primárně metastatickým nálezem. 11 pacientů (31 %) mělo postižení axiálního skeletu (pánev 8×, žebro, klíček, lopatka), ve 4 případech (36 %) se systémovým nálezem. V jednom případě šlo u 26leté pacientky o další malignitu po oboustranném retinoblastomu, bez nálezu mutace Rb genu.
Do roku 2005 byli pacienti léčeni systémovou chemoterapií dle protokolu ISG/OS-1 [19] Rizzoli Institutu v Bologni [předoperační metotrexát (M), doxorubicin (A), cisplatina (P), pooperačně s přidáním ifosfamidu (I) při nízké odpovědi na předoperační chemoterapii – 7 pacientů], od roku 2006 pacienti byli a jsou léčeni dle protokolu EURAMOS (20 pacientů, předoperační MAP, pooperační MAP/MAPIE s přidáním ifosfamid//etoposid při nedostatečné odpovědi). Pacienti starší 50 let byli léčeni dvojkombinací doxorubicin/cisplatina, podání 3 + 3 nebo 6 sérií adjuvantně (8 pacientů).
Nejstarší 82letá pacientka ve velmi dobrém celkovém stavu byla léčena 4 cykly adjuvantní chemoterapií doxorubicinem v monoterapii, žije dosud v kompletní remisi, více než 3 roky od stanovení diagnózy. Všichni pacienti byli před započetím léčby náležitě poučeni a podepsali informovaný souhlas s navrhovaným léčebným postupem.
Celkem bylo operováno 27 pacientů (75 %), všichni na jednom pracovišti. Primární operační výkon byl indikován u 5 pacientů, po předoperační chemoterapii bylo operováno 22 pacientů. Operováno nebylo 9 pacientů (25 %), z nichž jeden pacient navrhovanou operaci odmítl. Celkem 8 z 9 neoperovaných pacientů bylo léčeno lokální radioterapií (10–13 × 3 Gy), stejně jako jeden pacient s R1 resekcí pooperačně. Jeden pacient léčbu zářením odmítl.
Histologické subtypy byly následující: 21× osteoblastická varianta (58,3 %), 6× fibroblastická varianta (16,7 %), 6× chondroblastická varianta (16,7 %), 3× teleangiektatický osteosarkom (8,3 %).
U 22 operovaných pacientů po neoadjuvantní chemoterapii byla hodnocena histopatologická odpověď dle běžně užívané stupnice Salzer-Kuntschik, resp. pacient s nálezem 90 % nekróz a více byl hodnocen jako „good responder“, pod 90 % jako „poor responder“.
Retrospektivně byla zhodnocena toxicita léčby, byly sledovány další parametry s možným prognostickým dopadem – hodnota laktátdehydrogenázy (LD) a alkalické fosfatázy (ALP) v době stanovení diagnózy, imunohistochemicky detekovaný p53 protein, p-glykoprotein, index proliferační aktivity Ki 67, overexprese HER2 genu imunohistochemicky i metodou FISH, u části pacientů (22) byly imunohistochemicky detekovány nestin a CD133+ buňky.
Primárním cílem studie bylo zhodnotit vliv klinických faktorů (pohlaví, věk, rozsah, lokalizace, operabilita, histologický typ, procento nekróz) a dalších potenciálních prognostických faktorů (ALP, LD, p53, p-glykoprotein, Ki 67, HER 2, nestin a CD133+) na základní parametry přežití, čas bez progrese nemoci (PFS), celkové přežití (OS) a čas přežití do zjištění progrese/relapsu nemoci (EFS).
Parametr PFS je definován jako doba od započetí léčby do recidivy/progrese nádoru.
Parametr OS je definován jako doba od započetí léčby do úmrtí pacienta. Parametr EFS je doba od dosažení kompletní remise do selhání léčby, kterým byl relaps, progrese na léčbě, úmrtí v remisi.
Sekundárním cílem bylo zhodnocení toxicity léčby, neboť jde o léčbu určenou především pro děti, adolescenty a velmi mladé dospělé. Toxicita léčby byla hodnocena dle klasifikace National Cancer Institute Common Toxicity Criteria (NCI-CTC), verze 3.0.
Pro základní charakteristiku dat byly použity běžné statistické funkce (procentuální vyjádření, medián). Pro analýzu přežívání pak Kaplan-Meierův odhad funkce přežití, pro porovnání přežití jednotlivých skupin log-rank test a Gehanův-Wilcoxonův test.
Za statisticky signifikantní byly považovány hodnoty p < 0,05. Byl použit program Statistica, verze 10, za pomocí programových produktů společnosti Microsoft (Microsoft Word, Microsoft Excel).
Výsledky
Chemoterapie
Léčba předoperační chemoterapií byla zahájena u 31 pacientů s mediánem intervalu 15 dnů (12–29 dnů) od provedení histologické verifikace. U 5 primárně operovaných pacientů byla adjuvantní chemoterapie započata s mediánem intervalu 25 dnů (15–40 dnů). Plánovaný léčebný protokol dokončilo 28 pacientů (77 %). Byla zaznamenána dvě úmrtí v souvislosti s léčbou. Jeden pacient zemřel na masivní plicní embolii 18. den po aplikaci 1. série předoperační chemoterapie, jedna pacientka zemřela v místě bydliště na febrilní neutropenii komplikovanou následným metabolickým rozvratem. Pacientka byla v kompletní remisi, po aplikaci 2. série pooperační chemoterapie se zajištěním růstovými faktory. U 6 pacientů byla zjištěna progrese v průběhu pooperační chemoterapie.
Tolerance léčby byla vzhledem k její agresivitě uspokojivá, toxicita předvídatelná. Co se týče hematologické toxicity – 31 pacientů (86 %) mělo minimálně 1× febrilní neutropenii, anémie gr. III–IV nebyla zaznamenána, trombocytopenie gr. IV se vyskytla u jedné pacientky. Nehematologická toxicita gr. III–IV nebyla zaznamenána vyjma výše zmíněné fatálně probíhající masivní plicní embolie jednoho pacienta. Nicméně i tak došlo u 14 pacientů (39 %) k redukci chemoterapie pro nežádoucí účinky léčby (NUL), a to více než 1×, z toho polovinu tvořili pacienti nad 40 let věku.
Lokální kontrola nádoru
Primární operační výkon byl indikován ve 4 případech končetinového nálezu (R0 resekce 1×, amputace 3×) a v jednom případě pánevního postižení (R0 resekce). Po předoperační chemoterapii bylo operováno 22 pacientů: R0 resekce 16× (obr. 1–5), R1 resekce 1×, amputace 5×. Z 27 operovaných pacientů byl tedy indikován amputační výkon u 8 z nich – 29,6 %. Ze 36 pacientů nebylo operováno 9 pacientů (25 %), šlo o 3 pacienty s nálezem v oblasti končetin (multifokální, chirurgicky neřešitelné systémové onemocnění 2×, jeden pacient zemřel na akutní plicní embolii) a 5 pacientů s inoperabilním a/nebo mnohočetným systémovým postižením, 1 pacient operaci odmítl. Celkem 8 z 9 neoperovaných pacientů bylo léčeno lokální radioterapií (RT, 10–13 × 3 G), stejně jako jeden pacient s R1 resekcí a následnou reresekcí. Jeden pacient léčbu zářením odmítl.
Obr. 1. RTG – rozsáhlý osteosarkom distálního femuru, osteoblastická varianta. 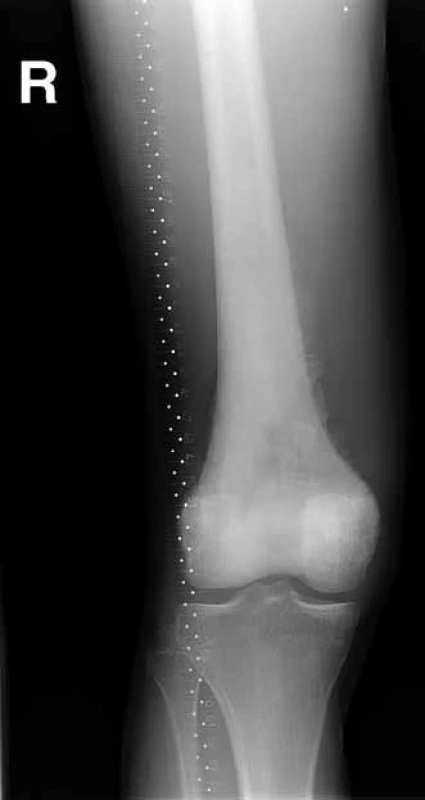
Obr. 2. Peroperační preparát – osteosarkom distálního femuru, osteoblastická varianta. 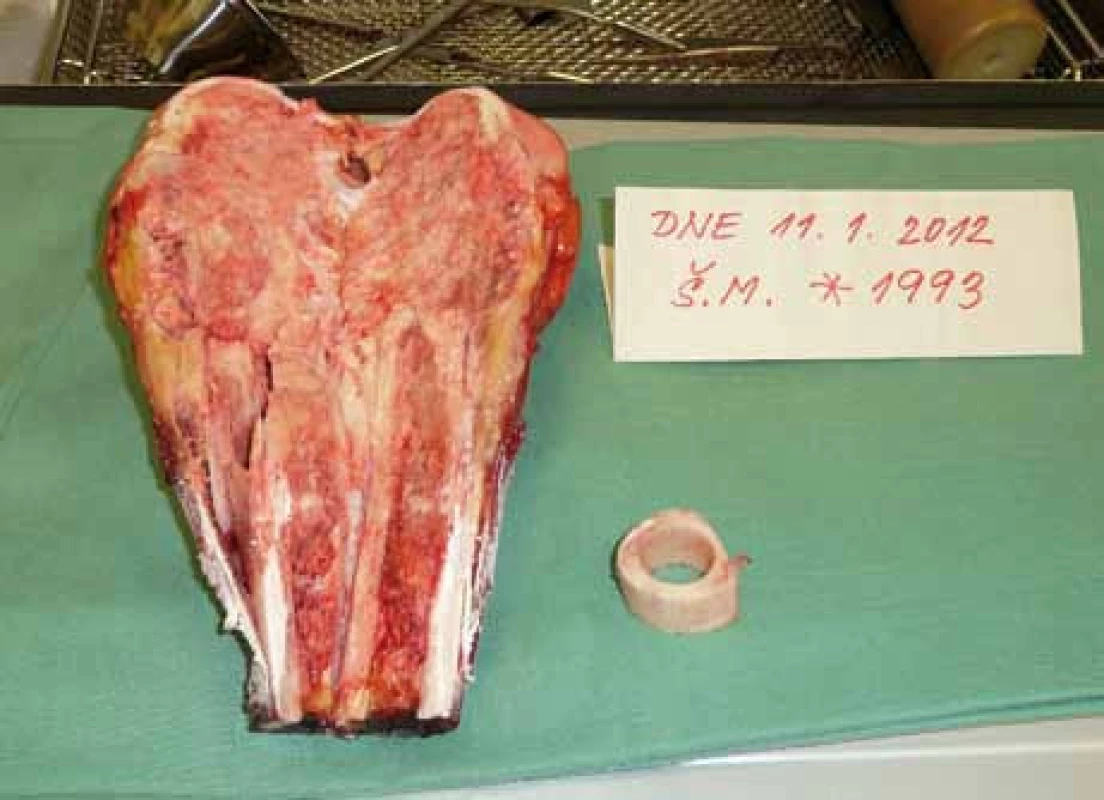
Obr. 3. Peroperační foto – femorální část kompozitní endoprotézy (homoštěp distálního femuru + femorální komponenta) na instrumentačním stolku. 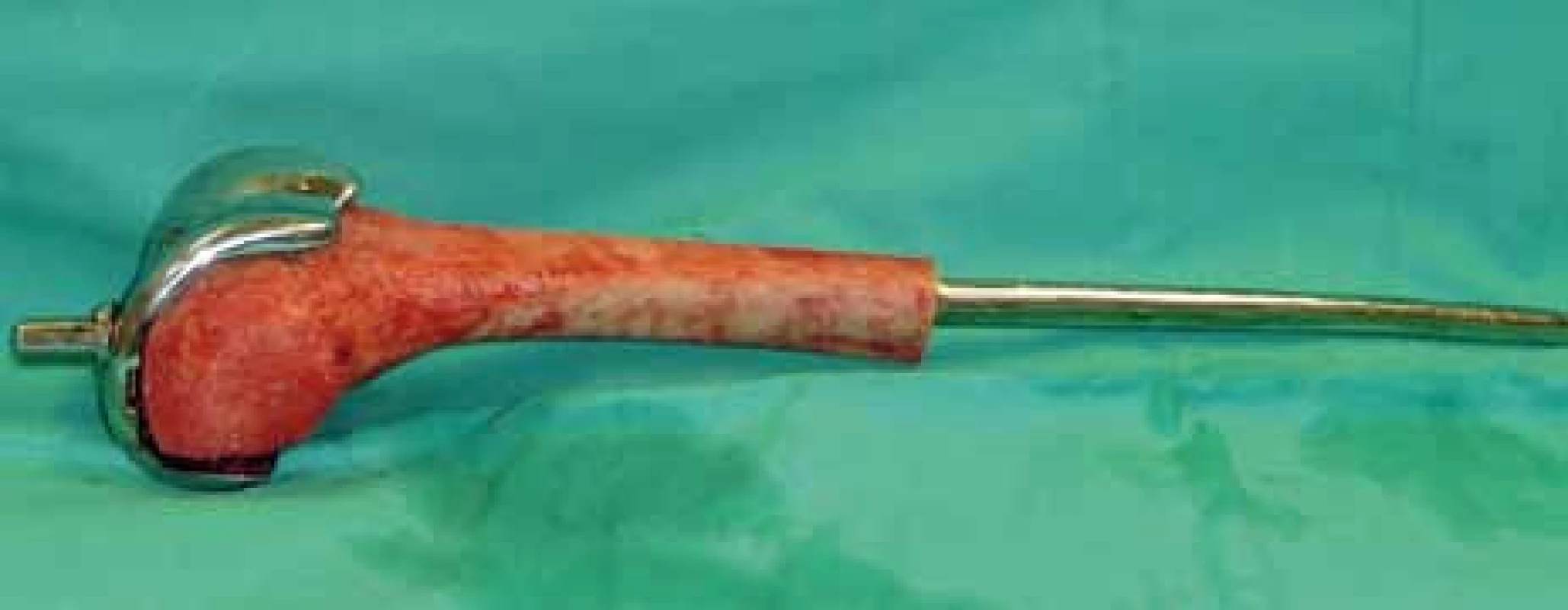
Obr. 4. Peroperační foto – implantovaná kompozitní endoprotéza in situ. 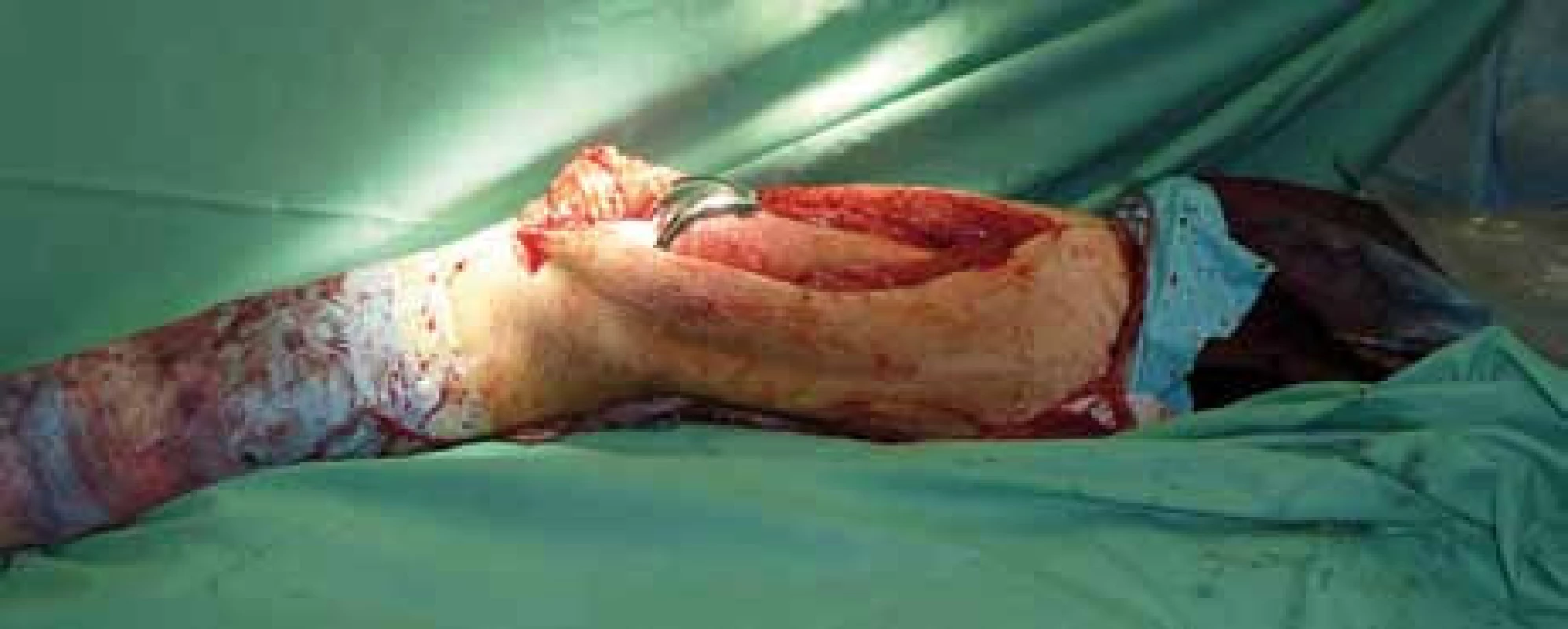
Obr. 5. Pooperační RTG – stav po resekci distálního femuru a náhradě kompozitivní endoprotézou, poor responder (50 %). 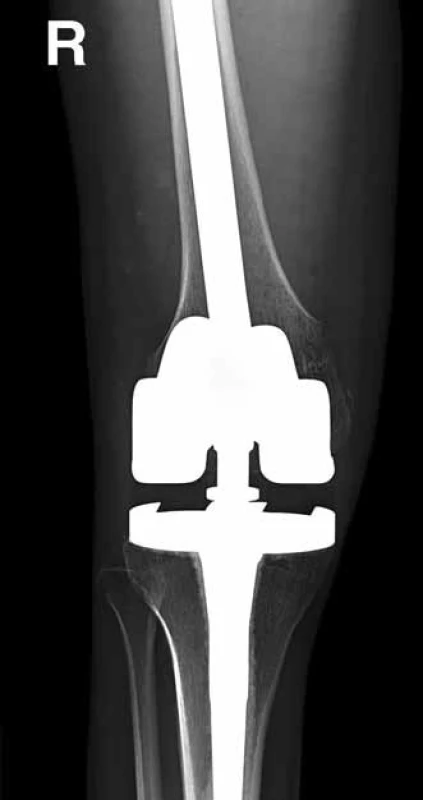
Chirurgická léčba jako lokální kontrola primárních plicních metastáz byla možná a provedena pouze u 2 pacientů, 5 pacientů podstoupilo plicní resekci následně při systémové progresi onemocnění.
Histologická odpověď na předoperační chemoterapii
Odpověď bylo možno hodnotit pouze u 22 pacientů (61 %) operovaných po podání předoperační chemoterapie. 6 pacientů (27 %) bylo hodnoceno jako „good responders“ s rozmezím nekróz 95–100 %, 16 pacientů (73 %) odpovědělo na chemoterapii nedostatečně, s rozmezím nekróz 5–85 % (graf 2).
Graf 2. Histologická odpověď na předoperační chemoterapii. 
Elevace ALP minimálně nad 1,5násobek horní hranice normy byla iniciálně zjištěna u 13 pacientů (36 %), z toho u 5 pacientů s primárně metastatickým postižením. Elevace LD minimálně nad 1,5násobek normy byla iniciálně zjištěna u 7 pacientů (19 %), z toho u 4 pacientů s primárně metastatickou chorobou. Index proliferační aktivity Ki 67 se pohyboval v rozmezí 0–70 %, nad 30 % mělo 19 pacientů (53 %), nad 50 % 9 pacientů (25 %). Imunohistochemicky detekovaná exprese p-glykoproteinu (možný marker chemorezistence) byla nulová u 22 pacientů (62 %), elevovaná u 14 pacientů (38 %). Imunohistochemicky detekovaná exprese p53 proteinu byla nenulová u 14 pacientů (38 %). Pouze u jednoho pacienta byla nalezena pozitivita HER2neu genu stanovená imunohistochemicky (IHC3+), po došetření metodou FISH byly všechny nálezy negativní. Zhodnocení CD133 a nestin pozitivních buněk (možné markery identifikace nádorových kmenových buněk) bylo provedeno z důvodu nedostatku materiálu pouze u 25 pacientů. 16 pacientů mělo hodnotu CD133 pod 1 %, 9 pacientů výše než 2 % imunohistochemickým stanovením. Imunohistochemicky mělo více než 2 % nestin+ buněk celkem 16 pacientů a nad 11 % buněk 9 pacientů.
V celém souboru 36 dospělých pacientů bylo zaznamenáno 5leté přežití 52,4 % (medián 52,4 měsíce). V případě primárně lokalizovaného onemocnění (69 % pacientů) dosáhlo 5letého přežití 68,12 % (medián 74,7 měsíce). V případě primárně metastatické nemoci (31 % pacientů) bylo zaznamenáno 2leté přežití 26 % (medián 13,6 měsíce), 3leté pak 15 % (graf 3). V závislosti na věku přežívá v celém souboru 5 let 51,7 % pacientů ve věku 19–29 let, 57 % pacientů ve věku 19–39 let a pouze 43 % pacientů starších 40 let (13 pacientů, dvě úmrtí na NUL). Průměrné celkové přežití celého souboru bylo 44,7 měsíce (medián 23 měsíců). 5letý PFS činil 25,5 % (medián 18,9 měsíce), 5letý EFS činil 38,7 % (medián 45,6 měsíce). Průměrná doba sledování činila 44,7 měsíce (2–177 měsíců, medián 23 měsíců).
Graf 3. Kaplan-Meierova analýza – celkové přežití (OS). 
Jako statisticky signifikantní pro léčebné výsledky byly v našem souboru zjištěny následující parametry:
- rozsah onemocnění; pacienti s lokalizovanou formou nemoci měli signifikantně delší přežití proti pacientům s primárně metastatickým postižením, HR = 5,49, p = 0,006 (graf 4),
- operace znamenala statisticky signifikantní prodloužení přežití proti nálezu neoperovanému, HR = 6,05, p = 0,00572 (graf 5),
- iniciální elevace hodnoty ALP znamenala signifikantně horší přežití proti normě, HR = 3,31, p = 0,00841 (graf 6),
- iniciální elevace hodnoty LD znamenala signifikantně horší přežití proti normě, HR = 4,09, p = 0,0478 (graf 7).
Graf 4. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na rozsahu onemocnění (p = 0,006). 
Graf 5. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na operabilitě (p = 0,00572). 
Graf 6. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na hodnotě ALP (p = 0,00841). 
Graf 7. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na hodnotě LD (p = 0,047). 
Ostatní sledované parametry nedosáhly statistické významnosti.
U věkové skupiny nad 30, resp. 40 let, je naznačen trend k horšímu přežití, bez statistické významnosti (p = 0,586, graf 8).
Graf 8. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na věku (p = 0,58686) na hodnotě LD (p=0.047). 
Muži dosáhli v našem souboru léčebných výsledků lepších, bez statistické významnosti (p = 0,28).
Subtyp osteoblastický a teleangiektatický je spojen s lepším přežitím nežli subtyp fibro/chondroblastický, bez statistické významnosti (p = 0,254).
Pacienti s imunohistochemicky zjištěnou nenulovou hodnotou exprese p53 proteinu měli horší přežití než pacienti s nulovou hodnotou, bez statistické významnosti (p = 0,28).
Index proliferační aktivity Ki 67 nad 50 % znamenal horší přežití, bez statistické významnosti (p = 0,14).
Imunohistochemicky detekovaná přítomnost CD133+ buněk nad 2 % byla spojena v tomto malém souboru s lepším přežitím, bez statistické významnosti (p = 0,14).
Statisticky významná závislost mezi histopatologickou odpovědí na chemoterapii a celkovým přežitím nebyla v našem souboru nalezena, u dobré odpovědí jen náznak trendu k lepšímu přežití, bez statistické významnosti (p = 0,945).
Redukce chemoterapie více než 1× pro NUL naznačuje horší přežití, bez statistické významnosti (p = 0,75061, graf 9).
Graf 9. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na redukci chemoterapie (více než 1krát) (p = 0,75061). 
Zcela bez vlivu na výsledky léčby byla hodnota HER2neu a p-glykoproteinu.
Na základě provedeného parametrického odhadu lze konstatovat, že v našem souboru
- pacient s metastatickým onemocněním má 5,49× vyšší riziko úmrtí než pacient s lokalizovanou formou,
- neoperovaný pacient má 6,05× vyšší riziko úmrtí než pacient operovaný (operabilní pacient se dožívá 5 let v 67,64 %, neoperovaný má medián přežití 12,9 měsíce),
- pacient se zvýšenou výchozí hladinou ALP má 3,91× vyšší riziko úmrtí než pacient s normální hodnotou (normální hodnota 5letého přežití 70,39 %, zvýšená hodnota 20,83 %),
- pacient se zvýšenou výchozí hodnotou LD má 4,09× vyšší riziko úmrtí než pacient s LD v normě (normální hodnota: 5leté přežití 61,53 %, medián 72 měsíců, zvýšená hodnota: medián 12 měsíců).
Progrese nemoci
K progresi/relapsu choroby došlo u 24 pacientů (66,6 %), z toho 6 pacientů progredovalo časně, v průběhu pooperační chemoterapie (2–7 měsíců, plíce). Lokální recidiva se vyskytla u 5 pacientů (PFS 12–57 měsíců), kombinace lokální recidivy/progrese se systémovým relapsem plicním byla zjištěna u 3 pacientů (PFS 7–11 měsíců). Relaps pouze plicní byl zjištěn u 8 pacientů (PFS 12–58 měsíců), progrese plicní u 6 pacientů (PFS 3–11 měsíců). V jednom případě šlo o postižení lymfatických uzlin, jeden pacient měl lokální recidivu s progresí multifokálního kostního postižení.
Systémová léčba 2. linie byla indikována u 16 pacientů. Prioritou bylo chirurgické odstranění relapsu. V 5 případech byla možná plicní metastasektomie, poté podána chemoterapie 2. linie ifosfamid//etoposid (I/E). Ve 3 případech došlo k radikální resekci lokální recidivy. 3 případy chirurgicky neřešitelné lokální recidivy/progrese podstoupily ozařování. 10 pacientů bylo léčeno 2. linií chemoterapie samotné (I/E, I mono, etoposid mono, cyclofosfamid/topotecan), jeden pacient ve výborném celkovém stavu byl léčen 3. linií paliativní chemoterapie gemcitabinem. V ostatních případech byla indikována symptomatická léčba. Z těchto 24 pacientů žije dále 5 pacientů ve 2. kompletní remisi (20–123 měsíců), dva pacienti s progresí (18 a 12 měsíců). Dosud zemřelo 20 pacientů (55 %), z toho dva pacienti na NUL.
Diskuze
High-grade osteosarkom je typickým nádorem dětí a adolescentů, pouhá třetina pacientů je starších 30 let. S narůstajícím věkem se vyskytuje častěji metastatické postižení, častěji je postižen axiální skelet, je obecně nižší odpověď na předoperační chemoterapii, horší tolerance léčby, nižší léčebná odpověď i celkové přežití [1,7,11,16,18,21].
Prediktivním a současně prognostickým faktorem je histopatologická odpověď na předoperační chemoterapii [7,11]. Cílem řady studií byla snaha o identifikaci prognostických faktorů, které by mohly umožnit lepší stratifikaci léčby jednotlivých pacientů.
Dosud největší soubor pacientů vyhodnotili Bielack et al [7], šlo o analýzu 1 702 pacientů léčených pro osteosarkom neoadjuvantní chemoterapií do roku 1998 dle protokolů německé pracovní skupiny COSS (Cooperative Osteosarcoma Study Group). 59 % souboru tvořili muži, věkové rozmezí 2–68 let, medián věku 15 let. Jako klíčové prognostické faktory byly označeny chirurgická radikalita výkonu a histologická odpověď. Faktory, které úzce souvisely se špatnou odpovědí na chemoterapii, byly nádory lokalizované v oblasti axiálního skeletu, metastatické postižení v době diagnózy, mužské pohlaví a symptomatologie delší než 3 měsíce před stanovením diagnózy. Navíc v oblasti končetin byla proximální lokalizace končetinových osteosarkomů rovněž nepříznivým prognostickým faktorem.
V této analýze Bielacka et al bylo pouze 20 % pacientů starších 20 let, 3,2 % pacientů (celkem 54 pacientů) starších 40 let. 5leté přežití pacientů starších 40 let činilo 55 %, EFS 42 %. Tato podskupina měla signifikantně častěji axiální postižení, stejně jako delší období symptomů, signifikantně delší interval do zahájení léčby i častější sekundární osteosarkomy. V našem souboru bylo starších 40 let 31 % pacientů, jde o malá čísla, nicméně jejich 5leté přežití činilo 43 %, EFS 38 %.
V analýze Bielacka et al byla končetinová lokalizace přítomna u 93,7 % pacientů, 6,3 % pacientů mělo postiženo axiální skelet. Primární metastatické postižení bylo zjištěno pouze u 12,4 % pacientů.
V našem souboru starších pacientů jsme zjistili zvýšeně zastoupené prakticky všechny negativní prognostické faktory – ve 31 % metastatické postižení, ve 31 % postižení axiálního skeletu, všichni pacienti měli anamnézu delší než 3 měsíce před zahájením léčby. Až na 4 výjimky byla vždy postižena proximální část končetiny. Bielack et al rozdílné přežití v závislosti na pohlaví neprokázali [7]. 5leté přežití u mužů činilo 63,9 % a u žen 67,4 %. V našem souboru jsme zaznamenali lehký benefit v přežití u mužů, a to 66,96 % proti 40,1 % v 5 letech u žen, avšak bez statistické významnosti. Tento rozdíl lze vysvětlit vyšším procentem primárně metastatického onemocnění u žen (42,11 % proti 17,65 % u mužů) v souboru.
Faktorem zcela zásadním v léčbě osteosarkomu je chirurgická lokální kontrola primárního nádoru, neboť žádný z pacientů bez radikální chirurgické léčby nemá naději na dlouhodobé přežití, resp. vyléčení. Účinná předoperační chemoterapie je předpokladem provedení končetinu šetřícího výkonu za předpokladu bezpečného odstranění nádoru s adekvátními okraji. V opačném případě je doporučena amputace. Nebyl zjištěn rozdíl v přežití pacientů po ablativním versus resekčním výkonu [7]. Obecně jsou ablativní výkony zvažovány u prognosticky nepříznivých forem s nízkou odpovědí na léčbu a rozsáhlých nálezů v periferních částech končetin, kde je riziko obtížné rekonstrukce, a tím omezení funkce končetiny. V analýze Bielacka et al tvořily amputační výkony před rokem 1998 31 % všech chirurgických výkonů, v našem souboru jsme zaznamenali 29,6 % amputací, a to včetně nádorů v oblasti pánevního pletence. Díky stále se zlepšujícím operačním technikám je dnes možný konzervativní postup u 80–90 % pacientů. Publikovaná data velkých center v posledních dvou letech udávají procento amputačních výkonů u končetinových nálezů kolem 4–15 % [18,19].
Při analýze větších souborů pacientů s osteosarkomem je histologické hodnocení protinádorové odpovědi na indukční chemoterapii považováno kromě radikality chirurgického výkonu za druhý klíčový prognostický faktor, který současně predikuje léčebnou odpověď [7,18,19,21,22]. Dle evropských kritérií je nekróza nad 90 % buněk hodnocena jako dobrá léčebná odpověď, pod 90 % jako nedostatečná léčebná odpověď. Bielack et al prokázali signifikantní rozdíl v přežití, pacienti s dobrou odpovědí měli 5leté EFS 68 % proti 39 % s odpovědí nedostatečnou. Dobrou léčebnou odpověď mělo v analýze 1 702 pacientů celkem 55,6 %, nižší léčebná odpověď byla v univariační analýze spojena s mužským pohlavím, postižením axiálního skeletu, odkladem započetí léčby a delší předdiagnostickou symptomatologií.
V našem souboru bylo po indukční chemoterapii operováno 22 pacientů, z nichž pouze 27 % bylo hodnoceno jako „good responders“. Při nedostatečné léčebné odpovědi jsme pooperační léčbu měnili pouze u 3 mladších pacientů dle protokolu EURAMOS přidáním kombinace ifosfamid/etoposid. V ostatních případech jsme léčbu neměnili. Bielack et al ve svojí analýze zaznamenali vyšší procento léčebných odpovědí u dívek [7], na našich malých číslech tento trend není vidět.
Při srovnávání léčebné odpovědi je třeba brát v potaz i histologický subtyp osteosarkomu, neboť nádory s vyšším podílem chondroblastické složky jsou k chemoterapii obecně méně citlivé [10,14]. V našem souboru měla podskupina pacientů s osteoblastickým a teleangiektatickým typem osteosarkomu přežití lepší, nicméně bez statistické významnosti (p = 0,25).
Dalším z faktorů je míra redukce intenzity chemoterapie. V našem souboru byla dávka chemoterapie (CHT) pro nežádoucí účinky léčby více než 1× redukována u 39 % pacientů, z toho více než polovinu tvořili pacienti starší 40 let. Pacienti bez redukce léčby vykazovali trend k lepšímu přežití, především s narůstající dobou od diagnózy, bez statistické významnosti (p = 0,75).
Za posledních 20 let nebylo dosaženo žádného významného zlepšení výsledků léčby pacientů s primárně metastatickým onemocněním, stejně jako u pacientů s relabujícím onemocněním. Dlouhodobé přežití závisí na efektu CHT, na počtu a lokalizaci metastáz a především na možnosti radikálního chirurgického odstranění všech lézí [7,23,24]. Relativně dobře jsou na tom pacienti s limitovaným a operabilním plicním nálezem, kde se 5letý EFS ve velkých centrech udává kolem 30 % [11,23]. Bielack et al uvádějí 38 % [7].
Kager et al [24] ve skupině 202 metastatických onemocnění (medián věku 15 let, 89,6 % končetinových nálezů), kde 71 % pacientů podstoupilo chirurgickou resekci všech ložisek, udávají 5letý EFS 18 % a OS 29 %, do souboru jsou zahrnuti i pacienti se skip metastázami. V případě pouze plicního postižení 5letý OS činí 33 %, u pacientů s unilaterálním postižením OS 42 % proti bilaterálnímu nálezu OS 16 %. V případě kostního postižení přežívalo 5 let 10–13 % pacientů, 85 % pacientů zemřelo v mediánu 12 měsíců od diagnózy, pouze 4 ze 45 pacientů žili déle než 3 roky. Neoperovaní pacienti měli 5× vyšší riziko úmrtí než ti, kteří chirurgický výkon podstoupili (HR 4,9). Vzácné sekundární postižení lymfatických uzlin, jater či mozku má obdobně nepříznivou prognózu [24].
V našem souboru mělo z 11 pacientů pouze plicní postižení 8 pacientů, z nichž 2 byli hrudním chirurgem operováni. U první operované pacientky došlo k opětovnému plicnímu relapsu s PFS 9 měsíců a OS 19 měsíců, druhá pacientka je po ukončení léčby sledována, žije v remisi zatím 28 měsíců. U 6 pacientů nebyla plicní resekce indikována z důvodu miliárního plicního postižení nebo lokoregionální progrese primárního nádoru v pánvi, jeden z nich léčbu odmítl. 59letá pacientka s primárním nádorem končetiny a současným postižením jater, kostí a plic zemřela po 9 měsících, s PFS 8 měsíců. Pacient se současným mnohočetným postižením kostí a plic dosáhl OS 15 měsíců při PFS 12 měsíců, pacient s mnohočetným kostním postižením žije s progresí na další léčbě zatím 19 měsíců s PFS 9 měsíců.
Skip metastázu, tedy druhé ložisko oddělené od primární léze normální tkání, měl v našem souboru pouze jeden pacient, léze byla nalezena až peroperačně (MR, CT/scintigrafie negativní). Pacient byl reresekován, v rámci pooperační léčby byl i ozařován a žije v kompletní remisi (CR) nyní více než 108 měsíců. Byl zařazen do skupiny pacientů s lokalizovaným onemocněním, i když některá pracoviště zahrnují tyto léze mezi metastatická postižení [8,24,25]. Sajadi et al [25] prezentovali soubor 155 pacientů mladších 27 let, kde u 6,5 %, tedy 10 pacientů, byla nalezena skip metastáza. Prognóza byla extrémně nepříznivá, průměrné přežití všech 10 pacientů bylo 32,5 měsíce, resp. 27,2 měsíce (jen skip metastáza). Naopak v práci Kagera et al [24] nebyl nalezen rozdíl v přežití proti pacientům s lokalizovaným onemocněním, s 5letým EFS 47 %. Bielack et al [7] řadí tyto léze rovněž k lokalizovanému onemocnění.
Nález patologické fraktury není zásadní indikací ke změně léčebného postupu, jak bylo dříve doporučováno. Bacci et al [26] prezentovali soubor 46 pacientů s výskytem patologické zlomeniny jinak lokalizovaného osteosarkomu končetiny. Po NCHT byla provedena u 12 pacientů amputace, u 34 pacientů končetinu šetřící výkon. Nebyl nalezen rozdíl v přežití mezi oběma typy chirurgického výkonu, 5letý EFS a OS činily 59 %, resp. 65 %. Záchovný typ resekce nezvyšoval riziko lokálního relapsu. V našem souboru 26 končetinových nálezů byla zjištěna patologická zlomenina u 3 pacientů, jedna pacientka podstoupila v úvodu amputaci, dva pacienti po léčbě končetinu šetřící výkon.
I při dosažení CR dochází více než u třetiny pacientů k relapsu onemocnění [8,11,27–30].
Medián vzniku relapsu se ve velkých centrech pohybuje mezi 11 a 23 měsíci [7,8,11,27–29,31]. Interval do vzniku relapsu byl sledován mnoha autory prací, některé práce považovaly za příznivý faktor vznik relapsu v intervalu delším než 12 měsíců [13,30], resp. 24 měsíců [10,31] od diagnózy. Některé rozdíl neprokázaly [29]. Medián vzniku relapsu činil u našich pacientů 18,9 měsíce. Klíčové je dosažení druhé chirurgické remise.
Lokální recidiva (LR) je méně častá, dochází k ní u 4–10 % pacientů [7,11,27]. Signifikantní pro riziko jejího vzniku jsou nedostatečné resekční okraje a malá odpověď na NCHT [6,11,13]. V souboru 1 126 končetinových sarkomů uvádějí Bacci et al [27] pouze 5,4 % lokálních recidiv s mediánem vzniku 2,3 roku od diagnózy, nicméně následně 5 let přežívalo v této skupině jen 16,4% pacientů. Grimer et al [28] prezentovali u 96 pacientů s LR a mediánem vzniku 11 měsíců následné 5leté přežívání v 41 %. U izolované lokální recidivy je prioritou chirurgická kurabilita, resekce a RT nebo amputace v případě, že nelze zajistit dostatečné resekční okraje [27]. Pacient s lokální recidivou má vysoké riziko vzniku systémových metastáz, role následné adjuvantní chemoterapie je v případě samotné a resekabilní lokální recidivy nejasná [28,30]. V našem souboru vznikla izolovaná lokální recidiva u 3 pacientů s končetinovým nálezem (11 %, 12–16–38 měsíců od diagnózy), všichni tři žijí po resekci ve 2. CR (20, 63 a 64 měsíců). U dvou pacientek vznikla lokální recidiva v oblasti axiálního skeletu, inoperabilní v oblasti Th 3 (PFS 57 měsíců, OS 93 měsíců po RT) a operabilní v sousedství lopatky (PFS 35 měsíců, pacientka žije ve 2. CR po operaci a RT nyní 123 měsíců). Jeden pacient s končetinovým sarkomem měl synchronní výskyt lokální recidivy s miliární plicní diseminací, PFS 11 a OS 14 měsíců. Grimer et al [28] prezentují u obdobné skupiny pacientů 2leté přežití ve 14 %.
Nejčastějším projevem relapsu je vznik plicních metastáz [13,31,32]. Otázkou je velikost lézí na CT, neboť i léze pod 5 mm je třeba považovat za suspektní a je třeba současně předpokládat, že pacient s unilaterálním postižením má s velkou pravděpodobností ještě nedetekovatelné postižení bilaterální [11]. Dosud není dán jednotný konsenzus, zda při unilaterálním postižení provádět i druhostrannou exploraci [11].
Kempf-Bielack et al [31] udávají ve skupině 576 relabujících pacientů medián 1. relapsu 1,6 roku, nejlepší prognózu mají pacienti s delším PFS a solitárním nálezem. Kruciální je chirurgická resekabilita metastáz, a to i opakovaně.
V našem souboru došlo k sekundárnímu, pouze plicnímu postižení u 8 pacientů, 5 pacientů podstoupilo plicní metastasektomii, 3 oboustrannou, 2 pacienti s druhostrannou explorací, v obou případech s nálezem ložisek zjištěných manuální palpací. Z těchto 5 pacientů dosud žije jeden ve 2. CR, 66 měsíců od primární diagnózy a 2 roky od diagnózy solitárního plicního nálezu. U jedné pacientky došlo k sekundárnímu postižení lymfatických uzlin, PFS 12 měsíců, OS 15 měsíců.
Role adjuvantní chemoterapie po dosažení 2. chirurgické remise není zcela jednoznačná, standardní systémová léčba 2. linie není definována [7,8,11], navíc její přínos je diskutabilní [31]. Některé práce benefit dokládají [32,33,34], některé nepotvrzují [29,35]. Prognóza relabujícího onemocnění je v každém případě nepříznivá.
Relaps po více než 5 letech od diagnózy je vzácný, Strauss et al [36] udávají nejdelší interval do prvního relapsu 14 let a doporučují v případě pozdního relapsu provedení rozšířeného restagingu včetně vyšetření méně očekávaných lokalizací. U žádného z našich pacientů nedošlo k relapsu po více než 5 letech, nejdelší PFS činil 58 měsíců.
Spektrum používaných cytostatik v léčbě osteosarkomu je omezené [37], metaanalýza studií ukázala, že při použití trojkombinačního režimu metotrexát/adriamycin/cisplatina je dosaženo signifikantně lepšího přežití než při použití dvojkombinačního režimu adriamycin/cisplatina [37], nedošlo k signifikantnímu zlepšení přežití při přidání ifosfamidu ± etoposidu [14,18,19]. V případě relabujícího onemocnění lze použít kombinace některých z již použitých látek, kombinace ifosfamid/etoposid, případně cyklofosfamid/topotekan [38]. V klinické studii II. fáze prokázal gemcitabin vysoké procento stabilizací [39], alternativou může být potenciace s radioterapií. Nadějně se jeví výsledky klinické studie fáze II se sorafenibem, s klinickým benefitem u 42 % pacientů [40]. Svoje místo v paliativní léčbě relabujícího onemocnění mají bisfosfonáty, celková aplikace radionuklidů [41,42], budoucnost by mohl mít inhibitor RANKL denosumab [43]. Inhalace růstových faktorů při plicním postižení benefit neprokázala, přidání imunomodulační látky MTPPE (muramyl tripeptid phosphatidyl ethanolamin, mifamurtid) k adjuvantní CHT po chirurgické resekci zvýšilo ve studii III. fáze u pacientů mladších 30 let s lokalizovaným končetinovým osteosarkomem 6leté přežití na 78 % [44].
Hledání dalších možných prognostických faktorů, které by pomohly lépe stratifikovat léčbu pacientů, pokračuje [7,11]. Bacci et al hodnotili na souboru 1 421 pacientů předléčebnou hladinu sérové ALP a LD ve vztahu k přežití [45]. Pacienti s elevací hodnoty měli 5letý EFS 39,5 % proti 60 % pacientů s hodnotou v normě (p = 0,0001). Podobně na souboru 570 pacientů Bacci et el [46] prokázali korelaci mezi výchozí elevací sérové hladiny ALP ve vztahu k PFS, pacienti s normální hodnotou měli PFS 26,3 měsíce proti 22,2 měsíce u pacientů s elevací hodnoty p ≤ 0,005. V našem souboru mělo 13 ze 36 pacientů (36 %) elevaci hodnoty vyšší než 1,5násobek normy, z toho 5 pacientů s metastatickým postižením. Tito pacienti měli statisticky signifikantně kratší OS proti pacientům s hodnotou ALP v normě (p = 0,00841), ze 36 pacientů mělo 7 (19 %) elevaci hodnoty LD vyšší než 1,5násobek normy, z toho 4 pacienti s metastatickým postižením. Tito pacienti měli signifikantně kratší OS proti normě (p = 0,047).
V našem souboru jsme hodnotili stupeň proliferační aktivity buněk měřený indexem Ki 67 (indikátor buněčné proliferace), zamýšleli jsme ověřit hypotézu, zda je s vyšší růstovou aktivitou buněk možná vyšší odpověď na NCHT, a tím i lepší přežití. Hodnota indexu Ki 67 se pohybovala mezi 0 a 70 %. Hodnotu nad 30 %, tedy vysokou růstovou frakci, mělo 19 pacientů (53 %). Výše uvedenou hypotézu se nepodařilo prokázat, ani histologická odpověď na chemoterapii ani přežití se nelišily v závislosti na hodnotě Ki 67. Pouze podskupina pacientů s Ki 67 nad 50 % (9 pacientů, 25 %) měla tendenci k delšímu přežití, bez statistické významnosti (p = 0,143).
Mutace genu TP53 byly popsány v různých sarkomech a karcinomech. Mutace v genu TP53 nebo imunohistochemicky detekovatelná akumulace p53 proteinu byly asociovány s vyšším gradem a nepříznivou prognózou u některých nádorů. Některé práce na přelomu století nalezly pozitivní exprese HER2neu genu, receptoru pro epidermální růstový faktor, který je u jiných solidních nádorů obecně spojován s vyšší agresivitou a metastatickým potenciálem. Výsledky malých studií byly rozporuplné [47,48], podobně jako detekce p-glykoproteinu (produkt MDR1 genu), markeru, který by mohl mít nepřímou souvislost s chemorezistencí nádoru.
V našem souboru byla imunohistochemicky zjištěna nenulová exprese p53 proteinu u 14 pacientů (39 %). Pouze u jednoho pacienta byla imunohistochemicky zjištěna overexprese HER2neu genu (IHC3+), všichni pacienti byli došetřeni fluorescenční in situ hybridizací (FISH) s negativním nálezem. Zvýšená hodnota p-glykoproteinu (nad 5 %) byla imunohistochemicky zjištěna u pěti pacientů (14 %), u ostatních byla hodnota nulová. U žádného z faktorů nebyla zjištěna korelace s léčebnou odpovědí, EFS, OS a dalšími sledovanými parametry, pouze pacienti s nulovou hodnotou p53 měli naznačeno lepší přežití, bez statistické významnosti (p = 0,270).
CD133 je transmembránový glykoprotein, jehož přesná funkce není známá. CD133+ buňky byly detekovány v mnoha typech nádorů včetně nádoru mezenchymálního původu. U nádorů kolorekta je například vyšší exprese spojena s radiorezistencí, častějším relapsem a kratším přežitím [50]. Předpokládá se, že jde o marker nádorových kmenových buněk.
Nestin je polymerní protein z rodiny intermediálních filament a mimo jiné se v buňce podílí na organizaci cytoskeletu, distribuci materiálu v cytoplazmě, ovlivňuje migraci a proliferaci. Je to marker nezralých a nediferencovaných buněk. Jeho identifikace je u některých nádorů spojována s horší prognózou. Jde o marker angiogeneze, je považován za antigenní marker tumorigenních buněk. V experimentu bylo potvrzeno, že nestin+ a CD133+ buňky vykazují vlastnosti nádorových kmenových buněk (CSCs) [51].
V našem souboru pacientů bylo možno pro nedostatek materiálu provést detekci nestin a CD133 pozitivních buněk pouze u 25 z 36 pacientů. Imunohistochemicky mělo CD133+ buňky nad 2 % celkem 9 pacientů (36 %), pod 1 % celkem 16 pacientů. Více než 2 % imunohistochemicky detekovaných nestin+ buněk mělo 19 pacientů, více než 11 % pak 7 pacientů. V univariační analýze nebyla nalezena statistická korelace pozitivity žádného z obou faktorů s léčebnou odpovědí, potažmo přežitím. Naopak pacienti s vyšší hodnotu obou faktorů vykazovali trend k lepšímu přežívání (p = 0,187 pro CD133+, p = 0,748 pro nestin+). Výsledky jsou však limitovány malým počtem vyšetřených pacientů.
Vzhledem k nízké incidenci osteosarkomu v populaci je hodnocení výsledků jednotlivých pracovišť, tedy i našeho, limitované. Řešením je léčba dle jednotných léčebných protokolů, která by umožnila hodnocení těchto i jiných faktorů na velkých souborech pacientů s cílem optimalizace léčebné strategie pro skupiny různého rizika. V současné době je léčba celosvětově vedena skupinou EURAMOS (European and American Osteosarcoma Group), která vznikla na základě spolupráce jednotlivých světových center. Byl vytvořen společný léčebný protokol, jehož cílem je mimo jiné zjistit přínos přidání etoposidu s ifosfamidem u pacientů s nedostatečnou léčebnou odpovědí či přínos přidání imunoterapie – PEG interferonu alfa 2b – k adjuvantní chemoterapii.
Do studie je celosvětově zapojeno 330 center ze 17 zemí, dosud do ní bylo zařazeno 2 260 pacientů, výsledky organizátoři očekávají v průběhu roku 2014.
Závěr
V našem souboru starších pacientů s osteosarkomem jsme dosáhli celkového 5letého OS 52,4 % a 5letý EFS činil 38,7 měsíce. Tyto výsledky se pohybují na dolní hranici výsledků zahraničních center, která však publikují výsledky léčby především dětí a adolescentů.
Medián věku většiny publikovaných studií nepřesahuje 15 let. Téměř polovina našich pacientů byla starší 30 let a třetina starší 40 let, 31 % pacientů mělo metastázy v době stanovení diagnózy.
O této věkově specifické subpopulaci je pouze omezené množství publikovaných informací, výsledky jsou obdobné jako u našich pacientů [21,22].
U lokalizovaného onemocnění (69 % pacientů) dosáhlo 5letého přežití 68,12 % pacientů (medián 74,7 měsíce), výsledky se blíží výsledkům léčby dětí a adolescentů.
V případě primárně metastatické nemoci (31 % pacientů) bylo zaznamenáno 2leté přežití 26 % (medián 13,6 měsíce), 3leté pak 15 %. V závislosti na věku přežívá v celém souboru 5 let 51,7 % pacientů ve věku 19–29 let, 57 % pacientů ve věku 19–39 let a pouze 43 % pacientů starších 40 let. Nicméně věk není v našem souboru statisticky signifikantním faktorem, starší pacienti mají tedy stejnou šanci na léčebnou odpověď jako mladší jedinci, jsou-li léčeni dle stejných léčebných protokolů. Toxicita léčby je předvídatelná a při použití maximální podpůrné terapie zvládnutelná i u pacientů vyššího věku. Průměrné celkové přežití celého souboru bylo 44,7 měsíce (medián 23 měsíců). Průměrná doba sledování činila 44,7 měsíce (2–177 měsíců, medián 23 měsíců). Metastatické onemocnění, operabilita, výchozí elevace ALP a LD byly v našem souboru statisticky signifikantními faktory ve vztahu k léčebné odpovědi a celkovému přežití. Histologická odpověď na předoperační chemoterapii nedosáhla statistické významnosti, hodnocení bylo limitováno menším počtem pacientů operovaných po neoadjuvantní chemoterapii.
K dosažení optimálních léčebných výsledků pacientů s osteosarkomem je třeba, aby byla léčebná strategie každého jednotlivého pacienta vedena multidisciplinárním týmem na pracovišti s dostatečnými zkušenostmi s léčbou tohoto onemocnění. I když bylo dosaženo významného pokroku v léčbě lokalizované nemoci, v léčbě pacientů s metastatickou chorobou nebo relapsem onemocnění žádného významného úspěchu za uplynulých 20 let dosaženo nebylo. Stejně tak u pacientů, kteří na chemoterapii 1. linie reagují omezeně.
Možnosti systémové léčby cytostatiky jsou pravděpodobně limitovány, je třeba soustředit pozornost na procesy na úrovni buněčné. Klinické zkoušení nových léků tzv. cílené léčby, případně jejich kombinace s cytostatiky, je proto logickým krokem. Nicméně podmínkou nezbytnou k získání validních dat je dostatečný nábor pacientů.
Práce byla podpořena prostředky institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR v roce 2012 a projektem A-MATH-NET Síť pro transfer znalostí v aplikované matematice – číslo: CZ.1.07/2.4.00/17.0100.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Dagmar Adámková Krákorová
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: dadamkova@mou.cz
Obdrženo/Submitted: 20. 6. 2012
Přijato/Accepted: 7. 8. 2012
Zdroje
1. Isakoff MF, Harris MJ, Beghart MC et al. Bone Sarcomas. In: Bleyer WA, Barr RD (eds). Cancer in Adolescents and Young Adults. Berlin, Heidelberg, New York: Springer-Verlag 2007 : 203–218.
2. Bleyer WA, O’Leary M, Barr R et al. Cancer epidemiology in Older Adolescents and Young Adults 15 to 29 years of Age, including SEER Incidence and Survival, 1975–2000. Bethesda MD: National Cancer Institute 2006.
3. Malawer MM, Helman LJ, Sullivan BO. Sarcomas of Bone. In: De Vita VT, Hellmann S, Rosenberg SA (eds). Cancer Principles and Practise of Oncology. 8th ed. Philadelphia: Lippincot Williams and Wilkins 2008 : 1794–1812.
4. Pazdur R, Wagman LD, Camphausen KA et al. Cancer Management: A Multidisciplinary Approach. 12th ed. 2009 : 569–583. Available from: http://www.cancernetwork.com/cancer-management-12.
5. NCCN Clinical Practise Guidelines in Oncology. Bone Cancer V 2/2012. Available from: http://www.nccn.org//professionals/physician_gls/PDF/breast.pdf.
6. Carrle D, Bielack SS. Current strategies of chemotherapy in osteosarcoma. Int Orthop 2006 : 30(6): 445–451.
7. Bielack SS, Kempf-Bielack B, Delling G et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. J Clin Oncol 2002; 20(3): 776–790.
8. Longhi A, Errani C, De Paolis M et al. Primary bone osteosarcoma in the pediatric age: state of the art. Cancer Treat Rev 2006; 32(6): 423–436.
9. Picci P. Osteosarcoma (osteogenic sarcoma). Orphanet J Rare Diseases 2007; 2 : 6.
10. Ferrari S, Palmerini E. Adjuvant and neoadjuvant combination chemotherapy for osteogenic sarcoma. Curr Opin Oncol 2007; 19(4): 341–346.
11. Bacci G, Longhi A, Versaci M et al. Prognostic factors for osteosarcoma of the extremity treated with neoadjuvant chemotherapy: 15 year experience in 789 patients treated at a single institution. Cancer 2006; 106(5): 1154–1161.
12. Ritter J, Bielack SS. Osteosarcoma. Ann Oncol 2010; 21 (Suppl 7): vii320–vii325.
13. Harting ML, Blakely ML. Management of osteosarcoma pulmonary metastases. Semin Pediatr Surg 2006; 15(1): 25–29.
14. Lewis IJ, Nooij MA, Whelan J et al. Improvement in histologic response but not survival in osteosarcoma patients treated with intensified chemotherapy: a randomized phase III trial of the European Osteosarcoma Intergroup. J Natl Cancer Inst 2007; 99(2): 112–128.
15. DeLaney TF, Park L, Goldberg SI et al. Radiotherapy for local control of osteosarcoma. Int J Radiat Oncol Biol Phys 2005; 61(2): 492–498.
16. Bacci G, Lonhgi A, Bertoni F et al. Primary high-grade osteosarcoma: comparison between preadolescent and older patients. J Pediatr Hematol Oncol 2005; 27(3): 129–134.
17. Goorin AM, Schwartzentruber DJ, Devidas M et al. Presurgical chemotherapy compared with immediate surgery and adjuvant chemotherapy for nonmetastatic osteosarcoma: Pediatric Oncology Group Study POG-8651. J Clin Oncol 2003; 21(8): 1574–1580.
18. Smeland S, Bruland OS, Hjorth L et al. Results of the Scandinavian Sarcoma Group XIV protocol for classical osteosarcoma: 63 patients with a minimum follow-up of 4 years. Acta Orthop 2011; 82(2): 211–216.
19. Ferrari S, Ruggieri P, Cefalo G et al. Neoadjuvant chemotherapy with methotrexate, cisplatin, and doxorubicin with or without ifosfamide in nonmetastatic osteosarcoma of the extremity: an Italian Sarcoma Group Trial ISG/OS-1. J Clin Oncol 2012; 30(17): 2112–2118.
20. Hegyi M, Semsei AF, Jakab Z et al. Good prognosis of localized osteosarcoma in young patients treated with limb-salvage surgery and chemotherapy. Pediatr Blood Cancer 2011; 57(3): 415–422.
21. Hagleitner MM, Hoogerbrugge PM, van der Graaf WT et al. Age as prognostic factor in patients with osteosarcoma. Bone 2011; 49(6): 1173–1177.
22. Song WS, Kong CB, Jeon DG et al. Prognosis of extremity osteosarcoma in patients aged 40–60 years: a cohort/case controlled study at a single instituce. Eur J Surg Oncol 2010; 36(5): 483–488.
23. Harting MT, Blakely ML, Jaffe N et al. Long-term survival after aggressive resection of pulmonary metastases among children and adolescents with osteosarcoma. J Pediatr Surg 2006; 41(1): 194–199.
24. Kager L, Zoubek A, Pötschger U et al. Primary metastatic ostesarcoma: presentation and outcome of patients treated on neojadjuvant Cooperative Osteosarcoma Study Group protocols. J Clin Oncol 2003; 21(10): 2011–2018.
25. Sajadi KR, Heck RK, Neel MD et al. The incidence and prognosis of osteosarcoma skip metastases. Clin Orthop Relat Res 2004; 426 : 92–96.
26. Bacci G, Ferrari S, Longhi A et al. Nonmetastatic osteosarcoma of the extremity with pathologic fracture at presentation: local and systemic control by amputation or limb salvage after preoperative chemotherapy. Acta Orthop Scand 2003; 74(4): 449–454.
27. Bacci G, Forni C, Longhi A et al. Local recurrence and local control of non-metastatic osteosarcoma of the extremities: a 27-year experience in a single institution. J Surg Oncol 2007; 96(2): 118–123.
28. Grimer RJ, Sommerville S, Warnock D et al. Management and outcome after local recurrence of osteosarcoma. Eur J Cancer 2005; 41(4): 578–583.
29. Crompton BD, Goldsby RE, Weinberg VK et al. Survival after recurrence of osteosarcoma: a 20-year experience at a single institution. Pediatr Blood Cancer 2006; 47(3): 255–259.
30. Nathan SS, Gorlick R, Bukata S et al. Treatment algorithm for locally recurrent osteosarcoma based on local disease-free interval and the presence of lung metastasis. Cancer 2006; 107(7): 1607–1616.
31. Kempf-Bielack K, Bielack SS, Jürgens H et al. Osteosarcoma relapse after combined modality therapy: an analysis of unselected patients in the Cooperative Osteosarcoma Study Group (COSS). J Clin Oncol 2005; 23(3): 559–568.
32. Ferrari S, Briccoli A, Mercuri M et al. Postrelapse survival in osteosarcoma of the extremities: prognostic factors for long-term survival. J Clin Oncol 2003; 21(4): 710–715.
33. Bielack SS, Kempf-Bielack B, Branscheid D et al. Second and subsequent recurrences of osteosarcoma: presentation, treatment, and outcome of 249 consecutive cooperative osteosarcoma study group patients. J Clin Oncol 2009; 27(4): 557–565.
34. Bacci A, Briccoli A, Longhi A et al. Treatment and outcome of recurrent osteosarcoma: experience at Rizzoli in 235 initially treated with neoadjuvant chemotherapy. Acta Oncol 2005; 44(7): 748–755.
35. Briccoli A, Rocca M, Salone M et al. Resection of recurrent pulmonary metastases in patients with osteosarcoma. Cancer 2005; 104(8): 1721–1725.
36. Strauss SJ, McTiernan A, Whelan JS. Late relapse of osteosarcoma: implications for follow-up and screening. Pediatr Blood Cancer 2004; 43(6): 692–697.
37. Anninga JK, Gelderblom H, Fiocco M et al. Chemotherapeutic adjuvant treatment for osteosarcoma: where do we stand? Eur J Cancer 2011; 47(16): 2431–2445.
38. Saylors RL 3rd, Stine KC, Sullivan J et al. Cyclophosphamide plus topotecan in children with recurrent or refractory solid tumor: a Pediatric Oncology Group Phase II Study. J Clin Oncol 2001; 19(15): 3463–3469.
39. Merimsky O, Meller I, Flusser G et al. Gemcitabine in soft tissue or bone sarcoma resistant to standard chemotherapy: a phase II study. Cancer Chemother Pharmacol 2000; 45(2): 177–181.
40. Grignani G, Palmerini E, Dileo P et al. A phase II trial of sorafenib in relapsed and unresectable high-grade osteosarcoma after failure of standard multimodal therapy: an Italian Sarcoma Group study. Ann Oncol 2012; 23(2): 508–516.
41. Loeb DM, Garrrett-Mayer E, Hobbs RF et al. Dose-finding study of 153Sm-EDTMP in patients with poor-prognosis osteosarcoma. Cancer 2009; 115(11): 2514–2522.
42. Franzius S, Schuck A, Bielack SS. High-dose samarium-153 ethylene diamine tetramethylene phosphonate: low toxicity of skeletal irradiation in patients with osteosarcoma and bone metastases. J Clin Oncol 2002; 20(7): 1953–1954.
43. Anderson P, Kopp L, Anderson N et al. Novel bone cancer drugs: investigational agents and control paradigms for primary bone sarcomas (Ewing’s sarcoma and osteosarcoma). Expert Opin Investig Drugs 2008; 17(11): 1703–1715.
44. Meyers PA, Schwarz CL, Krailo MD et al. Osteosarcoma: the addition of muramyl tripeptide to chemotherapy improves overall survival – a report from the Children’s Oncology Group. J Clin Oncol 2008; 26(4): 633–638.
45. Bacci G, Longhi A, Ferrari S et al. Prognostic significance of serum lactate dehydrogenase in osteosarcoma of the extremity: experience at Rizzoli on 1,421 patients treated over the last 30 years. Tumori 2004; 90(5): 478–484.
46. Bacci G, Ferrari S, Longhi A et al. Pattern of relapse in patients with osteosarcoma of the extremities treated with neoadjuvant chemotherapy. Eur J Cancer 2001; 37(1): 32–38.
47. Anninga JK, van de Vijver MJ, Cleton-Jansen AM et al. Overexpression of the HER-2 oncogene does not play a role in high-grade osteosarcomas. Eur J Cancer 2004; 40(7): 963–970.
48. Ferrari S, Bertoni F, Zanella L et al. Evalution of P-glycoprotein, HER-2/ErbB-2, p53, and Bcl-2 in primary tumor and metachronous lung metastases in patients with high--grade osteosarcoma. Cancer 2004; 100(9): 1936–1942.
49. Kruseová J, Mottl H, Kodet R et al. Radikální operační výkon a intenzivní chemoterapie jsou podmínkou úspěšné léčby osteosarkomu. Klin Onkol 2009; 22(4): 168–175.
50. Artells R, Moreno I, Díaz T et al. Tumour CD133 mRNA expression and clinical outcome in surgically resected colorectal cancer patients. Eur J Cancer 2010; 46(3): 642–649.
51. Veselska R, Hermanova M, Loja T et al. Nestin expression in osteosarcomas and derivation of nestin/CD133 positive osteosarcoma cell lines. BMC Cancer 2008; 8 : 300.
Další literatura u autora.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek EditorialČlánek Sarkómy maternice – prehľadČlánek Klinický registr TULUNGČlánek Soutěž o nejlepší práci
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2012 Číslo 5- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Editorial
- Mutace BRAF: nový přístup k cílené léčbě melanomu
- Hmotná podstata genetických informací – nukleové kyseliny
- Dabrafenib: nový inhibitor hyperaktivní kinázy B-RAF
- Sarkómy maternice – prehľad
- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Neoplastické účinky indometacínu v N-metyl-N-nitrozoureou indukovanej mamárnej karcinogenéze u samíc potkanov
- Predoperačná rádioterapia lokálne pokročilého karcinómu rekta: klinické výsledky krátkodobej a dlhodobej liečby s alebo bez konkomitantnej chemoterapie
- Význam stanovovania expresie DNA reparačných mechanizmov u nemalobunkového karcinómu pľúc
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Klinický registr TULUNG
- Další pozitivní studie u karcinomu ovaria
- Instrukce pro autory – příprava příspěvku k publikování v časopisu Klinická onkologie
- Instrukce pro autory – odeslání příspěvku k publikování v časopisu Klinická onkologie
- Onkologie v obrazech: Generalizovaný Kaposiho sarkom
- Soutěž o nejlepší práci
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Sarkómy maternice – prehľad
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Mutace BRAF: nový přístup k cílené léčbě melanomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



