-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRole membránových transportérů v chemorezistenci karcinomu pankreatu při terapii gemcitabinem
The Role of Membrane Transporters in Cellular Resistance of Pancreatic Carcinoma to Gemcitabine
Backgrounds:
Pancreatic carcinoma is one of the most serious forms of cancer, with a very high mortality rate, and is the fourth leading cause of cancer‑related death in the Czech Republic. The etiology and molecular pathogenesis of the disease is still poorly understood. Gemcitabine is a cytotoxic nucleoside analog, which is widely used in the treatment of malignancies, and in particular in pancreatic carcinoma. Interindividual differences in gemcitabine pharmacokinetics and pharmacodynamics have been demonstrated, which can significantly influence the outcome of the therapy in thus treated patients. Resistance developed to nucleoside analogs limits their clinical use, just like in the case of any other cytostatics.Aim:
This review summarizes available data concerning the membrane proteins involved in the transport mechanism of gemcitabine through cellular membrane, and their role in the cellular resistance of pancreatic carcinoma to gemcitabine.Key words:
pancreatic cancer – membrane transport proteins – ATP‑binding cassette transporters – nucleoside transport proteins – gemcitabine
Autoři: B. Mohelníková‑ duchoňová 1,2; P. Souček 1
Působiště autorů: Laboratoře toxikogenomiky, Státní zdravotní ústav, Praha 1; I. lékařská fakulta Univerzity Karlovy, Praha 2
Vyšlo v časopise: Klin Onkol 2010; 23(5): 306-310
Kategorie: Přehledy
Souhrn
Východiska:
Karcinom pankreatu je jednou z nejzávažnějších forem nádorového onemocnění s velmi vysokou mortalitou, která ho v ČR řadí na čtvrtou příčku v příčinách úmrtí na nádorová onemocnění. Cytostatikum ze skupiny nukleosidových analog – gemcitabin – patří v současné době mezi široce užívané preparáty v onkologické léčbě a zejména u karcinomu pankreatu. Existují však významné interindividuální rozdíly ve farmakokinetice a farmakodynamice gemcitabinu, které mohou významně ovlivnit výsledek terapie u takto léčených pacientů. Vznik lékové rezistence výrazně limituje klinické využití gemcitabinu, stejně jako ostatních cytostatik.Cíl:
V tomto článku jsou shrnuty základní dostupné informace o významných membránových proteinech účastnících se transportu gemcitabinu přes buněčnou membránu a jejich role při vzniku chemorezistence u nádorových buněk pankreatu.Klíčová slova:
karcinom pankreatu – membránové transportní proteiny – ABC přenašeče – proteiny přenášející nukleosidy – gemcitabinÚvod
Karcinom pankreatu (MKN 10 : C.25; OMIM : 260350) je jednou z nejzávažnějších forem nádorového onemocnění s velmi vysokou mortalitou, která ho v ČR řadí na čtvrtou příčku v příčinách úmrtí na nádorová onemocnění (zdroj ÚZIS 2010, www.novis.cz). Etiologie a molekulární patogeneze tohoto onemocnění nejsou stále objasněny. Mezi publikované rizikové faktory patří věk, pohlaví, diabetes, chronická pankreatitida, dietní návyky, kouření a infekce Helicobacter pylori [1,2]. Navíc genetická variabilita genů kódujících enzymy metabolizmu cizorodých látek může rovněž hrát důležitou roli při vzniku a rozvoji této malignity.
Mezi základní prognostické faktory patří stadium onemocnění (staging), provedení radikálního chirurgického výkonu a výkonnostní stav pacienta (performance status) [3].
Molekulárně biologické prognostické faktory jsou intenzivně studovány, ale zatím bez uplatnění v klinické praxi [4].
Mutace v genu KRAS jsou přítomny přibližně v 85 % sporadických nádorů pankreatu [4]. Frekvence výskytu KRAS mutací jsou asociovány s kouřením, alkoholem a expozicí organickým rozpouštědlům [5,6]. Tyto mutace lze detekovat již na samém počátku nádorového procesu [7]. Mutace v kodonu 12 působí změnu funkce KRAS proteinu, který setrvává v aktivovaném stavu, a umožňuje tak funkci signálních drah (MAPK, PI3K, NF kB a RAL GTP), což vede k zastavení buněčného cyklu v G1 fázi a následné kumulaci pozdějších alterací v dalších genech, jako CDKN2A, TP53 apod. [8]. Studie s využitím inhibice exprese pomocí siRNA poukázaly na zásadní úlohu KRAS při udržení nádorové populace [9,10]. KRAS negativní tumory vykazují, co se týče přežívání pacientů po radioterapii, lepší výsledky než tumory s přítomnými mutacemi. Analýzou podtypů KRAS mutací u karcinomu pankreatu bylo v souladu s výše zmíněnou studií prokázáno, že na výsledné přežívání nemocných mají vliv zejména mutace cGT, GcT a GaT v kodonu 12 (wild type GGT) [11]. Tumory s mutacemi v kodonu 13 mají menší tendenci k lokální progresi i ke vzdálenému metastazování [12].
Prognóza tohoto onemocnění je vzhledem k mortalitě rovnající se incidenci infaustní. Chemoterapií pokročilého karcinomu pankreatu je dosahováno mediánu přežití jen kolem 5 – 8 měsíců. V kontrolních skupinách bez chemoterapie se pohybuje medián přežití pouze mezi 2 a 4 měsíci [3]. Jednou z příčin je pozdní diagnostika tohoto typu onemocnění. Klinické příznaky se objevují až v pozdních stadiích a v době diagnózy je již 50 % pacientů s metastatickým postižením. Jediným dnes potenciálně kurativním přístupem je radikální resekce. S ohledem na pozdní diagnózu a špatný výkonnostní stav nemocných podstupuje radikální výkon jen kolem 15 – 20 % pacientů [13]. V adjuvanci i paliativní chemoterapii se uplatňují zejména nukleotidové antimetabolity. Dnes je uváděn jako lék první volby gemcitabin (2’,2’ difluordeoxycytidin).
Gemcitabin
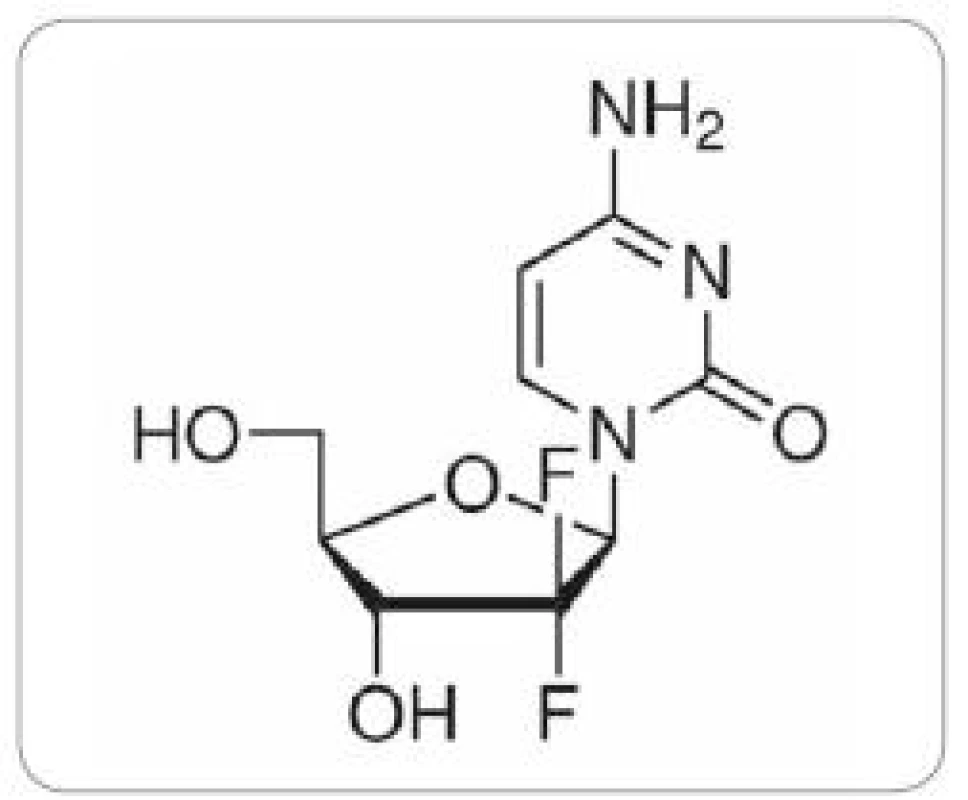
Gemcitabin – 2’,2’ difluordeoxycytidin (obr. 1) patří ke druhé generaci nukleosidových analog. K léčbě karcinomu pankreatu je standardně používán preparát Gemzar, který je využíván i při léčbě NSCLC a karcinomu močového měchýře, v druhé linii i pro nádory ovaria a prsu. Přestože je monoterapie gemcitabinem uváděna jako zlatý standard v léčbě pokročilého adenokarcinomu pankreatu (NCCN Clinical Practice Guidelines in Oncology: Pancreatic Adenocarcinoma V.1.2009. National Comprehensive Cancer Network), je odpověď na terapii gemcitabinem u nádorových buněk pankreatického duktálního adenokarcinomu v některých studiích uváděna jen 12 % a výsledky léčby mezi jednotlivými pacienty se významně liší. V současnosti je vyvíjena maximální snaha o nalezení prediktivních faktorů odpovědi na léčbu gemcitabinem u pacientů s karcinomem pankreatu a individualizaci léčby. Matsubara et al [14] vytvořili skórovací systém (normogram), který v jejich kohortě 304 pacientů s pokročilým karcinomem pankreatu léčených gemcitabinem dokázal rozlišit vysoce rizikovou skupinu pacientů s krátkým mediánem přežívání do 150 dní (p = 2 × 10–15). Sledovanými parametry tohoto normogramu byly hladiny α1 - antitrypsinu a alkalické fosfatázy v plazmě pacientů, počet leukocytů a performance status.
Chemorezistence je způsobena mnoharůznými, pravděpodobně na sobě nezávislými mechanizmy. Gemcitabin je transportován do intracelulárního prostoru pomocí nukleosidových transportérů [3], naopak transportéry rodiny ABC způsobují jeho eflux ven z buňky [4]. Intracelulárně dochází k jeho metabolické aktivaci. Preparát je fosforylován deoxycytosinkinázou na gemcitabin monofosfát a dále konvertován na dFd dCDP a dFd dCTP. Vzniklé metabolity gemcitabin trifosfát a gemcitabin difosfát [15] zodpovídají za vlastní cytostatický efekt léku.
Na fosforylaci gemcitabinu se může podílet i mitochondriální tymidinkináza (TK2). Substrátová specifita TK2 je však pro gemcitabin výrazně nižší než pro přírodní formy nuklesidů.
Metabolická inaktivace probíhá zejména cestou cytidindeaminázy anebo po fosforylaci cestou deoxycytidindeaminázy (DCTD) [16]. DCTD se účastní reakce, při které vzniká 2’ 2’ difluordeoxyuridin. Mezi dalšími faktory, které velmi pravděpodobně ovlivňují citlivost, jsou zvýšená oprava DNA a alterace cesty apoptózy [17]. V poslední době je věnováno velké úsilí studiu možností ovlivnění cest buněčné signalizace a úloze genů regulujících buněčný cyklus.
Nukleosidové transportéry
Přestože gemcitabin je hydrofilní látka, pravděpodobně nedochází k jeho významnému průniku přes plazmatickou membránu prostou difuzí. Nukleosidový transport se vyskytuje jako Na+ - independentní, obousměrný prováděný hENT (human Equilibrative Nucleoside Transporter, označovaný také jako rodina SLC29), nebo jako Na+ - dependentní, prováděný hCNT (human Concentrative Nucleoside Transporter, rodina SLC28). Zatím je známo sedm nukleosidových transportérů, které se dělí do dvou rodin proteinů: SLC29 (SLC29A2, SLC29A3, SLC29A4, známé rovněž jako hENT1, hENT2, hENT3 a hENT4) a SLC28 (SLC28A1, SLC28A2, SLC28A3, také označovány jako hCNT1, hCNT2 a hCNT3) [18,19].
Současný výzkum prokázal, že buňky, které nejsou schopny transportu pomocí těchto proteinů, jsou k inhibici gemcitabinem významně rezistentní. Příkladem je např. inhibice nukleosidových transportérů inhibitory typu dipyridamolu [20].
Gemcitabin je podáván jako i.v. bolus v infuzi trvající cca 30 min, a to první, osmý a patnáctý den 28denního cyklu, nebo jednou týdně po dobu dvou měsíců. Peak v séru dosahuje maximálně 50mM a deaminace způsobí rychlý pokles plazmatické koncentrace, takže v průběhu 2 hod spadne pod hranici stanovitelnosti. Předpoklad, který z toho vyplývá, je, že buňky jsou vystaveny gemcitabinu v signifikantní koncentraci jen krátkou dobu a neúčinný buněčný uptake je s největší pravděpodobností jedním z mechanizmů chemorezistence [20].
Gemcitabinový uptake je zajišťován 4 transportéry: hENT1 =~ hCNT1 > hENT2> hCNT3 [20]. Ve tkáních pankreatu je exprimován hENT1, hENT2 [19], ale vyskytují se zde i hCNT transportéry (hCNT1, hCNT2, hCNT3), jejichž exprese v nádorových tkáních je velmi variabilní [20]. Hlavní mechanizmus příjmu gemcitabinu buňkou je tedy pravděpodobně zajišťován hENT transportéry, protože aktivita hCNT1 byla demonstrována pouze v ledvinách, játrech, střevu a hCNT3 jen v leukemických buňkách a v buňkách kolorektálního karcinomu [22].
Studie in vitro ukázaly, že gemcitabin je do buněk transportován převážně díky hENT1 transportéru [21] a použití inhibitorů, jako je nitrobenzyl merkaptopurin ribosid či dipyridamol, snížilo více než 20násobně citlivost ke gemcitabinu [20]. Imunohistochemická studie na nádorových tkáních od 21 pacientů s pokročilým karcinomem pankreatu ukázala, že pacienti s expresí hENT1 měli významně delší medián přežití než ti s nízkou expresí či absencí hENT1 (13 vs 4 měsíce, p = 0,01) [23]. Podobné výsledky ukazuje i farmakogenetická studie na 83 pacientech, kdy byla exprese analyzována pomocí PCR. Dle autorů bylo celkové přežívání delší u pacientů s vysokou hladinou transkriptů hENT1 (25,7 vs 8,5 měsíce) [24].
ABC transportéry
Chemorezistence je způsobena mnoha různými, pravděpodobně na sobě nezávislými mechanizmy. Jedním z důležitých mechanizmů je snížená akumulace léčiva v nádorových buňkách způsobená jeho zvýšeným únikem (eflux). Ten je zprostředkován proteiny, které z velké části přísluší k nadrodině ABC transportérů (human ATP binding cassette transporters). K dnešnímu datu bylo v lidském genomu identifikováno 49 různých ABC transportérů. Dělí se do 7 tříd (A G) na základě sekvenční podobnosti. Prvním popsaným lidským ABC transportérem byl P glykoprotein (ABCB1) [25]. Následně byl izolován z buněk buněčné linie bronchogenního karcinomu MRP1 (ABCC1) [26]. Ukázalo se, že zejména zástupci rodiny ABCB, ke které se řadí i P glykoprotein [22] a rodiny ABCC [27], jsou zodpovědné za mnohočetnou lékovou rezistenci, tzv. MDR (multiple drug resistance). Kromě uvedených transportérů lze jmenovat i další transportéry, např. BCRP (ABCG2) [28].
ABCB1 (MDR1, P glykoprotein)
ABCB1, nazývaný také MDR1 či P glykoprotein, je nejdéle známý a v současnosti nejlépe prostudovaný zástupce ABC transportérů. Substrátem ABCB1 jsou obecně hydrofobní léky s polyaromatickým jádrem a neutrálním nebo kladným nábojem, např. etoposid, adriamycin, vinblastin [29]. Dříve provedené studie prokázaly, že genetické polymorfizmy v ABCB1 genu jsou důležitou determinantou jeho exprese a funkce [30] a obecně ovlivňují odpověď na farmakoterapii [31]. Dle závěrů japonských studií [32,33] vykazují haplotypy ABCB1 významnější vztah k míře exprese než jednotlivé polymorfizmy. Proto lze předpokládat, že haplotypy mohou lépe určit vztah mezi genotypem a fenotypem tohoto transportéru a velmi pravděpodobně bude tento princip univerzální. Vysoce pozitivní imunohistochemické barvení pro P glykoprotein bylo nalezeno u 73 % duktálních adenokarcinomů pankreatu (n = 103), přičemž exprese ABCB1 genu byla detekována ve všech vyšetřených tumorech, a to ve zvýšené míře oproti normální tkáni slinivky břišní. Vyšší míra exprese ABCB1 dle autorů významně korelovala s lepší prognózou a byla uvedena do souvislosti s menší biologickou agresivitou nádoru. Dále byla nalezena vyšší exprese ABCB1 v dobře diferencovaných nádorech oproti těm hůře diferencovaným [34]. Na tuto studii navázala skupina autorů [35], v jejichž studii bylo 75 % vzorků karcinomu pankreatu imunohistochemicky pozitivních na přítomnost proteinu ABCB1 (n = 63). Pacienti s nízkou či střední expresí proteinu vykazovali delší dobu přežití než pacienti s negativní expresí. Velmi zajímavé bylo, že u případů s vysokým stupněm exprese genu ABCB1 bylo nalezeno kratší přežívání než u těch s nižší expresí [35]. Exprese ABCB1 se tedy projevuje jako obecný fenomén vyskytující se v nenádorové i nádorové tkáni, jehož klinický dopad není stále jasný, a jeví se jako aktuální pro podrobné studium v jednotlivých typech nádorů. Na našem pracovišti již probíhá studium ABCB1 v nádorové tkáni prsu. Mezi první publikované výsledky patří prokázaný vztah mezi jednotlivými polymorfizmy genu ABCB1 a mírou exprese tohoto genu (resp. hladinou transkriptu v nádorech prsu). Výskyt funkčních polymorfizmů navíc koreloval s prognózou onemocnění (stav estrogenních receptorů) [36].
ABCC (MRP) rodina
ABCC rodina zahrnuje 13 členů, přičemž 9 z nich se řadí mezi tzv. multidrug resistence proteins (MRP1 - MRP9, resp. ABCC1 - ABCC6 a ABCC10 - ABCC12). ABCC transportéry jsou integrální membránové proteiny způsobující ATP dependentní export organických iontů ven z buněk. ABCC1 - 6 transportují lipofilní složky konjugované s glutathionem, glukuronátem či sulfátem. Substráty pro ABCC4, ABCC5 a ABCC11 zahrnují také cyklické nukleotidy a nukleotidová analoga [37 – 39]. ABCC4 byl navíc identifikován jako kotransportér pro redukovaný glutathion se žlučovými solemi a transportér prostaglandinů a DHEAS (dihydroepiandrosteron 3 - sulfát).
Ve zdravé tkáni pankreatu i v duktálním adenokarcinomu jsou exprimovány geny ABCC1 - 6 a ABCC10, zatímco gen ABCC12 (kódující protein MRP9) byl prozatím detekován jen v normálním parenchymu slinivky břišní. Exprese ABCC3 proteinu je v nádorových vzorcích zvýšená a koreluje s gradingem nádoru [40]. In vitro studie prokázala, že zvýšená exprese ABCB1 a ABCC1 způsobuje buněčný stres, jehož důsledkem je i zvýšený metabolizmus gemcitabinu a zvýšená vnímavost buněk k jeho působení [22]. Oguri et al [42] prověřili expresi genu ABCC5 na buněčných liniích NSCLC (non small cell lung cancer) a poukázali na korelaci mezi jeho expresí a rezistencí vůči gemcitabinu. Při inkubaci s inhibitorem ABCC5 (zaprinast) dochází ke zvýšení citlivosti buněk (tj. cytotoxicity gemcitabinu), což bylo potvrzeno i užitím si RNA.
Dosud známé údaje o expresi a účincích ABCB1, ABCG2 a ABCC rodiny u nádorů pankreatu jsou shrnuty v tab. 1.
Tab. 1. Známé údaje o expresi a účincích ABCB1, ABCG2 a ABCC rodiny u nádorů pankreatu. 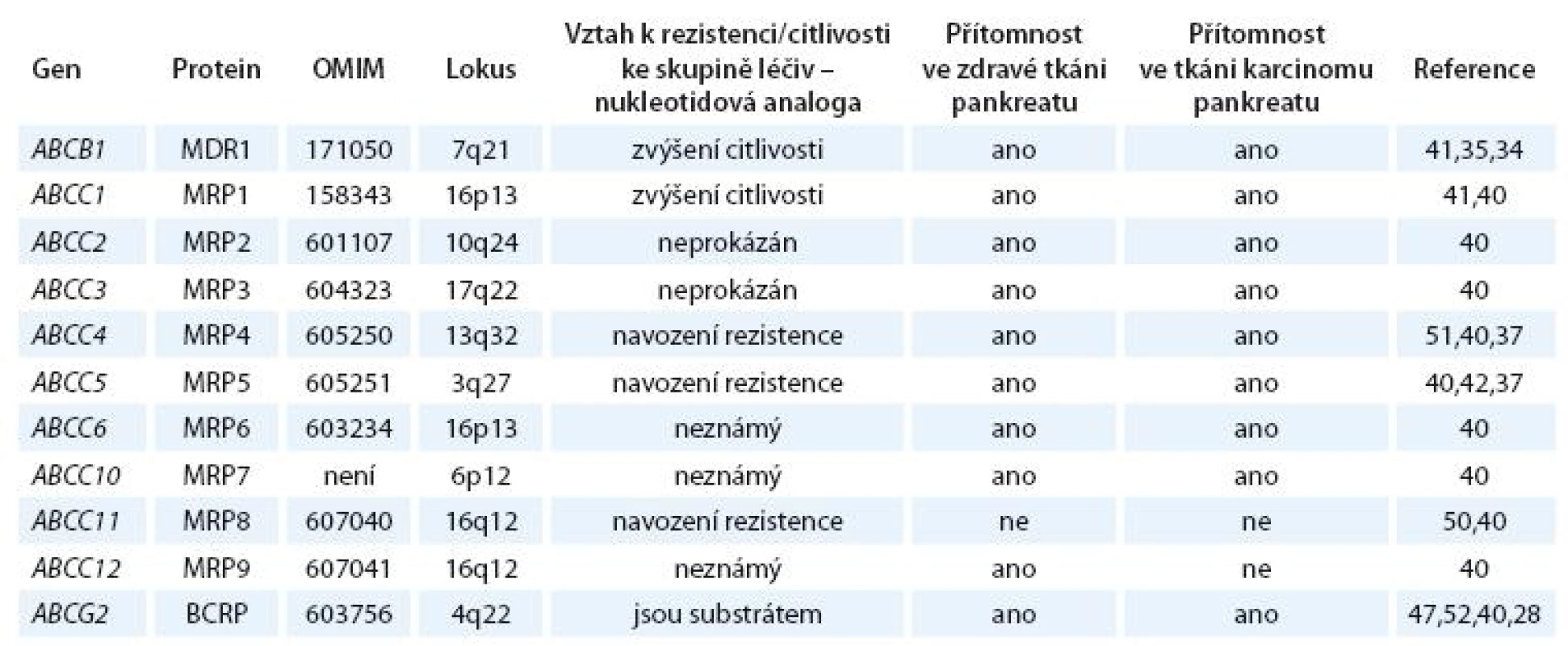
ABCG2 (BCRP – breast cancer resistance protein)
Podobně jako u ABCB1 vede i v případě genu ABCG1 jeho zvýšená exprese ke vzniku mnohočetné lékové rezistence v nádorových buňkách. ABCG2 je polovičním transportérem a k jeho správné funkci je třeba vytvoření homodimerní nebo oligomerní efluxní membránové pumpy spojením dvou anebo více proteinů [43].
Substrátem pro ABCG2 je řada cytostatik, např. topotekan, irinotekan metotrexát, a většina nukleosidových analog včetně gemcitabinu [44,45]. ABCG2 je exprimován v řadě zdravých tkání včetně slinivky a jeho exprese byla detekována i v nádorových buňkách karcinomu pankreatu [40]. Zhou et al demonstrovali přítomnost tzv. side population cells v buněčné linii PANC 1. Tato buněčná linie měla výrazně vyšší expresi ABCB1 a ABCG2 transportérů, což může významně přispívat k její známé lékové rezistenci. Po třídenní kultivaci s gemcitabinem došlo k nárůstu populace těchto buněk. Autoři usuzují, že se může jednat o kandidátní nádorové kmenové buňky, které se účastní relapsu onemocnění [46].
ABCG2 navíc vykazuje spolu s P glykoproteinem silnou tendenci k interakcím s klinicky významnými inhibitory kináz včetně erlotinibu [47].
Erlotinib (Tarceva) inhibuje receptor typu 1 pro epidermální růstový faktor (EGFR, známý také jako HER1) mechanizmem selektivní intracelulární inhibice fosforylace EGFR asociovaných tyrozinkináz, čímž vyvolává změnu proliferační aktivity buněk.
Erlotinib je aktivně transportován do buněk pomocí ABCB1 a ABCG2 transportérů in vitro [48]. V souladu s tímto tvrzením byla i in vivo nalezena vyšší biologická dostupnost erlotinibu po perorálním podání u myší, které měly tyto dva transportéry inaktivovány, oproti zvířatům, která měla tyto transportéry aktivní [48].
Závěr
Karcinom pankreatu patří k nádorovým onemocněním s velmi vážnou prognózou a pětiletým přežitím pod 5 %, a to i přes celosvětovou snahu o hledání účinnější léčby, včetně léčby biologické. V současnosti se za nejúčinnější dostupnou léčbu považuje kombinovaná terapie: gemcitabin (Gemzar) a erlotinib (Tarceva). Pacienti s pokročilým karcinomem pankreatu léčení touto kombinací dosahují jednoletého přežití až ve 20 % [49].
Chemorezistence je způsobena mnoha různými, pravděpodobně na sobě nezávislými mechanizmy. Nicméně jak u gemcitabinu, tak i u erlotinibu byl in vitro i in vivo prokázán významný vliv membránových transportérů na biologickou dostupnost a účinnost těchto preparátů.
Gemcitabin je transportován do intracelulárního prostoru pomocí nukleosidových transportérů. Transportéry rodiny ABC pak způsobují vypumpování jak gemcitabinu, tak i erlotinibu ven z buňky. Genetické alterace v genech, které kódují transportéry, mohou být u pacientů s karcinomem pankreatu jedním z potenciálních prediktivních faktorů pro individualizovanou chemoterapii.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Beatrice Mohelníková-Duchoňová
Laboratoře toxikogenomiky
Státní zdravotní ústav v Praze
Šrobárova 48
100 42 Praha 10
e-mail: mohelnikova@szu.cz
Zdroje
1. Everhart J, Wright D. Diabetes mellitus as a risk factor for pancreatic cancer. A meta‑analysis. JAMA 1995; 273(20): 1605 – 1609.
2. Mukesh V. Pancreatic cancer epidemiology. Technol Cancer Res Treat 2005; 4 : 295 – 301.
3. Klener P et al. Klinická onkologie. Praha: Galén 2002 : 429 – 433.
4. Almoguera C, Shibata D, Forrester K et al. Most human carcinomas of the exocrine pancreas contain mutant c ‑ K ‑ ras genes. Cell 1988; 53(4): 49 – 54.
5. Li D, Xie K, Wolff R et al. Pancreatic cancer. Lancet 2004; 363(9414): 1049 – 1057.
6. Porta M, Malats N, Jariod M et al. Serum concentrations of organochlorine compounds and K ‑ ras mutations in exocrine pancreatic cancer. PANKRAS II Study Group. Lancet 1999; 354(9196): 2125 – 2129.
7. Terhune PG, Phifer DM, Tosteson TDet al. K ‑ ras mutation in focal proliferative lesions of human pancreas. Cancer Epidemiol Biomarkers Prev 1998; 7(6): 515 – 521.
8. Serrano M, Lin AW, McCurrach ME et al. Oncogenic ras provokes premature cell senescence associated with accumulation of p53 and p16INK4a. Cell 1997; 88(5): 593 – 602.
9. Hirano T, Shino Y, Saito T et al. Dominant negative MEKK1 inhibits survival of pancreatic cancer cells.Oncogene 2002; 21(38): 5923 – 5928.
10. Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science 2002; 296(5567): 550 – 553.
11. Kawesha A, Ghaneh P, Skar R et al. K ‑ ras oncogene subtype mutations are associated with survival but not expression of p53, p16(INK4A), p21(WAF ‑ 1), cyclin D1, erbB ‑ 2 and erbB ‑ 3 in resected pancreatic ductal adenocarcinoma. Int J Cancer 2000; 89(6): 469 – 474.
12. Finkelstein SD, Przygodzki R, Pricolo VE et al. Genotypic classification of colorectal adenocarcinoma. Biologic behavior correlates with K ‑ ras ‑ 2 mutation type. Cancer 1993; 71(12): 3827 – 3388.
13. Pannala R, Basu A, Petersen GM et. al. New ‑ onset diabetes: a potential clue to the early diagnosis of pancreatic cancer. Lancet Oncol 2009; 10(1): 88 – 95.
14. Matsubara J, Ono M, Honda K et al. Survival prediction for pancreatic cancer patients receiving gemcitabine treatment. Mol Cell Proteomics 2010; 9(4): 695 – 704.
15. Heinemann V, Hertel LW, Grindey GB et al. Comparison of the cellular pharmacokinetics and toxicity of 2’,2’ ‑ difluorodeoxycytidine and 1‑beta‑D ‑ arabinofuranosylcytosine. Cancer Res 1988; 48(14): 4024 – 4031.
16. Plunkett W, Huang P, Xu YZ et al. Gemcitabine: metabolism, mechanisms of action, and self ‑ potentiation. Semin Oncol 1995; 22 : 3 – 10.
17. Erkan M, Kleeff J, Esposito I et al. Loss of BNIP3 expression is a late event in pancreatic cancer contributing to chemoresistance and worsened prognosis. Oncogene 2005; 24(27): 4421 – 4432.
18. Baldwin SA, Beal PR, Yao SY et al. The equilibrative nucleoside transporter family, SLC29. Pflugers Arch 2004;447 : 735 – 743.
19. Gray JH, Owen RP, Giacomini KM. The concentrative nucleoside transporter family, SLC28. Pflugers Arch 2004; 447(5): 728 – 734
20. Mackey JR, Mani RS, Selner M et al. Functional nucleoside transporters are required for gemcitabine influx and manifestation of toxicity in cancer cell lines. Cancer Res 1998; 58(19): 4349 – 4357.
21. García ‑ Manteiga J, Molina ‑ Arcas M, Casado FJ et al. Nucleoside transporter profiles in human pancreatic cancer cells: role of hCNT1 in 2’,2’ ‑ difluorodeoxycytidine ‑ induced cytotoxicity. Clin Can Res 2003; 9(13): 5000 – 5008.
22. Bergman AM, Pinedo HM, Talianidis I et al. Increased sensitivity to gemcitabine of P ‑ glycoprotein and multidrug resistance‑associated protein‑overexpressing human cancer cell lines. Br J Cancer 2003; 88(12): 1963 – 1970.
23. Spratlin J, Sangha R, Glubrecht D et al. The absence of human equilibrative nucleoside transporter 1 is associated with reduced survival in patients with gemcitabine‑treated pancreas adenocarcinoma. Clin Cancer Res 2004; 10(20): 6956 – 6961.
24. Giovannetti E, Del Tacca M, Mey V et al. Transcription analysis of human equilibrative nucleoside transporter ‑ 1 predicts survival in pancreas cancer patients treated with gemcitabine. Cancer Res 2006; 66(7): 3928 – 3935.
25. Chen CJ, Chin JE, Ueda K et al. Internal duplication and homology with bacterial transport proteins in the mdr1 (P ‑ glycoprotein) gene from multidrug‑resistant human cells. Cell 1986; 47(3): 381 – 389.
26. Cole SP, Bhardwaj G, Gerlach JH et al. Overexpression of a transporter gene in a multidrug‑resistant human lung cancer cell line. Science 1992; 258(5088): 1650 – 1654.
27. Ambudkar SV, Kimchi ‑ Sarfaty CH, Sauna ZE et al. P ‑ glycoprotein: from genomics to mechanism. Oncogene 2003; 22(47): 7468 – 7485.
28. Borst P, Evers R, Kool M et al. A family of drug transporters: the multidrug resistance‑associated proteins. J Natl Cancer Inst 2000; 92(16):1295 – 1302.
29. Olempska M, Eisenach PA, Ammerpohl O et. al. Detection of tumor stem cell markers in pancreatic carcinoma cell lines. Hepatobiliary Pancreat Dis Int 2007; 6(1): 92 – 97.
30. Rabow AA, Shoemaker RH, Sausville EA et al. Mining the National Cancer Institute’s tumor ‑ screening database: identification of compounds with similar cellular activities. J Med Chem 2002; 45(4): 818 – 840.
31. Gottesman MM, Fojo T, Bates SE. Multidrug resistance in cancer: role of ATP ‑ dependent transporters. Nat Rev Cancer 2002; 2(1): 48 – 58.
32. Marzolini C, Paus E, Buclin T et al. Polymorphisms in human MDR1 (P ‑ glycoprotein): recent advances and clinical relevance. Clin Pharmacol Ther 2004; 75(1): 13 – 33.
33. Takane H, Kobayashi D, Hirota T et al. Haplotype ‑ oriented genetic analysis and functional assessment of promoter variants in the MDR1 (ABCB1) gene. J Pharmacol Exp Ther 2004; 311(3): 1179 – 1187.
34. Taniguchi S, Mochida Y, Uchiumi T et al. Genetic polymorphism at the 5’ regulatory region of multidrug resistance 1 (MDR1) and its association with interindividual variation of expression level in the colon. Mol Cancer Ther 2003; 2(12): 1351 – 1359.
35. Suwa H, Ohshio G, Shinji A et al. Immunohistochemical localization of P ‑ glycoprotein and expression of the multidrug resistance ‑ 1 gene in human pancreatic cancer: relevance to indicator of better prognosis. Jpn J Cancer Res 1996; 87(6): 641 – 649.
36. Lu Z, Kleeff J, Shrikhande S et al. Expression of the multidrug‑resistance 1 (MDR1) gene and prognosis in human pancreatic cancer. Pancreas 2000; 21(3): 240 – 247.
37. Václavíková R, Nordgard SH, Alnaes GI et al. Single nucleotide polymorphisms in the multidrug resistance gene 1 (ABCB1): effects on its expression and clinicopathological characteristics in breast cancer patients. Pharmacogenet Genomics 2008; 18(3): 263 – 273.
38. Reid G, Wielinga P, Zelcer N et al. The human multidrug resistance protein MRP4 functions as a prostaglandin efflux transporter and is inhibited by nonsteroidal antiinflammatory drugs. Mol Pharmacol 2003; 63 : 1094 – 1103.
39. Chen ZS, Guo Y, Belinsky MG et al. Transport of bile acids, sulfated steroids, estradiol 17‑beta‑D ‑ glucuronide, and leukotriene C4 by human multidrug resistance protein 8 (ABCC11). Mol Pharmacol 2005; 67(2): 545 – 557.
40. Wijnholds J, Mol CA, van Deemter L et al. Multidrug‑resistance protein 5 is a multispecific organic anion transporter able to transport nucleotide analogs. Proc Natl Acad Sci USA 2000; 97(13): 7476 – 7481.
41. Konig J, Hartel M, Nies AT et al. Expression and localization of human multidrug resistance protein (ABCC) family members in pancreatic carcinoma. Int J Cancer 2005; 115(3): 359 – 367.
42. Oguri T, Achiwa H, Sato S et al. The determinants of sensitivity and acquired resistance to gemcitabine differ in non‑small cell lung cancer: a role of ABCC5 in gemcitabine sensitivity. Mol Cancer Ther 2006; 5(7): 1800 – 1806.
43. Kage K, Fujita T, Sugimoto Y. Role of Cys ‑ 603 in dimer/ oligodimer formation of the breast cancer resistance protein BCRP/ ACG2. Cancer Sci 2005; 96(12): 866 – 872.
44. de Wolf C, Jansen R, Yamaguchi H et al. Contribution of the drug transporter ABCG2 (breast cancer resistance protein) to resistance against anticancer nucleosides. Mol Cancer Ther 2008; 7(9): 3092 – 3102.
45. Doyle LA, Ross DD. Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2). Oncogene 2003; 22(47): 7340 – 7358.
46. Zhou J, Wang CY, Liu T et al. Persistence of side population cells with high drug efflux capacity in pancreatic cancer. World J Gastroenterol 2008, 14(6): 925 – 930.
47. Shi Z, Peng XX, Kim IW et al. Erlotinib (Tarceva, OSI ‑ 774) antagonizes ATP‑binding cassette subfamily B member 1 and ATP‑binding cassette subfamily G member 2 – mediated drug resistance. Cancer Res 2007; 67(22): 11012 – 11020.
48. Marchetti S, de Vries NA, Buckle T et al. Effect of the ATP‑binding cassette drug transporters ABCB1, ABCG2, and ABCC2 on erlotinib hydrochloride (Tarceva) disposition in in vitro and in vivo pharmacokinetic studies employing Bcrp1 - / ‑ / Mdr1a/ 1b ‑ / ‑ (triple - knockout) and wild‑type mice. Mol Cancer Ther 2008; 7(8): 2280 – 2287.
49. Ardavanis A, Kountourakis P, Karagiannis A et al. Biweekly gemcitabine (GEM) in combination with erlotinib (ERL): an active and convenient regimen for advanced pancreatic cancer. Anticancer Res 2009; 29(12): 5211 – 5217.
50. Guo Y, Kotova E, Chen Z et al. MRP8, ATP‑binding cassette C11 (ABCC11), is a cyclic nucleotide efflux pump and a resistance factor for fluoropyrimidines 2’,3’ ‑ dideoxycytidine and 9’ ‑ (2’ ‑ phosphonylmethoxyethyl)adenine. J Biol Chem 2003; 278(32): 29509 – 29514.
51. Takenaka K, Morgan JA, Scheffer GL et al. Substrate overlap between Mrp4 and Abcg2/ Bcrp affects purine analogue drug cytotoxicity and tissue distribution. Cancer Res 2007; 67(14): 6965 – 6972.
52. Okazaki T, Javle M, Tanaka M et al. Single nucleotide polymorphisms of gemcitabine metabolic genes and pancreatic cancer survival and drug toxicity. Clin Cancer Res 2010; 16(1): 320 – 329.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2010 Číslo 5- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
- Detekcia hypermetylácie DNA ako potenciálny biomarker pre karcinóm prostaty
- Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
- Role membránových transportérů v chemorezistenci karcinomu pankreatu při terapii gemcitabinem
- Incidence a mortalita nádorových onemocnění v České republice
- 18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
- Léčebné výsledky pacientů léčených v letech 1980– 2004 na jediném pracovišti pro nefroblastom
- České programy screeningu zhoubných nádorů v roce 2010
- Mukoepidermoidní karcinom dutiny nosní – vzácný nádor
- Kazuistika pacientky s triple negativním karcinomem prsu, která při léčbě paklitaxelem a bevacizumabem dosáhla kompletní remise plicního, uzlinového a kostního metastatického postižení
- Klinický registr TARCEVA
- Gefitinib v monoterapii u nemocných s pokročilým NSCLC nesoucím aktivující mutaci EGFR zlepšuje významně léčebné výsledky oproti standardní chemoterapii – aktualita z klinické praxe
- Profesor Koutecký osmdesátiletý
- Zápis ze schůze výboru České onkologické společnosti dne 21. 9. 2010 v Liberci
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí
- Hand‑ foot syndrom po podání inhibitorů tyrozinkinázové aktivity
- Mukoepidermoidní karcinom dutiny nosní – vzácný nádor
- 18F‑ FDG PET/ CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc‑ MIBI scintigrafií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání