-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTěžký deficit zinku nedonošených novorozenců
Severe zinc deficiency of premature newborns
We present two cases of premature newborns with a severe zinc deficiency. Both children were born in our department. At the time of hospital discharge they were breastfed exclusively and throve. There were no signs of dermatitis or any other illness. Between the 3rd and 4th month of chronological age both children presented skin lesions and a failure to thrive. Within a differential diagnosis we considered a low serum zinc level, which was confirmed. After oral zinc supplementation a rapid clinical improvement occured within a few days, followed by a complete resolution of symptoms.
Severe zinc deficiency can be caused by either genetic autosomal recessive disorder acrodermatitis enteropathica or acquired condition (e.g. transient zinc deficiency in an exclusively breastfed premature infant, short bowel syndrome, malabsorption syndromes etc.) [1, 2, 3]. The illness is manifested by skin lesions over the extremities, anogenital and perioral areas. Mucous parts of the body can also be affected, the intestine lesions lead to diarrhoea. Other clinical signs of severe zinc deficiency include recurrent infection based on immunodeficiency, alopecia, growth retardation, failure to thrive and other nonspecific symptoms [1, 2].
Keywords:
zinc deficiency – acrodermatitis enteropathica
Autoři: L. Hušková; Z. Tomšíková; V. Axmanová
Působiště autorů: Neonatologické oddělení Perinatologického centra IP, Nemocnice České Budějovice, a. s.
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (5): 280-283.
Kategorie: Kazuistika
Souhrn
V našem sdělení uvádíme kazuistiky dvou nedonošených novorozenců s těžkým deficitem zinku. Obě prezentované děti se narodily v našem perinatologickém centru. Při propuštění do domácí péče byly plně kojeny a prospívaly. Nenacházely se u nich žádné kožní eflorescence ani jiné příznaky onemocnění. Mezi 3. a 4. měsícem kalendářního věku se objevily kožní léze a děti přestaly prospívat. V rámci diferenciální diagnostiky byla zjištěna výrazně snížená sérová hladina zinku. Po zahájení suplementace zinkem došlo během několika dní k podstatnému zlepšení kožních lézí a následně k úplnému vymizení.
Podkladem těžkého nedostatku zinku může být buď autosomálně recesivně dědičné onemocnění acrodermatitis enteropathica (AE), anebo se jedná o stavy získané (např.: přechodný deficit u plně kojeného zejména nedonošeného dítěte, syndrom krátkého střeva, malabsorbční syndromy a jiné) [1, 2, 3]. Onemocnění se projevuje kožními lézemi na akrech končetin, v okolí úst, konečníku a perigenitálně. Mohou být postiženy také sliznice, nejčastěji střeva, což vede ke vzniku průjmů. Dalšími z projevů jsou časté infekce vznikající na podkladě imunodeficitu, alopecie, poruchy růstu, neprospívání a řada dalších nespecifických projevů [1, 2].
Klíčová slova:
deficit zinku – acrodermatitis enteropathica
ÚVOD
Deficit zinku je definován jako nepoměr mezi příjmem a jeho potřebou v organismu. Ačkoliv těžký deficit zinku je vzácný, jeho lehká až středně těžká forma je celosvětovým problémem. Podle WHO je odhadovaná světová prevalence zinkového deficitu 31 % [4]. Nejvíce je ohrožena populace v rozvojových zemích. Z dostupných dat je prokázáno, že děti v těchto zemích ve věku 0–4 roky mají vyšší riziko morbidity a mortality průjmových onemocnění, pneumonie a malárie související s deficitem zinku [4].
V naší práci se zaměřujeme pouze na těžký deficit zinku, který prezentujeme na kazuistikách dvou kojenců.
KAZUISTIKA 1
Chlapec z druhého těhotenství narozený císařským řezem na našem pracovišti ve 30. týdnu gravidity s porodní hmotností 1250 g. Délka a průběh hospitalizace odpovídaly gestačnímu stáří dítěte, bez neobvyklého průběhu. Do domácí péče byl propuštěn plně kojený a váhově prospíval. Ve 3 měsících kalendářního věku (3 týdny korigovaně) byl vyšetřen u praktického lékaře pro exantém pravého očního víčka a genitálu. Pro rychlé šíření lézí po obličeji byl dále sledován cestou naší ambulance ve spolupráci s kožním oddělením. Zpočátku byla nasazena lokální léčba Fucidin, Clotrimazol a Hydrocortison. I přes lokální terapii docházelo k propagaci a impetiginizaci ložisek, která se již nacházela na obou očních víčkách, ušních boltcích, periorálně, na genitálu a na akrech končetin. Léze byly různého charakteru, od mokvavých po zaschlé s medovými krustami. V dutině ústní a na genitálu klinický obraz odpovídal mykotickému postižení.
Vzhledem k rozsahu postižení jsme chlapce přijali k hospitalizaci, byla nasazena empiricky antibiotika (Prostaphlin) a antimykotika (Flukonazol). Eflorescence jsme ošetřovali přípravky se stříbrem. Krevní odběry byly překvapivě bez elevace zánětlivých parametrů a stěry z ložisek byly také negativní. Na zavedené terapii následovalo období střídavého zlepšení a zhoršení nálezu. V této době bylo vysloveno podezření na deficit zinku, který byl následně potvrzen. Hladina u našeho pacienta dosahovala hodnoty 245 μg/l (norma 460–1500 μg/l). Následně bylo zahájeno podávání zinkového sirupu v dávce 1 mg/ /kg/den. Po několika dnech došlo ke zlepšení veškerých projevů (obr. 1, 2).
Obr. 1. Kazuistika 1 – před zahájením suplementace zinkem.
Fig. 1. Case report 1 – before zinc supplementation.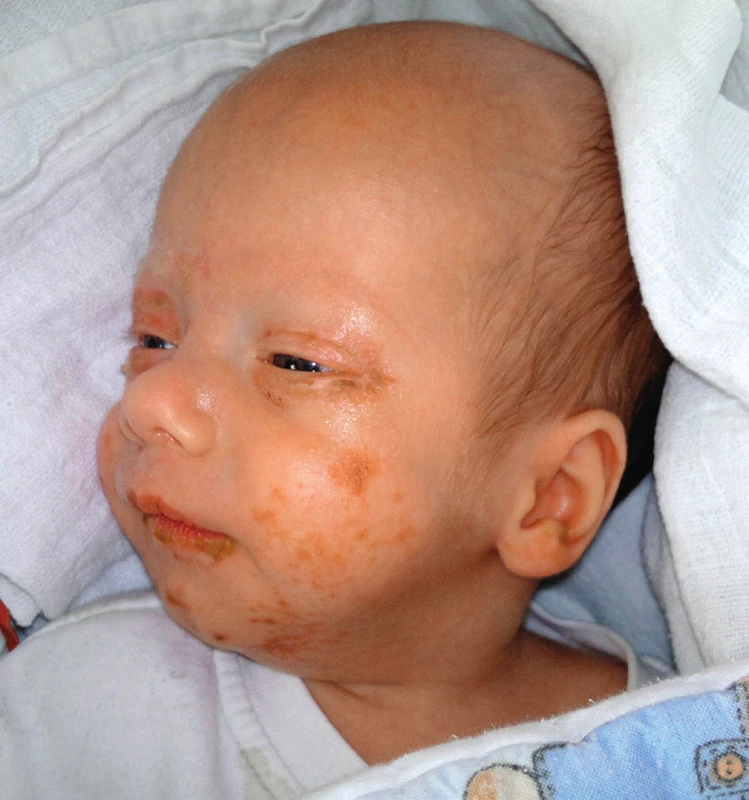
Obr. 2. Kazuistika 1 – po léčbě.
Fig. 2. Case report 1 – after treatment.
Po šesti měsících léčby bylo přistoupeno k diagnostickému vysazení terapie nutnému pro rozlišení AE od přechodného deficitu zinku nedonošených dětí. U chlapce k relapsu onemocnění nedošlo, nyní je bez zdravotních potíží a jeho psychomotorický vývoj odpovídá korigovanému věku.
KAZUISTIKA 2
Chlapec ze sedmé gravidity, druhé parity, narozen na našem oddělení ve 27. gestačním týdnu císařským řezem s porodní hmotností 900 g. Při propuštění byl plně kojený a prospíval. Ve 4. měsíci kalendářního věku byl vyšetřován pro impetiginizaci kožních eflorescencí a neprospívání. Kožní léze, charakteru vezikul, hemoragických bul a žlutavých krust byly lokalizovány zejména na obličeji, genitálu, hýždích a konečcích prstů. Krevní odběry byly bez elevace markerů zánětu. Ze stěru byl vykultivován Staphylococcus aureus, mykologicky byla kultivace negativní.
V rámci diferenciální diagnostiky byla při příjmu vyšetřena hladina zinku, která ukazovala na jeho nedostatek. Deficit dosahoval hodnoty 194 μg/l (norma 460–1500 μg/l). Vzhledem k časné diagnostice spočívala léčba v perorálním podávání zinkového sirupu a pouze místní aplikaci Fucidinu.
Během dvou dnů došlo ke zlepšení lokálního nálezu a k váhovým přírůstkům. Po půl roce léčby byl zinek postupně vysazen a také u tohoto pacienta nedošlo k následnému relapsu onemocnění.
DISKUSE
Zinek hraje v lidském organismu řadu důležitých rolí. Je součástí více než 200 Zn-dependentních metaloenzymů (alkalická fosfatáza, karboanhydráza, alkoholdehydrogenáza, laktátdehydrogenáza, superoxiddismutáza aj.) [5]. Je nutný pro syntézu DNA a pro funkci některých bílkovin na DNA navázaných. Prostřednictvím enzymů v metabolismu nukleových kyselin ovlivňuje buněčné dělení a diferenciaci buněk. V organismu je jeho přítomnost důležitá hlavně v kůži, sliznicích, imunitním systému, gonádách, smyslových orgánech a CNS.
Zinek je absorbován převážně v duodenu a jejunu a menší část také v ileu a tlustém střevě. V průběhu trávení je zinek z potravy uvolňován a absorbován střevní sliznicí dále do krevního řečiště. V krvi je vázán především na albumin a mikroglobulin. Dále je zinek vychytáván ve všech tkáních lidského těla [6]. Jeho nejvyšší obsah je ve svalech, kostech, kůži a játrech. Vylučování probíhá prostřednictvím gastrointestinálního traktu, v menší míře také ledvinami. Metabolismus zinku je regulován metalothioneinem. Na rozdíl od dospělých jedinců, donošení novorozenci mají dostupné zásoby zinku v játrech, které vznikají během celého těhotenství a zejména v posledním trimestru [7]. Tento aspekt je důležitý pro předčasně narozené děti, u kterých nejsou tyto zásoby dostatečně vytvořeny a navíc mají vyšší potřebu pro svůj vývoj. Doporučený denní enterální příjem zinku u donošených novorozenců je 0,8 mg/kg a parenterální 250 μg/kg, zatímco nedonošenci mohou vyžadovat až 3 mg/kg, respektive 400 μg/kg [8]. Dostatečný příjem zinku je důležitý také v těhotenství. V klinických studiích bylo prokázáno, že deficit zinku u těhotných zvyšuje riziko intrauterinní růstové retardace, vzniku defektů neurální trubice a malformací gastrointestinálního traktu u plodu [9]. Doporučený příjem zinku v těhotenství u dospělé ženy se udává 9,5 mg/den [10].
Deficit zinku může být vrozený (AE), nebo získaný.
AE je vzácné autosomálně recesivně dědičné onemocnění vznikající mutací genu SLC39A4 [1, 2, 5]. Tato mutace vede k částečné či úplné poruše transportního proteinu zinku v tenkém střevě a následně k jeho malabsorpci. Odhadovaná incidence je 1 : 500 000 [1, 5]. Projevy jsou přítomny již v prvních měsících života a léčba musí být celoživotní.
Získané stavy deficitu zinku jsou obecně důsledkem nedostatečného příjmu, zvýšených potřeb, malabsorpce, zvýšených ztrát nebo narušené utilizace [11].
Jednou ze skupin ohrožených získaným deficitem zinku jsou nedonošení novorozenci. Největší tvorba zásob zinku probíhá ve třetím trimestru gravidity, a tak na rozdíl od dětí donošených mají nedonošenci zásoby zinku v organismu menší. K tomu dále přispívá jeho vyšší potřeba pro jejich postnatální vývoj [12]. Další skupinou postižených mohou být výhradně kojené děti, donošené i nedonošené. V tomto případě je důvodem mutace genu SLC30A2 kódující transportér zinku v mléčné žláze [1, 13]. Výsledkem je porucha sekrece zinku do mateřského mléka. K získanému deficitu také přispívají malabsorpční syndromy, zahrnující například chronické střevní záněty, u kterých je snížena absorpce ve střevě, syndrom krátkého střeva, dále dlouhodobá totální parenterální výživa s neadekvátním obsahem zinku a řada chronických onemocnění, jako jsou např. jaterní onemocnění, kde je deficit zinku multifaktoriální etiologie (snížený příjem, hypoalbuminémie, zvýšená exkrece), a některá onemocnění ledvin vedoucí k nefrotickému syndromu s následnou nadměrnou exkrecí zinku do moči [2, 3].
Klinické projevy těžkého deficitu vrozených i získaných forem jsou podobné. Charakteristickým místem postižení je kůže a kožní adnexa. V okolí úst, očí, nosu, na akrálních částech končetin a genitálu se objevují erytematózní, šupinaté plaky nebo vezikulobulózní eroze či krusty. Dochází k postupnému vypadávání vlasů, případně i obočí a řas. Časté jsou sekundární infekce (nejčastější vyvolavatelé S. aureus, Candida) [1, 5], které modifikují klinický obraz a tím prodlužují dobu stanovení správné diagnózy. Mezi celkové projevy patří neklid, dráždivost, neprospívání a poruchy růstu. Mezi další nespecifické projevy řadíme průjem, postižení sliznic, fotofobie, hypogeusie, hyposmie a řadu dalších.
Základem diagnostiky je stanovení sérové hladiny zinku spolu s klinickými projevy. Další možností určení deficitu zinku v organismu, ale v běžné praxi nepříliš využívané, je stanovení jeho obsahu ve vlasech, v moči či v neutrofilech. Dalším ukazatelem deficitu může být snížená hodnota zinek-dependentních enzymů. Jedním z těchto proteinů je alkalická fosfatáza, a proto její snížení, po vyloučení jiných příčin, může poukazovat na jeho možný deficit [1, 5]. K odlišení vrozených a získaných forem je možný pokus s vysazením léčby, kdy v případě AE dochází po několika dnech k relapsu onemocnění [13]. K potvrzení AE je možné doplnit genetické vyšetření, to v době naší diagnostické rozvahy nebylo v České republice dostupné. U našich dvou pacientů předpokládáme, že na manifestaci deficitu měla největší podíl jejich nedonošenost. Přispět k tomu mohla také nízká hladina zinku v mateřském mléce, nicméně toto vyšetření nebylo provedeno. Jiné rizikové faktory u našich pacientů identifikovány nebyly.
Léčba spočívá v substituci zinku v dávce 1–3 mg/kg/den. Po zahájení suplementace dojde během prvních dnů ke zlepšení. Kontrola sérových hladin zinku a alkalické fosfatázy probíhá každých 3–6 měsíců [2].
ZÁVĚR
V běžné praxi se s těžkým deficitem zinku nesetkáváme příliš často. Jeho forma může být vrozená, nebo získaná. Doba potřebná ke stanovení správné diagnózy může být prodloužena kvůli časté sekundární kožní infekci, která modifikuje obraz onemocnění. Diagnostika se opírá o klinické projevy a stanovení sérové hladiny zinku spolu s rapidní odpovědí na podávanou suplementaci.
Léčba spočívající v užívání zinkových preparátů vede k rychlému zlepšení stavu. Jednoduchý pokus s vysazením léčby nám pomůže odlišit vrozenou a získanou formu onemocnění. U obou našich pacientů se jednalo o získaný deficit zinku nedonošených dětí, nikoliv o vrozenou AE.
Obrázky jsou publikovány se souhlasem rodičů.
Došlo: 23. 10. 2018
Přijato: 2. 4. 2019
MUDr. Lenka Hušková
Neonatologické oddělení
Perinatologické centrum IP
Nemocnice České Budějovice, a.s.
B. Němcové 585/54
370 01 České Budějovice
e-mail: lenhuskova@gmail.com
Zdroje
1. Beigi PKM, Maverakis E. Acrodermatitis Enteropathica, A Clinician‘s Guide. New York: Springer, 2015 : 7–22, 29–35, 39–41, 63–72. ISBN 978-3-319-17819-6.
2. Abrams S. Zinc deficiency and supplementation in children and adolescents. UpToDate Wolters Kluwer. Dostupné na https://www.uptodate.com/contents/zinc-deficiency-and-supplementation-in-children-and-adolescents.
3. Stapleton K, O‘Loughlin E, Relic P. Transient zinc deficiency in a breast-fed premature infant. Australas J Dermatol 1995; 36 : 157–159.
4. Ezzati M, Lopez A, Rodgers A, et al. Comparative quantification of health risks: global and regional burden of disease attributable to selected major risk factors. In: Caulfield L, Black R. Zinc Deficiency. Hong Kong: WHO, 2004 : 257–279. ISBN 92-4-158031-3.
5. Maverakis E, Fung MA, Lynch PJ, et al. Acrodermatitis enteropathica and an overview of zinc metabolism. J Am Acad Dermatol 2007; 56 : 116–124.
6. Pazirandeh S, Burns DL, Griffin IJ, et al. Overview of dietary trace minerals. UpToDate Wolters Kluwer. Dostupné na https://www.uptodate.com/contents/overview-of-dietary-trace-minerals.
7. Terrin G, Berni Canani R, Di Chiara M, et al. Zinc in early life: A key element in the fetus and preterm neonate. Nutrients Dec 2015; 7 (12): 10427–10446.
8. Gleason CA, Juul SE. Avery‘s Diseases of the Newborn. Philadelphia: Elsevier, 2017. ISBN: 978-0-323-40139-5.
9. Wang H, Hu YF, Hao JH, et al. Maternal zinc deficiency during pregnancy elevates the risks of fetal growth restriction: a population-based birth cohort study. Sci Rep 2015; 5 : 11262.
10. Gibson RS, King JC, Lowe N. A review of dietary zinc recommenda-tions. Food Nutr Bull 2016; 37 (4): 443–460.
11. Roohani N, Hurrell R, Kelishadi R, et al. Zinc and its importance for human health: An integrative review. J Res Med Sci 2013; 18 : 144–157.
12. Stevens J, Lubitz L. Symptomatic zinc deficiency in breast-fed term and premature infants. J Paediatr Child Health 1998; 34 : 97–100.
13. Chue CD, Rajpar SF, Bhat J. An acrodermatitis enteropathica-like eruption secondary to acquired zinc deficiency in an exclusively breast-fed premature infant. Int J Dermatol 2008 Apr; 47 : 372–373.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Závažný průběh celiakie
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2019 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
-
Všechny články tohoto čísla
- Odešel profesor MUDr. Josef Koutecký, DrSc. (31. 8. 1930 – 5. 7. 2019)
- Současná dětská onkologie v České republice
- Vplyv zdravotného postihnutia dieťaťa na súrodenecké vzťahy v rodine
- Predčasne narodený novorodenec s hypotonickým syndrómom a kryptorchizmom
- Závažný průběh celiakie
- Těžký deficit zinku nedonošených novorozenců
- Život ohrozujúca hemoptýza u pacientov s jednokomorovou cirkuláciou
- Poruchy příjmu potravy – mentální anorexie a bulimie, nejzávažnější somatické a metabolické komplikace. Způsoby realimentace Shrnutí 30leté praxe z metabolického pohledu internisty
- Poruchy polykání v dětském věku
- Odešla MUDr. Ema Alena Kubíková-Kouřilová, CSc.
- Recenzia publikácie: „Sociálne determinanty zdravia školákov. Národná správa o zdraví a so zdravím súvisiacom správaní 11-, 13- a 15-ročných školákov na základe prieskumu uskutočneného v roku 2017/2018 v rámci medzinárodného projektu „Health Behaviour in School Aged Children“ (HBSC)“
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Poruchy příjmu potravy – mentální anorexie a bulimie, nejzávažnější somatické a metabolické komplikace. Způsoby realimentace Shrnutí 30leté praxe z metabolického pohledu internisty
- Predčasne narodený novorodenec s hypotonickým syndrómom a kryptorchizmom
- Těžký deficit zinku nedonošených novorozenců
- Poruchy polykání v dětském věku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



