-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAutoimunitní onemocnění jater v dětském věku – část I
Autoimmune Liver Diseases in Children. Part I
Autoimmune liver diseases form a group of chronic inflammatory illnesses associated with serious prognosis. Autoimmune hepatitis, autoimmune sclerosing cholangitis, and primary sclerosing cholangitis are the most common entities seen during childhood. Clinical findings of liver disorder are not typical, even the disease course may be asymptomatic. We can frequently found other illnesses with autoimmune pathogenesis in patients or their first-degree relatives. Laboratory diagnostics is based on detection of different types of autoantibodies, hypergammaglobulinemia, and elevated IgG. The definitive diagnosis is provided by liver biopsy and imaging of biliary tree.
Early and proper diagnosis followed by prompt therapy affects the patient’s prognosis significantly. Corticosteroids alone or paired with azathioprine have proven efficacy, administration of ursodeoxycholic acid is still a matter of debate. Chronic liver failure requiring liver transplant occurs despite treatment in many patients, especially those with sclerosing cholangitis.Key words:
autoimmune liver disease, autoimmune hepatitis, primary sclerosing cholangitis, autoimmune sclerosing cholangitis, primary biliary cirrhosis, childhood, overlap syndrome
Autoři: P. Dědek
Působiště autorů: Dětská klinika Fakultní nemocnice, Hradec Králové, přednosta prof. MUDr. M. Bayer, CSc.
Vyšlo v časopise: Čes-slov Pediat 2010; 65 (12): 694-705.
Kategorie: Přehledový článek
Souhrn
Autoimunitní onemocnění jater představují skupinu chronických zánětlivých postižení jater se závažnou prognózou. Mezi nejčastější autoimunitní onemocnění jater v dětském věku patří autoimunitní hepatitida, autoimunitní sklerózující cholangitida a primární sklerózující cholangitida. Klinický obraz jaterního postižení je necharakteristický. Onemocnění může probíhat i asymptomaticky. U samotných nemocných nebo v přímém příbuzenstvu často diagnostikujeme další nemoci s imunopatologickou patogenezí. V laboratorním vyšetření prokazujeme přítomnost různých typů autoprotilátek, hypergamaglobulinémii a zvýšenou hodnotu IgG. Nezastupitelnou úlohu plní v diagnostice jaterní biopsie a zobrazovací vyšetření velkých žlučových cest.
Včasná a správná diagnóza následovaná bezprostředním zahájením terapie významným způsobem ovlivňuje prognózu pacientů. Prokázána je účinnost terapie samotnými kortikoidy nebo kombinované terapie kortikoidy s azathioprinem. Úloha kyseliny ursodeoxycholové není dosud uzavřena. U významné části pacientů, především u nemocných se sklerózující cholangitidou, však onemocnění progreduje do obrazu chronického jaterního selhání vyžadujícímu transplantaci jater.Klíčová slova:
autoimunitní onemocnění jater, autoimunitní hepatitida, primární sklerózující cholangitida, autoimunitní sklerózující cholangitida, primární biliární cirhóza, překryvný syndromÚvod
Mezi klasická autoimunitní onemocnění jater řadíme autoimunitní hepatitidu (AIH), primární sklerózující cholangitidu (PSC) a primární biliární cirhózu (PBC). Tyto jednotky jsou jasně definovány klinicky, laboratorně a histologicky. Další onemocnění jsou obtížně zařaditelná, protože diagnostická kritéria chybějí. Jedná se o překryvný syndrom AIH/PSC, AIH/PBC, AIH/chronická hepatitida C a některé formy kryptogenní hepatitidy (AIH s negativními autoprotilátkami, „séronegativní“ AIH). Zvláštní skupinu tvoří autoimunitní hepatitida de novo vznikající v játrech transplantovaných z jiné indikace, než je autoimunitní hepatitida.
Výčet výše uvedených jednotek se u dětí a dospělých neliší. Pro dětský věk je však charakteristická odlišná frekvence výskytu, iniciální manifestace, závažnost onemocnění, léčba a prognóza jednotlivých onemocnění. V dětském věku se nejčastěji setkáváme s autoimunitní hepatitidou, primární sklerózující cholangitidou a překryvným syndromem AIH/PSC. Vzácně diagnostikujeme překryvný syndrom AIH/PBC. Výskyt klasické PBC či kryptogenní hepatitidy s předpokládanou autoimunitní etiopatogenezí je podle literárních odkazů i vlastních zkušeností raritní.
Je známou skutečností, že autoimunitní onemocnění jater probíhají u dětí závažněji a mají horší prognózu. Většina nemocných sice odpovídá na léčbu, ale vyžaduje relativně vyšší dávky léků podávaných po delší dobu a v průběhu léčby dochází častěji k relapsům základního onemocnění.
Děti s autoimunitními onemocněními jater tvoří v ordinaci dětského hepatologa velmi významnou skupinu pacientů. Všeobecně se úroveň znalostí o této skupině chorob zlepšuje, ale stále není dostačující. I za předpokladu, že se na tato onemocnění myslí, není jejich diagnostika vždy snadná. Na rozdíl od virových hepatitid totiž chybějí vyšetření, která by nemoc jednoznačně definovala. Prognóza je však na správné a včasné diagnóze s bezprostředním zahájením terapie závislá.
V následujícím přehledu jsou jednotlivé nozologické jednotky řazeny podle frekvence výskytu u dětí. Vzhledem k tomu, že jsme překryvný syndrom AIH/chronická hepatitida C nikdy nediagnostikovali a s autoimunitní hepatitidou de novo nemáme žádné zkušenosti, nebudou tato onemocnění dále diskutována.
1. Autoimunitní hepatitida
Charakteristika
Autoimunitní hepatitida představuje závažné zánětlivé heterogenní onemocnění jater. Postihuje více dívky a bývá provázena výskytem různých imunopatologických stavů u samotných nemocných nebo jejich přímých příbuzných. V laboratorním vyšetření je charakterizována zvýšenými hodnotami aminotransferáz, hypergamaglobulinémií, zvýšenou hodnotou IgG, přítomností orgánově specifických a nespecifických autoprotilátek a asociací s určitými HLA antigeny. Při histologickém vyšetření jaterní tkáně je prokazován obraz periportální či periseptální hepatitidy (tzv. „interface hepatitis“). Nejvýznamnějším rysem je všeobecně známá odpověď na terapii kortikoidy, buď samotnými, nebo v kombinaci s imunosupresivy [1]. Prevalence AIH u dětských pacientů je udávána 1 až 10/1 000 000, AIH je zodpovědná za 2–5 % chronických jaterních onemocnění u dětí [2].
Klinický obraz
Onemocnění se manifestuje kdykoli v průběhu života, nejčastěji v dětském věku a u mladých dospělých. V literatuře je udáváno rozmezí výskytu od 6 měsíců do 77 let [3, 4]. Nejčastěji je onemocnění diagnostikováno mezi 10. a 40. rokem věku. Asi polovina nemocných je v době diagnózy mladší 30 let. Onemocnění má jednoznačnou predilekci k ženskému pohlaví. U žen se vyskytuje v 70 až 80 %, v dětském věku je udáván poměr mezi děvčaty a chlapci 8–9 : 1. V přímém příbuzenstvu i u samotných nemocných prokazujeme další onemocnění s předpokládanou imunopatologickou patogenezí bez vztahu k průběhu AIH a k závažnosti histologického nálezu jaterní tkáně. Vyskytují se asi u 25–40 % pacientů a jejich výčet je rozsáhlý [3, 5]. Podle literárních zdrojů patří mezi onemocnění asociovaná s AIH autoimunitní thyreoiditida, Gravesova choroba, ulcerózní kolitida, autoimunitní hemolytická anémie, celiakální sprue, dermatitis herpetiformis, idiopatická trombocytopenická purpura, diabetes mellitus 1. typu, diabetes insipidus, fibróza plic, myasthenia gravis, perikarditida, pleuritida, glomerulopatie, nefrotický syndrom, tubulointersticiální nefritida, febrilní panikulitida, hypereozinofilní syndrom, Sjögrenův syndrom, systémová onemocnění pojivové tkáně, juvenilní chronická artritida, ankylosující spondylartritida, iridocyklitida, vaskulitidy, urticaria pigmentosa, vitiligo, psoriáza, hypoparathyreóza, Addisonova nemoc a autoimunitní polyglandulární syndrom 1. typu [1, 2, 4, 6, 7]. Mezi nejčastější patří autoimunitní hemolytická anémie, autoimunitní thyreoiditida a ulcerózní kolitida. Zvláštní formou AIH je nález obrovskobuněčné hepatitidy s Coombs-pozitivní hemolytickou anémií u kojenců a batolat [5]. Vztah mezi AIH a idiopatickými střevními záněty je komplikovanější. Je všeobecně známá asociace mezi idiopatickými střevními záněty a hepatobiliárními onemocněními, především primární sklerózující cholangitidou. Podle epidemiologických studií byla i u nemocných s AIH zjištěna vyšší prevalence ulcerózní kolitidy, vztah ke Crohnově chorobě prokázán nebyl. Autoimunitní hepatitida se může podobně jako PSC manifestovat zcela nezávisle na klinickém průběhu ulcerózní kolitidy.
Asi ve 30–40 % případů se AIH manifestuje pod obrazem akutní hepatitidy s ikterem jako hlavním příznakem. Tato akutní symptomatologie, někdy splňující kritéria akutního či fulminantního selhání jater, představuje pravděpodobně exacerbaci déletrvajícího, subklinického onemocnění. U 25 až 40 % nemocných je klinická symptomatologie méně specifická a nápadná („obraz chronické hepatitidy“). Nemocní si stěžují na únavu, dyspeptické potíže, úbytek na váze či je pozorován intermitentní ikterus. Vzácně (do 10 %) dochází u pokročilé jaterní léze k manifestaci na podkladě komplikující portální hypertenze. Výjimečně může být AIH diagnostikována v asymptomatickém stadiu, kdy zvýšené hodnoty aminotransferáz nebo hepatosplenomegalie jsou zjištěny náhodně při screeningovém vyšetření.
V dosud největším publikovaném souboru 52 dětských pacientů je popisován klinický obraz akutní hepatitidy u 29 dětí (u šesti z nich s rozvojem fulminantního jaterního selhání) a obraz chronické hepatitidy s nespecifickými příznaky u 17 nemocných. U zbývajících šesti dětí se autoimunitní hepatitida manifestovala na podkladě komplikující portální hypertenze [2].
Při fyzikálním vyšetření zjišťujeme následující symptomy: hepatomegalie (86 %), ikterus (66 %), splenomegalie (32–56 % podle přítomnosti cirhózy jater), pavoučkové névy (60 %), ascites (10 %), jaterní encefalopatie (14 %) [5]. Objektivní nález v době diagnózy ale může být i normální.
Laboratorní vyšetření
V laboratorním vyšetření je až na výjimky (inaktivní jaterní cirhóza) vždy přítomna zvýšená aktivita aminotransferáz. U neléčených nemocných jejich hodnota koreluje se závažností onemocnění a prognózou. U většiny pacientů se aktivita aminotransferáz pohybuje do desetinásobku normy, asi u 16 % je hodnota zvýšena na více než dvacetinásobek. Pokud je přítomna hyperbilirubinémie, jedná se téměř vždy o konjugovanou hyperbilirubinémii. Zvýšená frakce nepřímého bilirubinu budí podezření na současně probíhající hemolýzu. Konjugovaná hyperbilirubinémie se vyskytuje asi u 80 % nemocných se závažným průběhem AIH [4]. Laboratorní ukazatele cholestázy (aktivita GGT, ALP) mohou být mírně zvýšené, ale cholestatický laboratorní obraz není výrazněji vyjádřen. Poškozená syntetická schopnost jater se projevuje prodlouženým protrombinovým časem, který nedostatečně reaguje na dodávku vitaminu K. Snížená může být i hladina albuminu. Ukazuje se, že hodnoty bilirubinu a protrombinového času jsou významnými faktory ve vztahu k prognóze [2].
Významným rysem AIH je polyklonální hypergamaglobulinémie vyskytující se u 80–100 % dětí. Na zvýšené hodnotě gamaglobulinů se podílí vysoká hodnota IgG. Dále prokazujeme zvýšenou hladinu cirkulujících imunokomplexů nebo sníženou hladinu C4 složky komplementu. U poloviny dětí bývá pozitivní přímý Coombsův test [4].
Pro AIH je charakteristická přítomnost autoprotilátek [8]. K detekci autoprotilátek se využívá různých technik (nepřímá imunofluorescence, ELISA, imunoblot, radioimunoassay). Metody stanovení autoprotilátek nejsou dostatečně standardizovány (užívání různých substrátů, různá ředění sér a rozdílné hodnocení výsledků). Je proto obtížné hodnotit senzitivitu a specificitu jednotlivých autoprotilátek v diagnostice AIH. Základní a nejlépe propracovanou metodikou je nepřímá imunofluorescence využívající jako antigenní substrát krysí játra, ledvinu a žaludek. I když je některými autory upřednostňována vlastní příprava z čerstvých tkání, v běžné praxi se používají různě kvalitní komerční soupravy. Upozorňujeme, že metodika nepřímé imunofluorescence vyžaduje velkou zkušenost vyšetřujícího. Důležitá je také správná klinická interpretace výsledků, protože se autoprotilátky vyskytují u řady dalších jaterních i mimojaterních onemocnění.
Přítomnost autoprotilátek je významná nejen v diagnostice, ale i v klasifikaci AIH.
AIH 1. typu je charakterizována přítomností protilátek proti hladkému svalu (SMA – smooth muscle antibody) a/nebo antinukleárních protilátek (ANA – antinuclear antibody). Protilátky proti hladkému svalu jsou hlavním laboratorním znakem AIH 1. typu (obr. 1). Běžně se vyskytují v kombinaci s ANA, u 26 % případů jsou jediným sérologickým markerem. Protilátky proti hladkému svalu představují heterogenní směs protilátek namířených proti aktinovým i neaktinovým komponentám cytoskeletu (tubulin, vimentin, desmin, skeletin). Jelikož jsou pro AIH 1. typu charakteristické antiaktinové autoprotilátky, označuje se někdy tato choroba jako „anti-actin hepatitis“ [7]. Protilátky detekují takzvaný polymerizovaný F-aktin. Lze je prokázat např. při imunofluorescenčním vyšetření využívajícím buněčné kultury fibroblastů nebo Hep-2 buněk (obr. 2). U 9–14 % nemocných jsou antinukleární protilátky jediným markerem onemocnění. Při nepřímé imunofluorescenci pozorujeme různé typy imunofluorescence nejlépe prokazatelné pomocí Hep-2 buněk (obr. 3). Homogenní typ se vyskytuje u 34–66 % a skvrnitý typ u 21–38 % případů. Další typy imunofluorescence (nukleolární, centromerický, periferní) se prokazují méně často. Jelikož jsou ANA tvořeny heterogenní směsí protilátek proti různým komponentám buněčných jader, je snaha o detailnější identifikaci těchto antigenů. Některé práce stanovují protilátky proti dvouvláknové DNA (ds-DNA), jednovláknové DNA (ss-DNA) či rekombinantním jaderným antigenům. V současné době není jasné, zda další subklasifikace protilátek proti jaderným antigenům má klinický význam. Naopak byl v diagnostice AIH 1. typu prokázán přínos protilátek proti cytoplazmě neutrofilů (ANCA – antineutrophil cytoplasmatic antibody) převážně perinukleárního typu (pANCA), které se vyskytují až u 80–90 % pacientů (obr. 4).
Obr. 1. Imunofluorescenční obraz protilátek proti hladkému svalu (substrát – krysí žaludek, A – hladký sval ve stěně cév, B – muscularis musosae, C – muscularis propria). Fig. 1. Immunofluorescent image of smoothmuscle antibodies (substrate – rat stomach, A – smooth muscle in the vascular wall, B – muscularis musosae, C – muscularis propria). 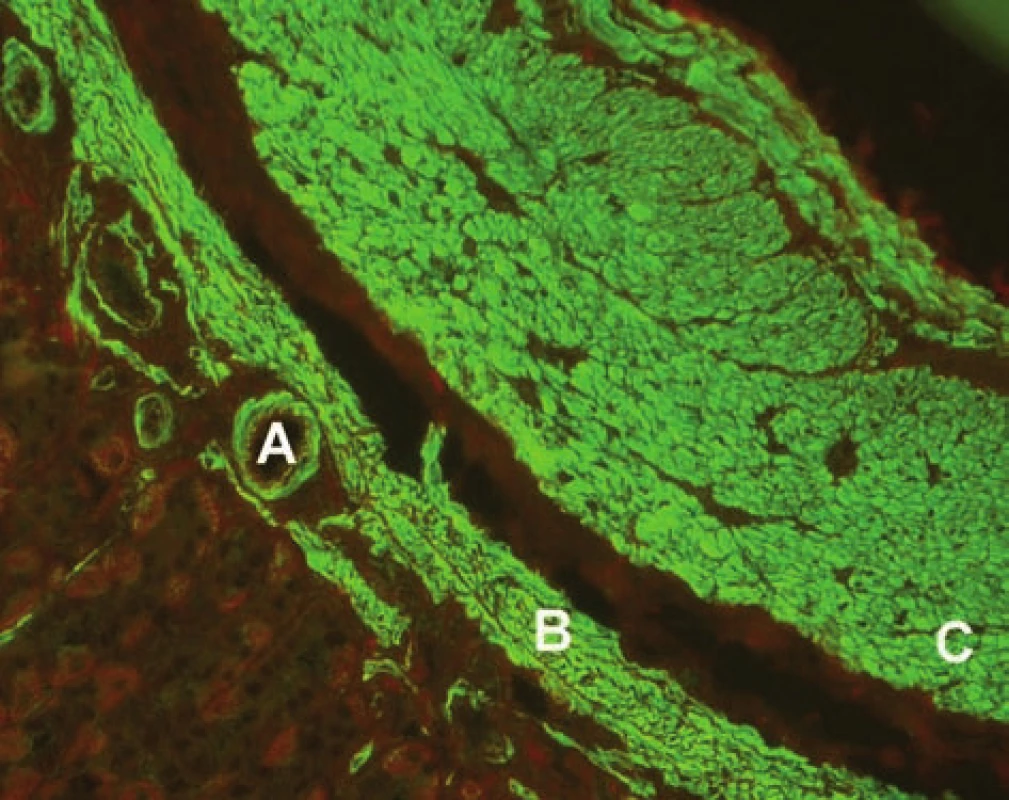
Obr. 2. Imunofluorescenční obraz protilátek proti aktinu (substrát – buněčná linie Hep-2). Fig. 2. Immunofluorescent image of anti-actin antibodies (substrate – Hep-2 cell line). 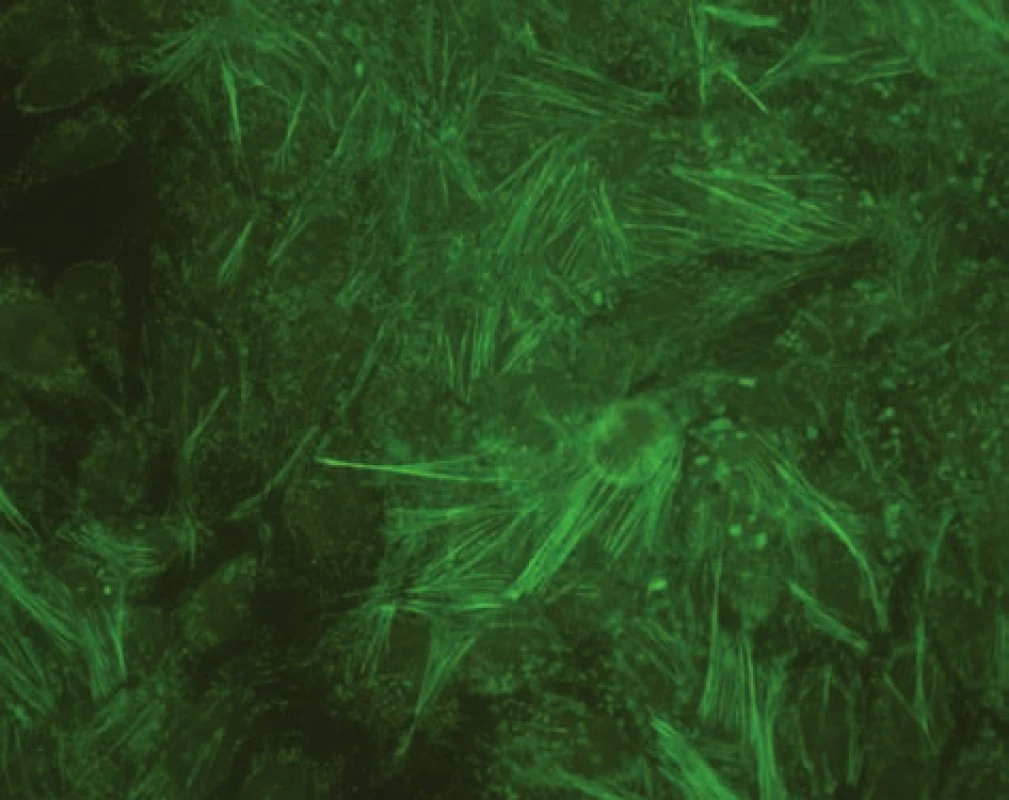
Obr. 3. Imunoflourescenční obraz antinukleárních protilátek – homogenní typ (substrát – buněčná linie Hep-2). Fig. 3. Immunofluorescent image of antinuclear antibodies – homogenous type (substrate – Hep-2 cell line). 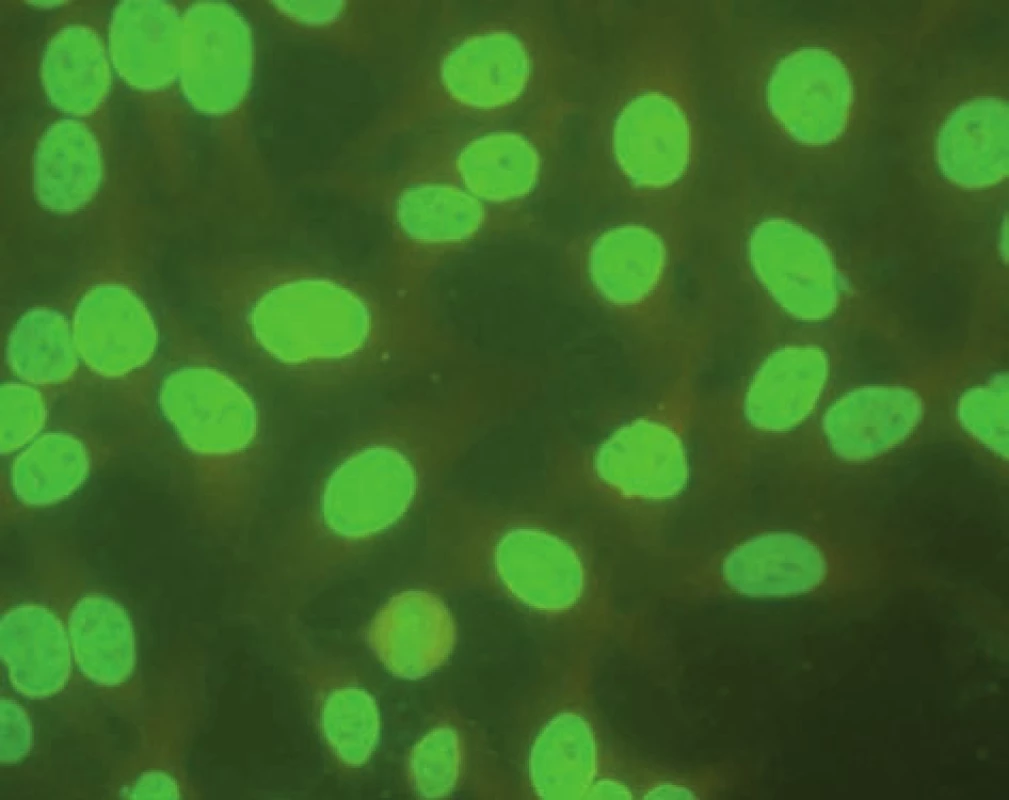
Obr. 4. Imunofluorescenční obraz ANCA protilátek perinukleárního typu na lidských granulocytech fixovaných etanolem. Fig. 4. Immunofluorescent image of anti-neutrophil cytoplasmatic antibodies of perinuclear type on human granulocytes fixed with ethanol. 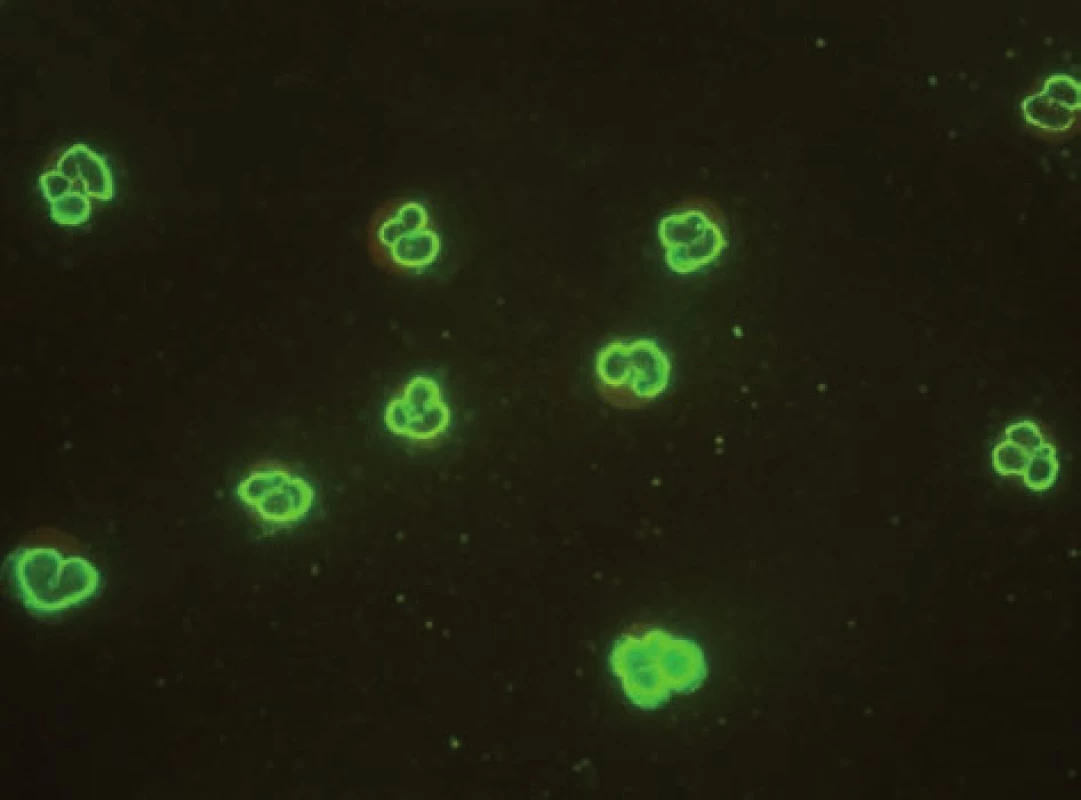
AIH 1. typu je nejčastějším typem autoimunitní hepatitidy. U dospělých představuje 80–95 % všech případů, u dětí není převaha AIH 1. typu tak výrazná (asi dvě třetiny případů). Maximum výskytu je vázáno na dvě věková období mezi 10–20 a 45–70 lety. Asi 40 % nemocných s AIH 1. typu je v době diagnózy mladší 18 let, u dětí je průměrný věk při stanovení diagnózy kolem 10 let [2, 7]. U 40 % pacientů probíhá onemocnění pod obrazem akutní hepatitidy. U 17–48 % pacientů je diagnostikováno i jiné imunopatologické onemocnění. Hypergamaglobulinémie a/nebo elevace IgG je přítomná u 85–97 % pacientů. Asi u 25–70 % nemocných je již v době diagnózy přítomna cirhóza jater.
AIH 2. typu je charakterizována přítomností protilátek proti mikrozomálním antigenům jater a ledvin 1 (anti-LKM – anti-liver kidney microsome antibody) a/nebo protilátek proti jaternímu cytosolu 1 (anti-LC – anti-liver cytosol antibody). Protilátky proti mikrozomálním antigenům jater a ledvin lze nejlépe prokázat metodou nepřímé imunofluorescence na řezech krysích jater, ledvin a žaludku (obr. 5). Tyto protilátky reagují s buňkami třetí části proximálního tubulu ledvin a s jaterní cytoplazmou, ale nikoli s parietálními buňkami žaludku. Výrazná reakce proti renálním tubulům může při imunofluorescenčním vyšetření zakrýt rozlišení mezi reakcí proti proximálnímu a distálnímu tubulu. Důsledkem je pak nesprávné hodnocení pozitivity antimitochondriálních protilátek. Důležité je proto zařazení žaludeční tkáně do vyšetřovacího algoritmu, protilátky proti mitochondriím jsou totiž dobře prokazatelné na parietálních buňkách žaludku (obr. 6). V současné době je na základě znalostí cílového antigenu dostupná a spolehlivá ELISA metoda.
Obr. 5. Imunofluorescenční obraz protilátek proti mikrozomálnímantigenůmjater a ledvin 1 (substrát – krysí játra a ledvina, A – jaterní buňky, B – proximální tubuly). Fig. 5. Immunofluorescent image of anti-liver kidney microsome antibodies 1 (substrate – rat liver and kidney, A – liver cells, B – proximal tubules). 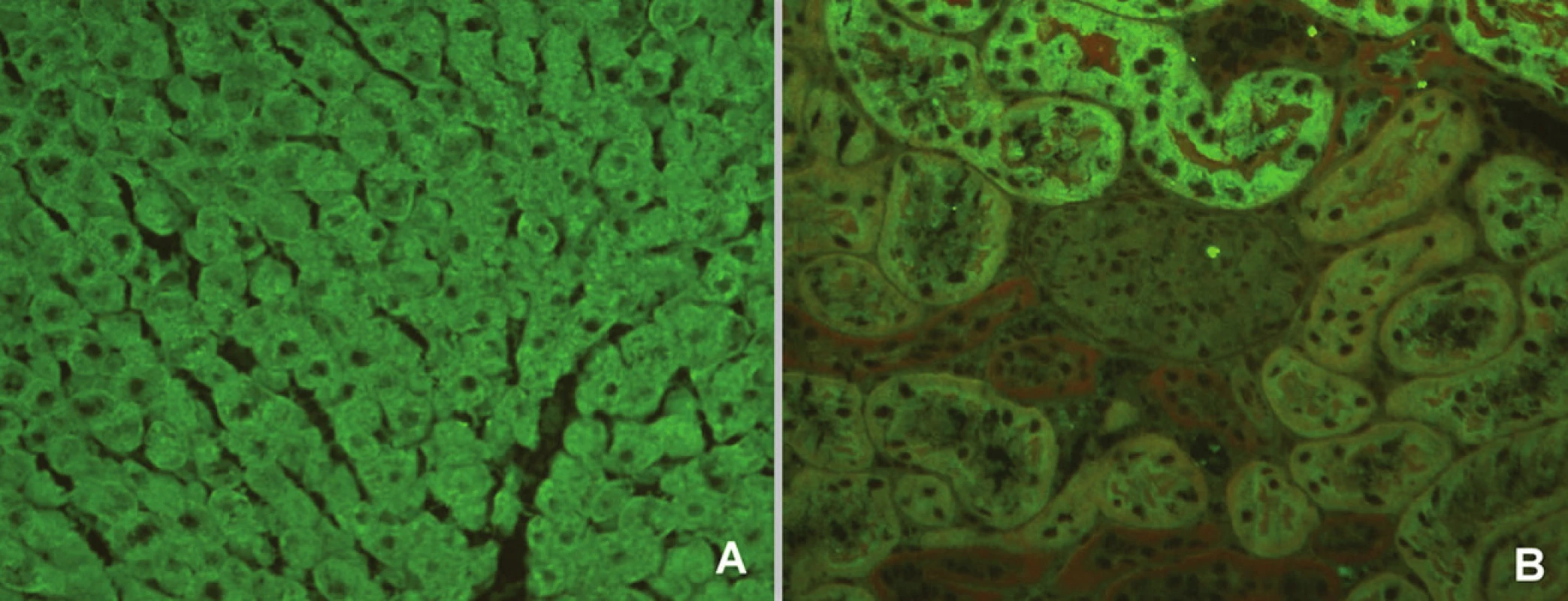
Obr. 6. Imunofluorescenční obraz antimitochondriálních protilátek (substrát – krysí játra, ledvina a žaludek, A – jaterní buňky, B – proximální a distální tubuly, C – parietální buňky žaludeční sliznice). Fig. 6. Immunofluorescent image of anti-mitochondrial antibodies (substrate – rat liver, kidney and stomach, A – liver cells, B – proximal and distal tubules, C – parietal cells of stomach mucosa). 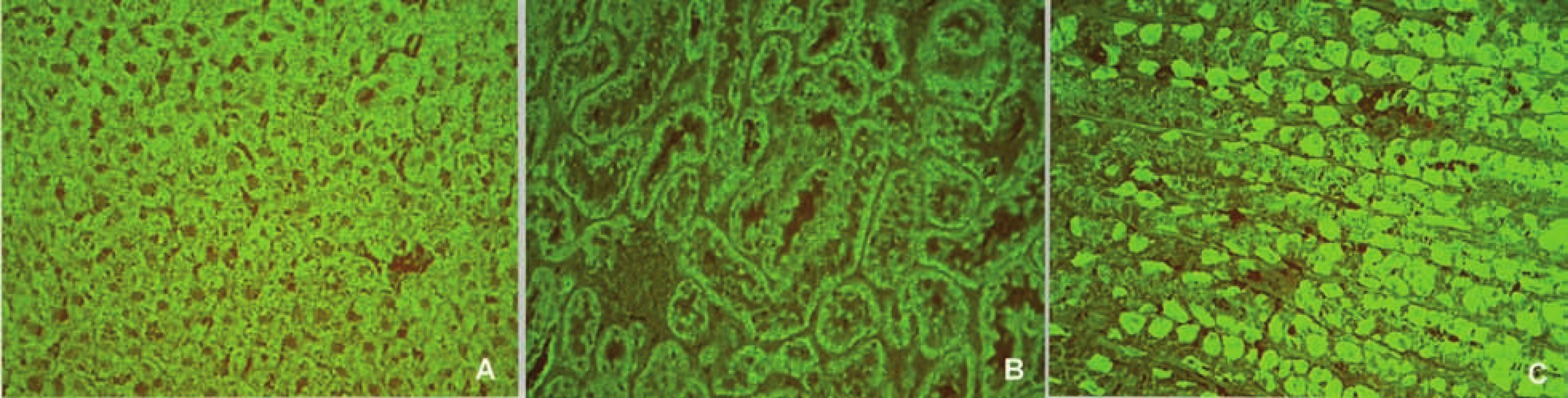
Protilátky proti jaternímu cytosolu 1 se vyskytují u nemocných s AIH 2. typu ve 30–67 %. Bylo však prokázáno, že nejsou pro AIH 2. typu zcela specifické. V klinické praxi se tyto protilátky využívají omezeně. Jejich význam spočívá především ve zpřesnění diagnostiky nejasného jaterního onemocnění zvláště u dětí, protože mohou být jedinou prokazatelnou autoprotilátkou. Prokazují se nepřímou imunofluorescencí a ELISA metodou.
AIH 2. typu se diagnostikuje u 4–20 % všech dospělých pacientů s AIH (méně v USA, více v Evropě). U dětí se AIH 2. typu vyskytuje častěji (až ve 30 % případů). Klinický i laboratorní obraz je poněkud odlišný od AIH 1. typu. Maximum výskytu AIH 2. typu spadá právě do dětského věku mezi 2–14 lety. U nemocných s AIH 2. typu je diagnóza stanovena před 18. rokem v 80 % případů, průměrný věk v době stanovení diagnózy u dětí je 6,5 roku, tj. asi o 3 roky dříve než u AIH 1. typu [2, 6]. Častější je výskyt fulminantní hepatitidy, závažného histologického nálezu jaterní tkáně, extrahepatálního imunologického onemocnění (např. vitiligo, diabetes mellitus, autoimunitní thyreoiditida, autoimunitní polyendokrinní syndrom typ 1) a je pozorována častější progrese nemoci do jaterní cirhózy (až u 82 % nemocných). V době manifestace onemocnění se naopak cirhóza jater vyskytuje oproti AIH 1. typu méně často. AIH 2. typu se tak jeví jako „více akutní“ onemocnění s předpokládaným kratším subklinickým průběhem před manifestací. V laboratorním vyšetření prokazujeme vyšší průměrnou hodnotu bilirubinu, vyšší aktivitu aminotransferáz a častější výskyt orgánově specifických autoprotilátek (proti štítné žláze, parietálním buňkám žaludeční sliznice, proti Langerhansovým ostrůvkům). Na rozdíl od AIH 1. typu jsou relativně nižší hodnoty gamaglobulinů a imunoglobulinů s častým průkazem snížené hladiny IgA v séru.
K dalším rutinně vyšetřovaným autoprotilátkám patří protilátky proti mitochondriím (AMA – anti-mitochondrial antibody) (obr. 6). Jejich přítomnost svědčí proti diagnóze autoimunitní hepatitidy, protože se jedná o laboratorní marker vyskytující se až u 95 % pacientů s primární biliární cirhózou. V nižších titrech mohou však být detekovány i u AIH [9]. Pokud je zachycen vysoký titr AMA, je nutno uvažovat o jiné diagnóze. Může jít o PBC, překryvný syndrom AIH/PBC nebo mylně interpretovanou LKM1 pozitivitu.
Existují další typy autoprotilátek, jako např. pro AIH specifické protilátky proti rozpustnému jaternímu antigenu/proti jaterní a pankreatické tkáni (anti-SLA/LP – soluble liver antigen/liver pancreas), dříve navrhované jako imunosérologický marker AIH 3. typu. Dnes jejich význam spočívá především v diagnostice nemocných se séronegativní autoimunitní hepatitidou a zvažuje se i význam prognostický (závažnější průběh v případě anti-SLA pozitivity). Cílový antigen je již známý, proto jsou k průkazu užívány komerční kity. Protilátky proti asialoglykoproteinovému receptoru se i přes svůj diagnostický a prognostický potenciál v běžné praxi nestanovují.
Histologický nález jaterní tkáně
Histologické vyšetření jaterní tkáně je nezbytné z hlediska diagnostiky a posouzení závažnosti onemocnění (grading, staging). Bioptický nález je charakterizován přítomností výrazné periportální nebo periseptální hepatitidy, tzv. „interface hepatitidy“, s převahou lymfoplazmocytárního infiltrátu – s porto-portálními či centro-portálními přemosťujícími (bridging) nekrózami nebo bez nich (obr. 7). S autoimunitní hepatitidou je spojován zvýšený počet plazmatických buněk v infiltrátu a tvorba takzvaných rozet hepatocytů (obr. 8). Zánětlivý infiltrát, který může postihnout větší část lalůčku, obvykle šetří biliární systém. Zánětlivé postižení žlučovodů diagnózu AIH nevylučuje. V sestavách pacientů s AIH se histologické změny žlučových cest vyskytují až u 30 % pacientů [2,10] (obr. 9). U většiny dětí je již při úvodním vyšetření přítomna fibróza v různém stupni vývoje, cirhóza jater je prokazatelná asi u poloviny pacientů v 36–80 % [2, 5]. Ačkoli histologický nález je u AIH charakteristický, není nálezem specifickým. Žádný morfologický nález není pro AIH patognomonický. Byly publikovány neobvyklé kazuistiky pacientů s morfologickou lézí postihující především pericentrální oblast jaterního lalůčku (zóna 3) [11]. Opakované histologické vyšetření jaterní tkáně v průběhu terapie podává nejlepší informaci o vývoji onemocnění. Zejména v pediatrii zůstává rezervováno obvykle pro pacienty, u kterých je zvažována zásadní změna terapie, včetně jejího ukončení. Je nutno brát v úvahu, že histologické změny zaostávají za biochemickým vyšetřením asi o 3 až 6 měsíců. Efekt léčby je patrný především na nekroticko-zánětlivé komponentě. Vliv léčby na fibrotickou komponentu zánětu byl také prokázán [12, 13, 14].
Obr. 7. Obraz těžké chronické aktivní hepatitidy s nápadným rozšířením portálního pole a těžkou periportální hepatitidou (výrazné piece-meal nekrózy) u 11letého chlapce s AIH 1. typu. Fig. 7. A picture of severe chronic active hepatitis with conspicuously extended portal field and severe periportal hepatitis (marked piece-meal necroses) in an 11-year boy with AIH of 1st type. 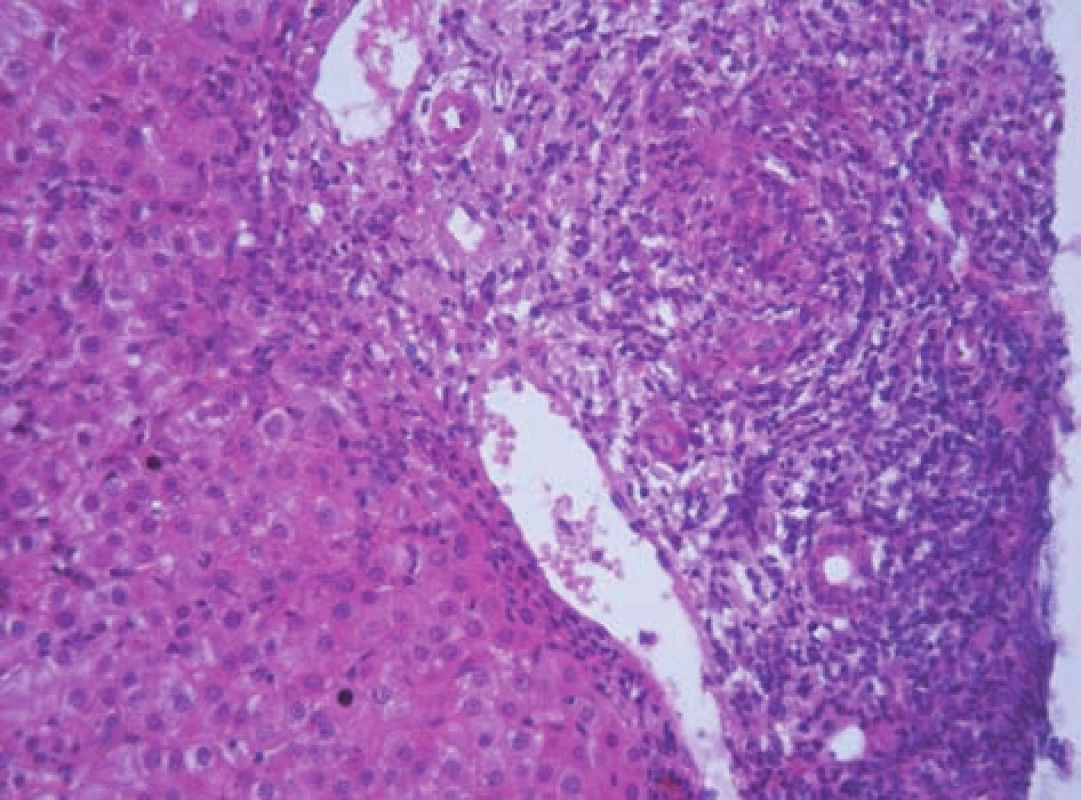
Obr. 8. A, B. Charakteristické změny pro AIH: a) přítomnost plazmatických buněk v zánětlivém infiltrátu (ozn. šipkami) v rozšířeném portálním poli, navíc známky výrazné periportální hepatitidy (obr. A). b) přítomnost tzv. rozet hepatocytů (ozn. hvězdičkou) – sekvestry částečně dystrofických jaterních buněk obklopených zánětlivým infiltrátem (obr. B). Fig. 8A, B. Changes characteristic for AIH: a) presence of plasma cells in the inflammatory infiltrate (marked with arrows) in the extended portal field; moreover there are signs of marked periportal hepatitis (Fig. A) b) presence of sc. hepatocyte rosettes (marked with asterisk) – sequesters of partly dystrophic liver cells surrounded by inflammatory infiltrate (Fig. B). 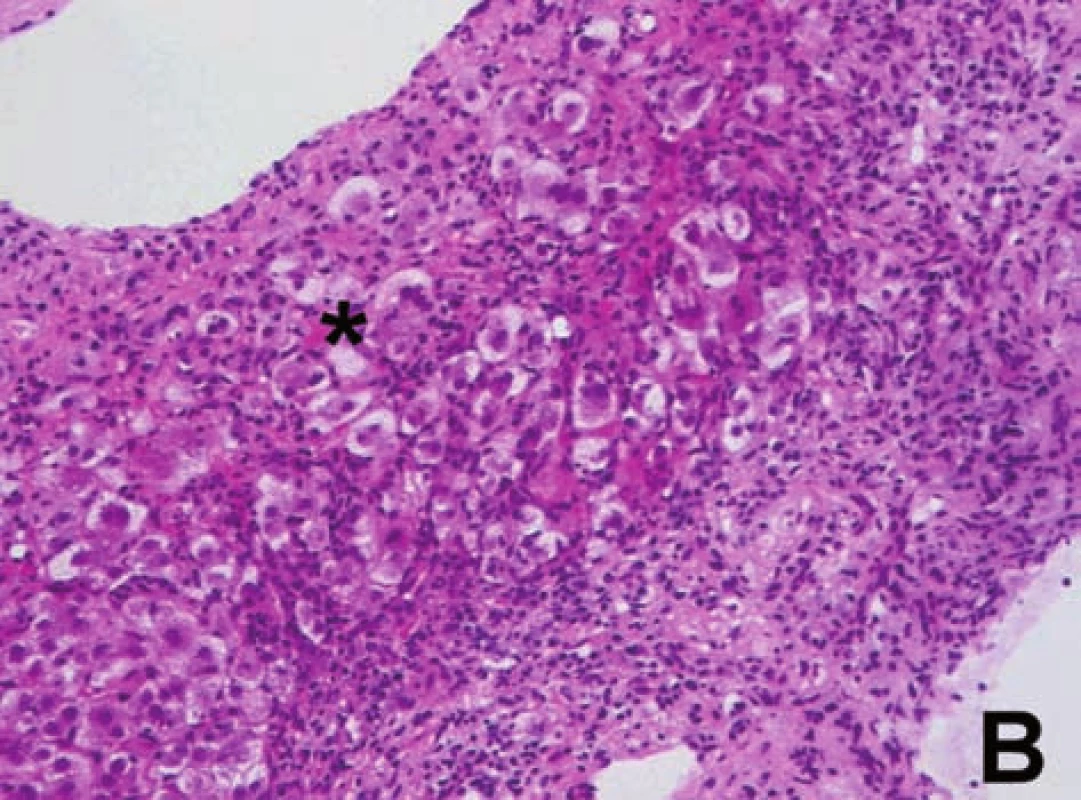
Obr. 9. Rozšířené portální pole s těžkou chronickou zánětlivou infiltrací a porušenou architektonikou interlobulárního žlučovodu charakteru lymfocytární cholangoitidy a víceřadé výstélky žlučovodu u 11letého chlapce a AIH 1. typu. Fig. 9. Extended portal field with severe chronic inflammatory infiltration and damaged architecture of interlobular bile duct of the lymphocytic cholangoitis character andmultilayer epithelium of bile duct in an 11-year boy with AIH and AIH of the 1st type. 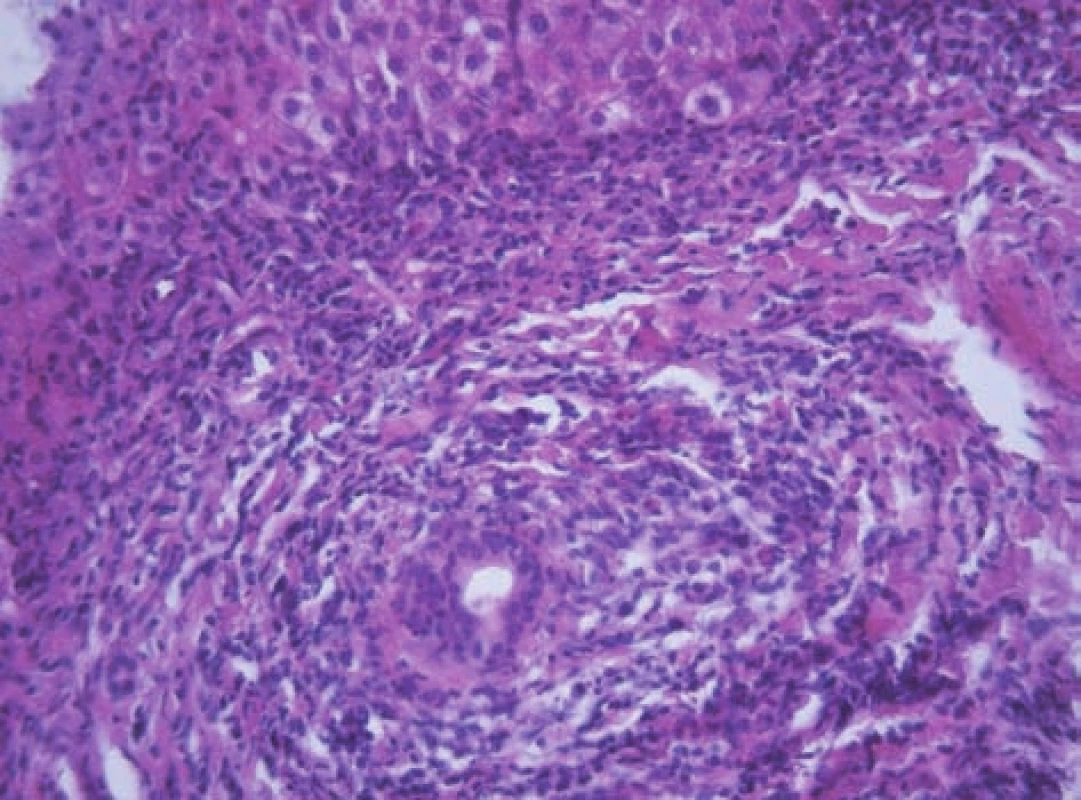
Diagnostika
Autoimunitní hepatitida je diagnostikována na základě klinických, laboratorních a histologických nálezů, které jsou pro AIH charakteristické. Neexistuje vyšetření, které by jednoznačně svědčilo pro AIH. Proto diagnostika AIH vyžaduje spolehlivé vyloučení jiných příčin jaterního onemocnění (chronická hepatitida B, C, chronická cholestatická onemocnění – PBC a PSC, Wilsonova nemoc, nealkoholická steatohepatitida, deficit alfa-1 antitrypsinu, toxické poškození jater apod.). Jelikož je symptomatologie AIH často akutní, je součástí diagnostického algoritmu vyloučení akutní infekce, především virové etiologie. V případě diferenciálně diagnostických rozpaků i po důkladné rozvaze je možno provést terapeutický test s kortikoidy [15]. Efekt léčby daný zřetelným poklesem aktivity aminotransferáz by měl být patrný během 3 měsíců. Pokud pochybnosti přetrvávají, doporučuje se pokračovat v terapii další 3 měsíce s provedením kontrolní biopsie jater.
Dříve mezi všeobecně přijímaná kritéria AIH patřila: chronicita onemocnění (trvání >6 měsíců), zvýšená hodnota aminotransferáz 3–10krát nad normu a gamaglobulinů 2krát nad normu, vysoký titr autoprotilátek (více než 1 : 40) a vyloučení jiných příčin jaterního postižení [16]. U řady nemocných je obtížné těmto kritériím vyhovět. Ve skutečnosti spektrum jaterního postižení pokrývá nemocné s asymptomatickým průběhem až po nemocné s akutní symptomatologií, někdy i s fulminantním průběhem. Jelikož počátek onemocnění je často obtížně definovatelný a oddálení léčby u závažnějších forem AIH je spjato s horší prognózou, upustilo se od dříve akceptovaného požadavku šestiměsíčního průběhu před stanovením konečné diagnózy. Dále je známo, že v době iniciální manifestace jsou hodnoty aminotransferáz zvýšené od horní hranice normy až po její padesátinásobek a že u 20 % nemocných nejsou v séru zjistitelné klasické autoprotilátky či zjevná hypergamaglobulinémie. Diagnostika může být navíc komplikována současným výskytem jiných etiologických faktorů, jako jsou virová infekce, léková toxicita či obezita.
Mezinárodní skupinou expertů byla v roce 1992 vypracována popisná kritéria a skórovací systém pro diagnostiku autoimunitní hepatitidy [16]. Podle klinických, laboratorních a histologických kritérií je diagnóza AIH jednoznačná nebo pravděpodobná. Systém byl v roce 1999 revidován, protože ve své původní verzi dostatečné neodlišoval cholestatická onemocnění jiné etiologie [17]. Doporučení bylo původně určeno pro dospělé, ale s určitými úpravami ho můžeme aplikovat i na dětskou populaci [2, 18, 19]. Jelikož na rozdíl od dospělých je přítomnost autoprotilátek u zdravých dětí vzácná, i nižší titry mohou být diagnosticky významné (≥1 : 20 pro SMA, ANA, ≥1 : 10 pro LKM1) [8]. Skórovací systém ve své revidované verzi uvádí tabulka 1. Jak je patrné, je možné skórovací systém využít nejen v době diagnostiky, ale i v průběhu léčby. Přestože má celkové skóre (≥10 bodů před léčbou) vysokou senzitivitu a specificitu (97–100 % a 89 %), pro komplikovaný výpočet se v běžné praxi nepoužívá. Proto byl nově zaveden zjednodušený bodovací systém s velmi dobrou pozitivní i negativní predikcí, který hodnotí přítomnost autoprotilátek, hodnotu IgG, histologický nález jaterní tkáně a markery virových hepatitid (tab. 2) [20]. U dětí nejsou s tímto modifikovaným bodovacím systémem dosud zkušenosti.
Tab. 1. Skórovací systém pro diagnózu autoimunitní hepatitidy (revidovaná verze) [17]. ![Skórovací systém pro diagnózu autoimunitní hepatitidy (revidovaná verze) [17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0f674244f28ff4fcd20856baf16f2387.png)
CELKOVÉ SKÓRE – před léčbou >15 jednoznačná diagnóza 10–15 pravděpodobná diagnóza během léčby >17 jednoznačná diagnóza 12–17 pravděpodobná diagnóza [Alvarez F, et al., J. Hepatol. 1999; 31: 929–938 (upraveno s ohledem na dětský věk)] Tab. 2. Zjednodušený skórovací systém pro diagnózu autoimunitní hepatitidy u dospělých [20]. ![Zjednodušený skórovací systém pro diagnózu autoimunitní hepatitidy u dospělých [20].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4aea8811d6c96c0a7a418e64ebdd1a8e.png)
Typický histologický nález = nezbytné splnění všech podmínek a) „interface“ hepatitida b) lymfocytární/plazmocytární infiltrát v portálních polích c) jaterní rozety Kompatibilní histologický nález = chronická hepatitida s lymfocytární infiltrací bez splnění všech výše uvedených podmínek CELKOVÉ SKÓRE – před léčbou ≥7 jednoznačná diagnóza 6 pravděpodobná diagnóza [Hennes EM, et al., Hepatology 2008; 48: 169–176] Léčba
Včasná a správná diagnóza následovaná bezprostředním zahájením terapie významným způsobem ovlivňuje prognózu pacientů. Podle kontrolovaných studií ze 60. a 70. let u dospělých nemocných s chronickou aktivní hepatitidou bylo patrné, že více jak polovina neléčených umírala během 3–5 let [4]. U těchto pacientů byl průběh onemocnění variabilní a nepředvídatelný, ale obvykle progresivní. Byly pozorovány rekurentní epizody exacerbace s projevy akutní hepatitidy. Pouze výjimečně došlo ke spontánní remisi onemocnění. U většiny přežívajících byl pozorován přechod z aktivní hepatitidy nebo cirhózy do inaktivní makronodulární cirhózy, kdy po mnoha letech inaktivity mohlo dojít opět k recidivě zánětlivé aktivity. Publikované údaje z 80. let mluví již o desetiletém přežití léčených pacientů v 98 %, pokud není cirhóza jater diagnostikována před zahájením léčby. Přežívání skupiny pacientů s jaterní cirhózou na počátku léčby bylo nižší (pětileté přežití je 80 % a desetileté 65 %) [15]. Podle novější studie z 90. let dospělí nemocní s jaterní cirhózou odpovídali na terapii obdobně jako pacienti bez cirhózy jater [21]. Celkové přežití všech nemocných během desetiletého sledování bylo srovnatelné s normální populací. Přežití se statisticky významně nelišilo u pacientů s cirhózou jater nebo bez ní. Z dlouhodobého hlediska však přítomnost cirhózy jater patří mezi negativní prognostické ukazatale.
Přínos a rizika léčby byly stanoveny pouze pro pacienty se závažným a progredujícím průběhem onemocnění, který je definován histologicky chronickou aktivní hepatitidou a zvýšením aktivity AST nad desetinásobek horní hranice normy nebo nad pětinásobek normy ve spojení s nejméně dvojnásobným zvýšením gamaglobulinů [15]. Také nález přemosťujících nebo multiacinárních nekróz v jaterní tkáni je jednoznačnou indikací k léčbě. Oproti tomu méně výrazné klinické, laboratorní a histologické známky aktivity onemocnění jsou spojovány s lepší prognózou a poměr přínos/riziko terapie není přesně stanoven. Většina autorit se však pro nepředvídatelný průběh onemocnění k léčbě přiklání i v těchto případech [22, 23].
U dětí nebyly kontrolované studie léčby AIH z etických důvodů již provedeny, proto se vychází ze zkušenosti s léčbou dospělých pacientů. Vzhledem k závažnému průběhu AIH je v dětském věku léčba indikována prakticky vždy [24, 25]. Je prokázána účinnost terapie samotnými kortikoidy nebo kombinované terapie kortikoidy s azathioprinem. Počáteční léčba samotným azathioprinem je neúčinná. Obvykle se léčba zahajuje prednisonem v počáteční dávce 2 mg/kg/den (maximálně 60 mg/den). Během 4–6 týdnů se dávka prednisonu postupně snižuje (o 5–10 mg/týden) za pravidelného monitorování klinického stavu a laboratorního vyšetření, především aktivity aminotransferáz. Je snahou snižovat prednison na takovou dávku, která udržuje normální hodnoty aminotransferáz. Obvykle se jedná o dávku 0,1–0,2 mg/kg/den nebo 2,5–5 mg denně. Pokud podávání samotných kortikoidů není provázeno progresivním snížením aktivity ALT nebo je ho dosaženo jen za cenu vysokých dávek kortikoidů spojených s vedlejšími účinky, je v léčbě přidán azathioprin v iniciální dávce 0,5 mg/kg/den. Postupně se jeho dávka zvyšuje během 4 týdnů do maximální dávky 2–2,5 mg/kg/den. Zkušenost s léčbou AIH u dětí je taková, že v průběhu sledování je naprostá většina nemocných (až 85 %) léčena kombinovanou terapií především pro nižší výskyt vedlejších účinků kortikoidní léčby [24]. Proto ke kombinované léčbě přistupujeme mnohdy od počátku onemocnění s výjimkou ikterických forem vzhledem k možné hepatotoxicitě azathioprinu.
V dalším průběhu je snahou dosáhnout co nejnižších dávek léků, což bývá provázeno relapsem až u 40 % nemocných, vyžadujícím přechodné zvýšení dávky kortikoidů. Významnou roli zde také hraje non-compliance v užívání léků především u adolescentů [26]. Dávkování prednisonu a azathioprinu je přísně individuální, stejně jako rychlost ve snižování dávky. Léčba by měla být podávána v dostatečné dávce po dostatečně dlouhou dobu. Dostatečná dávka je taková, která udržuje aktivitu aminotransferáz v normálním rozmezí [27]. Ačkoli je patrný výrazný pokles (o 80 %) v aktivitě aminotransferáz u většiny nemocných během šestitýdenní léčby, kompletní úprava může trvat několik měsíců. U 52 dětských pacientů byl medián normalizace aktivity ALT 6 měsíců (rozmezí 2 měsíce až 7 let) u AIH 1. typu a 9 měsíců (rozmezí 2 měsíce až 3 roky) u AIH 2. typu [2]. Délka léčby je individuální, asi u 75 % pacientů je terapie dlouhodobá, ne-li celoživotní. Uvádí se, že by léčba měla být podávána minimálně 2 až 4 roky ]3, 28, 29]. U dětí je některými autory doporučována alespoň pětiletá délka léčby [6, 7]. Pro častější riziko relapsů se nedoporučuje vysazovat léky bezprostředně před pubertou nebo v jejím průběhu. Při dlouhodobé léčbě je pro udržení laboratorní remise využívána monoterapie azathioprinem podobně jako u dospělých [30, 32]. V případě kortikodependence se obdenní terapie kortikoidy nedoporučuje a upřednostňuje se dlouhodobá léčba malými denními dávkami kortikoidů s azathioprinem. Přínos takovéto léčby převyšuje její rizika [25].
Jelikož klasická terapie je u části nemocných provázena nežádoucími účinky či nevede k remisi, bylo snahou rozšířit spektrum léčebných možností. V posledních letech jsou k dispozici výsledky úspěšné terapie cyklosporinem A na větších souborech dětí s AIH 1. i 2. typu [31, 33]. S dalšími imunosupresivy, jako je budesonid, mykofenolát mofetil, metotrexát či takrolimus, jsou zkušenosti u dětí minimální nebo žádné [34, 35, 36, 37]. Úloha kyseliny ursodeoxycholové u méně aktivních forem AIH není zcela jasná [36, 38]. Pro obvykle agresivní průběh AIH v dětském věku pravděpodobně nepřináší další výhody.
Cílem terapie je dosáhnout remise onemocnění, která je definována vymizením klinické symptomatologie, normalizací laboratorního vyšetření po dobu 1 až 2 let (normální ALT, gamaglobuliny, IgG, negativní nebo nízký titr autoprotilátek) a minimální nebo žádnou zánětlivou aktivitou při histologickém vyšetření jaterní tkáně [25]. U dětí je dosahováno remise ve více než 80 % případů. Pokud je dosaženo remise, je možné ukončení léčby. Po ukončení léčby dochází k relapsu nejméně u 50 % pacientů do šesti měsíců a u 70–80 % nemocných do tří let. V souboru 47 dětí byla splněna kritéria pro ukončení léčby u 13 pacientů (9 dětí s AIH 1. typu a 4 s AIH 2. typu). U 6 dětí přetrvávala remise 9–13 let, u ostatních včetně všech dětí s AIH 2. typu došlo k relapsu onemocnění za 1–15 měsíců od ukončení terapie [2]. U dětí s AIH 1. typu je pravděpodobnost trvalé remise bez udržovací imunosupresivní terapie asi 15–20%. V případě AIH 2. typu je indikována dlouhodobá, ne-li celoživotní udržovací terapie.¨
Prognóza
Transplantace jater (LTx) je indikována v případě akutního jaterního selhání nereagujícího na imunosupresivní léčbu nebo dekompenzace onemocnění v průběhu terapie či po jejím ukončení.
Neexistují klinické, laboratorní ani histologické nálezy, které by vylučovaly odpověď na iniciální léčbu kortikoidy a byly indikací k urgentní transplantaci jater. Proto o dalším postupu rozhoduje terapeutická odpověď. O její adekvátnosti by se mělo rozhodnout v průběhu prvních dvou týdnů léčby.
Podle literatury asi 8,5 % léčených dětí s AIH dospěje v horizontu 8 až 14 let do obrazu chronického jaterního selhání [2], v delším časovém období je předpoklad transplantace jater asi 10–20% [2, 3, 5]. Diagnóza autoimunitní hepatitidy se všeobecně podílí 2,5–5 % na celkovém počtu všech transplantací jater [24, 38]. V době stanovení diagnózy patří mezi faktory spojené s horší prognózou mladší věk, LKM1 pozitivita, vyšší hodnota INR, bilirubinu a cirhóza jater [2, 5]. V průběhu sledování pak nemožnost dosažení remise, přetrvávání zvýšené hodnoty INR a non-compliance v užívání léků [30, 39].
Po transplantaci jater se udává pětileté a desetileté přežití 83–95 %, resp. 64–75 % [40, 41, 42]. Výsledky nejsou ovlivněny délkou terapie před transplantací. Otázkou zůstává rekurence základního onemocnění v transplantátu, ke které dochází i při imunosupresivní terapii. Diagnóza rekurence AIH v jaterním štěpu není snadná. Je nutné vyloučit jiné příčiny jaterní léze, jako je např. rejekce nebo infekce. Podle literárních odkazů se rekurence vyskytuje u 0–39 % pacientů v průběhu 1–3 let po LTx [41, 42]. Úprava dávky imunosupresiva vede obvykle ke zlepšení stavu, někdy je však nutná retransplantace. Birnbaum et al. popisují u dětí neobvykle vysokou frekvenci rekurence AIH po LTx (v průměru za 11 měsíců po LTx u 5 ze 6 transplantovaných) s nutností retransplantace jater u 3 dětí. I u nich došlo k další rekurenci základního onemocnění v transplantátu vyžadující v jednom případě provedení třetí LTx [43].
Poděkování
Autor vyslovuje poděkování za laskavé poskytnutí obrazové dokumentace MUDr. M. Podholovi, Ph.D., z Fingerlandova ústavu patologie FN v Hradci Králové a RNDr. M. Drahošové z Ústavu klinické imunologie a alergologie FN v Hradci Králové. Za popisky k histologickým obrázkům jaterní tkáně děkuje MUDr. J. Nožičkovi, Ph.D.
Došlo: 31. 10. 2010
Přijato: 25. 11. 2010
MUDr. Petr Dědek, Ph.D.
Dětská klinika
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
e-mail: dedek@fnhk.cz
Zdroje
1. Krawitt EL. Autoimmune hepatitis. N. Engl. J. Med. 1996; 11 : 897–903.
2. Gregorio GV, Portmann B, Reid F, et al. Autoimmune hepatitis in childhood: a 20-year experience. Hepatology 1997; 25 : 541–547.
3. Alvarez F. Autoimmune hepatitis and primary sclerosing cholangitis. Clin. Liver Dis. 2006; 10 : 89–107.
4. Czaja AJ. Natural history, clinical features, and treatment of autoimmune hepatitis. Semin. Liver Dis. 1984; 4 : 1–12.
5. Saadah OI, Smith AL, Hardikar W. Long-term outcome of autoimmune hepatitis in children. J. Gastroenterol. Hepatol. 2001; 16 : 1297–302.
6. Maggiore G, Bernard O, Homberg JC, et al. Liver disease associated with anti-liver-kidney microsome antibody in children. J. Pediatr. 1986; 108 : 399–404.
7. Maggiore G, Veber F, Bernard O, et al. Autoimmune hepatitis with anti-actin antibodies in children and adolescents. J. Pediatr. Gastroenterol. Nutr. 1993; 17 : 376–381.
8. Vergani D, Alvarez F, Bianchi FB, et al. Liver autoimmune serology: a consensus statement from the committee for autoimmune serology of the International Autoimmune Hepatitis Group. J. Hepatol. 2004; 41 : 677–683.
9. Kenny KP, Czaja AJ, Ludwig J, et al. Frequency and significance of antimitochodrial antibodies in severe chronic active hepatitis. Dig. Dis. Sci. 1986; 31 : 705–711.
10. Czaja AJ, Carpenter HA. Autoimmune hepatitis with incidental histologic features of bile duct injury. Hepatology 2001; 34 : 659–665.
11. Misdraji J, Thiim M, Graeme-Cook FM. Autoimmune hepatitis with centrilobular necrosis. Am. J. Surg. Pathol. 2004; 28 : 471–478.
12. Czaja AJ, Carpenter HA. Decreased fibrosis during corticosteroid therapy of autoimmune hepatitis. J. Hepatol. 2004; 40 : 646–652.
13. Dufour JF, DeLellis R, Kaplan MM. Reversibility of hepatic fibrosis in autoimmune hepatitis. Ann. Intern. Med. 1997; 127 : 981–985.
14. Ferreira AR, Roquete ML, Toppa NH, et al. Effect of treatment of hepatic histopathology in children and adolescents with autoimmune hepatitis. J. Pediatr. Gastroenterol. Nutr. 2008; 46 : 65–70.
15. Maddrey WC, Combes B. Therapeutic concepts for the management of idiopathic autoimmune chronic hepatitis. Semin. Liver Dis. 1991; 11 : 248–255.
16. Johnson PJ, McFarlane IG. Meeting report: International Autoimmune Hepatitis Group Hepatology 1993; 18 : 998–1005.
17. Alvarez F, Berg PA, Bianchi FB, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J. Hepatol. 1999; 31 : 929–938.
18. Ebbeson RL, Screiber RA. Diagnosing autoimmune hepatitis in children: is the International Autoimmune Hepatitis Group scoring systém useful? Clin. Gastroenterol. Hepatol. 2004; 2 : 935–940.
19. Smolka V. Autoimunitní hepatitida – použití diagnostického skórovacího systému. Čes.-slov. Pediat. 1996; 51 : 200–202.
20. Hennes EM, Zeniva M, Czaja AJ, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology 2008; 48 : 169–176.
21. Roberts SK, Therneau TM, Czaja AJ. Prognosis of histological cirrhosis in type 1 autoimmune hepatitis. Gastroenterology 1996; 110 : 848–857.
22. Czaja AJ, Bayraktar Y. Non-classifical phenotypes of autoimmune hepatitis and advances in diagnosis and treatment. World J. Gastroenterol. 2009; 15 : 2314–2328.
23. Ishibashi H, Komori A, Shimoda S, et al. Guidelines for therapy of autoimmune liver disease. Semin. Liver Dis. 2007; 27 : 214–226.
24. Czaja AJ, Freese DK. Diagnosis and treatment of autoimmune hepatitis. Hepatology 2002; 36 : 479–497.
25. Mieli-Vergani G, Vergani D. Autoimmune paediatric liver disease. World J. Gastroenterol. 2008; 14 : 3360–3367.
26. Kerkar N, Annunziato RA, Foley L, et al. Prospective analysis of nonadherence in autoimmune hepatitis: a common proflem. J. Pediatr. Gastroenterol. Nutr. 2006; 43 : 629–634.
27. Muratori L, Muratori P, Granito A, et al. Current topics in autoimmune hepatitis. Dig. Liver Dis. 2010; Jul 6 [Epub ahead of print].
28. Manns MP. Recent developments in autoimmune liver diseases. J. Gastroenterol. Hepatol. 1997; 12: S256–S271.
29. Mieli-Vergani G, Heller S, Jara P, et al. Autoimmune hepatitis. J. Pediatr. Gastroenterol. Nutr. 2009; 4 : 158–164.
30. Banerjee S, Rahhal R, Bishop WP. Azathioprine monotherapy for maintenance of remission in pediatric patients with autoimmune hepatitis. J. Pediatr. Gastroenterol. Nutr. 2006; 43 : 353–356.
31. Alvarez F, Ciocca M, Cañero-Velasco C, et al. Short-term cyclosporine induces a remission of autoimmune hepatitis in children. J. Hepatol. 1999; 30 : 222–227.
32. Johnson PJ, McFarlane IG, Williams R. Azathioprine for long-term maintenance of remission in autoimmune hepatitis. N. Engl. J. Med. 1995; 333 : 958–963.
33. Debray D, Maggiore G, Girardet JP, et al. Efficacy of cyclosporin A in children with type 2 autoimmune hepatitis. J. Pediatr. 1999; 135 : 111–114.
34. Aw MM, Dhawan A, Samyn M, et al. Mycophenolate mofetil as rescue treatment for autoimmune liver disease in children: a 5-year follow-up. J. Hepatol. 2009; 51 : 156–160.
35. Devlin SM, Swain MG, Urbanski SJ, et al. Mycophenolate mofetil for the treatment of autoimmune hepatitis in patients refracory to standard therapy. Can. J. Gastroenterol. 2004; 18 : 321–326.
36. Strassburg CP, Manns MP. Treatment of autoimmune hepatitis. Semin. Liver Dis. 2009; 29 : 273–285.
37. Teufel A, Galle PR, Kanzler S. Update on autoimmune hepatitis. World J. Gastroenterol. 2009; 15 : 1035–1041.
38. Manns MP, Vogel A. Autoimmune hepatitis, from mechanisms to therapy. Hepatology 2006; 43: S132–S144.
39. Montano-Loza AJ, Carpenter HA, Czaja AJ. Improving the end point of corticosteroid therapy in type 1 autoimmune hepatitis to reduce the frequency of relapse. J. Gastroenterol. 2007; 102 : 1005–1012.
40. Ahmed M, Mutimer D, Hathaway M, et al. Liver transplantation for autoimmune hepatitis: a 12-year experience. Transplant. Proc. 1997; 29 : 496.
41. Chai PF, Lee WS, Brown RM, et al. Childhood autoimmune liver disease: indications and outcome of liver transplantation. J. Pediatr. Gastroenterol. Nutr. 2010; 50 : 295–302.
42. Ratziu V, Samuel D, Sebagh M, et al. Long term follow-up after liver transplantation for autoimmune hepatitis: evidence of recurrence of primary disease. J. Hepatol. 1999; 30 : 131–41.
43. Birnbaum AH, Benkow KJ, Pittman NS, et al. Recurrence of autoimmune hepatitis in children after liver transplantation. J. Pediatr. Gastroenterol. Nutr. 1997; 25 : 20–25.
Štítky
Neonatologie Pediatrie Pneumologie a ftizeologie Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2010 Číslo 12- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- Contens
- VĚCNÝ REJSTŘÍK
- Obsah
- Číslo 5: IX. český pediatrický kongres s mezinárodní účastí, Olomouc, 19.–22. 5. 2010
- Stanoviska České pediatrické společnosti respektují zvláštnosti dětského vývoje
- Unilaterální multicystická dysplazie ledvin (soubor pacientů)
- Současné postavení dynamické scintigrafie ledvin s aplikací diuretika v dětském věku
- Autoimunitní onemocnění jater v dětském věku – část I
- Infekce močových cest u dětí a dorostu, novější údaje o etiologii, diagnostice a léčbě
- Současná situace v pediatrii v Německu
- Kurzy plavání pro kojence a batolata – co by měly vědět jejich rodiny
- Správné odpovědi na kontrolní otázky k doškolovacímu článku Hamanová J., Csémy L.: Prenatální účinky alkoholu (č. 10/2010)
- Seznam čtenářů se správnou odpovědí na kontrolní otázky k doškolovacímu článku z č. 1/2010 Kolský A., Doležalová Š., Skálová S., Jiroušová K., Bébrová E., Kolská M.: Terapie infekcí močových cest u dívek v adolescentním věku
- Zpráva o XX. konferenci dětských hematologů a onkologů České a Slovenské republiky konané ve dnech 8.–10. října 2010 v Praze
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autoimunitní onemocnění jater v dětském věku – část I
- Unilaterální multicystická dysplazie ledvin (soubor pacientů)
- Současné postavení dynamické scintigrafie ledvin s aplikací diuretika v dětském věku
- Infekce močových cest u dětí a dorostu, novější údaje o etiologii, diagnostice a léčbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




