-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Patologická diagnostika nerefluxních ezofagitid
Pathology of non-reflux esophagitides
The topic of non-reflux esophagitides is partially hidden in the shadow cast by the huge and modern entity of gastroesophageal reflux disease. Histological investigation alone is often insufficient to reach the correct diagnosis without a correlation of the microscopic picture with clinical presentation, endoscopic gross appearance, personal and pharmacological history of the patient, results of hematological, serological, immunological and microbiological examinations. Due to their low-prevalence, individual types of non-reflux esophagitides are not routinely encountered in routine biopsies. Furthermore, the plethora of etiological agents present with only a limited range of reaction patterns, and thus a single histological picture may be common for more agents. Conversely, one cause may be associated with more morphological patterns. Due to these circumstances the pathological diagnostic management should follow a settled algorithm to prevent an inadequate narrowing of the histopathologist´s view. Histologic findings forming the base of this algorithm include distribution and type of inflammatory infiltrate, appearance of epithelial changes, and (in some cases) even the presence of causative agent in histological slides.
Keywords:
esophagus – esophagitis – mycotic – HSV – CMV – eosinophilic
Autoři: Ondřej Daum
; Magdaléna Dubová; Marián Švajdler
Působiště autorů: Bioptická laboratoř, s. r. o., Plzeň ; Šiklův ústav patologie LF UK a FN Plzeň
Vyšlo v časopise: Čes.-slov. Patol., 52, 2016, No. 1, p. 23-30
Kategorie: Přehledový článek
Souhrn
Problematika nerefluxních ezofagitid zůstává vzhledem k jejich relativní vzácnosti poněkud ve stínu onemocnění jícnu vyvolaného gastroezofageálním refluxem. V diagnostice často nelze dosáhnout přesného závěru pouze na základě histologického vyšetření, ale je třeba korelovat mikroskopický obraz s klinickou symptomatologií, endoskopickým makroskopickým obrazem, osobní a farmakologickou anamnézou, případně i s výsledky hematologických, serologických, imunologických a mikrobiologických vyšetření. Vzhledem k tomu, že jednotlivé typy nerefluxních ezofagitid jsou pro svou nízkou prevalenci v běžném bioptickém provozu poměrně málo zastoupeny, a projevují se omezenou škálou morfologických obrazů, přičemž ale jedna příčina může být asociována s více obrazy a naopak určitý morfologický obraz může být společný pro více etiologických agens, je nutné postupovat v diagnostice podle zažitého algoritmu, který zabrání nepřiměřeně úzkému pohledu histopatologa. Histologické znaky, které jsou součástí tohoto algoritmu zahrnují charakter zánětlivého infiltrátu, typ poškození epitelu a (v některých případech) i v histologickém řezu viditelné etiologické agens.
Klíčová slova:
jícen – ezofagitida – mykotická – HSV – CMV – eozinofilní
Přestože převážná většina zánětů jícnu je způsobena gastroezofageálním refluxem, v diagnostické praxi je nutné počítat i s možností některé ze vzácnějších příčin ezofagitid. Etiologická klasifikace ezofagitid (tab. 1) je sice přehledná, ale neodráží přístup histopatologa k diagnostice založený primárně na hodnocení obrazu postižení jícnu. Histologické vyšetření v prvé řadě umožňuje rozpoznání zánětlivé povahy onemocnění, zhodnocení povahy zánětlivého infiltrátu, tkáňového (především epitelového) poškození, případně i detekce etiologického agens. V různé míře je pak užitečné až nezbytné zohlednit i výsledky dalších diagnostických metod, ať už laboratorních nebo klinických. V žádném případě nelze tyto informace od kolegů z jiných oborů ignorovat (obr. 1). Na prvním místě diagnostického algoritmu stojí většinou převažující typ zánětlivého infiltrátu (vzhledem k povrchovosti endoskopicky odebraných vzorků je převážně možné hodnotit pouze intraepiteliální infiltrát), na jehož základě se lze zaměřit na další znaky, jejichž analýza vede k zúžení diferenciální diagnózy, případně umožní přímo diagnostikovat specifickou nozologickou jednotku (obr. 2). V souladu s tímto přístupem v následujícím textu uvedeme přehled nejdůležitějších morfologických obrazů a diagnostických jednotek, přičemž se z praktických důvodů nebudeme detailněji věnovat refluxní ezofagitidě, která má svou vlastní problematiku, a postižení jícnu při systémových onemocněních pojiva a vaskulitidách, při nichž je role patologa v diagnostice značně limitována, ať už pro jejich obecně nespecifický morfologický obraz nebo kvůli faktu, že endoskopicky získaný materiál je většinou tvořen pouze dlaždicovým epitelem s minimem subepiteliálního stromatu.
Tab. 1. Základní typy ezofagitid (kromě refluxní ezofagitidy a systémových onemocnění). 
Volně podle (16,17) Obr. 1. Souhrn vztahu histologického vyšetření a dalších diagnostických metod v diagnostickém algoritmu. 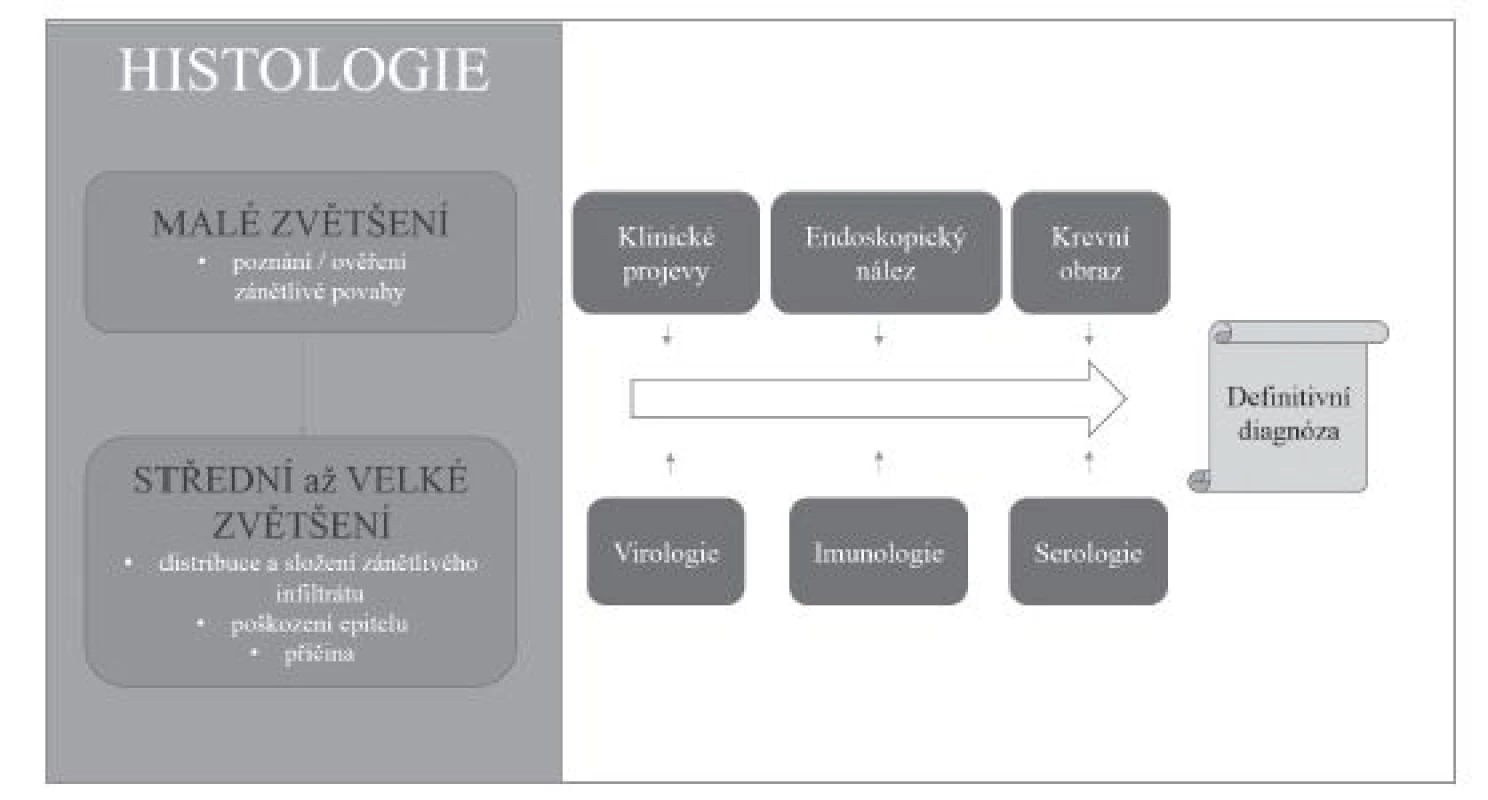
Obr. 2. Vztah typu dominantního zánětlivého infiltrátu k hlavním typům ezofagitid. 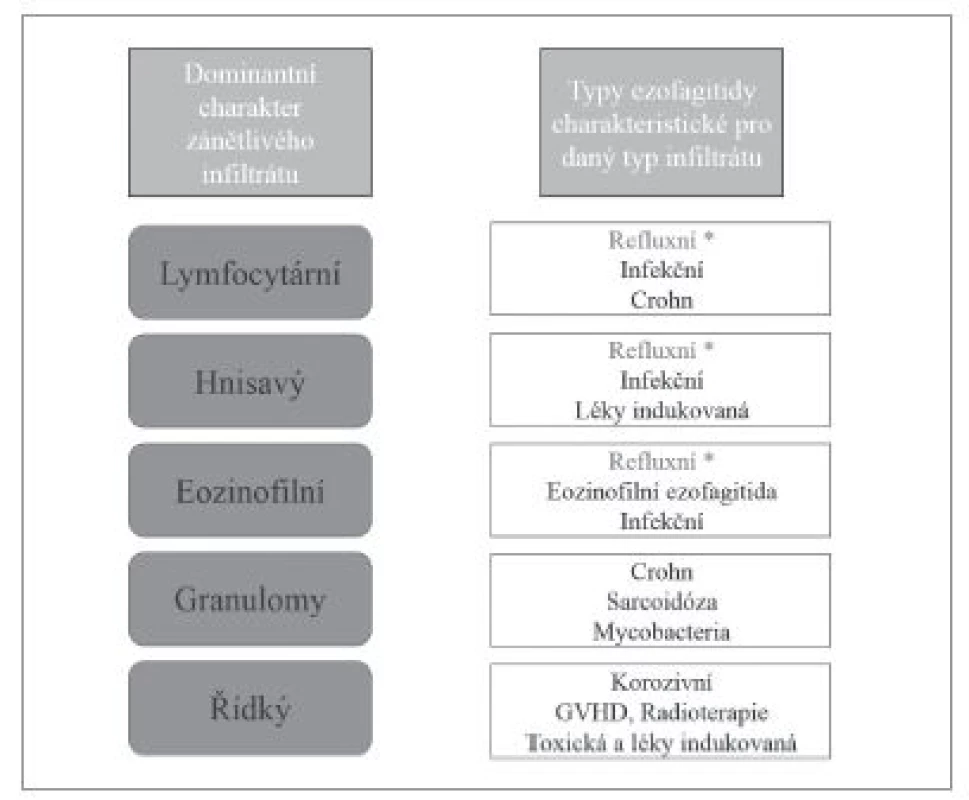
* - problematika refluxní ezofagitidy je mimo záměr tohoto článku. 1. PŘEVAŽUJÍCÍ LYMFOCYTÁRNÍ ZÁNĚTLIVÝ INFILTRÁT
Absolutně nejčastější příčinou přítomnosti lymfocytů v dlaždicovém epitelu jícnu je gastroezofageální reflux. Lymfocyty jsou často doprovázeny neutrofilními a eozinofilními granulocyty. Diagnózu refluxní ezofagitidy z histologického hlediska významně podporuje přítomnost kolumnární sliznice (CLE) v materiálu, diagnostickou jistotu může dále posílit ještě korelace s klinickými údaji (obr. 3).
Obr. 3. Diferenciální diagnostika ezofagitid s dominantním lymfocytárním typem zánětlivého infiltrátu. Eos – příměs eozinofilních granulocytů, Neus – příměs neutrofilních granulocytů, CLE – kolumnární metaplázie sliznice jícnu (columnar-lined esophagus, CLE). 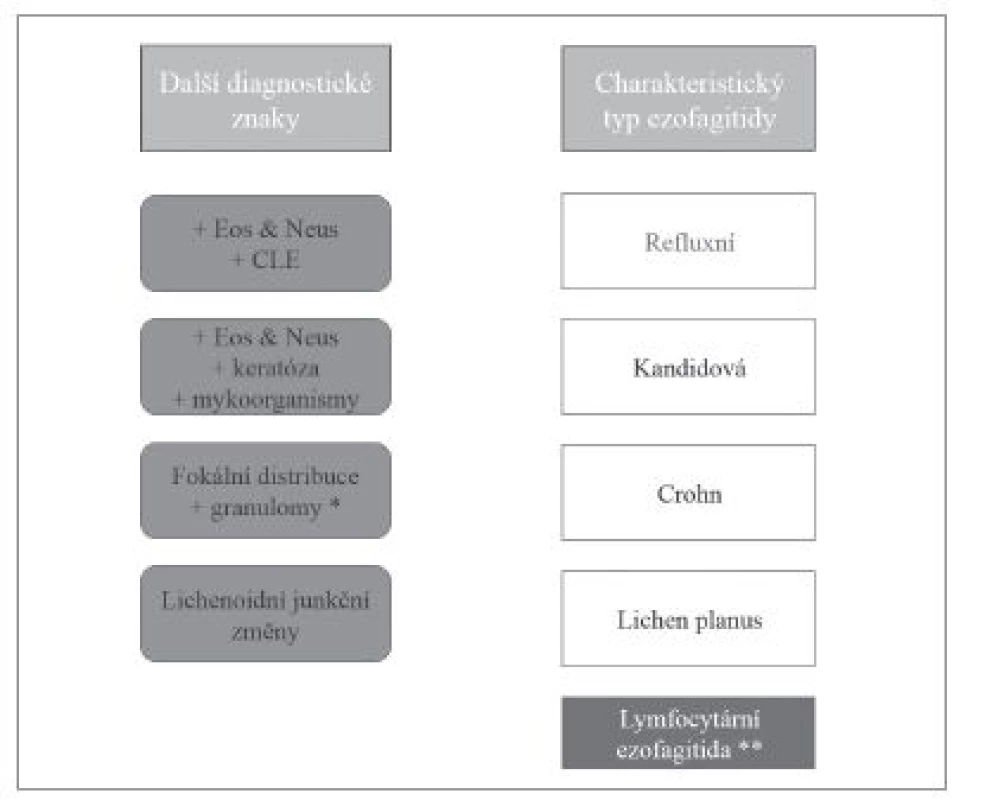
* - problematika výskytu granulomů při postižení jícnu Crohnovou chorobou diskutována v textu, ** - diagnostické znaky lymfocytární ezofagitidy uvedeny v textu. Je-li v epitelu příměs eozinofilních a neutrofilních granulocytů výraznější, zejména v odlučujících se skupinách rohovějících buněk, měl by patolog zaměřit svou pozornost na přítomnost pseudohyf a/nebo blastokonidií, jejichž rozpoznání je snadnější v barvení PAS, a které v našich podmínkách a v jícnové lokalizaci svědčí zejména pro kandidovou ezofagitidu způsobenou druhem Candida albicans.
Při signifikantně fokální distribuci lymfocytárního infiltrátu, zejména v asociaci s přítomností epiteloidních granulomů (jejichž problematice a zejména problémovosti jejich detekce v biopsiích jícnu se budeme věnovat níže), hlavně u dětských pacientů je nutné zvážit možnost postižení jícnu Crohnovou chorobou (obr. 4).
Obr. 4. Postižení jícnu Crohnovou chorobou. V biopsii je zastižena pouze mírná ložisková lymfocytární infiltrace dlaždicového epitelu a subepiteliálního stromatu s ojedinělými neutrofily je zcela nepříznačná (A) (HE, 400x), v biopsii z distálního ilea však byly zastiženy charakteristické změny i s epiteloidními granulomy (B) (HE, 400x). 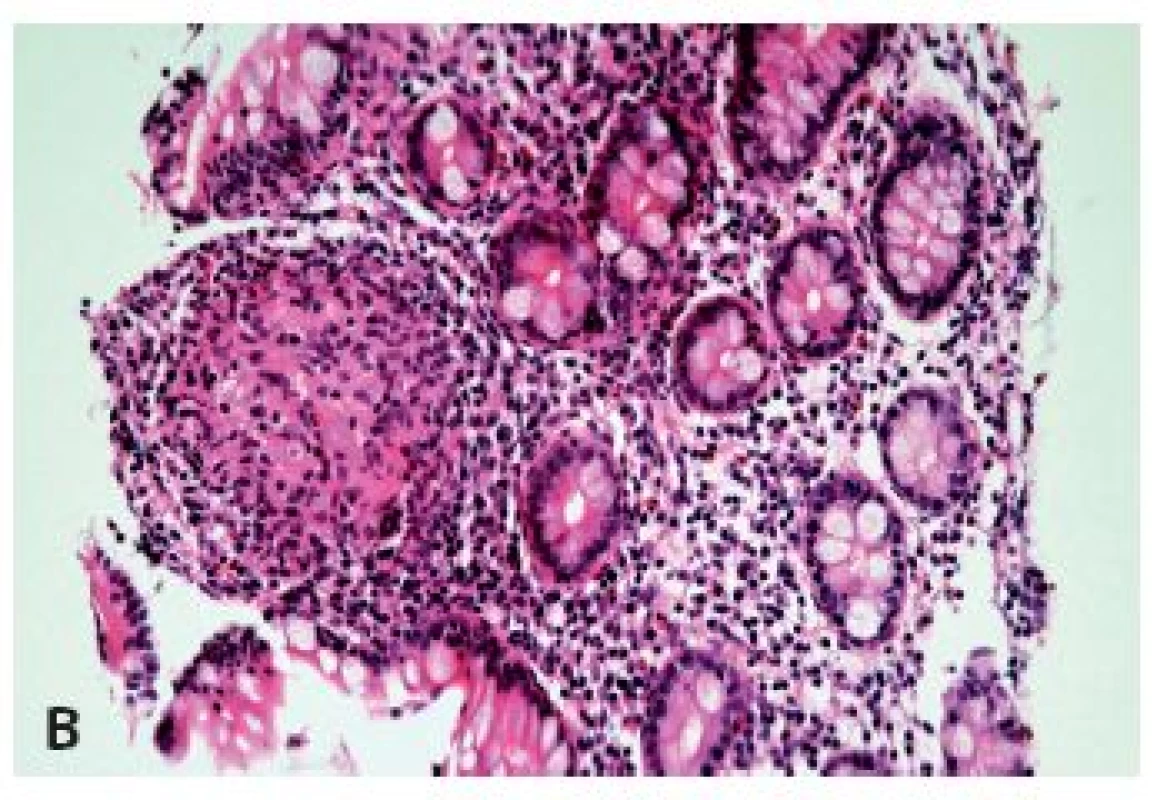
Má-li lymfocytární infiltrát tzv. lichenoidní charakter, tedy postihuje - li ve vágně ohraničeném pruhu bazální vrstvy epitelu a přilehlou povrchovou proprii jícnu, měl by vzbudit podezření na možnost ezofageálního lichen planus nebo lichenoidní reakce. Lichen planus v jícnu je histologicky blízký častější orální prezentaci, na rozdíl od kožního lichen planus tedy vykazuje spíše známky parakeratózy než hyperortokeratózy, postrádá hypergranulózu, a namísto akantózy lze častěji pozorovat atrofii epitelu. „Pilovitá“ transformace reliéfu junkce nebývá tak výrazná jako v kůži, i zde se však vyskytují disperzní nekrotické keratinocyty (Civattova tělíska). Postiženy jsou převážně starší ženy, poměrně často mají zároveň i postižení orální sliznice. Nutné je, podobně jako v orální lokalizaci, vyloučit lichenoidní reakci, hlavně farmakologicky navozenou (což je samozřejmě spíše úkolem klinika, povinností patologa by však mělo být tuto možnost zmínit v histologické diagnóze). Dále se morfologicky obdobné změny mohou vyskytovat v blízkosti ulcerací různé etiologie (1).
Z praktického hlediska značně nešťastnou jednotkou je poměrně nová diagnostická kategorie lymfocytární ezofagitida. Definována je jako přítomnost zvýšeného počtu intraepiteliálních lymfocytů, zejména v peripapilární oblasti, a to bez příměsi neutrofilních a eozinofilních granulocytů, doprovázená spongiózou. Problémy s touto diagnózou jsou však na všech úrovních, počínaje nejistotou ohledně hraničního počtu intraepiteliálních lymfocytů (podle různých autorů se tato hranice pohybuje mezi 20 a 50 lymfocyty na zorné pole velkého zvětšení). Klinicky se může projevovat škálou příznaků, mezi něž patří zejména dysfagie, bolesti břicha nebo pálení žáhy, endoskopický obraz pak může být normální, může odpovídat Barrettovu jícnu, případně se mohou vyskytovat i slizniční prstence a rýhy, které jsou jinak spojovány s eozinofilní ezofagitidou. Znepokojující je také fakt, že obraz lymfocytární ezofagitidy doprovází celou řadu stavů, což značně snižuje přínos této diagnózy. U dětí je nejčastěji asociována s Crohnovou chorobou, u dospělých s gastroezofageálním refluxem. Dále však byla popsána v souvislosti s různými imunopatologickými onemocněními, infekčními chorobami, infekcí Helicobacter pylori, celiakií a při achalázii (2-4).
2. PŘEVAŽUJÍCÍ HNISAVÝ ZÁNĚTLIVÝ INFILTRÁT
Stejně jako v případě převažujícího lymfocytárního zánětlivého infiltrátu, tak i při nálezu signifikantní infiltrace neutrofilními granulocyty (většinou v kombinaci s lymfocyty a eozinofilními granulocyty, zejména za přítomnosti CLE) je nejčastější příčinou gastroezofageální reflux (obr. 5). Přítomnost shluků keratinizovaných epitelií v asociaci s tímto typem infiltrátu zase nejspíš svědčí pro kandidovou ezofagitidu (obr. 6). Kandida však často kolonizuje preexistující vředy nebo poškozenou sliznici a proto je nutné pamatovat na možnost jiné primární patologie.
Kromě těchto dvou banálních jednotek je však hnisavým obrazem charakterizováno ještě několik vzácnějších a z pohledu patologa zajímavějších jednotek. V prvé řadě to jsou virové ezofagitidy, k jejichž diagnóze může přispět jednak klinická informace o podezření z virové etiologie (založeném na klinickém obraze, přítomnosti snížení imunity nebo serologickém nálezu), jednak v některých případech nález virových inkluzí.
Herpetická (HSV) ezofagitida se vyskytuje nejčastěji u novorozenců a malých dětí či imunosuprimovaných dospělých, ale k rozvoji ezofagitidy může dojít při reaktivaci infekce i u imunokompetentních jedinců. Projevuje se akutně vzniklou odynofagií a bolestmi na hrudi doprovázenými zvýšenou teplotou, přičemž v jícnu, zejména v jeho distální polovině, se tvoří puchýře měnící se v ohraničené vředy, které při nepříznivém průběhu splývají, případně v těžkých případech může probíhat pod obrazem hemoragické ezofagitidy. Z histologického hlediska je nejdůležitější průkaz Cowdryho intranukleárních eozinofilních inkluzí typu A v epitelových buňkách s matnicovými jádry s marginální kondenzací chromatinu a vícejaderných epitelových buněk s objemnou eozinofilní cytoplazmou v okraji ulcerace (obr. 7). Ne vždy však musí být přítomny diagnostické inkluze a onemocnění se může manifestovat pouze balónovitou degenerací dlaždicových epitelií a mononukleárním infiltrátem s příměsí neutrofilních granulocytů (obr. 8). Zlatým standardem potvrzení morfologické diagnózy je molekulárně genetický průkaz HSV (5).
Obr. 5. Diferenciální diagnostika ezofagitid s dominantním hnisavým typem zánětlivého infiltrátu. Eos – příměs eozinofilních granulocytů, Lys – příměs lymfocytů, CLE – kolumnární metaplázie sliznice jícnu (columnar-lined esophagus, CLE). 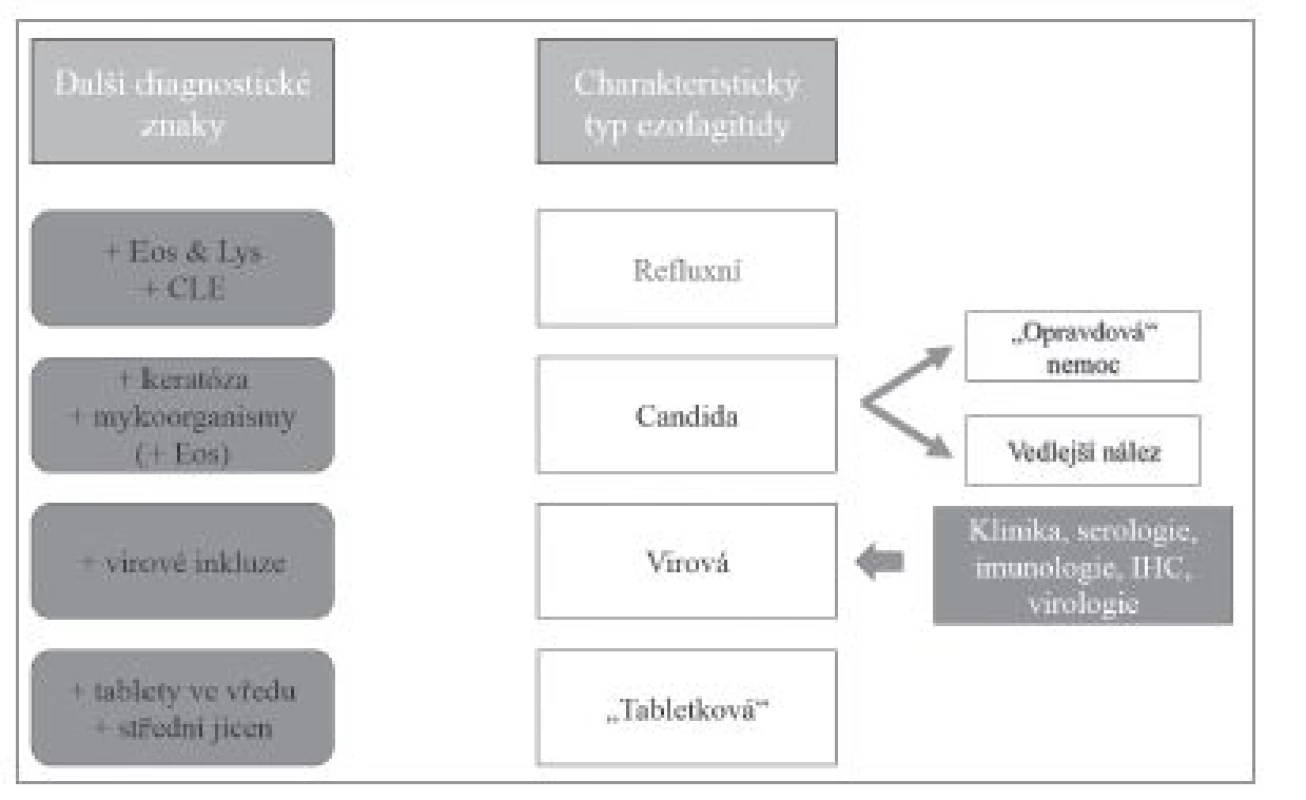
Obr. 6. Kandidová ezofagitida. Hnisavý zánětlivý infiltrát téměř překrývá útržky keratinizujícího dlaždicového epitelu a mykotické pseudohyfy (A) (HE, 400x), které však mohou být zvýrazněny barvením PAS (B) (PAS, 400x). Přítomnost pseudohyf svědčí spíše pro primární kandidovou ezofagitidu než pro sekundární kontaminaci léze jícnu jiného původu. 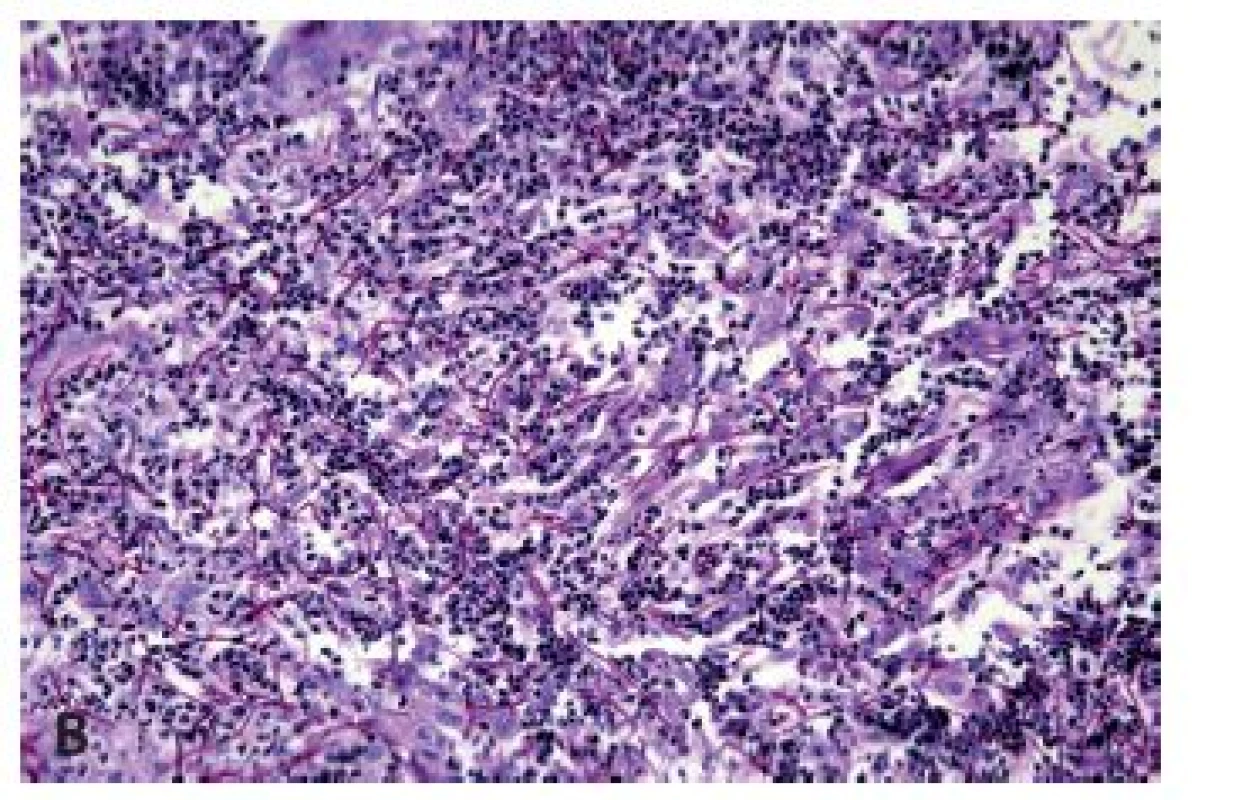
Obr. 7. Herpetická ezofagitida. Diagnosticky nejdůležitějšími znaky jsou obrovské vícejaderné buňky (modrá šipka) a intranukleární inkluze Cowdry A (zelené šipky) (HE, 400x). 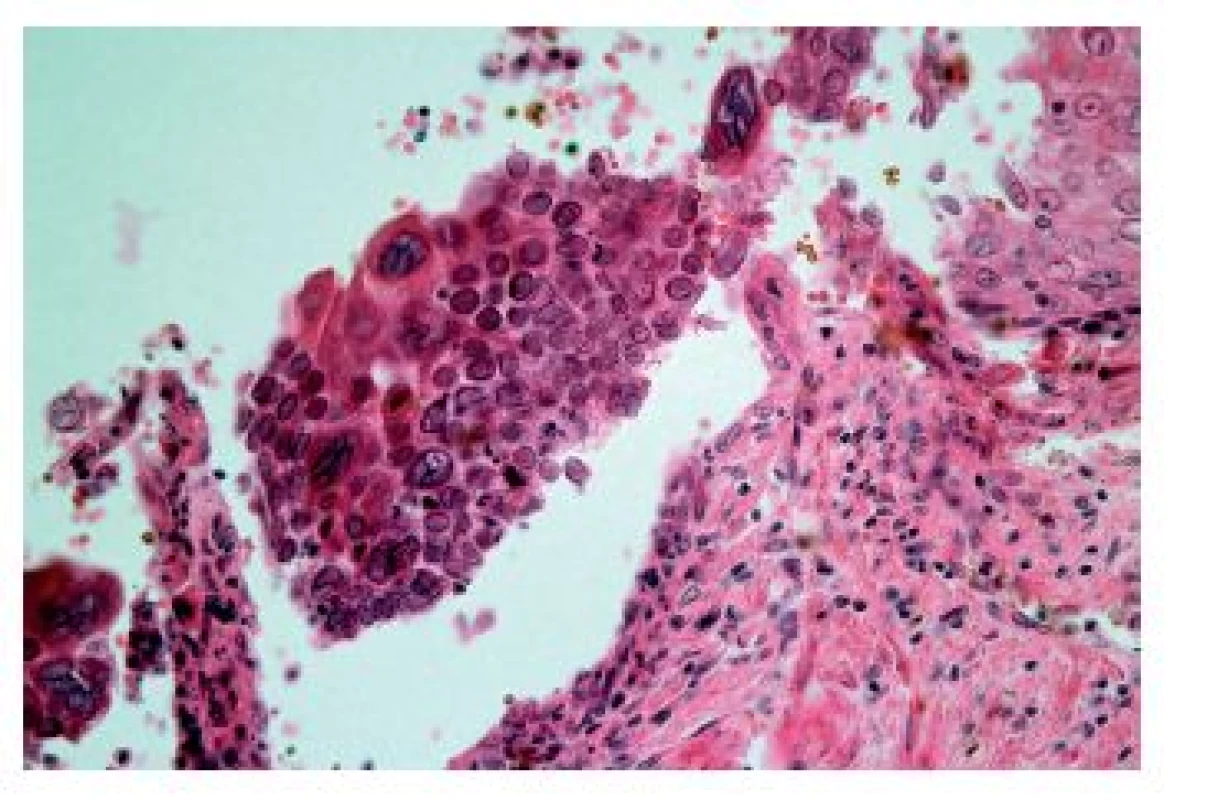
Obr. 8. Herpetická ezofagitida. V některých případech HSV ezofagitidy nemusí být charakteristické inkluze zastiženy a onemocnění se prezentuje pouze balónovitou degenerací epitelií a zánětlivým infiltrátem s různým poměrem lymfocytů a eutrofilů (HE, 400x). 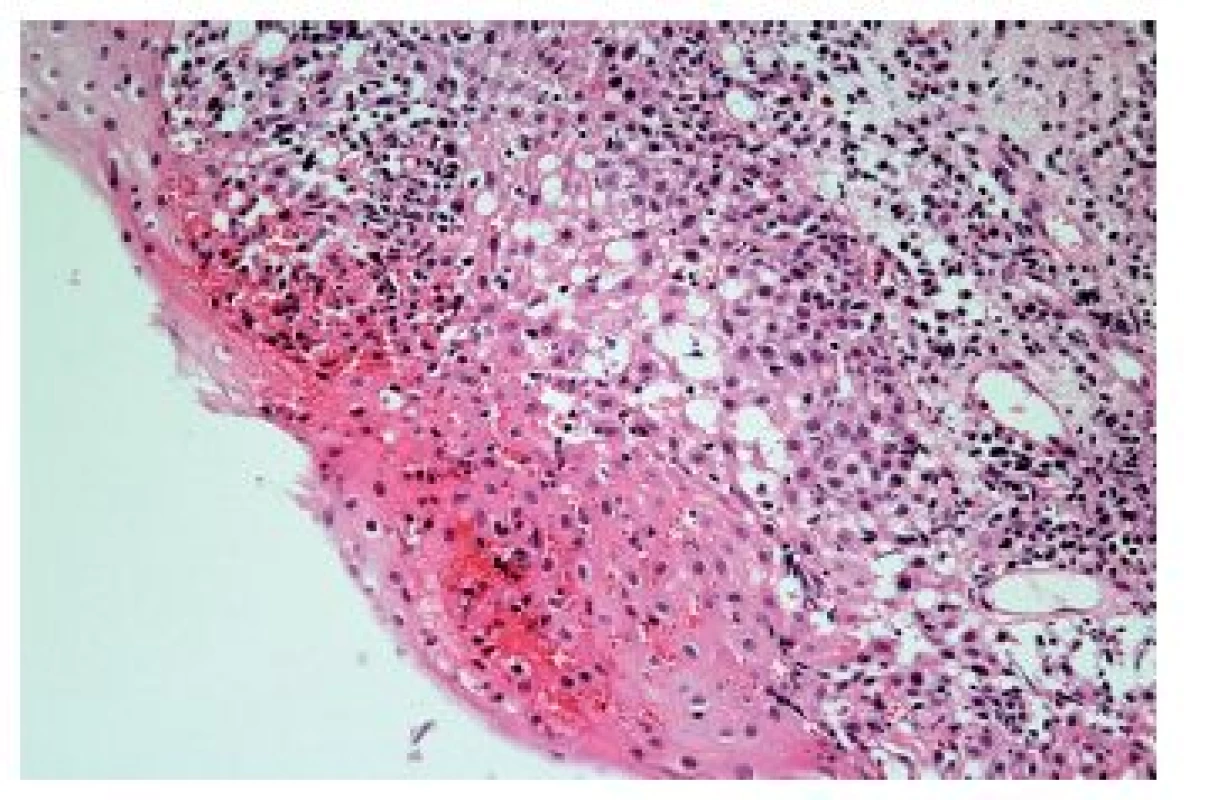
Častěji se lze setkat s cytomegalovirovou (CMV) ezofagitidou, a to zejména u osob sešlých věkem nebo těžkým chronickým onemocněním a samozřejmě u imunosuprimovaných pacientů. Klinické příznaky jsou poměrně nespecifické, endoskopicky jsou většinou patrné mělké vředy v distálním jícnu, v jejichž stěně lze nalézt diagnostické inkluze. Na rozdíl od herpetických inkluzí jsou však lokalizovány především v myofibroblastech, endoteliích a makrofázích. Dobře patrné jsou hlavně intranukleární eozinofilní inkluze, zatímco cytoplazmatické bazofilní inkluze jsou poměrně diskrétní (obr. 9). V epitelových buňkách se sice inkluze vyskytovat mohou, ale spíše lze zastihnout pouze nespecifické reaktivní změny epitelií a intraepiteliální smíšený zánětlivý infiltrát (obr. 10). Inkluze nemusí být přítomny u všech pacientů ani ve všech biopsiích od jednoho pacienta. V těchto případech může podezření vzbudit ložisková akumulace makrofágů v exsudátu a/nebo granulační tkáni (6), i když tento znak byl popsán i u ezofagitidy herpetické (7). Ověřit etiologii lze imunohistochemicky nebo molekulárně geneticky. Senzitivita obou metod je srovnatelná, pozitivita je (stejně jako přítomnost virových inkluzí) většinou limitována na stěnu ulcerací a jejich bezprostřední okolí (8).
Obr. 9. Cytomegalovirová ezofagitida. Charakteristické intranukleární eozinofilní (modrá šipka) a méně nápadné intracytoplazmatické bazofilní inkluze se nacházejí zejména v endoteliích, myofibroblastech a makrofázích ve spodině ulcerací (HE, 800x). 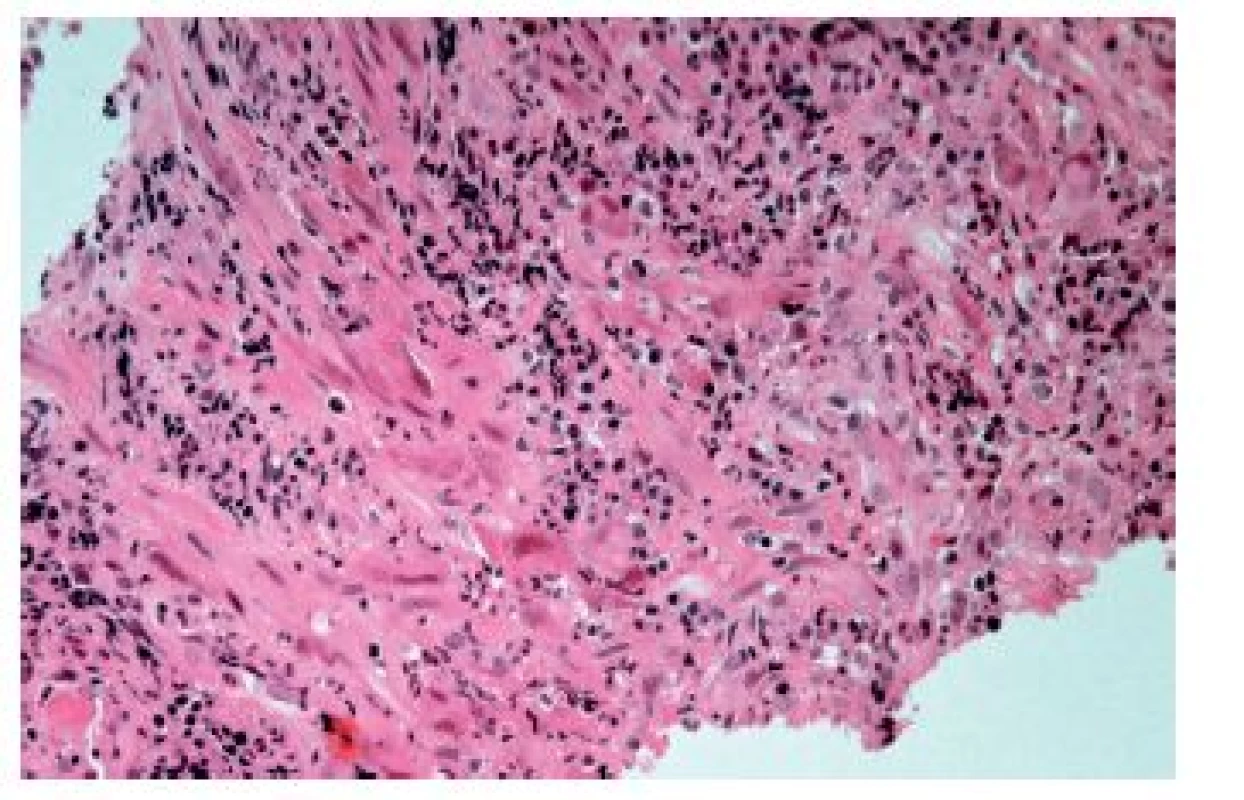
Obr. 10. Cytomegalovirová ezofagitida. V dlaždicovém epitelu však inkluze nemusí být patrné a lze pak zastihnout pouze známky alterace a zánětlivý infiltrát (HE, 800x). 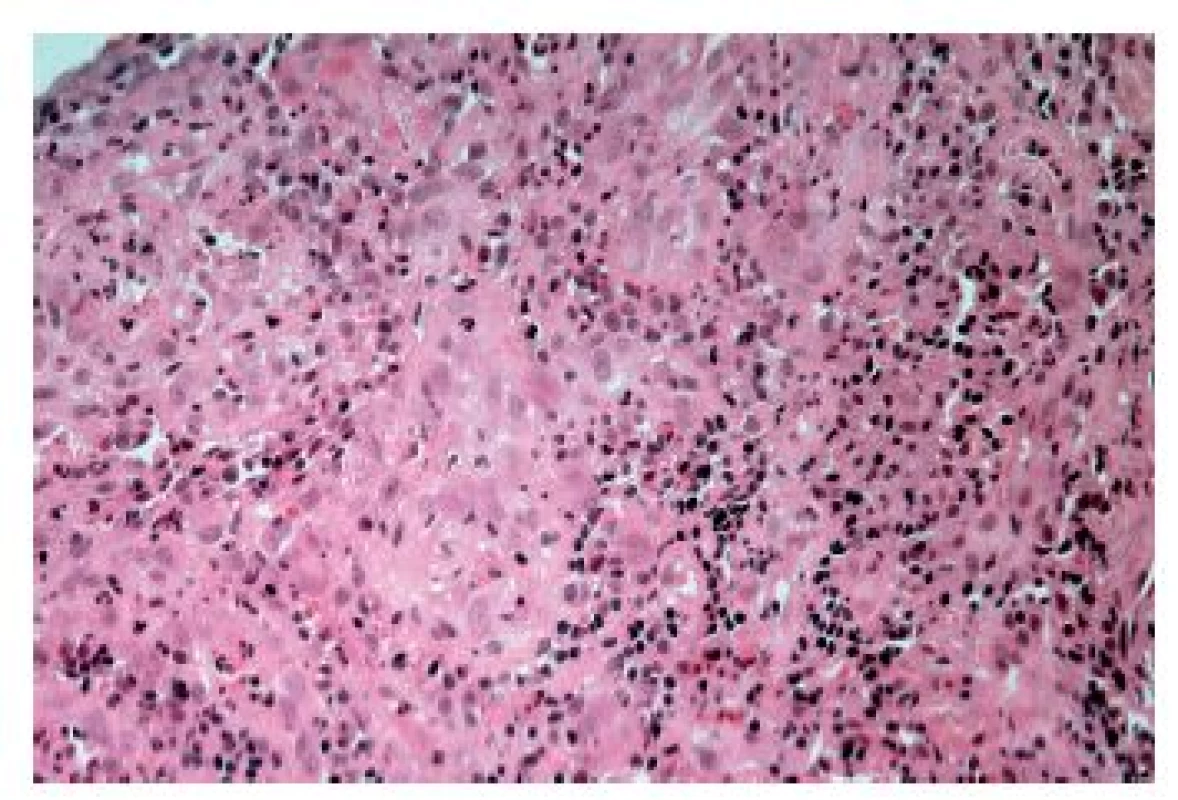
Konečně lze obraz ezofagitidy s převahou hnisavého zánětlivého infiltrátu nalézt ve stěně ulcerací vyvolaných topickým efektem farmak (tzv. „pill esophagitis“ neboli „tabletková ezofagitida“). Při ní je ulcerace většinou lokalizována ve středním jícnu, což pravděpodobně souvisí se vztahem jícnu k průdušnici a tím pádem i k relativně nejvyšší možnosti „uváznutí tabletky“. Nejčastěji poškození jícnu vyvolává doxycyklin, preparáty železa a alendronát. Ne vždy ale musí být tento obraz podmíněn skutečnými tabletkami. Roztok polystyren sulfonátu sodného (kayexalát, rezonium) používaný jako iontoměnič k terapii hyperkalémie může způsobit jícnové ulcerace s charakteristickými krystaly (obr. 11). Ty jsou sice cenným histopatologickým znakem, ale samotné ulcerace jsou ve skutečnosti způsobeny roztokem sorbitolu, v němž je kayexalát rozpuštěn (9).
Obr. 11. Krystaly rezonia v ulceraci jícnu. Silně bazofilní polyedrické krystaly rezonia jsou dokladem poškození sliznice sorbitolem, který je součástí roztoku tohoto intoměniče (HE, 400x). 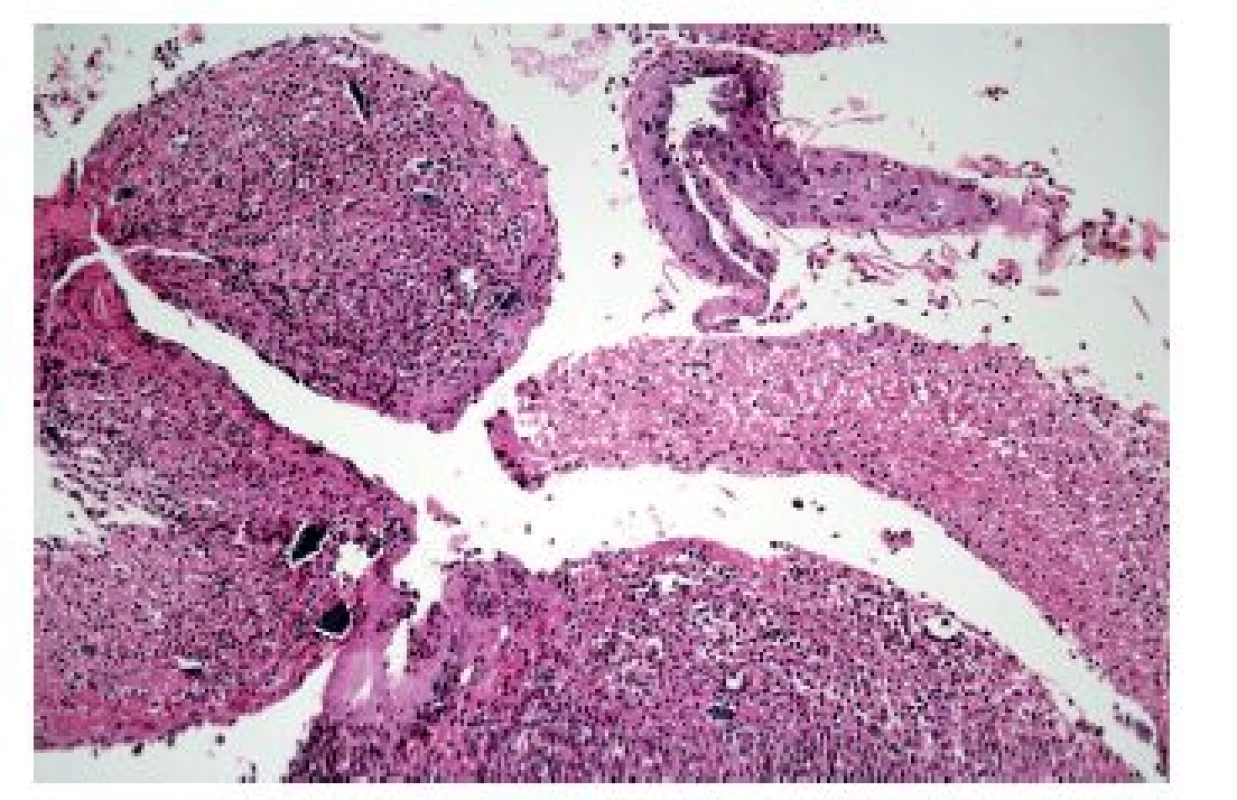
3. PŘEVAŽUJÍCÍ EOZINOFILNÍ ZÁNĚTLIVÝ INFILTRÁT
Výrazná účast eozinofilních granulocytů v zánětlivém infiltrátu bývá u některých již uvedených jednotek jako refluxní ezofagitidy, kandidové ezofagitidy, virových ezofagitid nebo Crohnovy choroby (obr. 12).
Obr. 12. Diferenciální diagnostika ezofagitid s dominantním eozinofilním typem zánětlivého infiltrátu. Neus – příměs neutrofilních granulocytů, Lys – příměs lymfocytů, CLE – kolumnární metaplázie sliznice jícnu (columnar-lined esophagus, CLE). 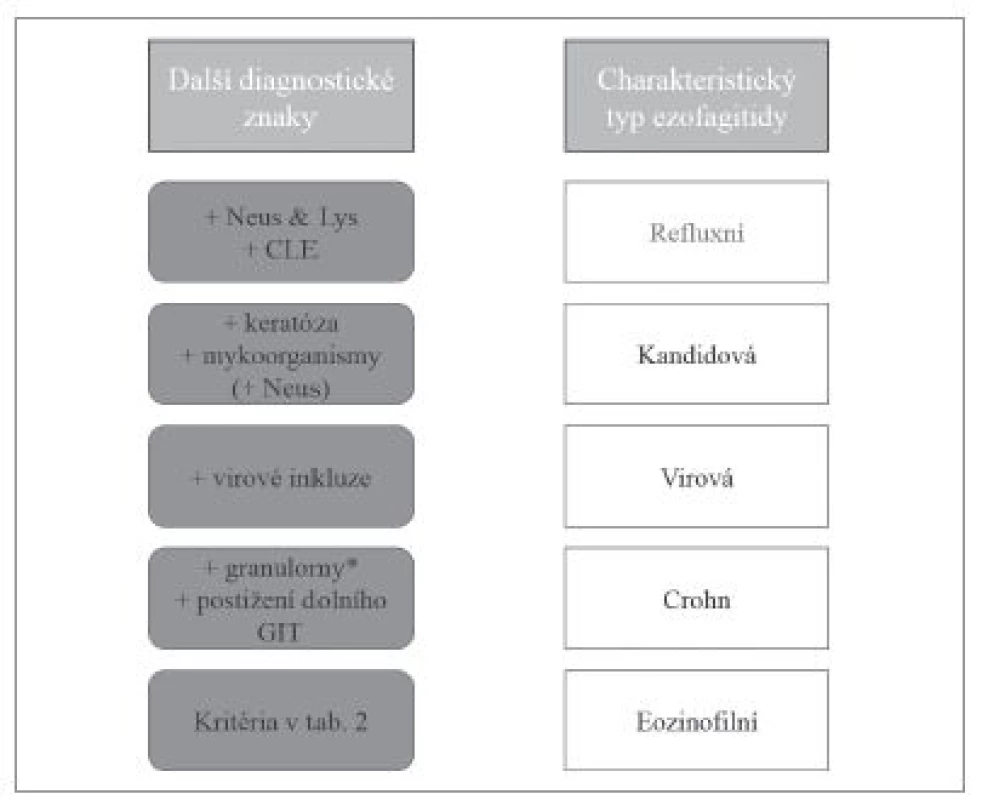
* - problematika výskytu granulomů při postižení jícnu Crohnovou chorobou diskutována v textu. Skutečně typická je signifikantní infiltrace eozinofily pro eozinofilní ezofagitidu. Současná doporučení American College of Gastroenterology (ACG) ji definují jako „klinickopatologické onemocnění diagnostikované klinikem“ na podkladě klinických a patologických znaků posuzovaných v celku a uvedených níže (10):
- symptomy dysfunkce jícnu
- bioptický průkaz zánětu s převahou eozinofilů, jejichž počet ≥ 15/HPF (zorné pole velkého zvětšení)
- slizniční eozinofilie je omezena na jícen a je refrakterní na terapii inhibitory protonové pumpy
- byly vyloučeny sekundární příčiny slizniční eozinofilie
- odpověď na dietní a/nebo steroidní léčbu podporuje diagnózu.
Z hlediska patologa jsou některé aspekty těchto doporučení sporné. A to ne snad proto, že hlavní roli přisuzuje klinikovi – to je logické už proto, že je to právě klinik, kdo má k dispozici další informace umožňující diagnózu. Problém je s definicí histologických kritérií (druhá odrážka, zvýrazněno kurzívou), která se v podstatě omezuje na počet eozinofilních granulocytů převyšující limit stanovený víceméně arbitrárně na podkladě statistického zpracování kvantitativních studií. Na některých pracovištích striktní dodržování těchto doporučení vedlo až ke stavu, kdy je od patologa požadováno jediné: spočítat eozinofily. A to i přes to, že je už delší dobu známé, že „zorné pole velkého zvětšení“ může mít na různých mikroskopech různou plochu (kterou ovšem doporučení ACG blíže nedefinují) a že jsou známy i jiné, snadněji hodnotitelné, kvantitativní a neméně specifické histologické znaky eozinofilní ezofagitidy (tab. 2) (11). Zatímco spongióza epitelu je nespecifickým znakem svědčícím pro jeho poškození způsobené řadou příčin, tvorba denzních klastrů eozinofilních granulocytů až eozinofilních mikroabscesů (obr. 13) a známky degranulace eozinofilů (obr. 14) svědčí pro jejich aktivní účast v patogenezi onemocnění. Subepiteliální skleróza proprie (obr. 15) je pak dokladem chronického průběhu tohoto procesu. Eozinofilní ezofagitida není samozřejmě jediným chronickým zánětem jícnu signifikantně moderovaným eozinofily, proto je třeba komplexním vyšetřením vyloučit další jednotky s obdobným histologickým nálezem. Vzhledem k vysoké prevalenci v prvé řadě přichází v úvahu refluxní ezofagitida, která se někdy může také histologicky manifestovat výraznější účastí eozinofilů v zánětlivém infiltrátu (tab. 3). Již z pohledu obecné patologie zánětu očekávatelnou, ač v našich podmínkách nikoli běžnou příčinou eozinofilní infiltrace jícnu je parazitární onemocnění, jehož diagnostika je ovšem v tomto případě většinou mimo možnosti patologa. Obdobné omezení platí i pro většinu dalších onemocnění projevujících se (mimo jiné) eozinofilními infiltráty v jícnových biopsiích (tab. 4). Zvláštní zmínku zasluhuje eozinofilní gastroenteritida (EGE), onemocnění podobně nejasné etiopatogeneze jako eozinofilní ezofagitida, postihující jakoukoli etáž trávicího traktu, tedy i jícen, přičemž léčba těchto dvou imunopatologických onemocnění se liší (12). Histologicky lze EGE od „pouhé“ eozinofilní ezofagitidy odlišit na základě přítomnosti eozinofilního zánětlivého infiltrátu též v žaludeční biopsii (je-li ovšem dostupná).
Tab. 2. Histologické znaky eozinofilní ezofagitidy. 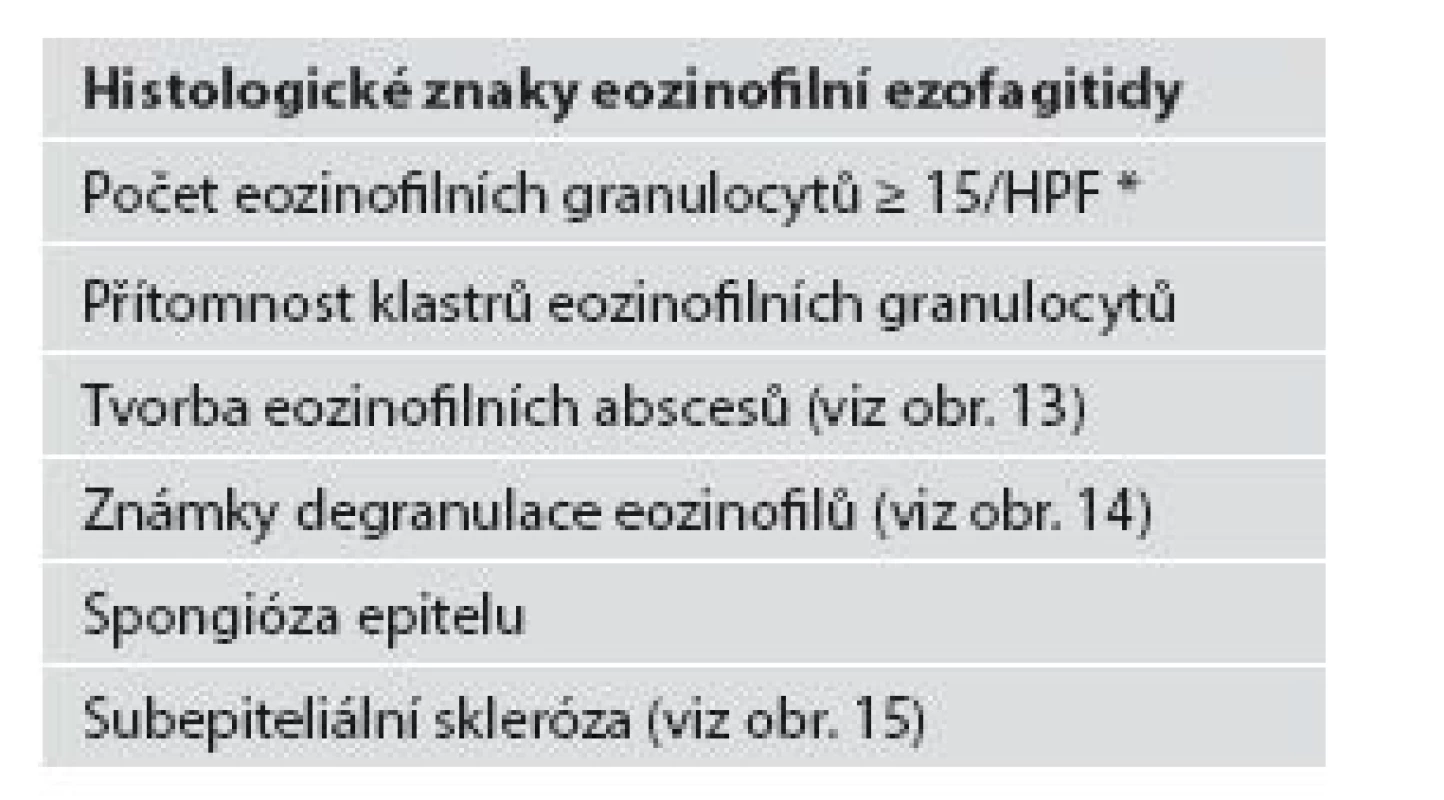
*HPF: zorné pole velkého zvětšení (high-power field), pro kritický rozbor tohoto parametru viz text Obr. 13. Eozinofilní ezofagitida. Eozinofilní absces v dlaždicovém epitelu (HE, 400x) 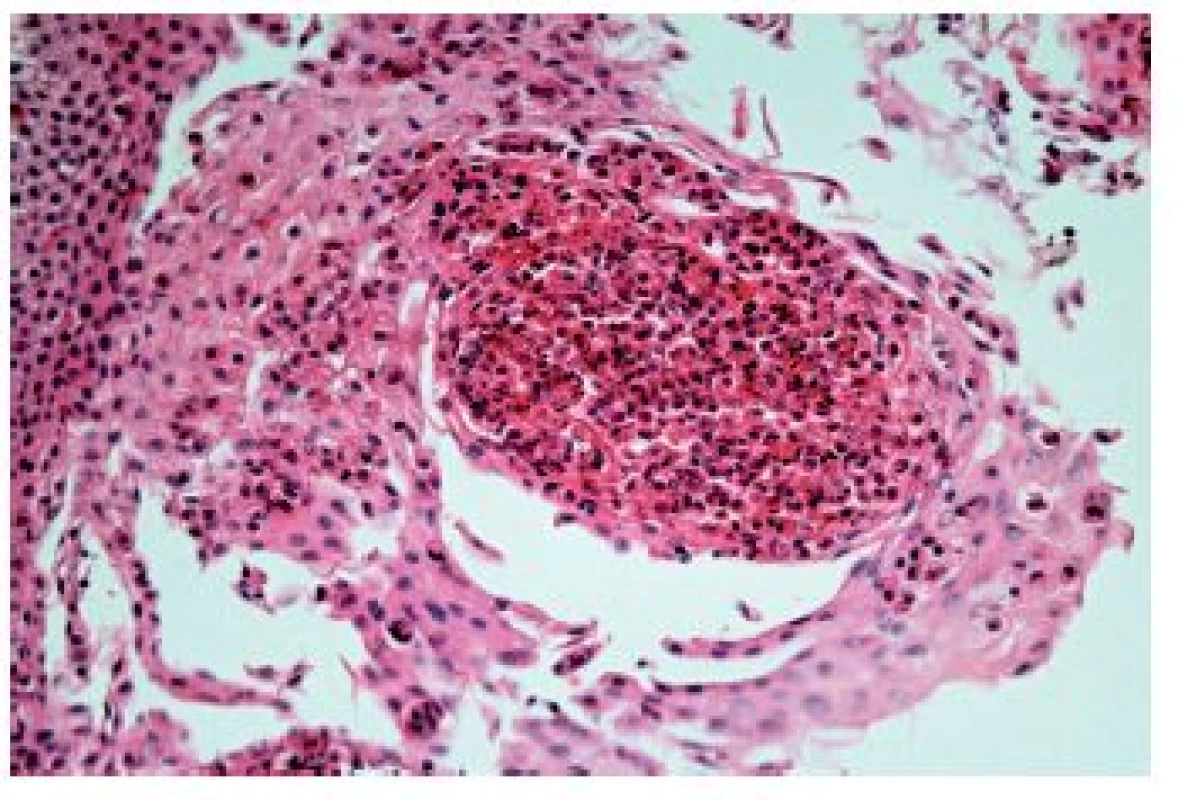
Obr. 14. Eozinofilní ezofagitida. Přítomnost degranulace (modré šipky) je známkou aktivace eozinofilních granulocytů, spongióza epitelu (zelené šipky) svědčí pro jeho poškození zánětem (HE, 800x). 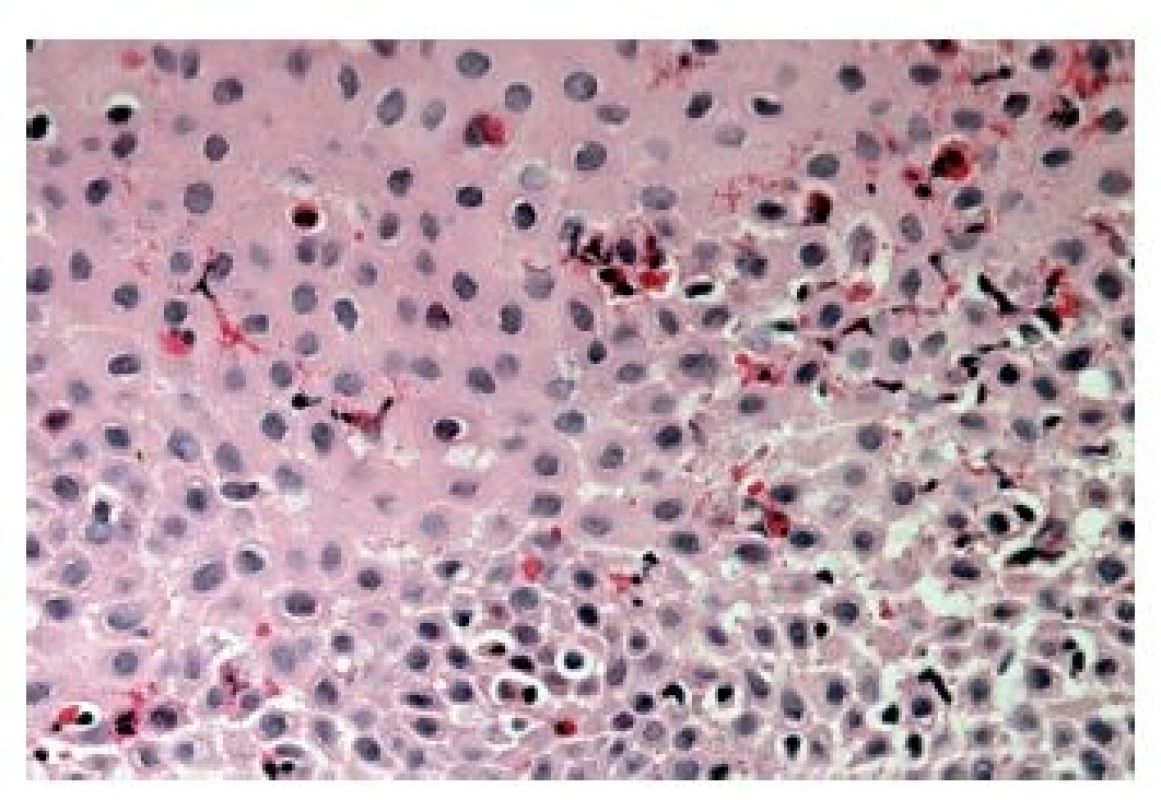
Obr. 15. Eozinofilní ezofagitida. Skleróza subepiteliálního stromatu je důsledkem chronické aktivace eozinofilů při eozinofilní ezofagitidě (HE, 200x). 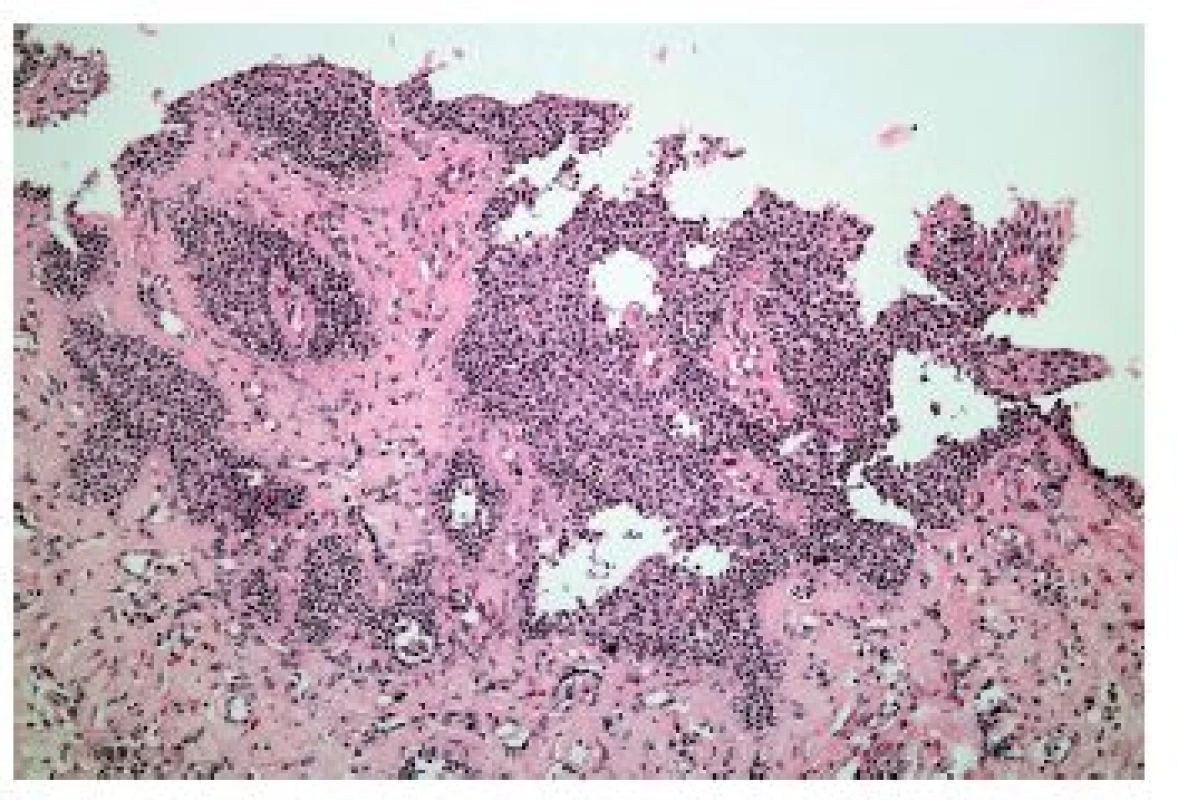
Tab. 3. Eozinofilní ezofagitida vs. refluxní ezofagitida. 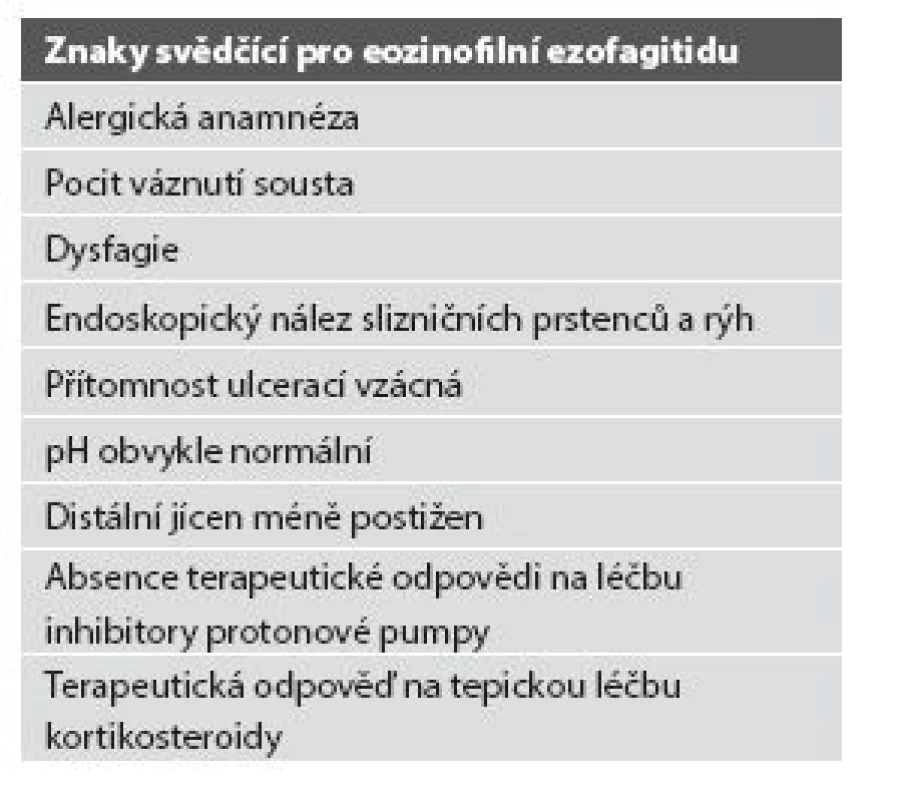
Tab. 4. Další diferenciální diagnóza eozinofilní ezofagitidy. 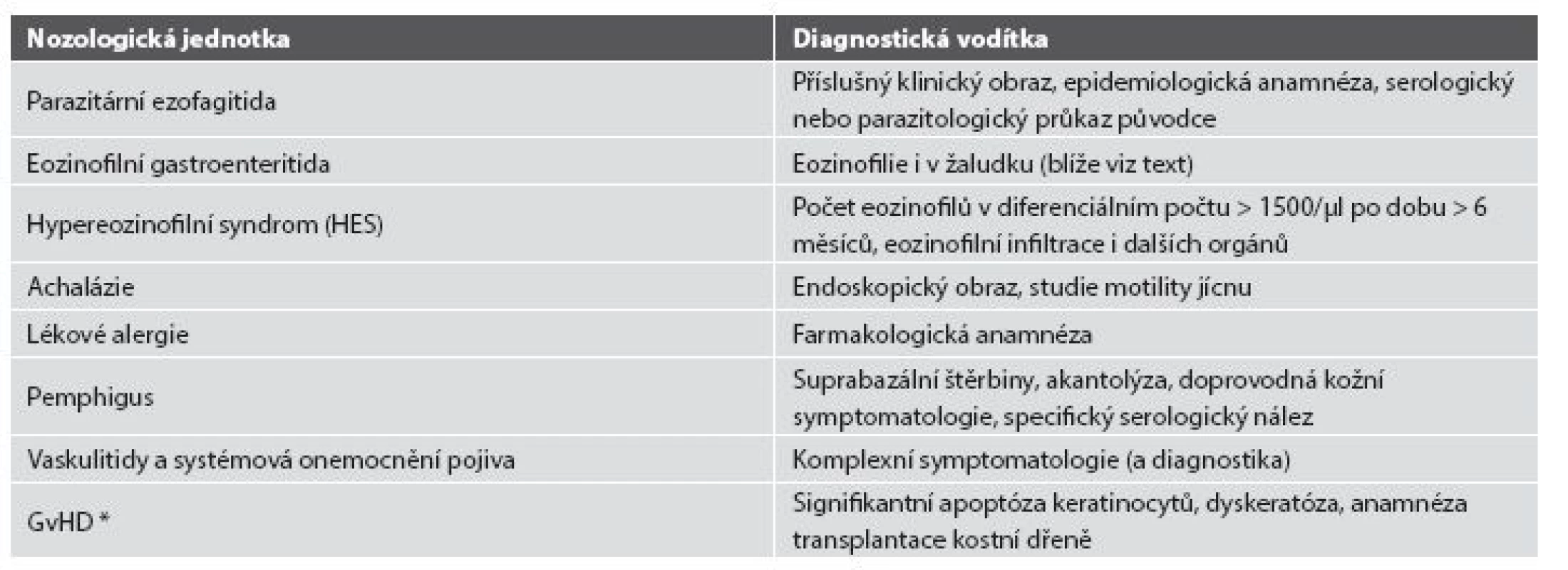
* GvHD: reakce štěpu proti hostiteli (graft versus host disease) 4. PŘÍTOMNOST GRANULOMŮ
Ačkoli tradiční pohled v diagnostice Crohnovy choroby zdůrazňuje přítomnost granulomů, praktická zkušenost jistě již každého přesvědčila, že frekvence jejich výskytu je poněkud nižší než se uvádí v učebnicích, zejména pokud jde o endoskopické biopsie a ještě k tomu z jiné lokalizace než z ilea. Postižení jícnu patří mezi diagnosticky nejobtížnější. Odhady prevalence jeho postižení se pohybují mezi 1 – 10 %. Navzdory historicky tradovanému názoru, že granulomy lze nalézt až ve 40 % těchto případů, recentní studie připouštějí pouze výjimečné případy prezentující se granulomatózním typem zánětu (13-15), což odpovídá i našim zkušenostem a odráží to i fakt, že endoskopické biopsie jícnu jsou v drtivé většině případů tvořeny pouze epitelovou vrstvou. Histologicky je většinou přítomen pouze nepříznačný ložiskový smíšený zánětlivý infiltrát s predominancí lymfocytů, neutrofilních granulocytů nebo eozinofilů, lokalizovaný hlavně v hlubších vrstvách. Podezření by takový ložiskový obraz měl vzbudit především u dětských pacientů. Zásadním nálezem pro diagnózu je přítomnost typických změn v ileokolické lokalizaci (obr. 4).
Vzhledem k současným poznatkům by tedy přítomnost granulomů, zejména dobře patrných a objemnějších, měla spíše vzbudit pochyby o diagnóze Crohnovy choroby (neopírá-li se tato o jiné nálezy) a iniciovat pátraní po jiné etiologii. V našich podmínkách je nutné vyloučit především tuberkulózu, sarkoidózu, mykotickou ezofagitidu a vaskulitidy.
5. ŘÍDKÝ ZÁNĚTLIVÝ INFILTRÁT
V některých případech je zánětlivý infiltrát nápadně řídký, minimální, a to třeba i navzdory výrazným alterativním změnám. Většinou jde o jednotky vzácné nebo alespoň vzácně diagnostikované, protože diagnostická endoskopická biopsie většinou v takových případech není prováděna (tab. 5). Mimo případy uvedené v tabulce, podmíněné buď fyzikálně-chemickým účinkem některých substancí nebo podmíněných dysfunkcí imunitního systému, se lze relativně častěji setkat s (post) aktinickou (radiační) ezofagitidou. Její makroskopický endoskopický obraz není nikterak specifický, navíc může být částečně podmíněn aditivním účinkem chemoterapie. V akutní fázi lze pozorovat edematózní a hyperemickou sliznici s tvorbou vředů, později se rozvíjí fibrotické změny vedoucí k poruchám motility, tvorbě striktur a membrán. Ani histologický nález v dlaždicovém epitelu není příliš charakteristický, dominují mu zejména nespecifické degenerativní a regenerativní změny v akutní fázi, s akantózou a parakeratózou objevující se v časovém odstupu. Máme-li však štěstí a v biopsii je zastižena ve větším množství i lamina propria, můžeme pozorovat i specifičtější změny známé důvěrně z distální části GIT: hyalinizaci proprie, vaskulární ektázie a atypické fibroblasty (obr. 16).
Tab. 5. Diferenciální diagnostika ezofagitid s nápadně řídkým zánětlivým infiltrátem. 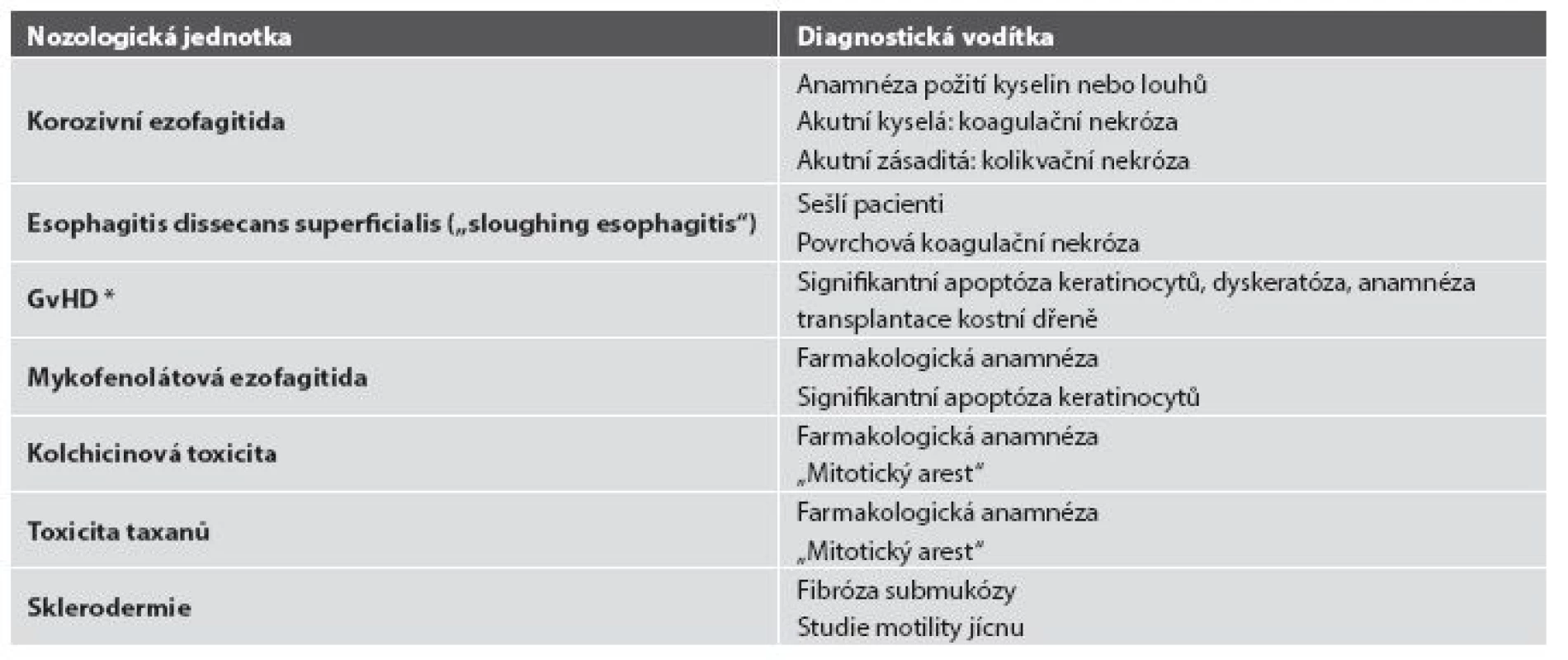
* GvHD: reakce štěpu proti hostiteli (graft versus host disease) Obr. 16. Radiační ezofagitida. Vaskulární ektázie a atypické fibroblasty ve fibrózně ztluštělé proprii by měly vzbudit podezření na postaktinické změny (HE, 600x). 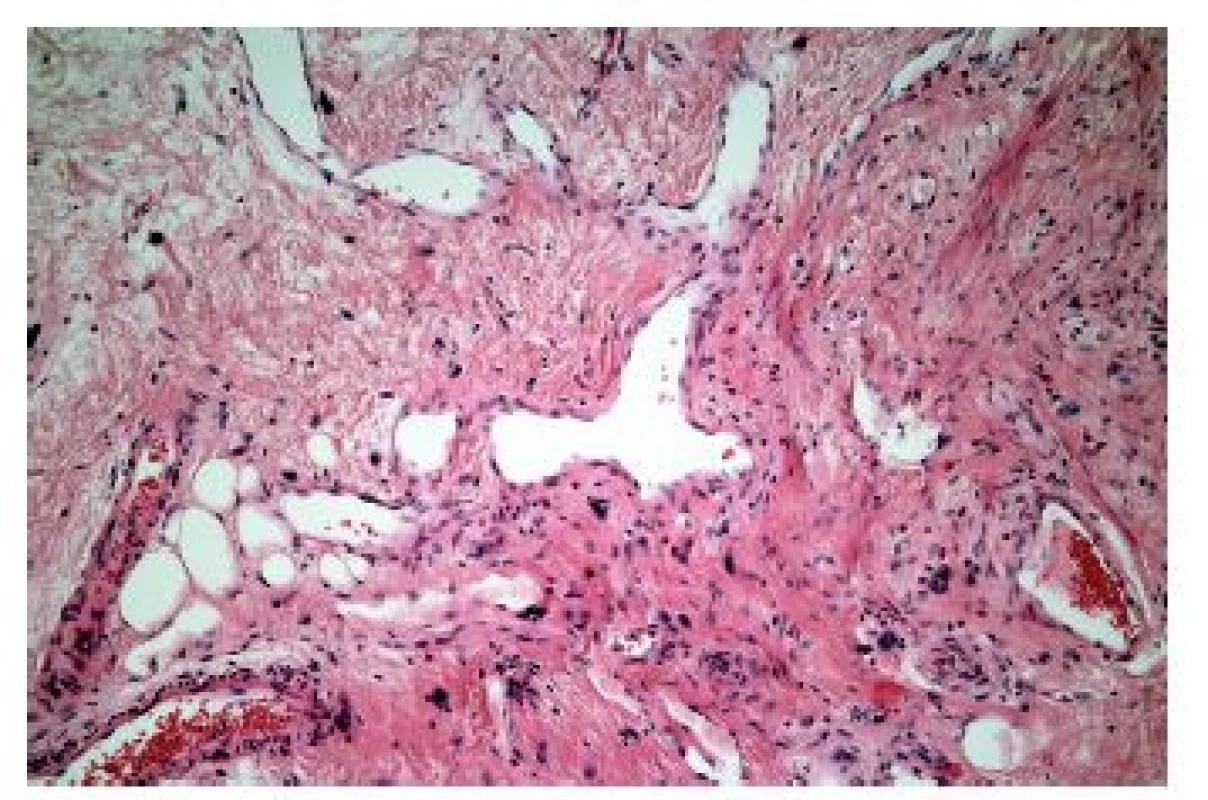
ZÁVĚR
Ačkoli je drtivá většina zánětů jícnu kauzálně asociovaná s gastroezofageálním refluxem, v diagnostické praxi je nutné brát v potaz i daleko méně často se vyskytující jednotky, které mohou být vyvolány činiteli fyzikálními, chemickými (včetně léčiv), infekčními a imunitními. Samotný histologický obraz nemusí být pro diagnózu určující. Frustrující je zejména fakt, že běžné obrazy epiteliálního poškození jsou sdíleny více typy ezofagitid, včetně ezofagitidy refluxní, podobně jako nejčastější typy zánětlivého infiltrátu (lymfocytární, hnisavý, eozinofilní), které mohou být zastiženy jak u různých nerefluxních ezofagitid, tak při poškození jícnu při refluxu. Většinou je tedy v prvé řadě na místě vyloučit možnost refluxní ezofagitidy, a to histologicky na podkladě přítomnosti refluxem indukované kolumnární metaplázie dlaždicového epitelu distálního jícnu, v optimálním případě v korelaci s odpovídajícím klinickým obrazem případně doplněným o výsledky jícnové pHmetrie a/nebo manometrie a o terapeutickou odpověď na léčbu inhibitory protonové pumpy. Bez dalších informací prakticky nelze dospět k patologické diagnóze zejména v případě imunopatologických onemocnění a toxických efektů léků, s jejichž stále častějším výskytem je nutné v současné době počítat. Konečně je na místě zmínit, že diagnostika je někdy komplikována sporně stanovenými diagnostickými kritérii (eozinofilní ezofagitida) nebo existencí jednotek, jejichž význam je dosud poměrně sporný (lymfocytární ezofagitida).
PODĚKOVÁNÍ
Práce vznikla za částečné podpory výzkumného projektu SVV 260171/2015 a grantu IGA NT14227.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 13,
305 99 Plzeň
tel.: +420377402523
e-mail: DAUM@fnplzen.cz
Zdroje
1. Chandan VS, Murray JA, Abraham SC. Esophageal lichen planus. Arch Pathol Lab Med 2008; 132(6): 1026-1029.
2. Rubio CA, Sjodahl K, Lagergren J. Lymphocytic esophagitis: a histologic subset of chronic esophagitis. Am J Clin Pathol 2006; 125(3): 432-437.
3. Purdy JK, Appelman HD, Golembeski CP, McKenna BJ. Lymphocytic esophagitis: a chronic or recurring pattern of esophagitis resembling allergic contact dermatitis. Am J Clin Pathol 2008; 130(4): 508-513.
4. Veits L, Drgac J, Rieker RJ. Lymphozytare osophagitis: eine ausschlussdiagnose in der diagnostik chronischer osophagitiden. Pathologe 2013; 34(2): 105-109.
5. Feiden W, Borchard F, Burrig KF, Pfitzer P. Herpes oesophagitis. I. Light microscopical and immunohistochemical investigations. Virchows Arch A Pathol Anat Histopathol 1984; 404(2): 167-176.
6. Greenson JK. Macrophage aggregates in cytomegalovirus esophagitis. Hum Pathol 1997; 28(3): 375-378.
7. Greenson JK, Beschorner WE, Boitnott JK, Yardley JH. Prominent mononuclear cell infiltrate is characteristic of herpes esophagitis. Hum Pathol 1991; 22(6): 541-549.
8. Zidar N, Ferkolj I, Tepes K, et al. Diagnosing cytomegalovirus in patients with inflammatory bowel disease-by immunohistochemistry or polymerase chain reaction? Virchows Arch 2015; 466(5): 533-539.
9. Abraham SC, Bhagavan BS, Lee LA, Rashid A, Wu TT. Upper gastrointestinal tract injury in patients receiving kayexalate (sodium polystyrene sulfonate) in sorbitol: clinical, endoscopic, and histopathologic findings. Am J Surg Pathol 2001; 25(5): 637-644.
10. Dellon ES, Gonsalves N, Hirano I, Furuta GT, Liacouras CA, Katzka DA. ACG clinical guideline: Evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis (EoE). Am J Gastroenterol 2013; 108(5): 679-692.
11. Lee S, de Boer WB, Naran A, et al. More than just counting eosinophils: proximal oesophageal involvement and subepithelial sclerosis are major diagnostic criteria for eosinophilic oesophagitis. J Clin Pathol 2010; 63(7): 644 - 647.
12. Yan BM, Shaffer EA. Primary eosinophilic disorders of the gastrointestinal tract. Gut 2009; 58(5): 721-732.
13. Abdullah BA, Gupta SK, Croffie JM, et al. The role of esophagogastroduodenoscopy in the initial evaluation of childhood inflammatory bowel disease: a 7-year study. J Pediatr Gastroenterol Nutr 2002; 35(5): 636-640.
14. Feagans J, Victor D, Joshi V. Crohn disease of the esophagus: a review of the literature. South Med J 2008; 101(9): 927-930.
15. Sakuraba A, Iwao Y, Matsuoka K, et al. Endoscopic and pathologic changes of the upper gastrointestinal tract in Crohn’s disease. Bio - Med research international 2014; 610767.
16. Noffsinger A, Fenoglio-Preiser CM, Maru D, Gilinsky D. Diseases of the esophagus. In: King DW, Sobin LH, Stocker JT, et al., eds. Atlas of nontumor pathology, Fascicle 5 - Gastrointestinal diseases (1 ed). Washington, DC: American Registry of Pathology; 2007 : 91-122.
17. Bennett AE, Goldblum JR, Odze RD. Inflammatory disorders of the esophagus. In: Odze RD, Goldblum JR, eds. Surgical pathology of the GI tract, liver, biliary tract, and pancreas (2nd ed). Philadelphia, PA: Saunders/ Elsevier; 2009 : 231-267.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Jaká je Vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2016 Číslo 1-
Všechny články tohoto čísla
- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- MONITOR aneb nemělo by vám uniknout, že
- Patologická diagnostika nerefluxních ezofagitid
- Zaostrené na gastrointestinálny trakt
- MONITOR aneb nemělo by vám uniknout, že
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- O teórii „tripolárneho života“
- Jaká je Vaše diagnóza?
- Hypoglykémie u solitárního fibrózního tumoru jater
- Jaká je Vaše diagnóza? Odpověď
- MONITOR aneb nemělo by vám uniknout, že
- Klinicko-patologická korelace imunoprofilu u difúzního velkobuněčného lymfomu, NOS - zkušenost z jednoho pracoviště
- MONITOR aneb nemělo by vám uniknout, že
- Kožná bunková reakcia po popálení medúzou
- MONITOR aneb nemělo by vám uniknout, že
- Postinfekční glomerulonefritida u dospělých: skrytá tvář dlouho známého onemocnění
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- Kožná bunková reakcia po popálení medúzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





