-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hypoglykémie u solitárního fibrózního tumoru jater
Hypoglycemia in a solitary fibrous tumor of the liver
A 64-year-old patient developed sudden hypoglycemia leading to unconsciousness. Hypoglycemic episodes recurred on several occasions but were not accompanied by unconsciousness. Magnetic resonance imaging revealed a liver tumor in the right lobe sized 20.0 × 14.6 × 19.0 cm. No other masses were detected. Right hemihepatectomy was indicated but could not be performed due to heavy bleeding near the tumor. Histological examination showed a relatively cellular tumor made of elongated bland cells. The mitotic index was fewer than 4 mitoses per 10 HPF. The tumor was without necrosis or hemorrhage. The excised tumor was not encapsulated and showed no signs of invasive growth. On immunohistological examination, the tumor expressed NSE, CD34, CD99, Bcl2 and STAT6; Ki-67 was positive in approximately 20% of the cells. Both the histological pattern and immunophenotype were suggestive of solitary fibrous tumor of the liver. Given its size, cellularity and relatively high expression of the proliferation marker Ki-67, the tumor was classified as potentially malignant. The patient underwent embolization of arteries supplying the tumor with blood. The effect of the procedure on the tumor will only be assessed later. Hypoglycemia has resolved and the patient feels well.
Keywords:
solitary fibrous tumor – liver – hypoglycemia – immunohistology
Autoři: Jirka Mačák 1; Petr Buzrla 1; Jana Dvořáčková 1; Petr Prokop 2,3; František Jalůvka 3
Působiště autorů: Ústav patologie Lékařské fakulty Ostravské univerzity v Ostravě a Fakultní nemocnice Ostrava 1; Katedra chirurgických oborů Lékařské fakulty Ostravské univerzity v Ostravě 2; Chirurgická klinika Fakultní nemocnice Ostrava 3
Vyšlo v časopise: Čes.-slov. Patol., 52, 2016, No. 1, p. 41-44
Kategorie: Původní práce
Souhrn
U 64-letého pacienta se náhle objevila hypoglykémie, která vedla až k bezvědomí. Hypoglykemické stavy se několikrát opakovaly, ale k bezvědomí již nedošlo. Vyšetřením magnetickou rezonancí byl zjištěn nádor pravého laloku jater velikosti 20 x 14,6 x 19 cm. Další nádorová ložiska vyšetření neprokázalo. U pacienta byla navržena pravostranná hemihepatektomie. V průběhu operace byl stav hodnocen jako inoperabilní a byl proveden pouze odběr pro bioptické vyšetření. V histologickém obraze byl poměrně buněčný nádor z protáhlých buněk blandního vzhledu. Počet mitóz byl pod 4 mitózy /10 HPF. Nekrózy ani hemoragie v tumoru nebyly nalezeny. V rozsahu excize nádor nebyl opouzdřený ani nebyly přítomny známky invazivního růstu. Imunohistologicky nádor exprimoval: NSE, CD34, CD99, Bcl2, STAT6; KI-67 bylo pozitivní asi u 20 % buněk. Histologický obraz a imunofenotyp odpovídal solitárnímu fibróznímu tumoru jater. Vzhledem k velikosti nádoru, jeho buněčnosti a poměrně vysoké expresi proliferačního markeru Ki-67 řadíme nádor do kategorie potenciálně maligních. Pacientovi byla provedena embolizace tepen, které zásobují nádor krví. Vliv tohoto zákroku na velikost nádoru bude posouzen později. Hypoglykemické stavy ustoupily a pacient se cítí dobře.
Klíčová slova:
solitární fibrózní tumor – játra – hypoglykémie – imunohistologie
Solitární fibrózní tumor (dále SFT) byl popsán a rozpoznán od mezoteliomu poprve v roce 1931 (1,2). Nádor se může objevit v kterékoliv lokalizaci. Asi 30 % SFT vzniká na pleuře, z toho dvě třetiny nádorů vychází z viscerální pleury; v parenchymu plic se SFT vyskytuje poměrně vzácně (3). Ve 20 % se nádory objevují v dutině břišní, případně v retroperitoneu; na horních a dolních končetinách v 8 % případů (4). Debs et al. (5) uvádějí, že bylo dosud popsáno 56 případů SFT jater. V řadě případů se nádor objeví náhodně. Teprve, když dosahuje značné velikosti může se projevovat např. plností břicha, zvracením a hubnutím (6). V některých případech bývá spojován s výraznou hypoglykémií, trombocytózou a zvýšenou hladinou C-reaktivního proteinu (7-10).
POPIS PŘÍPADU
64-letý pacient na dovolené v létě náhle upadl do bezvědomí. Při vyšetření se zjistila hypoglykémie a následně na CT se objevil tumor jater (obr. 1). Pacient si měřil hladinu glukózy, která ráno dosahovala hladiny 2 mmol/l (fyziologické rozmezí je 3,9 – 6,1 mmol/l). Koncem července byl hospitalizován pro embolii a. pulmonalis. Z této příhody se pacient poměrně rychle zotavil. Při hospitalizaci byl potvrzen multicystický tumor jater. Od července do listopadu měl pacient ještě několik hypoglykemických stavů vždy ráno. Po jídle se stav upravil. Opakovaně měřená glykémie se pohybovala v rozmezí 3,5 – 5,6 mmol/l a hladina inzulinu dosahovala hodnoty 4,6 mU/l (fyziologické rozmezi je 1,9 – 23,0 mU/l). V aspirační cytologii byly zjištěny nádorové buňky benigního vzhledu. Pacient byl indikovaný k operaci při které byl zjištěn objemný nádor v pravém laloku jater velikosti 20 x 14,6 x 19 cm. Byla indikována hemihepatektomie. Při operační revizi byl nádor pro svoji velikost, lokalizaci a neovaskularizaci hodnocený jako inoperabilní a byl proveden pouze odběr pro bioptické vyšetření. Pacientovi byla následně provedena embolizace tepen, které zásobují nádor krví. Vliv tepenné embolizace na velikost nádoru bude posouzen později, hypoglykemické stavy však ustoupily.
Obr. 1. Vyšetřením CT se objevil velký tumor pravého laloku jater. 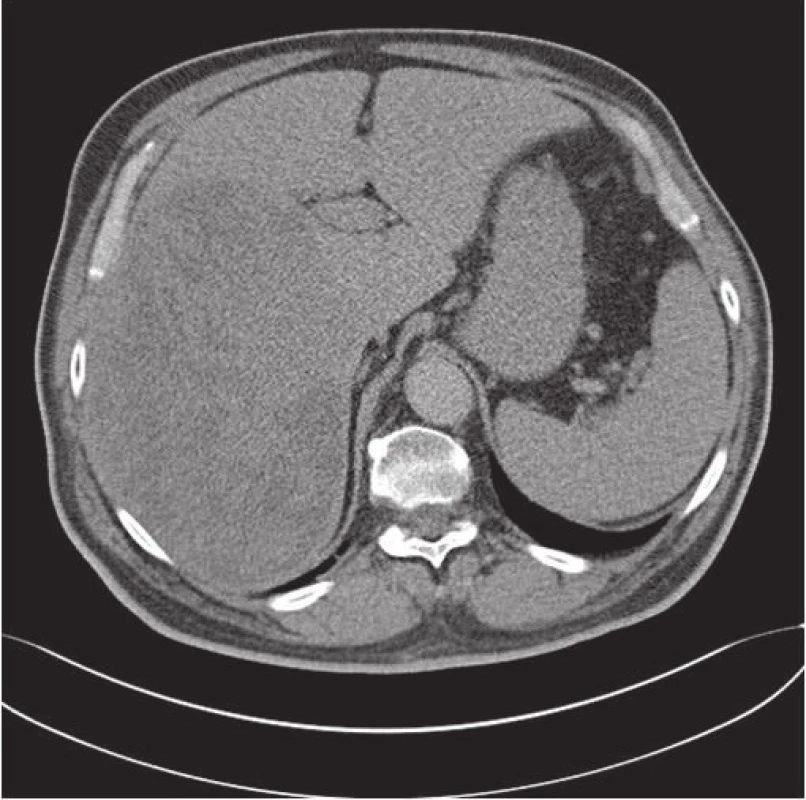
HISTOLOGICKÉ VYŠETŘENÍ
Tkáň nádoru byla fixována pufrovaným 10% formalinem a zpracována parafinovou technikou. Řezy byly barveny hematoxylinem - eozinem; imunohistologické vyšetření bylo prováděno metodou avidin-biotin komplex (ABC). Seznam použitých protilátek, výrobců, pracovního ředění a výsledků imunohistologického vyšetření je uveden v tabulce č. 1.
Tab. 1. Seznam použitých protilátek, výrobců, pracovního ředění a výsledků imunohistologického vyšetření. 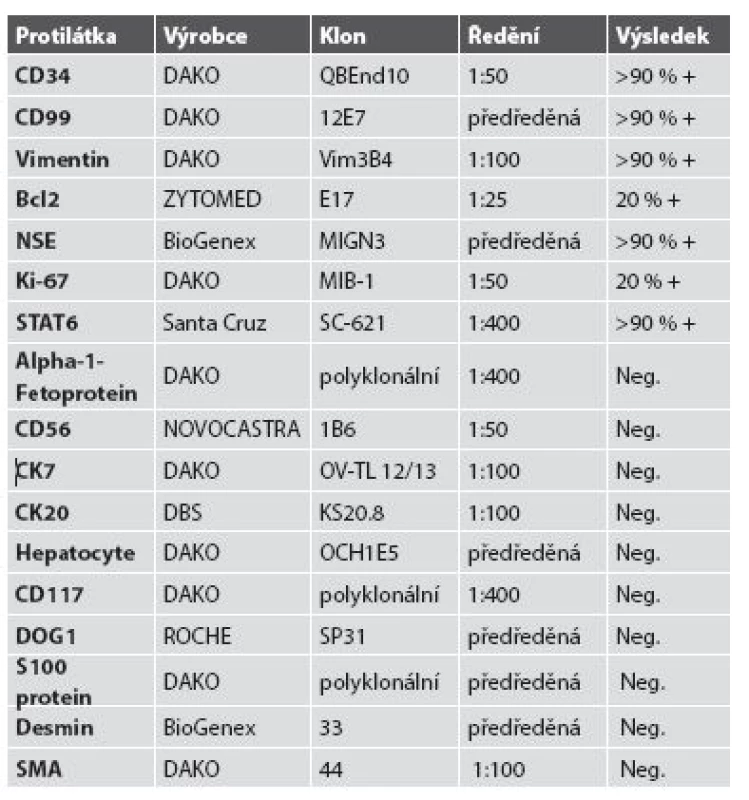
Histologicky byl nádor poměrně buněčný, tvořený protáhlými buňkami s oválnými až protáhlými jádry s jemně hrudkovitým chromatinem. V rozsahu excize nádor nebyl opouzdřený, nádorové buňky naléhaly přímo na jaterní trámce. Periferie nádoru byla zřetelně buněčnější než hlubší části (obr. 2, 3). Tam byly mezi nádorovými buňkami tenké snopce kolagenních vláken. V některých úsecích byly četnější tenkostěnné kapiláry místy parožnatého vzhledu. Mitotická aktivita byla malá, počet mitóz nedosahoval 4 mitózy / 10 HPF. V barvení na retikulin podle Gömöriho je patrná velmi hustá retikulinová síť, která obklopuje i jednotlivé nádorové buňky. Nekrózy nebyly zjištěny.
Obr. 2. SFT bez vazivového pouzdra naléhá na jaterní parenchym (vpravo dole). HE, měřítko 200 μm. 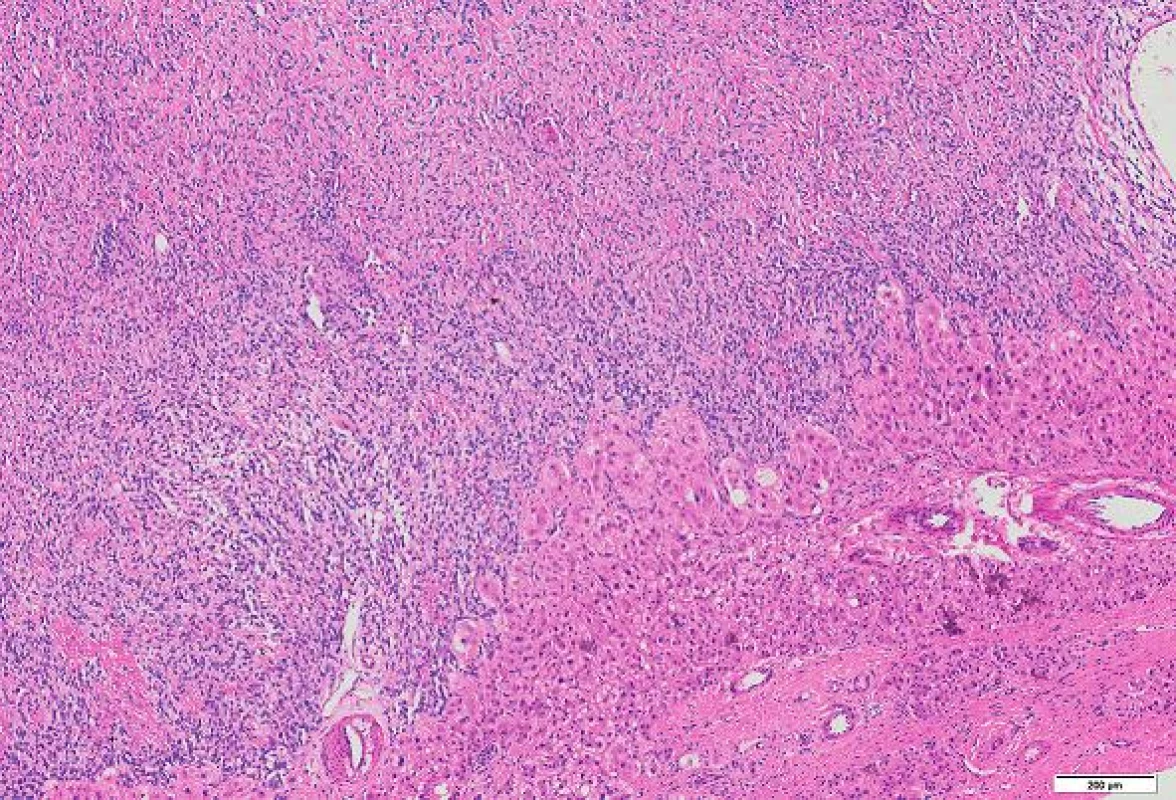
Obr. 3. Nádor byl výrazně buněčný. Nádorové buňky byly protáhlého tvaru. Jádra buněk byla pravidelná bez polymorfie. HE, měřítko 50 μm. 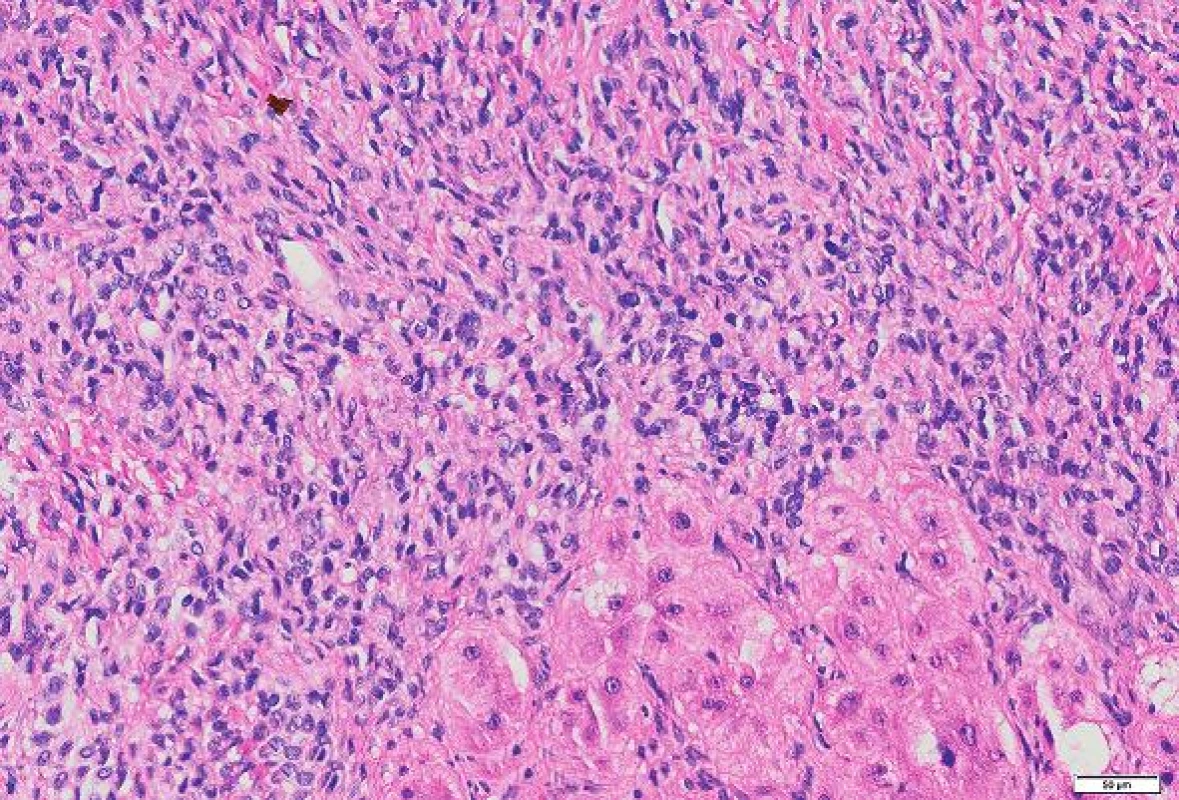
Imunohistologické vyšetření (tab. 1) ukázalo pozitivní výsledky s protilátkami: NSE, CD34, CD99, Bcl2, STAT6, tyto protilátky byly pozitivní u více než 90 % nádorových buněk; Ki-67 bylo pozitivní v buněčných strukturách na periferii nádoru asi 20 % buněk (obr. 4 - 6). Nádorové buňky nereagovaly s následujícími protilátkami: CD117, DOG1, CK7, CK20, CD56, SMA, hepatocyte, alpha-1-fetoprotein.
Obr. 4. Nádorové buňky exprimovaly marker CD34. Immunohistologie, měřítko 20 μm. 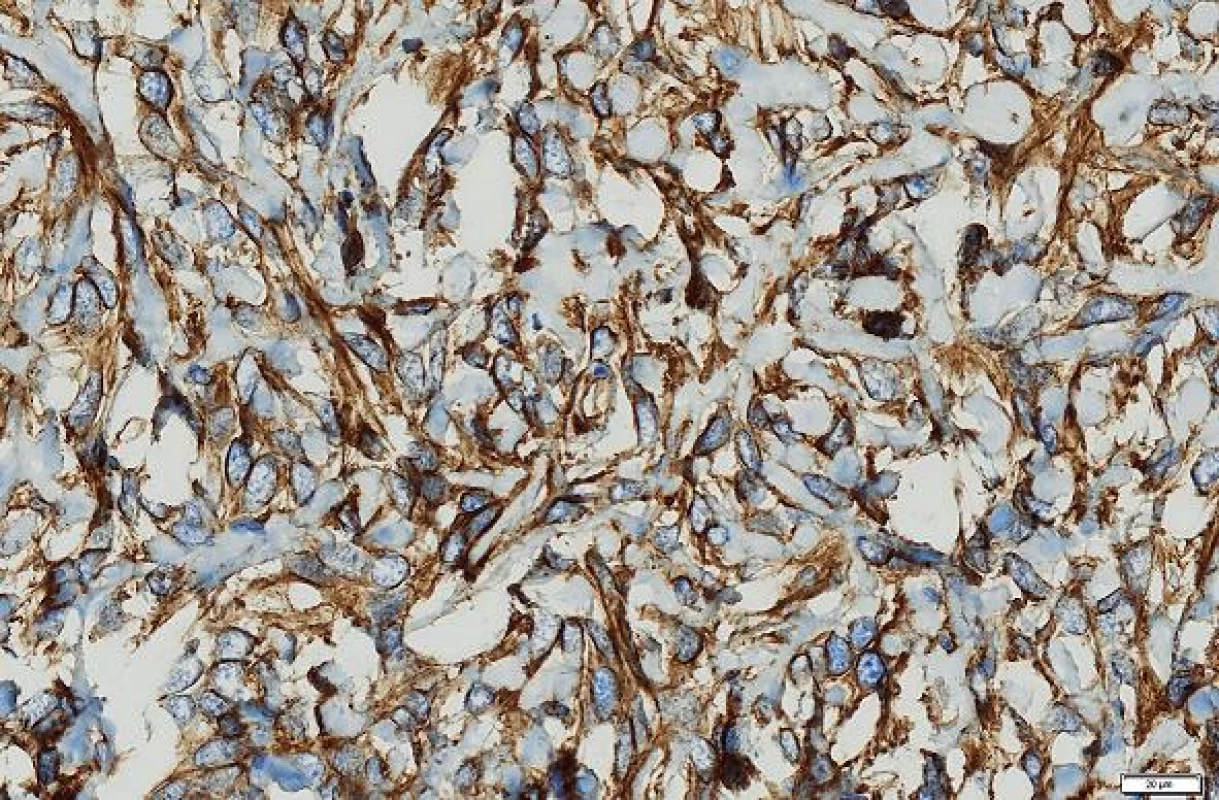
Obr. 5. V periferních oblastech nádoru asi 20 % buněk exprimovalo proliferační marker Ki-67. Immunohistologie, měřítko 50 μm. 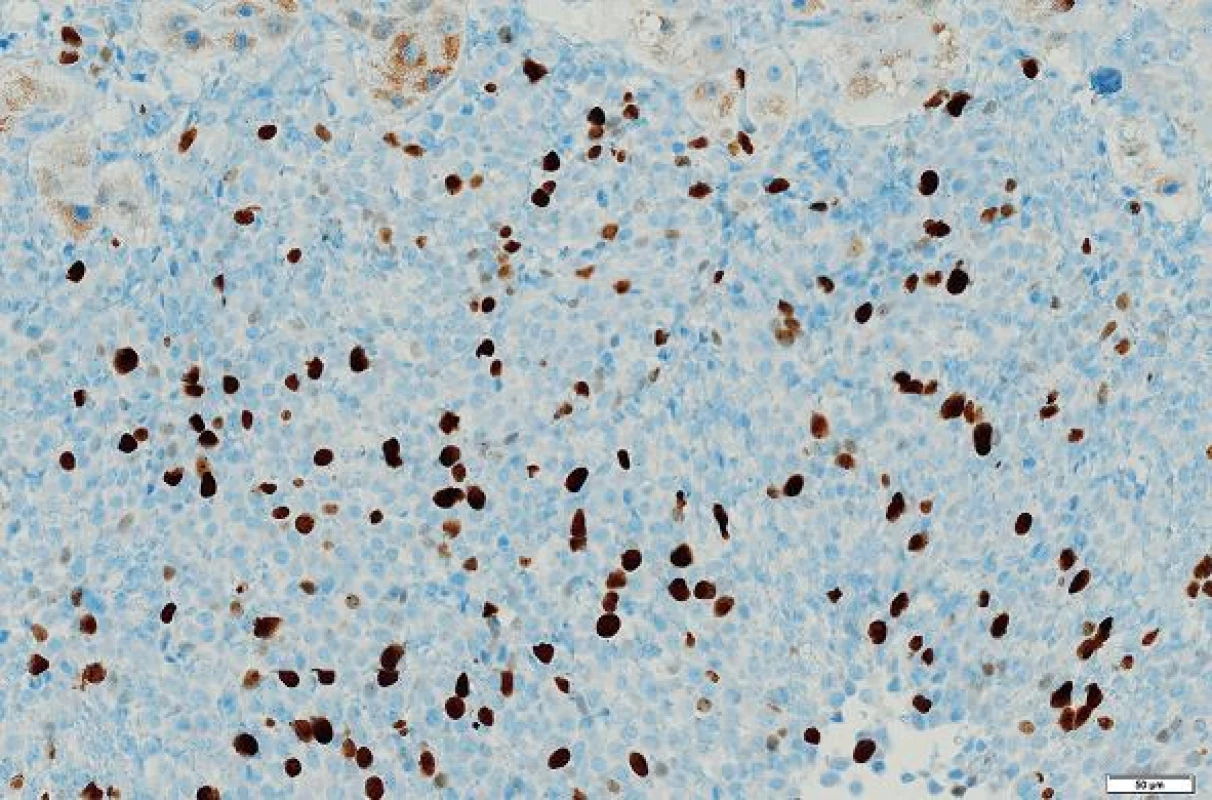
Obr. 6. Nádorové buňky exprimovaly marker STAT6. Immunohistologie, měřítko 100 μm. 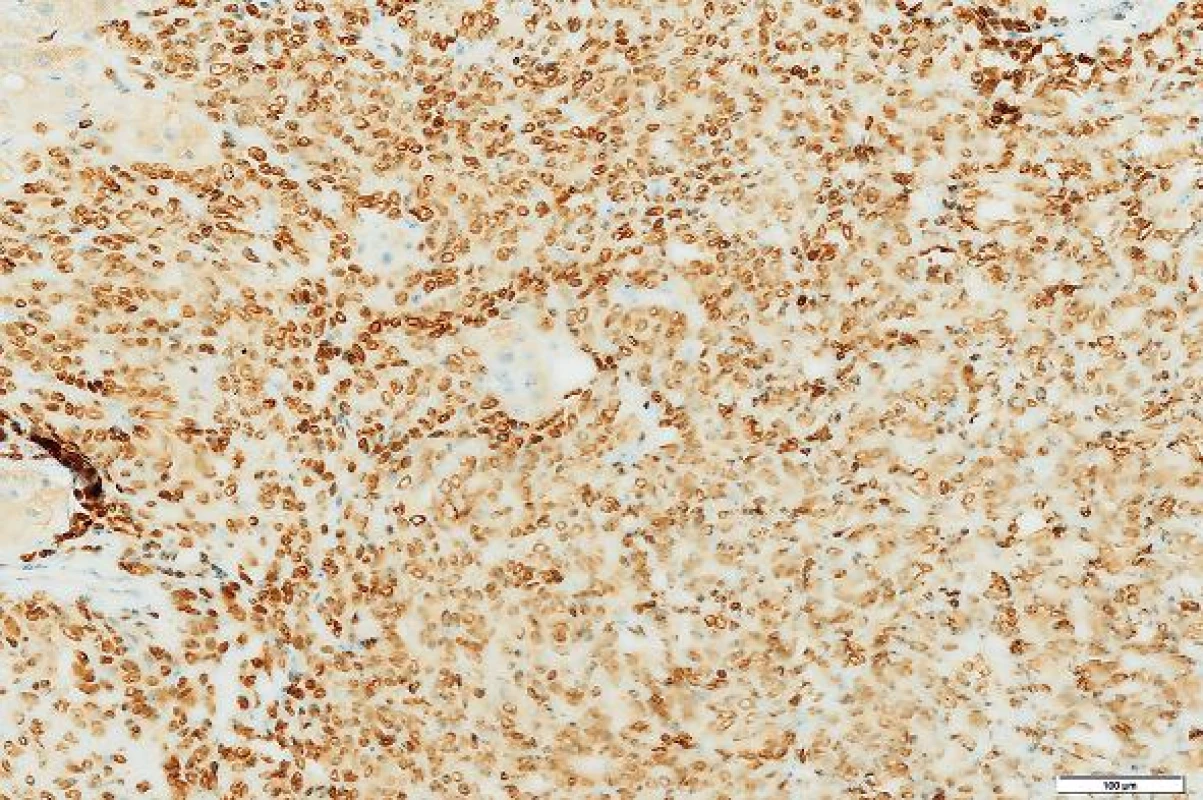
DISKUZE
SFT patří mezi nádory, které se nejčastěji objevují na pleuře (1). Často je jejich růst bezpříznakový a může se projevit náhle výraznou hypoglykémií při které může pacient upadnout do bezvědomí (7). Nádor vychází z fibroblastů. Podle WHO klasifikace SFT zahrnuje podtyp, který byl dříve označován jako hemangiopericytom (HPC). Histologický obraz obou lézí je podobný. Zjistilo se, že HPC nejspíše vychází z fibroblastů jako SFT a nikoliv z pericytů (11). Rozlišení SFT a jeho varianty HPC bylo v histologickém obraze v řadě případů obtížné. Obě varianty jsou tvořeny směsí protáhlých, oválných a kulatých buněk. U HPC se popisovaly tzv. parožnatě větvené kapiláry. Tento znak však není specifický a byl zjištěn aspoň fokálně asi u 15 % všech měkkotkáňových tumorů. SFT obsahuje zpravidla větší množství kolagenního vaziva než HPC. Cytogeneticky se ukázalo, že SFT a HPC obsahují stejný fúzní gen NAB2-STAT6 a termín HPC se v novějších klasifikacích měkkotkáňových nádorů vypouští. Tento fúzní gen může být detekován imunohistologicky pomocí protilátky STAT6 v jádrech buněk. Ukazuje se, že tato protilátka je vysoce senzitivní a specifická pro SFT a může zastoupit průkaz fúzního genu (12). V našem případě nádor exprimoval tento marker u více než 90 % buněk.
V centrálním nervovém systému však jsou SFT a HPC klasifikovány zvlášť i v současné době na základě odlišného biologického chování obou lézí. HPC má agresivnější chování včetně vyššího metastatického potenciálu. Nález fúzního genu NAB2-STAT6 u meningeálních HPC však naznačuje, že tento stav může být korigován (13).
Primární mezenchymový nádor jater tvořený protáhlými nádorovými buňkami je vždy neobvyklý a vede k široké diferenciálně diagnostické rozvaze. Vzhledem k tomu, že nádorové buňky byly poměrně blandního vzhledu na prvních místech je nutné vyloučit benigní mezenchymové nádory, např.: leiomyom, inflamatorní myofibroblastický nádor a nádor z obalů periferních nervů (PNST). Ze zhoubných nádorů: metastázu gastrointestinálního stromálního tumoru, sarkomatoidní variantu hepatocelulárního karcinomu a monofazickou variantu synoviálního sarkomu. Kromě imunohistologického vyšetření hodnotíme i histologické detaily.
Leiomyom obsahuje zpravidla buňky s cigaretovým tvarem jádra a pozitivní nález s protilátkou proti desminu, hladkosvalovému aktinu, zatímco CD34 je negativní. Inflamatorní myofibroblastický nádor se skládá ze směsi fibroblastů a myofibroblastů, mezi kterými jsou malé lymfocyty, plazmatické buňky a disperzně eozinofily. Imunohistologicky tyto nádory exprimují vimentin, hladkosvalový aktin a cytokeratiny. Nádor z obalů periferních nervů se muže histologicky SFT značně podobat. Imunohistologicky však nádor aspoň fokálně exprimuje S100 protein a na rozdíl od SFT bývá CD34 negativní. Metastáza GIST bývá CD34 pozitivní s expresí KIT (CD117), která bývá vysoká (podle některých údajů až v 95 % případů); KIT (CD117) negativní nádory mohou exprimovat DOG1. V našem případě byl nádor s těmito markery negativní. V případě maligní varianty GIST by se s velkou pravděpodobností objevila další metastatická nádorová ložiska v játrech nebo jinde v organismu. Sarkomatoidní variantu hepatocelulárního karcinomu odlišíme aspoň ložiskovitým výskytem trabekulárního uspořádání a expresí cytokeratinů (1,14). Monofazická varianta synoviálního sarkomu může být velmi podobná SFT zvláště v buněčnějších oblastech. Nádor stejně jako SFT exprimuje Bcl2, ale prakticky všechny nádory jsou CD34 negativní a nádor neexprimuje protilátku STAT6. Uvádí se, že i monofazická varianta synoviálního sarkomu exprimuje fokálně či monocelulárně cytokeratiny a EMA. K expresi těchto markerů monocelulárně však dochází i u SFT. Je však možné cytogenetické odlišení. Asi u dvou třetin synoviálních sarkomů prokážeme fúzní gen SS18-SSX1 a u jedné třetiny případů SS - 18-SSX2 (4,15).
SFT se řadí mezi benigní či potenciálně maligní nádory. Asi 10 % z nich se může transformovat do maligní varianty. Podle WHO klasifikace nádorů měkkých tkání (15) patří ke kriteriím malignity: velikost nádorového ložiska nad 10 cm, hypercelularita, buněčná a jaderná pleomorfie, počet mitóz nad 4/10 HPF, nekrózy, hemoragie a infiltrativní růst do okolních tkání (13). Podle Miettinena (4) nádory, které exprimují protilátku Ki-67 u více než 5 % buněk se často řadí k atypickým či maligním. Z výše uvedených kritérií byla v našem případě přítomna hypercelularita, velikost nádoru nad 10 cm a Ki-67 exprimovalo asi 20 % buněk. Nebyla zjištěna pleomorfie nádorových buněk a počet mitóz jako rozhodující kritérium malignity byl pod 4 mitózy/10 HPF. Vzhledem k těmto prognosticky nepříznivým ukazatelům je možné nádor zařadit do kategorie potenciálně maligních. Omezujícím prvkem ve stanovení prognózy onemocnění je v našem případě i nedostatečné histologické vyšetření poměrně velkého nádoru.
Hypoglykémie se považuje za velmi závažný příznak, který se objevuje v rámci paraneoplastického syndromu u SFT. Asi v 50 % nemocných se hypoglykémie zjistila jako první příznak, který předcházel nálezu SFT v játrech; u druhé poloviny pacientů se hypoglykémie prokázala v průběhu nádorového onemocnění (7,16). Podle řady autorů (7,17,18) je hypoglykémie vyvolána tvorbou IGF2 (insulin-like growth factor 2). Jde o polypeptidový růstový faktor, který se skládá z 67 aminokyselin a má vysokou homologii s inzulinem. Gen pro IGF2 je lokalizován na krátkém raménku chromozomu 11 (11p15) v sousedství s genem pro inzulin (19). Nejčastěji se hypoglykémie objevuje u SFT pleury, mezoteliomů pleury a v dřivější nomenklatůře u hemangiopericytomů. V ojedinělých případech IGF2 a hypoglykémii můžeme pozorovat i u jiných mezenchymových a epitelových nádorů (18), např. fibrosarkomu, leiomyosarkomu, gastrointestinálního stromálního nádoru, feochromocytomu; z epitelových nádorů u hepatocelulárního karcinomu a v ojedinělých případech u karcinomu nadledviny a adenokarcinomu žaludku (20-23). K hypoglykémii může dojít náhle po dlouhodobém bezpříznakovém průběhu a bez varovných symptomů. Náhle může dojít ke ztrátě vědomí, tak jak tomu bylo i u našeho pacienta. V těchto případech bývá hladina inzulinu normální nebo nízká na rozdíl od neuroendokrinního tumoru pankreatu (7). Spojení SFT (benigní i maligní varianty) a hypoglykémie bývá eponymicky označované jako Doege-Potter syndrom (17). Podle některých autorů je výskyt hypoglykémie častější u větších nádorů velikosti kolem 20 cm. Z nich asi 40 % patří k maligním variantám (24). Pokud se podaří nádor odstranit, hypoglykémie ustává (18). V našem případě byl tumor značně velký a teprve bezprostředně při pokusu o jeho odstranění byl hodnocený jako inoperabilní. Další terapeutickou možností je embolizace krevních cév, které nádor zásobují. Tento terapeutický přístup byl proveden i u našeho pacienta (embolizace přívodných tepen). Výsledkem tohoto zákroku bylo vymizení hypoglykemických stavů.
PODĚKOVÁNÍ
Autoři děkují prof. MUDr. M. Michalovi z Šiklova ústavu patologie Lékařské fakulty UK v Plzni a Fakultní nemocnice Plzeň za pomoc při imunohistologickém vyšetření.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Jirka Mačák, CSc.
Ústav patologie LF OU v Ostravě a FN Ostrava
Tř. 17. listopadu 1790,
708 52 Ostrava-Poruba
tel.: 597 37 2309
e-mail: macak.jirka@seznam.cz
Zdroje
1. Liu Q, Liu J, Chen W, Mao S, Guo Y. Primary solitary fibrous tumors of liver: a case report and literature review. Diagn Pathol 2013; 8, doi: 10.1186/1746-1596-8-195.
2. Klemperer P, Rabin CB. Primary neoplasia of the pleura. A report of five cases. Am J Ind Med 1992; 22 : 1-31.
3. Singh RK, Thangakunan B, Isaac BT, Gupta A. Disseminated solitary fibrous tumour of the lung and pleura. BMJ Case Rep 2013, doi: 10.11136/bcr-2013-009362.
4. Miettinen M. Modern soft tissue pathology. Tumors and non-neoplastic conditions. Cambridge university Press: New York 2010.
5. Debs T, Kassir R, Amor IB, Martin F, Iannelli A, Gugenheim J. Solitary fibrous tumor of the liver: report of two cases and review of the literature. Int J Surg 2014; 12 : 1291-1294.
6. Vernerová E, Bělina F, Hrabal P. Solitární fibrózní tumor jater. Čes a Slov Gastroent a Hepatol 2007; 61 : 135-138.
7. Mohammedi K, Abi KC, Oliver S, Benabad I, Roussel R, Marre M. Paraneoplastic hypoglycemia in a patient with a malignant solitary fibrous tumor. Endocrinol Diabetes Metab Case Rep 2014, doi: 10.1530/EDM-14-0026.
8. Famà F, Yves Le B, Barrande G, Villenneuve A, Berry MG, Pidoto RR, Saint MO. Solitary fibrous tumour of the liver with IGF-II-related hypoglycaemia: a case report. Langenbecks Arch Surg 2008; 393 : 611-616.
9. Penel N, Amela EY, Decanter G, Robin YM, Marec-Berard P. Solitary fibrous tumors and so-called hemangiopericytoma. Sarcoma 2012, doi: org/10.1155/2012/690251.
10. Jakob M, Schneider M, Hoeller I, Laffer U, Kaderli R. Malignant solitary fibrous tumor involving the liver. World J Gastroenterol 2013; 19 : 3354-3357.
11. Bokshan SL, Doyle M, Becker N, Nalbantoglu I, Chapman WC. Hepatic hemangiopericytoma/ solitary fibrous tumor: a review of our current understanding and case study. J Gastrointest Surg 2012; 16 : 2170-2176.
12. Yoshida A, Tsuta K, Ohno M, et al. STAT6 immunohistochemistry is helpful in the diagnosis of solitary fibrous tumors. Am J Surg Pathol 2014; 38 : 552-559.
13. Schweizer L, Koelsche C, Sahm F, et al. Meningeal haemangiopericytoma and solitary fibrous tumors carry the NAB2-STAT6 fusion and can be diagnosed by nuclear expression of STAT6 protein. Acta Neuropathol 2013; 125 : 651-658.
14. Fryer E, Chetty R. Unusual and rare tumours of the liver. Diagn Histopathol 2012; 8 : 449-456.
15. Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F. WHO classification of tumours of soft tissue and bone. IARC Press: Lyon 2013.
16. Bodnar TW, Acevedo MJ, Pietropaulo M. Management of non-islet-cell tumor hypoglycemia: a clinical review. J Clin Endocrinol Metab 2014; 99 : 713-722.
17. Chaberlain MH, Taggart DP. Solitary fibrous tumor associated with hypoglycemia: an example of the Doege-Potter syndrome. J Thorac Cardiovasc Surg 2000; 11 : 185-187.
18. Fukasawa Y, Takada A, Tateno M et al. Solitary fibrous tumor of the pleura causing recurrent hypoglycemia by secretion of insulin-like growth factor II. Pathol Int 1998; 48 : 47-52.
19. deGroot JW, Rikhof B, vanDoorn J et al. Non-islet cell tumor-induced hypoglycaemia: a review of the literature including two new cases. Endocr Relat Cancer 2007; 14 : 979-993.
20. Gordon P, Hendriks CM, Kahn CR, Megyesi K, Roth J. Hypoglycemia associated with non-islet-tumor and insulin-like growth factors: a study of the tumor types. N Engl J Med 1981; 305 : 1452-1455.
21. Pink D, Schoeler D, Lindner T et al. Severe hypoglycemia caused by paraneoplastic production of IGF-II in patients with advanced gastrointestinal stromal tumors: a report of two cases. J Clin Oncol 2005; 23 : 6809-6811.
22. Khowaja A, Johanson-Rabbett B, Bantle J, Moheet A. Hypoglycemia mediated by paraneoplastic production of insulin like growth factor-2 from a malignant renal solitary fibrous tumor – clinical case and literature review. BMC Endocr Disord 2014; 14 : 14-49.
23. Daughaday WH, Trivedi B, Kapadia M. Measurement of insulin-like growth factor II by specific radioreceptor assay in serum of normal individuals, patients with abnormal growth hormone secretion, and patients with tumor-associated hypoglycemia. J Clin Endocrinol Metab 1981; 53 : 289-294.
24. Kalebi AY, Hale MJ, Wong ML, Hoffman T, Murray J. Surgically cured hypoglycemia secondary to pleural solitary fibrous tumour: case report and update review on the Doege-Potter syndrome. J Cardiothoracic Surg 2009, doi: 10.1186/1749-8090-4-45.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Jaká je Vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2016 Číslo 1-
Všechny články tohoto čísla
- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- MONITOR aneb nemělo by vám uniknout, že
- Patologická diagnostika nerefluxních ezofagitid
- Zaostrené na gastrointestinálny trakt
- MONITOR aneb nemělo by vám uniknout, že
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- O teórii „tripolárneho života“
- Jaká je Vaše diagnóza?
- Hypoglykémie u solitárního fibrózního tumoru jater
- Jaká je Vaše diagnóza? Odpověď
- MONITOR aneb nemělo by vám uniknout, že
- Klinicko-patologická korelace imunoprofilu u difúzního velkobuněčného lymfomu, NOS - zkušenost z jednoho pracoviště
- MONITOR aneb nemělo by vám uniknout, že
- Kožná bunková reakcia po popálení medúzou
- MONITOR aneb nemělo by vám uniknout, že
- Postinfekční glomerulonefritida u dospělých: skrytá tvář dlouho známého onemocnění
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- Kožná bunková reakcia po popálení medúzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



