-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunofluorescenční vyšetření v dermatologii*
Immunofluorescence in Dermatology
Immunofluorescence methods have been used in medical research and diagnostics for more than 50 years. In dermatology, direct and indirect immunofluorescence methods are mainly used in diagnostics of immunobullous and connective tissue diseases. The review summarizes the basic diagnostic possibilities and common findings in these disesases, and other uses, including modern applications of immunofluorescence methods.
Key words:
immunofluorescence – dermatology – bullous dermatoses – connective tissue disorders –methods
Autoři: H. Jedličková
Působiště autorů: Dermatovenerologická klinika FN u sv. Anny v Brně a LF MU
Vyšlo v časopise: Čes-slov Derm, 86, 2011, No. 4, p. 175-184
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Imunofluorescenční metody se již více než půl století používají v lékařské diagnostice a výzkumu. V dermatologii je to především diagnostika puchýřnatých onemocnění a onemocnění pojivové tkáně metodou přímé a nepřímé imunofluorescence. V článku je podán přehled základních možností diagnostiky a nálezů u těchto onemocnění, dalších možností využití včetně moderních aplikací imunofluorescence.
Klíčová slova:
imunoflurescence – dermatologie – bulózní dermatózy – nemoci pojiva – metodyI. ÚVOD
Imunofluorescenční (IF) metody jsou pro svoji relativní jednoduchost široce používané v lékařské diagnostice a výzkumu, důležitou roli hrají i v dermatovenerologii, především v diagnostice autoimunitních onemocnění. Imunofluorescenční metody byly použity na sklonku 50. let minulého století k detekci LE buněk [8], následovalo rozlišení jednotlivých antinukleárních protilátek, v roce 1963 byl popsán lupusový pruh Burnhamem [4].
V roce 1964 popsal detekci autoprotilátek imunofluorescenční metodou u pemfigu Beutner a Jordan [2]. Následoval popis protilátek proti bazální membráně u pemfigodu stejnými autory v roce 1965 [15]. V roce 1969 van der Meer popsal IgA v papilách u dermatitis herpetiformis [18]. Tyto objevy znamenaly počátek rozšíření IF diagnostiky na celou řadu chorob. U nás se o rozvoj IF metod v dermatologii zasloužili Vlašín a Kratochvil [17, 28], kteří metody začali používat již na sklonku 60. let. V současnosti patří IF metody do rutinního vyšetřování imunologických a patologických laboratoří, pro svoji specificitu si zachovala IF diagnostiku i některá specializovaná dermatologická pracoviště.
II. PODSTATA METODY
Některé molekuly mají díky své chemické struktuře schopnost po absorpci světla s vysokou energií přejít do excitovaného stavu a následně vyzářit fotony o vyšší vlnové délce a nižší energii. Tento jev se nazývá fluorescence a molekuly fluorochromy. Každý fluorochrom má charakteristické absorpční a emisní spektrum. Rozdíl mezi vlnovou délkou absorbovaného a emitovaného světla se nazývá Stokesův posun. Některé molekuly vykazují přirozenou fluorescenci, tzv. autofluorescenci (např. zelený fluorescentní protein GFP – green fluorescent protein), nebo lze proteiny, nukleové kyseliny apod., fluorescentním barvivem fluorochromem označit. V imunofluorescenčních metodách se využívá fluorochrom konjugovaný s protilátkou, tzv. konjugát, který reaguje s tkáňovými a buněčnými antigeny, imunoglobuliny, složkami komplementu, zánětlivými markery apod. Pro pozorování fluorescence je nutný fluorescenční mikroskop. V současnosti se používají tzv. epiluminiscenční mikroskopy – světlo prochází shora objektivem, který funguje jako kondenzor. Starším typem byl transmisní mikroskop. Světelným zdrojem je rtuťová výbojka, halogenová lampa se širokým spektrem, lasery nebo nově LED (light emitting diod), zdroje s úzkým spektrem. Světlo prochází excitačním filtrem, který propustí pouze vlnovou délku vhodnou pro daný fluorochrom; emisní filtr pak propustí jen požadované vlnové délky. Pozorovatel sleduje zářící označenou strukturu v tmavém poli, současně lze použít i několik fluorochromů. Nejčastějším fluorochromem používaným v dermatologii je fluorescein izothiocyanát (FITC), který po absorpci modrého světla vydává jasně zelenou fluorescenci; existují však desítky dalších používaných fluorochromů (rhodamin, thioflavin T aj.).
Při pozorování dochází rychle působením volných kyslíkových radikálů k vyzáření – vyblednutí fluorochromu. Nelze proto preparáty déle uchovávat, je možné ale jejich životnost prodloužit (montovací média DABCO, Citifluor apod.). K základním metodám patří tzv. přímá a nepřímá imunofluorescenční metoda.
A. Přímá imunofluorescenční metoda (PIF)
Odběr materiálu – bioptický vzorek z ložiska (lichen ruber, lupus erythematosus (LE), vaskulitida) nebo z perilezionální oblasti (puchýřnaté choroby) se co nejrychleji zmrazí, nejčastěji tekutým dusíkem. K vyšetření je nutné vybrat čerstvý projev se zachovanou epidermis, bez erozí a krust, kde ještě neproběhla degradace autoprotilátek zánětlivými procesy. U vaskulitid by léze neměla být starší než 24 hodin. Výjimkou je chronický lupus erythematosus, u kterého je přínosnější starší léze. Zpracovává se nejlépe do 24 hodin, maximálně do 5 dnů. Vzorek lze uchovávat ve speciálním zmrazovacím médiu (OCT médium). Při nutnosti transportu do vzdálené laboratoře je možné použít transportní médium, které nevyžaduje při transportu teploty pod nulou (Michelovo médium s maleimidem). Při zpracování do 24 hodin lze vzorek uchovat i ve fyziologickém roztoku.
Tkáňové řezy se inkubují s konjugovanou protilátkou, která se naváže na odpovídající strukturu (např. autoprotilátku navázanou na cílový antigen). Ke zvýraznění kontrastu IF a pozadí je možno preparát dobarvit Evansovou modří, která v IF mikroskopu zbarví epidermis dočervena. Zásadní význam má PIF u diagnostiky puchýřnatých autoimunitních chorob, diagnostickou hodnotu má i u lupus erythematosus, smíšené choroby pojiva, porfyrie, lichenu a vaskulitid, okrajově i u dalších onemocnění jako např. sklerodermie a dermatomyozitidy. V běžné diagnostice v dermatologii se používají protilátky (prasečí, myší, králičí, kozí aj.) proti lidským imunoglobulinům IgG, IgA, IgM, proti polyvalentnímu imunoglobulinu IgG, IgA a IgM, protilátky proti složce C3 komplementu a proti fibrinu značené FITC. Nejčastěji detekované autoprotilátky jsou třídy IgG ( LE, puchýřnatá onemocnění aj.). IgA autoprotilátky jsou typické pro Henochovu-Schönleinovu purpuru, morbus Duhring, IgA lineární dermatózu, popř. IgA pemfigus. IgM autoprotilátky nacházíme u vaskulitid a jako součást apoptotických tělísek (tzv. agregáty). Detekce C3 ukazuje aktivaci komplementu u zánětlivých dějů, např. u puchýřnatých chorob a vaskulitid. Detekce fibrinu jako tkáňového lepidla ukazuje na nespecifické poškození tkáně, např. junkční zóny u lichenu, poškození stěny cév.
B. Nepřímá imunofluorescenční metoda (NIF)
Široce prováděné vyšetření detekuje cirkulující autoprotilátky, v dermatologii má největší význam u puchýřnatých chorob a lupus erythematosus. Vyšetřované sérum se nejprve inkubuje s vhodným substrátem (tkáňovými řezy, buňkami), ve druhé fázi se přidává konjugovaná protilátka. Je možno provádět stanovení titru autoprotilátek, který koreluje s aktivitou onemocnění, např. u pemfigu. Substrát musí být citlivý na hledanou autoprotilátku, u puchýřnatých chorob se nejčastěji používá opičí ezofagus nebo lidská kůže. Existuje škála dalších, komerčně dostupných substrátů, např. buněčné linie HEp-2 a He-La z lidských karcinomů pro vyšetřování antinukleárních autoprotilátek. Nevýhodou vyšetření je subjektivní hodnocení pozorovatele.
Metodicky náročnější je vyšetření nepřímou IF na solí štěpené lidské kůži („salt split skin“ – SSS) u subepidermálních dermatóz. Při této technice je junkční zóna rozštěpena 1M roztokem NaCl v oblasti lamina lucida, což umožní rozlišení jednotlivých subepidermálních dermatóz, především bulózního pemfigoidu od epidermolysis bullosa acquisita. Obnažení antigenních epitopů také zesiluje citlivost reakce. Metodu SSS lze také použít v přímé IF na perilezionální kůži. V současnosti jsou k dispozici již i komerční sety.
III. POUŽITÍ U JEDNOTLIVÝCH CHOROB
1. Intraepidermální bulózní dermatózy
Pemfigus
Přímá IF – odebíráme vzorek perilezionální kůže z okraje puchýře.
U pemfigu jsou detekovány autoprotilátky třídy IgG (řidčeji IgA) navázané na desmozomy keratinocytů, tzv. intercelulární substanci (ICS). Cílovými antigeny jsou strukturální proteiny desmozomů, převážně desmogleiny a desmokoliny. Tyto protilátky fixují komplement, je tedy detekovatelná C3 složka komplementu, ve stejné lokalizaci jako ICS.
Pemphigus vulgaris (PV) vykazuje PIF téměř 100% senzitivitu. Selhat může u lokalizovaného pemfigu malého rozsahu a u léčených pacientů.
Pemphigus vegetans (PVg), který je variantou pemphigus vulgaris, má senzitivitu vyšetření přímou IF metodou nižší (obr. 1).
Obr. 1. Pemphigus vegetans – pozitivní intercelulární substance v dolní části epidermis (přímá IF, C3) 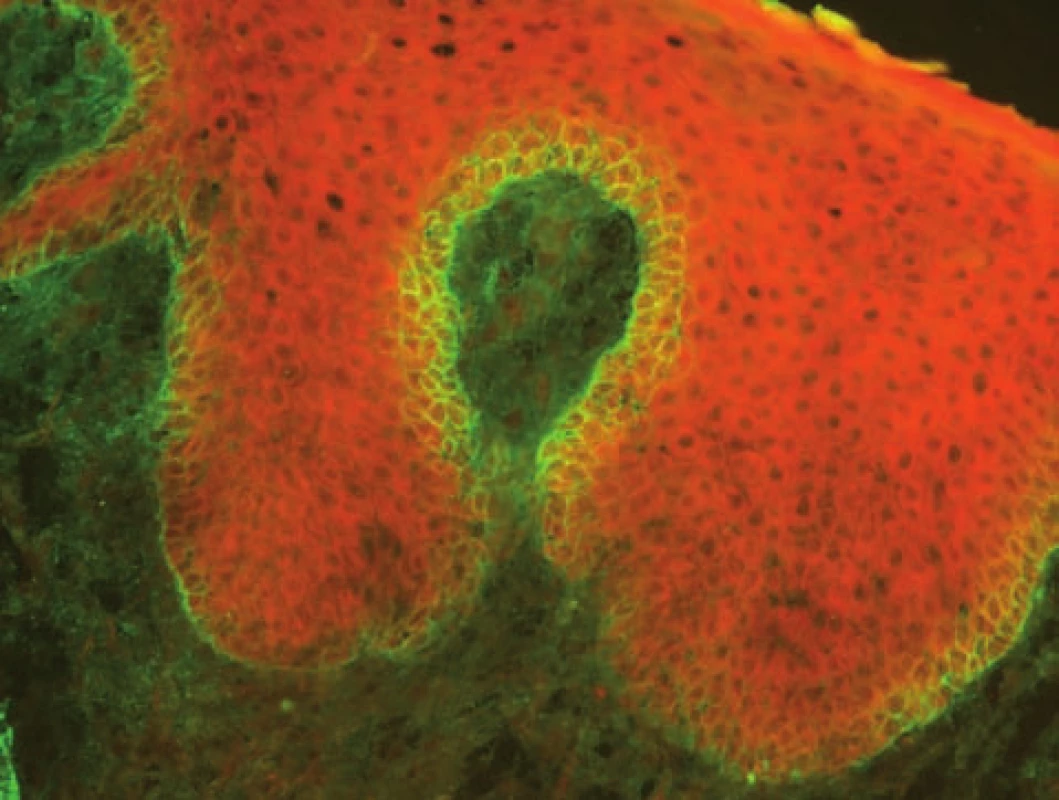
U pemphigus foliaceus (PF) se v typickém případě maximum protilátek detekuje v horní třetině epidermis, což odpovídá distribuci cílového antigenu desmogleinu 1 v epidermis. U lokalizovaných nálezů může být vyšetření negativní. Senzitivita je nižší, asi 70%.
Pemphigus erythematosus (syn. morbus Senear Usher) je variantou pemphigus foliaceus se znaky LE; při vyšetření můžeme detekovat kromě ICS lupusový pruh v junkční zóně.
Pemfigus indukovaný léky je většinou typu PF, s odpovídajícími IF nálezy. U pemfigu indukovaného thiolovými sloučeninami se předpokládá i možnost přímé akantolýzy bez nutnosti účasti autoprotilátek. IF nálezy pak mohou být negativní.
Nepříma IF – u pemfigu lze detekovat cirkulující autoprotilátky v séru. Je výhodné sledování titru autoprotilátek, protože koreluje s aktivitou onemocnění a reakcí na léčbu. Nejvyšší senzitivitu má vyšetření u PV (obr. 2). U PF je senzitivita nižší. U léčených pacientů může být vyšetření negativní u lokalizovaného pemfigu či naopak u rozsáhlého pemfigu s hypogamaglobulinémií. Pozitivita protilátek v nízkém titru často přetrvává i při klinické remisi onemocnění. V současnosti jsou dostupné sety pro nepřímou IF s buněčnými liniemi exprimujícími desmogleiny 1 a 3; komerčně dostupná je i ELISA.
Obr. 2. Pemphigus vulgaris – pozitivní intercelulární substance (nepřímá IF, opičí ezofagus, polyvalentní Ig) 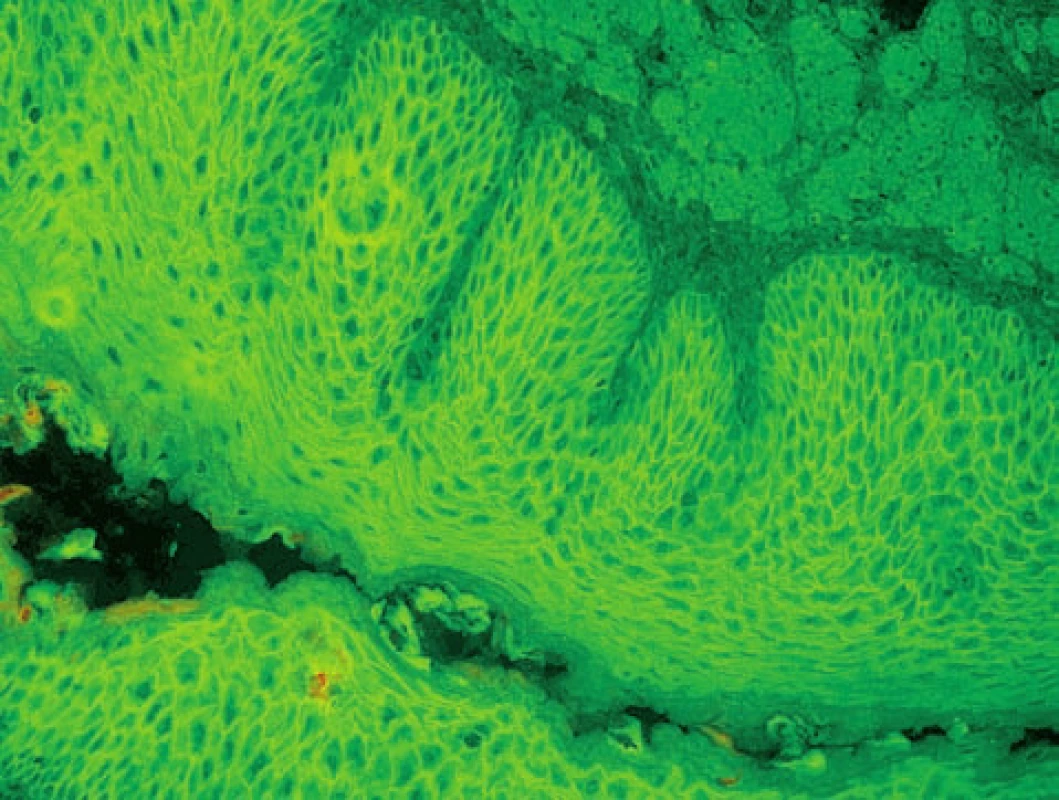
Další varianty pemfigů
Pemfigus paraneoplastický (PNP), syn. paraneoplastický autoimunitní multiorgánový syndrom – PAMS, je vzácná jednotka s vysokou mortalitou [11]. Přímou IF detekujeme pruh uloženin IgG, C3 a fibrinu v junkční zóně a IgG/C3 intercelulárně (ICS).
V nepřímé IF se využívá kromě běžných substrátů afinity autoprotilátek k epitelu močových cest (tkáňové řezy epitelu močového měchýře krysy), kterou nemají ostatní druhy pemfigu [6].
Těžištěm diagnostiky u PNP kromě klasické histopatologie a IF je detekce autoprotilátek imunoprecipitací a imunoblotem; popsány byly autoprotilátky proti desmoplakinu I, II, envoplakinu, periplakinu, plektinu, desmogleinu 1, 3, antigenu BP1 a proteinu o molekulové hmotnosti 170 kDa [19].
IgA pemfigus je velmi vzácná a zatím nedostatečně charakterizovaná jednotka. Rozlišuje se varianta podobná subkorneální pustulóze a intraepidermální varianta. V přímé IF detekujeme IgA autoprotilátky (méně často i IgG a C3) intercelulárně, u varianty intraepidermální v rozsahu celé epidermis a u varianty subkorneální bývá ICS patrná pouze v horních partiích epidermis. IF je pro diagnózu málo senzitivní, v detekci autoprotilátek se používá imunoprecipitace a imunoblot.
Nepřímá IF může být negativní, IgA je detekováno asi v 50 %, v nižších titrech než u klasického pemfigu, senzitivitu zvýší použití lidské kůže jako substrátu. Speciální metodou je nepřímá IF na buněčné linii exprimující desmokolin 1, který je cílovým antigenem u subkorneální varianty. Cílový antigen u intraepidermální varianty zatím nebyl charakterizován [12].
Pemphigus herpetiformis je velmi vzácný typ pemfigu s klinickým obrazem připomínajícím dermatitis herpetiformis a IF nálezy odpovídajícími PV.
2. Subepidermální bulózní dermatózy
Odebíráme perilezionální kůži, drobný puchýřek nebo urtikariální projev.
Bulózní pemfigoid (BP) – v přímé IF detekujeme u BP linii na bazální membráně s IgG a C3, typicky opisující cytoplazmatickou membránu keratinocytu, homogenní linie může indikovat i další subepidermální dermatózy (obr. 3, 4). Vyšetření má vysokou senzitivitu, téměř 100%, selhává jen u špatně provedeného odběru či odběru staré morfy.
Obr. 3. Linie na bazální membráně, kopírující keratinocyty, typická pro bulózní pemfigoid (přímá IF, C3) 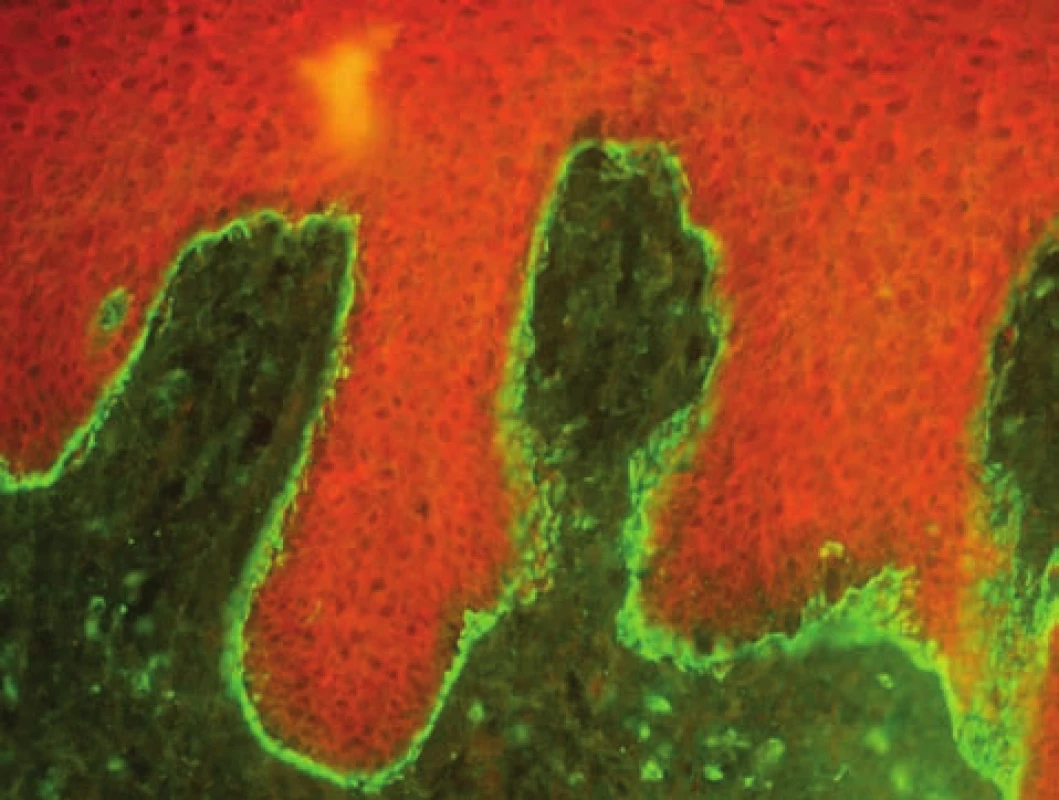
Obr. 4. Homogenní linie na bazální membráně, odpovídá bulóznímu či jizvícímu pemfigoidu i EBA (přímá IF, C3) 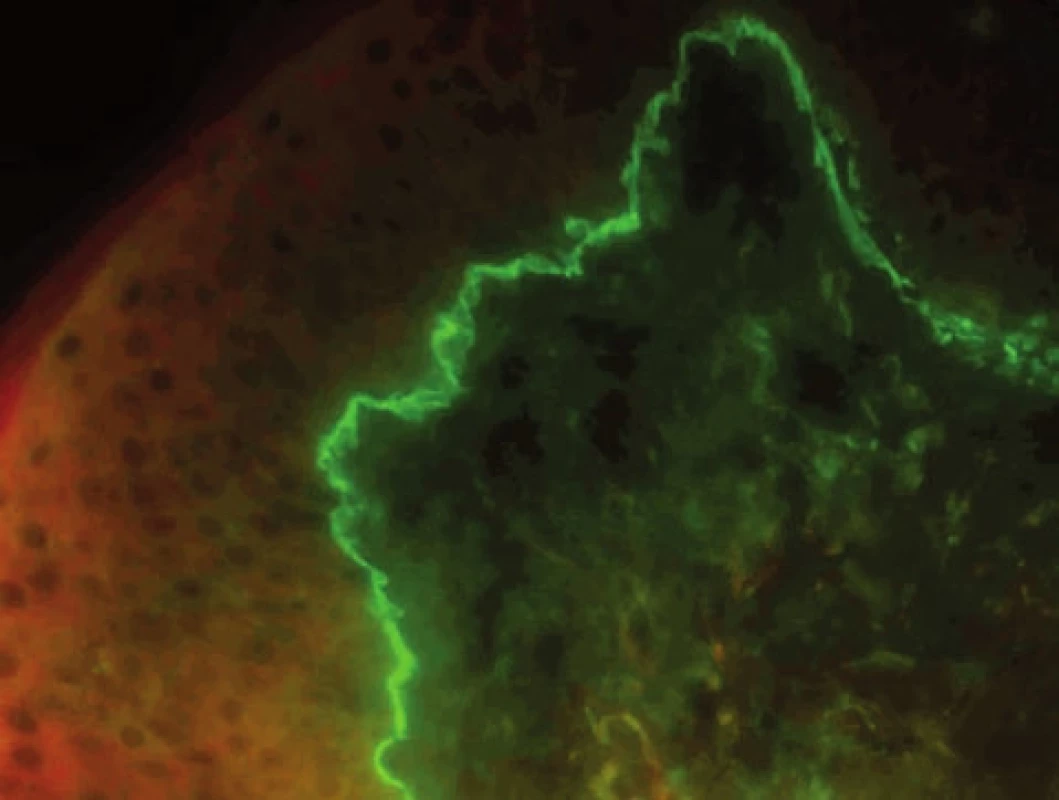
Nepřímá IF je vysoce senzitivní, je pozitivní i u lokalizovaných a rozvíjejících se případů pemfigoidu. Na možnost subklinického pemfigoidu upozorňuje i nález IF cytoplazmatické membrány bazálních buněk na substrátu opičího ezofagu (obr. 5) [14]. Při vyšetření SSS prokazujeme vazbu autoprotilátek na strop puchýře. Cílovými antigeny jsou součásti hemidesmozomu: BP antigen 1(BPAg1 – 230 kD) a BPAg2 (180 kD).
Obr. 5. IF cytoplazmatické membrány bazálních buněk může být detekována v prebulózním stadiu bulózního pemfigoidu (nepřímá IF na opičím ezofagu, polyvalentní Ig) 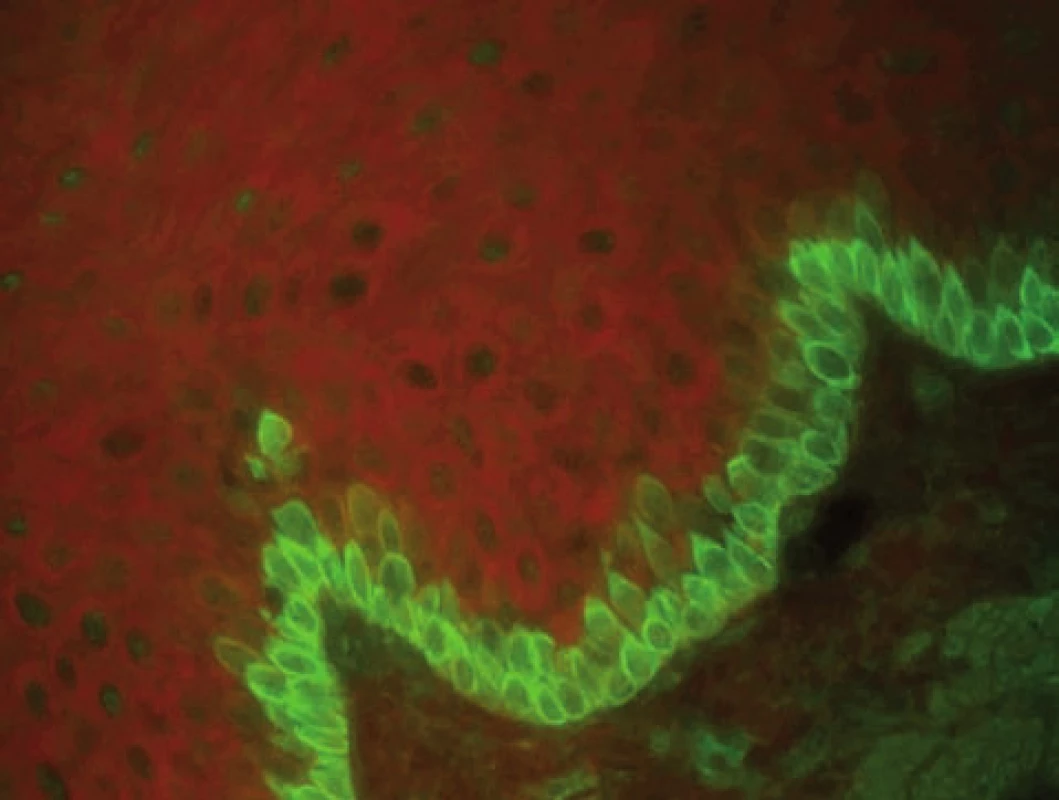
Pemphigoid gestationis (syn. herpes gestationis) je vzácná těhotenská varianta pemfigoidu, která se může asociovat i s choriokarcinomem. V přímé IF detekujeme především C3 složku komplementu, detekce IgG může být negativní, stejně tak i nepřímá IF. Citlivost vyšetření nepřímou IF je možno zvýšit použitím lidské kůže jako substrátu a přidáním čerstvého komplementu. Cirkulující IgG protilátky fixují komplement v oblasti bazální membrány. Cílovým antigenem je BPAg2.
Jizvící pemfigoid („cicatricial pemphigoid“ – CP) – syn. slizniční pemfigoid – vzhledem k převažujícímu postižení sliznic u CP se v současnosti používá název slizniční pemfigoid, „mucous membrane pemphigoid“ – MMP. Na kůži bývají projevy minimální nebo žádné. Pouze kůži postihuje lokalizovaný jizvící pemfigoid („Brunsting-Perry pemphigoid“). Tato varianta se zpravidla objevuje na kůži hlavy a horní poloviny trupu [13]. U jizvícího pemfigoidu má záchyt přímou i nepřímou IF výrazně nižší senzitivitu než u bulózního pemfigoidu.
Přímá IF na kůži je pozitivní pouze asi v 60 %, linie je homogenní, tenká, detekujeme depozita IgG a C3. Na sliznicích je detekce citlivější, problémem je správný odběr z křehké sliznice a zpracování vzorku, především při biopsii spojivky. Na sliznicích bývají také detekovány IgA autoprotilátky.
Nepřímá IF má nízkou senzitivitu, asi 30%, autoprotilátky se vyskytují pouze v nízkých titrech. Solí dělená kůže má senzitivitu vyšší, linie je detekována zpravidla ve stropě, ale i na dně puchýře [10]. Blíže určit lokalizaci štěpení bazální membrány lze mapováním s kolagenem IV (součást lamina densa) [5]. Výtěžnost vyšetření lze zvýšit koncentrováním vyšetřovaného séra [16].
Jizvící pemfigoid je heterogenní onemocnění, s řadou cílových antigenů (BPAg2, laminin 332, alfa6beta4 integrin). Pod klinickým obrazem jizvícího pemfigoidu se může skrývat i IgA lineární dermatóza a epidermolysis bullosa acquisita. Klíčovou je tedy přesná detekce cílových antigenů imunoblotem nebo metodou ELISA.
Epidermolysis bullosa acquisita (EBA) – v přímé IF asi v 80 % detekujeme homogenní linii na bazální membráně, ve spodině puchýře, kde se navazují IgG autoprotilátky (obr. 6), fixující komplement. Při větším zvětšení je možno detekovat roztřepení linie (tzv. „u – serrated pattern“), které odpovídá lokalizaci kolagenu VII pod bazální membránou [32]. U slizniční EBA je možno detekovat i IgA autoprotilátky.
Obr. 6. Linie ve spodině puchýře, odpovídá EBA (přímá IF, C3) 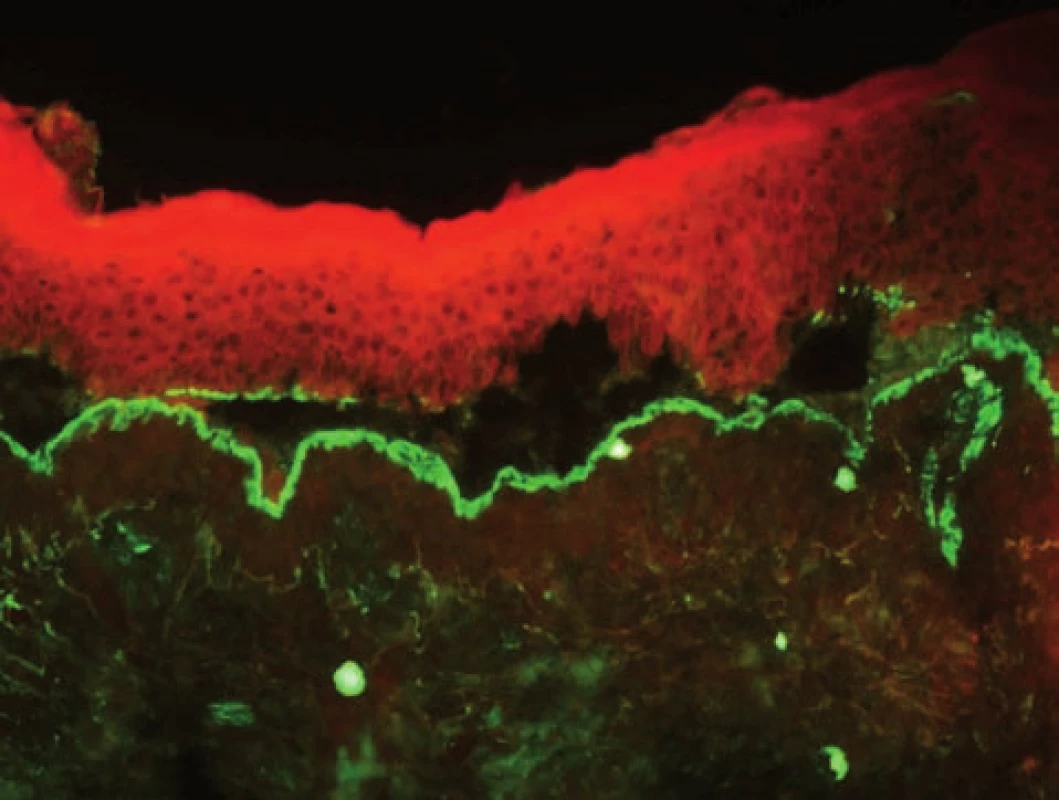
Nepřímá IF má senzitivitu jen asi 50%. U podezření na EBA je vhodné provést vyšetření SSS – antigen epidermolysis bullosa acquisita (NC1 doména kolagenu VII v kotvících fibrilách) je typicky lokalizován ve spodině puchýře [25].
IgA lineární dermatóza (LABD) – cílovým antigenem je fragment antigenu BPAg2, v přímé IF tedy detekujeme linii na bazální membráně s IgA, někdy i s IgG.
Nepřímá IF má nízkou senzitivitu, IgA autoprotilátky detekujeme asi ve 30 % a v nízkém titru. Častější záchyt cirkulujících autoprotilátek je u dětí [26]. Vyšetření SSS je citlivější, popisována jsou depozita jak ve stropě, tak spodině puchýře. U slizniční LABD IF vyšetření neodliší MMP a EBA.
Dermatitis herpetiformis Duhring (DHD) – odběr provádíme z perilezionální kůže čerstvého projevu.
DHD je asociována s gluten senzitivní enteropatií. Ve střevě poškozeném zánětem se tvoří IgA protilátky proti tkáňové transglutamináze (tTG). Ty zkříženě reagují s epidermální transglutaminázou( eTG), která je homologní s tTG. V dermoepidermální junkci se ukládají komplexy IgA autoprotilátek s eTG [22]. V přímé IF je pak typickým nálezem množství drobných zrníček IgA protilátek spolu s C3 ve vrcholcích papil (obr. 7). Méně často detekujeme pruh jemně granulárních uloženin podél BM, tento typ IF nesmí být zaměněn s lineárními uloženinami u LABD [23]. Přítomnost IgM agregátů není specifická. U DHD velmi záleží na správném odběru čerstvé, nerozškrábané morfy nebo perilezionální tkáně. Doporučováno je sériové prokrájení vzorku [9].
Obr. 7. Makovité uloženiny IgA v papilách u dermatitis herpetiformis 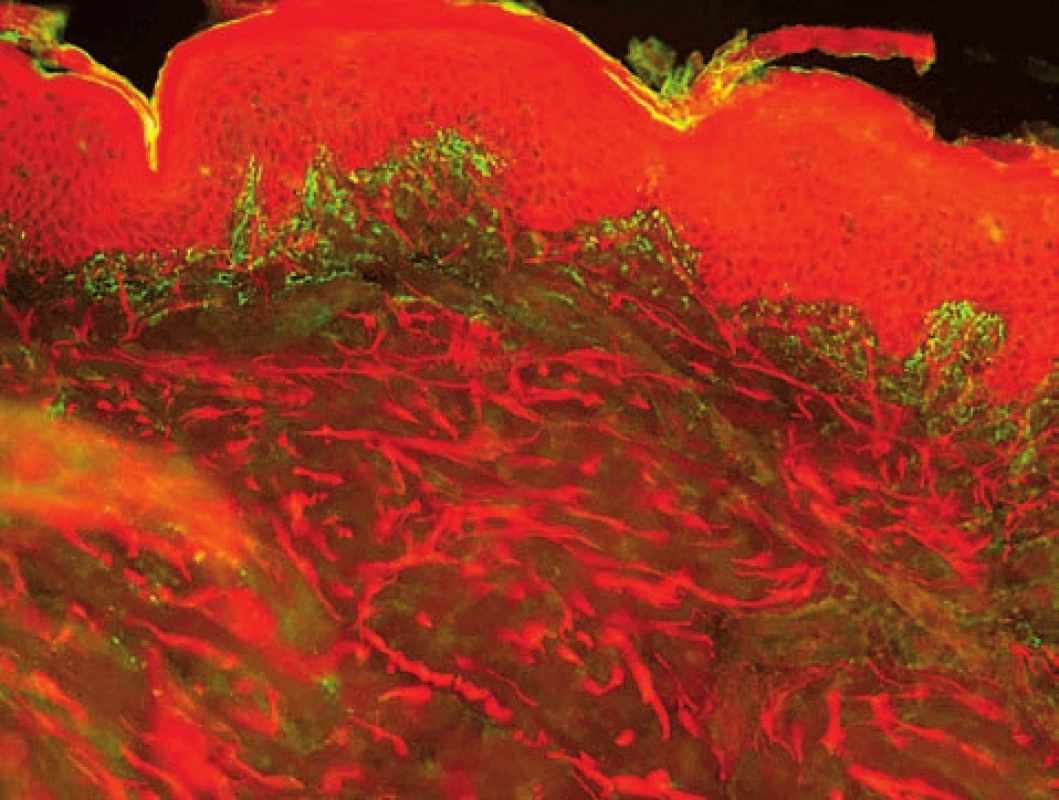
V nepřímé IF detekujeme protilátky proti endomyziu hladkého svalu (opičí ezofagus) a retikulinu (opičí játra). Protilátky proti lepku a tkáňové transglutamináze se detekují metodou ELISA. IgA autoprotilátky proti tkáňové transglutamináze a epidermální transglutamináze jsou vysoce specifické a společně s antiendomyziálními protilátkami mají u DHD největší diagnostickou hodnotu [24].
3. Onemocnění pojiva
Lupus erythematosus (LE) – nález v přímé IF se liší podle typu LE. Odběr se provádí z projevu ložiska.
Systémový LE (SLE) – v postižené kůži detekujeme IgG, IgM, složky komplementu (C3) a fibrin v homogenním, fibrilárním nebo zrnitém pruhu (tzv. lupusový pruh) na bazální membráně. Často jsou detekována depozita Ig i v cévách a kolem ztluštělých bazálních membrán potních žláz jako nespecifický nález, ukazující na autoimunitní poškození daných struktur.
Dříve se často používalo v detekci LE IF vyšetření zdravé, před světlem kryté kůže. Nález lupusového pruhu ve zdravé kůži poukazuje na závažné systémové postižení [31]. Nespecificita nálezu, nutnost biopsie nepostižené kůže a rozvoj dalších diagnostických metod tuto indikaci zatlačily do pozadí. Vyšetření může být přínosné ve sporných případech.
Subakutní kožní lupus erythematosus (SCLE) – u SCLE s typickou pozitivitou anti Ro/SSA autoprotilátek může být v junkční zóně a v dolní části epidermis místo lupusového pruhu detekováno množství drobných zrnitých precipitátů IgG, které odpovídají anti-Ro/SSA autoprotilátkám (obr. 8, 9).
Obr. 8. Lupusový pruh, větší agregáty a rozvolnění junkce u SCLE (přímá IF, IgG) 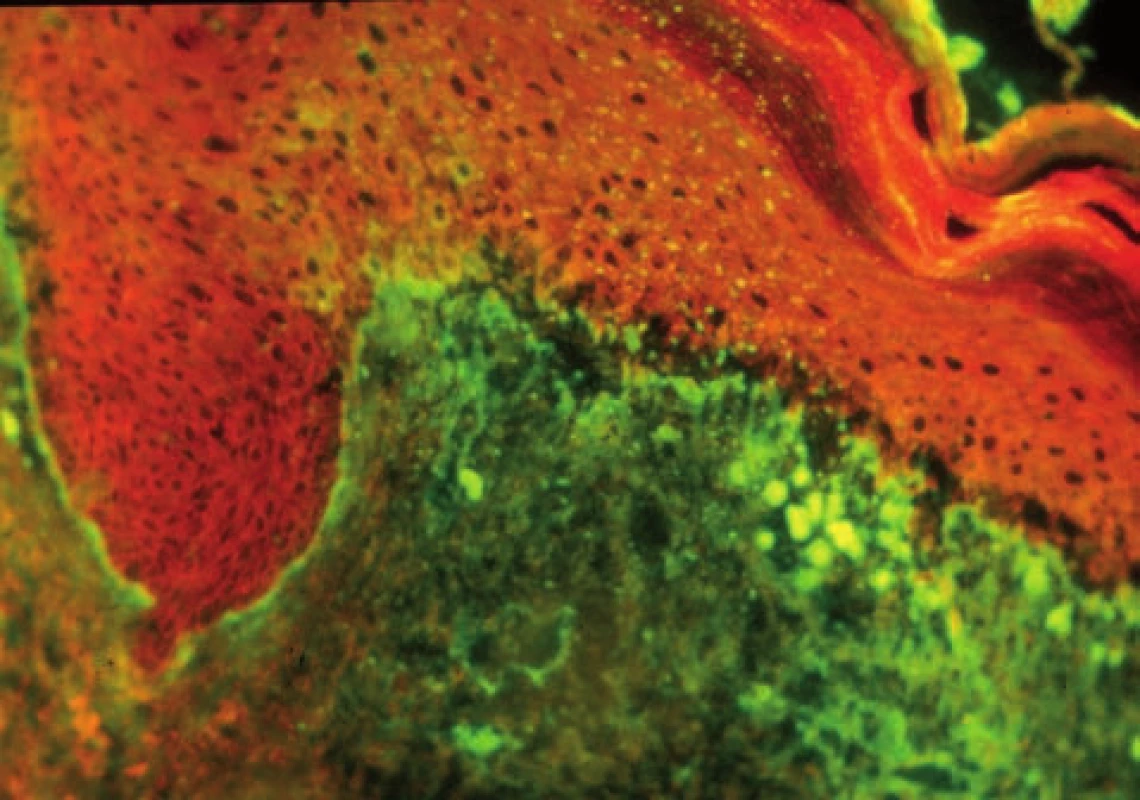
Obr. 9. Větší agregáty v junkci, drobné precipitáty IgG v bazální vrstvě odpovídající Ro protilátkám u SCLE (přímá IF) 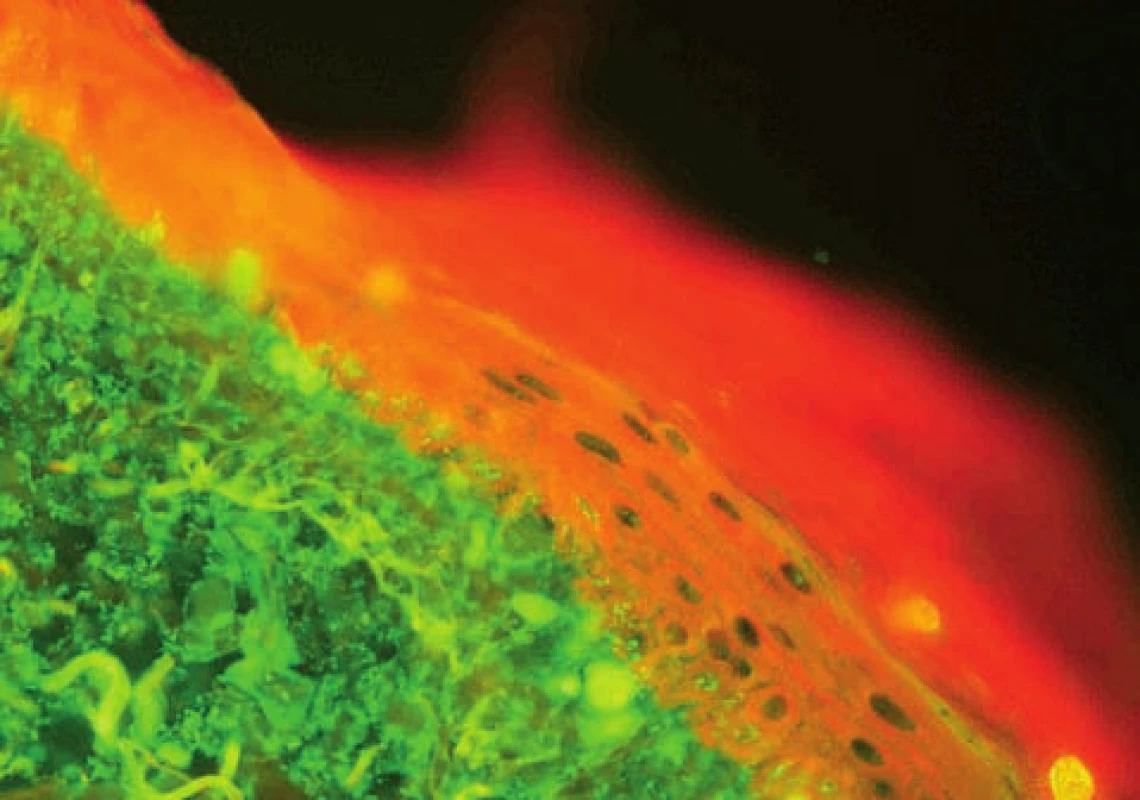
Chronický kožní lupus erythematosus/diskoidní lupus erythematosus (CDE) – u diskoidního LE kromě lupusového pruhu s IgG detekujeme typicky větší imunokomplexové agregáty a apoptotická tělíska obsahující IgM, časté jsou také uloženiny imunoglobulinů a fibrinu v solárně poškozeném vazivu.
Vyšetření nepřímou IF antinukleárních protilátek zůstává bazálním vyšetřením u LE. Na buněčných substrátech (např. Hep-2 buňky) detekujeme pozitivitu antinukleárních autoprotilátek (ANA) a jejich titr. Klinický význam má titr od 1 : 40 výše. Základními typy IF jsou homogenní, periferní, granulární, nukleolární, centromerový a cytoplazmatický. Typ homogenní a periferní jaderné IF je typický pro systémový lupus, pro SCLE a CDE granulární [30]. Pro další typizaci protilátek jsou používány metody ELISA, imunoblot, imunoprecipitace. IF se využívá i pro detekci dsDNA (dvojvláknové DNA) za pomoci bičíkovce Crithidia luciliae, jehož kinetoplast obsahuje čistou dsDNA. Popis množství v současnosti vyšetřovaných autoprotilátek u LE přesahuje rozsah této práce.
Bulózní lupus erythematosus (BSLE) je vzácná varianta systémového lupus erythematosus, charakterizovaná vznikem subepidermálních puchýřů. Prokázána je tvorba autoprotilátek proti NC1 doméně kolagenu VII kotvících fibril, tj. cílového antigenu u EBA (1). Ve vyšetření přímou IF nacházíme lineární i granulární pruhovitou IF bazální membrány epidermis s ukládáním IgG; v nepřímé IF a SSS vyšetření perilezionální kůže zůstává linie ve spodině puchýře. Autoprotilátky se dále prokazují imunoblotem, ELISA, imununoprecipitací.
Smíšené onemocnění pojiva („mixed connective tissue disease“ – MCTD, syn. Sharpův syndrom) – odebírá se vzorek z postižené kůže.
V přímé IF kromě lupusového pruhu detekujeme i ANA v jádrech keratinocytů, což bývá u LE výjimečným nálezem u vysokých titrů protilátek [29] – obrázek 10.
Obr. 10. Homogenní ANAv jádrech keratinocytů i dalších buněk jsou typické pro Sharpův syndrom (přímá IF, IgG) 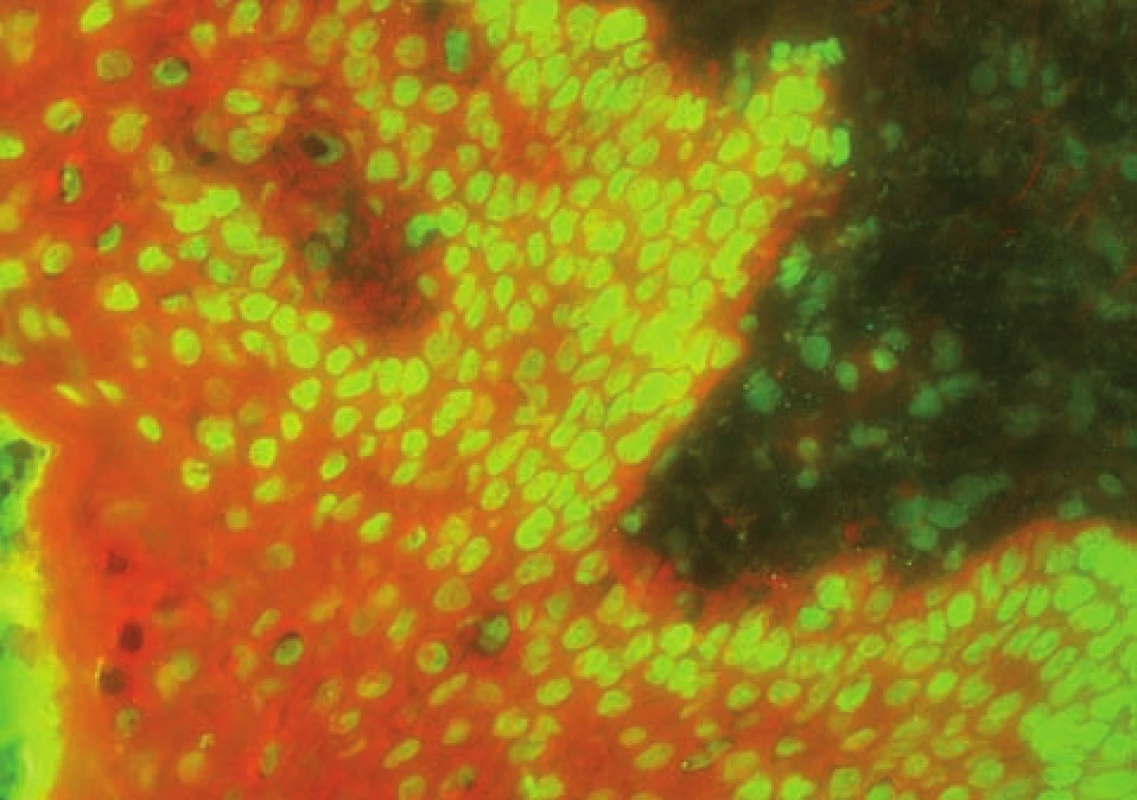
Granulární ANA v nepřímé IF odpovídají autoprotilátkám proti extrahovatelným nukleárním antigenům (ENA) U1RNP, detekovaným ve vysokých titrech.
Sklerodermie
Sklerodermie systémová nemá v přímé IF specifický nález. Můžeme detekovat uloženiny fibrinu v cévách a nespecifické uloženiny v poškozeném vazivu. Popisována je IF jader epidermis a depozita v junkční zóně, převážně s IgM [27].
V nepřímé IF bývají nukleolární ANA v nízkých titrech (odpovídají autoprotilátkám proti Scl70, fibrillarinu, U3-nRNP) či granulární (Ro/SSA) (Hep-2 buňky aj.).
CREST syndrom (syn. limitovaná systémová sklerodermie) má v nepřímé IF typický nález autoprotilátek proti centromerám chromozomů (Hep-2 buňky aj.)
Lokalizovaná sklerodermie (syn. cirkumskriptní sklerodermie, morfea) má obdobný nespecifický nález v přímé IF, ANA bývají negativní.
Dermatomyozitida (DM) – nemá specifický nález v přímé IF, můžeme nalézt lupusový pruh, agregáty v junkci i uloženiny v cévách, nález ale nelze spolehlivě odlišit od LE.
V nepřímé IF můžeme detekovat granulární ANA v nízkých titrech. Určení autoprotilátek je možné dalšími metodami (imunoblot, ELISA). Specifické pro DM jsou anti-Mi-2 autoprotilátky, mohou se vyskytnout i anti Ro/SSA autoprotilátky. Anti Jo-1 jsou pozitivní vzácně, indikují postižení plic, další autoprotilátky specifické pro myozitidu se u DM nevyskytují. V posledních letech byly objeveny protilátky specifické pro amyopatickou DM (anti CADM-140) a paraneoplastickou DM (anti p155) [3].
4. Vaskulitidy
Odebírá se vzorek z ložiska, ne staršího než 24 hodin.
Imunokomplexové vaskulitidy
U vaskulitid detekujeme přímou IF v kůži depozita ve stěnách cév, často IgG, IgM a složky komplementu [21] – obrázek 11.
Obr. 11. Uloženiny C3 v cévě u vaskulitidy (přímá IF) 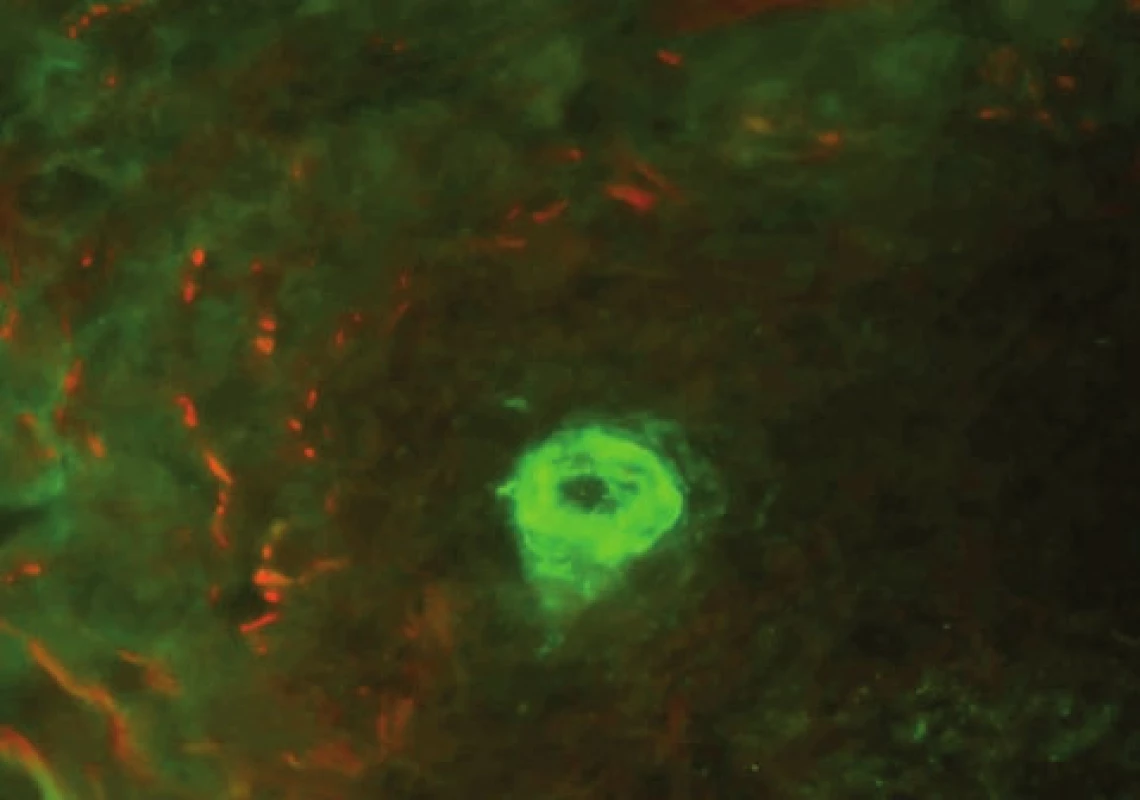
U IgA vaskulitidy (Schönleinova-Henochova purpura) nacházíme typicky depozita IgA. Fibrin se nespecificky může ukládat ve všech postižených cévách, tento nález vždy musí korelovat s klinikou a místem excize (nespecificky bývají postiženy cévy v distálních partiích dolních končetin).
Nepřímá IF detekuje u některých vaskulitid protilátky proti cytoplasmě neutrofilů – tzv. ANCA. Cytoplazmatické c-ANCA jsou specifické pro Wegenerovu granulomatózu (antigenem je proteináza PR3), perinukleární p-ANCA (antigenem je myeloperoxidáza MPO) jsou pozitivní u mikroskopické polyangiitidy a Churgova-Straussova syndromu. Smíšený obraz ANCA v IF byl detekován i u jiných onemocnění než vaskulitid (např. colitis ulcerosa, SLE apod.)
5. Ostatní
Vyšetření přímou IF můžeme použít s výhodou i u lichen ruber planus a porfyrie, které mají typický IF obraz.
Lichen ruber planus (LRP)
Odebírá se vzorek z projevu.
Typickým nálezem pro LRP je přítomnost agregátů, představujících apoptotické keratinocyty, obsahujících IgM, které se vyskytují jednotlivě i ve skupinách v junkční zóně (obr. 12). Poškozená junkční zóna se barví fibrinem v typické krajkovité linii. Tento nález je možno detekovat u všech lichenoidních zánětů a u CDE/LRP overlap syndromu.
Obr. 12. Hnízdo agregátů pod bazální membránou, typické pro lichen planus (přímá IF, IgM) 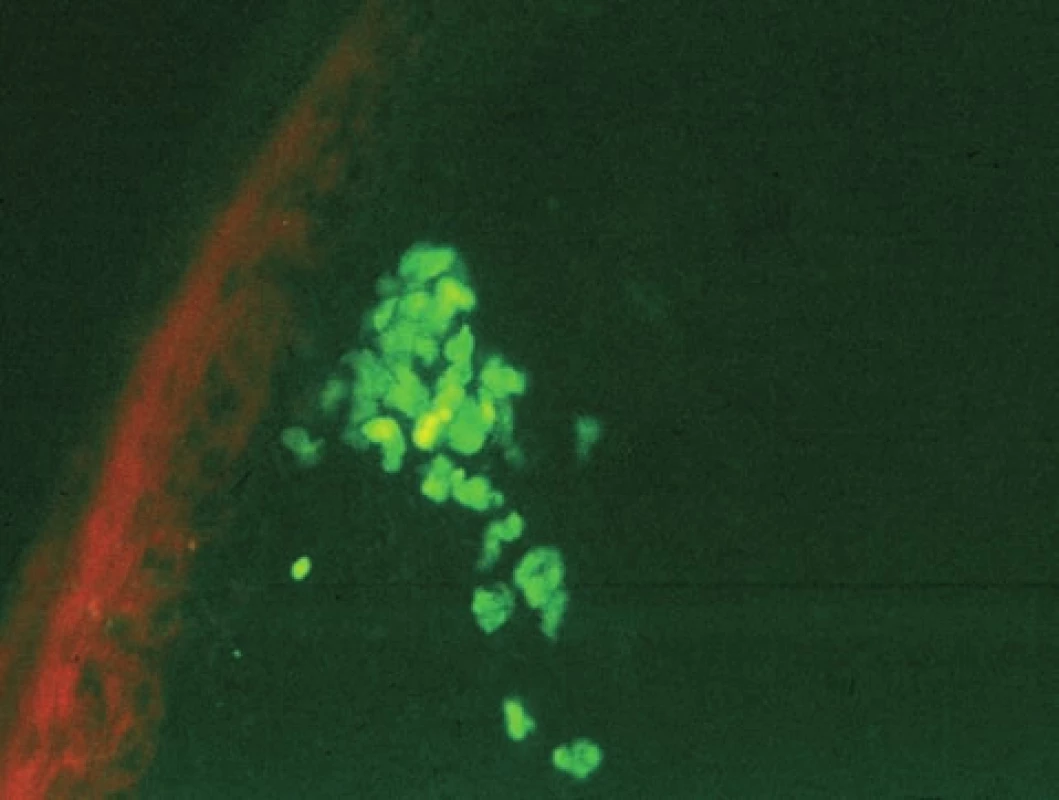
Porphyria cutanea tarda
Odebírá se vzorek perilezionálně.
U porfyrie dochází k poškození kožních cév, které jsou vakovitě rozšířené. V přímé IF pak detekujeme v cévách uloženiny IgG, C3 a fibrinu, někdy i pruh na bazální membráně. Výrazný bývá tento nález i v oblasti potních žláz (obr. 13).
Obr. 13. Vakovité cévy a ztluštění bazálních membrán potních žláz u porfyrie, stejný obraz bývá i u SLE (přímá IF, IgG) 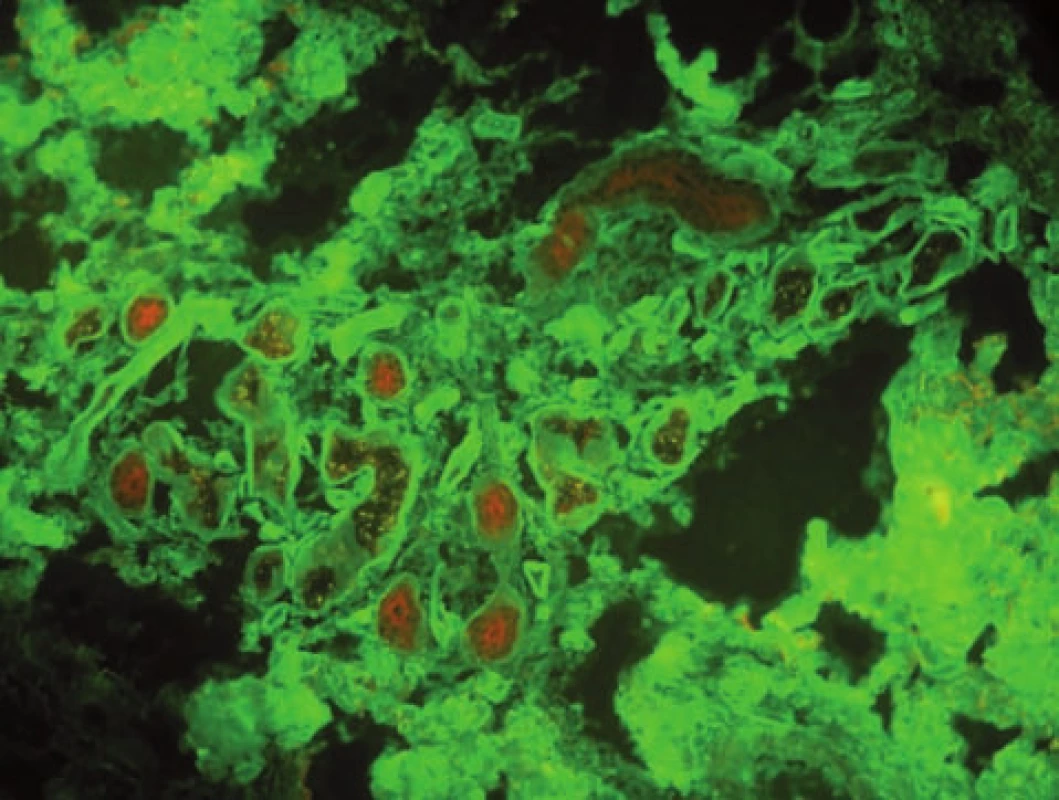
6. Nespecifické nálezy
Od specifických nálezů je nutno odlišit celou řadu nálezů nespecifických.
U řady zánětlivých dermatóz (psoriáza, parapsoriáza) často detekujeme v PIF mírnou imunokomplexovou aktivitu na bazální membráně – pruh z drobných zrnek C3.
Linii na bazální membráně s IgM můžeme detekovat i u jiných chorob než LE, např. u teleangiektázií, fotosenzitivní rosacey, dermatofytóz.
V NIF může být detekována ICS v nízkém titru např. u morbus Crohn, psoriázy, herpetických onemocnění apod.
7. Další
Kromě popsaných indikací lze IF využít v dermatologii i u dalších onemocnění. Příkladem další možnosti imunofluorescenčního vyšetřování v kůži je detekce amyloidu barvením thioflavinem T, se kterým amyloid září žlutě.
IV. MODERNÍ IMUNOFLUORESCENČNÍ METODY
IF metody v posledních letech prožívají velký rozvoj, díky široké škále fluorochromů a monoklonálních protilátek, využívání metod molekulární biologie, zdokonalení detekčních technik a nových aplikací. Fluorescenční metody se využívají při studiu struktury tkání, buněk a buněčných pochodů včetně pozorování in vivo. Heslovitě se zmíníme o nejzajímavějších aplikacích, které mají vztah k dermatologii.
- 1. Rozšíření možností nepřímé imunofluorescence
„Biochip Technology“ využívá technologie rozřezání substrátu na více polí v milimetrových velikostech, což umožní přípravu mnoha polí z jednoho řezu.
„Biochip Mosaic“ využívá více substrátů na jednom skle, umožní tak rychlou detekci antigenního profilu daného séra. K detekci cílového antigenu u puchýřnatých chorob lze např. dermatologickou mozaiku, kdy je na jednom skle fixováno 6 substrátů (opičí ezofagus, SSS, desmoglein 1 exprimující buňky, desmoglein 3 exprimující buňky, BPAg1 a BPAg2 exprimující buňky – Euroimmun).
Firma Euroimmun má také patentovaný EuroplusTm systém – jedná se o monospecifické antigenní kapky nebo řady k vyšetření mnoha vzorků, např. při detekci ANCA [7].
Komerčně dostupný je již též speciální biochip k detekci cílových domén antigenů bulózního pemfigoidu BPAg2 NC16A a globulární domény BPAg1.
- 2. Konfokální laserový mikroskop dosahuje vyššího rozlišení než běžná IF. Detekuje pouze světlo z ohniskové roviny mikroskopu, dopadá skrze clonu na jediný bod vzorku, bodový obraz je skenován, a to v různých rovinách, výsledný obraz je poskládán počítačem. Jeho využití je badatelské. Využívá se při FOAM („Fluorescence overlay mapping“) metodě, při které se skládají obrazy s několika různými konjugáty značenými antigeny do jednoho obrazu. Používá se např. u detekce antigenů v bazální membráně.
- 3. K moderním metodám využití principu fluorescence patří i FISH („fluorescence in situ hybridization“) – cytogenetická technika, která detekuje chybějící nebo nadbytečné sekvence DNA na chromozomech. Vysoce specifické DNA sondy značené fluorochromy se váží na určené oblasti cílových chromozomů. Pro dermatologii má význam použití FISH např. u lymfomů či u maligního melanomu, především u pigmentových lézí s nejasnou biologickou povahou. Detekce chromozomálních aberací podporuje diagnózu maligního onemocnění. Sonda Vysis (Abbot) je konstruována k detekci častých poškození chromozomů 6 a 11 (geny RREB1, MYB, CCDN1 a centromera 6) u maligního melanomu [20].
- 4. Průtoková cytometrie je založena na principu IF a používá pro značení buněčných subpopulací fluorochromy. Mezi četné možnosti využití průtokové cytometrie patří stanovování subpopulací lymfocytů u kožních lymfomů či poruch imunity.
Tab. 1. Přehled IF nálezů u bulózních onemocnění 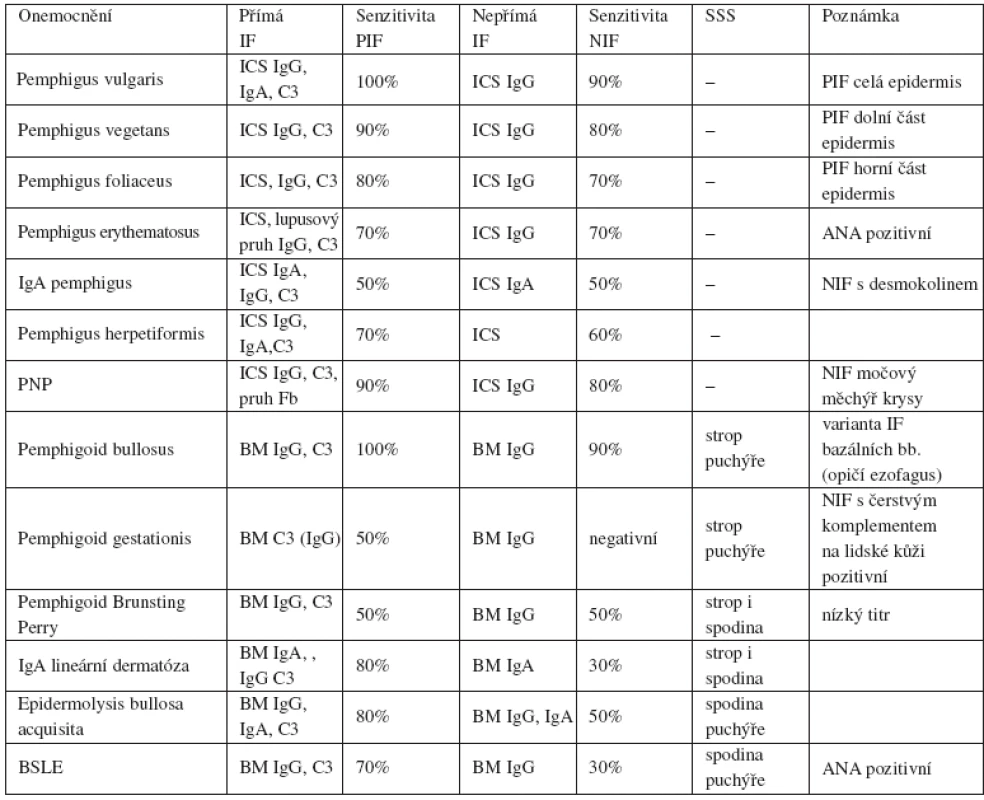
ANA – antinukleární protilátky, BM – bazální membrána, ICS – intercelulární substance, NIF – nepřímá imunofluorescence, PIF – přímá imunofluorescence, PNP – paraneoplastický pemfigus, SSS – salt split skin V. ZÁVĚR
Přehled tradičních indikací a očekávaných výsledků v přímé a nepřímé imunofluorescenci si klade za cíl pomoci čtenáři orientovat se mezi nálezy u jednotlivých onemocnění. Krátce také zmiňuje molekulární charakteristiku detekovaných antigenů a nové možnosti fluorescenční diagnostiky se vztahem k dermatologii. Ačkoliv stále více hodnocení přebírají počítače, i dnes zůstává prostor pro pozorovatele, fascinovaného zářícím světem fluorescenční mikroskopie.
*Věnováno k životnímu jubileu prof. Vlašína.
Do redakce došlo dne 14. 3. 2011.
Kontaktní adresa:
Doc. MUDr. Hana Jedličková, CSc.
Dermatovenerologická klinika FN u sv. Anny
Pekařská 53
956 91 Brno
e-mail: hana.jedlickova@fnusa.cz
Zdroje
1. ALAHLAFI, A. M., WORDSWORTH, P., WOJNAROWSKA, F. The lupus band: do the autoantibodies target collagen VII? Br. J. Dermatol., 2004, 150, p. 504–510.
2. BEUTNER, E. H., JORDON, R. E. Demonstration of skin antibodies in sera of pemphigus vulgaris patients by indirect immunofluorescent staining. Proc. Soc. Exp. Biol Med., 1964, 117, p. 505–510.
3. BIELSA, I. New Antibodies in Dermatomyositis. Actas Dermosifiliogr., 2009, 100, p. 182–189.
4. BURNHAM, T. K., NEBLETT, T. R., FINE, G. Application of fluorescent antibody technique to the investigation of lupus erythematosus and various dermatoses. J. Invest. Dermatol., 1963, 41, p. 451–456.
5. BRUCH-GERHARZ, D., HERTL, M., RUZICKA, T. Mucous membrane pemphigoid: clinical aspects, immunopathological features and therapy. Eur. J. Dermatol., 2007, 17, p. 191–200.
6. CETKOVSKÁ, P. Autoimunitní bulózní dermatózy. Čes-slov. Derm., 2006, 81, p. 188–196.
7. DAMOISEAUX, J., STELLER, U., BUSCHTEZ, M., VAESSEN, M., ROSEMANN, A., VAN PAASSEN, P., STÖCKER, W., FECHNER, K., TERVAERT, J. W. EUROPLUS ANCA BIOCHIP mosaic: PR3 and MPO antigen microdots improve the laboratory diagnostics of ANCA-associated vasculitis. J. Immunol. Methods., 2009, 348, p. 67–73.
8. FRIOU, G. J. Clinical application of lupus serum. Nucleoprotein reaction using fluorescent antibody technique. J. Clin. Invest.,1957, 36, p. 890.
9. FRY, L. Dermatitis herpetiformis: problems, progress and prospects. Eur. J. Dermatol., 2002, 12, p. 523–531.
10. HALAGOVEC, A., JAUTOVÁ, J., ROSOCHA, J., GARZANIČ, V., ANDRAŠKO, J., MARTINÁSKOVÁ, K., KAMPE, T. Súčasné možnosti imunohistochemického diagnostikovania autoimunitných bulóznych ochorení v zóne epidermálnej bazálnej membrány. Čes-slov. Derm., 2002, 77, p. 245–251.
11. HONOMICHLOVÁ, P., PIZINGER, K., CETKOVSKÁ, P. Paraneoplastický pemfigus. Čes-slov. Derm., 2004, 5, p. 173–175.
12. IIDA, K., SUEKI, H., OHYAMA, B., ISHII, N., HASHIMOTO, T. A Unique Case of Intra-Epidermal Neutrophilic Dermatosis-Type IgA Pemphigus Presenting with Subcorneal Pustules. Dermatology, 2011, 222, p. 15–19.
13. JEDLIČKOVÁ, H., NIEDERMEIER, A., ZGAŽAROVÁ, S., HERTL, M. Brunsting-Perry Pemphigoid of the Scalp with Antibodies against Laminin 332. Dermatology., 2011 [Epub ahead of print].
14. JEDLIČKOVÁ, H., RAČOVSKÁ, J., NIEDERMEIER, A., FEIT, J., HERTL, M. Anti-basement membrane zone antibodies in elderly patients with pruritic disorders and diabetes mellitus. Eur. J. Dermatol., 2008, 18, p. 534–538.
15. JORDON, R. E., BEUTNER, E. H., WITEBSKY, E., BLUMENTAL, G., HALE, W. L., LEVER, W. F. Basement zone antibodies in bullous pemphigoid. JAMA, 1967, 200, p. 751–756.
16. KORMAN, N. J., WATSON, R. D. Immune –mediated subepidermal blistering diseases of the mucous membranes: improving the detection of circulating autoantibodies by the use of concentrated serum samples. Arch. Dermatol., 1996, 132, p. 1194–1198.
17. KRATOCHVIL, F. Využití a klinický význam imunofluorescenčních metod v dermatologii. Brno: Opuscula dermatovenerologica 101, Sborník prací Lékařské fakulty v Brně, 1988.
18. VAN DER MEER, J. B. Granular deposits of immunoglobulins in the skin of patients with dermatitis herpetiformis. An immunofluorescent study. Br. J. Dermatol., 1969, 81, p. 493–503.
19. MEGAHED, M. Paraneoplastic pemphigus. In: Histopathology of blistering diseases. Berlin: Springer 2004, p. 103–108.
20. MOREY, A. L., MURALI, R., MCCARTHY, S. W., MANN, G. J., SCOLYER, R. A. Diagnosis of cutaneous melanocytic tumours by four-colour fluorescence in situ hybridisation Pathology., 2009, 41, p. 383–387.
21. MUTASIM, D. F., ADAMS, B. B. Immunofluorescence in dermatology. J. Am. Acad. Dermatol., 2001, 45, p. 803–822.
22. ROSE, C., ARMBRUSTER, F. P., RUPPERT, J., IGL, B-W., ZILLIKENS, D., SHIMANOVICH, I. Autoantibodies against epidermal transglutaminase are a sensitive diagnostic marker in patients with dermatitis herpetiformis on a normal or gluten-free diet. J. Am. Acad. Dermatol., 2009, 61, p. 39–43.
23. ROSE, C., ZILLIKENS, D. Dermatitis Herpetiformis Duhring. In: Autoimmune diseases of the skin. Hertl, M. (ed.) Wien: Springer, 2005, 2. angl. Vydání, p. 95–108.
24. SALAVEC, M. Diagnostika a terapie autoimunitních puchýřnatých chorob. Dermatol. praxi., 2010, 4, p. 148–155.
25. SALAVEC, M., NOŽICKA, Z., ROZSÍVALOVÁ, V., PAVLÁTOVÁ, J. The immunofluorescence evaluation of some subepidermal bullous diseases by use of NaCl-split skin. Sb. Ved. Pr. LF UK, Hradec Králové. 1994, 37, p. 67–71.
26. SALAVEC, M. et al. IgA bulózní dermatóza u dětí. Derma., 2009, 1, p. 15–19.
27. SHIBESHI, D., JARZABEK - CHORZELSKA, M., JABLOŃSKA, S., CHORZELSKI, T. Immunopathologic findings in systemic sclerosis patients: clinical and immunopathologic relationships. Int. J. Dermatol., 1989, 28, p. 650–656.
28. VLAŠÍN, Z. Puchýřnatá onemocnění skupiny pemfigu a pemfigoidu. Praha: Avicenum, 1978.
29. VLAŠÍN, Z., HLUBINKA, M., JEDLIČKOVÁ, H., RULCOVÁ J., LOKAJ, J. Nejběžnější imunofluorescenční obrazy kožních chorob. Klin. imunológia a alergológia, 2000, 10, p. 5–8.
30. VLAŠÍN Z., HLUBINKA M., POKORNÁ, J., JEDLIČKOVÁ, H., LOKAJ J. Diagnostické využití metody nepřímé imunofluorescence v dermatologii. Čes-slov. Derm., 2000, 75, p. 75–79.
31. VLAŠÍN, Z., HLUBINKA, M., RULCOVÁ, J. Výsledky imunohistologického vyšetřování nepostižené (před sluncem chráněné) kůže předloktí u skupiny 60 nemocných SLE a možnosti diagnostické aplikace této metody. Prakt. Lékař., 1995, 75, p. 559–563.
32. VODEGEL, R. M., JONKMAN, M. F., PAS, H. H., DE JONG, M. C. U-serrated immunodeposition pattern differentiates type VII collagen targeting bullous diseases from other subepidermal bullous autoimmune diseases. Br. J. Dermatol., 2004, 151, p. 112–118.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2011 Číslo 4- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- INFOGRAFIKA: Vzácná diagnóza včas
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
-
Všechny články tohoto čísla
- Jsou za námi další 4 roky našeho života
- Imunofluorescenční vyšetření v dermatologii*
- DOŠKOLOVÁNÍ LÉKAŘŮ – KONTROLNÍ TEST
- Psoriaziformné kožné reakcie počas liečby TNF-α blokátormi
- Dermatitida z korálů Rudého moře
- Naše zkušenosti s léčbou psoriázy ustekinumabem
- Bizarní ulcerace ve kštici
- Nodulární tumor na trupu
- Zpráva z 22. světového dermatologického kongresu v Soulu (24. – 29. 5. 2011)
- Odborné akce v roce 2011
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dermatitida z korálů Rudého moře
- Imunofluorescenční vyšetření v dermatologii*
- Psoriaziformné kožné reakcie počas liečby TNF-α blokátormi
- Nodulární tumor na trupu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



