-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné trendy a nové možnosti v léčbě melanomu
Current Developments and New Treatment Options in the Therapy of Melanoma
Melanoma incidence is consistently rising as well as the detection of early prognostically favourable tumours. However, the number of advanced tumours with high risk of further progression is not decreasing. Adjuvant therapy with IFN α prolongs disease free survival in some patients but has only limited effect on prolongation of the overall survival. Chemotherapy and chemo-immunotherapy is only partially effective and they usually give only short-term response rates. Research of new treatment options is oriented, among others, also on immunomodulatory therapy that could break the immune tolerance of cancer cells. Blocking of the CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4) seems to be one of the promising approaches. As long as the results of ongoing clinical trials are not confirmed, the most effective treatment remains an early surgical removal of the tumour.
Key words:
primary melanoma – adjuvant therapy – metastatic melanoma – immunomodulation – anti CTLA 4 – autoimmunity
Autoři: I. Krajsová
Působiště autorů: Dermatovenerologická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. J. Štork, CSc
Vyšlo v časopise: Čes-slov Derm, 85, 2010, No. 4, p. 189-195
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Incidence melanomu trvale stoupá a zvyšuje se záchyt časných prognosticky příznivých nádorů. Současně ale neklesá počet primárně diagnostikovaných pokročilých melanomů s vysokým rizikem další progrese. Adjuvantní léčba IFN α prodlužuje u některých nemocných přežívání bez relapsu, ale velmi omezeně prodlužuje i celkové přežití. Chemoterapie a chemoimunoterapie má v léčbě metastazujícího melanomu pouze omezenou účinnost a léčebné odpovědi jsou většinou velmi krátkodobé. Pozornost při hledání nových terapeutických možností je mimo jiné zaměřena na imunomodulační léčbu, která by dokázala prolomit toleranci imunitního systému k nádorovým buňkám. Jedním ze slibných postupů se zdá blokáda CTLA-4. Dokud nebudou výsledky probíhajících studií potvrzeny, zůstává nejúčinnější léčbou primárního melanomu včasný chirurgický výkon.
Klíčová slova:
primární melanom – adjuvantní léčba – metastazující melanom – imunomodulace – anti-CTLA-4 – autoimunitaÚVOD
Incidence melanomu stále stoupá a v ČR se, stejně jako v ostatních zemích, za posledních 20 let jeho výskyt téměř ztrojnásobil. V roce 1987 bylo diagnostikováno 771 nových případů kožního melanomu a v roce 2007 již 2016. I když dochází díky řadě výukových programů pro laickou i zdravotnickou veřejnost k záchytu melanomu v počínajícím vývojovém stadiu, přetrvává stále vysoké procento nemocných, kteří přicházejí na první vyšetření až s velmi pokročilým a vysoce rizikovým nádorem. V současné době se poměr časných a pokročilých melanomů pohybuje na úrovni 80 : 20 %. I přesto je melanom stále odpovědný až za 90 % všech úmrtí na kožní nádory.
Melanom je nádor vznikající maligní transformací melanocytů. Nejčastěji postiženým orgánem je kůže, ale může se objevit primárně i v očích, v oblasti uvey, ciliárního tělesa či spojivky. Vzácněji vzniká primární melanom i na sliznicích dýchacího, trávícího a urogenitálního traktu, na meningách a jiných vnitřních orgánech.
Hlavním etiologickým faktorem je intenzivní expozice UV záření, zejména intermitentní, způsobující spálení kůže. Nejvíce ohroženou částí populace jsou lidé se světlou kůži, mnohočetnými melanocytárními névy nebo s atypickými dysplastickými névy (DN). Jsou popisovány také případy hereditárního melanomu, často spojené s familiárním výskytem DN. Představují asi 5–10 % všech zachycených nádorů.
Prognostické faktory a staging melanomu
Nejvýznamnějšími prognostickými faktory jsou tloušťka nádoru měřená v milimetrech na 2 desetinná místa, označovaná jako hodnota Breslowa a ulcerace nádoru potvrzená histologicky jako defekt v celém rozsahu epidermis. Hloubka invaze, neboli hodnota Clarka, je od zavedení nové AJCC klasifikace v roce 2002 považována za významnou pouze u velmi tenkých melanomů do tloušťky 1,00 mm. Nově se hodnotí mitotická aktivita jako nezávislý prognosticky významný faktor. Většina kožních melanomů, uvádí se že až 90 %, je zachycena jako primární nádory (2).
Melanom má, při překročení určité vývojové fáze, vysokou tendenci k metastazování lymfogenní i hematogenní cestou. Za rysy, které naznačují pravděpodobnou agresivitu biologického chování a riziko metastazování, jsou považovány tloušťka nádoru nad 1,00 mm, hodnota Clarka IV až V a verikální růst. Přibližně 20–25 % všech primárních melanomů je diagnostikováno až v těchto fázích nádorového růstu.
K potvrzení přesného stadia onemocnění je nezbytné znát jeho celkový rozsah. Proto bylo zavedeno vyšetřování sentinelové uzliny (SLN), což je první regionální uzlina, která drénuje oblast kůže postiženou primárním melanomem. Mapování SLN je minimálně invazivní metoda umožňující patologické zhodnocení stavu regionálních lymfatických uzlin u pacientů s pokročilým nádorem. Je šetrnější než kompletní disekce a velmi spolehlivě informuje o celkovém stavu regionální lymfatické oblasti. Negativní SLN, při správném a pečlivém histopatologickém zhodnocení, vylučuje postižení následných uzlin. Průkaz metastáz v SLN je naopak indikací k exenteraci regionálních lymfatických uzlin a označuje nemocné s vysokým rizikem další progrese onemocnění. Vyšetření sentinelové uzliny není v současné době považováno za léčebnou metodu. Jedná se o vyšetřovací metodu umožňující přesný staging onemocnění a je indikována pro nemocné s pokročilým primárním melanomem pT1b – pT4b.
Asi 2/3 nádorů metastazují primárně do regionálních lymfatických uzlin, zbylá část se šíří přímo hematogenně. Riziko hematogenního šíření stoupá se zvyšující se tloušťkou nádoru, hloubkou invaze a přítomností ulcerace. Samotná chirurgická léčba je tedy účinná pouze u časných stadií melanomu.
Vysoké riziko metastazování pokročilých primárních melanomů vede k hledání nových léčebných postupů, které by dokázaly progresi onemocnění zabránit.
Adjuvantní léčba melanomu
Až 90 % všech metastáz vzniká v průběhu prvních 5 let po operaci primárního nádoru a asi 10 % se objevuje v delším časovém odstupu i jako velmi pozdní. Popsány jsou případy metastazování po 25 i více než 30 letech. Zabránit takovéto progresi onemocnění má za cíl adjuvantní léčba. Je tedy určena nemocným po odstranění primárních pokročilých melanomů, u kterých nejsou klinicky prokazatelné metastázy, ale riziko jejich vzniku je velmi vysoké. Podle doporučovaných standardů léčby onkologických onemocnění jsou za pokročilé nádory považovány melanomy stádia II B – III C podle nové AJCC klasifikace (15). Jedná se o melanomy s hodnotou Breslowa vyšší než 2,00 mm a s ulcerací nebo nádory se všemi typy metastáz v regionálních lymfatických uzlinách a satelitními či intranzitními metastázami.
Mikrometastázy v sentinelových uzlinách (SLN) nejsou klinicky detekovatelné a prokazují se až histologickým vyšetřením. Satelitní metastázy jsou nádorová ložiska do vzdálenosti 2 cm od nádoru, zatímco intranzitní metastázy se objevují až 2 cm od nádoru a směřují k regionální lymfatické oblasti. Makrometastázy způsobují klinicky patrné zvětšení regionálních uzlin.
Metastatické postižení uzlin významně zhoršuje prognózu onemocnění, uvádí se, že 10leté přežití u pacientů s mikrometastázami je 30–70 %, u pacientů se satelitními a intranzitními metastázami 30–50 % a při makroskopickém postižení uzlin se snižuje až na 20–40 %.
Cílem adjuvantní léčby melanomu je likvidace předpokládaných okultních metastáz a prodloužení celkového přežití nemocných (OS), včetně prodloužení přežívání bez relapsu (DFS).
V adjuvantní léčbě melanomu se od poloviny minulého stolení vyzkoušela řada léčebných přístupů.
Mezi chirurgické adjuvantní léčebné postupy lze zařadit elektivní disekci regionálních lymfatických uzlin, která však byla nahrazena méně zatěžujícím a velmi spolehlivým vyšetřením sentinelové uzliny. V současné době se však nejedná o léčebnou, ale pouze o diagnostickou metodu umožňující přesnější určení prognózy onemocnění. Pod adjuvantní chirurgickou léčbu lze zařadit také končetinovou cytostatickou perfúzi. Vzhledem k relativně vysokému riziku nežádoucích účinků a nízké účinnosti v adjuvantní aplikaci je ale tato metoda využívána více v léčbě metastazujícího melanomu.
Adjuvantní aktinoterapie má omezené využití zejména v případech, kdy není možné dostatečně radikální odstranění nádoru. Týká se tak hlavně primárně slizničních melanomů v ORL a urogenitální oblasti nebo rozsáhlých uzlinových metastáz pronikajících přes pouzdro uzliny.
V adjuvantní chemoterapii je nejčastěji zkoušeným preparátem Dacarbazin, jeho podávání ale neprokázalo statistické významné prodloužení OS. Ani použití více preparátů v kombinované chemoterapii nedosahuje přesvědčivých výsledků a neprodlužuje přežívání nemocných.
V posledních desetiletích došlo k výraznému pokroku v imunoterapii maligních nádorů. Adjuvantní imunoterapie je v současnosti nejvíce využívanou léčebnou metodou u pokročilých primárních melanomů.
Pozorování častých spontánních regresí nebo výrazné lymfocytární infiltrace primárních melanomů vedlo k předpokladu, že imunitní systém nositele hraje při vzniku i dalším vývoji nádoru významnou roli. Schopnost imunitní odpovědi na nádor je velmi individuální a její kvalita má zásadní prognostický a prediktivní význam. Imunoterapie může spustit imunitní protinádorovou odpověď tím, že poruší toleranci vůči vlastním antigenům nebo odkryje imunitnímu systému nádorové antigeny. Vznik vitiliga, antithyreoidálních autoprotilátek a dalších autoimunitních rekcí u nemocných s melanomem bývá spojován s příznivějším průběhem onemocnění, delším obdobím do relapsu i prodloužením celkové doby přežití.(1) Lepší porozumění regulaci imunitního systému či dynamiky interakcí mezi nádorem a hostitelem tak umožňuje vývoj nových léčebných postupů, které stimulují nebo spouštějí účinnou imunitní protinádorovou odpověď.
Interferon α (IFN α) je cytokin nejdéle používaný v adjuvantní léčbě melanomu. První randomizované klinické studie byly zahájeny již v osmdesátých letech minulého století. Metaanalýzy proběhlých studií potvrzují statisticky významné prodloužení přežívání bez relapsu, a v některých studiích i prodloužení celkového přežití nemocných léčených adjuvantně IFN α. (6) Stále nebylo jednoznačně rozhodnuto o výši jednotlivých léčebných dávek, o optimální celkové době podávání ani o intervalech nebo způsobu aplikace. Přesto je zřejmé, že určitá skupina populace pacientů z této léčby profituje. Výzkum je v poslední době zaměřen na zjištění prediktivních faktorů, které by označovaly nemocné, u kterých dokáže aplikace IFN α prodloužit OS. Jedním z pozitivních ukazatelů může být spuštění autoimunitních reakcí, ale dosud neznáme parametry, které by nám naznačily, u kterých nemocných k této reakci dojde (4). Zatím předběžná pozorování také naznačují, že pegylovaný IFN α dokázal u pacientů s ulcerovaným melanomem prodloužit DFS více než u nemocných s neulcerovaným nádorem (3). K ověřené této hypotézy se připravují další studie s pegylovaným IFN α. Jeho výhodou je možnost aplikace 1x týdně.
V současné době je indikována adjuvantní léčba s IFN α u nemocných s pokročilými melanomy stadia II B – III C. Používána jsou různá léčebná schémata v závislosti na zkušenostech a preferencích jednotlivých pracovišť. V USA je FDA schválen pouze vysokodávkový IFN α 2b dle Kirkwoodova ECOG (East Cooperative Group) schématu, ve střední Evropě se spíše dle schémat WHO a EORTC využívají střední a nízké dávky IFN α 2a a 2b, jak ukazuje tabulka 1.
Tab. 1. IFN α - různá léčebná schémata 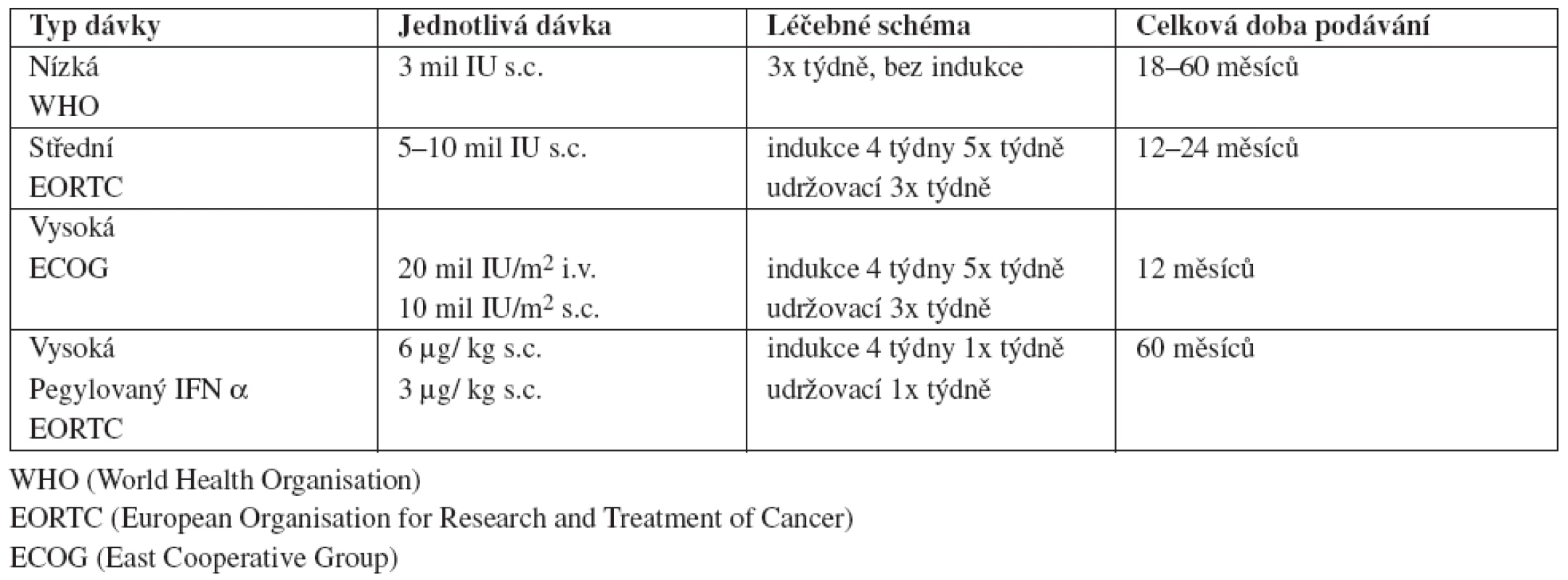
Využití IFN α v adjuvantní léčbě melanomu zčásti omezuje toxicita léčby. Vždy je nutné porovnat výši rizika progrese onemocnění s možnou závažností nežádoucích účinků. Podávání IFN α bývá spojeno s toxickým působením na řadu orgánů a závažnost příznaků je ovlivňována výškou dávky, celkovým stavem, současně probíhajícími nemocemi, jinou konkomitantní léčbou i individuální reaktibilitou pacienta. Před zahájením léčby je nezbytné pacienta poučit o očekávaných komplikacích a možnostech jejich ovlivnění (5).
Akutní chřipkové příznaky vznikají téměř u všech nemocných při zahájení léčby, jsou ale dobře ovlivnitelné antipyretiky nebo nesteroidními antirevmatiky a postupně ve většině případů odeznívají. Pravidelnými laboratorními vyšetření je možné monitorovat, včas odhalit a potlačit hematologickou či hepatální toxicitu. Spuštění autoimunitních reakcí se většinou projevuje autoimunitní thyreoiditou s následnou hypotyreózou dobře zvládnutelnou správnou endokrinologickou léčbou. Na kůži můžeme pozorovat vitiligo jako projev autoimunitní reakce, ale také různé necharakteristické exantémy nebo toxoalergické reakce. Vypadávání a prořídnutí kštice je nepříjemným nežádoucím účinkem, který ale odeznívá po ukončení léčby. Neurologické a psychiatrické příznaky mohou být různého typu a je nutné je vždy řešit s odborníky. Velmi nepříjemným nežádoucím účinkem bývá únava, která je obtížně ovlivnitelná, někdy pomůže snížení dávky, ve výjimečných případech je nutné i z tohoto důvodu léčbu ukončit.
V rámci EORTC MCG (Melanoma Cooperative Group) byla zahájena také první mezinárodní randomizovaná klinická studie s adjuvantním podáváním monoklonální protilátky proti CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4) – Ipilimumabu. Je porovnávána jeho účinnost oproti placebu u pacientů s melanomem po operaci uzlinového postižení stadia III A, B, C. Předběžné výsledky je možné očekávat až v odstupu několika let. Ipilimumab bude podrobněji zmíněn v části věnované léčbě metastatického melanomu.
Nádorové vakcíny se podávají s cílem prolomit toleranci hostitele vůči nádoru a posílit T buněčnou odpověď. Velmi důležitá pro účinnost této léčby je volba vhodného cílového antigenu exprimovaného nádorovými buňkami. V léčbě melanomu se zkoušela již dlouhá řada různých typů vakcín s různými antigeny, bohužel bez většího léčebného efektu. EORTC studie s GMK vakcínou byla dokonce předčasně ukončena pro horší průběh onemocnění u léčených pacientů. V poslední době se v rámci mezinárodní klinické studie DERMA zkouší vakcinace s MAGE-A3 antigenem, který je popisován až u 70 % melanomů a bylo prokázáno, že je schopen vyvolat tvorbu dlouho přetrvávajících protilátek. Vakcína je podávána v rámci adjuvantní léčby u nemocných s makroskopicky postiženými regionálními uzlinami. Výsledky této a dalších studií s vakcínami jsou netrpělivě očekávány (12).
Léčba metastazujícího melanomu
Metastazující melanom je onemocnění s velmi špatnou prognózou a mediánem přežití pohybujícím se mezi 6–9 měsíci, některé práce dokonce uvádějí pouze 2–8 měsíců (7). Patří mezi nádory, které v případě metastazování velmi špatně odpovídají na jakoukoliv léčbu. Pouze 25% nemocných přežívá 1 rok a méně než 5% přežívá 5 let. Přes mnohaletý vývoj různých léčebných postupů nebyl zatím nalezen lék, který by dokázal statisticky významně prodloužit dobu přežití nemocných s pokročilým melanomem.
V současnosti dostupné léčebné postupy jsou tak považovány spíše za paliativní a kompletního vyléčení je dosaženo velmi zřídka. Hlavním cílem léčby je tedy alespoň prodloužení celkového přežití a zmenšení nádorových mas.
Stejně jako u adjuvantní léčby neznáme ani u chemoterapie metastazujícího melanomu prediktivní faktory, které by označily nemocné s vyšší pravděpodobností léčebné odpovědi. V zásadách cytostatické léčby maligních onkologických onemocnění je doporučováno několik schémat s chemoterapií a kombinovanou chemoimunoterapií (15). Hlavní indikací této léčby jsou inoperabilní regionální a orgánové metastázy.
Neexistují jednotné postupy ani doporučení k léčbě v první a dalších liniích. Nejčastěji používanými cytostatiky jsou dacarbazin (DTIC), carboplatina, cisplatina, vinblastin, vincristin, bleomycin, fotemustin, lomustin (CCNU) a karmustin (BCNU). V monoterapii se většinou podává pouze DTIC, ostatní preparáty se častěji navzájem kombinují. Při chemoimunoterapii se k cytostatikům přidává IFN alfa nebo Interleukin 2 ( IL-2) nebo oba preparáty současně. Předpokládá se synergistický účinek cytostatik a těchto cytokinů (7). Při aplikaci kombinované chemoimunoterapie je sice popisováno často vyšší procento léčebných odpovědí (RR) ale také vyšší toxicita a ve většině případů není dosaženo statisticky významného prodloužení OS. Některá častější schémata jsou uvedená v tabulce 2.
Tab. 2. Příklady používané chemoterapie u melanomu 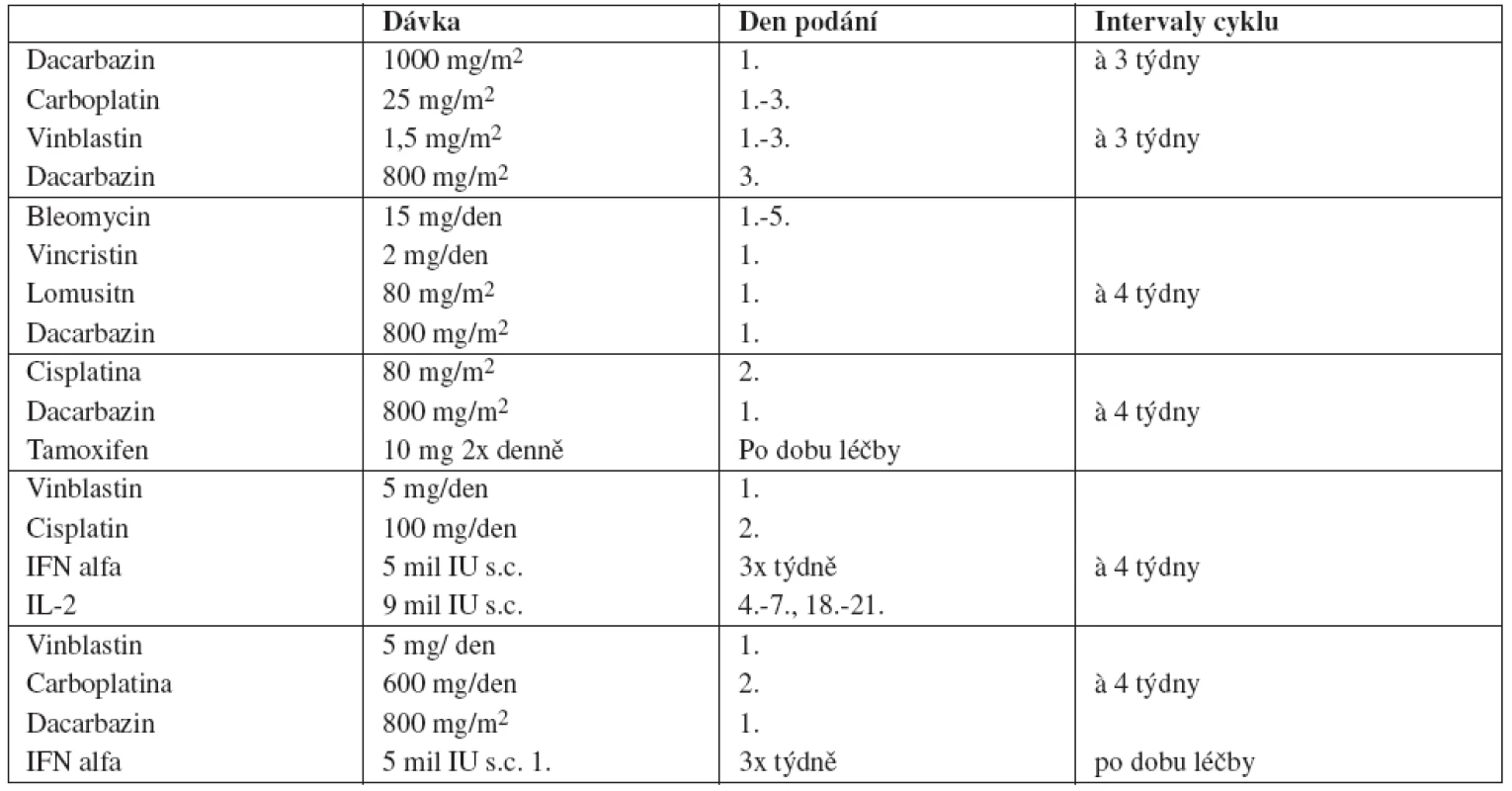
Používá se řada dalších kombinací i různých léčebných dávek, které je nutné individuálně upravovat dle celkového stavu pacienta a reakce na léčbu. Nejpozději po 3 cyklech léčby, zejména v případě kombinované chemoimunoterapie, je nezbytné celkové přešetření a zhodnocení účinnosti. Za hlavní ukazatel efektu chemoterapie je považováno zmenšení celkového objemu metastáz. Vzhledem k obecně malé citlivosti metastazujícího melanomu je možné i stabilizaci nálezu bez dalšího zvětšování či vzniku nových ložisek hodnotit pozitivně. V případě, že pokračuje progrese onemocnění, je nutné léčbu ukončit a pokud to umožňuje stav pacienta, zvolit jinou alternativu. U inoperabilních kožních či uzlinových metastáz je vhodná kombinace s aktinoterapií (2).
V případě lokoregionálních recidiv melanomu postihujících pouze dolní nebo horní končetiny je možné zvolit jako léčebnou variantu namísto systémově podávané chemoterapie izolovanou cytostatickou končetinovou perfúzi (Isolated Limb Perfusion ILP). Umožňuje podání celkově vyšších dávek chemoterapie, která navíc působí přímo v místě metastáz. ILP lze kombinovat ještě s hypertemií v rozmezí 38 – 42 °C. Zahřátí perfundované končetiny zesiluje účinnost léčby, současně ale zvyšuje její toxicitu. Nejčastěji používaným cytostatikem je melfalan v dávce 10 mg/l, méně často se zkouší cisplatina, carboplatina nebo fotemustin, z cytokinů TNF alfa. Kompletní a částečné remise jsou popisovány ve 40–80 %, v případě recidiv je možné ILP opakovat a znovu dosáhnout léčebné odpovědi, bez výraznějšího zvýšení toxicity (10).
Pro malou účinnost současné léčby metastazujícího melanomu se stále hledají nové látky, které by byly schopné průběh onemocnění příznivě ovlivnit. A stejně jako v adjuvantní léčbě je i v léčbě metastazujícího melanomu pozornost zaměřena zejména na imunitní reakce.
Kapacita imunitního systému rozpoznávat a likvidovat nádorové buňky je u jednotlivých nemocných velmi rozdílná a může být negativně ovlivněna samotným nádorem. Melanom produkuje řadu látek, které mu umožňují maskování vlastních nádorových buněk, čímž uniká protinádorové imunitní kontrole hostitele. Další pozitivně ovlivňují nádorový růst, působí supresivně na imunitní systém a potlačují lokální i systémovou imunitní odpověď. Pochopení procesů jakými melanom překonává imunitní reakce hostitele je klíčové pro vývoj účinných léčebných postupů (8).
Jednou z nových možností je taková modulace imunitního systému, která dokáže překonat imunosupresi vyvolanou nádorem, odkrýt melanomové antigeny a posílit imunitní odpověď hostitele.
CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4) je receptor exprimovaný na povrchu aktivovaných T lymfocytů a je klíčovým negativním regulátorem adaptivní imunitní odpovědi. Zvyšuje práh pro aktivaci T buněk na periferii a blokuje jejich proliferaci a stimulaci, čímž snižuje riziko napadení vlastních tkání. Je odpovědný, pravděpodobně přes ovlivnění funkce regulačních T buněk ( Treg), za toleranci k vlastním antigenům. Blokáda CTLA-4 potlačuje negativní signál a umožňuje delší a silnější aktivaci T buněk. Posunuje rovnováhu mezi regulačními a efektorovými T lymfocyty (Tef) směrem k efektorovým, které jsou schopné rozpoznat nádorové buňky jako cizí antigen a útočit na něj. Dochází také přímo k ovlivnění efektorových CD4+ a CD8+ lymfocytů odstraněním kontroly jejich proliferace.
Potlačení funkce CTLA-4 může posílit T buněčnou imunitní odpověď organismu vůči nádorům. Současně ale zablokování CTLA-4 receptoru způsobuje převahu Tef nad Treg s následným vyšším sklonem ke vzniku autoimunitních reakcí. V současné době existují dvě monoklonální protilátky proti CTLA-4 receptoru. Plně humánní IgG1 je označována jako ipilimumab a IgG2 jako tremelimumab. Jejich hlavním předpokládaným léčebným účinkem je překonání imunologické tolerance hostitele vůči melanomu.(9)
V ČR máme v současné době zkušenosti pouze s ipilimumabem z několika probíhajících mezinárodních klinických studií. Po celém světě byl podáván již v mnoha studiích fáze II a III u více než 4000 nemocných s různými typy nádorů, ale převážně u metastazujícího melanomu. Zkouší se v monoterapii nebo v komibinaci s vakcínami, chemoterapií či IL-2 (9).
Většina studií ještě nebyla uzavřena nebo nebyla dosud publikována konečná data, přesto předběžné výsledky naznačují, že ipilimumab může být v léčbě inoperabilního metastazujícího melanomu účinný jak v monoterapii, tak v kombinaci s DTIC nebo IL-2. Procento RR není sice příliš vysoké a pohybuje se okolo 15, ale překvapivá a nadějná je dlouhodobá stabilizace onemocnění i při malé léčebné odpovědi. Ze zatím předběžných nepublikovaných výsledků i našeho vlastního pozorování je doba přežívání nemocných výrazně delší než při léčebných odpovědích na klasickou cytostatickou léčbou. Přitom nemusí být v některých případech ani dosaženo kompletní regrese metastáz (14).
Účinnost léčby cytostatiky je hodnocena na základě zmenšení velikosti metastáz, podle WHO či RECIST kritérií (Response Evaluation Criteria in Solid Tumors). Jakékoliv zvětšení sledovaných ložisek je považováno za selhání léčby. Při léčbě blokátory CTLA-4 bylo zjištěno, že zejména v prvních 12 týdnech, může docházet nejprve k přechodnému zvětšení metastáz, po kterém teprve v určitém časovém odstupu následuje postupná a výrazná regrese. Někdy také vznikají nová metastatická ložiska při současném zmenšování původních. Zvětšení metastáz může být v těchto případech způsobeno infiltrací nádoru T lymfocyty, či edematózním prosáknutím. Vznik nových ložisek je vysvětlován tím, že tato ložiska již existovala před zahájením léčby, ale byla tak malá, že nebyla detekovatelná klasickými zobrazovacími metodami. Při léčbě anti-CTLA-4 dojde k jejich přechodnému zvětšení vyvolanému spuštěnou imunitní kontrolou. Nejedná se tedy o progresi metastáz.
Nově se tak hovoří o kritériích léčebné odpovědi vyvolané imunitní reakcí. Označují se irRC (immune-related Response Criteria) a zařazuje se mezi ně odpověď vznikající až po přechodném zvětšení celkového objemu metastáz a vznik nových ložisek při současném zmenšení celkového objemu nádorových mas. V případech zvětšování metastáz po zahájení léčby anti-CTLA-4 se doporučuje ověření nálezu ve 4týdenním intervalu a teprve pokud progrese pokračuje, léčbu ukončit. Velmi často je totiž možné pozorovat zmenšování metastáz až po jejich přechodném zvětšení. Zavedení těchto irRC kritérií do hodnocení účinnosti imunoterapie umožňuje objektivnější zhodnocení léčebných odpovědí a brání předčasnému ukončení léčby (13).
Výraznější terapeutický efekt anti-CTLA-4 je popisován u nemocných, u nichž současně dojde v průběhu léčby k nežádoucím účinkům, které jsou způsobené autoimunitními reakcemi. Typickými nežádoucími účinky jsou enteriitida provázená průjmy a endokrinopatie charakteru tyreoiditidy a hypofyzitidy, způsobené autoimunitními reakcemi. Kožní autoimunita se projevuje vznikem vitiliga, necharakteristickým svěděním kůže nebo kožními exantémy. Bývá popisována také hepatotoxicita anti-CTLA-4. Ve většině případů je možné nežádoucí účinky zvládnout symptomatickou léčbou, nárazem systémově podaných kortikoidů ve středních dávkách, u endokrinopatií je nutná odpovídající hormonální substituce. Nežádoucí účinky vyvolané autoimunitou se označují jako irAEs (immune-related Adverse Events) a jsou častěji pozorovány u nemocných, kteří současně příznivě odpovídají na léčbu anti-CTLA-4 (8).
Dosud získaná data z klinických studií s ipilimumabem naznačují, že se RR pohybují na úrovni 15 % a dalších přibližně 10 % pozdních léčebných odpovědí se objevuje za více než 12 týdnů od zahájení léčby. Velmi slibná se zdá také doba trvání RR, která je výrazně delší než při léčebných odpovědích dosažených u chemoterapie. I v případech, kdy dojde pouze ke stabilizaci onemocnění (SD), to znamená, že zmenšení metastáz nesplňuje RECIST kritéria pro částečnou remisi (PR), přetrvává SD, u některých nemocných nečekaně dlouhé období. Předpokládá se, že blokáda CTLA-4 poruší toleranci vůči autoantigenům, čímž pomůže imunitnímu systému lépe rozpoznávat nádorové antigeny s následnou dlouhodobou kontrolou nádorové progrese (14).
I u metastazujícího melanomu se zkouší cílená léčba, která by mohla přímo ovlivnit biologické chování nádoru. V současnosti probíhají převážně studie fáze I/II, nejčastěji zkoušenými látkami jsou například Sorafenib, Oblimersen, Bevacizumab, Bortezomib, inhibitory MEK a řada dalších. V monoterapii nebyla prokázána výrazná účinnost, a proto se zkouší převážně v kombinaci s cytostatiky nebo cytokiny. Výsledky se zatím očekávají (11).
Závěr
Melanom je nádor vysoce rezistentní k léčbě, zejména v případě orgánových metastáz. Chemoterapie i chemoimunoterapie mají pouze omezenou účinnost projevující se většinou krátce trvajícími léčebnými odpověďmi s následnou další progresí. Cílená léčba má před sebou ještě dlouhou dobu hledání. S netrpělivostí se očekávají výsledky studií fáze III s blokátory CTLA-4, které by mohly pacientům s melanomem přinést novou šanci nejen v léčbě metastazujícího melanomu, ale i v adjuvantním podání. Nezbytností je nalézt prediktivní faktory určující nemocné s vysoce rizikovým melanomem, kteří by mohli profitovat z adjuvantní léčby IFN alfa a dalšími novými látkami. Dokud toho nedosáhneme, zůstává stále nejúčinnější léčbou melanomu včasná diagnóza a včasné chirurgické odstranění.
MUDr. Ivana Krajsová, MBA
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
128 08, Praha 2
E-mail: krajsova@vfn.cz
Zdroje
1. Bouwhuis, M., Suciu, S., Testori, A., et al.: Phase III trial comparing adjuvant treatment with pegylated interferon alfa 2b versus observation: prognostic significance of autoantibodies – EORTC 18991. J Clin Oncol, published ahead of print, April 12, 2010.
2. Garbe, C, Peris, K., Hauschild, A., Saiag, P., et al.: Diagnosis and treatment of melanoma: European consensus-based interdisciplinary guideline. Eu J Cancer, 2010, 46, 270-283.
3. Gogas,H., Eggermont,A.M., Hauschild,A., et al.: Biomarkers in melanoma. Annals of Oncol, 2009, 20(6), vi8-vi13
4. Gogas, H., Ioannovich, J., Kirkwood, JM., et al.: Prognostic significance of autoimmunity during treatment of melanoma with interferon. N Engl J Med, 2006,354(7),709-718 -
5. Kirkwood, JM., Tarhini, AA., Panelli, CM., Moschos, JS., Gogas, JH.: Next generation of immunotherapy for melanoma. J Clin Oncol, 2008,26, 3445-3455.
6. Mocellin, P., Pasquali, S., Rossi, CR., Nitti, D.: Interferon alfa adjuvant therapy in patients with high risk melanoma: a systematic review and meta-analysis. J Natl Cancer Inst, 2010, 102(7), 493-501.
7. Mouawad, R., Sebert, M., Michels, J., Bloch, J., Spamo, JP., Khayat, D.: Treatment for metastatic melanoma: old drugs and new strategies. Crit Rev Oncol/Hematol, 2009,doi: 10.1016.
8. O’DAY, SJ., HAMID, O.,et al.: Targeting cytotoxic T-lymphocyte antigen-4 ( CTLA-4): a novel strategy for the treatment of melanoma and other malignancies. Cancer, 2007, 110(12), 2614-2627.
9. Ridolfi, L., Ridolfi, R.: Anti-CTLA-4 therapy in melanoma: role of ipilimumab. Expert Rev. Dermatol., 2009, 4(3), 199-210.
10. Sanki, A., Kam, CAP., Thompson, JF.: Long-term results of hyperthermic, isolated limb perfusion for melanoma. Ann Surg, 2007, 245(4), 591-596.
11. Tawbi, H., Nimmagalda, N.: Targeted therapy in melanoma. Biologics: Targets&Therapy, 2009,3, 475-484.
12. VErma, S., Quirt, I., McCready, D., et al.: Systematic review of systematic adjuvant therapy for patients at high risk for reccurent melanoma. Cancer, 2006, 106,1431-1442.
13. Wolchok, JD., Hoos, A., O’Day, S., Weber, JS., et al.: Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related responce criteria. Clin Cancer Res, 2009, 15(23), 7412-7420.
14. Wolchok, JD., Linette, G., Negrier, S., Thomas, L., et al.: Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, doubleblind, multicentre, phase 2, dose-ranging study. 2009, doi: 10,1016/S1470-2045.
15. Česká onkologická společnost ČLS JEP. Kap.15, Zhoubný melanom kůže. In: Zásady cytostatické léčby maligních onkologických onemocnění. 10.aktualizované a doplněné vydání, ČOS ČLS JEP, ISBN 978-80-254-4859-5, 2010, 65-67.
Štítky
Dermatologie Dětská dermatologie
Článek Sledování souboru pacientů s těžkými formami acne vulgaris léčených perorálním izotretinoinemČlánek Komentář k Doporučením Evropského dermatologického fóra pro celkovou léčbu psoriasis vulgarisČlánek Pseudoxanthoma elasticumČlánek 7. jarní sympozium Evropské akademie dermatovenerologie (EADV)Cavtat (Chorvatsko), 13. – 16. 5. 2010Článek Odborné akce v roce 2010
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2010 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- HydroCleanem efektivně hojíme onkologické rány po radioterapii
-
Všechny články tohoto čísla
- Prázdniny! Okurková sezóna nebo vysněný ráj pro workoholiky?
- Současné trendy a nové možnosti v léčbě melanomu
-
DOŠKOLOVÁNÍ LÉKAŘŮ – KONTROLNÍ TEST
Současné trendy a nové možnosti v léčbě melanomu
- Sledování souboru pacientů s těžkými formami acne vulgaris léčených perorálním izotretinoinem
- Nystatin – nově dostupné léčivo pro magistraliter přípravu
- Komentář k Doporučením Evropského dermatologického fóra pro celkovou léčbu psoriasis vulgaris
- Pseudoxanthoma elasticum
- Klinický případ: Drsné papuly v obličeji
-
VI. kongres slovenských a českých dermatovenerológov
Bratislava, 3.–5. 6. 2010
- Zápis ze schůze výboru ČDS konané dne 1. dubna 2010 v Praze
- Zápis ze schůze výboru ČDS konané dne 6. května 2010 v Praze
- XII. Krajský seminár dermatológov Banskobystrického kraja, Sklené Teplice, 18. 6. 2010
-
7. jarní sympozium Evropské akademie dermatovenerologie (EADV)
Cavtat (Chorvatsko), 13. – 16. 5. 2010
-
10. kongres Evropské společnosti pro dětskou dermatologii (ESPD)
Lausanne (Švýcarsko), 20. – 22. 5. 2010
- Odborné akce v roce 2010
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nystatin – nově dostupné léčivo pro magistraliter přípravu
- Sledování souboru pacientů s těžkými formami acne vulgaris léčených perorálním izotretinoinem
- Současné trendy a nové možnosti v léčbě melanomu
- Klinický případ: Drsné papuly v obličeji
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



