-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDiagnostika nealkoholové tukové nemoci jater a její aktivní screening v rizikových skupinách
Diagnosis of non-alcoholic fatty liver disease and its active screening in risk groups
Non-alcoholic fatty liver disease (NAFLD) is currently the most common chronic liver disease in developed countries, where it affects up to a quarter of the population. The groups at most risk are diabetics, obese and patients with dyslipidemia, i. e. individuals with advanced metabolic syndrome, in whom the prevalence of NAFLD exceeds 50 %. Some of these patients develop inflammation, so-called steatohepatitis, and subsequent fibroproduction, which in turn can lead to liver cirrhosis with all the complications, especially liver failure, portal hypertension (ascites, esophageal varices) and hepatocellular carcinoma. Therefore recently great emphasis has been placed on actively searching for advanced forms of NAFLD in this population in order to identify and adequately treat these patients in a timely manner. Today, diagnostic methods are widely available and the development of effective therapies for advanced forms of NAFLD is at the forefront of research interest.
Keywords:
elastography – non-alcoholic fatty liver disease – non-alcoholic steatohepatitis – type 2 diabetes mellitus metabolic syndrome
Autoři: Šimon Dostál; Václav Šmíd
Působiště autorů: 4. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 72-76
Kategorie: Přehledový článek
Souhrn
Nealkoholová tuková choroba jater (NAFLD) je v současnosti ve vyspělých zemích nejčastější chronickou jaterní nemocí. Vyskytuje se přibližně u čtvrtiny dospělé populace. Mezi nejrizikovější skupiny z hlediska NAFLD patří diabetici, obézní a pacienti s dyslipidémií, tedy jedinci s rozvinutým metabolickým syndromem. Prevalence tohoto onemocnění u nich přesahuje 50 %. U části těchto pacientů dojde k rozvoji zánětu, tzv. steatohepatitidě, a následné tvorbě vaziva, což ve svém důsledku může vést až ke vzniku jaterní cirhózy se všemi jejími komplikacemi, zejména jaterní insuficiencí, portální hypertenzí (ascitem, jícnovými varixy) a hepatocelulárním karcinomem. V poslední době je proto kladen velký důraz na aktivní vyhledávání pokročilých forem NAFLD v rizikových skupinách s cílem tyto pacienty včas rozpoznat a adekvátně léčit. V dnešní době jsou diagnostické metody široce dostupné a vývoj účinné terapie pokročilých forem NAFLD je v popředí výzkumného zájmu.
Klíčová slova:
diabetes mellitus 2. typu – elastografie – metabolický syndrom – nealkoholová steatohepatitida – nealkoholová tuková nemoc jater
ÚVOD
Nealkoholová tuková nemoc jater (NAFLD – non-alcoholic fatty liver disease) je skupina patologických stavů, které spojuje steatóza (depozita tuku) ve více než 5 % hepatocytů, a mezi něž patří prostá steatóza, nealkoholová steatohepatitida (NASH) a jaterní fibróza, která může vyústit v cirhózu.
Prostá steatóza je obecně vnímána jako benigní nález, nicméně u části těchto pacientů dochází v játrech k rozvoji zánětu a progresi do klinicky významné nealkoholové steatohepatitidy (1). V tuto chvíli není bohužel možná neinvazivní diagnostika NASH, protože spočívá ve vyhodnocení bioptického vzorku patologem a stanovení NAFLD Activity Score (NAS) sestávajícího z vyhodnocení steatózy, známek zánětu a tíže tzv. balónových změn hepatocytů. I proto je odhad rizika progrese do NASH u pacienta s prostou steatózou poměrně obtížný, toto riziko se odhaduje na 6,67–29,85 % (2). Naproti tomu diagnostika jaterní fibrózy se dnes opírá téměř výhradně o neinvazivní metody, zejména jaterní elastografii.
Pro diagnózu NAFLD je třeba vyloučit jiné příčiny jaterního poškození, zejména vliv alkoholu. Hranice je dána konzumací více než 30 g etanolu denně u mužů a 20 g u žen (1). To odpovídá například 750 ml, respektive 500 ml 10° piva.
RIZIKOVÁ POPULACE
NAFLD je nejčastější chronické jaterní onemocnění dospělé populace západních zemí s prevalencí 17–46 % (3). Zodpovídá za 30–75 % případů kryptogenní cirhózy, 13,5 % případů hepatocelulárního karcinomu a v USA je druhým nejčastějším důvodem transplantace jater (4). Situace v Česku může být do jisté míry odlišná, neboť se dlouhodobě řadíme mezi státy s nejvyšší konzumací alkoholu (5).
Výskyt NAFLD je dán součinností mnoha faktorů a může se vyskytnout u kohokoliv. Nalezneme jej u 7 % pacientů s normální hmotností (6). Jeho prevalence stoupá s věkem, vyskytuje se násobně častěji u pacientů s jednotlivými komponentami metabolického syndromu (7), avšak nejvýznamnější je jeho asociace s inzulinovou rezistencí a diabetem 2. typu. Celosvětově je prevalence u diabetiků 1. typu 30–40 %, u 2. typu 55 % (6, 8). U kohorty českých pacientů s diabetem 2. typu byla prevalence 79 % (9).
Současné doporučené postupy i přes vysokou prevalenci tohoto onemocnění nedoporučují provádět celopopulační screening. Naproti tomu screening rizikové populace je většinou odborných společností doporučen (10). Doporučený postup České hepatologické společnosti ČLS JEP (ČHS) z roku 2019 je zdrženlivější. Konstatuje, že pro jednoznačné doporučení screeningu rizikové populace chybí data o nákladové efektivitě tohoto postupu a cituje doporučení Americké asociace pro studium jaterních chorob z roku 2018 (2, 11). Doporučení Americké diabetologické asociace z roku 2020 uvádějí pro nemocné s prediabetem a diabetiky 2. typu kontrolu jaterních testů jednou ročně a pro pacienty s abnormálním výsledkem, případně s nálezem steatózy při ultrazvukovém vyšetření, doporučují screening NASH a fibrózy (12). Vzhledem k nejednoznačnosti doporučených postupů je tak přístup k rizikové populaci v rukách ošetřujícího lékaře.
U každého pacienta je nutné vzít v úvahu individuální riziko, compliance a motivaci k léčbě a na základě toho pak indikovat další vyšetření tak, aby byli zachyceni pacienti, u kterých znalost diagnózy přinese klinický benefit. Jedná se především o pacienty s NASH, tedy progresivní formou NAFLD a/nebo pacienty s jaterní fibrózou. Případně o motivované pacienty, u kterých informace o steatóze jater povede ke změně životnímu stylu.
Naopak platí, že v případě náhodného záchytu NAFLD – například při ultrazvukovém vyšetření indikovaném z jiného důvodu, je pátrání po dyslipidémii a inzulinové rezistenci nutné vždy (11).
DIAGNOSTICKÉ MOŽNOSTI
Kromě klinického obrazu, který bývá v případě NAFLD chudý a nekonzistentní (zvýšená únavnost, hepatomegalie a bolest v pravém podžebří) se nabízejí 3 skupiny diagnostických modalit: laboratorní testy, zobrazovací metody a jaterní biopsie.
Laboratorní testy
Zatím neexistuje jednoznačný laboratorní ukazatel, který by nám umožnil stanovit diagnózu NAFLD. Připomínáme, že ta je podmíněna přítomností steatózy více než 5 % hepatocytů. Laboratorní testy jsou však užitečné ve výběru pacientů, které podrobíme dalším vyšetřením nebo odešleme ke specialistovi.
Pozornost věnujeme zejména odchylkám jaterních testů. Pacient s NAFLD může mít zcela normální jaterní testy, zároveň jsou jednotlivé laboratorní odchylky pro diagnostiku NAFLD značně nespecifické. Je proto snaha senzitivitu a specificitu laboratorních testů zvýšit vytvořením skórovacích schémat, která využívají více parametrů dosazených do matematického vzorce. Rozlišujeme skóre pro identifikaci steatózy a skóre pro identifikaci jaterní fibrózy.
Jedním z validovaných a komerčně dostupných testů k určení jaterní steatózy je SteatoTest, který využívá deset sérových markerů a jeho cena se pohybuje kolem 2500 Kč. Pro klinickou praxi je ovšem lépe využitelný Fatty Liver Index (FLI), který využívá snadno dostupné hodnoty: body mass index (BMI), délka obvodu pasu, triacylglyceroly (TAG) a gama-glutamyltransferázu (GGT). Index nabývá hodnot 0–100, přičemž FLI < 30 vylučuje steatózu jater, FLI > 60 ji potvrzuje (13) se senzitivitou 80,3 % a specificitou 87,3 % (14). Novější čínská studie navrhuje pro diagnostiku NAFLD mezní hodnotu 30 se senzitivitou 79,89 % a specificitou 71,51 % (15).
Z volně dostupných schémat k vyloučení jaterní fibrózy vykazuje pravděpodobně nejlepší výsledky skóre FIB-4, které využívá věk pacienta, aktivitu aspartátaminotransferázy (AST), alaninaminotransferázy (ALT) a počet trombocytů. Hodnota < 1,45 vylučuje pokročilou fibrózu s negativní prediktivní hodnotou 90–95 % (16, 17). Hodnota > 3,25 naznačuje pokročilou fibrózu s pozitivní prediktivní hodnotou 65 % (17). Dle recentní studie se zdá, že optimální hranicí pro vyloučení závažnější fibrózy je hodnota 2,68 (negativní prediktivní hodnota 92,2 %) (18). Mezi obdobné skóre patří NFS (NAFLD Fibrosis Score) a APRI (AST to Platelet Ratio Index). Matematické vzorce těchto indexů jsou volně dostupné a on-line lze nalézt i jejich praktické kalkulačky, aktuálně povětšinou cizojazyčné. Česká verze bude v dohledné době dostupná na stránkách České hepatologické společnosti ČLS JEP (www.ces-hep.cz).
Z komerčně dostupných testů zmiňme ELF (Enhanced Liver Fibrosis score), který využívá hladin tkáňového inhibitoru metaloproteáz 1, amino-terminálního polypeptidu prokolagenu typu III a kyseliny hyaluronové v krvi (19). Jeho cena se pohybuje kolem 5000 Kč, nabízí ale o něco vyšší senzitivitu a specificitu než FIB-4 (ibid.).
K základní orientaci poslouží i snadno dostupný poměr hodnot AST/ALT. Hodnota < 0,8 poměrně spolehlivě vylučuje pokročilou fibrózu (16), naproti tomu hodnota > 1,0 upozorňuje na možnou přítomnost jaterní fibrózy i při fyziologických hodnotách aktivit obou enzymů.
Z výše uvedeného vyplývá, že síla těchto testů spočívá především ve vyloučení jaterní fibrózy, tedy slouží k selekci pacientů, kteří nevyžadují další dispenzarizaci specialistou (gastroenterologem či hepatologem).
Zobrazovací metody
Ultrasonografie
V běžné klinické praxi vyžíváme pro diagnostiku jaterních chorob ze zobrazovacích metod nejčastěji ultrazvuk (USG). Depozita tuku, případně vaziva v játrech mění parametry šíření ultrazvukové vlny parenchymem. Orientačně lze využít srovnání echogenity parenchymu jater a kůry pravé ledviny, které by za normální situace měly být přibližně stejné. Je-li echogenita jater pouhým okem viditelně vyšší, svědčí to pro jejich ztukovatění. Tohoto faktu využívá hepatorenální index (HRI), u něhož je poměr echogenit zhodnocen počítačem. Dále u závažnější steatózy pozorujeme dorzální atenuaci (zeslabení) akustického signálu, rozostření cév (vessel blurring) a často nacházíme hypoechogenní okrsky fokálního neztukovatění. Spolehlivost vyšetření roste se stupněm závažnosti steatózy. Na otázku, zda je, či není přítomna závažnější steatóza, odpoví ultrazvuk se senzitivitou 85 % a specificitou 93 % (20). Kvantifikovat lze steatózu pomocí metod hodnotících již dříve zmíněnou dorzální atenuaci akustického signálu (např. CAP – controlled attenuation parameter, ATT – attenuation coefficient).
Pro diagnostiku steatózy lze využít také magnetickou rezonanční spektroskopii či speciální protokol PDFF (proton density fat fraction). Obě metody poskytují při vyšších nákladech a časové zátěži pacienta přesné výsledky, v klinické praxi jsou však bohužel prakticky nedostupné.
Elastografie
Pro pokročilou fibrózu, či spíše již cirhózu svědčí typické sonografické známky, kterými jsou nerovný povrch jater, nepravidelný průběh cév, případně nehomogenní struktura jater. Zaměřujeme se také na rychlost toku krve v. portae, která bývá snížena. Kvantifikovat stupeň jaterní fibrózy z prostého ultrazvukového obrazu však nelze. K tomuto účelu byly vyvinuty speciální metody, které souhrnně nazýváme elastografie.
Princip této metody zjednodušeně spočívá v tom, že přístrojem je do tkáně vyslán impulz, jehož šíření v parenchymu je ovlivněno mechanickými vlastnostmi tkáně. To je kvantifikováno číselnou hodnotou, ze které můžeme usuzovat na tuhost tkáně – a nepřímo tak i na závažnost fibrózy. Těchto metod existuje celá řada. V detailech fungování se liší, jsou výrobci různě nazývány, výsledky jsou uváděny v jiných jednotkách, a vzájemně tak nejsou zaměnitelné. V principu může být tato modalita implementovaná přímo do ultrazvukového přístroje, který používáme pro běžné vyšetření – například pSWE nebo 2D-SWE (point, resp. 2D shear wave elastography). Výhodou této metody je, že si můžeme za kontroly zrakem vybrat oblast parenchymu, kterou chceme vyšetřit. Dále existují dedikované přístroje určené pouze pro měření jaterní tuhosti, například FibroScan. V obou případech znamená vyšší naměřená hodnota těžší stupeň jaterní fibrózy.
Jaterní biopsie
Jaterní biopsie je pro diagnostiku NAFLD zlatým standardem, jedná se však o invazivní výkon, většinou s nutností krátké hospitalizace – je tak v diagnostice NAFLD až poslední volbou s výjimkou diagnostiky NASH, kterou bez histologického vyšetření jaterní tkáně určit nelze. Její indikace spadá do rukou gastroenterologa/hepatologa.
Genetické vyšetření
Co se týká vzniku a progrese NAFLD, bylo identifikováno několik genetických modifikátorů. Nejlépe charakterizovaná asociace je spojena s genem PNPLA3, který kóduje protein s hydrolázovou (lipázovou) aktivitou vůči triacylglycerolům. Polymorfismus genu PNPLA3, resp. jeho nepříznivá homozygotní varianta trojnásobně zvyšuje riziko vzniku NAFLD. Dalšími modifikátory patogeneze NAFLD včetně rizika vzniku kardiovaskulárních komplikací jsou geny TM6SF2 a MBOAT7. Bohužel genetické vlivy prozatím v klinické praxi rutinně nelze vyhodnocovat, zůstávají nadále vyhrazeny, ať již klinickým hodnocením či výzkumným projektům. Věříme však, že s rozvojem personalizované medicíny budou v blízké budoucnosti vyhodnocovány i tyto faktory.
POSTUP U RIZIKOVÉ POPULACE
Na následujících řádcích se pokusíme nastínit vhodný způsob screeningu a dispenzarizace rizikových pacientů. Postup, jak je námi prezentován, představuje kombinaci doporučeného postupu ČHS z roku 2019, Evropské asociace pro studium jater (EASL) z roku 2016 (1, 11) a novějšího postupu Americké diabetologické asociace (ADA) z roku 2020 (12). V dohledné době očekáváme aktualizaci příslušných doporučených postupů.
U všech pacientů s diabetem a prediabetem a u vybraných pacientů s metabolickým syndromem na základě zhodnocení individuálního rizika provedeme vstupně kontrolu jaterních testů (bilirubin, ALT, AST, GGT, ALP), triacylglycerolů (TAG) a krevního obrazu tak, aby bylo možné kalkulovat skóre pro steatózu, např. FLI a skóre pro fibrózu, např. FIB-4 (viz výše). Samozřejmostí je fyzikální vyšetření a odebrání podrobné anamnézy se zaměřením na jaterní choroby, diabetes mellitus, abusus, farmakoterapii, doplňky stravy a podobně. Na základě rozvahy lékaře lze vstupně provést i ultrazvukové vyšetření břicha, eventuálně s elastografií. Tímto rozdělíme pacienty do tří skupin.
První skupinu pacientů s normálními jaterními testy a bez přítomnosti steatózy dle FLI nebo USG dále sledujeme s cílem odhalit rozvoj steatózy, případně fibrózy. FLI a FIB-4 skóre počítáme vždy jednou ročně – dle doporučeného postupu ADA (12, 21) je u všech pacientů s diabetem mellitem a prediabetem indikována kontrola jaterních testů jednou ročně, k vypočtení skóre pak postačí žádanku rozšířit o TAG a krevní obraz.
Druhá skupina zahrnuje pacienty, u kterých na základě FLI a/ nebo USG prokážeme steatózu, ale FIB-4 skóre, případně elastografie pro přítomnost fibrózy nesvědčí. Hraniční hodnota pro vyloučení fibrózy se podle různých autorů liší, ale za bezpečný lze považovat výsledek nižší než 1,45. Hranicí FLI pro diagnostiku steatózy je hodnota větší než 60. Hodnoty 30–60 jsou „šedou zónou“, některými autory jsou ovšem jako pozitivní vnímány již hodnoty > 30 (15). U této skupiny pacientů opět kontrolujeme FLI a FIB-4 jednou ročně, USG jater (podle dostupnosti i s elastografií) provádíme asi jednou za dva roky.
Třetí skupina zahrnuje pacienty se steatózou, u nichž FIB-4 nevylučuje či naopak predikuje fibrózu (> 1,45), případně u kterých nalezneme výraznější elevaci jaterních testů. Tyto pacienty je nutné odeslat ke specialistovi k provedení elastografie, protože jak je zmíněno výše, fibrózu nelze kvantifikovat prostým ultrazvukovým vyšetřením. Specialista také indikuje v rámci diferenciální diagnostiky jaterního onemocnění, k níž patří vyloučení infekční a autoimunitní hepatitidy a geneticky podmíněné nemoci (hemochromatóza, Wilsonova nemoc atd.), další vyšetření a určí, jak pacienta dále dispenzarizovat. Kontrolní USG u těchto pacientů provádíme jednou ročně, pacienty s cirhózou kontrolujeme dvakrát ročně, a to především v rámci screeningu hepatocelulárního karcinomu. Samozřejmě existují i pacienti, u kterých je fibróza přítomna bez steatózy. Péče o ně spadá do rukou specialisty.
Pacienti samozřejmě v čase přecházejí z jedné skupiny do druhé, jak se zlepšuje nebo zhoršuje jejich klinický stav. To u rizikových jedinců přehodnocujeme minimálně jednou ročně. U všech pacientů se steatózou je nutná důsledná terapie komorbidit a prevence progrese jaterního postižení. Postaráme se o včasný záchyt a dobrou kompenzaci diabetu mellitu, korekci dyslipidémie a arteriální hypertenze. Zásadní postavení v léčbě NAFLD má u pacientů s nadváhou redukce hmotnosti alespoň o 5 %. Pacienty pozitivně motivujeme, doporučíme režimová opatření – racionální dietu, vyloučení kaloricky bohatých pokrmů a nápojů, podporujeme pití kávy (ideálně neslazené), doporučíme přiměřenou a pravidelnou pohybovou aktivitu. Je vhodné minimalizovat konzumaci alkoholu, mj. vzhledem jeho vysoké energetické hodnotě. Jeden gram etanolu představuje energii 29 kJ, tedy více než 1 g sacharidů či proteinů, kde je to 17 kJ.
Cílem dispenzarizace je odhalit pacienty s progredujícím onemocněním (NASH), u nichž v důsledku zánětu jaterního parenchymu dochází k tvorbě vaziva, zhoršování funkce jater a hrozí rozvoj cirhózy se všemi konsekvencemi (portální hypertenzí, jaterní insuficiencí, vznikem hepatocelulárního karcinomu). Tyto pacienty referujeme ke specialistovi, který nabídne specifickou farmakoterapii. V případě progrese do cirhózy o pacienty pečujeme komplexně tak, jako o pacienty s cirhózou jiné etiologie. Návrh postupu u rizikové populace ukazuje obr. 1.
Obr. 1. Postup screeningu a dispenzarizace rizikových pacientů z pohledu vzniku a progrese NAFLD. 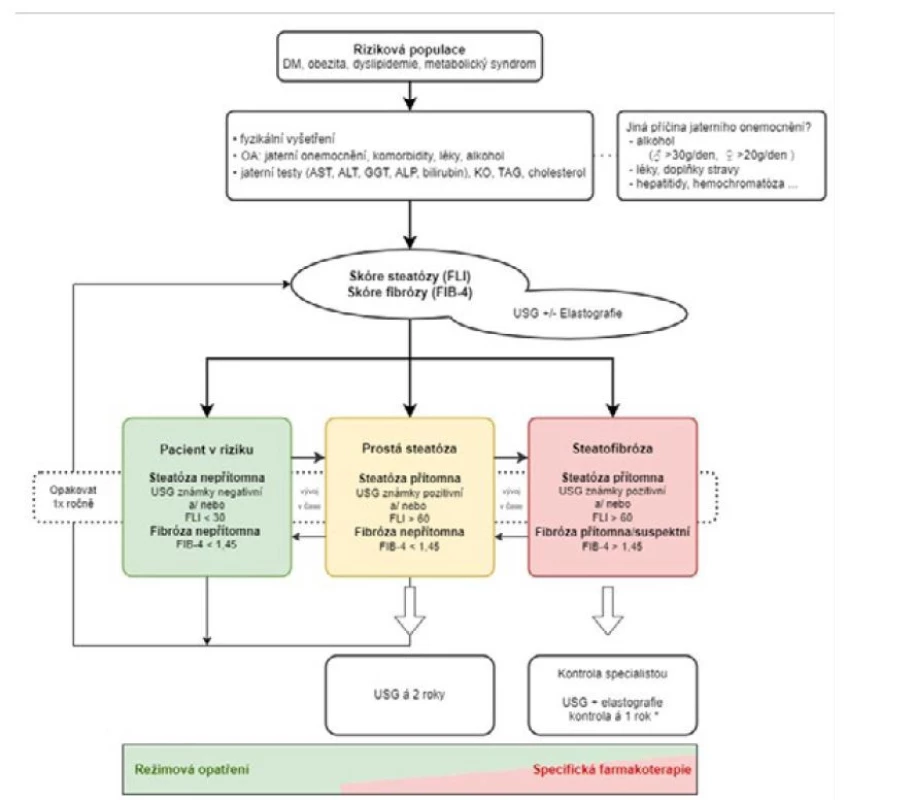
Prevalence NAFLD v rizikových skupinách, zejména u diabetiků, přesahuje 50 %. Pokročilé stadium onemocnění v podobě jaterní cirhózy je diagnostikováno zcela náhodně až ve dvou třetinách případů. V poslední době je proto kladen velký důraz na screening rizikové populace sestávající z vyhodnocení skórovacích indexů pro jaterní steatózu a fibrózu a následného využití pokročilých metod v diagnostice jaterní fibrózy. ZÁVĚR
Na riziko vzniku NAFLD je třeba pomýšlet především u pacientů s metabolickým syndromem a diabetem mellitem, u nichž jeho prevalence přesahuje 50 %. Závažnější formy tohoto onemocnění zatěžují pacienty i zdravotní systém zvýšenou morbiditou a mortalitou. V dnešní době jsou diagnostické metody NAFLD dobře dostupné a začínají se objevovat i první možnosti specifické farmakoterapie. Základem by měl být aktivní přístup k rizikovým skupinám, umožňující včasný záchyt pokročilých forem NAFLD, zejména jaterní fibrózy, s cílem zastavení její progrese. Aplikace neinvazivních skórovacích schémat, jako je FLI a FIB-4, které využívají výsledků rutinních krevních odběrů, dokáže tyto pacienty velmi přesně identifikovat. Vůbec nejdůležitější je ale na možnost postižení jater v těchto rizikových skupinách pomyslet, a proto je na místě v rizikové populaci jednou ročně tato schémata rutinně aplikovat. Naopak při náhodném záchytu jaterní steatózy je žádoucí aktivně pátrat po přítomnosti diabetu mellitu a dalších komponent metabolického syndromu.
Čestné prohlášení
Autoři tohoto sdělení prohlašují, že si nejsou vědomi střetu zájmů.
Seznam použitých zkratek
ADA American Diabetes Association
ALP alkalická fosfatáza
ALT alaninaminotransferáza
AST aspartátaminotransferáza
APRI AST to Platelet Ratio Index
ARFI acoustic radiation forced impulse elastography
BMI body mass index
CAP controlled attenuation parameter
ČHS Česká hepatologická společnost ČLS JEP
DM diabetes mellitus
EASL European Association for the Study of the Liver
FLI Fatty Liver Index
FIB-4 Fibrosis-4 Score
GGT gama-glutamyltransferáza
KO krevní obraz
NAFLD nealkoholová tuková nemoc jater
NASH nealkoholová steatohepatitida
NFS NAFLD Fibrosis Score
TAG triacylglycerol
USG ultrazvuk
Adresa pro korespondenci:
MUDr. Šimon Dostál
4. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze
U Nemocnice 499/2, 128 08 Praha 2
Tel.: 224 962 506
e-mail: simon.dostal@vfn.cz
Zdroje
- Marchesini G, Day Ch, Dufour JF, Canbay A et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64 : 1388–1402.
- Chalasani N, Younossi Z, Lavine JE et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Diseases. Hepatology 2018; 67 : 328–357.
- Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther 2011; 34 : 274–285.
- Pais R, Barritt AS 4th, Calmus Y et al. NAFLD and liver transplantation: Current burden and expected challenges. J Hepatol 2016; 65(6): 1245–1257.
- Poznyak V, Rekve D. Global status report on alcohol and health 2018. WHO, Ženeva, 2018.
- Targher G, Lonardo A, Byrne CD. Nonalcoholic fatty liver disease and chronic vascular complications of diabetes mellitus. Nat Rev Endocrinol 2018; 14(2): 99–114.
- Alberti KG, Eckel RH, Grundy Smet al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120 : 1640–1645.
- Younossi ZM, Golabi P, de Avila L et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: a systematic review and meta-analysis. J Hepatol 2019; 71 : 793–801.
- Dvorak K, Hainer R, Petrtyl J et al. The prevalence of nonalcoholic liver steatosis in patients with type 2 diabetes mellitus in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(3): 442–448.
- Monelli F, Venturelli F, Bonilauri L et al. Systematic review of existing guidelines for NAFLD assessment. Hepatoma Res 2021; 7 : 25.
- Brůha R, Dvořák K, Fejfar T et al. Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater (NAFLD). Dostupné na: www.ces-hep.cz/file/602/nafld-dop-postup-chs.pdf
- American Diabetic Association. Comprehensive Medical Evaluation and Assessment of Comorbidities: Standards of Medical Care in Diabetes—2020. Diabetes Care 2020; 43(1): S37–S47.
- Bedogni G, Bellentani S, Miglioli L et al. The Fatty Liver Index: a simple and accurate predictor of hepatic steatosis in the general population. BMC Gastroenterol 2006; 6 : 33.
- Zelber-Sagi S, Webb M, Assy N et al. Comparison of fatty liver index with noninvasive methods for steatosis detection and quantification. World J Gastroenterol 2013; 19(1): 57–64.
- Huang X, Xu M, Chen Y et al. Validation of the fatty liver index for nonalcoholic fatty liver disease in middle-aged and elderly Chinese. Medicine (Baltimore) 2015; 94(40): e1682.
- McPherson S, Stewart SF, Henderson E et al. Simple non-invasive fibrosis scoring systems can reliably exclude advanced fibrosis in patients with non-alcoholic fatty liver disease. Gut 2010 Sep; 59(9): 1265–9.
- Sterling RK, Lissen E, Clumeck N et al. Development of a simple noninvasive index to predict significant fibrosis patients with HIV/HCV co-infection. Hepatology 2006; 43 : 1317–1325.
- Roh YH, Kang BK, Jun DW et al. Role of FIB-4 for reassessment of hepatic fibrosis burden in referral center. Sci Rep 2021; 11: 13616.
- Lichtinghagen R, Pietsch D, Bantel H et al. The Enhanced Liver Fibrosis (ELF) score: normal values, influence factors and proposed cut-off values. J Hepatol 2013; 59(2): 236–242.
- Castera L, Friedrich-Rust M, Loomba R. Noninvasive assessment of liver disease in patients with nonalcoholic fatty liver disease. Gastroenterology. 2019 Apr; 156(5): 1264–1281.
- Vieira Barbosa J, Lai M. Nonalcoholic Fatty liver disease screening in type 2 diabetes mellitus patients in the primary care setting. Hepatol Commun 2021; 5 : 158–167.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚVODEMČlánek EDITORIALČlánek Jaterní testyČlánek Elastografie jaterČlánek Statiny a játraČlánek Současná léčba hepatitidy C
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
2022 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
-
Všechny články tohoto čísla
- ÚVODEM
- EDITORIAL
- Jaterní testy
- Možnosti diagnostiky jaterní steatózy
- Elastografie jater
- Ztukovatění jater spojené s metabolickou dysfunkcí (MAFLD) jako přesnější název pro NAFLD – společné aspekty patogeneze
- Diagnostika nealkoholové tukové nemoci jater a její aktivní screening v rizikových skupinách
- Současné možnosti léčby nealkoholového ztukovatění jater (NAFLD)
- Statiny a játra
- Alkoholová choroba jater v terénní praxi
- Současná léčba hepatitidy C
- Klinická obezitologie – nejen Základy
- Nutriční návyky studentů lékařských fakult
- Za profesorem Peterem Krištúfkem, čestným prezidentem SLS
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



