-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHodnoty diference silných iontů (SID) u kriticky nemocných pacientů s normálními hodnotami arteriálního pH, pCO2, BE a HCO3-a jejich vliv na mortalitu
Strong ion difference (SID) in critically ill patients with normal arterial pH, pCO2, BE and HCO3- and its impact on mortality
Objective:
To identify acid-base disturbances according to the Stewart-Fencl approach in critically ill patients with normal arterial pH, pCO2, HCO3- and BE. To compare the SIDapp, SIDef, SIG and AGkor values in the patients who were vs. were not alive at three months from ITU admission.Design:
Single-centre, retrospective, observational study.Setting:
Anaesthesiology and Resuscitation Department of a Regional Hospital.Materials and methods:
The criteria (normal arterial pH, pCO2, BE, HCO3-) were met by 112 critically ill patients. In these patients, the parameters needed to calculate the SID and SIG were sampled. Thirty nine of the patients died within three months of admission, 50 patients survived longer than 3 months and 23 patients were eliminated from the subsequent part of the study. SIDapp, SIDef, SIG and AGkor values were calculated in all these patients.Results:
A total of 110 patients had abnormal SIDef values (98.21%), 107 patients had abnormal SIDapp values (95.54%), 52 patients had SIG values above 5 mmol/l (46.43%) and 4 of them over 10 mmol/l (3.57%). There was a statistically significant difference between the non-survivors and survivors in the SIDapp (p < 0.01), SIG (p < 0.005) and AGkor (p < 0.005) values. There was no statistically significant difference between the SIDef values.Conclusion:
This study confirmed that the majority of critically ill patients admitted to the ITU with normal parameters of arterial pH, pCO2, HCO3- and BE have acid-base disturbances according to the Stewart-Fencl approach. We found a significant difference in SIDapp, SIG and AGkor values between the survivors and the non-survivors.Keywords:
acid-base disturbances – Stewart-Fencl approach – strong ion difference (SID) – critically ill patients
Autoři: Večeřa Lubomír; Turek Radovan
Působiště autorů: Anesteziologicko-resuscitační oddělení, Krajská nemocnice Tomáše Bati, a. s., Zlín
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 2, s. 88-97
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Zjistit u kriticky nemocných pacientů s normálními hodnotami arteriálního pH, pCO2, BE a HCO3- přítomnost poruchy acidobazické rovnováhy hodnocené podle Stewartova-Fenclova principu. Porovnat hodnoty SIDapp, SIDef, SIG a AGkor u pacientů, kteří zemřeli do 3 měsíců od přijetí na resuscitační lůžko, a pacientů, kteří přežili déle než 3 měsíce od přijetí na resuscitační lůžko.Typ studie:
Monocentrická retrospektivní observační studie.Typ pracoviště:
Resuscitační oddělení krajské nemocnice.Materiál a metoda:
Kritéria (normální hodnoty arteriálního pH, pCO2, BE, HCO3- a zároveň odběr všech parametrů nutných k vypočítání SID a SIG) splnilo 112 pacientů, 39 z nich zemřelo do 3 měsíců od přijetí, 50 přežilo déle než 3 měsíce a 23 bylo z další části studie vyřazeno. U těchto pacientů bylo spočítáno SIDapp, SIDef, SIG a AGkor a zjištěn rozdíl mezi danými dvěma skupinami.Výsledky:
Celkem 110 pacientů mělo abnormální hodnoty SIDef (98,21 %), 107 pacientů mělo abnormální hodnoty SIDapp (95,54 %), 52 pacientů mělo hodnotu SIG nad 5 mmol/l (46,43 %) a 4 z nich SIG nad 10 mmol/l (3,57 %). Mezi zemřelými a přeživšími byl nalezen statisticky signifikantní rozdíl mezi hodnotami SIDapp (p < 0,01), SIG (p < 0,005) a AGkor (p < 0,005). Nebyl nalezen statisticky signifikantní rozdíl mezi hodnotami SIDef.Závěr:
V této studii bylo potvrzeno, že většina pacientů přijímaných do nemocnice v akutním stavu, kteří mají normální parametry arteriálního pH, pCO2, BE a HCO3-, mají poruchu acidobazické rovnováhy hodnocené podle Stewarta-Fencla. Dále bylo prokázáno, že existuje signifikantní rozdíl v hodnotách SIDapp, SIG a AGkor mezi danými dvěma skupinami.Klíčová slova:
porucha acidobazické rovnováhy – Stewartův-Fenclův princip – diference silných iontů (SID) – kriticky nemocníÚVOD
Poruchy acidobazické rovnováhy (ABR) jsou u kriticky nemocných pacientů velmi časté. Velké množství z nich jsou poruchy kombinované, které se navzájem kompenzují a často mohou uniknout pozornosti lékaře. Poruchy ABR můžeme posuzovat podle dvou základních přístupů (dalším principem je přístup podle teorie iontového ekvilibria [1]). Prvním je mezi lékaři velmi rozšířený a používaný „klasický“ přístup, který k hodnocení poruchy posuzuje změny pH, parciálního tlaku CO2 (pCO2) a změnu výchylky pufrovatelných bazí (base excess – BE) nebo výchylky v koncentraci bikarbonátu (HCO3-). Druhým přístupem je méně známý a využívaný postup hodnotící změny tří nezávislých proměnných. Metabolickou složku představují diference silných iontů (strong ion difference – SID), celková koncentrace netěkavých slabých kyselin (Atot-) a respirační složku představuje stejně jako v „klasickém“ přístupu změna pCO2. Tento postup je nazýván podle svých největších představitelů jako přístup Stewartův-Fenclův [2, 3].
Tento model vytvořil v roce 1981 kanadský fyziolog P. A. Stewart [2] a dále rozpracoval původem český lékař V. Fencl se svými spolupracovníky [3]. Základem tohoto modelu je posouzení metabolické složky poruchy acidobazické rovnováhy podle 2 nezávislých veličin:
- Diference silných iontů (SID)
- Celková koncentrace netěkavých slabých kyselin (Atot-).
Respirační složka poruchy acidobazické rovnováhy se posuzuje pomocí změny pCO2 stejně jako v klasickém přístupu.
Hodnotu SID můžeme získat ze dvou vzorců:
Stewartův vzorec [2]:
SID = [Na+] + [K+] + [Ca] + [Mg] – [Cl-] – [UA-] (1)
Fenclův vzorec [3]:
SIDef = [HCO3-] + [Atot-] (2)
Hodnota Atot- odpovídá součtu nábojů nebikarbonátových netěkavých slabých kyselin, jejichž klinicky významnými představiteli jsou albumin a fosfáty:
[Atot-] = [Alb] x (0,123 x pH – 0,631) + [Pi] x(0,309 x pH – 0,469) (3)
Velkým nedostatkem Stewartova vzorce (1) je hodnota [UA-], což je součet všech neměřených silných aniontů (laktát, sulfáty, ketolátky, glykolát, mravenčan…). Tyto anionty (kromě laktátu) běžně nejsou stanovovány, a proto podle klasického Stewartova vzorce je téměř nemožné SID vypočítat. Z tohoto důvodu se v klinické praxi používá spíše Fenclův vzorec (2), který vychází z běžně stanovovaných proměnných (HCO3-, albumin, fosfáty) a někdy bývá nazýván efektivním SID (SIDef). V některých pracích se můžeme setkat se zjednodušeným Stewartovým vzorcem, ze kterého je vynechána hodnota [UA-].
SIDapp = [Na+] + [K+] + [Ca] + [Mg] – [Cl-] (4)
Nevýhodou tohoto vzorce je, že nepočítá právě s hodnotou [UA-], která může v některých případech (diabetická ketoacidóza, intoxikace metanolem…) být významným acidifikujícím jevem. Tato hodnota proto bývá nazývána jako zdánlivý SID (SIDapp). Je velmi důležité si uvědomit, že hodnoty SIDef a SIDapp mezi sebou vzájemně nekorelují (v této studii Pearsonův korelační koeficient = 0,22), je proto důležité tyto dvě hodnoty mezi sebou nezaměňovat. Jejich rozdílem je právě hodnota [UA-], která bývá nazývána také jako okno silných iontů (strong ion gap – SIG) a kterou můžeme vypočítat takto:
[UA-] = SIDapp – SIDef = SIG (5)
Ze silných aniontů je u kriticky nemocných pacientů většinou stanovována hodnota laktátu, proto v některých publikacích bývá uváděn upravený vzorec pro výpočet SIDapp, který navíc počítá právě s hodnotou laktátu [4, 5]:
SIDapp[lac] = [Na+] + [K+] + [Ca] + [Mg] – [Cl-] – [lac-] (6)
Normální hodnota SIDef je 39 ± 1 mmol/l [3, 6], hodnoty nižší než 38 mmol/l odpovídají metabolické acidóze, hodnoty nad 40 mmol/l odpovídají metabolické alkalóze.
Normální hodnoty Atot- jsou 15 mmol/l [6] a rozdíl SIDef – Atot- odpovídá hodnotě HCO3- (norma 24,5 mmol/l). Normální hodnoty SIDapp bez zahrnutí hodnoty laktátu (podle vzorce (4)) jsou 43,8 mmol/l (zaokrouhleně 44 mmol/l), norma SIDapp se započtením hodnoty laktátu – podle vzorce (6) – je 42,5 mmol/l [5]. Normální hodnoty [UA-] jsou udávány buď 8 ± 2 mmol/l [6], nebo podle vzorce (5) odpovídají hodnotě 5 mmol/l (nepočítáno s laktátem) nebo 3,5 mmol/l (počítáno s laktátem).
SOUBOR PACIENTŮ A METODA
Tato monocentrická retrospektivní observační studie byla projednána místní etickou komisí a byli do ní zařazeni kriticky nemocní pacienti, kteří byli akutně přijati na resuscitační lůžko Anesteziologicko-resuscitačního oddělení Krajské nemocnice Tomáše Bati, a. s., ve Zlíně, a to v období srpen 2010 až květen 2013. Inkluzivními kritérii byly normální hodnoty parametrů acidobazické rovnováhy (ABR) arteriálního vzorku krve hodnocené podle „klasického“ přístupu: pH = 7,4 ± 0,05, BE = 0 ± 2,5 mmol/l, HCO3- = 24,5 ± 2,5 mmol/l a pCO2 = 5,3 ± 0,6 kPa. Zároveň musely být ze stejného vzorku krve provedeny odběry nutné pro stanovení SIDef a SIDapp (koncentrace sodíku, draslíku, celkového hořčíku, celkového vápníku, chloridů, albuminu a fosfátů). Abnormální hodnoty pH, BE, HCO3- a pCO2 byly exkluzivními kritérii pouze pro ten izolovaný odběr, při kterém byla počítána acidobazická rovnováha podle Stewart-Fenclova principu. Od jednoho pacienta byl vždy jen jeden odběr, nebylo zohledněno, jestli daný pacient měl abnormální hodnoty pH, BE, HCO3- nebo pCO2 v jiném odběru během hospitalizace. Celkem tato kritéria splňovalo 112 pacientů (tab. 1, 2).
Tab. 1. Demografické, klinické a biochemické charakteristiky 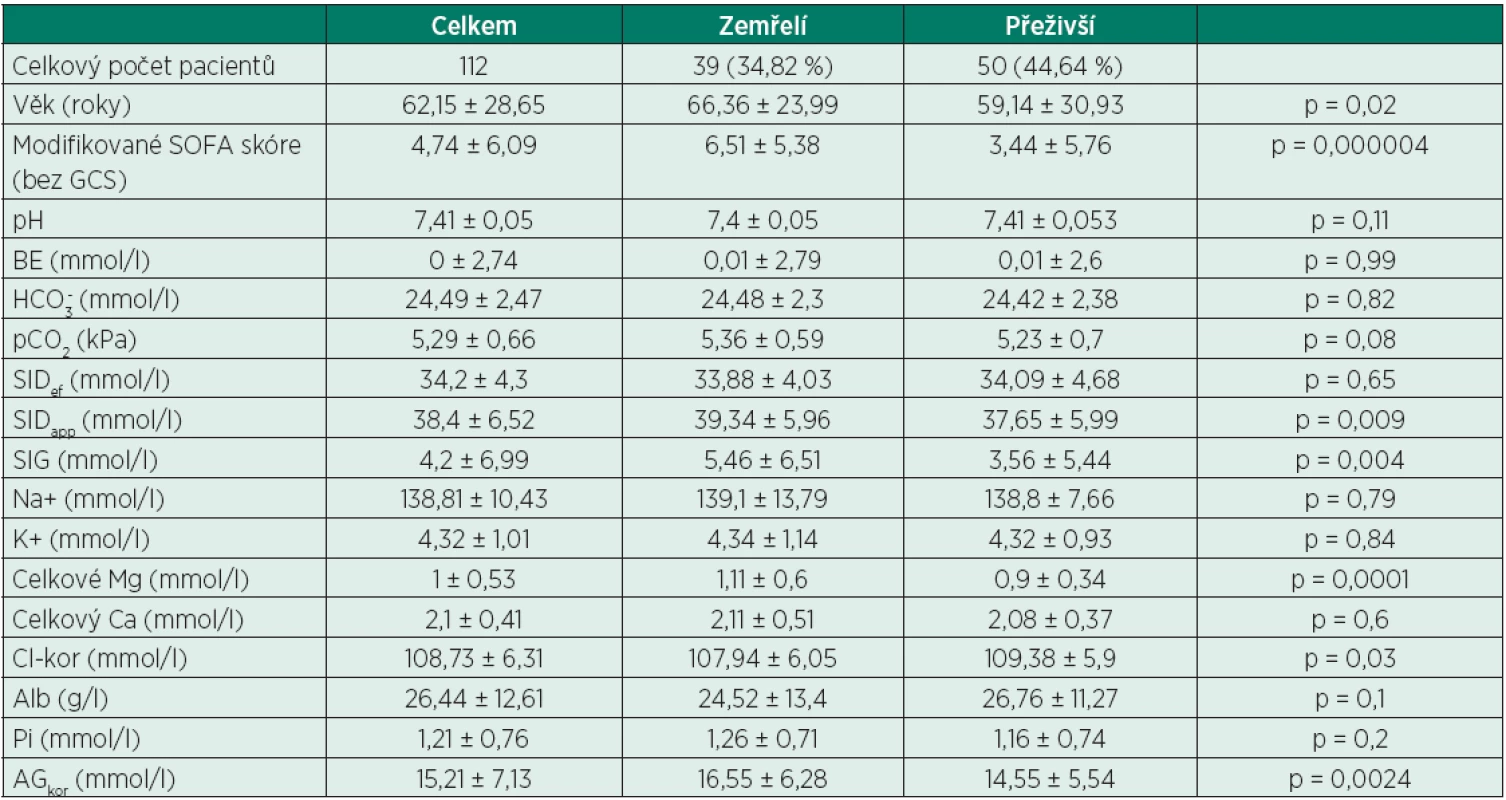
Hodnoty jsou uváděny v aritmetickém průměru ± 2 směrodatné odchylky. AGkor – aniontové okno (anion gap) korigované na normální hladinu albuminu, Alb – koncentrace albuminu, BE – výchylka bazí (base exces), Ca – koncentrace celkového vápníku, Cl-kor – koncentrace chloridových aniontů korigována na normální hladinu sodných kationtů, GCS – Glasgow coma scale, HCO3- – koncentrace hydrogenuhličitanového aniontu, K+ – koncentrace draselných kationtů, Mg – koncentrace celkového hořčíku, Na+ – koncentrace sodného kationtu, p – hodnota Studentova dvouvýběrového nepárového T-testu, pCO2 – parciální tlak oxidu uhličitého v arteriální krvi, Pi – koncentrace fosfátů, pH – pH arteriální krve, SIDapp – zdánlivá (apparent) diference silných iontů (strong ion difference), SIDef – efektivní (effective) diference silných iontů (strong ion difference), SIG – okno silných iontů (strong ion gap), SOFA – Sequential Organ Failure Assessment Tab. 2. Rozdělení pacientů podle příčiny hospitalizace 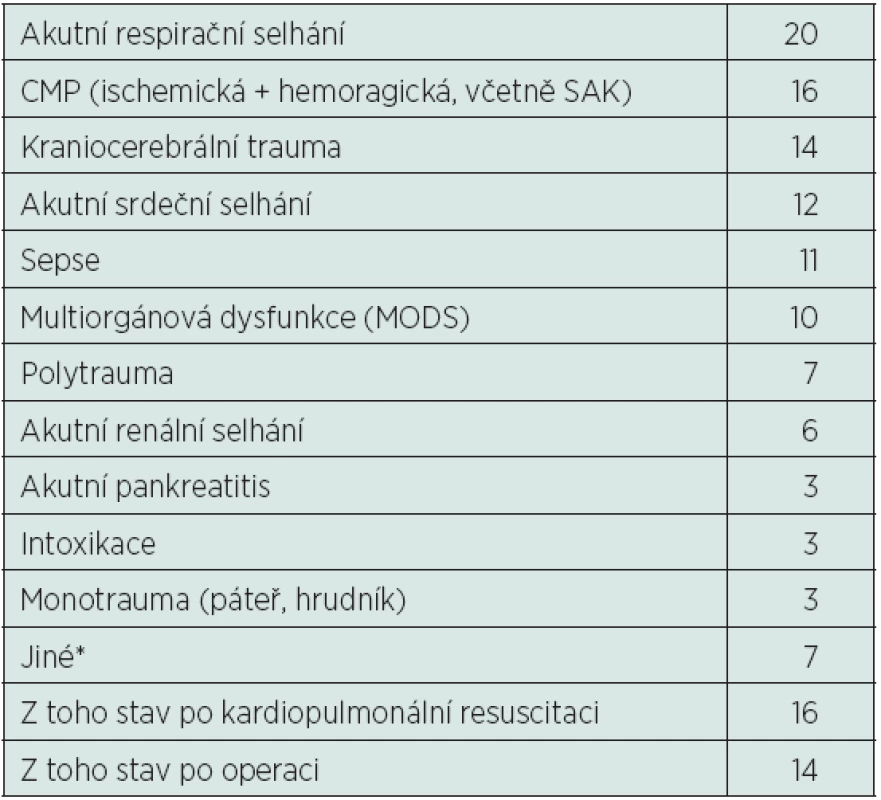
CMP – cévní mozková příhoda, SAK – subarachnoidální krvácení * náhlá příhoda břišní, tumor mozku (po operaci), peripartální život ohrožující krvácení, hemoragický šok, status epilepticus, myastenická krize, hypotenze nejasné etiologie Důležité je podotknout, že se nejednalo o vstupní odběry, ale o jakýkoliv odběr v průběhu hospitalizace, který splňoval daná kritéria. Všechny hodnoty pH, BE, HCO3- a pCO2 byly zjištěny pomocí bedside analyzátoru ABL 800 firmy Radiometer®.Všechny hodnoty Na+, K+, Cl-, celkového Mg, celkového Ca, Pi a albuminu pocházely z akreditované biochemické laboratoře Krajské nemocnice Tomáše Bati, a.s. ve Zlíně. U všech zařazených pacientů byly spočítány hodnoty SIDef, SIDapp a SIG (podle vzorce (2), (4) a (5)), byla stanovena hodnota AG a korigována na hodnotu albuminu (podle vzorce: AGkor = Na+ + K+ – Cl- – HCO3- + 0,25 * (44 – Alb)), změřená hodnota chloridů byla korigována na hodnotu sodíku (podle vzorce: Cl-kor = Cl- * 140/Na+). V další fázi studie byli pacienti rozděleni do dvou skupin. V první skupině byli pacienti, kteří zemřeli do 3 měsíců od přijetí, ve druhé skupině byli pa-cienti, kteří prokazatelně přežili déle než 3 měsíce od přijetí do nemocnice. Vzhledem k tomu, že někteří pacienti byli přeloženi z naší nemocnice před uplynutím tří měsíců a od té doby nebyly o nich žádné záznamy v nemocničním systému, byli tito pacienti z další části studie vyřazeni. Celkem bylo zařazeno do druhé části studie 89 pacientů, 39 z nich zemřelo do 3 měsíců od přijetí (skupina zemřelí) a 50 prokazatelně přežilo déle než 3 měsíce od přijetí do nemocnice (skupina přeživší). Po rozdělení bylo v každé skupině pomocí F-testu a Studentova dvouvýběrového nepárového T-testu (v tabulkách hodnota p) zjištěno, zda je mezi sledovanými proměnnými v daných sledovaných skupinách statisticky významný rozdíl. U parametrů s prokázaným statisticky významným rozdílem byly pomocí programu MedCalc firmy MedCalc software ® sestrojeny ROC (Receiver Operating Characteristic) křivky, stanoveny optimální hraniční hodnoty, AUC (area under curve), senzitivita a specificita pro 95% konfidenční interval a byly sestrojeny Box and Whisker grafy pro SIDapp, SIG, AGkor a celkové Mg (obr. 1–5). V poslední části práce bylo u všech parametrů, u kterých byl zjištěn statisticky signifikantní rozdíl mezi oběma skupinami (SIDapp, SIG, AGkor a celkové Mg) pomocí Pearsonova korelačního koeficientu zjištěno, zda existují korelace mezi hodnotami SIDapp, SIG, AGkor a celkového Mg.
Obr. 1. Porovnání ROC křivek pro SID<sub>app</sub>, SIG, AG<sub>kor</sub> a celkové Mg SID<sub>app</sub> (AUC) = 0,655, SIG (AUC) = 0,691, AG<sub>kor</sub> (AUC) = 0,686, celkové Mg (AUC) = 0,7 SID<sub>app</sub> – zdánlivá (apparent) diference silných iontů (strong ion difference), SIG – okno silných iontů (strong ion gap), AG<sub>kor</sub> – aniontové okno (anion gap) korigované na normální hladinu albuminu, Mg – koncentrace celkového hořčíku 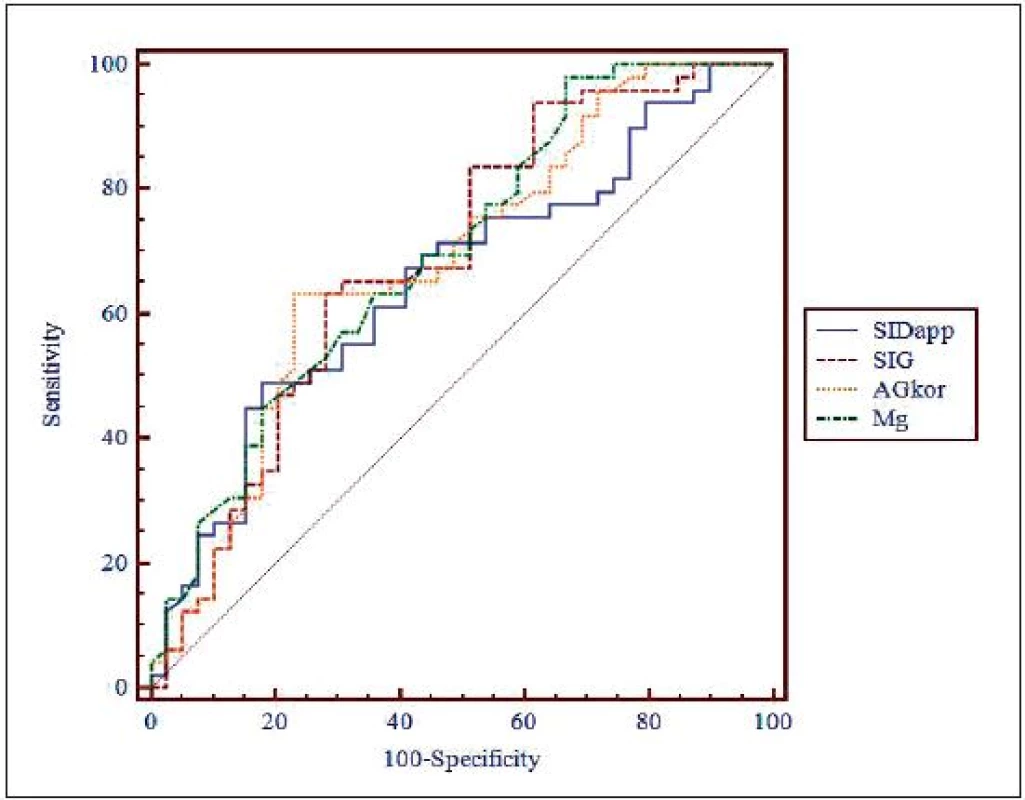
Obr. 2. Box and Whisker graf pro SID<sub>app</sub>, SID<sub>app</sub> – zdánlivá (apparent) diference silných iontů (strong ion difference) 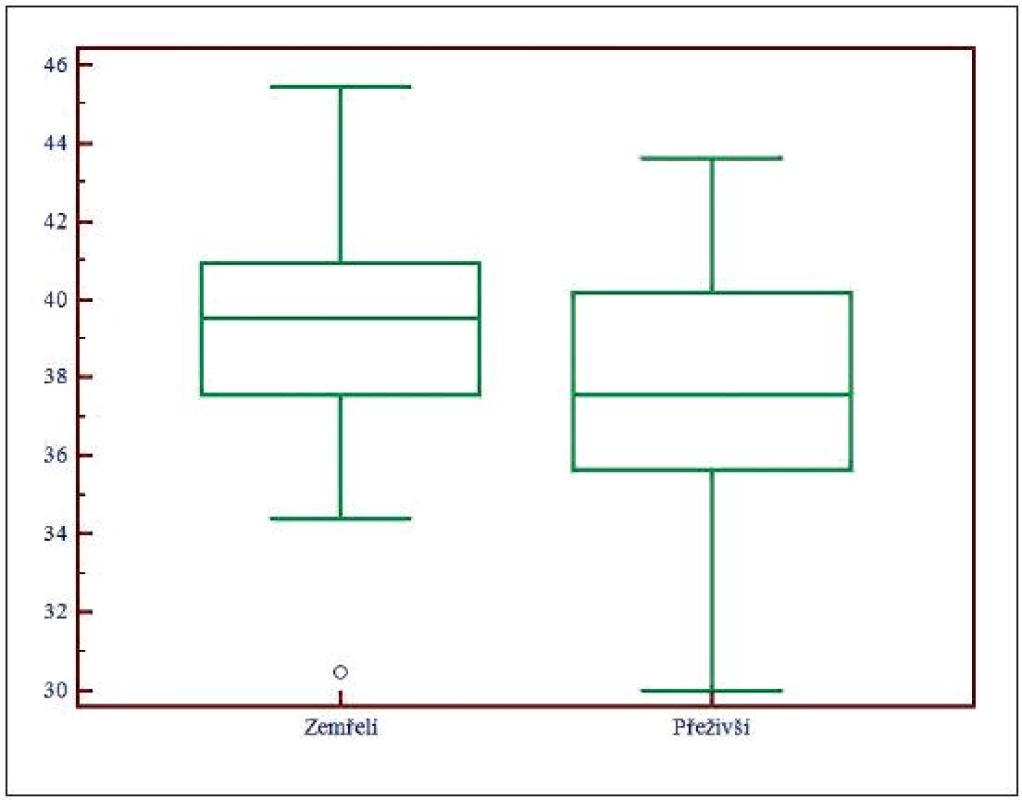
Obr. 3. Box and Whisker graf pro SIG, SIG – okno silných iontů (strong ion gap) 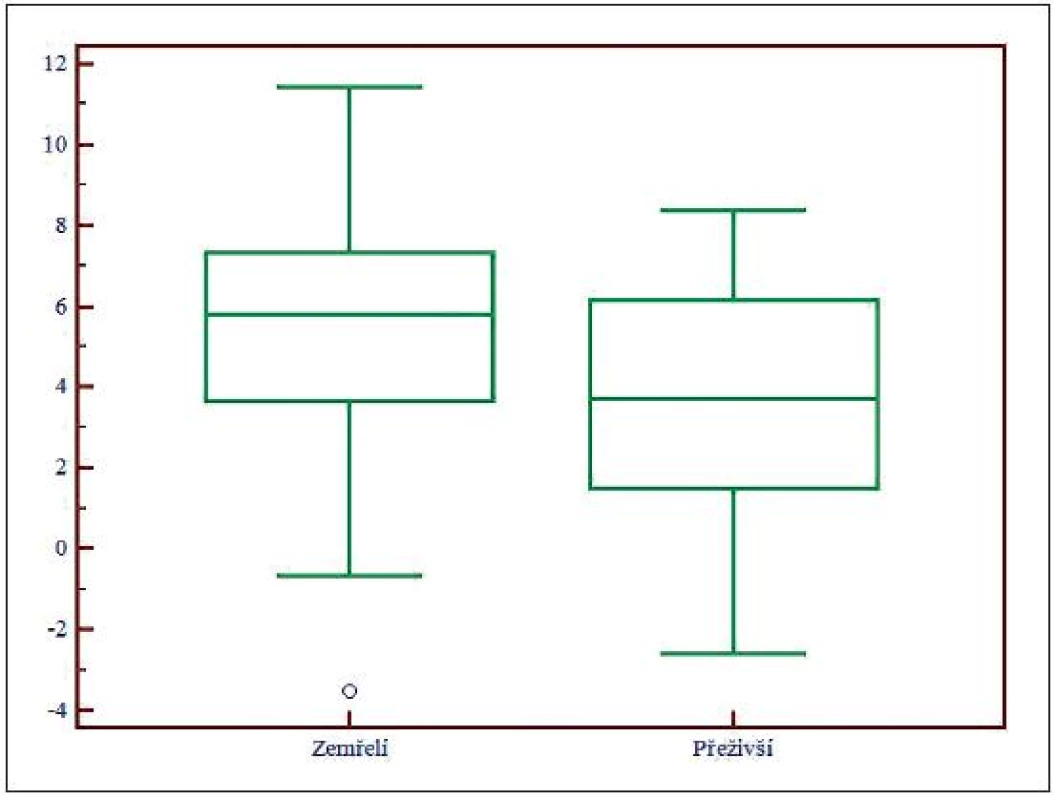
Obr. 4. Box and Whisker graf pro AG<sub>kor</sub>, AG<sub>kor</sub> – aniontové okno (anion gap) korigované na normální hladinu albuminu 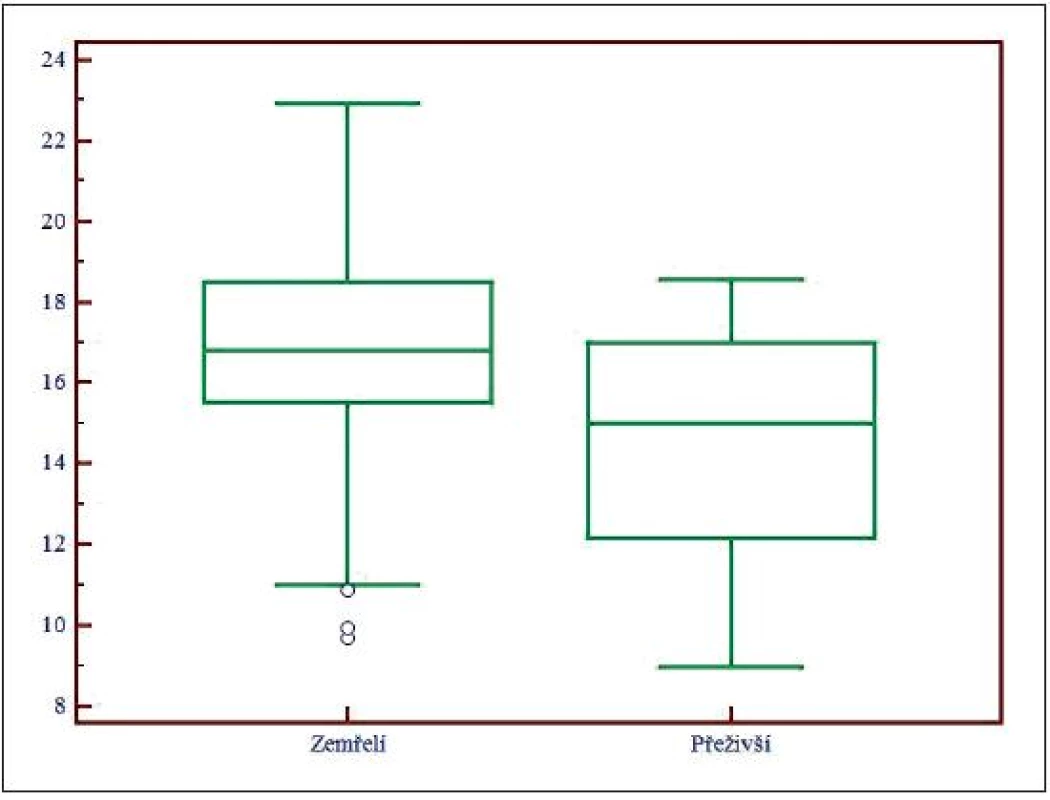
Obr. 5. Box and Whisker graf pro celkové Mg, Mg – koncentrace celkového hořčíku 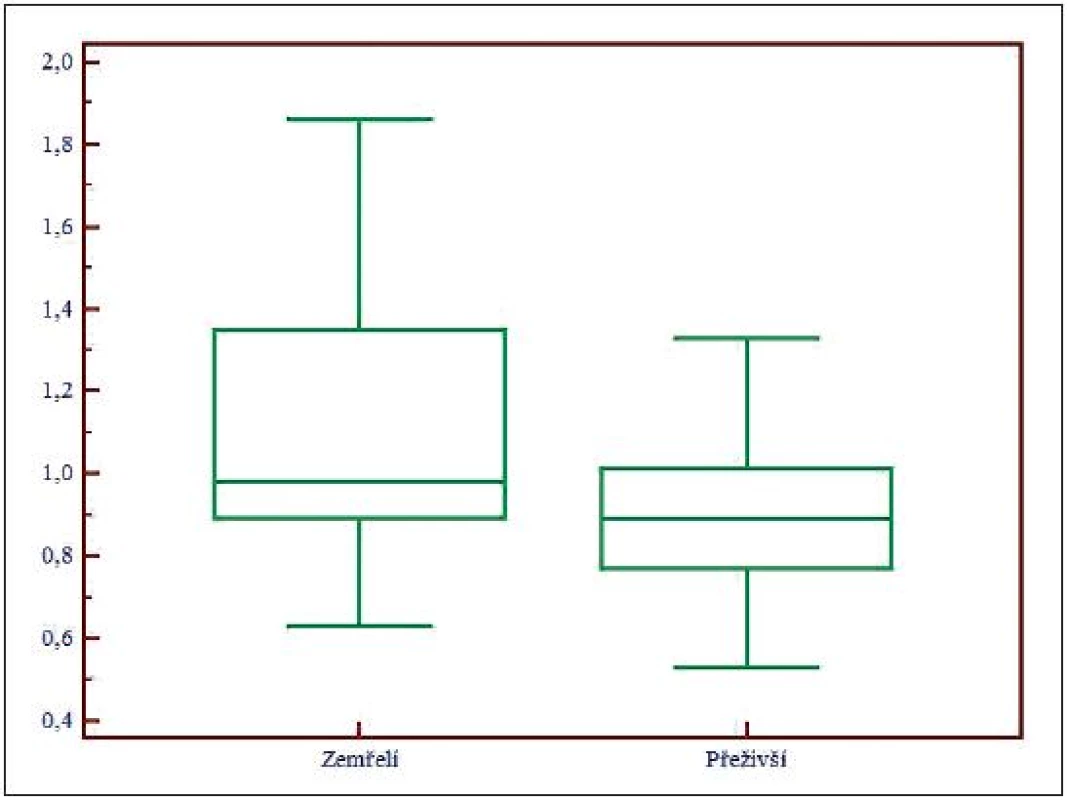
VÝSLEDKY
Ze 112 pacientů zařazených do této studie jich 39 zemřelo do 3 měsíců od přijetí (34,82 %), dalších 50 pacientů prokazatelně přežilo déle než 3 měsíce od přijetí a zbylých 23 pacientů bylo z naší nemocnice propuštěno/přeloženo před uplynutím doby 3 měsíců – tito pacienti byli z další části studie vyřazeni. Z celkového počtu 112 pacientů s normálními hodnotami pH, pCO2, BE a HCO3- jich 110 mělo abnormální hodnoty SIDef (98,21 %), z toho 85 pacientů mělo hodnotu SIDef pod 36 mmol/l (75,89 %) a 2 dokonce pod 30 mmol/l (1,79 %), což je hodnota vyjadřující již velmi těžkou metabolickou acidózu (tab. 3). Dále 107 pacientů mělo abnormální hodnoty SIDapp (95,54 %) (tab. 4), 52 pacientů mělo hodnotu SIG nad 5 mmol/l (46,43 %) a 4 z nich dokonce SIG nad 10 mmol/l (3,57 %) (tab. 5). Nejdůležitějšími acidifikujícími vlivy byly především hyperchlorémie (88 pacientů, 78,57 %), hyponatrémie v rámci diluční acidózy (19 pacientů, 16,96 %) a vysoká hodnota korigovaného AG (nad 16 mmol/l) odpovídající zvýšenému množství neměřitelných aniontů (54 pacientů, 48,21 %). Dále u velké části pacientů byla pozorována hypokalcémie (84 pacientů, 75 %), u menšího počtu pacientů byla pozorována hyperfosfatémie (15 pacientů, 13,39%). Žádný acidifikující vliv nebyl nalezen u 2 pacientů (1,79 %) (tab. 6). Z alkalizujících vlivů byla dominantní hypoalbuminémie (104 pacientů, 92,86 %), u velké části pacientů byla přítomna hypermagnezémie (68 pacientů, 60,71 %), u menší části pak hypofostatémie (15 pacientů, 13,39 %). U daleko menšího počtu pacientů byla pozorována hypernatrémie v rámci koncentrační alkalózy (10 pacientů, 8,93 %), hypochlorémie (po korekci na hodnotu sodíku) nebyla pozorována ani v jednom případě. Žádný alkalizující vliv nebyl zjištěn u 2 pacientů (1,79 %) (tab. 7). Jediný statisticky signifikantní rozdíl mezi skupinou zemřelých a přeživších byl nalezen u hodnoty korigovaného AG (AGkor nad 16 mmol/l) (66,67 % vs. 38 %, p = 0,007), u ostatních acidifikujících i alkalizujících vlivů nebyl mezi oběma skupinami nalezen statisticky signifikantní rozdíl, i když v některých případech se jednalo o rozdíly s hraniční statistickou významností (viz tabulky 6 a 7).
Tab. 3. Rozdělení pacientů dle hodnoty SIDef 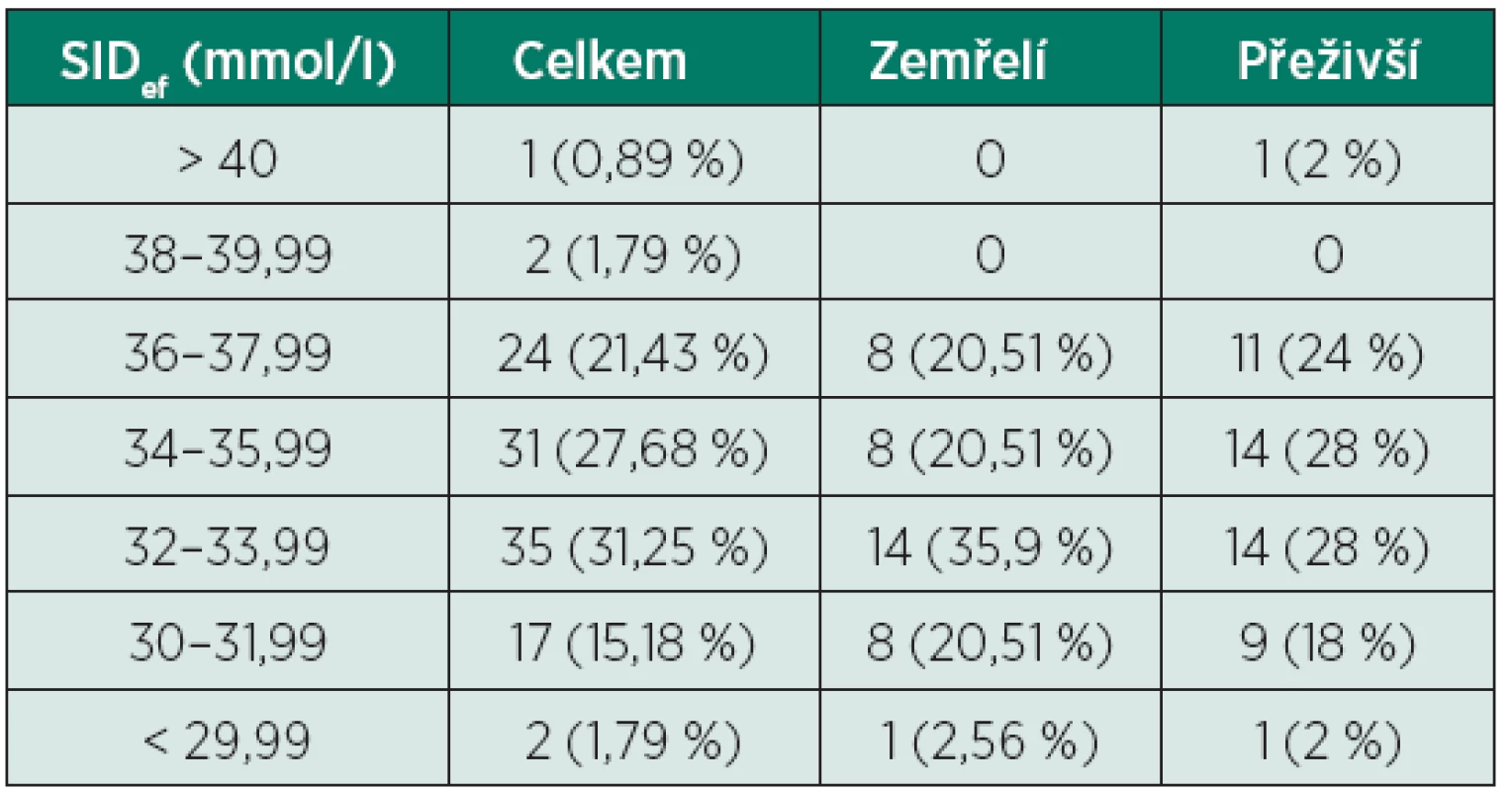
SIDef – efektivní (effective) diference silných iontů (strong ion difference) Tab. 4. Rozdělení pacientů dle hodnoty SIDapp 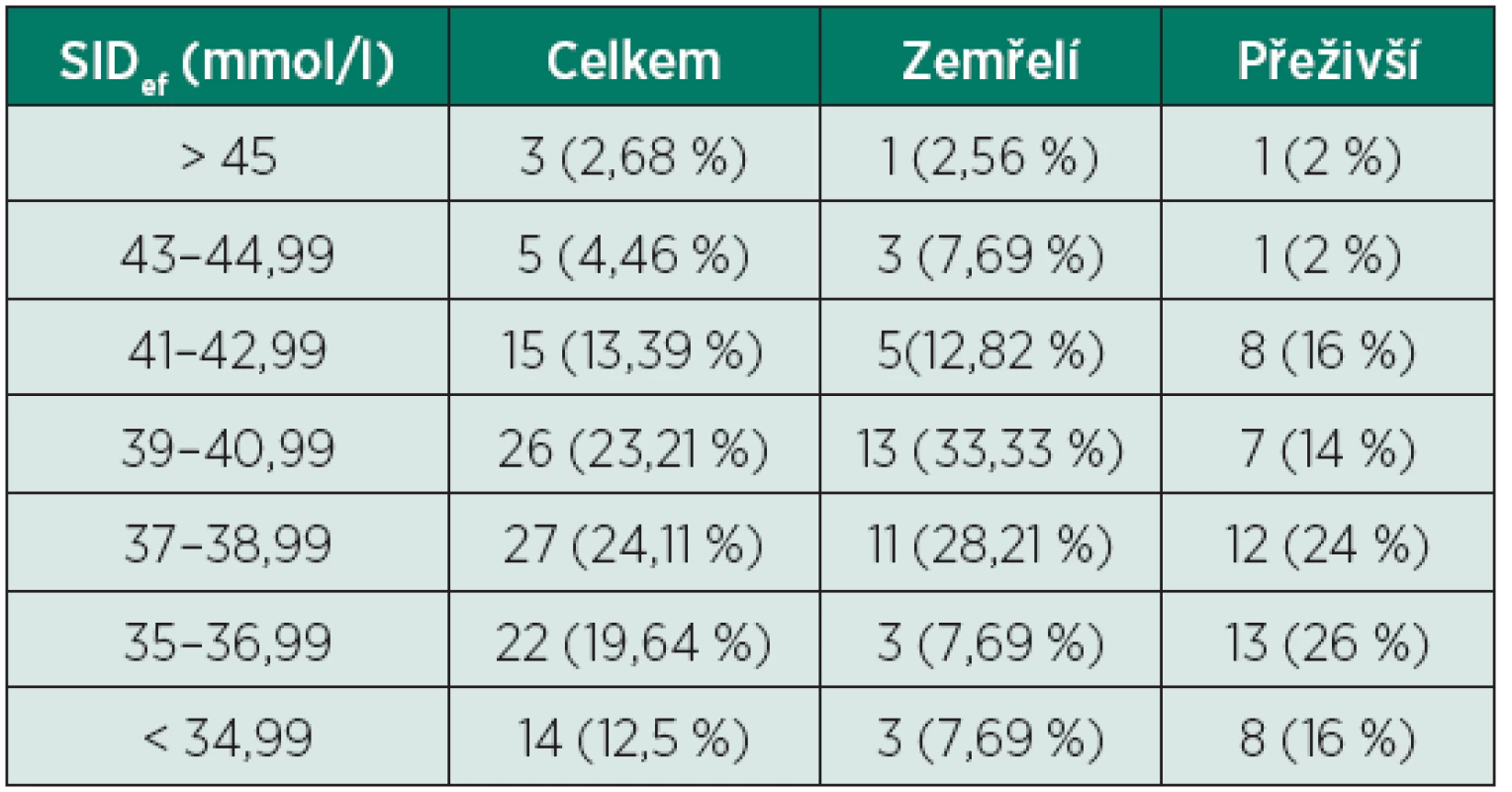
SIDapp – zdánlivá (apparent) diference silných iontů (strong ion difference) Tab. 5. Rozdělení pacientů podle hodnoty SIG 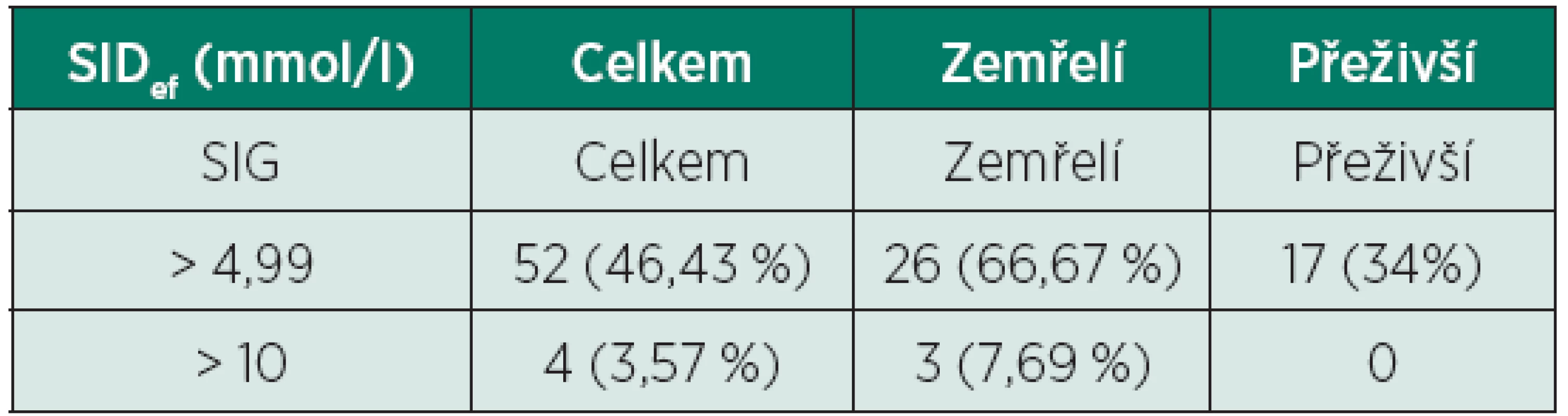
SIG – okno silných iontů (strong ion gap) Tab. 6. Rozdělení pacientů podle acidifikujících vlivů 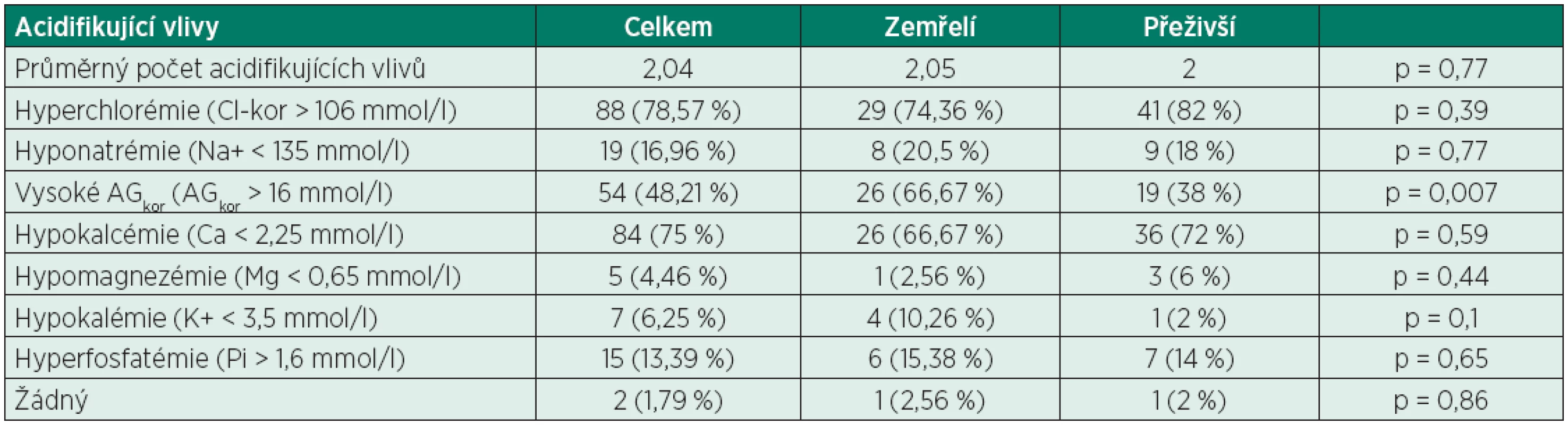
AGkor – aniontové okno (anion gap) korigované na normální hladinu albuminu, Ca – koncentrace celkového vápníku, Cl-kor – koncentrace chloridových aniontů korigována na normální hladinu sodných kationtů, K+ – koncentrace draselných kationtů, Mg – koncentrace celkového hořčíku, Na+ – koncentrace sodného kationtu p – hodnota Studentova dvouvýběrového nepárového T-testu, Pi – koncentrace fosfátů Tab. 7. Rozdělení pacientů dle alkalizujících vlivů 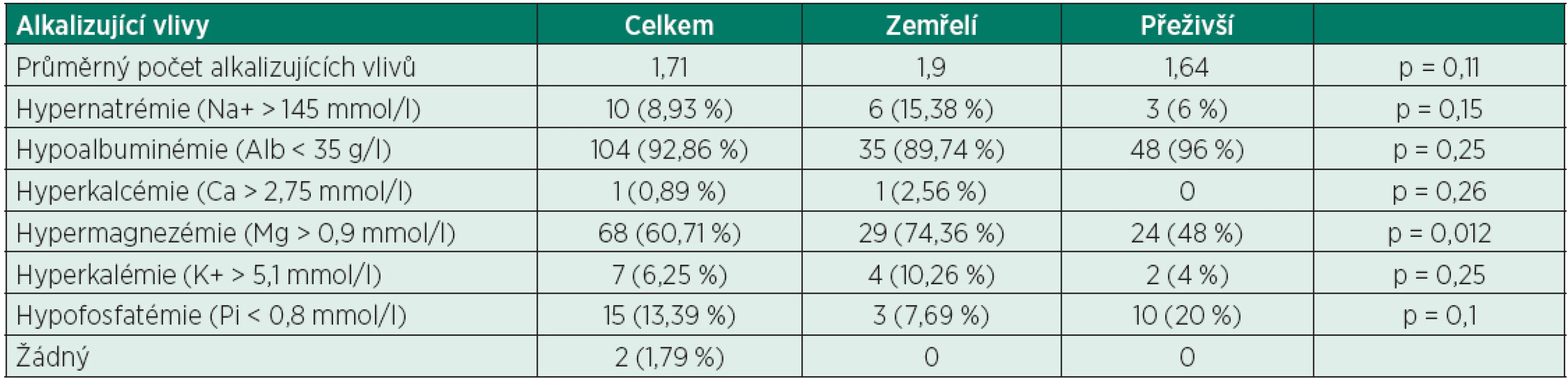
Alb – koncentrace albuminu, Ca – koncentrace celkového vápníku, K+ – koncentrace draselných kationtů, Mg – koncentrace celkového hořčíku, Na+ – koncentrace sodného kationtu, p – hodnota Studentova dvouvýběrového nepárového T-testu, Pi – koncentrace fosfátů Velmi zajímavé je zkoumání kombinací různých acidifikujících a alkalizujících vlivů. Průměrně měl každý pacient 2,04 acidifikujících a 1,71 alkalizujících vlivů, ve skupině zemřelých byl poměr 2,05/1,9 (acidifikující/alkalizující), ve skupině přeživších byl poměr 2,0/1,64 (acidifikující/alkalizující), i přes mírně vyšší počet alkalizujících vlivů ve skupině zemřelých nebyl nalezen statisticky signifikantní rozdíl mezi oběma skupinami. Nejčastější kombinací acidifikujícího a alkalizujícího vlivu byla kombinace hyperchlorémie/hypoalbuminémie (83 pacientů, 74,11 %), ale nebyl nalezen statisticky signifikantní rozdíl mezi oběma skupinami (71,79 % ve skupině zemřelých, 80 % ve skupině přeživších, p = 0,37). Ostatní kombinace a jejich porovnání s oběma skupinami jsou uvedeny v tabulce 8, na tomto místě se zaměříme jen na ty významné z nich. Statisticky signifikantní rozdíl mezi oběma skupinami byl nalezen u kombinace vysokého AGkor (nad 16 mmol/l) a hypermagnezémie (48,72 % vs. 18 %, p = 0,004), nicméně tento výsledek je velmi ovlivněn významně vyšší četností vysokého AGkor ve skupině zemřelých, při porovnáním této kombinace vysoké AGkor a hypermagnezémie v dále selektované populaci zemřelí s vysokou hodnotou AGkor/přeživší s vysokou hodnotou AGkor byl zjištěn sice výrazný, ale statisticky nesignifikantní rozdíl (73,08 % vs. 47,37 %, p = 0,08).
Tab. 8. Rozdělení pacientů dle kombinací acidifikujících a alkalizujících vlivů 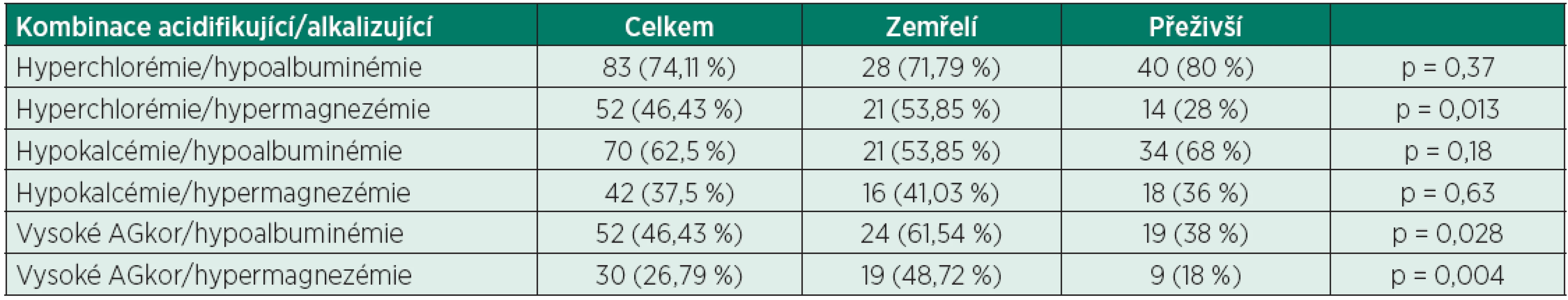
AGkor – aniontové okno (anion gap) korigované na normální hladinu albuminu, p – hodnota Studentova dvouvýběrového nepárového T-testu Z další části studie byli vyřazeni již výše zmínění pacienti, kteří nesplnili kritéria (smrt do 3 měsíců nebo prokazatelné přežití po 3 měsících od přijetí do nemocnice) a zbylí pacienti (89 pacientů) byli rozděleni do dvou skupin: skupina zemřelí (smrt do 3 měsíců od přijetí – 39 pacientů) a skupina přeživší (prokazatelné přežití po 3 měsících od přijetí – 50 pacientů) – viz tabulka 1. U všech pacientů zařazených do studie byla z dokumentace zpětně spočítána hodnota modifikovaného SOFA (Sequential Organ Failure Assessment) skóre, vzhledem k tomu, že většina pacientů byla v době odběru analgosedována a intubována, byla použita hodnota SOFA skóre bez započítání hodnoty Glasgow coma scale (GCS). Není překvapivé, že obě skupiny se velmi významně lišily v průměrné hodnotě modifikovaného SOFA skóre (zemřelí vs. přeživší – 6,51 vs. 3,44, p = 0,000004). Mezi zemřelými a přeživšími byl nalezen statisticky signifikantní rozdíl mezi hodnotami SIDapp (p = 0,009), SIG (p = 0,004), AGkor (p = 0,0024), celkového Mg (p = 0,0001), mezi ostatními hodnotami nebyl nalezen statisticky signifikantní rozdíl (viz tab. 1). Statisticky signifikantní rozdíl u parametrů SIG a AGkor je ve shodě s výše popsaným statisticky signifikantně větším počtem pacientů s AGkor nad 16 mol/l ve skupině zemřelých (p = 0,007).
U parametrů SIDapp, SIG, AGkor a celkového Mg byly pomocí programu MedCalc firmy MedCalc software ® sestrojeny ROC křivky, stanoveny optimální hraniční hodnoty, senzitivita a specificita pro 95% konfidenční interval. Optimální hraniční hodnota pro SIDapp byla v této studii 41,56 mmol/l, při této hodnotě je senzitivita testu 18,92 (95% CI 8,0–35,2) a specificita 93,75 (95% CI 82,8–98,7). Optimální hraniční hodnota pro SIG byla v této studii 6,9 mmol/l, senzitivita 37,84 (95% CI 22,5–55,2) a specificita 93,75 (95% CI 82,8–98,7). Optimální hraniční hodnota pro AGkor byla stanovena 18,1 mmol/l, senzitivita 27,03 (95% CI 13,8–44,1) a specificita 95,83 (95% CI 85,7–99,5). Optimální hraniční hodnota pro celkové Mg byla stanovena 1,25 mmol/l, senzitivita 32,43 (95% CI 18,0–49,8) a specificita 97,92 (95% CI 88,9–99,9) – vše viz tab. 9, obr. 1.
Tab. 9. Hraniční hodnoty, analýza ROC křivek, senzitivita a specificita pro sledované parametry (SIDapp, SIG, AGkor, celkové Mg) 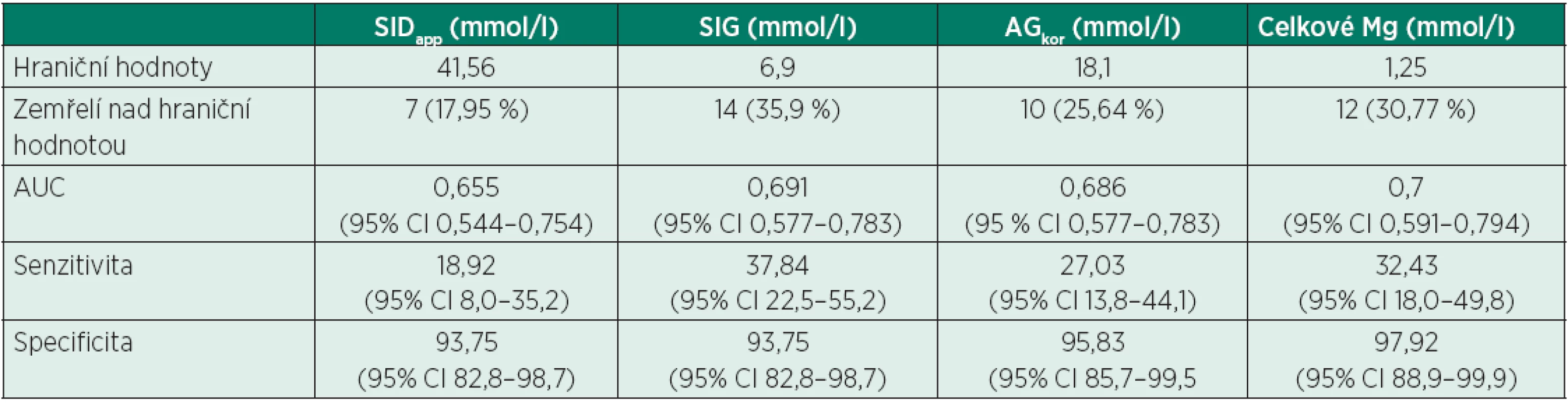
AGkor – aniontové okno (anion gap) korigované na normální hladinu albuminu, AUC – plocha pod křivkou (area under curve), CI – konfidenční interval (confidence interval), Mg – koncentrace celkového hořčíku, ROC – Receiver Operating Characteristic, SIDapp – zdánlivá (apparent) diference silných iontů (strong ion difference), SIG – okno silných iontů (strong ion gap) Poslední částí práce bylo zjištění korelace mezi všemi sledovanými parametry, u kterých byl nalezen statisticky signifikantní rozdíl (SIDapp, SIG, AGkor, celkové Mg). Jediná statisticky signifikantní lineární korelace byla zjištěna mezi hodnotami SIG a AGkor (Pearsonův korelační koeficient = 0,96), mezi ostatními sledovanými parametry nebyla zjištěna statisticky významná lineární korelace. Ostatní výsledky Pearsonova korelačního koeficientu: SIDapp/SIG = 0,79, SIDapp/AGkor = 0,79, SIDapp/Mg = 0,2, SIG/Mg = 0,11 a AGkor/Mg = 0,08.
DISKUSE
Jednoduché, nekomplikované poruchy acidobazické rovnováhy jsou většinou snadno odhaleny pomocí „klasického“ přístupu, nicméně kombinované a komplikované poruchy acidobazické rovnováhy na druhou stranu často zůstanou neodhaleny. „Klasický“ přístup selhává v situacích, kdy nacházíme abnormální hodnoty plazmatických non-bikarbonátových pufrů (albumin a fosfát), proto v těchto situacích můžeme nalézat normální hodnoty pH, BE a HCO3-. Je důležité si uvědomit, že porucha acidobazické rovnováhy je dynamický proces, který má svůj vývoj. V této práci jsme se zaměřili jen na jedno izolované vyšetření acidobazické rovnováhy podle obou přístupů bez ohledu na případný vývoj, možné předcházející nebo následující poruchy acidobazické rovnováhy hodnocené podle „klasického“ přístupu nebyly zohledněny. Velké množství acidifikujících vlivů (hyperchlorémie, diluční acidóza, elevace UA-) může být maskována hypoalbuminémií jako alkalizujícím procesem, a proto zůstává hodnota BE a HCO3- často nezměněna. Hypoalbuminémie je u kriticky nemocných pacientů velmi častá (v této studii 92,86 % ze všech sledovaných kriticky nemocných pacientů), je taktéž výrazným nezávislým rizikovým faktorem zhoršujícím nemocniční mortalitu a morbiditu [7]. U kriticky nemocných pacientů může být hypoalbuminémie příčinou poruchy acidobazické rovnováhy (snížená syntéza a zvýšená degradace albuminu, zvýšený kapilární průnik do intersticia při endoteliální dysfunkci), ale může být také kompenzačním mechanismem (hyperchlorémie při tekutinové resuscitaci fyziologickým roztokem, korekce vysokého množství UA-,…). V této studii měli pacienti ve skupině zemřelých sice nižší průměrnou hodnotu koncentrace sérového albuminu (24,52 g/l vs. 26,76 g/l), nicméně tento rozdíl byl statisticky nesignifikantní (p = 0,1).
Hypoalbuminémie je často spojena s hyperchlorémií. V této práci byla hypoalbuminémie nejčastější příčinou alkalizace a hyperchlorémie nejčastější příčinou acidifikace, nicméně zde nebyla nalezena korelace mezi hladinou albuminu a chloridů, ať už přímo měřených, nebo korelovaných na hodnotu sodíku (Pearsonův korelační koeficient = -0,16 resp. -0,14), tento nález je ve shodě s prací Fencla et al. [3]. Velmi důležité je zmínit, že zvýšená hodnota neměřených aniontů, ať už pomocí SIG nebo AG, se vyskytuje i u pacientů s normální hodnotou BE nebo HCO3-. Pro kriticky nemocné pacienty zde byly stanoveny hraniční hodnoty SIG (6,9 mmol/l) a AGkor (18,1 mmol/l), tyto hodnoty překročilo 35,9 %, respektive 25,64 % ze zemřelých pacientů, nicméně i u přeživších pacientů byla tato hraniční hodnota překročena v 6 %, respektive 4 %, tyto výsledky dávají velmi vysokou, nicméně ne 100%, specificitu testu (93,75, respektive 95,83), při posunutí hraniční hodnoty směrem nahoru by se sice specificita testu zvýšila, ale na úkor výrazného poklesu senzitivity. Je zajímavé zjištění, že v porovnání obou skupin (zemřelí vs. přeživší) je ve skupině zemřelých větší množství pacientů s vysokým AGkor a zároveň hypermagnezémií (48,72 % vs. 18 %). Je výše uvedeno, že hypoalbuminémie může být kompenzačním mechanismem zvýšeného množství UA- a tím pádem vyššího AG, proto v této práci je uváděna hodnota AG korigovaná na hodnotu albuminu. Pacienti ve skupině zemřelých měli sice nesignifikantně, ale přesto nižší střední hodnotu sérového albuminu a taktéž výrazně vyšší hodnotu modifikovaného SOFA skóre (viz tab. 1), proto je možné, že pacienti, kteří mají více postiženy orgánové funkce (vyšší modifikované SOFA skóre) ve větším množství kompenzují zvýšené množství UA- retencí horčíku. Toto zjištění by vysvětlovalo signifikantně větší střední hodnotu magnezémie ve skupině zemřelých, nicméně proti této myšlence svědčí jen velmi malá korelace mezi hodnotami SIG/Mg nebo AGkor/Mg (viz výsledky Pearsonova korelačního koeficientu).
Podle Stewartova vzorce (1) má zvýšení jakéhokoliv kationtu alkalizující vliv (zvýší se SID) a snížení jakéhokoliv kationtu acidifikující vliv (sníží se SID), u aniontů je to obráceně. Je tedy otázkou, jak chápat dysbalanci draslíku. Je obecně známo, že hyperkalémie má acidifikující účinky, je to způsobeno přesunem draselných iontů do buňky spojené s přesunem vodíkových iontů z buňky ven, ve Stewartově vzorci máovšem hyperkalémie mít alkalizující vliv, proto v této práci byla hyperkalémie brána jako alkalizující vliv a hypokalémie jako acidifikující vliv (viz tabulky 6 a 7).
V této studii měli pacienti ze skupiny zemřelých celkově vyšší hodnoty SIDapp, hraniční hodnota byla stanovena na 41,56 mmol/l, což představuje hraničně subnormální hodnotu acidobazické rovnováhy. Horší prognózu v této studii proto měli pacienti spadající podle Stewartova-Fenclova pojetí acidobazické rovnováhy do normy nebo alkalózy. Z těchto výsledků plyne, že je důležité při posuzování poruch acidobazické rovnováhy tyto hodnoty stanovovat i u pacientů s normálními hodnotami pH, BE a HCO3-. Nutno dodat, že do této studie byli zařazeni jen pacienti s normálními hodnotami arteriálního pH, BE, HCO3- a pCO2, u kriticky nemocných pacientů s abnormálními hodnotami těchto parametrů mohou být výsledky odlišné. Nicméně je nutné podotknout, že SIDapp tak, jak je zde interpretováno, má jen malou vypovídající hodnotu.
V této souvislosti je třeba zmínit, že ve světové literatuře dosud chybějí studie jasně potvrzující nebo vyvracející vliv acidémie u kriticky nemocných pacientů. Kazda et al. píší, že lehká metabolická acidóza může být u kriticky nemocných pacientů výhodná, důvodem je posunutí disociační křivky hemoglobinu doprava, a tím snadnější uvolňování kyslíku ve tkáních, snížení buněčných funkcí a nároků na utilizaci kyslíku [8], svůj podíl může mít i vazodilatace navozená acidózou a tím zlepšení perfuze tkání.
Ve světové literatuře bylo publikováno několik studií, které zkoumaly přítomnost poruchy acidobazické rovnováhy u kriticky nemocných hodnocené podle Stewartova-Fenclova přístupu při normálních hodnotách BE. Bylo jednoznačně prokázáno, že i při normálních hodnotách BE je přítomna porucha acidobazické rovnováhy hodnocená podle Stewartova-Fenclova přístupu [3, 9].
U pacientů přijímaných na resuscitační lůžko po závažném traumatu bylo prokázáno, že nízká hodnota SID a vysoká hodnota SIG jsou prognosticky nepříznivými faktory nemocniční mortality [10]. Dále bylo prokázáno, že hodnota SID u traumatických pacientů může identifikovat závažné trauma [11]. I přes prokázaný prognostický benefit SID a SIG u traumatických pacientů závěry některých prací tvrdí, že obecně u pacientů přijímaných na resuscitační lůžko bez ohledu na diagnózu nepřinášejí hodnoty SIDeff, SIDapp, ani SIG žádné výhody oproti klasickému přístupu hodnocení poruch acidobazické rovnováhy při stanovování prognózy kriticky nemocných [12, 13].
ZÁVĚR
Při hodnocení poruch acidobazické rovnováhy podle klasického přístupu založeném na hodnocení změny pH, BE, HCO3- a pCO2 často nezachytíme významné poruchy acidobazické rovnováhy. Tyto poruchy jsou především kombinované, kdy se acidifikující a alkalizující vlivy navzájem kompenzují. Z tohoto důvodu je velmi důležité u kriticky nemocných pacientů používat i alternativní, fyzikálně-chemický přístup podle Stewarta-Fencla. U stejné skupiny pacientů je taktéž velmi důležité sledovat hodnotu neměřených aniontů pomocí AGkor nebo SIG, protože vysoké hodnoty (AGkor nad 18,1 mmol/l, SIG nad 6,9 mmol/l) jsou i u pacientů s normálními parametry pH, BE a HCO3- spojeny s vyšší tříměsíční mortalitou. AGkor a SIG jsou parametry mezi sebou korelující, a tudíž navzájem zaměnitelné. Nevýhodou této studie je malý počet zařazených kriticky nemocných pacientů (112), retrospektivní typ studie a hodnocení jen izolovaného vyšetření acidobazické rovnováhy bez ohledu na možný vývoj poruchy. Otevřenou otázkou zůstává potenciálně protektivní vliv mírné acidémie u kriticky nemocných pacientů a možný vliv hypermagnezémie jako kompenzačního mechanismu vysokého množství UA- u pacientů s vyšší mírou orgánové dysfunkce. Je proto důležité provádět další studie na tato témata.
Seznam zkratek:
- ABR – acidobazická rovnováha
- AGkor – aniontové okno (anion gap) korigované na normálníhladinu albuminu
- Alb – koncentrace albuminu
- Atot - – celkové množství nebikarbonátových netěkavýchslabých kyselin (albumin, fosfáty)
- AUC – plocha pod křivkou (area under curve)
- BE – výchylka bazí (base exces)
- Ca – koncentrace celkového vápníku
- CI – konfidenční interval (confidence interval)
- Cl - – koncentrace chloridových aniontů
- Cl-kor – koncentrace chloridových aniontů korigovánana normální hladinu sodných kationtů
- GCS – Glasgow coma scale
- HCO3 - – koncentrace hydrogenuhličitanového aniontu
- K+ – koncentrace draselných kationtů
- lac - – koncentrace laktátu
- Mg – koncentrace celkového hořčíku
- Na+ – koncentrace sodného kationtu
- p – hodnota Studentova dvouvýběrového nepárového T-testu
- pCO2 – parciální tlak oxidu uhličitého v arteriální krvi
- Pi – koncentrace fosfátů
- pH – pH arteriální krve
- ROC – Receiver Operating Characteristic
- SIDapp – zdánlivá (apparent) diference silných iontů (strong ion difference)
- SIDef – efektivní (effective) diference silných iontů (strong ion difference)
- SIG – okno silných iontů (strong ion gap)
- SOFA – Sequential Organ Failure Assessment
- [UA-] – koncentrace neměřených silných aniontů
Tato práce byla projednána etickou komisí Krajské nemocnice Tomáše Bati, a. s., Zlín.
Autoři práce nejsou v žádném konfliktu zájmů.
Do redakce došlo dne 21. 9. 2013.
Do tisku přijato dne 15. 11. 2013.
Adresa pro korespondenci:
MUDr. Lubomír Večeřa
Anesteziologicko-resuscitační oddělení
Krajská nemocnice Tomáše Bati, a. s.
Havlíčkovo nábřeží 600
762 75 Zlín
e-mail: lubomir.vecera@bnzlin.cz
Zdroje
1. Corey, H. E. Stewart and beyond: New models of acid-base ba-lance. Kidney International, 2003, 64, p. 777–787.
2. Stewart, P. A. Modern quantitative acid-base chemistry. Canad. J. Physiol. Pharmacol., 1983, 61, p. 1444–1461.
3. Fencl, V. et al. Diagnosis of acid-base disturbances in critically ill patients. Am. J. Crit. Care, 2000, 162, p. 2246–2251.
4. Badr, A., Nightingale, P. An alternative approach to acid-base abnormalities in critically ill patients. Contin. Educ. Anaesth. Crit. Care. Pain., 2007, 7, 4, p. 107-111.
5. Story, D. A. et al. Hyperchloremic acidosis in the critically ill: One of the strong-ion acidoses? Anesth. Analg., 2006, 103, p. 144-148.
6. Schück, O. et al. Vztah mezi pH a diferencí silných iontů (SID) ve vnitřním prostředí. Klin. Biochem. Metab., 2005, 1, s. 32–35.
7. Nicholson, J. P. et al. The role of albumin in critical illness. Br. J. Anaesth., 2000, 85, p. 599-610.
8. Kazda, A. Vnitřní prostředí II – acidobazická rovnováha, kyslíkové parametry, laktát. In Kazda, A. et al. Kritické stavy. Metabolická a laboratorní problematika. Praha: Galén, 2012, s. 46.
9. Boniatti, M. M. et al. Acid-base disorders evaluation in critically ill patients: we can improve our diagnostic ability. Intensive Care Med., 2009, 35, 8, p. 1377-1382.
10. Kaplan, L. J. et al. Comparison of acid-base models for prediction of hospital mortality after trauma. Shock, 2008, 29, 6, p. 662-666.
11. Zehtabchi, S. et al. Utility of Stewart’s strong ion difference as a predictor of major injury after trauma in the ED. Am. J. Emerg. Med., 2007, 25, 8, p. 938-941.
12. Cusack, R. J. et al. The strong ion gap does not have prognostic value in critically ill patients in a mixed medical/surgical adult ICU. Intensive Care Med., 2002, 28, 7, s. 864-869.
13. Dubin, A. et al. Comparison of three different methods of evaluation of metabolic acid-base disorders. Crit. Care. Med., 2007, 35, 5, s. 1264-1270.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Acidobazická rovnováhaČlánek XX. kongres ČSARIM Brno 2013Článek Právo, etika, náš obor a myČlánek Oceněné práce 2013Článek Kongresy a konference
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2014 Číslo 2- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Aceklofenak v léčbě muskuloskeletálních onemocnění – srovnání s dalšími NSAIDs z hlediska účinnosti a bezpečnosti
- Metamizol a jeho pozice v léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Neodolpasse v léčbě pooperační bolesti
-
Všechny články tohoto čísla
- Statické a dynamické testy v řízení volumoterapie
- Ultrazvukové vyšetření aorty v urgentní medicíně
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Acidobazická rovnováha
- Mozková (mikro)cirkulace – základní struktura a funkce
- iNO a ARDS: Vyšetřování skončilo, zapomeňme!
-
The Canadian Critical Care Nutrition Guidelines in 2013
An Update on Current Recommendationsand Implementation Strategies - Doporučený postup před odběrem orgánů od zemřelých dárcůpo nevratné zástavě oběhu
- Pojem standardu péče v kontextu reformních změn
-
XX. kongres ČSARIM
Brno 2013 - MUDr. Peter Gašparec (14. 12. 1951 – 29. 11. 2013)
- Zemřel emeritní primář MUDr. Jiří Brabec (31. 8. 1925 – 19. 2. 2014)
- European Association of Cardiothoracic Anaesthesiologists v roce 2014
- Oceněné práce 2013
- Jubilejní XX. kongres České společnosti anesteziologie, resuscitace a intenzivní medicíny
- Kongresy a konference
- Stanovisko výboru ČSARIM k návrhu rozsahu požadovaných kompetencí v ultrazvukových metodách pro lékaře oboru Anesteziologiea intenzivní medicína
- Zamyšlení nad XX. kongresem ČSARIM v Brně
- Extrakorporální membránová oxygenace a respirační selhání
- Právo, etika, náš obor a my
- Fast-track není jen fyziologická anestezie
- Hodnoty diference silných iontů (SID) u kriticky nemocných pacientů s normálními hodnotami arteriálního pH, pCO2, BE a HCO3-a jejich vliv na mortalitu
- Metody mimotělní oxygenacea eliminace CO2 určené primárně k náhradě plicních funkcí
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Acidobazická rovnováha
- Statické a dynamické testy v řízení volumoterapie
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Extrakorporální membránová oxygenace a respirační selhání
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



