-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCurrent Practice in Obstetric Anaesthesia.
Part III. Regional anaesthesia for caesarean section
Current Practice in Obstetric Anaesthesia.
Part III. Regional anaesthesia for caesarean sectionNearly a quarter of all births in the Czech Republic end by caesarean section in the recent years. With the increasing age of mothers, number of comorbidities, deliveries after previous caesarean section and many other causes, it can be assumed that this trend will continue to rise despite all the efforts to change it. This negative trend is also influenced by the decreasing willingness of obstetricians to “risk“ spontaneous labour in borderline obstetric situations. The growing number of caesarean sections increases the importance and influence of anaesthesia. As well as elsewhere in the world, we register the rise of regional anaesthesia in comparison to general anaesthesia in the past 20 years, so at present regional anaesthesia in caesarean delivery prevails. A review of the actual numbers however shows the alarming gap between the Czech Republic and the rest of the world. In 2011 regional anaesthesia for caesarean section was administered in 53% of cases and general anaesthesia in 47% in the Czech Republic. For comparison, general anaesthesia for caesarean section does not exceed 10–15% in most of the developed world. The causes include the conservatism of Czech obstetrics and the reluctance of obstetricians in many departments to regional anaesthesia techniques, but perhaps also the lack of availability of “local“ experiences published in the Czech medical journals. Therefore ESPAA in this article aims to summarize the current experience and recommendations for caesarean section under regional anesthesia to support the sites where some concerns to regional techniques still remain.
Keywords:
caesarean section – general anaesthesia – regional anaesthesia – choice of anaesthesia
Autoři: Bláha Jan 1,2; Nosková Pavlína 1,2; Klozová Radka 1,3; Seidlová Dagmar 1,4; Štourač Petr 1,5; Pařízek Antonín 6
Působiště autorů: Expertní skupina pro porodnickou anestezii a analgezii ČSARIM 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK v Prazea Všeobecná fakultní nemocnice v Praze 2; Klinika anesteziologie a resuscitace, 2. LF UK v Praze a Fakultní nemocnice v Motole 3; II. anesteziologicko-resuscitační oddělení Fakultní nemocnice Brno 4; Klinika anesteziologie, resuscitace a intenzivní medicíny, LF MU a Fakultní nemocnice Brno 5; Gynekologicko-porodnická klinika, 1. LF UK v Praze a Všeobecná fakultní nemocnice v Praze 6
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 1, s. 29-39
Kategorie: Postgraduální vzdělávání - Expertní skupina pro porodnickou anestezii a analgezii
Souhrn
Císařským řezem dnes u nás končí skoro čtvrtina všech porodů a dá se předpokládat, že tento trend bude i přes veškerou snahu nadále stoupat. Díky zvyšujícímu se věku matek, jejich vyšší komorbiditě, zvyšujícímu se počtu stavů po předchozím císařském řezu a z mnoha dalších příčin. Svůj podíl nepochybně má i snižující se ochota porodníků “riskovat” v hraničních porodnických situacích vedení spontánního porodu. Stoupající počet císařských řezů zvyšuje i význam a vliv podané anestezie. Stejně tak jako jinde ve světě, i u nás evidujeme za posledních 20 let stálý vzestup regionální anestezie vůči anestezii celkové, takže v současné době již regionální anestezie převažuje. Podíváme-li se ale na konkrétní aktuální čísla, ukáže se alarmující propast mezi Českem a ostatním světem. V roce 2011 byla v České republice u císařského řezu podána regionální anestezie v 53 % případů a celková anestezie v 47 %. Pro srovnání, ve většině medicínsky vyspělého světa zastoupení celkové anestezie u císařského řezu nepřesahuje 10–15 %. Příčiny je nutno hledat především v rigiditě a konzervativnosti českého porodnictví, v obtížně pochopitelné nechuti porodníků na řadě pracovišť k regionálním anesteziologickým technikám. Ale možná i v nedostatečné dostupnosti „lokálních“ zkušeností publikovaných v českých odborných časopisech. ESPAA se proto v tomto článku snaží shrnout své současné zkušenosti a doporučení pro císařský řez v regionální anestezii a podpořit tím ta pracoviště, kde k regionálním technikám stále přetrvávají jisté obavy.
Klíčová slova:
císařský řez – celková anestezie – regionální anestezie – volba anestezieÚVOD
Neuroaxiální anestezie je celosvětově převažující metodou znecitlivění u císařského řezu (Sectio Caesarea; SC), výrazně vedoucí technikou je pak spinální anestezie (subarachnoidální; SAB) před epidurální (EDA) a kombinovanou spinální-epidurální (CSE) [1]. Tento trend je patrný i u nás, přičemž v roce 2010 byl v ČR poměr neuroaxiální a celkové anestezie u císařského řezu při retrospektivní analýze 60 : 40 [2]. O to překvapivější pak byly výsledky prospektivního sledování OBAAMA-CZ 2011. Z celkem 4 787 porodů jich 1 166 (24 %) bylo ukončeno císařským řezem. Většina z nich (57 %) v akutní indikaci, ale významná část (43 %) i elektivně – přičemž poměr mezi regionální a celkovou anestezií byl v podstatě vyrovnán (53 : 47) [3–5]. Jestliže poměr spontánních porodů vs. císařských řezů v Česku odpovídá údajům z vyspělých zemí, tak zastoupení jednotlivých typů anestezie u císařského řezu je u nás zcela mimo světový trend a 47% zastoupení celkové anestezie u císařského řezu v Česku se zcela vymyká jakémukoli srovnání s perinatologicky vyspělými zeměmi. Jen pro srovnání – v USA je celková anestezie u císařského řezu podávána pouze v 5 % případů, stejně tak v Holandsku, ve Velké Británii v méně než 15 %, v Belgii ve 4 %, v Německu v méně než 10 % a v Izraeli v 15 %. V evropském kontextu se ČR blíží pouze Španělsku a Itálii, kde se zastoupení celkové anestezie u císařského řezu pohybuje okolo 30 %, ale i tak je podíl celkové anestezie u nás neobvykle vysoký [1, 6–11]. Tento údaj je ve vztahu k celosvětovému trendu velmi znepokojivý a nedá se vysvětlit akutností výkonu a (relativním) nedostatkem času k podání regionální anestezie. Pokud se totiž z dat OBAAMA-CZ vezmou pouze elektivní císařské řezy, tedy výkony nezatížené časovou urgencí, byla celková anestezie v ČR podána v naprosto alarmujících 34 % případů. Opět pro srovnání, ve Francii byla celková anestezie ve stejné indikaci podána pouze v 1 % případů [12]. Toto vysoké číslo u nás nelze vysvětlit ani v ČR neobvykle častým odmítnutím regionální anestezie rodičkou (v 15 %) a příčiny je nutno hledat především v rigiditě a konzervativnosti českého porodnictví a obtížně pochopitelné nechuti porodníků k neuroaxiálním technikám na řadě, a překvapivě i některých větších, pracovišť. Možným důvodem by však mohl být i nedostatek „lokálních“ zkušeností publikovaných v posledních letech v českých odborných časopisech, proto si ESPAA toto vytyčila jako svůj nejdůležitější úkol pro nejbližší období [13].
VOLBA TECHNIKY NEUROAXIÁLNÍ ANESTEZIE
Dominující neuroaxiální technikou u císařského řezu je spinální anestezie. Hlavními důvody její výrazné preference je její spolehlivost a především jednoduchost s nízkým výskytem komplikací způsobených vlastní punkcí. Tím je tato metoda vhodná i pro méně zkušené a zručné anesteziology. Nelze ale říci, že se jedná o metodu u císařského řezu obecně lepší. Porovnáme-li v této indikaci anestezii epidurální a spinální, každá má své výhody a nevýhody, ale celkově se jedná o metody v podstatě rovnocenné [14–16]. Výhodou spinální anestezie je nižší potřeba doplňující intravenózní peroperační analgezie i nižší riziko selhání metody jako takové (četnost selhání spinální anestezie je udávána 0,5–4%, epidurální 4–13%) [17–19]. Mezi hlavní přednosti spinální anestezie u císařského řezu patří i rychlý nástupu účinku, jednoznačná identifikace subarachnoidálního prostoru a malé riziko komplikací způsobených toxicitou lokálního anestetika či poranění jehlou. V porodnických podmínkách je i významné nižší riziko vznikupostpunkční cefaley (Post Dural Puncture Heada-che; PDPH) – toto ale platí pouze pro spinální jehly velikosti 26G a tenčí. Výhodami epidurální anestezie jsou naopak: méně výrazný pokles krevního tlaku při pomaleji nastupující blokádě sympatiku, možnost ovlivňování anestezie v průběhu výkonu a jejího prodloužení v případě prodloužení výkonu, a především možnost optimální pooperační analgezie. Na rozdíl od spinální lze tak epidurální anestezii za určitých podmínek aplikovat i u komplikovaných a rizikových výkonů typu placenta previa nebo acreta, které byly dříve výsadou celkové anestezie.
Pro výkon v neuroaxiální anestezii je zcela nezbytná dobrá psychologická příprava rodičky. Musí být řádně informována o průběhu aplikace znecitlivění i celém průběhu operačního výkonu. Nelze spoléhat, že byla již dříve plně informována porodníky, je proto vhodné vysvětlit i porodnické souvislosti. Důležité je upozornění na fáze operace provázené možným určitým diskomfortem, snad i mírnou bolestí. Zejména je nutno ujistit rodičku o tom, že nabízený způsob znecitlivění je sice účinný a spolehlivý, ale že je vždy i možnost anestezii kdykoli rozšířit či doplnit, či konvertovat na anestezii celkovou. Tato příprava by neměla u elektivních výkonů probíhat až na porodním sále, ale s dostatečným předstihem před plánovaným datem, např. v rámci anesteziologické ambulance.
Součástí přípravy rodičky na porodním sále je v případě neuroaxiální anestezie především prevence hypotenze z blokády sympatiku a při syndromu aorto-kavální komprese (viz Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu v Anesteziologii a intenzivní medicíně 2/2013 [13]). Rodička by proto měla být na operačním stole vždy uložena v mírné laterální poloze (15 st.) či s dislokací dělohy mimo střední čáru. Farmakologická premedikace (anxiolýza) plně poučené rodičky není ve většině případů nutná, ale v případě potřeby ji lze eventuálně podat v dávce do 5 mg diazepamu nebo 3 mg midazolamu.
ROZSAH NEUROAXIÁLNÍ ANESTEZIE
Podmínkou neuroaxiální anestezie k císařskému řezu je její dostatečný účinek daný adekvátním rozsahem blokády. Senzorická blokáda by optimálně měla dosahovat úrovně Th5 (Th4). Rozsah a účinnost anestezie je dán několika faktory:
- velikostí dávky (objemu) lokálního anestetika,
- jeho koncentrací a
- místem vpichu.
Účinek anestetik na nervovou blokádu je otázkou jejich difuze nervovým svazkem. Rychlost difuze je určována jednak koncentrací lokálního anestetika, čili velikostí koncentračního gradientu, a jednak tloušťkou jednotlivých nervů, tj. difuzní vzdáleností. Motorická nervová vlákna jsou v nervovém svazku uložená hlouběji než senzorická, proto je v případě epidurální anestezie obtížnější je zcela blokovat. Nepřítomnost úplné motorické blokády (Bromage IV) tak nemusí být – na rozdíl od spinální anestezie – známkou nedostatečné kvality bloku. V tomto kontextu může být u epidurální anestezie dalším problémem blok sakrálních kořenů inervujících peritoneum. Sakrální nervové kořeny jsou silnější než lumbální, proto pro plnou difuzi anestetika celým nervem je nutný delší čas. Spolu s motorickými nervy jsou silnější také vlákna A-beta vedoucí dotek a tlak. Z tohoto důvodu bývá vnímání těchto pocitů často dlouho zachováno a pacientky to mohou pociťovat jako diskomfort. Při neposkytnutí dostatečného času k plnému nástupu blokády se proto v praxi můžeme relativně často setkat se situací, kdy incize kůže a podkoží je pro rodičku nebolestivá, ale tah za dělohu a jejím prostřednictvím za perito-neum je velmi bolestivý. Rychlost nástupu účinku neuroaxiální anestezie (především epidurální) je vedle fyzikálně-farmakologických principů dána i individuálními dispozicemi každé rodičky. Pokud je časový prostor, doporučujeme proto o něco prodloužit dobu do začátku operace oproti standardně uváděným časům nástupu účinku jednotlivých lokálních anestetik. Lze se tak vyhnout zbytečné konverzi epidurální na celkovou anestezii. I tak je však možné, že při manipulaci s dělohou či při práci operatéra v podbráničním prostoru (např. revize nebo toaleta břišní dutiny), může rodička v průběhu císařského řezu pociťovat tupou viscerální bolest a výrazný diskomfort, eventuálně s nauzeou a zvracením. Příčinou může být stimulace bránice (C3–C5; n. phrenicus) a bloudivého nervu [20]. Vhodné je pak doplnit neuroaxiální blok intravenózními opioidy, eventuálně situaci překlenout i krátkodobou sedací propofolem.
K testování rozsahu bloku se používá řada technik (lehký nebo ostrý dotek, pocit chladu apod.), přičemž každá z metod může ukazovat na jiný rozsah blokády. Rozdíl v předpokládaném rozsahu blokády se přitom může lišit i o několik segmentů. Nelze ale říci, že by některá z metod byla přesnější než jiná [21, 22]. Je však vhodné zvolit si jeden způsob testování a nekombinovat jej s jinými. Podle naší zkušenosti je výhodnou metodou testovat rozsah blokády na vnímání chladu pomocí dezinfekčního spreje, už proto, že je to technika jednoduchá, rychlá a rodičku nestresující. Ztráta citlivosti na chlad k úrovni Th4 je považována za dostatečný rozsah blokády pro císařský řez [23].
SPINÁLNÍ (SUBARACHNOIDÁLNÍ) ANESTEZIE
Spinální anestezie je spolehlivá a relativně jednoduchá metoda neuroaxiální anestezie, jejíž provedení je technicky jednodušší než epidurální anestezie. Díky rychlému nástupu účinku je ale spojena s vyšším rizikem závažné hypotenze, protože blokáda sympatiku je velmi rychlá a podanou dávku nelze titrovat. O to podstatnější je dostatečná volumoterapie (nejlépe ve formě tzv. co-loadu), prevence aorto-kavální komprese a včasné podání vazopresorů, v našich podmínkách efedrinu (viz Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu [13]).
Spinální anestezie je podávána jako jednorázová aplikace (tzv. „single-shot“). Kontinuální spinální techniky se zavedením subdurálního katétru jsou používány pouze výjimečně, protože intratekálně zavedené mikrokatétry (G27) byly v minulosti spojovány se vznikem syndromu cauda equina a např. americká FDA (Food and Drug Administration) je v roce 1992 zakázala (katétry G24 jsou již povoleny) [24]. Některá pracoviště zavádějí na 12–24 hodin silnější epidurální katétr (G20) intratekálně v případě arteficiální perforace dury při epidurální punkci [25].
O nejvhodnější velikosti a typu hrotu spinální jehly v porodnictví se opakovaně diskutuje. Jestli hrot typu pencil-point vede oproti klasickému Quinckeho k menší traumatizaci dury, a tím k nižšímu výskytu PDPH, nelze jednoznačně říci, protože na toto téma existují protichůdné výsledky i názory. Navíc spinální jehly s pencil-pointem musí být zavedeny hlouběji než jehly s klasickým hrotem, aby boční otvor v jehle dosáhl subarachnoidálního prostoru. S tím je spojeno i vyšší riziko dislokace v průběhu aplikace a poranění, zvláště pokud je vpich veden nad úrovní L2 [26].
Významnější, a zcela zásadní, je ale velikost (průměr) jehly, kdy při používání jehel 27G se výskyt postpunkční cefaley uvádí pod jedno procento. Přesto nelze říci, že čím tenčí jehla, tím nižší výskyt PDPH. Užití velmi tenkých jehel totiž díky velmi pomalému průtoku moku jehlou zhoršuje identifikaci subarachnoidálního prostoru, a vede tak k nerozpoznané punkci dury [27–30]. Místo jednoho vpichu je pak dura perforována opakovaně. V kontextu porodnické anestezie se jako optimální jeví spinální jehly 26–27G, v případě předpokládané obtížné punkce, např. u obézních rodiček, lze výjimečně použít i jehlu 25G.
Spinální punkce musí být provedena pod úrovní L2, lépe pod úrovní L3, aby bylo minimalizováno riziko poranění míchy. Ačkoli mícha typicky končí v dolní úrovni obratle L1 nebo v úrovni meziobratlového prostoru L1–L2, může být její konec variabilní mezi Th12–L3. Při vpichu v meziobratlovém prostoru L1–L2 by tak mohlo dojít k poranění míchy až u 40 % žen [31]. Meziobratlový prostor L3–L4 poskytuje většinou dobré, a přitom bezpečné podmínky punkce, a je proto doporučován jako preferenční místo vpichu. Primární užití tohoto prostoru přináší ještě podstatnou výhodu v tom, že i při poměrně často chybné identifikaci správného meziobratlového prostoru snižuje riziko poranění míchy při provedení vpichu výše, než bylo zamýšleno. Chyba v určení přesné výšky meziobratlového prostoru je častá (až v 68 %) a může vést k punkci až o 1–3 meziobratlové prostory výše, než se anesteziolog domnívá [32, 33]. Standardní metoda výškové orientace pomocí spojnice obou horních hran kostí kyčelních (typicky protíná trnový výběžek v úrovni L4; Tuffierova linie) je u těhotných nebo obézních žen velmi nepřesná. U rodiček je běžně pánev širší než ramena, v pozici na boku tak dochází ke sklonu osy páteře. Spojnice obou iliakálních krist pak není kolmá, ale šikmá (obr. 1). Dochází tak k časté chybě v identifikaci úrovně L4 [34]. Bohužel i ostatní metody – odpočítání dolů od výběžku C7 nebo podle posledního žebra (Th12) – jsou nepraktické a rovněž nepřesné [35].
Obr. 1. Projekce spojnice obou iliakálních krist u ležící těhotné ženy 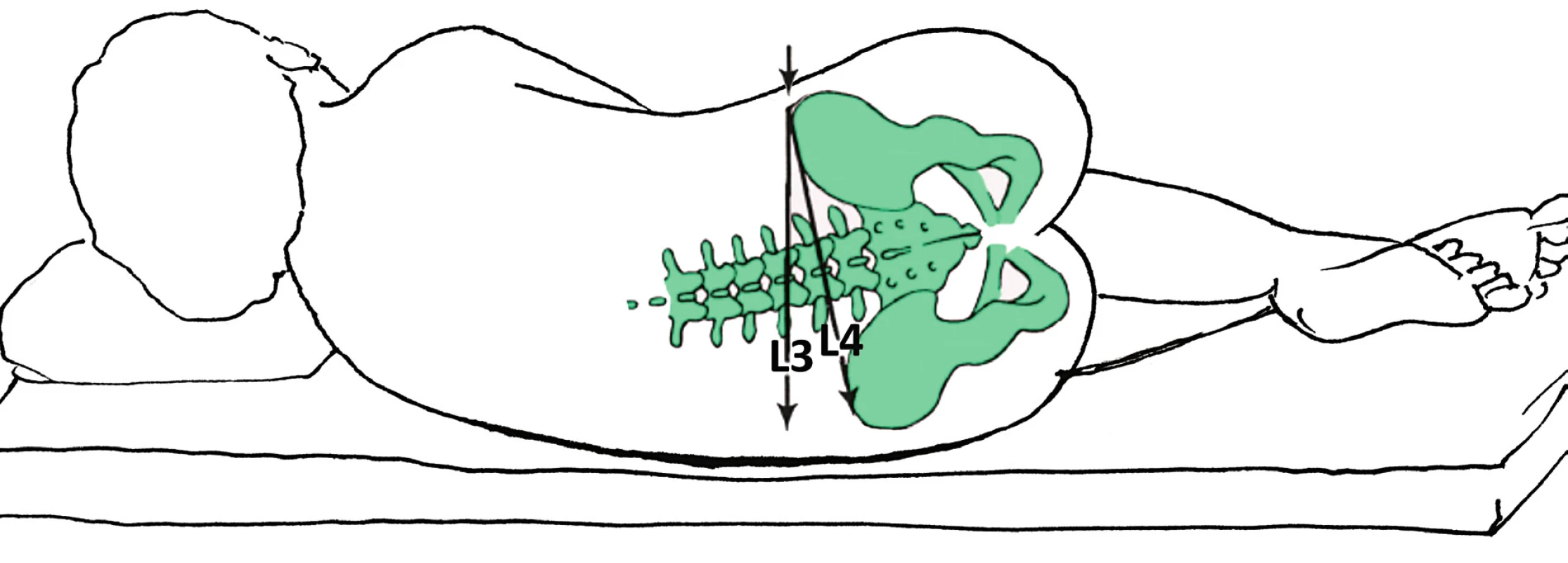
Volba lokálního anestetika pro spinální ane-stezii je méně významná než v případě epidurální anestezie. V současnosti u nás dostupná lokální anestetika určená pro intratekální podání, tj. především 0,5% bupivakain a 0,5% levobupivakain, se neliší významně ani v rychlosti nástupu účinku, ani délce jeho trvání. Ropivacain není v současné době v ČR již k dispozici, navíc ve srovnání s bupivakainem vykazoval při intratekální aplikaci slabší efekt i pomalejší nástup účinku [36], užití 2% lidocainu je vzhledem k jeho krátké době účinku u císařského řezu nevhodné. Těhotné ženy potřebují při intratekálním podání menší dávky lokálních anestetik. Důvodem je menší objem mozkomíšního moku v těhotenství a vyšší citlivost nervových vláken na lokální ane-stetika [37, 38]. Standardně se tak u císařského řezu podává dávka 10–15 mg (2–3 ml). Některými autory doporučovaná redukce dávky (pro snížení nežádoucích účinků, především hypotenze) pod 10 mg je již zatížena zvýšeným rizikem nedostatečné peroperační analgezie či dokonce selhání blokády.
Ne zcela zřejmou je otázka výhodnosti užití hyperbarických roztoků proti izobarickým. Dostupná data se liší ve výskytu hypotenze, nauzeyi efektivnosti blokády [39–41]. Nevýhodou hyperbarické techniky je, že nelze rodičku při případné hypovolémii uložit do Trendelenburgovy polohy. Riskovali bychom tím nežádoucí posun anestezie kraniálně. Výhodou naopak je rychlejší nástup účinku.
Pro prodloužení analgetického (nikoli anestetického) účinku blokády k pooperační analgezii je vhodné spolu s lokálním anestetikem podat i opioid. Nejlepší možností je purifikovaný morfin (CAVE nezaměňovat s HVLP 1% Morphine) v dávce 0,1 mg (vyšší dávka již u rodiček významně zvyšuje nežádoucí účinky, především pruritus [42, 43]). Tato dávka dokáže zajistit poměrně dobrou analgezii v následujících 12–24 hod. Po podání intratekálního morfinu (či jiného opioidu) je nezbytné pacientky dostatečně sledovat a monitorovat pro možnost rostrálního posunu a riziko pozdního dechového útlumu. Vzhledem k tomu, že ostatní opioidy (fentanyl, sufentanil), nejsou v ČR registrovány k intratekální aplikaci [44], nelze jejich podání u císařského řezu oficiálně doporučit, přestože ve světě i u nás se jedná o běžnou aplikaci. Účinek intratekálně podaného fentanylu i sufentanilu je obdobný jako v případě morfinu, pouze významně kratší [45–47]. Jako adjuvans prodlužující účinek a zlepšující kvalitu blokády lze přidat k lokálnímu anestetiku 0,1 mg adrenalinu [48].
Tab. 1. Indikace a kontraindikace neuroaxiální anestezie u císařského řezu 
EDA – epidurální anestezie ICP (intracranial pressure) – nitrolební tlak RA – regionální anestezie LMWH (low-molecular-weight heparin) – nízkomolekulární hepariny Tab. 2. Výhody a nevýhody jednotlivých neuroaxiálních technik u císařského řezu 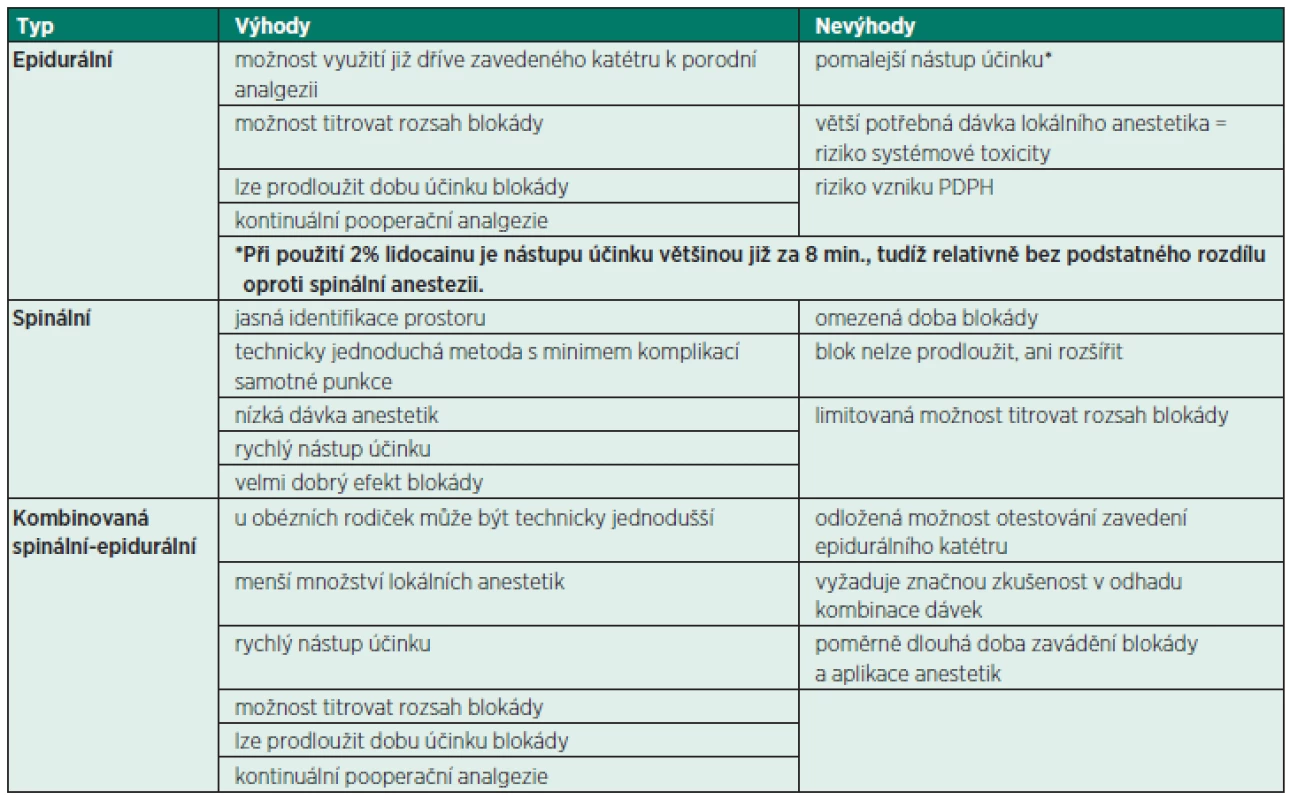
EPIDURÁLNÍ ANESTEZIE
Přestože je spinální anestezie celosvětově u císařského řezu převažující technikou neuroaxiální anestezie, má i epidurální anestezie své výhody: při pomalejším nástupu blokády dochází k méně významnému rozvoji hypotenze, nezastupitelnou výhodou je možnost pooperační regionální analgezie, a v případě akutní SC její význam stoupá díky zvyšujícímu se počtu rodiček s již zavedeným epidurálním katétrem pro porodní analgezii. V neposlední řadě je výhodou EDA se zavedeným epidurálním katétrem v případě potřeby možnost prodloužení doby anestezie.
Na rozdíl od spinální anestezie však může u epidurální anestezie dojít k intoxikaci lokálním anestetikem. Prakticky vždy je příčinou nepoznaná intravazální aplikace, nejčastěji do venózního vertebrálního plexu. Negativní aspirace před aplikací s jistotou nevyloučí intravazální aplikaci, a ani užití úvodní testovací dávky s příměsí adrenalinu, který má vyvolat tachykardii při intravenózním podání, není všeobecně přijato pro nízkou specificitu testu. Každou aplikovanou dávku je proto vhodné podávat frakcionovaně a považovat ji za „testovací“. Z běžně užívaných lokálních anestetik má nejvyšší kardiotoxicitu bupivacain, stupeň nežádoucího účinku záleží na intravazálně podaném množství. Projevy systémové toxicity zahrnují symptomatologii CNS a kardiovaskulárního systému; centrální projevy toxicity obvykle předcházejí projevům kardiovaskulárním. Současným doporučovaným postupem v případě známek kardiotoxicity nereagující na standardní terapii, je tzv. Lipid Rescue Therapy, kdy je jako nespecifické antidotum lipofilních látek podána infuze emulze lipidů (bolus Intralipidu 20% 1,5 ml/kgběhem jedné minuty a následně kontinuálně 0,25 ml/kg/min) [49–51]. Podrobně se tímto problémem zabývá Doporučení ČSARIM pro léčbu toxické reakce po podání lokálních anestetik [52] a více se tomu bude věnovat, spolu s ostatními anesteziologickými komplikacemi v porodnictví, i jeden z následujících článků série Současné postupy v porodnické anestezii.
Volba lokálního anestetika pro epidurální ane-stezii u císařského řezu je na rozdíl od spinálníanestezie důležitá. Nikoli co se týče kvality blokády, ale rychlosti nástupu jejího účinku. V ČR je stále nejpoužívanějším lokálním anestetikem u císařského řezu 0,5% bupivakain. Jak ale vyplynulo z projektu OBAAMA-CZ 2011, je bupivakain u nás nejčastěji používaným lokálním anestetikem i u akutních císařských řezů. Přitom se pro tuto indikaci rozhodně nejedná o optimální anestetikum. Doba nástupu účinku bupivakainu (i levobupivakainu) je ve srovnání s 2% lidokainem relativně dlouhá. V situaci urgence císařského řezu tak hrozí riziko nedostatečného času k proniknutí anestetika do silnějších sakrálních kořenů a vznik významného diskomfortu rodičky při manipulaci s peritoneem. Platí to především pro přidání do již zavedeného epidurálního katétru (tzv. top-up anestezii). V případě akutního řezu v epidurální anestezii se tak lokálním anestetikem volby jeví 2% lidokain, který má ve srovnání s bupivakainem i levobupivakainem (registrace ropivakainu byla v ČR ukončena) kratší nástup účinku a současně i nižší četnost nutné perioperační suplementační dávky analgetik [53, 54]. Podmínkou použití 2% lidokainu (i proto že podle SPC je maximální dávka 2% lidocainu 10 ml = 200 mg, byť myšlena pro intravenózní aplikaci, což by nezajistilo dostatečný rozsah blokády), je přidání adrenalinu do podávané směsi, a to v poměru1 : 200 000. V praxi to znamená, že např. k 20 ml směsi 2% lidocainu a 10 µg sufentanilu se přidá 0,1 ml adrenalinu (standardně se vyrábí v koncentraci 1 mg/ml = 1 : 1000). Nástup účinku je poměrně rychlý (8–10 min) a trvání účinku pro potřeby standardního císařského řezu je dostatečné(75–100 min.). Navíc v kontextu s rizikem nepoznaného intravazálního zavedení epidurálního katétru nehrozí v případě lidokainu tak těžká toxická reakce jako u bupivakainu.
Adrenalin jako smíšený α1,2-agonista sympatických receptorů je přidáván do lokálního ane-stetika jako vazokonstriktor ke snížení systémová absorpce z epidurálního prostoru (α1 účinek), vedle toho má ale i vlastní, nezávislý hypoalgetický účinek zprostředkovaný vazbou na α2-adrenergní receptory. V těhotenství bohaté venózní pleteně v epidurálním prostoru progresivně mohutní, a zvětšuje se tak systémová absorpce lokálního anestetika z epidurálního prostoru. Lokální vazokonstrikce zpomaluje vstřebávání do oběhu, čímž prodlužuje a potencuje účinek, ale i snižuje toxicitu lokálního anestetika [55, 56]. Optimální koncentrace adrenalinu v epidurální směsi je 1 : 200 000. V tomto množství neovlivňuje epidurálně podaný adrenalin uteroplacentární perfuzi [57, 58]. Přidání adrenalinu do lokálního ane-stetika by mělo proběhnout bezprostředně před podáním směsi do epidurálního prostoru, protože ve směsi podléhá adrenalin biodegradaci vlivem pH a světla [59]. Dobu nástupu účinku lokálních anestetik lze zkrátit i přidáním bikarbonátu sodného. Dojde tak k alkalizaci lokálního anestetika, čímž se zvyšuje podíl jeho neionizované, v tucích rozpustné formy. Výsledkem je zkrácení doby nástupu účinku a potenciace kvality epidurální blokády [60]. Bikarbonát (8,4%, bez konzervačních látek) se přidává v množství 2 ml k 20 ml lokálního anestetika, takže jeho výsledná koncentrace ve směsi je 0,75 %.
Nejčastějšími adjuvans v epidurální směsi jsou ale opiody. Efekt epidurálně podaných opioidů do značné míry závisí na jejich liposolubilitě. Zatímco hydrofilní morfin proniká relativně dobře do likvoru k cílovým míšním receptorům a má převažující míšní efekt, tak lipofilní opioidy (fentanyl, sufentanil) pronikají do likvoru minimálně. Naopak jsou resorbovány a jejich efekt je především systémový, nikoli míšní [61–63]. Jejich výsledná plazmatická koncentrace je tak nakonec sice stejná jako při i. m. či i. v. podání, ale s významně pozvolnějším farmakokinetickým profilem, takže nedochází k významnému přestupu do oběhu plodu a ovlivnění jeho poporodní adaptace [64–66]. Epidurálně podávaný morfin se u nás standardně nepoužívá. Oproti fentanylu a sufentanilu má výrazně delší (> 12 hod.) efekt, jako optimální dávka z hlediska účinku jsou uváděny 3–4 mg. Vyšší dávky již nezlepšují analgezii, ale naopak zvyšují výskyt nežádoucích účinků, především svědění [67, 68]. Možnost pozdního dechového útlumu je při uvedeném dávkování spíše teoretická, ale možná. DepoDur, morfin v lipidových částicích s prodlouženým uvolňováním, jehož účinek v dávce 10 mg epidurálně zajišťuje analgetický účinek na více než 48 hodin bez zvýšeného výskytu nežádoucích účinků [69, 70], není u nás zatím k dispozici. Stejně jako při intravenózním podání je antidotem epidurálně podaných opioi-dů naloxon. Je ale nutno vždy vzít v úvahu, že účinek naloxonu trvá přibližně 90 minut [71]. To znamená, že případný útlum dechového centra opioidy může přetrvat dobu jejich antagonizace naloxonem. Je proto nutno podat další dávky naloxonu, či jej podávat kontinuálně. Naloxon je indikován i v případě ostatních nežádoucích účinků opioidů, jako je svědění.
V jiných indikacích používaný klonidin není v porodnictví používán. FDA dokonce přímo varuje, že „epidurální podání klonidinu není v porodnictví pro riziko hypotenze a bradykardie doporučováno“ [72]. Klonidin je čistý α2-agonista sympatických receptorů, při epidurálním podání posiluje účinek lokálních anestetik na senzitivní i motorické nervy a působí tím významně analgeticky [73, 74]. Stimulace α2-receptorů (snad i α1-receptorů) má antinociceptivní vliv. Váže se i na neadrenergní místa, a to na imidazolinové nociceptory buněčných membrán periferních nervů. Doporučované dávky se liší a pohybují se v rozmezí 75–200 µg. Novější studie ukazují, že zřetelný analgetický vliv mají již malé dávky 15–30 µg [75]. Nejčastějšími nežádoucími účinky klonidinu jsou hypotenze a sedace.
KOMBINOVANÁ SUBARACHNOIDÁLNÍ-EPIDURÁLNÍ ANESTEZIE
Kombinovaná spinální-epidurální anestezie (CSE) se snaží využít to nejlepší z obou metod: rychlý a kvalitní nástup účinku spinální anestezie s možností jeho prodloužení a s možností pooperační analgezie díky zavedenému epidurálnímu katétru. Přestože se jedná o metodu již klasickou (poprvé ji u císařského řezu použil Brownridge v roce 1981 [76]), není její použití v našich podmínkách příliš rozšířeno. Důvodů může být více, tím hlavním je nejspíše vysoká cena setu pro CSE ve srovnání se setem pro epidurální anestezii či jehlou pro spinální techniku. Navíc ani časová výhoda není jednoznačná. Technicky je CSE výrazně náročnější než EDA i SAB (technikou „jehla skrz jehlu“, kdy je nejdříve zavedena jehla do epidurálního prostoru a skrz ni je zavedena spinální jehla do subarachnoidálního prostoru, trvá provedení celé blokády déle), takže EDA s 2% lidokainem nabízí srovnatelný čas nástupu účinku s CSE. Výhodou je naopak nižší riziko selhání blokády, kdy se obě metody ve svém efektu doplňují. Navíc epidurální jehla musí být zavedena vždy velmi pečlivě v ose páteře, protože při jejím šikmém zavedení by procházející subarachnoidální jehla subarachnoidální prostor minula. Ve výsledku to sice zkvalitňuje blokádu, ale i prodlužuje dobu její aplikace.
Kombinace spinálně a epidurálně podaných lokálních anestetik může být buď tzv. klasická (celá dávka spinálně + redukovaná dávka epidurálně) [77], nebo sekvenční (redukovaná dávka spinálně-částečná fixace lokálního anestetika-redukovaná dávka epidurálně) [78]. Výhodou sekvenční aplikace je nižší výskyt hypotenze, proto tato technika může být metodou volby u vysoce rizikových rodiček (např. se srdečním onemocněním), u kterých by případná výraznější hypotenze mohla mít kritické následky.
Pro použití k CSE jsou vhodná stejná ane-stetika a adjuvancia jako k subarachnoidální, respektive epidurální anestezii. Stejně tak všechny komplikace, které se mohou u obou technik vyskytnout, se mohou vyskytnout i u CSE. Byl popsán výskyt závažnější a protrahovanější hypotenze u CSE v případě aplikace blokády vsedě. Hypotenze může být způsobena zpožděným položením pacientky díky většímu časovému odstupu mezi subarachnoidální aplikací lokálních anestetik a zavedením epidurálního katétru [79]. Dalším vysvětlením může být fakt, že při CSE technice vystoupá subarachnoidálně podané lokální anestetikum výše, než při aplikaci stejné dávky při klasické subarachnoidální anestezii [77].
ZÁVĚR
Ve srovnání s celosvětovým trendem je v ČR využití neuroaxiální anestezie u císařského řezu poměrně nevýrazné. Přitom se situace v posledních letech významně mění. Stoupá nejen věk rodiček a počet vícečetných těhotenství, ale častěji se setkáváme i s tím spojeným větším množstvím přidružených onemocnění. Není dnes již výjimkou rodička s těžkým systémovým onemocněním či po orgánové transplantaci. Odráží to i celosvětově stoupající počet porodů císařským řezem. Porodní péče již není otázkou dostupnosti potřebného vybavení, ale otázkou zajištění bezpečného porodu právě pro komplikovaná těhotenství. A z tohoto hlediska regionální anestezie u císařského řezu nepochybně nabízí výhodnější podmínky nežanestezie celková. Podmínkou je multidisciplinární přístup se vzájemnou důvěrou celého porodnického týmu. Je nasnadě, že viditelně lepších výsledků dosahují ty porodnice, kde se o rodičky starají kombinované, navzájem spolupracující týmy složené ze zkušených porodníků, anesteziologů, neonatologů a porodních asistentek.
Poděkování: Autoři děkují Ing. Svatoplukovi Bláhovi, CSc., za ilustraci použitou v tomto článku.
Poznámka redakce: Přehledový článek reprezentuje stanovisko ESPAA k uvedené problematice a neprošel standardním recenzním řízením.
Adresa pro korespondenci:
MUDr. Jan Bláha, Ph.D.
KARIM 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jan.blaha@lf1.cuni.cz
Zdroje
1. Bucklin, B. A., Hawkins, J. L., Anderson, J. R., Ullrich, F. A. Obstetric anesthesia workforce survey: twenty-year update. Anesthesiology, 2005, 103, 3, p. 645–653.
2. Pařízek, A., Bláha, J., Dolenská, S., Nosková, P. Aktuální vývoj porodnické analgezie v ČR. In XVII národní kongres ČSARIM: 10.9.2010; Zlín 2010.
3. Štourač, P. Obstetric Anaesthesia and Analgesia Month Attributes – reálná zpráva o anesteziologické praxi na českých porodních odděleních. Anest. intenziv. Med., 2013, 24, 2, p. 81–82.
4. Pařízek, A., Bláha, J., Nosková, P. Porodnická analgezie a anest-ezie v České republice v roce 2012. 20. výročí programu postgraduálního vzdělávání. Česká gynekologie, 2012, 77, 4, p. 246–249.
5. Nosková, P., Bláha, J., Klozová, R., Seidlová, D., Štourač, P., Zelinková, H. Mýty a realita porodní analgezie ČR: OBAAMA-CZ projekt 2012. Bolest, 2012, 15, Suppl. 1, p. 18.
6. Marcus, H. E., Behrend, A., Schier, R., Dagtekin, O., Teschen-dorf, P., Bottiger, B. W., Spohr, F. Anesthesiological management of Caesarean sections : nationwide survey in Germany. Der Anaesthesist, 2011, 60, 10, p. 916–928.
7. Betran, A. P., Merialdi, M., Lauer, J. A., Bing-Shun, W., Tho-mas, J., Van Look, P., Wagner, M. Rates of caesarean section: analysis of global, regional and national estimates. Paediatric and perinatal epidemiology, 2007, 21, 2, p. 98–113.
8. Wilkins, K. K., Greenfield, M. L., Polley, L. S., Mhyre, J. M. A survey of obstetric perianesthesia care unit standards. Anesthesia and Analgesia, 2009, 108, 6, p. 1869–1875.
9. Tsai, P. S., Hsu, C. S., Fan, Y. C., Huang, C. J. General anaesthesia is associated with increased risk of surgical site infection after Caesarean delivery compared with neuraxial anaesthesia: a population-based study. British Journal of Anaesthesia, 2011, 107, 5, p. 757–761.
10. Van Houwe, P., Heytens, L., Vercruysse, P. A survey of obstetric an anesthesia practice in Flanders. Acta anaesthesiologica Belgica, 2006, 57, 1, 29–37.
11. Weiniger, C. F., Ivri, S., Ioscovich, A., Grimberg, L., Evron, S., Ginosar, Y. Obstetric anesthesia units in Israel: a national questionnaire-based survey. International Journal of Obstetric Anesthesia, 2010, 19, 4, p. 410–416.
12. Benhamou, D., Bouaziz, H., Chassard, D., Ducloy, J. C., Fu-zier, V., Laffon, M., Mercier, F., Raucoules, M., Samii, K. Anaesthetic practices for scheduled caesarean delivery: a 2005 French national survey. European Journal of Anaesthesiology, 2009, 26, 8, p. 694–700.
13. Bláha, J., Nosková, P., Klozová, R., Seidlová, D., Štourač, P., Pařízek, A. Současné postupy v porodnické anestezii I. – peroperační péče u císařského řezu. Anest. intenziv. Med., 2013, 24, 2, p. 91–101.
14. Schewe, J. C., Komusin, A., Zinserling, J., Nadstawek, J., Hoeft, A., Hering, R. Effects of spinal anaesthesia versus epidural anaesthesia for caesarean section on postoperative analgesic consumption and postoperative pain. European Journal of Anaesthesiology, 2009, 26, 1, p. 52–59.
15. Chiu, C. L., Mansor, M., Ng, K. P., Chan, Y. K. Retrospective review of spinal versus epidural anaesthesia for caesarean section in preeclamptic patients. International Journal of Obstetric Anesthesia, 2003, 12, 1, p. 23–27.
16. Ng, K., Parsons, J., Cyna, A. M., Middleton, P. Spinal versus epidural anaesthesia for caesarean section. Cochrane Database Syst. Rev., 2004, 2, p. CD003765.
17. Garry, M., Davies, S. Failure of regional blockade for caesarean section. Int. J. Obstet. Anesth., 2002, 11, 1, p. 9–12.
18. Pan, P. H., Bogard, T. D., Owen, M. D. Incidence and characteristics of failures in obstetric neuraxial analgesia and anesthesia: a retrospective analysis of 19,259 deliveries. Int. J. Obstet. Anesth., 2004, 13, 4, P. 227–233.
19. Fettes, P. D., Jansson, J. R., Wildsmith, J. A. Failed spinal anaesthesia: mechanisms, management, and prevention. British Journal of Anaesthesia, 2009, 102, 6, P. 739–748.
20. Burns, S. M., Cowan, C. M. Spinal anaesthesia for caesarean section: current clinical practice. Hosp. Med., 2000, 61, 12, p. 855–858.
21. Russell, I. F. A comparison of cold, pinprick and touch for assessing the level of spinal block at caesarean section. Int. J. Obstet. Anesth., 2004, 13, 3, p. 146–152.
22. Russell, I. F. Levels of anaesthesia and intraoperative pain at caesarean section under regional block. Int. J. Obstet. Anesth., 1995, 4, 2, p. 71–77.
23. Bourne, T. M., deMelo, A. E., Bastianpillai, B. A., May, A. E.A survey of how British obstetric anaesthetists test regional anaesthesia before caesarean section. Anaesthesia, 1997, 52, 9, p. 901–903.
24. Rollins, M., Lucero, J. Overview of anesthetic considerations for Cesarean delivery. British medical bulletin, 2012, 101, p. 105–125.
25. Ayad, S., Demian, Y., Narouze, S. N., Tetzlaff, J. E. Subarachnoid catheter placement after wet tap for analgesia in labor: influence on the risk of headache in obstetric patients. Regional anesthesia and pain medicine, 2003, 28, 6, p. 512–515.
26. Chestnut, D. H. Obstetric Anesthesia: Principles and Practice. 4 edn. Philadelphia: Mosby, Elsevier Inc., 2009.
27. Tsen, L. C., Hepner, D. L. Needles used for spinal anesthesia. Expert Rev. Med. Devices, 2006, 3, 4, p. 499–508.
28. Lambert, D. H., Hurley, R. J., Hertwig, L., Datta, S. Role of needle gauge and tip configuration in the production of lumbar puncture headache. Reg. Anesth., 1997, 22, 1, p. 66–72.
29. Ghaleb, A. Postdural puncture headache. Anesthesiol. Res. Pract., 2010.
30. Reina, M. A., de Leon-Casasola, O. A., Lopez, A., De Andres, J.,Martin, S., Mora, M. An in vitro study of dural lesions produced by 25-gauge Quincke and Whitacre needles evaluated by scanning electron microscopy. Reg. Anesth. Pain Med., 2000, 25, 4, p. 393–402.
31. Saifuddin, A., Burnett, S. J., White, J. The variation of position of the conus medullaris in an adult population. A magnetic resonance imaging study. Spine (Phila Pa 1976), 1998, 23, 13, p. 1452–1456.
32. Broadbent, C. R., Maxwell, W. B., Ferrie, R., Wilson, D. J., Gawne-Cain, M., Russell, R. Ability of anaesthetists to identify a marked lumbar interspace. Anaesthesia, 2000, 55, 11, p. 1122–1126.
33. Van Gessel, E. F., Forster, A., Gamulin, Z. Continuous spinal anesthesia: where do spinal catheters go? Anesth. Analg., 1993, 76, 5, p. 1004–1007.
34. Render, C. A. The reproducibility of the iliac crest as a marker of lumbar spine level. Anaesthesia, 1996, 51, 11, p. 1070–1071.
35. Reynolds, F. Logic in the safe practice of spinal anaesthesia. Anaesthesia, 2000, 55, 11, p. 1045–1046.
36. Gautier, P., De Kock, M., Huberty, L., Demir, T., Izydor-czic, M., Vanderick, B. Comparison of the effects of intrathecal ropivacaine, levobupivacaine, and bupivacaine for Caesarean section. Br. J. Anaesth., 2003, 91, 5, p. 684–689.
37. Kestin, I. G. Spinal anaesthesia in obstetrics. Br. J. Anaesth., 1991, 66, 5, p. 596–607.
38. Greene, N. M. Distribution of local anesthetic solutions within the subarachnoid space. Anesth. Analg., 1985, 64, 7, p. 715–730.
39. Carvalho, B., Durbin, M., Drover, D. R., Cohen, S. E., Ginosar, Y., Riley, E. T. The ED50 and ED95 of intrathecal isobaric bupivacaine with opioids for cesarean delivery. Anesthesiology, 2005, 103, 3, p. 606–612.
40. Bryson, G. L., Macneil, R., Jeyaraj, L. M., Rosaeg, O. P. Small dose spinal bupivacaine for Cesarean delivery does not reduce hypotension but accelerates motor recovery. Can. J. Anaesth., 2007, 54, 7, p. 531–537.
41. Ben-David, B., Miller, G., Gavriel, R., Gurevitch, A. Low-dose bupivacaine-fentanyl spinal anesthesia for cesarean delivery. Reg. Anesth. Pain Med., 2000, 25, 3, p. 235–239.
42. Swart, M., Sewell, J., Thomas, D. Intrathecal morphine for caesarean section: an assessment of pain relief, satisfaction and side-effects. Anaesthesia, 1997, 52, 4, p. 373–377.
43. Duale, C., Frey, C., Bolandard, F., Barriere, A., Schoeffler, P. Epidural versus intrathecal morphine for postoperative analgesia after Caesarean section. Br. J. Anaesth., 2003, 91, 5, p. 690–694.
44. Neuroaxiální blokády u císařského řezu a vaginálního porodu. Farmakoterapeutické informace, 2007, 10, p. 1–4.
45. Carvalho, B., Drover, D. R., Ginosar, Y., Cohen, S. E.,Riley, E. T. Intrathecal fentanyl added to bupivacaine and morphine for cesarean delivery may induce a subtle acute opioid tolerance. International journal of obstetric anesthesia, 2012, 21, 1, p. 29–34.
46. Karaman, S., Gunusen, I., Uyar, M., Biricik, E., Firat, V. The effects of morphine and fentanyl alone or in combination added to intrathecal bupivacaine in spinal anesthesia for cesarean sec-tion. Agri, 2011, 23, 2, p. 57–63.
47. Karaman, S., Kocabas, S., Uyar, M., Hayzaran, S., Firat, V. The effects of sufentanil or morphine added to hyperbaric bupivacaine in spinal anaesthesia for caesarean section. European Journal of Anaesthesiology, 2006, 23, 4, p. 285–291.
48. Abouleish, E. I. Epinephrine improves the quality of spinal hyperbaric bupivacaine for cesarean section. Anesth. Analg., 1987, 66, 5, p. 395–400.
49. Rothschild, L., Bern, S., Oswald, S., Weinberg, G. Intravenous lipid emulsion in clinical toxicology. Scand. J. Trauma Resusc. Emerg. Med., 18, 1, p. 51.
50. Harvey, M., Cave, G. Lipid registry: intravenous lipid emulsion as antidote. Emerg. Med. Australas, 2009, 21, 6, p. 521–522.
51. Cave, G., Harvey, M. Intravenous lipid emulsion as antidote beyond local anesthetic toxicity: a systematic review. Acad. Emerg. Med., 2009, 16, 9, p. 815–824.
52. Cvachovec, K., Černý, V., Doležal, D., Herold, I., Horáček, M.,Křikava, I., Ševčík, P. Doporučení pro léčbu toxické reakce po podání lokálních anestetik. In 8.1.2012 edn: ČSARIM; 2012.
53. Hillyard, S. G., Bate, T. E., Corcoran, T. B., Paech, M. J., O'Sullivan, G. Extending epidural analgesia for emergency Caesarean section: a meta-analysis. British Journal of Anaesthesia, 2011, 107, 5, p. 668–678.
54. Malhotra, S., Yentis, S. M., Lucas, N. Extending epidural analgesia for emergency Caesarean section. British Journal of Anaesthesia, 2012, 108, 5, p. 879–880; author reply 880-881.
55. Sakura, S., Sumi, M., Morimoto, N., Saito, Y. The addition of epinephrine increases intensity of sensory block during epidural anesthesia with lidocaine. Reg. Anesth. Pain Med., 1999, 24, 6, p. 541–546.
56. Bernards, C. M., Shen, D. D., Sterling, E. S., Adkins, J. E., Risler, L., Phillips, B., Ummenhofer, W. Epidural, cerebrospinal fluid, and plasma pharmacokinetics of epidural opioids (part 2): effect of epinephrine. Anesthesiology, 2003, 99, 2, p. 466–475.
57. Skjoldebrand, A., Eklund, J., Lunell, N. O., Nylund, L., Sarby, B., Thornstrom, S. The effect on uteroplacental blood flow of epidural anaesthesia containing adrenaline for caesarean section. Acta Anaesthesiol. Scand., 1990, 34, 2, p. 85–89.
58. Marx, G. F., Elstein, I. D., Schuss, M., Anyaegbunam, A., Fleischer, A. Effects of epidural block with lignocaine and lignocaine-adrenaline on umbilical artery velocity wave ratios. Br. J. Obstet. Gynaecol., 1990, 97, 6, p. 517–520.
59. Tuleu, C., Allam, J., Gill, H., Yentis, S. M. Short term stability of pH-adjusted lidocaine-adrenaline epidural solution used for emergency caesarean section. Int. J. Obstet. Anesth., 2008, 17, 2, p. 118–122.
60. Allam, J., Malhotra, S., Hemingway, C., Yentis, S. M. Epidural lidocaine-bicarbonate-adrenaline vs levobupivacaine for emergency Caesarean section: a randomised controlled trial. Anaesthesia, 2008, 63, 3, p. 243–249.
61. Coda, B. A., Brown, M. C., Schaffer, R. L., Donaldson, G., Shen, D. D. A pharmacokinetic approach to resolving spinal and systemic contributions to epidural alfentanil analgesia and side-effects. Pain, 1995, 62, 3, p. 329–337.
62. Miguel, R., Barlow, I., Morrell, M., Scharf, J., Sanusi, D., Fu, E. A prospective, randomized, double-blind comparison of epidural and intravenous sufentanil infusions. Anesthesiology, 1994, 81, 2, p. 346–352; discussion p. 325A–326A.
63. Ginosar, Y., Riley, E. T., Angst, M. S. The site of action of epidural fentanyl in humans: the difference between infusion and bolus administration. Anesth. Analg., 2003, 97, 5, p. 1428–1438.
64. Helbo-Hansen, H. S., Bang, U., Lindholm, P., Klitgaard, N. A. Neonatal effects of adding epidural fentanyl to 0.5% bupivacaine for caesarean section. Int. J. Obstet. Anesth., 1993, 2, 1, p. 27–33.
65. Helbo-Hansen, H. S., Bang, U., Lindholm, P., Klitgaard, N. A. Maternal effects of adding epidural fentanyl to 0.5% bupivacaine for caesarean section. Int. J. Obstet. Anesth., 1993, 2, 1, p. 21–26.
66. Grass, J. A., Sakima, N. T., Schmidt, R., Michitsch, R., Zuckerman, R. L., Harris, A. P. A randomized, double-blind, dose-response comparison of epidural fentanyl versus sufentanil analgesia after cesarean section. Anesth. Analg., 1997, 85, 2, p. 365–371.
67. Palmer, C. M., Nogami, W. M., Van Maren, G., Alves, D. M. Post cesarean epidural morphine: a dose-response study. Anesth. Analg., 2000, 90, 4, p. 887–891.
68. Sarvela, J., Halonen, P., Soikkeli, A., Korttila, K. A double-blinded, randomized comparison of intrathecal and epidural morphine for elective cesarean delivery. Anesth. Analg., 2002, 95, 2, p. 436–440, table of contents.
69. Carvalho, B., Riley, E., Cohen, S. E., Gambling, D., Palmer, C., Huffnagle, H. J., Polley, L., Muir, H., Segal, S., Lihou, C. et al.Single-dose, sustained-release epidural morphine in the mana-gement of postoperative pain after elective cesarean delivery: results of a multicenter randomized controlled study. Anesth. Analg., 2005, 100, 4, p. 1150–1158.
70. Carvalho, B., Roland, L. M., Chu, L. F., Campitelli, V. A., 3rd, Riley, E. T. Single-dose, extended-release epidural morphine (DepoDur) compared to conventional epidural morphine for post-cesarean pain. Anesth. Analg., 2007, 105, 1, p. 176–183.
71. Kaufman, R. D., Gabathuler, M. L., Bellville, J. W. Potency, duration of action and pA2 in man of intravenous naloxone measured by reversal of morphine-depressed respiration. J. Pharmacol. Exp. Ther., 1981, 219, 1, p. 156–162.
72. http://www.accessdata.fda.gov/drugsatfda_docs/label/2010/020615s003lbl.pdf. In: U.S. Food and Drug Admini-stration; 2010.
73. Eisenach, J. C., D‘Angelo, R., Taylor, C., Hood, D. D. An isobolographic study of epidural clonidine and fentanyl after cesa-rean section. Anesth. Analg., 1994, 79, 2, p. 285–290.
74. Capogna, G., Celleno, D., Zangrillo, A., Costantino, P., Foresta, S. Addition of clonidine to epidural morphine enhances postoperative analgesia after cesarean delivery. Reg. Anesth., 1995, 20, 1, p. 57–61.
75. Pařízek, A. Porodnická anestezie a analgezie. 1 edn. Grada, 2002.
76. Brownridge, P. Epidural and subarachnoid analgesia for elective caesarean section. Anaesthesia, 1981, 36, 1, p. 70.
77. Ithnin, F., Lim, Y., Sia, A. T., Ocampo, C. E. Combined spinal epidural causes higher level of block than equivalent single-shot spinal anesthesia in elective cesarean patients. Anesth. Analg., 2006, 102, 2, p. 577–580.
78. McNaught, A. F., Stocks, G. M. Epidural volume extension and low-dose sequential combined spinal-epidural blockade: two ways to reduce spinal dose requirement for caesarean section. Int. J. Obstet. Anesth., 2007, 16, 4, p. 346–353.
79. Yun, E. M., Marx, G. F., Santos, A. C. The effects of maternal position during induction of combined spinal-epidural anesthesia for cesarean delivery. Anesth. Analg., 1998, 87, 3, p. 614–618.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2014 Číslo 1- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Souběžně probíhající neodkladný a akutní císařský řez – kazuistika*
- Myasthenia gravis a anestezie – nový bezpečnější postup
- Zaměřeno na prerenální akutní poškození ledvin – nastal čas přepsat učebnice?
-
Current Practice in Obstetric Anaesthesia.
Part III. Regional anaesthesia for caesarean section - Ultrazvukové vyšetření hrudníku v intenzivní medicíně
- Komplikace perkutánní biopsie plic pod CT kontrolou
- Hypovolemický šok
- Porodnická analgezie, aneb historie kontroverzí…
- Je vhodnější v rámci reverze nervosvalové blokády podat vagolytikum před neostigminem, nebo lze podávat obě látky současně?
-
Practice guidelines for management of the Difficult Airway
An updated Report by the American Societyof Anesthesiologists Task Forceon Management of the Difficult Airway - XV. kardioanesteziologické vědecké dny s mezinárodní účastí
-
Karl Koller, objevitel lokálně anestetického účinku kokainu,se narodil v Sušici!
Krátká historie lokálních anestetik - Zprávy ČSARIM
- Doporučení a stanoviska ČSIM
- Srovnání opioidní a neopioidní analgezie po císařském řezu v celkové anestezii – prospektivní observační studie
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ultrazvukové vyšetření hrudníku v intenzivní medicíně
- Hypovolemický šok
- Myasthenia gravis a anestezie – nový bezpečnější postup
-
Current Practice in Obstetric Anaesthesia.
Part III. Regional anaesthesia for caesarean section
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



