Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
Vitamin D metabolism and current options for therapeutic activation of vitamin D receptor in patients with chronic kidney disease or renal failure
Chronic kidney disease (CKD), and chronic renal failure in particular, is associated with vitamin D deficiency and with a disorder of all metabolic processes that are associated with vitamin D. Calcidiol levels are often low. At present, efforts are made to test and to pharmacologically modulate its levels and thus to contribute to greater availability of the substrate for external calcitriol production. Calcitriol production is reduced in CKD patients not only as a consequence of diminishing functional renal parenchyma but also as a consequence of 1-α-hydroxylase inhibition by FGF-23 and other factors. On the other hand, although parathormone (PTH) increases renal production of calcitriol, it also causes secondary hyperparathyroidism. Synthetic calcitriol (or α-calcidiol) supresses PTH production and is used to treat secondary hyperparathyroidism. This approach is often associated with adverse increase in calcaemia and phosphataemia as the effect on parathyroid glands is associated with an effect on the gastrointestinal tract where calcium and phosphor absorption is increased by calcitriol. Synthetic analogues of vitamin D inhibit parathyroid gland but have significantly lower effect on gastrointestinal tract. Paricalcitol is a selective VDR (vitamin D receptor) activator, used for targeted suppression of parathyroid glands. Vitamin D deficiency in general population is associated, at least in epidemiological studies, with a range of medical complications and the same also applies to patients with renal disease. Although randomised studies are not available, clinical observational studies repeatedly showed treatment with VDR activators to be associated with better prognosis. As other fields of medicine, nephrology currently pays a great attention to vitamin D and vitamin D receptor activation.
Klíčová slova:
calcitriol – calcidiol – paricalcitol – chronic kidney disease – chronic renal failure – vitamin D receptor – secondary hyperparathyroidism
Autoři:
S. Dusilová Sulková 1,2
Působiště autorů:
Hemodialyzační středisko FN, Hradec Králové, vedoucí lékařka prof. MUDr. Sylvie Dusilová Sulková, DrSc., MBA
1; Klinika nefrologie, Transplantcentrum Institutu klinické a experimentální medicíny Praha, přednosta prof. MUDr. Ondřej Viklický, CSc.
2
Vyšlo v časopise:
Vnitř Lék 2012; 58(11): 839-849
Kategorie:
Přehledné referáty
Souhrn
Chronické onemocnění ledvin (CKD) a zejména chronické selhání ledvin je spojeno s deficitem vitaminu D a s poruchou všech metabolických procesů, které se k vitaminu D v organizmu vztahují. Hladiny kalcidiolu jsou často nízké. V současné době je věnována pozornost jejich stanovení i jejich farmakologické úpravě, která může přispět ke zvýšení dostupnosti substrátu pro extrarenální produkci kalcitriolu. Tvorba kalcitriolu je u pacientů s CKD snížena, a to nejen v důsledku zanikajícího funkčního renálního parenchymu, ale i v důsledku útlumu 1-α-hydroxylázy působením FGF-23 a dalších vlivů. Naopak, parathormon (PTH) renální tvorbu kalcitriolu zvyšuje, avšak za cenu sekundární hyperparatyreózy. V léčbě sekundární hyperparatyreózy se využívá syntetický kalcitriol (či α-kalcidol), který suprimuje tvorbu PTH. Tento postup je často spojen s nežádoucím zvýšením kalcemie i fosfatemie, neboť efekt na příštítná tělíska je spojen s účinkem v zažívacím traktu, kde se vstřebávání kalcia i fosforu vlivem kalcitriolu zvyšuje. Syntetická analoga vitaminu D představují terapeutický postup, který inhibuje příštítná tělíska při významně nižším účinku v zažívacím traktu. Selektivním aktivátorem VDR (receptor pro vitamin D) využívaným pro cílenou supresi příštítných tělísek, je parikalcitol. Deficit vitaminu D v běžné populaci je spojen přinejmenším v epidemiologických studiích s celou řadou medicínských komplikací. Analogická spojitost je pozorována i u nefrologických pacientů. V klinických observačních studiích je léčba aktivátory VDR opakovaně spojena s lepší prognózou, cílené randomizované studie však nejsou k dispozici. Stejně jako v ostatních oborech medicíny, i v nefrologii je vitaminu D, resp. aktivaci receptoru pro vitamin D v současné době věnována velká pozornost.
Klíčová slova:
kalcitriol – kalcidiol – parikalcitol – chronické onemocnění ledvin – chronické selhání ledvin – receptor pro vitamin D – sekundární hyperparatyreóza
Úvod
V současné době je v mnoha medicínských oborech věnována velká pozornost důsledkům deficitu vitaminu D, resp. důsledkům chybějící aktivace receptoru pro vitamin D (VDR). Přinejmenším ve velkých epidemiologických studiích byla doložena souvislost mezi nízkými hladinami vitaminu D v krvi a řadou nemocí napříč různými medicínskými obory. Molekulárněbiologické studie i experimentální data dokládají význam aktivace VDR nejen pro homeostázu kalcia a fyziologický kostní metabolizmus (tzv. „ tradiční“ účinky vitaminu D), ale i pro fyziologickou funkci mnoha dalších orgánů a systémů (souhrnně v posledních letech označováno jako tzv. „netradiční“ účinky).
V nedávné době byla v časopise Vnitřní lékařství uveřejněna speciální příloha zaměřená na roli vitaminu D v kardiologii, diabetologii, imunologii, neurologii a dalších oblastech medicíny, včetně rozvahy o komplexní roli aktivace receptoru pro vitamin D v organizmu [1]. Fyziologickým aktivátorem VDR receptoru je kalcitriol, který z vitaminu D vzniká endogenně. Představuje tedy již nikoliv vitamin, ale hormon. Často se však užívá termín aktivní vitamin D, byť je vlastně míněna aktivita hormonu.
Je dobře dokumentováno, že po vazbě aktivního vitaminu D na jaderný receptor pro vitamin D následuje složitá posloupnost molekulárních dějů, jejichž výsledkem je zesílení či naopak inhibice transkripce určitého genu. Tento gen je pochopitelně odlišný v různých tkáních a orgánech. aktivace VDR kontroluje genovou transkripci a aktivní vitamin D (resp. molekulu, která VDR aktivuje, viz dále) lze označit za transkripční faktor.
Regulaci vlivem aktivace VDR podléhá podle současných poznatků několik set genů. Účinky vitaminu D v organizmu jsou tedy mnohem širší než klasicky definovaný vliv na kostní metabolizmus a příštítná tělíska. Obecně lze netradiční účinky aktivace VDR označit jako antiproliferativní a prodiferenciační (podpora buněčného zrání a naopak inhibice proliferace buněk neboli růstu tkáně).
V nefrologii je klasickým příkladem přímého účinku aktivního vitaminu D, resp. aktivace VDR suprese transkripce genu pro parathormon. Jaderný receptor pro vitamin D v buňkách příštítných tělísek přímo kontroluje přepis genu pro parathormon. Pokud není zajištěna optimální aktivace VDR, tvorba parathormonu je nadměrná (funkční důsledek). Při déletrvajícím podnětu se tělíska zvětšují (hyperplazie). Nastává a progreduje sekundární hyperparatyreóza (SHPT).
Spojení mezi deficitem aktivního vitaminu D a hyperparatyreózou je však jen jednou z oblastí, ve které je patrný velký význam poruchy metabolizmu vitaminu D, která pravidelně doprovází chronická onemocnění ledvin (CKD – chronic kidney disease).
Chronická onemocnění ledvin jsou spojena s řadou metabolických odchylek. Příčinou je nejen snížená či dokonce chybějící renální eliminace (retence látek označovaných jako „uremické toxiny“), ale i deficit endogenní renální produkce (kalcitriolu a erytropoetinu) a abnormální intrarenální metabolizmus (příkladem je glykosurie bez spojitosti s diabetes mellitus). Komplexní a složitou poruchu vnitřního prostředí zprvu částečně kompenzují určité regulační mechanizmy, které se však postupně fixují a stávají se spoluodpovědné za výsledný patologický stav.
Typickým příkladem klinické komplikace doprovázející CKD je sekundární hyperparatyreóza (SHPT). Výše bylo uvedeno spojení mezi hyperfunkcí a hyperplazií příštítných tělísek a deficitem aktivního vitaminu D, avšak patogeneze SHPT je mnohem komplexnější. S určitým zjednodušením ji lze charakterizovat jako dlouhodobý souběžný důsledek chybějícího renálního vylučování (retence fosfátů) a nedostatečné endogenní produkce kalcitriolu s negativní kalciovou bilancí.
Hyperfunkce příštítných tělísek zprvu kompenzatorně zvyšuje fosfaturii (snížení zpětné resorpce fosfátů v tubulech vlivem PTH, tj. do glomerulárního filtrátu sice přejde méně fosfátů, ale více jich je vyloučeno močí, stoupá tzv. exkreční frakce). Dále se vlivem PTH upravuje deficit kalcitriolu, neboť PTH je stimulátorem renální 1-α-hydroxylázy, neboli enzymu, který mění 25-hydroxyvitamin D (kalcidiol) na 1,25-dihydroxyvitamin D (kalcitriol). Protože však porucha funkce ledvin či dokonce zánik funkce (ESRD – end-stage renal disease) nadále trvají, je konečným důsledkem nejen hyperfunkce, ale i hyperplazie příštítných tělísek s postižením skeletu (tzv. renální osteopatie), kalcifikacemi cév a postižením dalších orgánů (přehledně v našem písemnictví např. [2,3]).
Vysoká koncentrace PTH není spojena jen s poškozením kostní tkáně, ale má i řadu dalších negativních důsledků (parathormon jako „uremický toxin“) [4]. Prevence i léčba SHPT je důležitou oblastí péče o pacienty s CKD.
Pacienty se selháním ledvin provází nejen komplexní porucha kostního metabolizmu a abnormality příštítných tělísek a homeostázy kalcia a fosforu (dnes označovaná jako CKD-MBD – chronic kidney disease--mineral bone disorder), ale řada dalších závažných komplikací. Kvalita života a jeho délka jsou významně zkráceny – mortalita dialyzovaných pacientů je přibližně 10–20krát vyšší ve srovnání se stejnou věkovou kohortou s normální funkcí ledvin. Mortalita je zvýšená již v průběhu chronických nefropatií. Hlavní příčinou jsou kardiovaskulární komplikace [5].
Příčiny kardiovaskulárního poškození při CKD a ESRD jsou komplexní. Lze je rozdělit na 2 hlavní skupiny – tzv. „tradiční“ rizikové faktory, které jsou shodné s obecnou populací (zejména hypertenze, dále i kouření, věk atd.), a „netradiční“, spojené jednak se selháním ledvin, tj. „uremia – related“ (metabolické změny, např. akcentovaný oxidační stres, retence určitých látek – produkty pokročilé glykace apod.), a spojené s vlastní náhradou funkce ledvin, tj. „dialysis – related“ (výkyvy hydratace, vliv mimotělního okruhu). Je doloženo, že abnormální metabolizmus vápníku, fosforu a vitaminu D může přímo či nepřímo ke kardiovaskulárnímu riziku a k nepříznivé prognóze nefrologických pacientů přispívat [6].
Cílem této přehledné práce je popsat odchylky metabolizmu vitaminu D při chronických onemocněních ledvin a zejména při selhání ledvin a přehledně uvést současné farmakologické možnosti aktivace VDR u nefrologických pacientů (suplementace nativního vitaminu D, aktivní vitamin D, selektivní aktivátory VDR). Jsou uvedeny i vybrané recentní významné klinické studie s přímým zaměřením na účinek aktivace VDR u nefrologických pacientů.
Chronické onemocnění ledvin a metabolizmus vitaminu D
Při chronickém onemocnění ledvin je hlavní abnormalitou porušená až chybějící renální produkce kalcitriolu. Abnormality však byly zjištěny prakticky na všech úrovních metabolické přeměny vitaminu D v organizmu (včetně renálního transportu kalcidiolu, dostupnosti kalcidiolu pro konverzi na aktivní látku či biodegradace vitaminu D) a týkají se i vitamin D vážícího proteinu (DBP).
Metabolizmus kalcidiolu (25-hydroxyvitaminu D) při CKD
V současné době je stanovení 25-hydroxyvitaminu D (kalcidiolu) v krvi dobře dostupné a je známo, že jeho hladiny jsou u pacientů s CKD nízké. Pouze u necelých 30 % pacientů CKD stadia 3–4 (CKD 3 = glomerulární filtrace v rozmezí 0,5–1,0 ml/s; CKD 4 = glomerulární filtrace v rozmezí 0,25–0,5 ml/s) byly sérové koncentrace kalcidiolu vyšší než 75 nmol/l (tj. vyšší než 30 ng/ml) [7]. Analogické údaje lze nalézt v dalších pracích [8]. Výskyt deficitu vitaminu D u terminálního selhání ledvin (hemodialyzovaní a peritoneální dialyzovaní) je uváděn v 80–90 % [9]. Rovněž u pacientů s dobře funkční transplantovanou ledvinou je deficit vitaminu D velmi častý (až u 85 % pacientů) [10].
Jaká je příčina a jaké jsou důsledky chybění nativního vitaminu D u pokročilých chronických chorob ledvin?
Obecně lze zvažovat nízký přívod prekurzoru v potravě, resp. nízký vznik v kůži, dále poruchu hepatální konverze na kalcidiol, zvýšené renální ztráty kalcidiolu a případně i zvýšený katabolizmus kalcidiolu. U pacientů s CKD byly všechny uvedené možnosti skutečně demonstrovány, jejich relativní podíl na výsledné hladině kalcidiolu je pochopitelně u jednotlivých nemocných různý.
Prvním zdrojem vitaminu D je osvit kůže ultrafialovými paprsky vlnové délky 290–315 nm [11], resp. podle jiného literárního zdroje vlnové délky 285–310 nm [12]. Sluneční osvit je intenzivním zdrojem vitaminu D – krátkodobá příležitostná expozice přibližně 20 % tělesného povrchu je ekvivalentní přívodu 200 IU (= 5 µg) cholekalciferolu, avšak je závislá i na fototypu člověka a může kolísat.
Zvažuje se, že syntéza 7-dehydrocholesterolu v kůži je při selhání ledvin nízká [12]. Nedávno však bylo dokumentováno, že ultrafialové záření má kapacitu zvýšit hladinu vitaminu D v krvi u hemodialyzovaných pacientů [13]. Pravidelný sluneční osvit však u těchto pacientů zřejmě chybí.
Druhým zdrojem vitaminu D pro organizmus je potrava. Nejsou k dispozici data, jaký je obvyklý přívod vitaminu D u nefrologických pacientů, avšak běžně je v literatuře uváděno, že je nízký [12]. Sami jsme na malém vzorku dietních záznamů dialyzovaných pacientů (40 osob, záznam 3 různých dnů v týdnu) s pomocí softwaru Danone zjistili, že denní příjem vitaminu D je velmi nízký (nepublikovaná data). Pouze u jednoho pacienta dosahoval 500 IU denně, střední hodnota se pohybovala kolem 100 IU. Dietní omezení, resp. spíše nesprávné stravovací návyky u nefrologických pacientů mohou podle našeho názoru k deficitu vitaminu D významně přispívat.
Kalcidiol je lipofilní (hydrofobní). Proto necirkuluje v krvi volně, ale je navázán na specifický transportní protein (vitamin D binding protein – DBP), částečně i na albumin. Vazebná kapacita DBP je velká. Jen méně než 1 % vitaminu D je v cirkulaci volně. Při proteinurii se DBP spolu s ostatními bílkovinami (pochopitelně včetně albuminu) ztrácí do moče a tím se ztrácí i vitamin D [12]. Přesné údaje o kvantitě těchto ztrát však nejsou k dispozici.
Další zvažovanou možností je porucha hepatální tvorby kalcidiolu z prekurzoru. U osob s normální funkcí ledvin nepodléhá hepatální 25-hydroxyláza žádné regulaci a prakticky všechen nativní vitamin D se přemění na kalcidiol, a to i u pacientů s hepatopatií. Při CKD je snížená aktivita jaterního enzymatického cytochromu P450. Právě subkomponenta tohoto systému zodpovídá za hepatální tvorbu kalcidiolu. V experimentu na zvířeti byla při uremii snížena konverze podaného nativního vitaminu D na kalcidiol o přibližně 70 % ve srovnání se zdravými kontrolami [14]. Proto je možné, že k nízké hladině kalcidiolu při CKD může přispívat i porušená hepatální tvorba, zejména při souběžné hyperparatyreóze (v uvedeném experimentu se jaterní konverze normalizovala po paratyreoidektomii).
Konečně na nízké koncentraci kalcidiolu v krvi při CKD se podílí i zánik funkční renální tkáně. Fyziologicky se totiž kalcidiol dostává k buňkám proximálních tubulů vybavených 1-α-hydroxylázou nikoliv z krve, ale z glomerulárního filtrátu endocytózou (viz dále) [15,16].
Deficit kalcidiolu u pacientů s CKD a při selhání ledvin je častý a příčin je více. Ve svém důsledku znamená nedostatek substrátu pro konverzi na kalcitriol, ovšem je třeba poznamenat, že renální kapacita pro tuto konverzi je významně snížena.
Respektovaná KDIGO (Kidney Disease: Improving Global Outcome) iniciativa doporučuje stanovovat koncentraci kalcidiolu v krvi přinejmenším při vstupním vyšetření a dále v intervalech v závislosti na dříve naměřených hodnotách a léčebném postupu. Je doporučeno, aby naměřené hodnoty byly interpretovány shodně jako u osob s normální funkcí ledvin (tj. za dostatečnou považovat hodnotu 75 nmol/l). Pacientům s deficitem vitaminu D je vhodné podávat suplementaci [17,18]. Forma (dávky, frekvence podání) však nejsou jednoznačně stanoveny, resp. jsou stále diskutovány.
Metabolizmus kalcitriolu (1,25-dihydroxyvitaminu D) při CKD
Kalcitriol (1,25-dihydroxyvitamin D) představuje biologicky aktivní formu vitaminu D a správně by měl být (resp. je) řazen mezi hormony, neboť se do organizmu nedostává exogenně, ale fyziologicky vzniká výhradně endogenně [1].
Jak známo, pro systémovou potřebu je vytvářen v ledvinách z kalcidiolu. Biologický poločas kalcitriolu v krvi je 8–12 hod. Systémová hladina je závislá na funkčním renálním parenchymu a na výsledném vektoru stimulačních či inhibičních mechanizmů, které regulují aktivitu hydroxylujícího enzymu, tj. renální 1-α-hydroxylázy (enzym CYP27B1) [19].
Významným stimulátorem CYP27B1 je hypokalcemie. Vzestup kalcemie naopak aktivitu enzymu brzdí. Participující regulátory jsou dále parathormon (který CYP27B1 stimuluje), FGF-23 (silný inhibitor) a dále acidóza (inhibiční efekt). Dříve se uvádělo, že regulátorem je i fosfatemie, avšak podle současných názorů se jeví, že efekt fosfátů je zprostředkován vlivem FGF-23 (viz dále). Inhibitorem enzymu CYP27B1 je i blíže nespecifikovaná „uremická toxicita“. Nově se ukazuje, že negativním regulátorem je i produkt klotho genu [19].
Klotho je nezbytnou součástí funkčního receptoru pro FGF-23. FGF-23 je velmi silný fosfatonin. Molekula FGF-23 po navázání na receptorový komplex v ledvinách inhibuje fosfát--sodíkový transportní kanál a tím působí fosfaturicky (stejně jako PTH). Na rozdíl od PTH, který zvyšuje tvorbu kalcitriolu v ledvinách, je FGF-23 silným inhibitorem renální 1-α-hydroxylázy. FGF-23 je produkován v osteocytech v odpovědi na nálož fosfáty. Mechanizmus, kterým je nálož fosfátů v organizmu přenášena jako signál pro osteocyty, však není znám [20,21].
Vzhledem k tomu, že FGF-23 je skutečně velmi silným inhibitorem 1-α-hydroxylázy a že retence fosforu při CKD má řadu dalších negativních důsledků (fosfor jako uremický toxin), je v současné době kladen velký důraz na včasnou a trvalou kontrolu sérových koncentrací fosforu. Udržení normofosfatemie je základním a nezbytným požadavkem pro prevenci i léčbu poruchy kostního metabolizmu při CKD [2].
Regulace produkce kalcitriolu extrarenálně je zcela odlišná. Zde se uplatňují lokální působky (cytokiny a růstové faktory). Ke tkáním, jejichž buňky jsou vybaveny 1-α-hydroxylázou, patří mimo jiné buňky imunitního systému (monocyto-makrofágový systém a další), β-buňky pankreatu, buňky prostaty, tlustého střeva a další (včetně tkáně příštítných tělísek). Extrarenální produkce je určena pro parakrinní//autokrinní aktivitu, avšak za určitých okolností může být její rozsah vyšší a odrážet se v systémových koncentracích. Příkladem je sarkoidóza, tuberkulóza, ale i selhání ledvin [11,19].
Pro naprostou většinu biologických aktivit kalcitriolu je nutný receptor pro vitamin D (VDR). Tento receptor je identický ve všech buňkách, v nichž je exprimován (tj. organizmus disponuje pouze jediným typem VDR). Odpověď na aktivaci VDR je však rozdílná, mimo jiné proto, že v různých buňkách jsou rozdílně exprimovány regulační proteiny, které určují jak intenzitu vazby, tak i poločas komplexu. Při selhání ledvin jsou jemné intracelulární regulační mechanizmy, na kterých závisí konečný efekt aktivace VDR, narušeny.
Jaké jsou důsledky deficitu renální produkce kalcitriolu při CKD a zejména při selhání ledvin? Hlavní komplikací je již výše zmíněná komplexní porucha kostního metabolizmu a sekundární hyperparatyreóza. V posledních letech se však intenzivně studují i tzv. neklasické účinky aktivace VDR ve vztahu k ledvinám. Celá řada experimentálních poznatků dokládá, že aktivace VDR má určité nefroprotektivní a kardioprotektivní účinky, spolu s účinky imunomodulačními [22–24].
Katabolizmus vitaminu D při chronických onemocněních ledvin
Kalcidiol i kalcitriol i syntetické aktivátory VDR jsou katabolizovány enzymem 24-hydroxylázou. Vzniká neúčinný 24,25-dihydroxyvitamin D. Enzym CYP24A1 je konstitutivně exprimován v ledvinách a je indukován kalcitriolem prakticky ve všech tkáních, které mají receptor pro vitamin D. Katalyzuje biologickou inaktivaci (degradaci) 25-hydroxyvitaminu D, 1,25-dihydroxyvitaminu D i všech syntetických aktivátorů VDR. Poločas enzymatické aktivity je přibližně 7 dní. V ledvinách je aktivita CYP24A1 indukována FGF-23 (fibroblastový růstový faktor 23) i kalcitriolem, resp. jeho suplementací či podáváním farmakologických aktivátorů VDR, dále i metabolickou acidózou; naopak suprimována je parathormonem [15,16].
Nedávno bylo dokumentováno, že aktivita enzymu degradujícího vitamin D je při CKD nižší [25], než by odpovídalo normální funkci ledvin. Autoři této práce konstatují, že při selhání ledvin je nejen zpomalená tvorba aktivního vitaminu D, ale je i zpomalená jeho degradace. Selhání ledvin označují jako stav se stagnujícím metabolizmem vitaminu D.
Pro komplexnost problematiky metabolizmu vitaminu D v nefrogii ještě doplňujeme, že na hladinu vitaminu D (a též na expresi receptoru pro vitamin D a expresi megalinu zodpovědného za aktivní endocytózu vitamin D binding proteinu s navázaným kalcidiolem z močového ultrafiltrátu do tubulárních buněk) mají vliv i určitá imunosupresiva, hojně využívaná u pacientů s transplantovanou ledvinou a někdy i u autoimunitních nemocí ledvin. Kalcineurinové inhibitory (cyklosporin A, takrolimus), avšak nikoliv mTOR inhibitory (rapamune) zvyšují produkci kalcitriolu a současně snižují expresi VDR i expresi megalinu [26].
Degradaci kalcidiolu i kalcitriolu zvyšují i kortikoidy [12], které jsou nefrologickým pacientům poměrně často předepisovány (součást léčby většiny primárních i sekundárních glomerulonefritid a pochopitelně součást imunosupresivních režimů po transplantaci).
Poznámky k vitamin D binding proteinu (DBP), k roli megalinu při CKD a k tzv. rezistenci na vitamin D při CKD
Přibližně 85 % cirkulujícího kalcidiolu, který je hydrofobní, je vázáno na DBP (vitamin D binding protein, molekulová hmotnost 58 kD, biologický poločas přibližně 3 dny), 15 % je navázáno na albumin a přibližně 1 ‰ je volné. Jako biologicky dostupný vitamin D označujeme volný podíl spolu s podílem vázaným na albumin. DBP má velkou afinitu ke kalcidiolu a přibližně 10–100krát nižší afinitu ke kalcitriolu [27].
Roli DBP ve fyziologii vitaminu D lze označit jako udržující stav zásob vitaminu D v organizmu (ochrana před degradací – vitamin D je navázán a tudíž chráněn před biodegradací) a kontrolující jeho dostupnost pro cílové tkáně.
Jak uvedeno, jedním z mechanizmů, které udržují zásoby vitaminu D v organizmu, je renální tubulární zpětná reabsorpce profiltrovaného DBP s navázaným vitaminem D. Pokud je proteinurie vyšší a kapacita endocytózy je překročena, DBP i s navázaným vitaminem D se z organizmu ztrácí. Buňky proximálních renálních tubulů nedostávají kalcidiol z krve, ale z glomerulárního ultrafiltrátu. Mediátorem aktivního procesu endocytózy filtrovaného kalcidiolu navázaného na DBP je megalin.
Megalin má i další role – včetně reabsorpce albuminu v tubulech či internalizace Na-P kotransporteru, který je zodpovědný za fosfaturický účinek PTH. Exprese megalinu je dependentní na aktivaci receptoru pro vitamin D. Při CKD je exprese genu pro megalin snížená, obsah renálního megalinu rychle klesá, což pochopitelně snižuje endocytózu komplexu kalcidiol-vazebný protein.
DBP je produkován v játrech a katabolizován v ledvinách. Hladiny jsou nižší při hepatální cirhóze a nefrotickém syndromu. Je jen velmi málo informací o sérových koncentracích DBP u pacientů s CKD. V jedné práci byly nalezeny méně než poloviční koncentrace u hemodialyzovaných pacientů ve srovnání s kontrolami. I tato skutečnost by se mohla odrazit v nefyziologickém metabolizmu vitaminu D při CKD [28].
V kontextu poruch metabolizmu vitaminu D u pacientů s CKD je ještě vhodné zmínit tzv. rezistenci na vitamin D. Jde o situaci snížené odpovědi tkání (zejména příštítných tělísek), kdy efekt aktivace VDR je nižší než očekávaný. Mechanizmy jsou objasněny jen z části, zcela jistě k nim patří porucha receptorů pro vitamin D, ať již jejich snížený počet, resp. snížená exprese VDR, či porucha biologických a molekulárních dějů spojených s aktivací VDR. Rezistence na vitamin D je více vyjádřená při současné hyperfosfatemii.
Souhrnně jsou poruchy metabolizmu vitaminu D u pacientů s chronickým onemocněním a selháním ledvin uvedeny v tab. 1.
![Komplexní porucha metabolizmu vitaminu D při chronických onemocnění a selhání ledvin (volně podle [12]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b34ea939553ea1f8e60b5c3e1778ead8.png)
Netradiční účinky vitaminu D ve vztahu k nefrologii a důsledky chybějící aktivace VDR při chronickém onemocnění a selhání ledvin
Ve smyslu „tradičních“ účinků vitaminu D v organizmu je hlavním důsledkem chybějící aktivace VDR při chronickém onemocnění a selhání ledvin porucha kostního metabolizmu a sekundární hyperparatyreóza.
V současné době však existuje řada experimentálních dat i klinických pozorování (většinou epidemiologických), která dokumentují podstatně širší význam chybějící aktivace VDR u nefrologických pacientů [24]. Jak bude uvedeno dále, tzv. pleiotropní efekt vitaminu D je spojován s prognostickým benefitem. Uvádíme některé z tzv. netradičních účinků vitaminu D se vztahem k nefrologii.
Cévní stěna pacientů s CKD je často strukturálně i funkčně změněná (tzv. stiffening), ztrácí pružnost a je kalcifikovaná [29,30]. Tato abnormalita je jednou z komponent CKD-MBD (kostní a cévní poškození při nemocech ledvin) a významně zhoršuje kardiovaskulární morbiditu i mortalitu. Příčiny kalcifikací cév jsou komplexní a významně se na nich účastní zvýšená koncentrace vápníku i fosforu, resp. pozitivní kalciová a fosfátová bilance. Avšak role vitaminu D v patogenezi kalcifikací je složitější. Aktivní vitamin D sice zvyšuje kalcemii i fosfatemii a tím nepřímo kalcifikační potenciál zvyšuje, ale vlastní aktivace VDR na molekulární úrovni působí na cévní stěnu příznivě (mimo jiné inhibice transkripce některých prokalcifikačních genů, např. core binding factor-α-1, či indukce transkripce genu pro matrix-GLA protein, který je naopak potentním lokálním ochranným protikalcifikačním působkem) [23,31,32]. Pro klinickou praxi z výše uvedeného vyplývá, že při léčbě aktivátory VDR je vždy třeba sledovat, aby nenastala hyperkalcemie a hyperfosfatemie, která může důležité pozitivní účinky aktivace VDR znehodnotit.
Na molekulární úrovni byly získány poznatky i o příznivém vlivu aktivace VDR na myokard, které se však kontrolované randomizované studii PRIMO nepodařilo převést do klinické reality [33]. Problematika je však dále studována, protože studie ukázala některé zajímavé sekundární výsledky a trendy.
Naproti tomu experimentální i observační klinická data o nefroprotektivním efektu aktivace VDR již byla podpořena několika studiemi [34–37]. K experimentálně doloženým nefroprotektivním účinkům patří snížení glomerulosklerózy a glomerulární hypertrofie, mezangiální proliferace i intersticiální fibrózy [23]. Molekulární mechanizmy jsou jen částečně známy a jsou jistě komplexní. Roli může mimo jiné mít TACE (tumor-necrosis factor α konvertující enzym, označovaný též jako ADAM17), který konvertuje vznik cytokinu TNF-α [16]. Tento cytokin se podílí na proteinurii, glomerulární skleróze, zánětlivé infiltraci renálního parenchymu a na dalších cestách tkáňového (renálního) poškození. Aktivace VDR expresi a aktivitu TACE snižuje. Dosud bylo experimentálně podloženo, že aktivace VDR inhibuje systém renin-angiotenzin-aldosteron, snižuje zánět a snižuje proteinurii. Efekt na proteinurii byl pozorován i v některých klinických pracích [35,37].
Vitamin D má imunomodulační roli. U dialyzovaných pacientů jsou infekce 2. nejčastější příčinou úmrtí. Dosud je však věnováno překvapivě málo pozornosti tomu, zda suplementace vitaminu D sníží výskyt infekcí. Sami jsme dokumentovali potentní imunomodulační vliv kalcitriolu i parikalcitolu in vitro [22]. Imunomodulační vliv aktivace VDR může mít význam i v transplantologii [38]. V klinické, dialyzační i transplantační nefrologii je však zapotřebí tomuto tématu věnovat mnohem více pozornosti, stejně jako dalším zvažovaným netradičním účinkům aktivace VDR, popisovaným u běžné populace.
Farmakologická aktivace VDR u pacientů s chronickým onemocněním a selháním ledvin
Oba přirozené aktivátory VDR jsou při CKD v organizmu v podstatně menším množství než za fyziologických okolností. To vyplývá jak z nízkých hladin kalcidiolu, tak i z nízké systémové produkce kalcitriolu v ledvinách.
Aktivaci receptoru pro vitaminu D je možné zajistit farmakologicky. V principu lze používání látek aktivujících VDR v nefrologii rozdělit do 2 okruhů:
- nutriční suplementace deficitu vitaminu D při chronickém onemocnění a selhání ledvin,
- cílená léčba sekundární hyper-paratyreózy.
Nutriční suplementace znamená doplnění kalcidiolu, tj. dodání substrátu pro extrarenální produkci kalcitriolu. Pro léčbu sekundární hyperparatyreózy je však nedostačující.
Principem léčby hyperparatyreózy je suprese transkripce genu pro parathormon vlivem aktivace VDR v příštítných tělískách.
Farmakologická suprese příštítných tělísek aktivátory VDR je u pacientů s CKD využívána často. Jde o dlouhodobě zavedenou a schválenou indikaci. Máme na výběr několik látek, jejichž celkové účinky se mírně liší. Všechny účinně inhibují transkripci genu pro parathormon, ale pochopitelně všechny mají v organizmu i jiné účinky. K nejvíce vyjádřeným patří zvýšené vstřebávání vápníku a fosforu v zažívacím traktu.
V léčbě hyperparatyreózy spojené s CKD můžeme volit buď syntetický kalcitriol, či syntetický α-kalcidol, který vlastně představuje „pro-drug“ pro kalcitriol (kalcitriol vzniká hydroxylací α-kalcidolu v poloze 25 v játrech).
Novějším postupem je aplikace syntetického selektivního aktivátoru VDR. U nás je registrován jediný selektivní aktivátor VDR, parikalcitol (Zemplar). Princip selektivity spočívá ve výrazně vyšším účinku na tkáň příštítných tělísek při srovnatelném účinku v GIT (jinými slovy – výrazně menším účinku v GIT při shodném efektu na příštítná tělíska). Účinek parikalcitolu v zažívacím traktu je při srovnatelném účinku na příštítná tělíska přibližně třetinový ve srovnání s kalcitriolem (viz níže).
Jak bylo uvedeno, schválenou indikací v nefrologii pro selektivní, resp. aktivní aktivátory VDR je prevence a léčba sekundární hyperparatyreózy resp. renální osteodystrofie. V současné době se však velmi diskutuje o tom, že vlastní účinek je širší (viz dále).
V poslední době se stále více u pacientů s CKD zvažuje i podávání chybějícího prekurzoru kalcidiolu, hovoří se o nutriční suplementaci [12,39,40]. Stejně jako u běžné populace je dnes u nás v této indikaci lékem volby cholekalciferol v kapkách. Jedná se o synteticky připravený cholekalciferol, který se dále metabolizuje na kalcidiol (a poté na kalcitriol). V ČR je dostupný pod obchodním názvem Vigantol, kde jedna kapka Vigantolu obsahuje 667 IU (tj. 0,017 mg) cholekalciferolu.
Donedávna byla tato látka v nefrologii opomíjena, neboť nebyly informace o tom, že deficit nativního vitaminu D při nemocech ledvin je častý, a nepředpokládalo se, že extrarenální produkce kalcitriolu by mohla být klinicky relevantní. Naopak, v současné době se suplementace nativního vitaminu D u nefrologických pacientů považuje za významnou [41].
Literatura diskutuje i kombinaci nutriční suplementace vitaminu D a aktivních metabolitů [42]. Tento postup by však měl být výjimečný, neboť riziko hyperkalcemie a hyperfosfatemie se silně zvyšuje. Aktivní a selektivní aktivátor VDR pochopitelně nikdy nekombinujeme.
Nutriční suplementaci a cílenou supresi příštítných tělísek aktivátory VDR je potřeba od sebe rozlišovat. Oba postupy mají jiné cíle. I když samotné doplnění deficitu vitaminu D může tvorbu parathormonu do určité míry snížit, v léčbě pokročilé hyperparatyreózy nativní vitamin D rozhodně nestačí [12].
Podáváme-li jakýkoliv aktivátor VDR, musíme počítat s tím, že se vstřebává více kalcia a fosforu. Riziko hyperkalcemie a případně se i zhoršení hyperfosfatemie nelze vyloučit u žádného aktivátoru VDR. Mezi jednotlivými přípravky je však zásadní rozdíl v poměru jejich efektu na příštítná tělíska a na zažívací trakt. Tento poměr je výrazně příznivější pro parikalcitol a riziko hyperkalcemie či hyperfosfatemie je významně nižší.
Kalcitriol (originální přípravek Rocaltrol, tobolky 0,25 µg nebo 0,50 µg; v ČR existuje 1 generikum) byl poprvé použit v perorální formě k léčbě SHPT u hemodialyzovaných pacientů v polovině 80. let minulého století. Limitem však byla hyperkalcemie a hyperfosfatemie. Slatopolsky použil v roce 1984 poprvé parenterální intermitentní podání kalcitriolu, kdy pokles parathormonu nastal dříve, než se zvýšila kalcemie. I tento postup byl, byť v menší míře, limitován pozdější hyperkalcemií i hyperfosfatemií [43].
Jak bylo uvedeno, syntetická analoga vitaminu D, resp. syntetické aktivátory VDR mají mnohem menší riziko hyperkalcemie a hyperfosfatemie. Mají modifikovanou základní molekulu (proto se nejedná o metabolity, ale o analoga), avšak hydroxylace prvního uhlíku zůstává. U nás je registrován jediný takovýto přípravek – parikalcitol (Zemplar). Pro parikalcitol ve srovnání s kalcitriolem platí, že při stejné míře suprese příštítných tělísek je efekt v zažívacím traktu třetinový. Parikalcitol je proto označován jako selektivní aktivátor VDR. Rozdíl v účinku však není pouze v efektu na zažívací trakt a příštítná tělíska, ale je mnohem složitější a zahrnuje i např. rozdílný efekt parikalcitolu na expresi některých genů (experimentálně byl potvrzen rozdílný efekt parikalcitolu a kalcitriolu na expresi genů v buňkách hladké svaloviny cév) [44].
Donedávna byl parikalcitol dostupný pro parenterální aplikaci a byl (resp. dosud je) využíván k léčbě sekundární hyperparatyreózy dialyzovaných pacientů [45,46]. Intravenózní aplikace je u těchto pacientů jednoduchá, využívá mimotělní okruh (návratovou hadičku krevní cesty), neboli se nejedná o vpich do žíly.
V nedávné době byla zaregistrována i perorální forma parikalcitolu, určená k léčbě sekundární hyperparatyreózy nejen u hemodialyzovaných pacientů, ale i u pacientů v peritoneálním dialyzačním programu [47] a u dosud nedialyzovaných pacientů (u kterých by byla intravenózní aplikace podstatně komplikovanější, než u hemodialyzovaných) [48].
Tab. 2 uvádí přehled přípravků využívaných k aktivaci VDR u nefrologických pacientů.
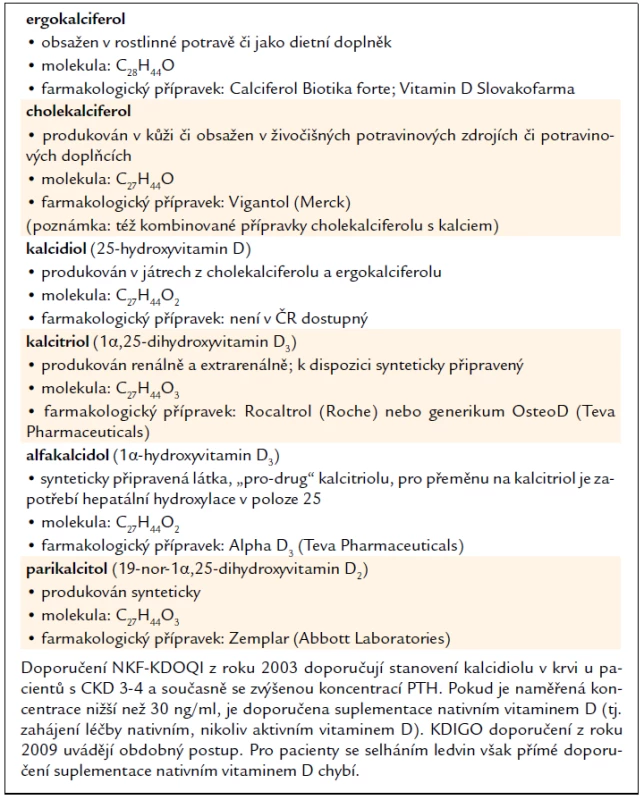
Vybrané publikace dokumentující efekt aktivace VDR při chronickém onemocnění či selhání ledvin
V současné době existují stovky prací, jejichž tématem jsou nejrůznější aspekty aktivace VDR v nefrologii. Intenzivně se experimentálně ověřuje účinek v jednotlivých tkáních a odvozují se možnosti klinické aplikace. Na zvířecích modelech se dále studuje nefroprotektivita i kardioprotektivita a hledají se i mechanizmy, které jsou za zjištěné efekty zodpovědné [49]. Dále se ověřuje, zda rozdílné postupy aktivace VDR (výběr přípravku, dávkovací schéma) mají srovnatelné či odlišné efekty, a to jak v experimentálních modelech, tak i v klinické praxi.
Níže uvádíme vybrané publikace výhradně s klinickým zaměřením (experimentální práce uvedeny nejsou). Jsou rozděleny do 3 okruhů: výskyt deficitu vitaminu D u pacientů s CKD, klinický význam a možnosti úpravy; vztah mezi aktivací VDR a prognózou dialyzovaných pacientů a recentní literární práce dokumentující účinky selektivního aktivátoru VDR v léčbě SHPT, ale i v jiných klinických situacích.
Deficit nativního vitaminu D u pacientů s CKD – výskyt, klinický význam a možnosti úpravy
V obecné populaci je deficit vitaminu D (= hladina kalcidiolu v krvi nižší než 20 µg/l, resp. 50 nmol/l) uváděn přibližně u 20–50 % osob, u CKD až u 70–80 % osob [12].
Již dokument KDOQI upozorňuje na častý nedostatek nativního vitaminu D u pacientů s CKD [17]. Rovněž KDIGO iniciativa doporučuje monitorovat a doplňovat nativní vitamin D, i když s určitou opatrností, neboť tzv. „tvrdá“ data (dokumentující efekt na mortalitu či morbiditu) v době přípravy dokumentu nebyla k dispozici [18].
S nízkými hladinami vitaminu D u pacientů s CKD je v řadě studií zjišťována asociace nejen s celkovou mortalitou, ale s klinickými komplikacemi, ať již kardiovaskulárními (mj. vyšší stupeň kalcifikace cévní stěny) či kostními (vyšší riziko fraktur). Je dokonce zmiňována i rychlejší progrese zániku funkce ledvin. Přehledně jsou tato data uvedena v letošní práci Nigwekara [12].
Podle SI nomenklatury jsou koncentrace látek uváděny v molárních jednotkách. Tomu odpovídá vyjádření koncentrace kalcidiolu v nmol/l. Níže uvedené publikace však používají vyjádření v ng/ml, a aby nedošlo k nepřesné interpretaci, ponecháváme literární zdroje bez úpravy. Koeficient přepočtu z ng/ml na nmol/l pro kalcidiol je 2,5; pro přepočet z nmol/l na ng/ml se použije koeficient 0,4.
Nová data registru NECOSAD (Nederland Cooperative on the Adequacy of Dialysis; detailně a dlouhodobě zpracovávaný prospektivní registr dialyzovaných pacientů v Nizozemsku) ukazují, že nízké koncentrace kalcidiolu u dialyzovaných pacientů jsou spojeny s horší prognózou. Z dat tohoto registru byli vybráni ti pacienti, u kterých byla v 1. roce dialyzační léčby stanovena hladina kalcidiolu (762 osob, průměrný věk 59 let, hladina 25D v krvi 18 ± 11 ng/ml). Tito pacienti pak byli prospektivně sledováni. Statistická analýza, korigovaná na možné ovlivňující jiné faktory, zjistila dvojnásobné riziko krátkodobé mortality pacientů s hladinami 25D nižšími či rovnými 10 ng/ml ve srovnání s pacienty s hladinami kalcidiolu vyššími než 10 ng/ml. Dlouhodobé riziko mortality bylo vyšší o polovinu. Výsledky dokumentují souvislost mezi nízkými hladinami vitaminu D u dialyzovaných pacientů a celkovým i kardiovaskulárním rizikem úmrtí, avšak pochopitelně z nich nelze odvodit, že tato souvislost znamená kauzalitu [50].
Data NECOSAD potvrzují nálezy Wolfa z roku 2007 [51]. V této průřezové studii sledující 825 konsekutivních incidentních (tj. nově zařazených do HD programu) hemodialyzovaných pacientů zjistili u 78 % hladiny vitaminu D nižší než 30 µg/l (75 nmol/l) a závažný deficit (hladiny nižší než 10 µg/l, tj. 25 nmol/l) v 18 %, což znamená, že jen u 4 % pacientů byly hladiny vitaminu D vyhovující.
Vliv dlouhodobého (12 měsíců) podávání cholekalciferolu na parametry fosfokalciového metabolizmu u pacientů s CKD 2–4 sledovali i slovenští autoři [52]. Srovnávali 2 dávkovací schémata – 5 000 vs 20 000 IU vitaminu D3 týdně. Vstupně mělo 83 % pacientů deficit či nedostatek vitaminu D. Zlepšení bylo více patrné při vyšší suplementační dávce, přitom koncentrace kalcia v séru nebyla rozdílná.
I v našich podmínkách je deficit vitaminu D u pacientů s onemocněním či selháním ledvin častý. Sami jsme zjistili v souboru 118 osob s CKD 3–4 průměrnou koncentraci kalcidiolu 15,5 µg/l (39 nmol/l) a v souboru 66 hemodialyzovaných pacientů dokonce průměrnou koncentraci 11,7 µg/l, tj. 29 nmol/l [53].
V poslední době se věnuje velká pozornost suplementaci nativního vitaminu D i při selhání ledvin. Pro ilustraci uvádíme výsledky studie, která sledovala hladiny kalcidiolu u chronicky hemodialyzovaných pacientů v randomizovaném dvojitě zaslepeném a placebem kontrolovaném designu [39]. Střední hodnota (median) vstupních koncentrací kalcidiolu v krvi v intervenované skupině byla 13,3 ng/ml (mezikvartilové rozmezí 11,1–16,2 ng/ml). Při suplementaci (10 000 j. cholekalciferolu 1krát týdně per os, celkem 15 týdnů) se významně zvýšila. Střední hodnota dosáhla 23,6 ng/ml (19,2–29,9 ng/ml) a u většiny pacientů byla koncentrace vyšší než 20 ng/ml. Naproti tomu v placebem kontrolované skupině nenastaly žádné změny. Vstupní koncentrace kalcidiolu byla 15,2 ng/ml a dále se nezvýšila. To ukazuje, že nízké koncentrace kalcidiolu lze u dialyzovaných pacientů upravit cílenou suplementací nativního vitaminu D. Podle autorů je takováto suplementace bezpečná, neboť nezaznamenali žádnou epizodu hyperkalcemie či hyperfosfatemie. Extrarenální konverzi kalcidiolu na kalcitriol i u hemodialyzovaných pacientů potvrdily v této studii zvyšující se sérové koncentrace nejen kalcidiolu, ale i kalcitriolu.
V praxi našich hemodialyzačních středisek se v současnosti často používá suplementace 1–2 kapky Vigantolu denně, což je postup srovnatelný s citovanou publikací.
Publikace z letošního roku shrnuje 5 dosud provedených placebem kontrolovaných randomizovaných studií na téma suplementace vitaminu D u pacientů s CKD. Vesměs ukázaly zvýšení hladin kalcidiolu, i když dávkovací schémata byla různá [41].
Pro úplnost uvádíme, že pro doplnění zásob vitaminu D je vhodnější cholekalciferol než ergokalciferol. Pro pacienty s CKD je cholekalciferol vhodnější i z hlediska dostupných lékových forem (viz tab. 2).
Vliv aktivace VDR na prognózu dialyzovaných pacientů a pacientů s CKD
V nefrologii je v současné době velmi žhavě diskutováno, komu vlastně vitamin D (resp. aktivátory VDR) podávat. Jedinou dosud schválenou indikací v nefrologii zůstává sekundární hyperparatyreóza (resp. renální osteodystrofie). Velkou pozornost v nefrologii však vzbudily práce, které dokumentují, že pacienti léčení aktivátory VDR mají lepší prognózu ve srovnání s těmi, kteří aktivátory VDR nedostávají.
Jedna z prvních informací pochází z roku 2003 a byla dokonce publikována v NEJM. Další velmi významná práce je z roku 2005 [54,55]. Obě tyto práce jsou dosud často citovány a jejich závěry lze shrnout takto: pacienti, kterým byl podáván injekční aktivátor VDR, měli lepší prognózu. Přitom platí, že kalcitriol je výhodnější než žádná aktivace VDR; avšak parikalcitol je výhodnější než kalcitriol.
Literárních informací, které tyto závěry potvrzují, a to nejen u dialyzovaných pacientů, ale i při CKD, je celá řada [56–58]. Mají i oporu s daty mnoha experimentálních studií [34,35], která dokumentují kardioprotektivní a nefroprotektivní efekt aktivátorů VDR (zejména selektivních). Limitem pro interpretaci dat je však neexistence prospektivních kontrolovaných studií. Prakticky všechny klinické doklady se opírají o retrospektivní, resp. historické analýzy, byť s dostatečně velkými soubory, s dostatečně dlouhou dobou sledování a i s robustními statistickými postupy.
Dosud publikované epidemiologické a klinické studie shrnuli Kalantar-Zadeh a Kovesdy v roce 2009 [59] a Melamed a Thadhani v roce 2012 [60]. V obou případech autoři uzavírají, že vitamin D, resp. aktivátory VDR jsou pro nefrologické pacienty velmi důležité. Neexistuje jediná práce, která by zjistila, že při podávání aktivátorů VDR by byla prognóza pacientů ovlivněna nepříznivě. Téma zůstává otevřené a intenzivní výzkumy pokračují.
Důležitou systémovou roli aktivace VDR potvrzují stále nové práce. V letošním roce byla uveřejněna rozsáhlá prospektivní italská studie, která dokumentuje příznivý prognostický efekt aktivace VDR u dialyzovaných pacientů dokonce při nízkých koncentracích PTH. Studie má název FARO. Probíhala ve 28 centrech po dobu 2 let a zahrnula celkem 2 453 chronicky hemodialyzovaných pacientů. V podskupině s nízkou koncentrací PTH (do 150 pg/ml) bylo riziko mortality nižší u těch, kteří byli léčeni aktivátory VDR, než u těch, kteří aktivátory VDR nedostávali (pokles rizika o 38 % při léčbě kalcitriolem a dokonce o 82 % při léčbě parikalcitolem) [61].
Selektivní aktivace VDR v nefrologii – vybrané klinické studie
Parikalcitol je selektivní aktivátor VDR, využívaný v současné době výhradně v nefrologii. Schválenou konkrétní indikací je prevence a léčba sekundární hyperparatyreózy u dialyzovaných pacientů a nově i u osob s CKD dosud bez nutnosti dialýzy (včetně pacientů po transplantaci ledviny). V posledních letech však byly publikovány významné studie zaměřené na možné aditivní příznivé účinky selektivní aktivace VDR.
Jedna z nich je studie VITAL [37]. Teoretickým podkladem byly experimentální poznatky o snížení proteinurie vlivem aktivace VDR. Studie byla koncipována jako multicentrická, placebem kontrolovaná, dvojitě zaslepená studie u subjektů s diabetickou nefropatií (DM 2. typu s albuminurií) již léčených stabilní dávkou ACEI//ARB. Léčebná fáze studie VITAL trvala 24 týdnů, kdy pacientům bylo podáváno placebo, parikacitol 1 µg nebo 2 µg/den. Primárním cílem byla změna albuminurie od vstupní hodnoty po konečnou hodnotu [vyjádření albuminurie jako geometrický průměr UACR (poměr albuminu ku kreatininu v moči)] pro parikalcitol vs placebo. Celkem bylo zařazeno 281 pacientů. Změna UACR v placebem kontrolované skupině byla –3 %, zatímco v intervenované kombinované skupině nastal pokles o 16 %. Při dávce 2 µg parikalcitolu denně byl pokles výraznější, a to v rozmezí 18–28 % (průměrný pokles 20 % na konci léčebné fáze byl statisticky významný oproti placebu). Závěr z klinické studie VITAL je, že přidání parikalcitolu 2 µg denně k inhibitoru RAAS bezpečně snižuje albuminurii u pacientů s DM 2. typu a nefropatií a může být novou možností snižování renálního rizika u diabetiků.
Jen ojedinělé práce se zabývají vzájemným srovnáním nativního vitaminu D (určeného primárně k suplementaci deficitu vitaminu D v organizmu) a selektivního aktivátoru VDR (cíleně určeného k supresi příštítných tělísek). U pacientů s CKD stadia 3–4 s deficitem vitaminu D a se sekundární hyperparatyreózou byla provedena a nedávno publikována randomizovaná studie srovnávající ergokalciferol (50 000 j., titrovaných k dosažení hladiny kalcidiolu 30 ng/ml) a parikalcitol (1 či 2 µg denně). Primárního cíle, tj. opakovaného poklesu koncentrace PTH nejméně o 30 %, bylo dosaženo u 53 % pacientů léčených parikalcitolem, avšak jen u 18 % léčených ergokalciferolem. Pokles PTH u pacientů, kterým byl podáván ergokalciferol, byl nesignifikantní. Podle očekávání je parikalcitol efektivnější v léčbě sekundární hyperparatyreózy u pacientů s CKD [62].
Rovněž studie IMPACT, která byla publikována v letošním roce, byla zaměřena na léčbu sekundární hyperparatyreózy. Nesrovnávala však dva aktivátory VDR, ale dva odlišné režimy léčby sekundární hyperparatyreózy (parikalcitol s ev. doplněním kalcimimetika při hyperkalcemii; kalcimimetikum s malými dávkami vitaminu D). Je známo, že obě skupiny léků (parikalcitol jako selektivní aktivátor VDR a kalcimimetikum jako modulátor citlivosti kalcium-senzing receptoru na extracelulární koncentraci kalcia) jsou cíleny na potlačení hyperaktivity příštítných tělísek a oba léky jsou v této indikaci registrovány.
Z patofyziologického pohledu je jisté, že souběžná aktivace VDR spolu se zajištěním stimulace CaR je z hlediska prevence i léčby optimální strategií. Tento princip je však možné realizovat různými způsoby, které se mohou lišit v důrazu na jeden aspekt (aktivace VDR či zvýšení citlivosti CaR) i v konkrétním dávkovacím schématu.
Celkem byly sestaveny 4 podskupiny (2 základní strategie, s dalším rozlišením podle způsobu aplikace parikalcitolu – intravenózní vs perorální). Randomizováno bylo 272 osob, z nich 268 obdrželo alespoň 1 léčebnou dávku. Primárním cílem bylo srovnání zastoupení (proporce) subjektů, které v období týdne 21–28 dosáhnou koncentraci PTH 150–300 pg/ml.
V intravenózním léčebném režimu bylo primárního cíle dosaženo u 58 % pacientů léčených parikalcitolem oproti 33 % pacientů léčených kalcimimetiky (rozdíl je statisticky signifikantní).
U perorální léčby byly výsledky nesignifikantní (54 % parikalcitol, 43 % cinacalcet). Výskyt hyperkalcemie u pacientů léčených parikalcitolem byl nízký. Pouze 8 pacientů potřebovalo cinacalcet k úpravě hyperkalcemie. U pacientů léčených cinacalcetem a malými dávkami vitaminu D byl vysoký výskyt hypokalcemií (u 47 %, resp. 55 % pacientů). Ve studii IMPACT byly sledovány i kostní parametry (alkalická fosfatáza – ALP; alkalická fosfatáza specifická pro kost – bsALP) a výsledky jsou velice zajímavé. U pacientů léčených parikalcitolem došlo k poklesu ALP i bsALP, naproti tomu u pacientů léčených cinacalcetem s malými dávkami vitaminu došlo k nárůstu obou parametrů.
Autoři uzavírají, že parikalcitol s případným doplněním kalcimimetika při hyperkalcemii poskytuje výhodnější léčebný postup než léčba založená na kalcimimetiku s malými dávkami vitaminu D [63,64].
Nově byla metodou metaanalýzy vyhodnocena účinnost a bezpečnost parikalcitolu [65]. Podkladem bylo celkem 9 randomizovaných kontrolovaných klinických studií (nikoliv studií retrospektivních, neintervenčních, resp. observačních) sledujících efekt parikalcitolu v porovnání s placebem v léčbě sekundární hyperparatyreózy a dále efekt parikalcitolu na proteinurii, obojí u pacientů stadia CKD 2–5 (celkem 832 pacientů).
Podle očekávání byl parikalcitol v porovnání s placebem mnohem účinnější (více než 6krát) v léčbě sekundární hyperparatyreózy. I redukce proteinurie byla signifikantní (o 60 % více při léčbě parikalcitolem). Stejně jako u mnoha dalších přehledných publikací či v souhrnných analýzách, i zde autoři uzavírají, že pro další zpřesnění léčebné strategie jsou zapotřebí kontrolované randomizované studie, které by určily, zda opravdu léčba parikalcitolem sníží progresi nemocí ledvin do konečného stadia selhání ledvin a zda sníží mortalitu pacientů s onemocněním ledvin.
Podpořeno projektem Ministerstva zdravotnictví rozvoje výzkumné organizace 00023001 (IKEM) – Institucionální podpora a Výzkumným záměrem MSM 0021620819.
Prof. MUDr. Sylvie Dusilová Sulková, DrSc., MBA
www.fnhk.cz/dial
e-mail: sulkovas@volny.cz
Doručeno do redakce: 12. 9. 2012
Přijato po recenzi: 19. 9. 2012
Zdroje
1. Vitamin D (příloha). Vnitř Lék 2012; 58: 378–416.
2. Dusilová Sulková S et al. Renální osteopatie. Praha: Maxdorf Jessenius, 2007.
3. Dusilová Sulková S. Kostní choroba při selhání ledvin a její moderní terapie. Vnitř Lék 2011; 57: 620–625.
4. Rodriguez M, Lorenzo V. Parathyroid hormone, a uremic toxin. Semin Dial 2009; 22: 363–368.
5. Go AS, Chertow GM, Fan D et al. Chronic kidney disease and the risk of death, cardiovascular events and hospitalization. N Engl J Med 2004; 351: 1296–1305.
6. Panichi V, Bigazzi R, Paoletti S et al. (RISCAVID Study Group) Impact of calcium, phosphate, PTH abnormalities and management on mortality in hemodialysis: results from the RISCAVID study. J Nephrol 2010; 23: 556–562.
7. LaClair RE, Hellman RN, Karp SL et al. Prevalence of calcidiol deficiency in CKD: a cross-sectional study across latitudes in United States. Am J Kidney Dis 2005; 45: 1026–1033.
8. Levin A, Bakris GL, Molitch M et al. Prevalence of abnormal serum vitamin D, PTH, calcium, and phosphorus in patients with chronic kidney disease: results of the study to evaluate early kidney disease. Kidney Int 2007; 71: 31–38.
9. Jean G, Charra B, Chazot C. Vitamin D deficiency and associated factors in hemodialysis patients. J Ren Nutr 2008; 18: 395–399.
10. Ewers B, Gasbjerg A, Mølgaard Ch et al. Vitamin D status in kidney transplant patients: need for intensified routine supplementation. Am J Clin Nutr 2008; 87: 431–437.
11. Holick MF. Vitamin D deficiency. N Engl J Med 2007; 357: 266–281.
12. Nigwekar SU, Bhan I, Thadhani R. Ergocalciferol and cholecalciferol in CKD. Am J Kidney Dis 2012; 60: 139–156.
13. Ala-Houhala MJ, Vahavihu K, Hasan T. Narrow-band ultraviolet B exposure increases serum vitamin D levels in haemodialysis patients. Nephrol Dial Transplant 2012; 27: 2435–2440.
14. Michaud J, Naud J, Quimet D et al. Reduced hepatic synthesis of calcidiol in uremia. J Am Soc Nephrol 2011; 21: 1488–1497.
15. Dusso AS. Kidney disease and vitamin D levels: 25-hydroxyvitamin D, 1,25-dihydroxyvitamin D and VDR activation. Kidney Int 2011; 79: (Suppl. 1): 136–141.
16. Dusso AS, Tokumoto M. Defective renal maintenance of the vitamin D endocrine system impairs vitamin D renoprotection: a downeard spiral in kidney disease. Kidney Int 2011; 79: 715–729.
17. National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003; 42: (Suppl. 3): S1–S201.
18. Kidney Disease Improving Global Outcomes (KDIGO) CKD-MBD work group KDIGO clinical practice guideline for the diagnosis, evaluation, prevention and treatment of chronic kidney disease – mineral bone disorder (CKD-MBD). Kidney Int 2009; 76: (Suppl. 113): S1–S130.
19. Dusso AS, Brown AJ, Slatopolsky E. Vitamin D. Am J Physiol Renal Physiol 2005; 289: F8–F28.
20. Prie D, Friedlander G. Reciprocal control of 1,25-dihydroxyvitamin D and FGF-23 formation involving the FGF-23/Klotho system Clin J Am Soc Nephrol 2010; 5: 1717–1722.
21. Dusilová Sulková S, Kalousová M. Fibroblastový růstový faktor 23 (FGF-23, fibroblast growth factor 23) je molekulou s velkým významem pro klinickou, dialyzační i transplantační nefrologii – základní přehled současných poznatků. Aktuality v nefrologii 2011; 17: 17–22.
22. Sochorová K, Budinský V, Rožková D et al. Paricalcitol (19-nor-1,25dihydroxyvitamin D2) and calcitriol (1,25-dihydroxyvitamin D3) exert potent immunomodulatory effects on dendritic cells and inhibit induction of antigen-specific T cells. Clin Immunol 2009; 133: 69–77.
23. Patel T, Singh AK. Role of vitamin D in chronic kidney disease. Semin Nephrol 2009; 29: 113–121.
24. Andress DL. Vitamin D in chronic kidney disease: a systemic role for selective vitamin D receptor activation. Kidney Int 2006; 69: 33–43.
25. Bosworth CR, Levin G, Robinson-Cohen C et al. The serum 24,25-dihydroxyvitamin D concentration, a marker of vitamin D catabolism, is reduced in chronic kidney disease. Kidney Int 2012; doi:10.1038/ki.2012.193.
26. Lee CT, Ng HY, Lien YH et al. Effects of cyclosporine, tacrolimus and rapamycin on renal calcium transport and vitamin D metabolism. Am J Nephrol 2011; 34: 87–94.
27. Brown AJ, Coyne DV. Bioavailable vitamin D in chronic kidney disease. Kidney Int 2012; 82: 5–7.
28. Bhan I, Powe CE, Berg AH et al. Bioavailable vitamin D is more tightly linked to mineral metabolism than total vitamin D in incident hemodialysis patients. Kidney Int 2012; 82: 84–89.
29. London GM, Guerin AP, Marchais SJ et al. Arterial media calcification in end-stage renal disease: impact on all-cause and cardiovascular mortality. Nephrol Dial Transplant 2003; 18: 1731–1740.
30. Mizobuchi M, Towler D, Slatopolsky E. Vascular calcification: The killer of patients with chronic kidney disease. J Am Soc Nephrol 2009; 20: 1453–1464.
31. Rodriguez M, Martinez-Moreno JM, Rodriguez-Ortiz ME. Vitamin D and vascular calcification in chronic kidney disease. Kidney Blood Press Res 2011; 34: 261–268.
32. Garcia-Canton C, Bosch E, Ramirez A et al. Vascular calcification and 25-hydroxyvitamin D in non-dialysis patients with chronic kidney disease stages 4 and 5. Nephrol Dial Transplant 2011; 26: 2250–2256.
33. Thadhani R, Appelbaum E, Pritchett Y et al. Vitamin D therapy and cardiac structure and function in patients with chronic kidney disease: the PRIMO randomized controlled trial. J Am Med Assoc 2012; 307: 674–684.
34. Alborzi P, Patel NA, Peterson C et al. Paricalcitol reduces albuminuria and inflammation in chronic kidney disease: a randomized double--blind pilot trial. Hypertension 2008; 52: 249–255.
35. Agarwal R. Vitamin D, proteinuria, diabetic nephropathy and progression of CKD. Clin J Am Soc Nephrol 2009; 4: 1523–1528.
36. Liu LJ, Lv JC, Shi SF et al. Oral calcitriol for reduction of proteinuria in patients with IgA nephropathy: a randomized controlled trial. Am J Kidney Dis 2012; 59: 67–74.
37. de Zeeuw D, Agarwal R, Amdahl M et al. Selective vitamin D receptor activation with paricalcitol for reduction of albuminuria in patients with type 2 diabetes (VITAL study): a randomized controlled trial. Lancet 2010; 376: 1543–1551.
38. Courbebaisse M, Souberbielle JC, Thervet E. Potential nonclassical effects of vitamin D in transplant recipients. Transplantation 2010; 89: 131–137.
39. Armas LAG, Andukuri R, Barger-Lux J et al. 25-hydroxyvitamin D response to cholekalciferol supplementation in hemodialysis. Clin J Am Soc Nephrol 2012; T: 1428-1434.
40. Cunningham J. Supplemental vitamin D: will do no harm and might do good. Nature Rev Nephrol 2009; 5: 614–615.
41. Kandula P, Dobre M, Schold JD et al. Vitamin D supplementation in chronic kidney disease: A systematic review and meta-analysis of observational studies and randomized controlled trials. Clin J Am Soc Nephrol 2011; 6: 50–62.
42. Jones G. Why Dialysis Patients Need Combination Therapy with Both Cholecalciferol and A Calcitriol Analogs. Semin Dial 2010; 23: 239–243.
43. Slatopolsky E, Weerts C, Thielan J et al. Marked suppression of secondary hyperparathyroidism by intravenous administration of 1,25-dihydroxycholecalciferol in uremic patients. J Clin Invest 1984; 74: 2136–2143.
44. Wu-Wong JR, Nakane M, Ma J et al. Effects of Vitamin D analogs on gene expression profiling in human coronary artery smooth muscle cells. Atherosclerosis 2006; 186: 20–28.
45. Martin JK, Gonzalez E, Lindgerg JS et al. Paricalcitol dosing according to body weight or severity of hyperparathyroidism: a double-blind, multicenter, randomized study. Am J Kidney Dis 2001; 38: (Supp. 5): S57–S63.
46. Cozzolino M, Brancaccio D. Emerging role for the vitamin D receptor activator (VDRA), paricalcitol, in the treatment of secondary hyperparathyroidism. Expert Opin Pharmacother 2008; 9: 947–954.
47. Ross EA, Tian J, Abboud H et al. Oral paricalcitol for the treatment of secondary hyperparathyroidism in patients on hemodialysis or peritoneal dialysis. Am J Nephrol 2008; 28: 97–106.
48. Coyne D, Acharva M, Qiu P et al. Paricalcitol capsule for the treatment of secondary hyperparathyroidism in stages 3 and 4 CKD. Am J Kidney Dis 2006; 47: 263–276.
49. Li YC. Vitamin D: roles in renal and cardiovascular protection. Curr Opin Nephrol Hypertens 2012; 21: 72–79.
50. Drechsler C, Verduijn M, Pilz S et al. Vitamin D status and clinical outcomes in incident dialysis patients: results from the NECOSAD study. Nephrol Dial Transplant 2011; 26: 1024–1032.
51. Wolf M, Shah A, Gutierrez O et al. Vitamin D levels and early mortality among incident hemodialysis patients. Kidney Int 2007; 72: 1004–1013.
52. Oksa A, Spustová V, Krivosíková Z et al. Effects of long-term cholecalciferol supplementation on mineral metabolism and calciotropic hormones in chronic kidney disease. Kidney Blood Press Res 2008; 31: 322–329.
53. Sulková S, Fořtová M, Uhrová J et al. Význam stanovení metabolitů vitaminu D u pacientů se sníženou funkcí ledvin. Vnitř Lék 2004; 50: 510–518.
54. Teng M, Wolf M, Lowrie E et al. Survival of patients undergoing hemodialysis with paricalcitol or calcitriol therapy. N Engl J Med 2003; 349: 446–456.
55. Teng M, Wolf M, Ofsthun MN et al. Activated injectable vitamin D and hemodialysis survival: a historical cohort study. J Am Soc Nephrol 2005; 16: 1115–1125.
56. Kovesdy CP. Survival benefits with vitamin D receptor activation: New insights since 2003. Clin J Am Soc Nephrol 2010; 5: 1704–1709.
57. Naves-Díaz M, Alvarez-Hernández D, Passlick-Deetjen J et al. Oral active vitamin D is associated with improved survival in hemodialysis patients. Kidney Int 2008; 74: 1070–1078.
58. Shoben AB, Rudser KD, de Boer IH et al. Association of oral calcitriol with improved survival in nondialyzed CKD. J Am Soc Nephrol 2008; 19: 1613–1619.
59. Kalantar-Zadeh K, Kovesdy CP Clinical outcomes with active versus nutritional vitamin D compounds in chronic kidney disease. Clin J Am Soc Nephrol 2009; 4: 1529–1539.
60. Melamed ML, Thadhani RI. Vitamin D therapy in chronic kidney disease and end stage renal disease. Clin J Am Soc Nephrol 2012; 7: 358–365.
61. Cozzolino M, Brancaccio D, Cannella G et al. VDRA therapy is associated with improved survival in dialysis patients with serum intact PTH <=150 pg/mL: results of the Italian FARO Survey. Nephrol Dial Transplant 2012; 27:3588-3594.
62. Kovesdy CP, Lu JL, Malakuaskas S et al. Paricalcitol versus ergocalciferol for secondary hyperparathyroidism in CKD stages 3 and 4: A randomized controlled trial. Am J Kidney Dis 2012; 59: 58–66.
63. Ketteler M, Martin KJ, Cozzolino M et al. Paricalcitol versus cinacalcet plus low-dose vitamin D for the treatment of secondary hyperparathyroidism in patients receiving haemodialysis: study design and baseline characteristics of the IMPACT SHPT study. Nephrol Dial Transplant 2012; doi:10.1093/ndt/gfr531.
64. Ketteler M, Martin KJ, Wolf M et al. Paricalcitol versus cinacalcet plus low-dose vitamin D therapy for the treatment of secondary hyperparathyroidism in patients receiving haemodialysis: Results of the IMPACT SHPT study. Nephrol Dial Transpant 2012; 27: 1942-1949.
65. Cheng J, Zhang W, Zhang X et al. Efficacy and safety of paricalcitol therapy for chronic kidney disease: A meta-analysis. Clin J Am Soc Nephrol 2012; 7: 391–400.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Vnitřní lékařství

2012 Číslo 11
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S profesorem Vladimírem Tesařem o léčbě CKD dle aktuálních doporučení: praktický lékař jako klíč k renoprotekci
- Porovnání empagliflozinu a dapagliflozinu v léčbě srdečního selhání
- Jak souvisí index systémového zánětu s kardiovaskulární mortalitou pacientů s hypertenzí?
Nejčtenější v tomto čísle
- Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
- Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta
- Karcinoid a jeho kardiální manifestace
