-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
Hypercalcemia, symptoms, differential diagnostics and treatment, or importance of calcium investigation
The concentration of calcium is carefully maintained under physiological conditions with parathormone, calcitonin and 1,25-dihydroxyvitamin D at appropriate levels. There are multiple causes that may bring about increased concentrations of calcium which exceed physiological values. Increased production of parathormone in parathyroid glands is only one of the possible causes. Malignant diseases are a very frequent cause of hypercalcemia, due to their creating mediators which stimulate osteoclasts and thereby osteolysis. A less frequent cause is represented by granulomatous processes, a typical example of which is sarcoidosis, whose cells increasingly (independently of parathormone) hydroxylate 25-hydroxyvitamin D to 1,25-dihydroxyvitamin D. However there are also hereditary forms of hypercalcemia. One of the causes of the hereditary form of hypercalcemia is mutations of the calcium sensing receptor. In order to locate the adenoma of parathyroid glands, essential apart from sonographic imaging is scintigraphy 99mTc-methoxyisobutylisonitrile (MIBI) and even more exact is PET-CT examination with a radio-pharmaceutical 18F-fluorocholine. PET-CT examinations are beneficial with regard to detecting a malignant cause of hypercalcemia in until then undetected malignancy or an undetected granulomatous process. The essential treatment procedures for malignant hypercalcemia include appropriate hydratation of ionic solutions without calcium, administering of bisphosphonates or denosumab. The text describes in detail the symptoms of hypercalcemia and diagnostics of causes of hypercalcemia.
Key words:
bisphosphonates – cinacalcet – denosumab – granulomatous diseases – hereditary hypercalcemia – hypercalcemia – hypercalciuria – hyperparathyreosis – calcimimetics – calcitonin – multiple myeloma – malignant hypercalcemia – parathormone – sarcoidosis – 1,25-dihydroxyvitamin D
Autoři: Zdeněk Adam 1; Karel Starý 2; Jozef Kubinyi 3; Kateřina Zajíčková 4; Zdeněk Řehák 5; Renata Koukalová 5; Miroslav Tomíška 1; Martina Doubková 6; Jiří Prášek 7; Eva Pourová 8; Zdeňka Čermáková 9; Luděk Pour 1; Marta Krejčí 1; Viera Sandecká 1; Eva Ševčíková 9,10; Sabina Ševčíková 11; Zdeněk Král 1; Aleš Čermák 12
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 1; Endokrinologikcká ambulance Interní gastroenterologické kliniky LF MU a FN Brno, pracoviště Bohunice 2; Ústav nukleární medicíny 1. LF UK a VFN v Praze 3; Endokrinologický ústav, Praha 4; Oddělení nukleární medicíny, centrum PET, RECAMO, Masarykův onkologický ústav, Brno 5; Klinika nemocí plicních a tuberkulózy LF MU a FN Brno, pracoviště Bohunice 6; Klinika nukleární medicíny LF MU a FN Brno, pracoviště Bohunice 7; Ordinace praktického lékaře pro dospělé Pustiměř 8; Oddělení klinické biochemie FN Brno, pracoviště Bohunice 9; Katedra laboratorních metod LF MU, Brno 10; Ústav patologické fyziologie LF MU, Brno 11; Urologická klinika LF MU a FN Brno 12
Vyšlo v časopise: Vnitř Lék 2016; 62(5): 370-383
Kategorie: Přehledné referáty
Souhrn
Koncentrace kalcia je za fyziologických podmínek pečlivě udržována parathormonem, kalcitoninem a 1,25-dihydroxyvitaminem D v náležitých hodnotách. Existuje více příčin, které mohou způsobit zvýšení koncentrace kalcia nad fyziologické hodnoty. Zvýšená tvorba parathormonu v příštítných tělískách je pouze jednou z možných příčin. Velmi častou příčinou hyperkalcemie jsou maligní choroby, které tvoří působky stimulující osteoklasty, a tedy osteolýzu. Vzácnější příčinou jsou granulomatózní procesy, typickým zástupcem je sarkoidóza, při nichž buňky ve zvýšené míře (nezávisle na parathormonu) hydroxylují 25-hydroxyvitamin D na 1,25-dihydroxyvitamin D. Nicméně existují i hereditární formy hyperkalcemie. Jednou z příčin hereditární formy hyperkalcemie jsou mutace molekuly receptoru pro kalcium (calcium sensing receptor). Pro lokalizaci adenomu příštítných tělísek je vedle sonografického zobrazení zásadní scintigrafie 99mTc-metoxyizobutylizonitril (MIBI) a ještě přesnější je PET-CT vyšetření s radiofarmakem 18F-fluorocholinem. Pro odhalení maligní příčiny hyperkalcemie v zatím nepoznané malignitě nebo nepoznaném granulomatózním procesu je přínosné PET-CT vyšetření. Zásadními léčebnými postupy při nádorové hyperkalcemii je odpovídající hydratace iontovými roztoky bez kalcia, podávání bisfosfonátů anebo denosumabu. Text se podrobně věnuje příznakům hyperkalcemie a diagnostice příčin hyperkalcemie.
Klíčová slova:
bisfosfonáty – cinakalcet – denosumab – granulomatózní choroby – hereditární hyperkalcemie – hyperkalcemie – hyperkalciurie – hyperparatyreóza – kalcimimetika – kalcitonin – mnohočetný myelom – nádorová hyperkalcemie – parathormon – sarkoidóza – 1,25-dihydroxyvitamin DÚvod
Zvýšená hladina vápníku v séru často signalizuje přítomnost závažné choroby a způsobuje četné v textu popsané patologické projevy, a proto je vhodné stanovit hladinu vápníku při vyšetřování každého nejasného závažnějšího onemocnění a je vhodné jej vyšetřit i v rámci preventivních prohlídek. Cílem článku je zdůraznit, že vyšetření iontů neznamená vyšetřit pouze natrium, kalium a chloridy. K vzestupu hladiny vápníku v séru dochází v některých případech velmi pomalu (v případě primární hyperparatyreózy), a pak jsou zpočátku hodnoty kalcia jen nepatrně zvýšené, takže je dosti času, aby zvýšený odpad kalcia v moči způsobil nefrolitiázu a případně nefrokalcinózu. Naopak v případě nádorové hyperkalcemie je křivka vzestupu plazmatické koncentrace kalcia v čase podstatně strmější, takže již není dostatek času k vytvoření nefrolitiázy či urolitiázy.
Závažná hyperkalcemie způsobuje polyurii, poruchu pasáže zažívacím traktem, a tím nevolnost a zvracení, takže ztrátu vody polyurií nelze doplnit zvýšeným pitím. To způsobí poruchu funkce ledvin. Vyšší koncentrace kalcia způsobují nejčastěji zmatenost, ale důsledkem hyperkalcemie mohou být i jiné psychiatrické symptomy a kvalitativní či kvantitativní poruchy vědomí, takže kalcium by mělo být vyšetřeno i u pacientů s nově vzniklou psychiatrickou poruchou.
Příznaky, jako je nevolnost, zvracení, zmatenost, mají podstatně více možných příčin, než je hyperkalcemie, což vede k tomu, že rozpoznat příčinu potíží se nepodaří vždy při první návštěvě lékaře. Hyperkalcemie je jedním z typických příznaků mnohočetného myelomu [1], ale možných příčin je podstatně více. Proto v následujícím textu shrneme příčiny, projevy a léčbu hyperkalcemie.
Fyziologická homeostáza kalcia
Ionizované a celkové kalcium
Z celkového kalcia v těle je 99 % deponováno v hydroxyapatitu, který je základním kamenem pro tvorbu kostí a rezervoárem kalcia pro další tkáňové kompartmenty. Pouze malá část celkového kalcia je lokalizována v intracelulární a extracelulární tekutině. Udržování stabilní fyziologické koncentrace kalcia v těchto tekutinách je zásadní pro normální průběh akčních potenciálů ve svalových a nervových buňkách, pro svalovou kontrakci, pro exocytózu neurotransmiterů a hormonů, pro regulaci buněčného růstu, pro aktivaci koagulace. Koncentrací kalcia je regulována také aktivita četných enzymů [2].
Kalcium se v krvi vyskytuje ve 3 formách. Přibližně 50 % kalcia je vázáno na bílkoviny, dominantně na albumin. Malá část kalcia je vázána v komplexech citrátů a fosfátů. Zbylé množství (45–50 %) se v séru vyskytuje jako ionty Ca2+. A pouze toto ionizované kalcium je biologicky aktivní [2].
Dříve byly pro pacienty se zásadní odchylkou koncentrace celkové bílkoviny a albuminu používány vzorce pro přepočet hladiny vápníku na normální hladiny albuminu a celkové bílkoviny. Dnes je jednodušší vyšetřit ionizované kalcium u všech pacientů s abnormálními hodnotami albuminu anebo celkové bílkoviny.
Jedno z pravidel pro přepočet hladiny vápníku zní: „Na každých 10 g albuminu/l, chybějících do průměrné normální hladiny 40 g/l, je třeba přičíst 0,2 mmol/l Ca“ [3].
Poměr vázaného a ionizovaného kalcia souvisí s pH, při poklesu pH na nižší hodnoty (při acidóze) se zvyšuje koncentrace ionizovaného kalcia.
Regulační mechanizmy
Za fyziologických okolností je hladina ionizovaného kalcia udržována ve velmi úzkém rozmezí. Na regulaci se podílí parathormon (PTH), metabolity vitaminu D a kalcitonin. Tyto 3 zásadní fyziologické regulační faktory ovlivňují rychlost přestupu kalcia mezi kostí a extracelulární tekutinou, prostupy kalcia tubuly ledvin a mukózou trávicího traktu.
Množství kalcia vstřebaného trávicím traktem se pohybuje mezi 15–60 % množství přijatého potravou. Aktivní vstřebávání střevní mukózou je stimulováno 1,25-dihydroxyvitaminem D a nepřímo PTH vzhledem k jeho vlivu na metabolizmus vitaminu D [2].
Kalcium je v ledvině volně filtrováno v glomerulu, denně 8–10 g, ale většina vápníku (98 %) je vstřebána zpět, takže močí je vyloučeno 100–300 mg/24 hod, což odpovídá 2,5–7,5 mmol/24 hod.
Většina vápníku je vstřebána v proximálním tubulu v procesu spjatém se vstřebáváním sodíku, nezávisle na PTH, který stimuluje vstřebávání vápníku v distálním tubulu a současně inhibuje vstřebávání fosfátů.
Kosti neustále podléhají postupné přestavbě, asi 500 mg kalcia je denně z kosti uvolněno a na jiném místě uloženo. Jak PTH, tak 1,25-dihydroxyvitamin D stimulují resorpční pochody z kosti, zatímco kalcitonin inhibuje resorpci [2].
Parathormon
Jde o polypeptid obsahující 84 aminokyselin, je produkován buňkami příštítných tělísek a secernován v závislosti na koncentraci ionizovaného kalcia. Informace o koncentraci kalcia v okolním prostředí je přenášena do buňky receptorem pro kalcium (calcium sensing receptor). Při vzestupu kalcia v okolním prostředí se receptor pro kalcium aktivuje a potlačí tvorbu parathormonu.
Ten samý receptor je přítomný v parafolikulárních buňkách ve štítné žláze. Aktivace receptoru v buňkách tvořících kalcitonin zvýší jeho tvorbu.
Aktivace receptoru pro kalcium pak v tubulárních buňkách v ledvině sníží reabsorpci vápníku.
Mutace, které vedou k inaktivaci receptoru pro kalcium, způsobují hyperkalcemii s hypokalciurií. Tato nemoc je autozomálně dominantně dědičná [4,5].
Naopak mutace, které vedou ke zvýšené aktivitě receptoru pro kalcium, vedou k autozomálně dominantní hypokalcemii [6–8].
Laboratorní vyšetřování hyperkalcemie
Stanovení kalcia je dnes standardizovanou metodou a fyziologické hodnoty se udávají 2,15–2,55 mmol/l. Pro stanovení vápenatého kationtu je při odběru nutné zabránit nadměrnému zatažení paže manžetou, což může způsobit zvýšení hladiny vápníku o 0,12–0,25 mmol/l v důsledku vytlačení vody z cévního kompartmentu. Odebírá se srážlivá nebo nesrážlivá krev s přídavkem heparinátu litného. Je nutno zabránit kontaminaci vzorku cheláty, jako je EDTA nebo citrát, které jsou používány pro vyšetření krevního obrazu. EDTA či jiné cheláty na sebe pevně váží kalcium, což sníží hodnotu kalcia ve vyšetřovaném vzorku.
V rámci diferenciální diagnostiky hyperparatyreózy se často zdůrazňuje důležitost vyšetření odpadu kalcia za 24 hod močí. Pro stanovení kalcia ve sbírané moči je nutno brát vzorek z celého promíchaného množství a v laboratoři je nutno provést acidifikaci pro uvolnění vápníku z vazby. Je vhodné též stanovit kreatinin pro posouzení správnosti sběru moči. Problém stanovení kalcia v moči sbírané po 24 hod spočívá v obvykle nízké kvalitě (přesnosti) sběru. V praxi se nyní nepoužívá pro stanovení kalciurie standardní dieta. Referenční hodnoty kalciurie nejsou většinou udávány současně s údajem o dietě. Rozmezí kalciurie pro muže je 2,4–7,5 mmol/24 hod, pro ženy je horní referenční mez 6,2 mmol/l [9]. Za hyperkalciurii lze považovat zvýšený odpad vápníku nad referenční mez a současně je poměr kalcia a kreatininu v moči > 0,6. Při dietě s dostatečným množstvím kalcia by kalciurie neměla být < 2,0 mmol/24 hod [9].
K dalším parametrům, které se vyšetřují při diferenciální diagnostice hyperkalcemie, zmíníme koncentraci fosfátů v séru, aktivitu alkalické fosfatázy, 25-hydroxyvitamin D, případně 1,25-dihydroxyvitamin D a dále sbíranou moč za 24 hod a v ní nejen kalciurii, ale také poměr kalcia a kreatininu v moči.
Příznaky hyperkalcemie
Příznaky hyperkalcemie se odvíjejí od výše ionizovaného kalcia. Nádorové hyperkalcemie obvykle mají rychlý vzestup kalcemie v čase a s tím související rychlý nástup symptomů. Chronická hyperkalcemie provázející hyperparatyreózu má podstatně méně intenzivní příznaky. Pacienti s hyperparatyreózou a hyperkalcemií mají často i vyšší krevní tlak, který se normalizuje po odstranění nadprodukce parathormonu. A tak vyšetření kalcia patří ke standardním vyšetřením u všech osob s hypertenzí.
Ale nejen dehydratace, zvracení a selhání ledvin jsou příznaky hyperkalcemie. Zvýšená hladina kalcia způsobuje také různé poruchy funkce CNS, z nichž nejčastější je zmatenost. Proto by vyšetření hladiny kalcia mělo patřit ke standardu i při všech nově vzniklých psychiatrických odchylkách [10,11]. Klinické příznaky dle jednotlivých orgánů shrnuje tab. 1 [12].
Tab. 1. Příznaky hyperkalcemie [12,88] ![Příznaky hyperkalcemie [12,88]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7c10d3a91be532c3107ffa4439cc105e.jpg)
Přehled příčin hyperkalcemie
Hyperkalcemie je nejčastěji způsobena buď hyperparatyreózou nebo maligní chorobou, která nějakým způsobem zvyšuje hladinu kalcia. Ostatní příčiny, zmíněné v textu, jsou méně časté. Pro diferenciální diagnostiku je vhodné rozdělit hyperkalcemie na:
- hyperkalcemii se zvýšenou hodnotou parathormonu (PTH dependentní)
- hyperkalcemie s nezvýšenou hodnotou parathormonu (PTH independentní) [2,12]
Jednotlivé příčiny pak uvádí tab. 2.
Tab. 2. Přehled etiologie hyperkalcemie 
Primární hyperparatyreóza
Dříve bývala hyperparatyreóza diagnostikována až při závažném poškození organizmu, při nefrolitiáze či nefrokalcinóze, a tak panovala představa, že jde o nemoc velmi vzácnou. V posledních letech, v nichž je hladina kalcia vyšetřována rutinně v rámci laboratorního vyšetření indikovaného z jiných důvodů či z důvodů preventivních, tak většina případů hyperparatyreózy bývá diagnostikována zcela náhodně v době, kdy zvýšení kalcia a parathormonu je bezpříznakové. Mnozí pacienti nemají žádné příznaky či jejich příznaky jsou jen mírné a hladina kalcia zůstává stabilní po více let. K nespecifickým příznakům nezávažné hyperkalcemie patří deprese, bolesti svalů, svalová slabost, ale také zácpa, projevy nefrolitiázy, nefrokalcinózy a urolitiázy, nebo i kostní projevy. Příznaky jsou podobné, ale méně intenzivní než při nádorem indukované hyperkalcemii. Pacienti s hyperparatyreózou mají často vyšší krevní tlak, který se po úspěšné operaci sníží [13].
Broulík uvádí, že v 70. letech minulého století byla incidence hyperparatyreózy 8 nových případů/100 000 obyvatel, zatímco v současnosti se incidence zvýšila na 24 případů/100 000 obyvatel a je 4krát častější u žen než u mužů [14]. Příčina tohoto prudkého vzestupu není jasná, podílet se na ní bude možná častější vyšetřování kalcia v rámci preventivních vyšetření.
Z uvedených důvodů by rozhodnutí o léčbě mělo být opřeno o přítomnost komplikací způsobených primární hyperparatyreózou [13–17].
Rozlišují se následující stavy:
- primární hyperparatyreóza – primární odchylka s nadměrnou tvorbou PTH
- sekundární hyperparatyreóza – nadměrná tvorba parathormonu je odpovědí na nízkou koncentraci vápníku v těle, většinou u pacientů s nemocemi ledvin, příčinou mohou být i malabsorbční poruchy a další
- terciální hyperparatyreóza – chronická stimulace příštítných tělísek hypokalcemií u renální insuficience vede nakonec k autonomní hyperfunkci [18–20]
Existuje i normokalcemická nebo epizodická hyperparatyreóza. Léčba je identická, jen diagnostika je složitější. Přestože laboratorně se jedná o méně nápadné formy primární hyperparatyreózy, lze i u nich očekávat typické komplikace.
Morfologickým podkladem zvýšené tvorby PTH je v 80–90 % benigní adenom příštítného tělíska.
V 10–15 % jde o onemocnění více tělísek nebo o difuzní paratyreoidální hyperplazii.
V méně než 1 % jde o karcinom příštítných tělísek [18–20]. Zcela raritně je PTH produkován ektopicky, např. funkčními neuroendokrinními nádory pankreatu.
Obtížnou diferenciálně diagnostickou otázku pak představují hereditární formy [16,21–23].
Projevy primární hyperparatyreózy
Biochemicky prokazujeme hyperkalcemii a normofosfatemii nebo hypofosfatemii (v důsledku inhibice reabsorpce fosfátu v proximálním tubulu). Hodnota PTH je zvýšená, někdy jen mírně, někdy značně. Normální PTH při hyperkalcemii také může znamenat PTH podmíněnou hyperkalcemii. Neboli, je-li při hyperkalcemii hodnota PTH jiná než přiměřeně nízká, může jít o PTH podmíněnou hyperkalcemii.
Kalcium je ve zvýšené míře vylučováno močí – hypekalciurie obvykle > 400 mg/den, což odpovídá 10 mmol/24 hod, která diferencuje primární hyperparatyreózu od familiární hypokalciurické hyperkalcemie. S délkou trvání hyperfunkce příštítných tělísek se progresivně snižuje hodnota kostní hmoty měřené pomocí dvoufotonové denzitometrie (DEXA) a vzniká RTG obraz subperiostální resorpce s tvorbou hnědých tumorů nebo osteitis fibrosa, což svědčí o delším trvání onemocnění. Časté jsou fraktury obratlů či v oblasti kyčlí po neadekvátním traumatu nebo i zcela bez úrazového děje. Hyperkalcemie spolu s nadprodukcí 1,25 (OH)2D vytvářejí podmínky pro ukládání kalcia v ledvině, k tubulointersticiálnímu postižení nebo nefrolitiáze či urolitiáze. Hyperkalcemie u některých nemocných s primární hyperparatyreózou poškozuje tubulární funkce ledvin a způsobuje nefrogenní diabetes insipidus, a tedy polyurii [24]. Přibližně 5 % pacientů s ledvinnými kameny má diagnostikovanou hyperparatyreózu. Hyperkalcemie však může také indukovat žaludeční vředy a pankreatitidu [25,26] a v neposlední řadě zvyšuje krevní tlak v důsledku kalciem indukované vazokonstrikce [7,8,20].
Zobrazovací možnosti adenomu příštítného tělíska
Sonografické a scintigrafické vyšetření jsou základem pro zobrazení paratyreoideální tkáně nadměrně produkující parathormon.
Sonograficky lze zobrazit většinu příštítných adenomů. Správnost diagnózy můžeme v případě potřeby ověřit biochemickým vyšetřením punktátu.
Je nutné uvést, že „normální“ příštítné tělísko přiměřené velikosti a funkce nelze zobrazit zpravidla žádnou zobrazovací metodou, dokonce se nemusí nalézt ani při operačním výkonu. Proto se zobrazovacích metod využívá prakticky jenom k lokalizaci patologicky zvětšených nebo hyperfunkčních příštítných tělísek, nejedná se o diagnostické vyšetření příštítných tělísek v pravém slova smyslu. Zobrazení a lokalizace hyperprodukující paratyreoidální tkáně má hlavní význam pro chirurgický výkon. Přesná lokalizace (zejména ektopických adenomů příštítných tělísek) ovlivňuje zásadně úspěšnost operace a umožňuje v řadě případů provést jenom miniinvazivní výkon. Zobrazovací techniky jsou efektivní zejména na pracovištích, na nichž se provádí větší počet vyšetření a je zpětná vazba z operačních nálezů.
Standardem scintigrafického vyšetření je dnes zobrazení pomocí izonitrilů (scintigrafie 99mTc-methoxyizobutylizonitril – MIBI). Je to lipofilní kationt, který byl do klinické praxe zaveden koncem 80. let minulého století k vyšetření perfuze myokardu. Brzy byla zjištěna jeho akumulace v nejrůznějších maligních nádorech. Proto začal být využíván i v nespecifické onkologické diagnostice. Přesný mechanizmus akumulace v nádorech nebyl u radiofarmak značených 99mTc zatím zcela objasněn. MIBI je převážně akumulován v mitochondriích viabilních buněk a v cytoplazmě. Hlavním mechanizmem akumulace je pravděpodobně elektrostatická přitažlivost mezi kladným nábojem lipofilní molekuly MIBI a negativním nábojem v mitochondriích. 99mTc-MIBI je po nitrožilní aplikaci akumulován ve štítné žláze a v adenomech příštítných tělísek [27]. Ze štítné žlázy je poměrně rychle vyplavován, na rozdíl od příštítných tělísek, a tím se mění poměr aktivity. Vyšetření provádíme obvykle jako dvoufázovou scintigrafii (snímáme za 10 a 120 min po nitrožilní aplikaci asi 700–800 MBq 99mTc MIBI) s možností odečtu časných a pozdních snímků.
Senzitivita metody na pracovištích, která se touto problematikou zabývají, je udávána okolo 90 %, specificita okolo 95 %. Podmínkou je dostatečná zkušenost a kvalitní přístrojové vybavení. Vysoké diagnostické přesnosti se nejčastěji dosahuje pomocí tomografické techniky SPECT (single photon emission computed tomography) ve spojení s CT zobrazením. To nám dovolí přesnou anatomickou identifikaci ložisek se zvýšenou kumulací aktivity. Tyto informace jsou cenné před chirurgickým výkonem, při kterém je možné použít scintilační sondu a provést navigovaný chirurgický výkon.
Nejnověji se k zobrazování využívá PET (positron emission tomography) ve spojení s CT nebo MR po aplikaci radiofarmaka 18F-fluorocholinu (FCH) [28]. PET má lepší rozlišení než SPECT a 18F-fluorocholin se akumuluje v příštítných tělískách jiným způsobem než MIBI. PET/CT s fluorocholinem může být rozhodujícím vyšetřením v případech, v nichž nebylo úspěšné ultrazvukové a MIBI-vyšetření [29]. Užití radioizotopových zobrazovacích technik pro lokalizaci hyperprodukující paratyroideální tkáně má smysl jen v případech, v nichž je signifikantně zvýšena hladina parathormonu. Nejlepších výsledků dosahuje scintigrafie právě při vysoké hladině parathormonu i kalcia. Při hraničních hodnotách scintigrafie zpravidla selhává (nedostatečně zvětšené tělísko s malou metabolickou aktivitou). Znázornění příštítných tělísek pomocí 18F-flurocholinu se však v roce 2015 používá pouze v Ústavu nukleární medicíny VFN v Praze. Klasické CT a MR-vyšetření má také své místo v diagnostice, ale nejpřínosnější je kombinace CT anebo případně i MR s radioizotopovým zobrazením (obr. 1 a 2) [30,31].
Obr. 1. FDG-PET/CT vyšetření pacienta s histologicky prokázanou sarkoidózou 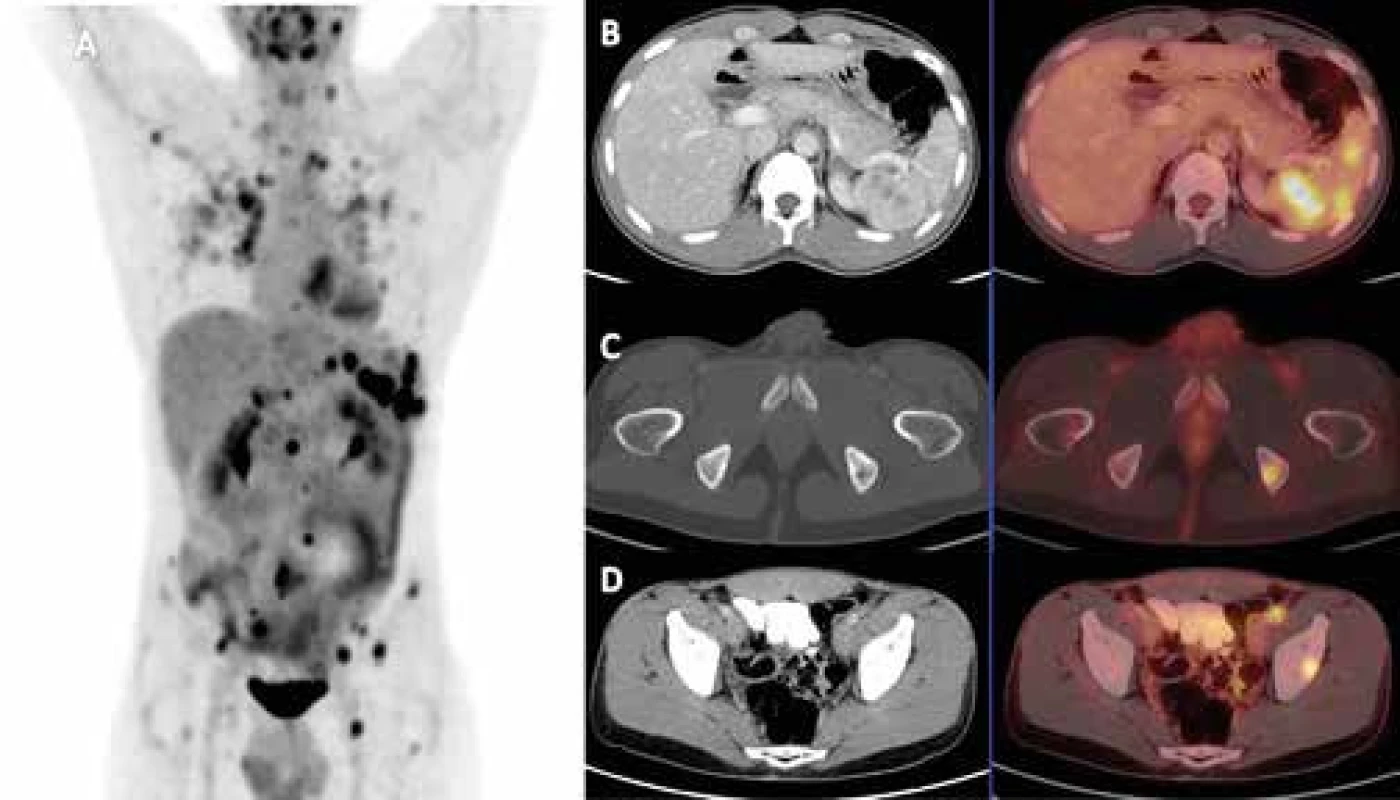
A. FDG-PET-CT vyšetření detekující mnohočetná metabolicky aktivní ložiska v plicích, slezině, lymfatických uzlinách a kostech - MIP PET trup B. axiální řez CT a PET-CT nezvětšené sleziny prostoupené hypodenzními splývajícími, metabolicky aktivními ložisky velikosti do 17 mm, SUVmax do 8,5 C. axiální řez CT a PET/-T v místě metabolicky aktivního osteolytického ložiska v levé sedací kosti 11 mm v průměru, SUVmax 5,6 D. axiální řez CT a PET-CT v místě ovoidní uzliny ventrálně od společného ilického cévního svazku vlevo velikosti 12 × 8 mm v příčném průměru, SUVmax 5,6 Obr. 2. Zobrazení příštítného tělíska 18F-fluorocholinem (FCH) PET-CT 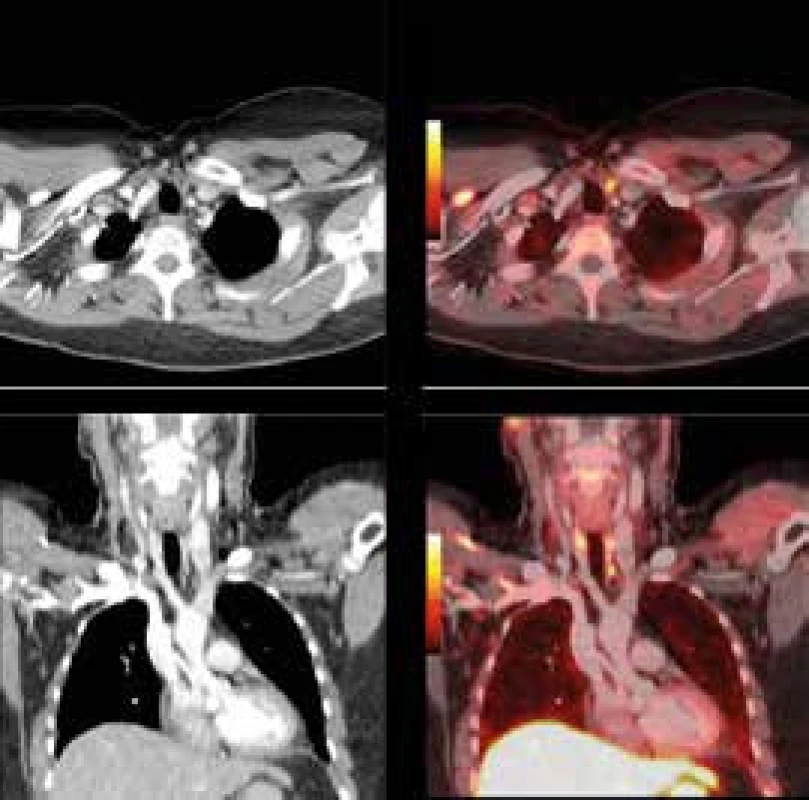
FCH-PET-CT obrázek 1cm adenomu levého dolního příštítného tělíska v typické lokalizaci. Na obrázku v rovinách axiální a koronární plnohodnotného CT s kontrastem vykazuje hypertenzní korelát (obrázky vlevo) v místě výrazně zvýšeného vychytávání FCH (odpovídající obrázky vpravo). Léčba hyperparatyreózy
Pokud se podaří zobrazit a detekovat suspektní příštítné tělísko, je léčba operační [32,33]. Vhodné je provádět exstirpace adenomů příštítných tělísek na specializovaných pracovištích. Při operačním řešení se používá peroperační sonografie či detekce pomocí označení příštítného tělíska radiofarmakem MIBI (gamma-navigovaná explorace).
Pokud se nepodaří najít příštítné tělísko, zbývá jedině léčba farmakologická, pokud se nesáhne k exploraci krku zkušeným chirurgem. Kličková diuretika mohou mírně snížit kalcemii, naopak nezbytné je vysazení tiazidů. Klasické antiresorptivní léky, jako jsou bisfosfonáty nebo raloxifen, sice nemají signifikantní vliv na hladinu kalcia a parathormonu, ale snižují resorpci kosti a zvyšují kostní denzitu osob léčených s hyperparatyreózou.
Jako kalcimimetické léky se označují takové látky, které aktivují receptor pro kalcium. Výsledkem je pokles koncentrace parathormonu a kalcia. V současnosti je k dispozici tabletová forma kalcimimetického agens zvaná cinakalcet (Mimpara). Používá se u pacientů, u kterých není možná operační léčba [8,34]. Nízkokalciová dieta zvýší efekt farmakologické léčby. Pro pacienta je často velmi neoblíbená. Pozitivní motivací je příslib vysokokalciové diety po úspěšné resekci příštítného adenomu.
Hyperkalcemie související s maligní chorobou
K hyperkalcemii může dojít až po dlouhodobějším normokalcemickém průběhu maligní choroby. Hyperkalcemie pak signalizuje transformaci do agresivnější formy nemoci, a tedy obvykle špatnou prognózu. Někdy však mohou být symptomy hyperkalcemie, např. zmatenost, prvními příznaky dosud nerozpoznaného mnohočetného myelomu. Jeden z našich pacientů s mnohočetným myelomem byl po první návštěvě svého lékaře poslán na psychiatrii pro závažnou zmatenost. Až tam vyšetřili kalcium a přesměrovali jej na interní oddělení, kde byla stanovena diagnóza dříve nepoznaného mnohočetného myelomu.
Z maligních chorob, které svými buňkami infiltrují (invadují) skelet a indukují osteolýzu, je třeba zmínit mnohočetný myelom a karcinom prsu, plic nebo ledvin s metastázami do skeletu.
Hyperkalcemie při maligní chorobě může vzniknout i bez invaze maligních buněk do kosti. Nejčastěji se to popisuje u dlaždicobuněčných tumorů plic, jícnu, nádorů hlavy a krku, gynekologických malignit, karcinomu prsu a karcinomu ledvin. Ale prakticky i každá jiná neoplazie může být příčinou hyperkalcemie.
Molekulární příčiny hyperkalcemie u maligních chorob jsou velmi pestré. V případě mnohočetného myelomu jde o sekreci četných cytokinů, které ve svém důsledku aktivují osteoklasty (tumor necrosis factor β, interleukin 1, interleukin 6). V případně lymfomů se v některých případech prokázala zvýšená tvorba 1,25-dihydroxyvitaminu D nebo peptidu zvaného parathormon releated peptide (PTHrP). Případy, v nichž by tumor produkoval přímo parathormon, jsou vzácné, spíše šlo o koincidenci hyperparatyreózy a maligní nemoci [35].
Hyperkalcemie u solidních nádorů je většinou způsobena látkami, které jsou kategorizovány jako PTHrP, což je bílkovina, která má s parathormonem četné společné biologické vlastnosti a sekvenci prvních 13 aminokyselin, které zodpovídají za jeho aktivitu. Parathormon se skládá pouze z 84 aminokyselin, zatímco PTHrP má více izoforem, které obsahují od 139 do 173 aminokyselin. Biologická aktivita PTH a PTHrP je téměř identická, ale ne zcela, PTHrP neaktivuje 1-α-hydroxylázu 25-hydroxyvitaminu D. Pacienti, kteří mají hyperkalcemii způsobenou PTHrP, mají obvykle nízké koncentrace jak PTH, tak i 1,25-dihydroxyvitaminu D, protože PTHrP není detekovatelný klasickým testem používaným k průkazu PTH a také proto, že neaktivuje 1α-hydroxylázu [36–39]. V aktivaci osteolýzy má zásadní význam aktivace signalizace dráhy RANK-RANKL. Kostní tkáň podléhá neustálé přestavbě, starší struktury hydroxyapatitu jsou odstraňovány a nahrazovány novými. Klíčové role v tomto procesu mají osteoblasty, které kost budují, a osteoklasty, které ji odbourávají. Prekurzory osteoblastů mají na svém povrchu receptor zvaný RANK (receptor activator of NF-κB – nuclear factor-κB). RANK je aktivizován pomocí RANKL (RANK-ligand), které se mimo jiné nachází na povrchu osteoblastů. Aktivace RANK pomocí RANKL stimuluje vyzrávání preosteoklastů do aktivních osteoklastů, a tím osteolýzu. Cílem léčby hyperkalcemie je zastavit patologicky zvýšenou aktivitu osteoklastů. Toho lze dosáhnout aplikací bisfosfonátů, jimž bylo v české literatuře věnováno hodně publikací a nejnověji pomocí denosumabu. Denosumab inhibuje maturaci osteoklastů tím, že váže a inaktivuje RANKL. To odpovídá přirozené aktivitě osteoprotegerinu, endogenního inhibitoru RANKL. Aktivita osteoprotegerinu za některých okolností nestačí regulovat nádorem zvýšenou osteolýzu a v případech pacientů s osteoporózou není zcela jasná příčina snížené aktivity osteoprogegerinu.
Sarkoidóza a další získané příčiny hyperkalcemie
Sarkoidóza
Granulomatózní choroby jsou další známou příčinou hyperkalcemie. Sarkoidóza je systémové granulomatózní nekaseifikující onemocnění nejasné etiologie, které může postihovat jakýkoliv orgán v lidském těle. V 90 % případů postihuje respirační systém, proto je sarkoidóza doménou plicních lékařů. Vyskytuje se zejména u jedinců mladšího a středního věku. Prognóza je většinou příznivá a závisí na typu a rozsahu postižení. Sarkoidóza může mít akutní či pozvolný chronický průběh. Z mimoplicních lokalizací sarkoidózy je nutno zmínit kůži, na které tvoří uzlovité infiltráty a plaky, a signálem přítomnosti sarkoidózy může být také erythema nodosum.
Sarkoidóza může způsobit zvětšení periferních uzlin a imitovat tak lymfom. Sarkoidóza může způsobit uveitidu a iridocyklitidu, ale může postihnout také kosterní svaly či sval srdeční. Výjimečně může postihnout nervový systém a vytvořit infiltráty na meningách. Důležité je, že sarkoidóza může postihnout také kosti. Starší literatura označovala kostní změny jako ostitis multiplex cystoides Jüngling [40,41]. Typickou kostní lokalizací, u níž bývají často detekovány kostní změny způsobené sarkoidózou, jsou kosti ruky a nohy. Tvoří je drobná, ostře ohraničená cystoidní projasnění v prořídlé „síťovité“ spongióze. Ale jak dokumentují v poslední době FDG-PET-CT studie, postižení skeletu je prokazatelné i v dlouhých kostech a axiálním skeletu [42–45].
Se zvyšující se dostupností PET-CT vyšetření se zvyšuje i počet pacientů se sarkoidózou, kteří prošli tímto vyšetřením. A to poněkud mění pohled na tuto nemoc. Ukazuje se, že mimo plicní a uzlinová postižení jsou často pomocí PET-CT detekována také postižení sleziny, kostí i dalších orgánů a kombinovaná systémová postižení až s obrazem připomínajícím lymfomy [42–45].
V souboru 158 pacientů vyšetřených metodou FDG--PET-CT byla PET pozitivita prokázána u 75 % z nich. V této skupině PET pozitivních pacientů bylo mimoplicní postižení prokázáno u 75 % [45,46].
Optimální pro zjištění rozsahu sarkoidózy se však zdá být kombinace FDG-PET-CT vyšetření s magnetickou rezonancí (MR). MR může prokázat kardiální, svalová a CNS ložiska sarkoidózy, zatímco PET-CT lépe informuje o postižení lymfatických uzlin a kostí (obr. 3) [47,48].
Obr. 3. Zobrazení příštítného tělíska scintigrafií MIBI 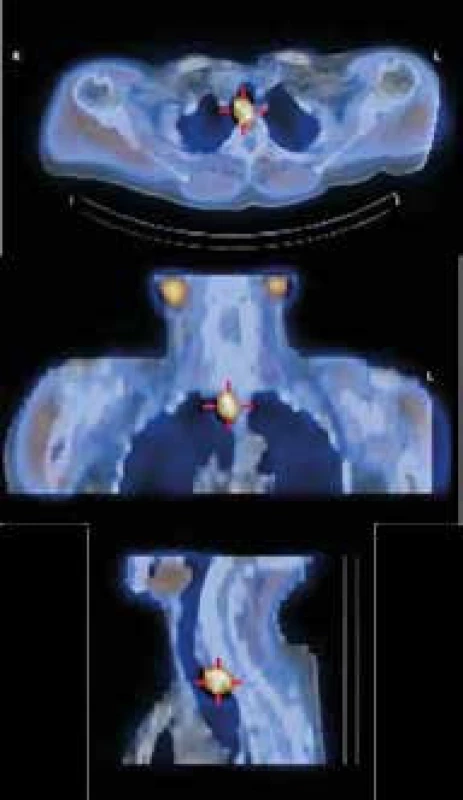
SPECT/low dose CT zobrazení 2cm adenomu (ektopického, vývojově pravého horního příštítného tělíska), uloženého ve střední čáře za tracheou, prevertebrálně. Obrázek pozdní fáze MIBI zobrazení s low dose CT (umožňuje jenom hrubou anatomickou orientaci). Na obrázku v rovinách axiální, koronární a sagitální je na CT pozadí jasně patrné výrazné zvýšení akumulace radiofarmaka v adenomu příštítného tělíska. Plicní formy jsou diagnostikovány po provedení zobrazovacích vyšetření metodou bronchoskopie s alveolární laváží. Sarkoidózu v jiných lokalizací musíme prokázat biopsií s histologickým hodnocením.
Z laboratorních parametrů bývá vyšší sedimentace erytrocytů, ale popsáno bylo i polyklonální zmnožení imunoglobulinů [49]. Diferenciálně diagnostiky je nutno odlišit sarkoidózu od multicentrické formy Castlemanovy choroby, která způsobuje zvýšení zánětlivých markerů a zvýšení koncentrace polyklonálních imunoglobulinů, ale někdy i zvýšení koncentrace monoklonálního imunoglobulinu.
V 70–80 % případů sarkoidózy bývá zvýšená aktivita ACE (angiotensin converting enzyme) [50]. Hyperkalcemie je popisována u 2–10 % pacientů se sarkoidózou [51]. Hyperkalciurie je častější a nachází se až v 40 % případů [51]. Více se projeví v letních měsících, během nichž se vápník zvýšeně resorbuje střevem při zevní aktivaci vitaminu D. V případě, v němž byla podána vyšší dávka vitaminu D pacientovi s nerozpoznanou sarkoidózou, došlo k jeho rychlé hydroxylaci na kalcitriol a ke vzniku hyperkalcemie, a tak i k odhalení sarkoidózy [52–56].
Příčinou hyperkalcmie a hyperkalciurie u sarkoidózy jsou makrofágy granulomů transformované na epiteloidní buňky. Makrofágy mají vysokou aktivitu 1-α-hydroxylázy vitaminu D, což vede ke zvýšené hydroxylaci 25-hydroxyvitaminu D a jeho přeměně na 1,25-dihydroxyvitamin D. Za fyziologických podmínek dochází k této hydroxylaci jen vlivem PTH, ale v případně sarkoidózy je tato hydroxylace nezávislá na PTH [57–61].
Nic však neplatí absolutně, v literatuře lze nalézt případy hyperkalcemie u sarkoidózy, u nichž byl příčinou PTHrP [61].
Další získané příčiny hyperkalcemie
Granulomatózní ložiska však mohou mít i jinou příčinu, než je sarkoidóza. Literatura např. popisuje případ jihoamerické ženy, která si z kosmetických důvodů nechala aplikovat do gluteální krajiny metylmetakrylátové injekce. Depozita metylmetakrylátu způsobila chronický zánět, detekovaný zvýšenou akumulací fluorodeoxyglukózy při PET-CT vyšetření. Autoři sdělení předpokládají , že příčinou hyperkalcemie byla zvýšená tvorba kalcitriolu granulomatózní tkání kolem depozit metakrylátu [62].
Granulomatózní tkáň vzniká také kolem případné nekrózy tuku, a i v tomto případě může způsobit hyperkalcemii [63,64]. Výjimečně jsou příčinou hyperkalcemie i granulomatózní změny jiné etiologie, například při kokciodiomykóze [65,66].
Hypertyreóza způsobuje taktéž zvýšenou resorpci vápníku, ale obvykle se projeví pouze zvýšenou kalciurií bez signifikantní hyperkalcemie.
Imobilizace také způsobuje zvýšenou resorpci kalcia, ale obvykle jen do té míry, že se projeví samotnou hyperkalciurií, ale již ne hyperkalcemií.
Z léků nutno zmínit tiazidová diuretika, která snižují kalciurii, ale obvykle již nezpůsobují signifikantní hyperkalcemii.
Z dalších léků zvyšujících kalcemii je nutno zmínit lithium. To však již není tak často podáváno jako dříve. Také teriparid, léčebně používaný derivát parathormonu, může někdy zvýšit hladinu kalcia. Zvýšení hladiny kalcia může být způsobeno také intoxikací vitaminem D nebo vitaminem A.
Sami jsme pozorovali případ chybné diagnózy u pacienta s předávkováním vitaminem D v podobě veterinárního preparátu, který si pacient sám aplikoval intramuskulárně s cílem vybudovat svalovou hmotu. Pacient přišel pro nejasné zvracení, naneštěstí však hladina vápníku nebyla vyšetřena, pouze byla zjištěna vyšší hladina amylázy a v důsledku toho byla diagnostikována akutní pankreatitida. Po přechodném zlepšení stavu a propuštění do domácího léčení se potíže opakovaly, při návratu do nemocnice však znovu nebyl vápník vyšetřen a stav byl hodnocen jako recidiva akutní pankreatitidy. Teprve při třetí hospitalizaci byla již na interním pracovišti laboratorně zjištěna vysoká hyperkalcemie a neměřitelně vysoká hladina vitaminu D, která pak přetrvávala ještě několik týdnů.
U mladíků vášnivě oddaných aktivitám, jako je body building, se lze setkat nejen vzestupem hodnot CK a myoglobinu, ale i další publikované zkušenosti popisují hyperkalcemie u jedinců zapálených pro budování svalů, kteří polykají různé potravinové doplňky prodávané v posilovnách [67].
Je důležité si uvědomit, že i u pacientů s nádorem se může současně vyskytnout nenádorová příčina hyperkalcemie [68]. Přehled možných příčin hypekalcemie shrnuje tab. 2.
Hereditární hyperkalcemie
Endokrinolog se ve své praxi setká nejčastěji s hyperkalcemií na podkladě primární hyperparatyreózy, která může být vzácně součástí familiárního syndromu buď jako porucha izolovaná, nebo asociovaná s jinými endokrinními i neendokrinními nádory, ale také hereditárními poruchami [5,6,14,16,21,69–72]. Dle některých autorů na hereditární formu připadá každá 10. primární hyperparatyreóza, nejčastěji jako iniciální projev mnohočetné endokrinní neoplazie 1. typu (MEN1) [73,74]. K abnormální sekreci parathormonu a následné hyperkalcemii dochází na podkladě zárodečných mutací vedoucích k aktivaci protoonkogenů (např. tyrozinkinázy RET u MEN2A) nebo k inaktivaci nádorových supresorů (např. meninu u MEN1).
Hereditární forma primární hyperparatyreózy se v rodině dědí nejčastěji autozomálně dominantně a vedle MEN1 může být součástí dalších syndromů, jako jsou MEN2A, MEN4, syndrom hyperparatyreózy asociované s nádory čelisti, familiární hypokalciurická hyperkalcemie (FHH) nebo jako familiární izolovaná hyperparatyreóza [73]. Vedle běžného biochemického vyšetření a zobrazovacích metod používaných u sporadické formy primární hyperparatyreózy jsou u některých syndromů k dispozici také mutační analýzy příslušných genů.
V klinické praxi na hereditární formu onemocnění pomýšlíme zejména tehdy, pokud je primární hyperparatyreóza diagnostikována u pacientů mladších 40 let, pokud je adenomem nebo hyperplazií postiženo současně více příštítných tělísek, nebo pokud má primární hyperparatyreóza rekurentní průběh. Mezi další faktory, které by mohly svědčit pro genetické pozadí onemocnění, patří pozitivní rodinná anamnéza primární hyperparatyreózy a/nebo jiných endokrinopatií, které by mohly být součástí familiárních syndromů. Nebo pokud jsou tyto endokrinopatie nalezeny u jednoho pacienta současně s primární hyperparatyreózou [74]. Pokud primární hyperparatyreóza vzniká na podkladě karcinomu příštítných tělísek, je doporučována analýza genu pro parafibromin [73]. Tento jinak vzácný karcinom se může až v 15 % vyskytovat u syndromu hyperparatyreózy asociované s nádory čelisti. Každý ze zmíněných syndromů má svá specifika, nicméně od ostatních se svým průběhem odlišuje familiární hypokalciurická hyperkalcemie. U této poruchy je hyperkalcemie přítomna již od narození, je asymptomatická, proto bývá zjištěna často náhodně a na rozdíl od jiných syndromů není vhodná paratyroidektomie. U homozygotní formy onemocnění (neonatální závažná primární hyperparatyreóza) je naopak totální paratyroidekotmie nutná co nejdříve po narození. Přesný popis uvedených syndromů, jejich diagnostická kritéria a indikace ke genetickému vyšetření přesahují rámec tohoto sdělení [73,74].
Vedle zmíněného genu pro menin u MEN1, RET u MEN2A a parafibrominu u syndromu hyperparatyreózy asociované s nádory čelisti je možné geneticky vyšetřit ještě gen CDKN1B u syndromu MEN4 a gen receptoru pro kalcium u familiární hypokalciurické hyperkalcemie [73]. Některá z těchto vyšetření jsou dostupná i v České republice, proto je při podezření vhodné se obrátit na Endokrinologický ústav v Praze. Genetické vyšetření neodhalí mutaci v příslušném genu u všech pacientů. U MEN1 se např. uvádí, že mutaci se podaří identifikovat asi v 75 %. Nález mutace umožní včas odhalit další rodinné příslušníky ještě před nástupem klinických projevů onemocnění.
K hereditárním hyperkalcemiím se řadí i tzv. PTH-nondependentní hyperkalcemie s nízkou nebo normální hodnotou PTH. K takovému biochemickému obrazu dochází např. u autozomálně recesivní mutace v genu pro 24-hydroxylázu vitaminu D3 (CYP24A1). Klinický obraz těchto pacientů doplňuje častý nález nefrokalcinózy. Vzhledem k nízké aktivitě enzymů metabolizujících vitamin D3 může suplementace vitaminem D při neznalosti této poruchy zhoršit hyperkalcemii, hyperkalciurii, a tak vést k postižení ledvin [75].
Diferenciální diagnostika hyperkalcemie
Zásadní pro nasměrování dalšího postupu je ověření hyperkalcemie vyšetřením ionizovaného kalcia, pokud jsou odchylky v koncentraci albuminu a celkové bílkoviny. Následuje vyšetření parathormonu a případně 1,25-hydroxyvitaminu D, je-li dostupné, a také vyšetření odpadu kalcia za 24 hod (kalciurie). Snížený odpad kalcia při hyperkalcemii by mohl svědčit pro familiární hyperkalcemii s hypokalciurií.
V případě zvýšené hladiny parathormonu je etiologie jasná a endokrinologové dále upřesňují, zda jde o izolovanou hyperparatyreózu, či o projev mnohočetné endokrinní neoplazie.
V případě hyperkalcemie a hyperkalciurie s nezvýšenou hodnotou parathormonu, či přesněji s adekvátně sníženou hodnotou parathormonu, je třeba pátrat po nádorech, případně po granulomatózních chorobách.
Vzhledem k tomu, že řada malignit metastázuje do kostí a může být provázena hyperkalcemií, je možné v rámci pátrání po okultní malignitě doporučit i FDG-PET-CT vyšetření. Některé malignity s osteoplastickými kostními metastázami (např. karcinom prostaty) bývají provázeny variabilní a často i nízkou akumulací FDG a kostní postižení takového typu může být lépe zobrazitelné pomocí konvenční scintigrafie skeletu. Nádory s osteolytickým typem kostního postižení jsou naopak FDG-PET-CT vyšetřením zobrazitelné zpravidla dobře, a to v místech primárního nádoru i kostních metastáz [76,77]. Míra akumulace fluorodeoxyglukózy v nádorovém ložisku jak známo přímo souvisí s mírnou aktivitou metabolizmu nádorové tkáně. Proto u rychle progredujících nádorů a aktivních zánětů je aktivita vysoká, zatímco co u pomalu rostoucích nádorů a jejich metastáz je aktivita metabolizmu maligních buněk, a tedy i akumulace FDG nižší. Výhodou FDG-PET-CT v diferenciální diagnostice hyperkalcemie s nezvýšenou hodnotou parathormonu je to, že pozitivní obraz mohou mít také ložiska zánětu (zejména granulomatózního), nevýhodou je však to, že nemusíme diferenciálně diagnosticky rozlišit ložiska granulomatózního zánětu od nádorových [44,45]. FDG-PET-CT může mít místo u všech nejasných případů hyperkalcemie s nezvýšenou hodnotou PTH [42,50].
V případě hyperkalcemie u dětí je nutno pátrat i po hereditárních příčinách [69–75]. Ale i u pacienta s nádorem je třeba myslet na možnost nenádorové příčiny hyperkalcemie [15,16,68] a pro jistotu vyšetřit i parathormon.
V případě hyperkalcemie u dětí či spíše obecně, když se nepodaří prokázat ani maligní onemocnění, ani granulomatózní onemocnění a ani primární hyperparatyreózu, je třeba pátrat také po hereditárních příčinách, což je doménou specializovaných endokrinologů, jak uvádí Žofková a další [5,6,15,20,67–69].
Léčba hyperkalcemie
Intenzita léčby se odvíjí od výše kalcemie. Pacienti s kalciem < 3 mmol/l jsou často bez přítomnosti klinicky závažných příznaků. Se vzestupem kalcemie > 3,0 mmol/l se prohlubuje intenzita příznaků, deplece intravaskulární a extracelulární tekutiny, nastává dramatický pokles glomerulární filtrace se vzestupem koncentrace kreatininu a urey, dochází k hypotenzi a celkovému obluzení a ke zpomalení fyziologické motility trávicího traktu, takže člověk není schopen uhradit deficit tekutin pitím, protože zvrací.
Na EKG křivce se zkracuje QT interval. V případě, že pacient užívá digitalis, zvyšuje se jeho toxicita.
Proto se léčba zahajuje podáváním iontových roztoků, které mají upravit hypovolemii [78–82].
Hydratace iontovými roztoky bez kalcia
Hyperkalcemie způsobuje poruchu koncentrace moči, a tedy polyurii. Proto má většina pacientů s klinicky významnou hyperkalcemií snížený objem intravaskulární tekutiny. Léčbu je vždy nutno zahájit nitrožilním podáním iontových roztoků bez obsahu vápníku. Lze použít Plasmalyte nebo fyziologický roztok, ale nikoliv Ringerův roztok nebo roztok EL 1/1, v nichž je vápník obsažen. Zásadní je přívod sodíku ve velkém objemu, 1. den často 3–6 l s ohledem na klinický stav nemocného, optimálně za monitorování centrálního žilního tlaku.
Podání furosemidu je sice při zvládání hyperkalcemie také zmiňováno, ale furosemid neovlivní nijak zásadně hladinu kalcemie, a tak by jeho místo mělo být u těch pacientů, u nichž hydratace způsobila již nežádoucí převodnění, jak uvádí v podrobném přehledu Maier a další [80–82].
Kalcitonin
Kalcitonin byl standardním preparátem pro akutní snížení hyperkalcemie. Jeho účinek trval však jen několik hodin, a proto jej bylo nutno podávat opakovaně. V době, kdy byl standardně dostupný, jsme jej podávali podkožně po 6 hod až do poklesu kalcemie na normální hodnoty. Pokles kalcia po bisfosfonátech se objeví až po 48 hod od podání, a tak pro akutní snížení hyperkalcemie měl kalcitonin svůj nezastupitelný význam. Jeho aplikace umožňovala výrazně snížit kalcemii již v prvních 24 hod, tedy v době, kdy ještě nenastoupil efekt nitrožilně podaných bisfosfonátů [78]. Nyní však kalcitonin není dostupný.
Bisfosfonáty
Bisfostonáty jsou standardním lékem již po několik desetiletí. Pro léčbu hyperkalcemie lze použít kterýkoliv z nitrožilně aplikovaných preparátů. Otázkou je pouze, v jaké dávce.
Pokud se podaří aktivitu maligní nemoci zvládnout chemoterapií, je dostačující pouze jedna aplikace bisfosfonátů. Pokud ovšem je onemocnění k chemoterapii či k jiné léčbě rezistentní a způsobuje hyperkalcemii, je nutno intervaly mezi nitrožilní aplikací bisfosfonátů stanovit dle vývoje kalcemie. V těchto případech je někdy nutné podávat bisfosfonáty nitrožilně i vícekrát do měsíce, tedy častěji, než jsou jejich standardní intervaly při dlouhodobé profylaktické léčbě pacientů s kostními metastázami či kostními infiltráty mnohočetného myelomu či lymfomu [78,79].
Klodronát
Pro léčbu hyperkalcemie lze použít klodronát v dávce 1 500 mg v 4hod infuzi fyziologického roztoku či roztoku 5% glukózy. Roztok je po naředění chemicky stabilní nejméně po 24 hod. V případě renální insuficience je doporučena redukce. O redukci uvažujeme při dlouhodobé chronické aplikaci, ne však při léčbě hyperkalcemie.
Námi často používanou alternativou je podání 900 mg intravenózně v 4–6 hod infuzi 2 dny po sobě, nebo podání 1 500 mg v kontinuální 24hod infuzi. Hyperkalcemie způsobuje velmi často reverzibilní renální selhání, dominantně z dehydratace. Proto v těchto případech neprovádíme redukci dávky klodronátu dle firemního doporučení, ale zásadně prodloužíme délku aplikace.
Toto naše praxí ověřené doporučení vychází ze známého velmi krátkého plazmatického poločasu, který souvisí mimo jiné s tím, že z krve, která proteče kostními kapilárami, je prakticky vychytán veškerý klodronát hydroxyapatitovými strukturami.
Při podání 1 500 mg klodronátu formou 24hod infuze pacientovi s hyperkalcemií provázenou renálním selháním jsme nepozorovali nikdy nežádoucí účinky klodronátu a uvedenou neredukovanou dávkou jsme dosáhli rychlé normalizace hyperkalcemie. Díky 24hod kontinuální infuzi se plazmatické hladiny klodronátu nijak zásadně nezvyšují [78,79].
Pamidronát
Pamidronát se doporučuje podávat po naředění do fyziologického roztoku nebo 5% glukózy, roztok nesmí obsahovat kalcium. Infuzní rychlost dle posledního doporučení nemá překročit 60 mg/hod. Pro celkové množství 90 mg pamidronátu je dostačující zředění ve 250 ml infuzního roztoku a podání během 2 hod. U pacientů s hyperkalcemií se doporučuje podávat 90 mg v 500 ml roztoku v průběhu nejméně 4 hod. Při dlouhodobém podávání je vhodné sledovat vývoj hodnot urey a kreatininu. V případě renální insuficience jakéhokoliv stupně není doporučena redukce dávek.
Při nedostatečném poklesu do 3–7 dnů je možné opakovat podání pamidronátu a léčba se vždy opakuje při opětovném vzestupu koncentrace kalcia.
Původní firemní materiály doporučovaly obezřetnost při podávání pamidronátu pacientům s renální insuficiencí, blíže však toto doporučení nespecifikovaly. V současnosti převládá názor, že pamidronát není nutno při renální insuficienci redukovat, je však nutno infuzi s pamidronátem nechat kapat déle než u pacientů s normální funkcí ledvin. Stejná dávka u pacienta s renální insuficiencí má větší hypokalcemizující efekt, jinak ale žádné negativní dopady. Obrovské plochy hydroxyapatitu lze přirovnat k rozsáhlým bažinám, kterým je celkem jedno, zda pohltí větší či menší množství pamidronátu. Proto také v informacích k preparátu není uvedena nutnost redukce dávky ani při závažném selhání ledvin. U pacientů se selháním funkce ledvin se doporučuje podstatně pomalejší infuzní podání 20 mg/hod [78,79].
Ibandronát
Pro léčbu hyperkalcemie se doporučuje 6 mg ibandronátu v nitrožilní infuzi. U ibandronátu se v dokumentaci objevuje doporučení redukovat dávku při chronické renální insuficienci. Pokud je kreatininová clearance > 30 ml/min (0,5 ml/s), podává se plná dávka, při clearence < 30 ml/min (0,5 ml/s) se doporučuje podávat 2 mg v intervalu 3–4 týdnů a infuze by měla trvat nejméně 1 hod.
Nicméně v literatuře lze najít více publikací malých sérií pacientů s hyperkalcemií léčených neredukovanou dávkou ibandronátu i při renální insuficienci, u nichž nebylo popsáno žádné poškození ledvin. Autoři těchto sdělení doporučují neredukovat dávku ibandronátu u pacientů s akutní hyperkalcemií a zhoršenou funkcí ledvin [83–86].
Zoledronát
V případně zoledronátu byla popsána renální toxicita podstatně častěji, než je tomu u ostatních bisfosfonátů, a proto zde je vhodné i při léčbě hyperkalcemie zoledronátem respektovat doporučení pro úpravu dávky v závislosti na funkci ledvin [78,79].
Další léky
Glukokortikoidy
Glukokortikoidy snižují vstřebávání vápníku tím, že sníží tvorbu 1,25-dihydroxyvitaminu D. Proto se používají pro léčbu hyperkalcemie provázející granulomatózní choroby, a případně pro léčbu hyperkalcemie způsobené mnohočetným myelomem nebo lymfomy [78,79]. U sarkoidózy, jako zástupce granulomatózních procesů, se prednison podává v ranní dávce 20–40 mg.
Denosumab
Denosumab je protilátka vážící se na RANKL, centrální stimulátor osteoklasické aktivity. Denosumab má u metastatického postižení skeletu podobnou protektivní roli jako bisfosfonáty. Denosumab se proto podává jako dlouhodobá léčba, jejímž cílem je brzdit progresi postižení skeletu maligním procesem. Dále jej lze úspěšně použít pro léčbu hyperkalcemie u solidních tumorů. U mnohočetného myelomu zatím není v této indikaci registrován, byť z mechanizmu účinku je zřejmé, že bude také účinný. Výhodou denosumabu je, že jeho dávkování není závislé na funkci ledvin, protože denosumab je metabolizován intracelulárně. Vzhledem k tomu, že hyperkalcemie způsobuje poruchu funkce ledvin a vzestup kreatininu, je velkou předností denosumabu, že dávkování na hodnotě kreatininu nezávisí. Denosumab se podává v dávce 120 mg podkožně [87,88].
Kalcimimetikum cinakalcet (MIMPARA)
Snižuje kalcemii v případě zvýšené hladiny parathormonu. Jeho předepisování spadá do kompetence endokrinologů [8].
Specifika léčení hyperkalcemie u sarkoidózy
V případě sarkoidózy lze použít jak výše uvedené léky inhibující osteolýzu, tak při méně intenzivních příznacích léky, které potlačí chorobu, a tím také tvorbu 1,25-dihydroxyvitaminu D. S tímto cílem se podávají jak glukokortikoidy, tak i další léky, hydroxychlorochin a nově také infliximab [89,90].
Hemodialýza
Hemodialýza je metoda vedoucí k velmi rychlé úpravě kalcemie, vhodná pro kritické stavy, u nichž nelze čekat na nástup účinku bisfosfonátů [78,79,91].
Závěry pro praxi
- vyšetření kalcia by mělo být běžnou součástí laboratorních vyšetření v případně nejasných potíží, ale i v rámci preventivního vyšetření, protože může odhalit dosud asymptomatickou hyperkalcemii
- v případě abnormalit v koncentraci celkové bílkoviny a albuminu je vhodné doplnit i vyšetření koncentrace ionizovaného kalcia
- vyšší hladina kalcia vyžaduje akutní diferenciální diagnostiku, základem je vyšetření hladiny parathormonu
- v případě vyšší hladiny parathormonu se vyšetření zaměří na příštítná tělíska
- v případě nezvýšeného parathormonu je nejpravděpodobnější příčinou maligní onemocnění anebo granulomatózní onemocnění, např. sarkoidóza
- pokud akutní RTG snímek plic a sonografie břicha neodhalí solidní tumor, vyšetření monoklonálního imunoglobulinu je negativní, vyšetření kostní dřeně neodhalí mnohočetný myelom či maligní infiltraci kostní dřeně, je vhodné provést FDG-PET-CT vyšetření, které může odhalit jak maligní, tak i zánětlivý granulomatózní proces
- pokud se neprokáže žádné vyvolávající onemocnění, může jít o hereditární odchylku, např. o familiární hyperkalcemickou hypokalciurii, a tyto pacienty je třeba odeslat na specializovaná pracoviště
Práce byla vytvořena na podporu následujících grantových aktivit: „AZV 15–29508A – MZ ČR – RVO (FNBr, 65269705) a 23/14/NAP“ a dále MZ ČR -RVO MOÚ 00209805 a také MŠMT-NPU-I-LO1413.
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno,
pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 12. 10. 2015
Přijato po recenzi 16. 11. 2015
Zdroje
1. Ščudla V, Bačovský J, Indrák K et al. Results of therapy and changing prognosis of multiple myeloma during the last 40 years in the region of North and Middle Moravia: group of 562 patients. Hematol J 2003; 4(5): 351–357.
2. Felsenfeld A, Rodriguez M, Levine B. New insights in regulation of calcium homeostasis. Curr Opin Nephrol Hypertens 2013; 22(4): 371–376.
3. Payne RB, Little AJ, Villiams RB et al. Interpretation of serum calcium in patients with abnormal serum proteins Brit Med J 1973; 4(5893): 643–646.
4. Varghese J, Rich T, Jimenez C. Benign familial hypocalciuric hypercalcemia. Endocr Pract 2011; 17(Suppl 1): S13-S17.
5. Christensen SE, Nissen PH, Vestergaard P et al. Skeletal consequences of familial hypocalciuric hypercalcaemia vs. primary hyperparathyroidism. Clin Endocrinol (Oxf) 2009; 71(6): 798–807.
6. Egbuna OI, Brown EM. Hypercalcaemic and hypocalcaemic conditions due to calcium-sensing receptor mutations. Best Pract Res Clin Rheumatol 2008; 22(1):129–148.
7. Toka HR, Pollak MR. The role of the calcium-sensing receptor in disorders of abnormal calcium handling and cardiovascular disease. Curr Opin Nephrol Hypertens 2014; 23(5): 494–501.
8. Yousaf F, Charytan C. Review of cinacalcet hydrochloride in the management of secondary hyperparathyroidism. Ren Fail 2014; 36(1): 131–138.
9. Lothar T. Clinical Laboratory Diagnostics: Use and Assessment of Clinical Laboratory Results. TH-Books: Frankfurt 1998. ISBN 978–3980521543.
10. Isaac ML, Larson EB. Medical conditions with neuropsychiatric manifestations. Med Clin North Am 2014; 98(5): 1193–1208.
11. Nakajima N, Ueda M, Nagayama H et al. Posterior reversible encephalopathy syndrome due to hypercalcemia associated with parathyroid hormone-related peptide: a case report and review of the literature. Intern Med 2013; 52(21): 2465–2468.
12. Stevart AF. Clinical practice. Hypercalcemia associated with cancer. N Engl J Med 2005; 352(4): 373–379.
13. Eastell R, Brandi ML, Costa AG et al. Diagnosis of asymptomatic primary hyperparathyroidism: proceedings of the Fourth International Workshop. J Clin Endocrinol Metab 2014; 99(10): 3570–3579.
14. Broulík P, Adámek S, Libánský P et al. Changes in the Pattern of Primary Hyperparathyroidism in Czech Republic. Prague Med Rep 2015; 116(2): 112–121.
15. Zajíčková K. Primarní hyperparathyroidisms jako příčina hypercalcémie u pacientky s karcinomem prsu. Čas Lék Čes 2010; 149(11): 546–548.
16. Broulík P. Diferenciální diagnóza hyperkalcémie. Vnitř Lék 2007; 53(7–8): 826–830.
17. Kokrdová Z. Těhotenství a primární hyperparathyroidismus. Česká Gynekol 2004; 69(3): 186–189.
18. Duan K, Gomez Hernandez K, Mete O. Clinicopathological correlates of hyperparathyroidism. J Clin Pathol 2015; 68(10):771–787.Dostupné z DOI: <http://dx.doi.org/10.1136/jclinpath-2015–203186>.
19. Roizen J, Levine MA. A meta-analysis comparing the biochemistry of primary hyperparathyroidism in youths to the biochemistry of primary hyperparathyroidism in adults. J Clin Endocrinol Metab 2014; 99(12): 4555–4564.
20. Silverberg SJ, Walker MD, Bilezikian JP. Asymptomatic primary hyperparathyroidism. J Clin Densitom 2013; 16(1): 14–21.
21. Žofková I. Familiární hypercalcemie a hypofosfatemie. Vnitř Lék 2010; 56(5): 397–401.
22. Giusti F, Cavalli L, Cavalli T et al. Hereditary hyperparathyroidism syndromes. J Clin Densitom 2013; 16(1): 69–74.
23. Shinall MC Jr, Dahir KM, Broome JT. Differentiating familial hypocalciuric hypercalcemia from primary hyperparathyroidism. Endocr Pract 2013; 19(4): 697–702.
24. Michels TC, Kelly KM. Parathyroid disorders. Am Fam Physician 2013; 88(4): 249–257.
25. Husová L, Šenkyřík M, Lata J et al. Akutní pankreatitida jako cesta k diagnóze primárního hyperparathyreoidismu. Vnitř Lék 2000; 46(19): 724–727.
26. Bai HX, Giefer M, Patel M et al. The association of primary hyperparathyroidism with pancreatitis. J Clin Gastroenterol 2012; 46(8): 656–661.
27. Hindié E, Zanotti-Fregonara P, Tabarin A. The role of radionuclide imaging in the surgical management of primary hyperparathyroidism. J Nucl Med 2015; 56(5): 737–744.
28. Lezaic L, Rep S, Sever MJ et al. ¹⁸F-Fluorocholine PET/CT for localization of hyperfunctioning parathyroid tissue in primary hyperparathyroidism: a pilot study. Eur J Nucl Med Mol Imaging 2014; 41(11): 2083–2089.
29. Kluijfhout WP, Vriens MR, Valk GD et al. (18)F-Fluorocholine PET-CT enables minimal invasive parathyroidectomy in patients with negative sestamibi SPECT-CT and ultrasound: A case report. Int J Surg Case Rep 2015; 13 : 73–75.
30. Moralidis E. Radionuclide parathyroid imaging: a concise, updated review. Hell J Nucl Med 2013; 16(2): 125–133.
31. Doležal J, Horáček J, Ceeová V et al. Diskrepance mezi nálezem 99mTc-MIBI a 99mTc-pertechnetate scintigrafií u pacientů s primárním hyperparathyroidismem. Vnitř Lék 2004; 50(1): 72–75.
32. Adámek S, Libánský P, Lischke R et al. [Surgical therapy of primary hyperparathyrodism in the context of orthopaedic diagnosis and treatment: our experiences in 441 patients]. Acta Chir Orthop Traumatol Cech 2011; 78(4): 355–360.
33. Adámek S, Libánský P, Schützner J et al. Chirurgický přístup k mediastinálním adenomům and parathyreoidním karcinomům. Sb Lék 2000; 101 : 307–314.
34. Nemeth EF, Goodman WG. Calcimimetic and Calcilytic Drugs: Feats, Flops, and Futures. Calcif Tissue Int 2016; 98(4) :341–358. Dostupné z DOI: <http://dx.doi.org/10.1007%2Fs00223–015–0052-z>.
35. Maletkovic J, Isorena JP, Palma Diaz MF et al. Multifactorial hypercalcemia and literature review on primary hyperparathyroidism associated with lymphoma. Case Rep Endocrinol 2014; 2014 : 893134. Dostupné z DOI: <http://dx.doi.org/10.1155/2014/893134>.
36. Lumachi F, Brynelko A, Roma A et al. Cancer-induced hypercalcemia. Anticancer Res 2009; 29(5): 1551–1555.
37. Jasti P, Lakhani VT, Woodworth. A Hypercalcemia secondary to gastrointestinal stromal tumors: parathyroid hormone-related protein independent mechanism? Endocr Pract 2013; 19(6): e158-e162. Dostupné z DOI: <http://dx.doi.org/10.4158/EP13102.CR>.
38. Kanaji N, Watanabe N, Kita N et al. Paraneoplastic syndromes associated with lung cancer. World J Clin Oncol 2014; 5(3): 197–223.
39. Nourani M, Manera RB. Pediatric ovarian dysgerminoma presenting with hypercalcemia and chronic constipation: a case report. J Pediatr Hematol Oncol 2013; 35(7): e272-e273. Dostupné z DOI: <http://dx.doi.org/10.1097/MPH.0b013e31829bcaf1>.
40. Campana L. Hat is your diagnosis? Pulmonary sarcoidosis (stage II/III) with bone manifestations (Osteitis cystoides Jüngling). Schweiz Rundsch Med Prax 1993; 82(38): 1025–1056.
41. Baltzer G, Behrend H, Behrend T et al. Incidence of cystic bone alterations (ostitis cystoides multiplex Jüngling) in sarcoidosis. Dtsch Med Wochenschr 1970; 95(38): 1926–1929.
42. Sousan M, Augier A, Brillet PY et al. Functional imaging in extrapulmonary sarkcoidosis: FDG-PET-CT and MR features. Clin Nucl Med 2014; 39(2): e146-e159. Dostupné z DOI: <http://dx.doi.org/10.1097/RLU.0b013e318279f264>.
43. Kuzyshyn H, Einstein D, Kolasinski SL et al. Osseous sarcoidosis. A case series. Rheumatol In 2015; 35(5): 925–933.
44. Talmi D, Smith S, Mulligan ME. Central skeletal sarcoidosis mimicking metastatic disease. Skeletal radiology 2008; 37(8): 757–761.
45. Sobic-Saranovic D, Grozdic I, Videnovic-Ivanov J e al. The utility of 18F-FDG PET/CT for diagnosis and adjustment of therapy in patients with active chronic sarcoidosis. J Nucl Med 2012; 53(10): 1543–1549.
46. Cremers JP, Van Kroonenburgh MJ, Mostart RL et al. Extent of disease activity assessed by 18-FDG-PET-CT in Dutch sarcoidosis population. Sarcoidosis BASF Difuse Lung Dis 2014; 31(1): 37–45.
47. Han EJ, Jang YS, Lee IS et al. Muscular sarcoidosis detected by F-18 FDG PET/CT in a hypercalcemic patient. J Korean Med Sci 2013; 28(9): 1399–1402.
48. Suri V, Singh A, Das R et al. S. Osseous sarcoid with lytic lesions in skull. Rheumatol Int 2014; 34(4): 579–582.
49. Nageshwaran S, Majumdar K, Russell S. Hypergammaglobulinemia, normal serum albumin and hypercalcaemia: a case of systemic sarcoidosis with initial diagnostic confusion. BMJ Case Rep 2012; 2012. pii: bcr0120125478. Dostupné z DOI: <http://dx.doi.org/10.1136/bcr.01.2012.5478>
50. Hunnighake GW, Costabel U, Ando M et al. ATS/ERS/WASOG statement on sarcoidosis. American Thoracic Society/Europa Respiratory Society/World Association of sarcoidosis and other granulomatou disorders. Sarcoidosis Vasc Difuse Lung Dis 1999; 16(2): 149–173.
51. Baughman RP, Teirstein AS, Judein MA et al. Clinical Characteristics of patient in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001; 164(10 Pt 1): 1885–1889.
52. Amrein K, Schilcher G, Fahrleitner-Pammer A. Hypercalcaemia in asymptomatic sarcoidosis unmasked by a vitamin D loading dose. Eur Respir J 2011; 37(2): 470–471.
53. Tollitt J, Solomon L. Hypercalcaemia and acute kidney injury following administration of vitamin D in granulomatous disease. BMJ Case Rep 2014; 2014. pii: bcr2014203824. Dostupné z DOI: <http://dx.doi.org/10.1136/bcr-2014–203824>.
54. Nayak-Rao S. Severe hypercalcemia unmasked by Vitamin D in a patient with sarcoidosis. Indian J Nephrol 2013; 23(5): 375–357.
55. Arai Y, Tanaka H, Hirasawa S et al. Sarcoidosis in a chronic dialysis patient diagnosed by sarcoidosis-related hypercalcemia with no common systemic clinical manifestations: a case report and review of the literature. Intern Med 2013; 52(23): 2639–2644.
56. Dennis BA, Jajosky RP, Harper RJ. Splenic sarcoidosis without focal nodularity: a case of 1,25-dihydroxyvitamin D-mediated hypercalcemia localized with FDG PET/CT. Endocr Pract 2014; 20: e28-e33. Dostupné z DOI: <http://dx.doi.org/10.4158/EP13240.CR>.
57. Baughman RP, Lower EE. Goldilocks, vitamin D and sarcoidosis. Arthritis Res Ther 2014; 16(3): 111.
58. Baughman RP, Janovcik J, Ray et al. Calcium and vitamin D metabolism in sarcoidosis. Sarcoidosis Vasc Diffuse Lung Di 2013; 30(2): 113–120.
59. Donovan PJ, Sundac L, Pretorius CJ et al. Calcitriol-mediated hypercalcemia: causes and course in 101 patients. J Clin Endocrinol Metab 2013; 98(10): 4023–4029.
60. Hsu HL. Multiple splenic tumors, hypercalcemia, and acute renal failure. Isolated splenic sarcoidosis. Gastroenterology 2011; 140(1): e7-e8. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2010.01.062>.
61. van Realte DH, Goorden SM, Kemper EA et al. Sarcoidosis releated hypercalcaemia due to production of parathyreoid hormone releated peptide. Brit Med J Case Rep 2015; 2015. pii: bcr2015210189. Dostupné z DOI: <http://dx.doi.org/10.1136/bcr-2015–210189>. Erratum in Erratum [BMJ Case Rep. 2015].
62. Rados DV, Furlanetto TW. An unexpected cause of severe and refractory PTH-independent hypercalcemia: case report and literature review. Arch Endocrinol Metab 2015; 59(3): 277–280.
63. Samedi VM, Yusuf K, Yee W et al. Neonatal hypercalcemia secondary to subcutaneous fat necrosis successfully treated with pamidronate: a case series and literature review. AJP Rep 2014; 4(2): e93-e96. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0034–1395987>.
64. Shumer DE, Thaker V, Taylor GA et al. Severe hypercalcaemia due to subcutaneous fat necrosis: presentation, management and complications. Arch Dis Child Fetal Neonatal Ed 2014; 99(5): F419-F421.
65. Zhang JT, Chan C, Kwun SY et al. A case of severe 1,25-dihydroxyvitamin D-mediated hypercalcemia due to a granulomatous disorder. J Clin Endocrinol Metab 2012; 97(8): 2579–2583.
66. Fierer J, Burton DW, Haghighi P et al. Hypercalcemia in disseminated coccidioidomycosis: expression of parathyroid hormone-related peptide is characteristic of granulomatous inflammation. Clin Infect Dis 2012; 55(7): e61-e66. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/cis536>.
67. Schäfer CN, Guldager H, Jørgensen HL. Multi-organ dysfunction in bodybuilding possibly caused by prolonged hypercalcemia due to multi-substance abuse: case report and review of literature. Int J Sports Med 2011; 32(1): 60–65.
68. Soyfoo MS, Brenner K, Paesmans M et al. Non-malignant causes of hypercalcemia in cancer patients: a frequent and neglected occurrence. Support Care Cancer 2013; 21(5): 1415–1419.
69. Hrdličková E, Kutílek S. Idiopatická infantilní hypercalcémie. Čas Lék Čes 1990; 129(44): 1397–1400.
70. Žofková I. Hyperkalcemie v praxi. Interní Med 2012; 14(11): 419–421.
71. Žofková I. Osteologie a kalcium – fosfátový metabolismus. Grada: Praha 2012. ISBN 978–80–247–3919–9.
72. Davies JH. A Practical Approach to Problems of Hypercalcaemia. In: Allgrove J, Shaw NJ (eds). Calcium and bone disorders in children and adolescents. Endocrin Dev Basel Karger 2009; 16 : 93–114. ISBN 978–3-8055–9161–4. Dostupné z DOI: <http://dx.doi.org/10.1159/000223691>.
73. Hendy GN, Cole D. Genetic Defects Associated with Familial and Sporadic Hyperparathyroidism. In: Stratakis CA (ed). Endocrine Tumor Syndromes and Their Genetics. Front Horm Res. Karger: Basel 2013; 41 : 149–165. ISBN 978–3-318–02330–5. Dostupné z DOI: <http://dx.doi.org/10.1159/000345675>.
74. Thakker RV, Newey PJ, Walls GV et al. Clinical Practice Guidelines for Multiple Endocrine Neoplasia Type 1(MEN1). J Clin Endocrinol Metab 2012; 97(9): 2990–3011.
75. Molin A, Baudoin R, Kaufmann M et al. CYP24A1Mutations in a Cohort of Hypercalcemic Patients: Evidence for a Recessive Trait. J Clin Endocrinol Metab 2015; 100(10): E1343-E1352.
76. Uchida K, Nakajima H, Miyazaki T et al. 18F-FDG PET/CT for diagnosis of osteosclerotic and osteolytic vertebral metastatic lesions: comparison with bone scintigraphy. Asian Spine J 2013; 7(2): 96–103.
77. Fogelman I, Cook G, Israel O et al. Positron emission tomography and bone metastases. Semin Nucl Med 2005; 35(2): 135–142.
78. Royer AM, Maclellan RA, Stanley JD et al. Hypercalcemia in the emergency department: a missed opportunity. Am Surg 2014; 80(8): 732–735.
79. Wagner J, Arora S. Oncologic metabolic emergencies. Emerg Med Clin North Am 2014; 32(3): 509–525.
80. Maier JD, Levine SN. Hypercalcemia in the Intensive Care Unit: A Review of Pathophysiology, Diagnosis, and Modern Therapy. J Intensive Care Med 2015; 30(5): 235–252.
81. Sargent JT, Smith OP. Haematological emergencies managing hypercalcaemia in adults and children with haematological disorders. Br J Haematol 2010; 149(4): 465–477.
82. Maier JD, Levine SN. Hypercalcemia in the Intensive Care Unit: A Review of Pathophysiology, Diagnosis, and Modern Therapy. J Intensive Care Med 2015; 30(5): 235–252.
83. Ahmad S, Kuraganti G, Steenkamp D. Hypercalcemic crisis: a clinical review. Am J Med 2015; 128(3): 239–245.
84. Henrich D, Hoffmann M, Uppenkamp M et al. R. Ibandronate for the treatment of hypercalcemia or nephrocalcinosis in patients with multiple myeloma and acute renal failure: Case reports. Acta Haematol 2006; 116(3): 165–172.
85. Henrich DM, Hoffmann M, Uppenkamp M et al. Tolerability of dose escalation of ibandronate in patients with multiple myeloma and end-stage renal disease: a case series. Onkologie 2009; 32(8–9): 482–486.
86. Bergner R, Henrich DM, Hoffmann M et al. Renal safety and pharmacokinetics of ibandronate in multiple myeloma patients with or without impaired renal function. J Clin Pharmacol 2007; 47 : 942–950.
87. Bergner R, Henrich DM, Hoffmann M et al. Therapy of hypercalcemia with ibandronate in case of acute renal failure. Internist (Berl) 2006; 47(8): 293–296.
88. Freeman A, El-Amm J, Aragon-Ching JB. Use of denosumab for renal cell carcinoma-associated malignant hypercalcemia: a case report and review of the literature. Clin Genitourin Cancer 2013; 11(4): e24-e26. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clgc.2013.06.002>.
89. Dietzek A, Connelly K, Cotugno M et al. Denosumab in hypercalcemia of malignancy: a case series. J Oncol Pharm Pract 2015; 21(2): 143–147.
90. Sparks JA, McSparron JI, Shah N et al. Osseous sarcoidosis: clinical characteristics, treatment, and outcomes – experience from a large, academic hospital. Semin Arthritis Rheum 2014; 44(3): 371–379.
91. Huffstutter JG, Huffstutter JE. Hypercalcemia from sarcoidosis successfully treated with infliximab. Sarcoidosis Vasc Diffuse Lung Dis 2012; 29(1): 51–52.
92. Davies JH. A Practical Approach to Problems of Hypercalcaemia. In: Allgrove J, Shaw NJ (eds.) Calcium and bone disorders in children and adolescent. Endocr Dev Basel Karger 2009; 16 : 93–114.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Cystická fibróza – editorial
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Cystická fibróza – editorial
- Imunitní systém a zpracování informací – editorial
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
- Diagnostika cystické fibrózy u dospělých
- Účinnost léčby lokální reziduální neoplazie za standardizovaných podmínek
- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Idiopatické střevní záněty jako protrombotický stav
- Klinické dôsledky syndrómu polycystických ovárií
- Léčba rituximabem jako výzva k prevenci infekčních komplikací
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Využití nových léků v primoterapii mnohočetného myelomu
-
Richard Rokyta, Cyril Höschl (eds).
Bolest a regenerace v medicíně -
Milan Halenka, Zdeněk Fryšák.
Atlas ultrasonografie štítné žlázy -
Petra Svozílková et al.
Uveitidy v kazuistikách
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Diagnostika cystické fibrózy u dospělých
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



