-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaStillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
Adult-onset Still’s disease – a difficult path to diagnosis through fever and effusions of unknown origin
Fever of unknown origin, pleural and pericardial effusions can be caused by a variety of independent agents. On the other hand, we can identify a common causative condition in other cases. Infectious diseases, malignancies and autoimmune diseases are the most common etiological factors. Considering the pleural and pericardial effusion, we also have to think of cardiovascular and pulmonary diseases. The basis of every diagnostic process is thorough medical history and detailed clinical examination followed by laboratory and imaging methods. In spite of that, the right diagnosis sometimes stays long time hidden. One of such conditions is Adult-onset Still’s disease (AOSD). It is a rare inflammatory, potentially life-threatening disease with unclear pathogenesis and heterogeneous symptoms. It has some features similar to systemic form of juvenile idiopathic arthritis. Diagnosis is established so called per exclusionem by fulfilling a set of clinical criteria and ruling out other diseases with similar symptomatology. In our article, we present an example of such an arduous diagnostic journey to final diagnosis.
Key words:
anakinra – arthralgia – evanescent rash – ferritin – fever of unknown origin – pericardial effusion – pleural effusion – procalcitonin – Still’s disease
Autoři: Jana Malegová 1; Lukáš Koten 1; Pavel Horák 2
Působiště autorů: Interní klinika IPVZ Praha a Krajské nemocnice T. Bati, a. s., Zlín, přednosta prim. MUDr. Jiří Latta 1; III. interní klinika - nefrologie, revmatologie a endokrinologie LF UP a FN Olomouc, přednosta prof. MUDr. Josef Zadražil, CSc. 2
Vyšlo v časopise: Vnitř Lék 2014; 60(5-6): 520-526
Kategorie: Kazuistika
Souhrn
Horečnaté stavy spojené s pleurálními a perikardiálními výpotky mohou mít celou řadu příčin, které spolu nesouvisejí, nebo naopak skrývají společného jmenovatele. K nejčastějším příčinám patří infekce, malignity a autoimunitní onemocnění, a v případě výpotků i srdeční a plicní onemocnění. Základem diagnostiky je vždy důkladná anamnéza, podrobné klinické vyšetření a následné cílené laboratorní a zobrazovací metody. Někdy je však i přesto diagnóza dlouho nejasná. Jedním z takových případů je i Stillova nemoc dospělých (adult-onset Still´s disease – AOSD). Jedná se o poměrně vzácné, zánětlivé a potencionálně život ohrožující onemocnění s dosud neobjasněnou etiopatogenezí a heterogenní symptomatologií, které se považuje za systémovou formou juvenilní idiopatické artritidy. Diagnóza je stanovená naplněním diagnostických kritérií a současně vyloučením řady dalších nemocí, tedy per exclusionem. Jednu takovou svízelnou diagnostickou cestu popisujeme v našem článku.
Klíčová slova:
anakinra – artralgie – exantém – feritin – horečka neznámého původu – perikardiální výpotek – pleurální výpotek – prokalcitonin – Stillova nemoc dospělýchKazuistika
23letá dosud zdravá žena, studentka vysoké školy, příležitostně pracující jako brigádnice v klimatizovaném prostředí obchodního domu, nekuřačka, bez významné rodinné anamnézy, si začátkem října roku 2013 stěžovala na horečku, bolesti kloubů a svalů, bolesti v krku. Kontaktu s infekcí si nebyla vědoma. Ošetřující lékař stav hodnotil jako virózu, nasadil antibiotika (klaritromycin). Potíže pacientky trvaly, denně měla vysoké horečky do 40 °C, byla proto hospitalizovaná na interním oddělení spádové okresní nemocnice. V odebraných mikrobiologických vzorcích byl ze sputa vykultivován Enterococcus faecalis, hemokultury byly negativní, byla vyloučena HIV infekce. Při otorinolaryngologickém (ORL) vyšetření byly známky tonzilitidy. Na RTG snímku srdce a plic, stejně jako na CT hrudníku, byly přítomny bilaterální infiltrace plicního parenchymu. Pacientka byla léčena kombinací amoxicilinu s kyselinou klavulanovou a gentamycinem, tato kombinace byla následně zaměněna za cefuroxim s levofloxacinem. Pro rozvoj respirační insuficience byla pacientka přeložena na jednotku intenzivní péče (JIP) plicního oddělení Krajské nemocnice T. Bati ve Zlíně.
Při přeložení byla pacientka febrilní, dušná, tachykardická, na těle byl intermitentně přítomen diskrétní růžovo-hnědý makulopapulózní exantém, občas nevýrazně svědivý, dále byly přítomny otoky zápěstí a drobných kloubů rukou charakteru polyartritidy. Podle výsledků laboratorních vyšetření byly zvýšeny parametry zánětu (sedimentace FW 140/hod, leukocyty 30 × 109/l s 96% podílem neutrofilů, CRP 260 mg/l, prokalcitonin 0,56 ng/ml), mírná elevace jaterních enzymů, vysoká hladina laktátdehydrogenázy (LDH) 7,72 µkat/l a vysoká hladina feritinu (19 867 µg/l). Dále byla nápadná středně těžká hypochromní mikrocytární anémie (Hb 79g/l) a trombocytóza (494 × 109/l). Byla opět změněna antibiotika, tentokrát byl podáván ertapenem a flukonazol cílená na Enterococcus a Candida prokázané ve sputu.
V rámci širší diagnostiky horečnatých stavů následovala řada sérologických odběrů a kultivací biologického materiálu, vyšetření na tuberkulózu, antropozoonózy i parazity, vše s negativním nálezem. Bylo zvažováno i systémové onemocnění pojiva. Výsledky revmatologických testů, konkrétně revmatoidní faktor (RF), antinukleární protilátky (ANA), protilátky proti cytoplazmě neutrofilů (ANCA), protilátky proti extrahovatelným nukleárním antigenům (ENA), antigen HLA-B27, cirkulující imunokomplexy (CIK) ale byly negativní. RTG vyšetření rukou bylo bez patologických známek. Nebyly přítomny laboratorní známky imunodeficitu. Stomatologické vyšetření vyloučilo odontogenní infekci. Při transezofageální echokardiografii se zobrazil normální chlopenní aparát, nebyly poruchy kinetiky či funkce myokardu, byla vyloučená endokarditida.
Byla indikována diagnostická punkce pleurálního výpotku, který biochemicky odpovídal exsudátu, za zmínku stojí vysoká hladina LDH (34 µkat/l). Cytologicky byl hodnocen jako zánětlivý, nemající však charakter empyému. Kultivačně sterilní.
Pro přítomnost exantému byl konzultován dermatolog, který zvažoval diagnózu dermatomyozitidy (antisyntetázová autoprotilátka anti-Jo-1 byla negativní, kreatinkináza v normě) a doporučil kožní excizi.
Ve vstupně provedených sérologických vyšetřeních byly hlášeny pozitivní protilátky proti Legionella pneumophila ve třídě IgM. Antigen v moči byl negativní, přesto byl do terapie vrácen klaritromycin v kombinaci s doxycyklinem a amikacinem. Pro počínající známky malnutrice byla nutná podpůrná enterální výživa. Vzhledem ke krystalizujícímu se podezření na imunopatologickou povahu choroby byla zahájena léčba nesteroidními antirevmatiky (NSA) a glukokortikoidy (metylprednisolon 40 mg 2krát denně intravenózně, poté prednison 30 mg denně perorálně).
Při zavedené medikaci se stav nemocné zlepšil pouze částečně, došlo k ústupu respirační insuficience a přechodně i exantému, jinak však trvala sinusová tachykardie (do 140/min), febrilie s maximy ve večerních hodinách, artralgie, polyartritida a CRP kolísalo kolem hodnoty 200 mg/l.
Celotělové CT se zaměřením na lymfatické uzliny prokázalo reaktivní lymfadenopatii mediastina a retroperitonea. Pneumonie kompletně regredovala, byl přítomen nepatrný fluidotorax, nově i fluidoperikard, který byl následně potvrzen i echokardiograficky. Imunoscintigraficky byly vyloučeny infekční fokusy, byla popsána hepatosplenomegalie. Na PET-CT nebyly známky lokální zvýšené akumulace fluorodeoxyglukózy, malignita, případně vaskulitida velkých cév prokázány nebyly.
V průtokové cytoflowmetrii z periferní krve i v mikroskopickém hodnocení punktátu kostní dřeně byla výrazná leukocytóza s převahou neutrofilů. Známky hemoblastózy však přítomny nebyly.
Průběžně byla pacientka léčena s pracovní diagnózou legionářské nemoci. Pro další vzestup zánětlivých markerů následovala další empirická změna antibiotické terapie na tigecyklin, piperacilin/tazobaktam, v kombinaci s antimykotikem mykaminem. Pro epistaxi byl vysazen profylakticky podávaný enoxaparin a následně i NSA.
Dle kontrolní echokardiografie došlo k progresi fluidoperikardu, pacientka byla výrazně tachykardická (do 170/min). Následoval překlad na JIP interní kliniky, kde byla realizována punkce perikardiálního výpotku (celkem evakuováno 500 ml), který byl biochemicky obdobný pleurálním výpotkům. Jednalo se o exsudát s vysokou hladinou LDH, cytologicky byl vysoce celulární s převahou neutrofilů, hodnotící patolog vyjádřil podezření na empyém, cytogenetické vyšetření na PCR však neprokázalo bakteriální ani mykotickou infekci.
V mezidobí byly provedeny doplňující sérotypizace proti legionele, které tuto infekci prakticky vyloučily. Antigen legionely v moči byl rovněž opakovaně negativní. Biopsie kůže hodnocená zkušeným histopatologem nabízela diferenciálně diagnosticky polékový exantém, incipientní prepustulózní stadium akutní generalizované pustulózy a Stillovu nemoc adultního typu.
Stav pacientky zůstával i přes rozsáhlou intenzivní péči a širokospektrou antibiotickou i antimykotickou terapii nezlepšen. Na základě provedených vyšetření, absencí průkazu infekčního agens, známek imunodeficitu, maligního onemocnění či systémové choroby pojiva případně vaskulitidy, jsme se přiklonili k diagnóze Stillovy nemoci dospělých. Přes trvající febrilie a vysoké zánětlivé markery jsme ukončili antibiotickou léčbu a zahájili terapii intravenózními glukokortikoidy ve vysokých dávkách (3krát 1 g metylprednisolonu), na což pacientka promptně reagovala – otoky kloubů regredovaly, od 3. dne byla afebrilní, klesly zánětlivé markery, tepová frekvence klesla až k hodnotám 45/min, pacientka udávala výrazné subjektivní zlepšení stavu.
Po převodu intravenózních glukokortikoidů na perorální formu (prednison 60 mg/den) ovšem došlo v průběhu 24 hod k relapsu febrilií, pacientka byla přeložena na revmatologické lůžkové oddělení fakultní nemocnice, kde byla posílena imunosupresivní terapie přidáním cyklosporinu A v dávce 3 mg/kg/den a hydroxychlorochinu v dávce 2krát 200 mg/den. Tato léčba vedla ke kontrole febrilií a exantému, stále však i po měsíci přetrvávala vyšší hodnota CRP, jakož i artritida a občasné subfebrilie. Vzhledem k nutnosti podávání vysokých dávek glukokortikoidů a jen částečné regresi potíží byla zahájena terapie přípravkem anakinra v dávce 100 mg/den podkožně. Po 4 týdnech aplikace anakinry se pacientka dostavila k ambulantní kontrole. Zdravotní stav pacientky byl velmi příznivý. Veškeré kloubní a kožní příznaky choroby zcela regredovaly. Horečky ani subfebrilie se v mezidobí neobjevily. Laboratorní nálezy svědčily pro naprostou regresi zánětu, došlo k normalizaci hladiny CRP, feritinu, jaterních testů i hemoglobinu, pouze leukocyty se pohybovaly lehce na horní hranici normy (11 × 109/l). V terapii anakinrou se bude pokračovat přibližně 6 měsíců, bude postupně snižována dávka glukokortikoidů i ostatních imunosupresiv. Pacientka bude pečlivě dispenzarizovaná, jelikož riziko vzplanutí choroby je vysoké zejména v 1. roce od propuknutí nemoci (tab. 1, obr).
Tab. 1. Vývoj výsledků vybraných laboratorních testů v průběhu léčby u naší pacientky 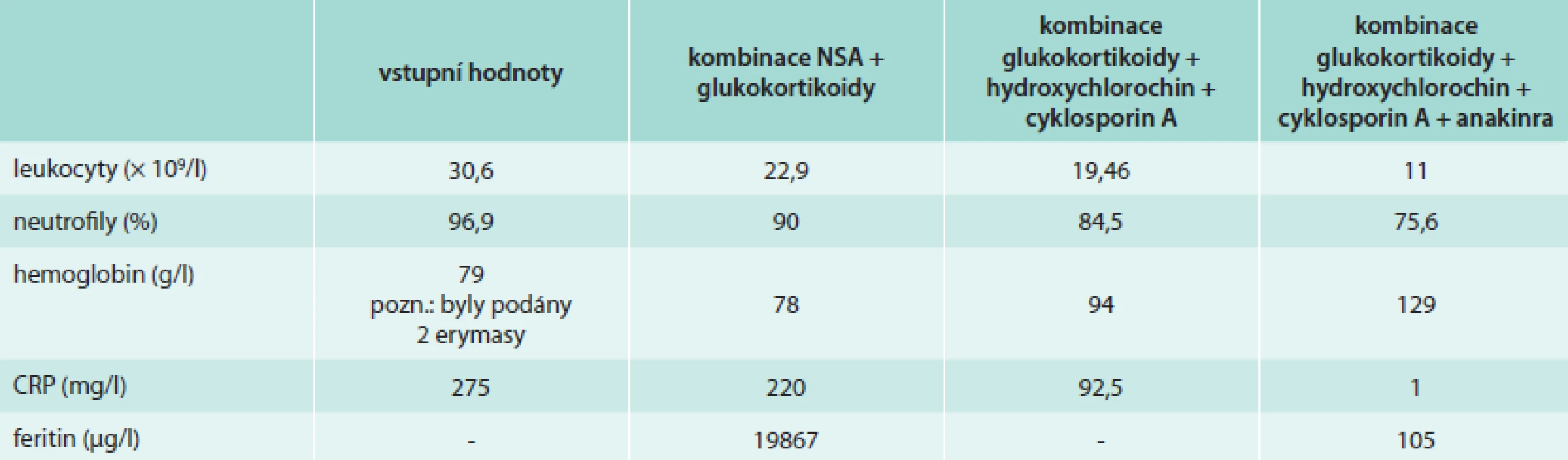
Obr. Fluidoperikard u naší pacientky 
Stillova nemoc dospělých
Stillova nemoc dospělých (adult-onset Still’s disease – AOSD) je vzácné akutní febrilní multisystémové onemocnění, pro které je charakteristická triáda: vysoké horečky, bolesti kloubů a prchavý kožní výsev. Vyskytuje se v méně než v 1 případu na 100 000 obyvatel, bez predispozice k některému z pohlaví [1,2]. Nejčastěji jsou postiženi lidé ve věku 15–25 let, další vrchol výskytu nemoci byl popsán mezi 36. a 46. rokem života [1].
Nemoc byla poprvé popsaná britským pediatrem Georgem Frederickem Stillem v roce 1896 u dětí. V roce 1971 se začal používat název Stillova nemoc dospělých dle příznaků skupiny dospělých nemocných, kteří nesplňovali kritéria pro klasickou revmatoidní artritidu, ale měli symptomy podobné dětem se systémovou formou juvenilní idiopatické artritidy [1].
Etiologie a patogeneze AOSD
Etiologie a patogeneze AOSD nejsou dosud objasněny. Uvažuje se o infekčních vyvolavatelích, které zahrnují řadu virových a bakteriálních agens. Dále se pomýšlí na vliv genetických faktorů a spojitost s HLA antigeny. Toto však nebylo jednoznačně potvrzeno. Rodinný výskyt či vyšší výskyt u dvojčat jsou zřídkavé [1].
V posledním desetiletí se objevují názory, že důležitou patogenetickou roli u AOSD mají změny v produkci cytokinů. V krvi a tkáních neléčených pacientů byly nalezeny zvýšené hladiny Th1 cytokinů, což je spojeno se zvýšenou tvorbou interleukinu 2 (IL2), interferonu γ (IFNγ) a tumor nekrotizujícího faktoru α (TNFα), které vedou B buňky k produkci IgG2a, aktivují makrofágy a NK buňky a dále podněcují buněčnou imunitu. Dále byla u pacientů s aktivní AOSD zjištěna zvýšená hladina IL6 a IL18 [3], IL1β [4]. Zvýšená hladina IL18 se na rozdíl od ostatních cytokinů zdá být více specifická pro AOSD než pro jiná systémová onemocnění [1].
Diagnostika
Diagnostika nemoci je složitá a často zdlouhavá, založená na klinických projevech. Neexistuje charakteristická protilátka, jediný specifický test nebo kombinace testů, které by vedly přímo ke stanovení diagnózy. Dosud bylo vytvořeno nejméně 7 skupin diagnostických kritérii, ze kterých jsou za nejcitlivější pokládána japonská Yamaguchi kritéria. Tato kritéria se skládají ze 4 hlavních: vysoká horečka, artralgie nebo artritida, nesvědící makulární nebo makulopapulární kožní exantém lososovité barvy a leukocytóza s převahou granulocytů. Vedlejší Yamaguchiho kritéria zahrnují: bolesti hrdla, lymfadenopatii, hepatomegalii nebo splenomegalii, abnormální hodnoty jaterních testů, negativní výsledek ANA a RF. Pro diagnózu Stillovy nemoci dospělých musí být splněno 5 kritérií, z toho nejméně 2 musí být hlavní kritéria a současně musí být vyloučena přítomnost infekce, malignity či jiného revmatologického onemocnění, které by mohly tuto nemoc imitovat [1,3,4]. Kritéria jsou podrobně shrnuta v tab. 2.
Tab. 2. Diagnostická kritéria pro AOSD a porovnání s případem naší pacientky. Upraveno podle [3]. ![Diagnostická kritéria pro AOSD a porovnání s případem naší pacientky. Upraveno podle [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/169060c7fd04c1e9aa06f9647617d673.png)
U 30–40 % pacientů s AOSD se popisuje postižení kardiovaskulárního systému a plic ve smyslu perikardiálních a pleurálních výpotků a plicních infiltrací. Obvykle převažuje mírný rozsah postižení, byly však popsány i závažné intersticiální plicní nemoci vedoucí k akutní respirační insuficienci [1]. Výpotek u řady revmatologických onemocnění, zvláště u revmatoidní artritidy, je makroskopicky žlutozelený [5], biochemicky se jedná o exsudát, má nízké pH a nízkou hladinu glukózy [6], je vysoce buněčný s převahou neutrofilů [7], což může vést k mylnému podezření na empyém. Při kultivaci revmatologického výpotku však nenacházíme infekční agens.
Rovněž existuje řada laboratorních abnormalit, které u pacientů s AOSD nacházíme. Žádná z nich sice není pro nemoc specifická, přesto jejich přítomnost spolu s klinickými příznaky mohou vést k podezření na Stillovu nemoc. Kromě výrazné elevace zánětlivých markerů je častá i anémie a trombocytóza. 75 % pacientů má vyšší hladinu ALT, AST a LDH. 70 % pacientů má extrémně zvýšenou hladinu sérového feritinu, až 5krát nad normu. Tak vysoký stupeň hyperferitinemie není typický pro jiné revmatologické nemoci a je indikátorem aktivity choroby v důsledku aktivace makrofágů [4]. Dle literatury [1] je vhodné současně stanovit glykosylovanou frakci sérového feritinu, která bývá u Stillovy nemoci snížená. Kombinace výrazné hyperferitinemie a nízké hladiny glykosylované frakce feritinu (méně než 20 %) mělo dle jedné práce [1] až 93% specifitu pro AOSD. Tyto laboratorní markery jsou zahrnuty v novějších diagnostických kritériích dle Fautlera (tab. 2). Stanovení glykosylované frakce feritinu však není v běžné praxi dostupné. Negativita ANA a RF jsou jedním z hlavních Cushiho a vedlejších Yamaguchiho kritérií, přesto lehce zvýšené titry jsou zpočátku nápomocné spíše k odlišení jiných nemocí. V iniciální akutní fázi AOSD obyčejně nejsou na klasických RTG snímcích zachyceny žádné radiografické změny bolestmi postižených kloubů, bývají přítomny u méně než 10 % pacientů, co může také ztížit diagnostiku AOSD [1].
Zobrazovací metody
Zobrazovací metody jsou zpočátku nápomocné spíše k odlišení jiných nemocí. V iniciální akutní fázi AOSD obyčejně nejsou na klasických RTG snímcích zachyceny žádné radiografické změny bolestmi postižených kloubů. Někdy se popisují otoky měkkých tkání, výpotky kloubů nebo lehká periartikulární demineralizace [3]. Ke klasickým radiografickým nálezům v pozdějším období patří neerozivní zúžení karpometakarpálního a interkarpálního kloubního prostoru, které často progreduje do ankylózy [1]. Mohou však být postiženy i jiné klouby (tab. 3).
Tab. 3. Četnost klinických projevů AOSD dle publikovaných prací a porovnání s naší pacientkou. Upraveno podle [3]. ![Četnost klinických projevů AOSD dle publikovaných prací a porovnání s naší pacientkou.
Upraveno podle [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/407a9140c8cabce95558234c64b28dab.png)
Diferenciální diagnostika
V rámci diferenciální diagnostiky je vždy nutno vyloučit 3 hlavní skupiny nemocí: infekce, malignity a systémové autoimunitní nemoci. Další méně častou skupinou horeček neznámého původu jsou tzv. periodické horečkovité stavy, jako jsou rodinná středozemní horečka a s TNF receptorem asociovaný periodický syndrom (TRAPS) [3]. Nejčastější nemoci přicházející do úvahy jsou shrnuty v tab. 4.
Tab. 4. Nejčastější příčiny klasické horečky neznámého původu. Upraveno podle [17]. ![Nejčastější příčiny klasické horečky neznámého původu. Upraveno podle [17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0bd1cae3a26703b07475cd3688e97353.png)
Průběh a prognóza
Průběh a prognóza AOSD jsou variabilní. Přibližně u 1/3 pacientů probíhá onemocnění monofázicky, resp. monocyklicky, nemoc trvá týdny až měsíce a do roka dochází k úplné doživotní remisi. U těchto pacientů dominují horečky, exantém, serozitidy a splenomegalie. U další 1/3 pacientů má nemoc polycyklický relabující průběh, po přechodné remisi, trvající týdny až 2 roky, znovu dochází k vzplanutí nemoci. Poslední 1/3 pacientů trpí chronickým aktivně perzistujícím onemocněním. U této skupiny dominuje postižení kloubů a je přítomno vyšší riziko vzniku destruktivní artritidy [1]. Chronicky aktivní onemocnění může vést i k orgánovému postižení či sekundární amyloidóze se všemi jejími důsledky. Poměrně vzácnou hematologickou komplikací je syndrom aktivovaných makrofágů, který v nepoznané formě může vést k úmrtí pacienta [8,9]. K dalším závažným, ale ne častým komplikacím AOSD patří diseminovaná intravaskulární koagulopatie a fulminantně probíhající hepatitida [4].
Terapie
Terapie Stillovy nemoci je vzhledem k její nízké incidenci založená na retrospektivních analýzách, observačních studiích malých souborů pacientů a kazuistických sděleních. Standardně užívané léky lze rozdělit do 3 skupin. První skupinu představují nesteroidní antirevmatika a glukokortikoidy jako léky využívané především v akutní fázi. Nesteroidní antirevmatika přinášejí úlevu jenom u asi 20 % jedinců, za nejvíce efektivní se považuje indometacin [4]. Dávky podávaných glukokortikoidů jsou obyčejně vysoké (0,5–1 mg/kg), v život ohrožujících stavech se podávají pulzně [8]. Při jejich redukci často dochází k relapsu onemocnění. Při nedostatečném efektu glukokortikoidů a ve snaze snížit jejich nežádoucí účinky se využívá jejích kombinace s konvenčními syntetickými DMARDs (disease modifying antirheumatic drugs), ke kterým patří na prvním místě metotrexát, dále hydroxychlorochin, azatioprim, cyklosporin, zlato nebo leflunomid [8]. Metotrexát se upřednostňuje zvláště u pacientů s dominantně vyjádřeným postižením skeletu [10]. U pacientů nereagujících na tuto léčbu byl opakovaně dokumentován efekt biologické terapie. Využívají se antagonisty TNFα etanercept a infliximab, dále antagonista proti receptoru interleukinu 1 (IL1-Ra) anakinra, inhibitor IL6 tocilizumab, chimérická protilátka proti CD20 rituximab, kostimulátor blokády T buněk abatacept, inhibitor IL1 kanakinubab [3,4,10].
Zvláště efektivní a slibné se podle posledních prací jeví u AOSD použití právě anti-IL1-R anakinry u pacientů s dominujícími systémovými projevy [10]. V dávce 100 mg/den podáváno subkutánně v kombinaci s glukokortikoidy vede anakinra dle dostupných, převážně zahraničních publikací k rapidnímu ústupu potíží už v průběhu několika dní. V průběhu týdnů až měsíců dochází i k normalizaci laboratorních parametrů: k poklesu CRP a hyperferitemie. I v porovnání s klasickými DMARDs vede léčba glukokortikoidy s anakinrou k lepším výsledkům [10–13]. Byly dokumentovány i případy, v nichž došlo k dosažení remise i v případě, že byla anakinra podávaná v monoterapii [10]. Léčba anakinrou je v zásadě dobře tolerována [14]. K hlavním nežádoucím účinkům patří dle Evropské agentury pro léčivé přípravky lokální reakce po aplikaci léku a mírná neutropenie, která ale nevyžaduje přerušení léčby a nebyla spojena se vznikem infekce. Incidence vážných infekcí ve studiích s aplikací 100 mg/den byla 1,8 % ve skupině pacientů léčených anakinrou a 0,7 % ve skupině pacientů léčených placebem. V průběhu 3letého období zůstával počet závažných infekcí stabilní, jednalo se převážně o bakteriální infekce jako pneumonie či infekční onemocnění kostí a kloubů, v souvislosti s infekcemi se nevyskytla žádná úmrtí. Většina pacientů po ústupu infekce pokračovala v užívání testovaného léčiva [15]. V případě, že pacient nereaguje nebo není schopný denní terapie anakinrou, lze zvážit terapii tocilizumabem, Při selhání obou preparátů přichází do úvahy terapie rituximabem a kanakinubabem [10].
Diskuse a závěry
U naší pacientky byly pomocí obšírné diagnostiky vyloučeny typické i méně časté nemoci vedoucí k přetrvávajícím horečkám, artralgiím, perikardiálním a pleurálním výpotkům. Byla splněna diagnostická kritéria pro AOSD dle Yamaguchiho, dle Cushe i dle Fautlera (tab. 2).
Diagnostika Stillovy nemoci dospělých je náročná a obyčejně trvá i několik týdnů, v tomto případě doba od začátku příznaků do vyslovení diagnózy uběhly přibližně 4 týdny. Při zpětném přehodnocování diagnostického postupu lze identifikovat 4 příčiny, které dle našeho názoru cestu ke konečné diagnóze AOSD nejvíce ztížily. Zaprvé se jedná o nemoc zřídkavou, se kterou se v klinické praxi potká jen část internistů. Zadruhé, zavádějícím nálezem byla pozitivita protilátek proti Legionella pneumophila ve třídě IgM a na tom postavený předpoklad, že by se mohlo jednat o legionářskou nemoc, proti čemuž však svědčil opakovaně negativní test na legionelový antigen v moči. Hodnocení hladiny titrů možných podtypů legionely nám pomohlo toto onemocnění vyloučit. Třetím zavádějícím okamžikem bylo vyhodnocení výpotků, které byly zpočátku hodnoceny jako možný empyém vzhledem k výrazné přítomnosti neutrofilů. Čtvrtým důvodem, proč se u pacientky pátralo především po možném infekčním agens a byla opakovaně prolongovaná antibiotická terapie, byla také vyšší hladina prokalcitoninu. To však diagnózu AOSD nevylučuje. Např. práce italských autorů [16] dochází k závěru, že právě u pacientů s AOSD bývá prokalcitonin často pozitivní i bez přítomnosti infekční komplikace.
Závěrem lze shrnout, že Stillova nemoc dospělých je vzácné, komplikované, potencionálně život ohrožující onemocnění, na které je nutno pomýšlet v případě trvajících vysokých horeček, či v rámci diferenciální diagnostiky domnělého septického stavu nereagujícího na standardní léčbu. Základní triádu symptomů tvoří vysoké horečky, artralgie a prchavý exantém, ale jedná se o multisystémové onemocnění a s tím spojenou různorodou symptomatologii. K stanovení diagnózy dojdeme způsobem per exclusionem, po pečlivém vyloučení infekčních, nádorových a autoimunitních onemocnění a naplnění určitých diagnostických kritérií. Cílená léčba pozůstávající z kombinace glukokortikoidů, konvenčních syntetických DMARDs a nových imunomodulačních biologických přípravků, z kterých zatím velmi slibné výsledky přináší preparát anakinra, dává pacientům naději na rychlou kompletní remisi a umožňuje jim návrat do běžného života.
MUDr. Jana Malegová
jana.malegova@bnzlin.cz
Interní klinika IPVZ Praha a Baťovy krajské nemocnice, a.s., Zlín
www.kntb.cz
Doručeno do redakce: 25. 1. 2014
Přijato po recenzi: 4. 3. 2014
Zdroje
1. Mandl LA. Clinical manifestations and diagnosis of adult Still’s disease. Dostupné z: <http://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-adult-stills-disease>.
2. Hu Q, Yan Z, Zhong J. Adult-onset Still’s disease: how to make a diagnosis in untypical case. Rheumatol Int 2012; 32(10): 3299–3302.
3. Efthimiou P, Paik PK, Bielory L. Diagnosis and management of adult onset Still’s disease. Ann Rheum Dis 2006; 65(5): 564–572.
4. Fong WS, Lui NL. Adult-Onset Still’s Disease: A Review. Proceedings of Singapore Healthcare 2013; 22(1): 44–47.
5. Heffner JE. Diagnostic evaluation of a pleural effusion in adults: Initial testing. Dostupné z: <http://www.uptodate.com/contents/diagnostic-evaluation-of-a-pleural-effusion-in-adults-initial-testing>.6. Fila L. Pleurální výpotky. Interní Med 2007; 9(11): 490–494.
7. Jakubec P, Palatka K, Jakubcová T et al. Úvod do laboratorní diagnostiky pleurálního výpotku. Vnitř Lék 2008; 54(3): 265–272.
8. Skácelová M, Horák P. Stillova nemoc dospělých. Čes Revmatol 2012; 20(4): 198–202.
9. Tomš J, Soukup T, Polák J et al. Multiorgánové selhání a syndrom aktivovaných makrofágů u Stillovy nemoci v dospělosti. Čes Revmatol 2012; 20(3): 133–137.
10. Mandl LA. Treatment of adult Still’s disease. Dostupné z: <http://www.uptodate.com/contents/treatment-of-adult-stills-disease>.
11. Laskari K, Tzioufas AG, Moutsopoulos HM. Efficacy and long-term follow-up of IL-1R inhibitor anakinra in adults with Still’s disease: a case-series study. Arthritis Res Ther 2011; 13(3): R91.
12. Nordström D, Knight A, Luukkainen R et al. Beneficial effect of interleukin 1 with anakinra in adult-onset Still’s disease: An open, randomized, multicenter study. J Rheumatol 2012; 39(10): 2008–2011.
13. Kalliolias GD, Georgiou PE, Antonopoulos IA et al. Anakinra treatment in patients with adult-onset Still’s disease is fast, effective, safe and steroid sparing: experience from an uncontrolled trial. Ann Rheum Dis 2007; 66(6): 842–843.
14. Tegzová D, Vencovský J, Hrba J et al. Nežádoucí účinky léků používaných v revmatologii a základní principy sledování jejich bezpečnosti. II. Biologické léky, kortikosteroidy, antiporotika. Klin Farmakol Farm 2004; 18(1): 30–37.
15. Kineret. EMA. Product Information. Ema.europa.eu [online]. © 1995–2013 [cit. 2013–12–28]. Dostupné z: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-Product_Information/human/000363/WC500042310.pdf>.
16. Scirè CA, Cavagna L, Perotti C et al. Diagnostic value of procalcitonin measurement in febrile patients with systemic autoimmune diseases. Clin Exp Rhematol 2006; 24(2): 123–128.
17. Smíšková D. Diferenciální diagnostika a léčba nejasných horečnatých stavů. Med Pro Praxi 2010; 7(1): 41–43.
Štítky
Dětská revmatologie Diabetologie Endokrinologie Interní lékařství Pediatrie Revmatologie
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 5-6- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Erdheimova-Chesterova choroba – poddiagnostikovaná zriedkavá choroba? – editorial
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – editorial
- Přínos natriuretických peptidů v současné klinické praxi – editorial
- Sentinelová biopsie, stručný nástin problematiky – editorial
- Časování chirurgické a endoskopické terapie akutní biliární pankreatitidy v podmínkách terciární nemocnice v České republice
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – naše zkušenosti za posledních 15 let
- Význam EKG u pacientov s resynchronizačnou liečbou
- Srdcové zlyhávanie – dá sa liečiť ovplyvnením kardiálneho metabolizmu?
- Difuzní idiopatická skeletární hyperostóza
- Proč a jak působí inzulinové přípravky na hmotnost
- Význam chuti v udržení homeostázy organizmu a patologický dopad vyrušení orocefalických reflexů ve vazbě na sladkou chuť v následku konzumace nekalorických sladidel
- Životní styl a riziko civilizačních nemocí
- Management chronických onemocnění v mezinárodním srovnání
- Rizikové faktory a prediktory progrese Barrettova jícnu do adenokarcinomu
- Přínos natriuretických peptidů v současné klinické praxi
- Sentinelová uzlina pri malígnom melanóme
- Manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- PET-CT dokumentovaná kompletní 4letá remise Erdheimovy-Chesterovy nemoci po léčbě kladribinem
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Extraadrenálny paraganglióm
- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Ruptura jater s hemoperitoneem jako vzácná komplikace kardiopulmonální resuscitace u mladé pacientky s akutním infarktem myokardu
- Near-infrared spectroscopy (NIRS), nová technika intrakoronárního zobrazení nestabilního koronárního plátu
- Význam stanovení natriuretických peptidů a prokalcitoninu u akutního srdečního selhání
- XVII International Congress on Nutrition and Metabolism in Renal Disease
- Rozlúčka s profesorom Ďurišom, nestorom Slovenskej internej medicíny
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Difuzní idiopatická skeletární hyperostóza
- Sentinelová uzlina pri malígnom melanóme
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



