-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Péče o diabetika s cévním onemocněním
Care for diabetic patients with vascular disease
There is an association between vascular complications and diabetes compensation in ambulatory as well as inpatient care. Diagnostics of vascular complications in diabetic patients are linked to increased risk of contrast‑induced nephropathy. Treatment of severe vascular complications usually requires hospitalization. Achieving and maintaining target glycaemia is essential. Compensation of hyperglycaemia must be sufficient and timely; the risk of hypoglycaemia must not be ignored. Target glycaemia values must be adjusted individually, insulin administration is usually preferred.
Key words:
complications of diabetes – comorbidities of diabetes – contrast‑induced nephropathy – target glycaemia – cardiovascular risk – diabetes mellitus
Autoři: A. Šmahelová
Působiště autorů: Diabetologické centrum Kliniky gerontologické a metabolické Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Luboš Sobotka, CSc.
Vyšlo v časopise: Vnitř Lék 2010; 56(4): 324-328
Kategorie: 11. celostátní diabetologické sympozium „Diabetes a angiologie“ , Hradec Králové, 5.– 6. června 2009
Souhrn
Cévní komplikace souvisejí s kompenzací diabetu při ambulantní i ústavní péči. Diagnostika cévních komplikací u diabetika je spojena s vyšším rizikem kontrastní nefropatie. Léčba závažných cévních komplikací probíhá z velké části při hospitalizaci. Velmi důležité je dosažení a udržení cílové glykemie. Hyperglykemie musí být včas dostatečně korigována, nesmí být ale ignorováno riziko hypoglykemie. Cílové glykemie je nutné upravovat individuálně, preferováno je obvykle podání inzulinu.
Klíčová slova:
komplikace diabetu – komorbidity diabetu – kontrastní nefropatie – cílová glykemie – kardiovaskulární riziko – diabetes mellitusÚvod
Výskyt komplikací diabetu v České republice se zvyšuje [1] (graf 1) a současně s tím se zvyšují i náklady na jejich léčbu [2]. Se zvyšující se prevalencí diabetu stoupá i výskyt cévních onemocnění. O péči diabetika s cévním onemocněním se dělí diabetolog a příslušný specialista, tedy zejména kardiolog, angiolog, ale v případě komplikací i další odborníci, např. nefrolog.
Graf 1. Vývoj komplikací diabetu v České republice [1]. ![Vývoj komplikací diabetu v České republice [1].](https://pl-master.mdcdn.cz/media/image/8bb71327edfc3efafd6de3ab5ffdb1bc.jpg?version=1537795165)
Co ovlivňuje vztah diabetu a cévních onemocnění
Mezi diabetem a cévními onemocněními je jasná epidemiologická souvislost [3]. Tento vztah je ovlivněn metabolickou kompenzací diabetu. Při vyšší glykemii je výskyt diabetické makroangiopatie i mikroangiopatie vyšší [4]. Současně jen částečně platí, že kompenzace diabetu ovlivňuje i recidivu cévního onemocnění. U pacientů s dobrou sekundární prevencí statinem není hodnota glykovaného hemoglobinu (HbA1c) prediktivní pro recidivu kardiovaskulární příhody [5]. Často se ale na diagnózu diabetu nemyslí, vyšetření glykemie při výskytu cévních onemocnění je proto nezbytné. Glykemie je třeba vyšetřovat i při předoperační přípravě a perioperačně. Kompenzaci diabetu je nutné pečlivě sledovat i při akutním interkurentním onemocnění, kde dominuje především korekce aktuálních glykemií. Optimální kompenzace diabetika v prevenci a léčbě cévních komplikací však neznamená pouze korekci glykemií, ale i dalších faktorů. Konsenzuálně jsou stanoveny a s postupným nárůstem poznatků aktuálně upravovány cílové parametry komplexní kompenzace diabetika (tab. 1).
Tab. 1. Metabolická kompenzace diabetika. 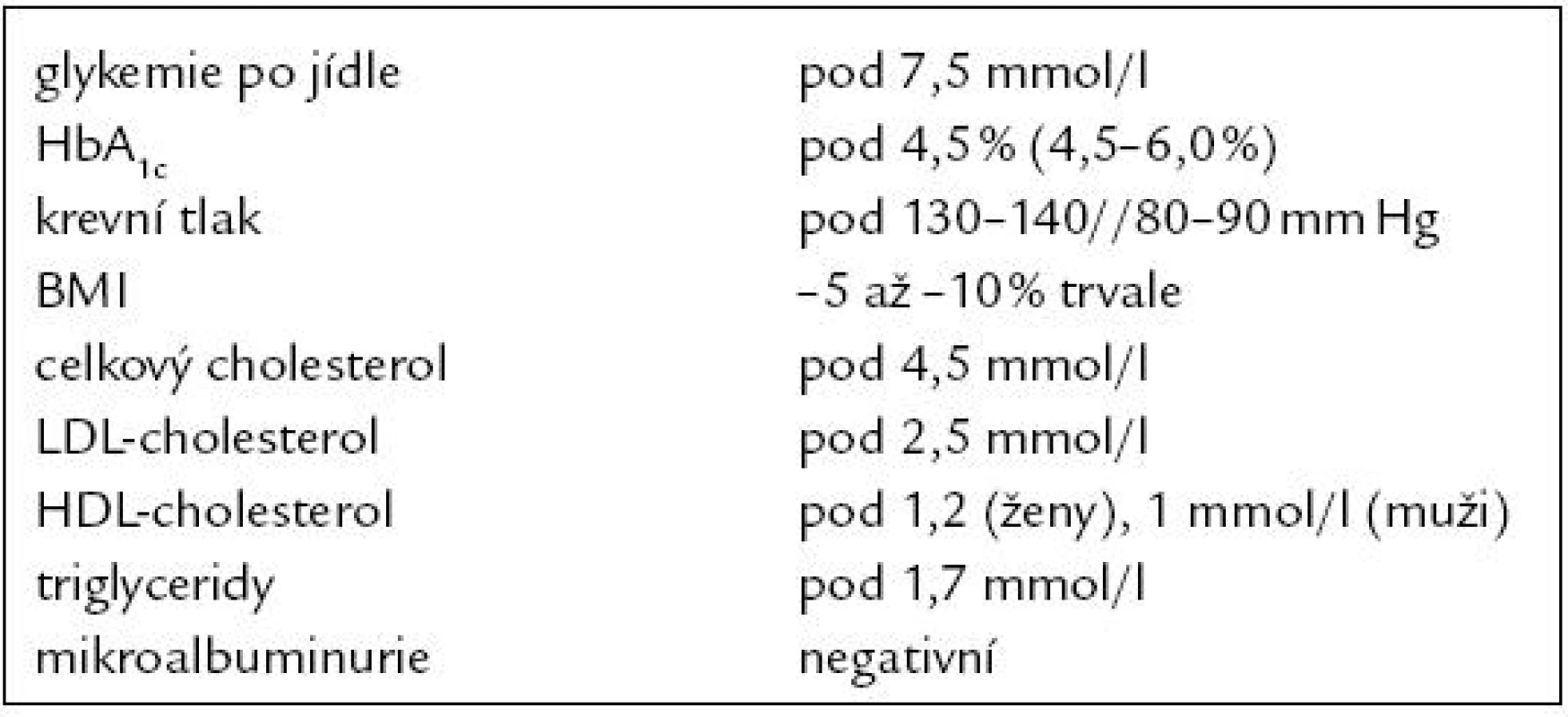
RTG kontrastní vyšetření u diabetika s cévním onemocněním
Vyšetřovací metody, využívané k dia-gnostice cévního postižení, vyžadují často podání RTG kontrastní látky. Diabetici jsou při těchto vyšetřeních zvýšeně ohroženi poškozením funkce ledvin. Aplikace RTG kontrastních látek může, byť většinou reverzibilně, akutně poškodit funkci ledvin [6,7]. Kontrastní nefropatie je např. ve Spojených státech amerických třetí příčinou renální insuficience u hospitalizovaných a s tímto faktem je spojena i významná morbidita a mortalita [8]. K predispozičním faktorům rozvoje kontrastní nefropatie patří primární chronické onemocnění ledvin. Do této skupiny pacientů patří i diabetici. Zejména jsou ohroženi pacienti s glomerulární filtrací nižší než 1 ml/ sec. Riziko koreluje se stavem hydratace, typem a množstvím podané kontrastní látky, případným souběžným podáváním léků s potenciálně nefrotoxickými účinky. Pravděpodobnost kontrastní nefropatie je také vyšší, jestliže předcházelo podobné vyšetření či zákrok v krátkém časovém odstupu. Observační studie naznačují, že kontrastní nefropatie je markerem vyšší mortality. K jasnému závěru však chybí prospektivní studie [9]. Přesto se zvyšuje počet publikací, které prokazují souvislost mezi kontrastní nefropatií a signifikantním zvýšením mortality při hospitalizaci i dlouhodobě, např. po koronárním vyšetření [10,11]. Léčba je stejná jako u akutní tubulární nekrózy, tedy hydratace a normalizace minerálové dysbalance. Speciální léčba neexistuje, důležitá je proto prevence.
Prevence kontrastní nefropatie
V klinické praxi nesmíme podceňovat dostatečnou hydrataci izotonickými infuzními roztoky nejen po, ale i před vyšetřením. Perorální způsob hydratace podle některých prací zvyšuje riziko kontrastní nefropatie [12]. Diuretika jsou indikována pouze ke korekci volumu, pro prevenci nemají význam, podobně jako manitol. Metformin a nesteroidní antirevmatika je nutné před vyšetřením vždy vysadit. Před opětným zahájením léčby metforminem je nutná kontrola renálních funkcí. To je často zanedbáváno, např. v univerzitní pittsburgské nemocnici byl metformin vrácen bez kontroly renálních funkcí polovině sledovaných diabetiků s RTG kontrastním vyšetřením [13]. Doporučení přerušit léčbu metforminem dva dny před RTG kontrastním vyšetřením nebylo doloženo žádnou studií a v praxi vede ke zbytečnému přerušení léčby hyperglykemie. S ohledem na nízkou lipofilitu a krátký plazmatický poločas metforminu by mělo u pacientů s normální renální funkcí stačit metformin odebrat večer před vyšetřením. Znovu nasazen by měl být ale dva dny po výkonu po ověření renálních funkcí [14]. Studie REMEDIAL potvrdila možný benefit acetylcysteinu v dávce 600 – 1 200 mg perorálně 2krát denně jeden den před a jeden den po vyšetření [15]. Při intravenózní aplikaci hrozí riziko anafylatické reakce. Hemodialýza a hemofiltrace nejsou preventivně doporučovány. Přesvědčivý efekt nemají další látky (renální vazodilatátory, atriální natiruetický peptid, kyselina askorbová, statiny).
Farmakoterapie v prevenci a léčbě cévních komplikací diabetu
Pro konzervativní léčbu cévních komplikací diabetu využíváme řadu léků a léčbu sestavujeme vždy komplexně [16]. První projevy mikroangiopatického postižení, mikroalbuminurie a proteinurie, jsou významně ovlivnitelné antihypertenzivy i fibráty, diabetická retinopatie fibráty. V léčbě diabetické makroangiopatie je zásadní důsledná léčba hypertenze i dyslipidemie, nejlépe kombinací hypolipidemik. I při volbě antidiabetik by měly být zvažovány jejich cévní efekty. Na cévní stěnu a projevy cévních onemocnění prokazatelně působí tzv. inzulinové senzitizéry, deriváty sulfonylurey a metformin. Z analog inkretinových mimetik má pravděpodobně významný kardiovaskulární protektivní efekt liraglutid, nyní uváděný na trh [17]. Ve vývoji jsou i další léky ovlivňující cévní diabetické komplikace. Již dnes by ale měl každý lékař v prevenci i léčbě cévních komplikací diabetu volit adekvátní léčbu antihypertenzivy, hypolipidemiky i antidiabetiky.
Kompenzace diabetu u hospitalizovaného diabetika s cévním onemocněním
Většina pacientů není hospitalizována primárně pro dekompenzaci diabetu, avšak správná kompenzace diabetu je zásadní pro zdárný průběh léčby jakéhokoli konkomitujícího onemocnění. Ke korekci hyperglykemie přistupuje v řadě případů problém s nutričním zajištěním. Rozšířeným nešvarem je aktuální aplikace dávky inzulinu se zpožděním, protože se čeká na výsledek okamžité glykemie. Pokud se chceme vyhnout zbytečnému prodlužování doby k dosažení optimální korekce glykemie bez extrémních výkyvů jak k hyperglykemii, tak i hypoglykemii, je nezbytné naplánovat fixní antidiabetickou strategii, kterou upravujeme dle aktuálních hodnot glykemie. U hospitalizovaných diabetiků bývá tolerována relativně mírná hyperglykemie. Nalezení správného inzulinového režimu komplikují některé faktory, např. režim odlišný od domácího režimu (pacienti většinou méně jedí, jsou tedy ve vyšším riziku hypoglykemie). U diabetiků podstupujících chirurgický výkon je riziko dobře kompenzovaného diabetika shodné s rizikem nediabetika. Diabetik je ale vždy navíc v možném ohrožení akutní diabetickou komplikací (hypoglykemie, diabetická ketoacidóza, neketotický hyperosmolální hyperglykemický stav). Asi u pětiny všech operovaných pacientů je diabetes diagnostikován v souvislosti s chirurgickým zákrokem. Rozhodnutí o hodnotě cílové glykemie a způsobu korekce hyperglykemie u hospitalizovaného diabetika není jednoduché. To souvisí s heterogenitou onemocnění a problémem s určením stadia diabetu. Důležitou pomůckou je vyšetření C peptidu. Standardně je za hypoglykemickou hodnotu považována glykemie nižší než 3,5 (případně 3,3) mmol/ l a za rizikovou s ohledem na riziko rozvoje ketoacidózy hodnota glykemie nad 16 mmol/ l. Vždy je však nezbytné vzít v úvahu konkrétní okolnosti, celkový stav a prognózu pacienta, techniku vyšetření glykemie i kvalifikaci ošetřujícího personálu. Vytvoření jednoduchého obecně vždy platného schématu je proto velmi obtížné. Vždy je nutná konzultace diabetologa. Hodnota cílové glykemie při hospitalizaci, která je spojená se zvýšením morbidity a mortality, se liší podle různých studií a populace sledovaných pacientů. Primární komplikací zlepšené kompenzace glykemií je hypoglykemie, proto je nutný dostatečný monitoring, edukace personálu a správně vypracované standardizované postupy na jednotlivých pracovištích.Ve Fakultní nemocnici v Hradci Králové jsou cílové hodnoty glykemie na jednotkách intenzivní péče 6,5 – 8 mmol/ l [18]. U diabetiků hospitalizovaných na standardním oddělení je možno za dobrou kompenzaci diabetu považovat hodnoty glykemie nalačno 5,5 mmol/ l, za hodinu po jídle do 9 mmol/ l, za 2 hod po jídle do 7 mmol/ l a před spaním nad 6,5 mmol/ l (tab. 2).
Tab. 2. Optimální kompenzace hospitalizovaného diabetika. 
U všech diabetiků je nutné vědět, co pacient skutečně jí, tedy objektivně bilancovat příjem stravy. Výhodná je někdy aplikace bolusů těsně po jídle, většinou krátkým inzulinovým analogem, kdy je možné dávku přizpůsobit zkonzumovanému jídlu. U pacientů s kontinuální enterální nebo parenterální výživou je nutné kontrolovat glykemie po 4 – 6 hod, u pacientů s intravenózní infuzí inzulinu v intervalech 30 – 120 min [19] (graf 2). U hospitalizovaných diabetiků je potřeba inzulinu oproti nediabetickým kontrolám vyšší, u diabetiků, kteří přijímají potravu perorálně, je potřeba prandiálního (nutričního) inzulinu i korekčního inzulinu nižší než u diabetiků, které je nutné živit parenterálně nebo enterálně [20]. U diabetiků 1. typu je obvyklá denní dávka inzulinu 0,5 – 0,7 j. na kg a den (průměrně 40 j. za den, polovina připadá na bazální inzulin, polovina na bolusy). U všech diabetiků je nutný bazální inzulin (množství inzulinu, potřebné k udržení euglykemie bez nutrice), i když pacient nejí. Při zvýšených nárocích na metabolizmus (např. infekce, těžký stres) je potřeba bazálního, ale i prandiálního inzulinu přibližně o třetinu vyšší. U diabetiků 2. typu komplikuje rozhodnutí o optimálním antihyperglykemickém režimu heterogenita onemocnění. U diabetiků léčených dosud perorálním antidiabetiky lze někdy léčbu ponechat a inzulin do schématu přidat, někdy pouze přechodně. To je možné jen u stabilizovaného průběhu. Nelze podceňovat známá rizika, zejména hypoglykemie při léčbě sulfonylureou nebo laktátové acidózy u metforminu (viz výše). U thiazolidindionů je nutné pamatovat na riziko kardiálního selhání. Denní dávka inzulinu na začátku inzulinoterapie se pohybuje od 0,3 j. na kg hmotnosti na den, ale při výrazné inzulinové rezistenci (metabolický stres, katabolický stav, infekce) může překročit i 1 j. na kg hmotnosti na den. Poměrně často jsou voleny nižší dávky, než by odpovídalo aktuálnímu stavu (inzulinová rezistence).
Graf 2. Přežívání u intenzivně a konvenčně léčených diabetiků na jednotkách intenzivní péče [19]. ![Přežívání u intenzivně a konvenčně léčených diabetiků na jednotkách intenzivní péče [19].](https://pl-master.mdcdn.cz/media/image/714dc74c633fa1550d42ba3ec5dfeb2b.jpg?version=1537794578)
U diabetiků 2. typu s inzulinoterapií z domova většinou zachováme stejný režim s úpravou dávkování. U hospitali-zovaných diabetiků s cévním onemocněním je nutná intravenózní infuze inzulinu při akutní dekompenzaci diabetu (ketoacidóza, hyperglykemie s hyperosmolalitou). Dále během operace nebo prolongovaného hladovění, kdy pacient nepřijímá per os nic déle než 8 hod. Dalším důvodem je akutní infarkt myokardu.
Úprava antihyperglykemické léčby diabetika před plánovanou operací
Glykemie v perioperačním období by měla být udržována tak, aby nepřevýšila hodnotu 11 mmol/ l, ale současně neklesla pod 8 mmol/ l. Případná hypoglykemie je v tomto období pro pacienta nevýhodná. Glykemie má být vyšetřována každou hodinu, dále potom po 4 hodinách. Běžně se používá infuze glukózy s inzulinem (500 ml 10% glukózy a 12 – 20 j. krátkodobého inzulinu podle hmotnosti s 10 – 20 mmol chloridu draselného podle kalemie) rychlostí 80 ml za hod. Výhoda infuze GKI vychází z teorie nerovnováhy mezi nízkou zásobou substrátu pro glykolýzu v hypoperfundované tkáni a zvýšenou nabídkou volných mastných kyselin. Mobilizace mastných kyselin z tukové tkáně je důsledkem lipolýzy, která je navozena katecholaminy. Studie byly ale prováděny na nediabeticích, příp. na pacientech s mírnou hyperglykemií. Optimálně by u diabetiků měla být podávána glukóza a inzulin zvlášť (minimálně pro optimální titraci inzulinu) [21].
Inzulin a korekce glykemie při intenzivní péči o diabetika s cévním onemocněním
Intenzivní inzulinová terapie snižuje mortalitu u diabetiků po akutním infarktu myokardu [22]. Intenzivní inzulinová léčba zlepšila oproti konvenčnímu inzulinovému režimu přežívání pacientů na jednotkách intenzivní péče [23]. Ve studii DIGAMI se při intenzivní inzulinové léčbě infuzí glukózy s inzulinem v prvních 24 hod po akutním infarktu myokardu snížila jednoroční mortalita o 30 % a 3,4letá mortalita o 11 %. Ve studii DIGAMI 2 (tedy follow up DIGAMI u 1 253 pacientů) byla celková mortalita u všech diabetiků bez ohledu na léčbu nižší (18,4 % vs očekávaná 22,3 %). Další průběh kardiovaskulárního onemocnění se u dobře kompenzovaných diabetiků nelišil od nediabetiků. Glykemie byla potvrzena jako silný nezávislý prediktivní faktor mortality po akutním infarktu myokardu. To je důvod intenzivní korekce glykemií u těchto stavů. Je však nutno počítat s faktem, že v DIGAMI 2 byli zařazeni pouze diabetici 2. typu, v původní studii DIGAMI byli sledováni pacienti mladší, všichni byli diabetici a všichni byli léčeni agresivně [24 – 26].
Možná rizika intenzivní korekce hyperglykemie
Nejen vysoká, ale i nízká glykemie nalačno je prediktor kardiovaskulární morbidity a mortality [27]. U starších diabetiků 2. typu (průměrný věk 65 let) byla nalezena korelace mezi hypoglykemií a demencí [28]. Diabetici 1. typu jsou při nízké glykemii v noci ohroženi arytmií. Např. bigeminicky vázané komorové ektopické extrasystoly byly zachyceny kontinuálním měřením intersticiální koncentrace glukózy již při glykemii 3,4 mmol/ l [29]. Již dlouho je znám syndrom náhlého úmrtí mladých diabetiků 1. typu v noci („dead in bed“), za jehož příčinu je považována pravděpodobně maligní arytmie [30]. V poslední době se přistupuje ke korekci glykemií u kriticky nemocných pacientů rezervovaněji. Studie NICE - SUGAR poukázala na horší přežívání intenzivně korigovaných glykemií. U kriticky nemocných se doporučuje zahájit korekci hyperglykemie při glykemii 10 mmol/ l a preferováno je infuzní podání inzulinu. Přívod inzulinu by měl být snížen už při glykemii 5,5 mmol/ l. U pacientů, kteří nejsou kriticky nemocní, je doporučena cílová glykemie před jídlem pod 7,8 mmol/ l a náhodně změřená pod 10 mmol/ l. U terminálně nemocných by měly být voleny méně přísné cílové glykemie [19]. U většiny hospitalizovaných vyžadujících léčbu hyperglykemie nejsou perorální antidiabetika vhodná a je doporučena inzulinová léčba. Hyperglykemie se vyskytuje také u mnoha hospitalizovaných pacientů léčených kortikoidy. Nezbytné je monitorování glykemií alespoň po dobu 48 hod a případné zahájení antihyperglykemické léčby. U pacientů s kontinuální enterální nebo parenterální výživou je nutné kontrolovat glykemie po 4 – 6 hod.
Závěr
U každého pacienta s cévním onemocněním je třeba vždy ověřit přítomnost diabetu, diabetes léčit a uvádět v dokumentaci. Diabetikovi je třeba věnovat vždy větší pozornost než jiným pacientům (tab. 3). Důvodem je zvýšený výskyt komplikací i vyšší mortalita kardiovaskulárního onemocnění než u nediabetika se stejným postižením. Léčba diabetika je také významně dražší, což zohledňuje mimo jiné např. systém DRG.Důležitá je rovněž důsledná léčba všech komorbidit (např. hypertenze, dyslipidemie, infekce). Cílovou glykemii je nutné posuzovat s ohledem na prognózu i délku trvání diabetu. I diabetik bez manifestních komplikací má pravděpodobně latentní kardiovaskulární onemocnění. Diabetici patří mezi skupinu pacientů s vyšší rizikem rozvoje kontrastní nefropatie. Škodlivost hyperglykemie ve vztahu k průběhu a výsledku hospitalizace byla jasně prokázána. Proto nesmí být hyperglykemie u hospitalizovaných ignorována a její korekce musí být korigována dostatečně bez prodlevy. Dnes už jsou ale známá a prokázána i rizika hypoglykemie. Proto je nezbytné upravit adekvátní cílové glykemie individuálně. Léčba perorálními antidiabetiky má u hospitalizovaných pacientů řadu omezení, proto je při korekci hyperglykemie preferován inzulin. Vzhledem k složitosti inzulinových režimů, používaných dnes, je rozhodně na místě konzilium kvalifikovaného diabetologa. Důležitá je také včasná odpovídající diabetologická, příp. nutriční edukace.
Tab. 3. Zásady péče o diabetika s cévním onemocněním. 
doc. MUDr. Alena Šmahelová, Ph.D.
www.fnhk.cz
e-mail: smahelov@lfhk.cuni.czDoručeno do redakce: 3. 1. 2010
Zdroje
1. ÚZIS ČR, Aktuální informace č. 36, 2009.
2. Horák P. Farmakoekonomika léčby diabetu – trendy u nás. Vnitř Lék 2009; 55, 331 – 342.3. Almeda ‑ Valdes P, Cuevas ‑ Ramos D, Mehta R et al. UKPDS Risk Engine, Decode and Diabetes PHD Models for the Estimation of Cardiovascular Risk in Patients with Diabetes. Curr Diabetes Rev 2009. Epub ahead of print.
4. Holman RR, Watkins PJ. UKPDS – the first 30 years. Oxford: Wiley ‑ Blackwell 2008.
5. Kauffman AB, Delate T, Olson KL et al. Relationship between haemoglobin A1C values and recurrent cardiac events: A retrospective, longitudinal cohort study. Clin Drug Investig 2008; 28 : 501 – 507.
6. Schwab SJ, Hlatky MA, Pieper KS et al. Contrast nephrotoxicity: a randomized controlled trial of a nonionic and an ionic radiographic contrast agent. N Engl J Med 1989; 320 : 149 – 153.
7. Asif A, Epstein M. Prevention of radiocontrast‑induced nephropathy. Am J Kidney Dis 2004; 44 : 12 – 24.
8. Schweiger MJ, Chambers CE, Davidson CJ et al. Prevention of contrast induced nephropathy: recommendations for the high risk patient undergoing cardiovascular procedures. Catheter Cardiovasc Interv 2007; 69 : 135 – 140.
9. Rudnick M, Feldman H. Contrast‑induced nephropathy: what are the true clinical consequences? Clin J Am Soc Nephrol 2008; 3 : 263 – 272.
10. Gruberg L, Mintz GS, Mehran R et al. The prognostic implications of further renal function deterioration within 48 h of interventional coronary procedures in patients with pre‑existent chronic renal insufficiency. J Am Coll Cardiol 2000; 36 : 1542 – 1548.
11. Rihal CS, Textor SC, Grill DE et al. Incidence and prognostic importance of acute renal failure after percutaneous coronary intervention. Circulation 2002; 105 : 2259 – 2264.
12. Dussol B, Morange S, Loundoun A et al. A randomized trial of saline hydration to prevent contrast nephropathy in chronic renal failure patients. Nephrol Dial Transplant 2006; 21 : 2120 – 2126.
13. Calabrese AT, Coley KC, DaPos SV et al. Evaluation of prescribing practices: risk of lactic acidosis with metformin therapy. Arch Intern Med 2002; 162 : 434 – 437.
14. Holstein A, Stumvoll M. Contraindications can damage your health – is metformin a case in point? Diabetologia 2005; 48 : 2454 – 2459.
15. Briguori C, Airoldi F, D’Andrea D et al. Renal Insufficiency Following Contrast Media Administration Trial (REMEDIAL): a randomized comparison of 3 preventive strategies. Circulation 2007; 115 : 1211 – 1217.
16. Šmahelová A. Konzervativní léčba diabetické mikroangiopatie a makroangiopatie. Čas Lék Čes 2009; 148 : 72 – 79.
17. NovoNordisk Book if Abstracts, Internatiional Diabetes Federation 20th World Diabetes Congress, Montreal, 18. – 22. October 2009.
18. ZS/ 1a/ 10 Postupy pro diagnostiku a terapii vybraných stavů závazné pro zdravotnická pracoviště FN HK A ZS/ 4 - PPZ/ 10.
19. Finfer S, Chittock DR, Su SY et al. NICE SUGAR Study Investigators. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009; 360 : 1283 – 1297.
20. Clement S, Braithwaite SS, Magee MF et al. Management of diabetes and hyperglycemia in hospitals. Diabetes Care 2004; 27 : 553 – 591.
21. Fonseca VA. Clinical Diabetes: translating Research into Practice. 1st ed. Philadelphia: Saunders Elsevier 2006.22. Malmberg K, Norhammar A, Wedel H et al. Glycometabolic state at admission: important risk marker of mortality in conventionally treated patients with diabetes mellitus and acute myocardial infarction: long‑term results from the Diabetes and Insulin‑Glucose Infusion in Acute Myocardial Infarction (DIGAMI) study. Circulation 1999; 99 : 2626 – 2632.
23. van den Berghe G, Wouters P, Weekers Fet al. Intensive insulin therapy in critically ill patients. N Engl J Med 2001; 345 : 1359 – 1867.
24. Malmberg K, Rydén L, Wedel H et al. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity Eur Heart J 2004; 26 : 650 – 661.
25. van den Berghe G. Insulin vs. strict blood glucose control to achieve a survival benefit after AMI? Eur Heart J 2005; 26 : 639 – 641.
26. Hirsch IB. Were We Wrong About Insulin and Acute Myocardial Infarction? DOC News. 2004. Available from: http:/ / docnews.diabetesjournals.org/ content/ 1/ 2/ 4.full.
27. Wei M, Gibbons LW, Mitchell TL et al. Low fasting plasma glucose level as a predictor of cardiovascular disease and all‑cause mortality. Circulation 2000; 101 : 2047 – 2052.28. Whitmer RA, Gunderson EP. Obesity in middle age and future risk of dementia: a 27 year longitudinal population based study. JAMA 2009; 301 : 1565 – 1572.
29. Gill GV, Woodward A, Casson IF et al. Cardiac arrhythmia and nocturnal hypoglycaemia in type 1 diabetes – the “dead in bed” syndrome revisited. Diabetologia 2009; 52 : 42 – 45.
30. Tu E, Twigg SM, Semsarian C. Sudden death in type 1 diabetes: the mystery of the ‚dead in bed‘ syndrome. Int J Cardiol 2010; 138 : 91 – 93.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Úvodní slovoČlánek Angiopatie a oko
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Úvodní slovo
- Diabetes a prediktivní medicína – paralaxa současnosti
- Endokrinní odchylky a cévy u diabetiků
- Diabetes mellitus a protrombotická aktivita
- Co spojuje obezitu a aterosklerózu?
- Pohybová aktivita v prevenci cévních komplikací a diabetes
- Hyperglykemie v akutní fázi mozkové ischemie a rekanalizační léčba
- Diabetes mellitus a ischemická choroba srdeční
- Léčba hypertenze u pacientů s diabetes mellitus a ischemickou chorobou dolních končetin
- Antihyperglykemická léčba a cévní onemocnění
- Chirurgická léčba ischemické choroby srdeční a diabetes mellitus
- Perkutánní intervenční výkony na věnčitých tepnách u diabetiků
- Péče o diabetika s cévním onemocněním
- Flebologické problémy a diabetes
- Angiopatie a oko
- Ischemická choroba dolních končetin a diabetes
- Komplexní péče o diabetika se syndromem diabetické nohy
- Klinický význam cévního postižení u diabetiků s onemocněním ledvin – pohled nefrologa
- Lokální léčba ran a cévní zásobení
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Angiopatie a oko
- Ischemická choroba dolních končetin a diabetes
- Chirurgická léčba ischemické choroby srdeční a diabetes mellitus
- Diabetes mellitus a ischemická choroba srdeční
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



