-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
Turner syndrome is associated with increased cardiovascular morbidity and mortality
The authors present a case of an acute myocardial infarction in a patient with Turner syndrome, leading to the death of the patient. An emphasis is put on the need of a thorough examination of cardiovascular system, specialized on congenital heart disease including aortic dilatation with the risk of dissection, and early development of ischemic heart disease. Regular monitoring as well as adequate therapy in patients suffering from this genetically determined disorder is recommended.
Key words:
Turner syndrome – ischemic heart disease – myocardial infarction – congenital heart disease
Autoři: M. Berková 1; Z. Berka 2; Z. Krčová 3
Působiště autorů: I. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Jan Lukl, CSc. 1; II. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta doc. MUDr. Vlastimil Procházka, Ph. D. 2; Ústav patologie Lékařské fakulty UP a FN Olomouc, přednosta doc. MUDr. Martin Tichý, CSc. 3
Vyšlo v časopise: Vnitř Lék 2009; 55(5): 523-528
Kategorie: Kazuistiky
Souhrn
Turnerův syndrom je spojen se zvýšenou kardiovaskulární morbiditou a mortalitou [1]. Kazuistika prezentuje případ akutního infarktu myokardu u pacientky s Turnerovým syndromem, končící smrtí pacientky. Zdůrazňuje nutnost pečlivého vyšetření kardiovaskulárního systému se zaměřením na srdeční vady včetně dilatace aorty s rizikem disekce a předčasný rozvoj ischemické choroby srdeční. Důležité je pravidelné sledování a včasná a adekvátní terapie u pacientek s tímto geneticky podmíněným postižením.
Klíčová slova:
Turnerův syndrom – ischemická choroba srdeční – infarkt myokardu – vrozené srdeční vadyÚvod
Turnerův syndrom, který je charakterizován monosomií či strukturální abnormalitou chromozomu X, představuje zvýšené riziko předčasného rozvoje ischemické choroby srdeční a zvýšené kardiovaskulární morbidity a mortality žen, které jsou nositelkami této genetické odchylky. To dokládá i námi popsaný případ.
Popis případu
41letá pacientka byla přivezena na interní kliniku pro protrahované, několik dní se opakující tlakové bolesti za hrudní kostí s progredující ponámahovou dušností, později i dušností klidovou.
Anamnesticky pacientka uváděla již prodělaný infarkt myokardu ve svých 27 letech, z dalších onemocnění hypertenzi a opakované záněty močových cest. Byla po operaci glaukomu a trpěla dalekozrakostí a nedoslýchavostí. Doma užívala Vasocardin 50 mg 3krát 1 tbl., Anopyrin 100 mg tbl. a Verogalid 120 mg tbl. 1krát denně. Při somatickém vyšetření obézní pacientky malého vzrůstu (156 cm, 73 kg, BMI 30,05) s krátkým, širokým krkem a plošším hrudníkem byly na plicích slyšitelné vlhké chrůpky při bazích a systolický šelest na hrotě srdečním. Na EKG při přijetí byl zaznamenán blok pravého Tawarova raménka a změny svědčící pro subakutní přední infarkt myokardu s elevacemi ST segmentu a již vytvořenými Q vlnami v hrudních svodech (obr. 1). Na RTG plic byly přítomny známky městnání v malém oběhu s tvorbou fluidotoraxů bilaterálně (obr. 2). Provedená koronarografie odhalila vícečetné postižení koronárního řečiště s ostiálně uzavřeným ramus interventricularis anterior a subtotální stenózou periferní části ramus circumflexus. Při ventrikulografii byla prokázána nízká ejekční frakce levé komory (20 %) a mitrální insuficience s regurgitací kontrastní látky do celé levé síně. Špatnou funkci levé komory s akinézou hrotu, přední stěny, septa a hrotu a významnou mitrální insuficienci potvrdilo i echokardiografické vyšetření.
Obr. 1. EKG při přijetí pacientky. Blok pravého Tawarova raménka a známky subakutního infarktu myokardu na přední stěně s elevacemi ST segmentu a již vytvořenými Q vlnami ve svodech V<sub>1</sub>– V<sub>5</sub>. 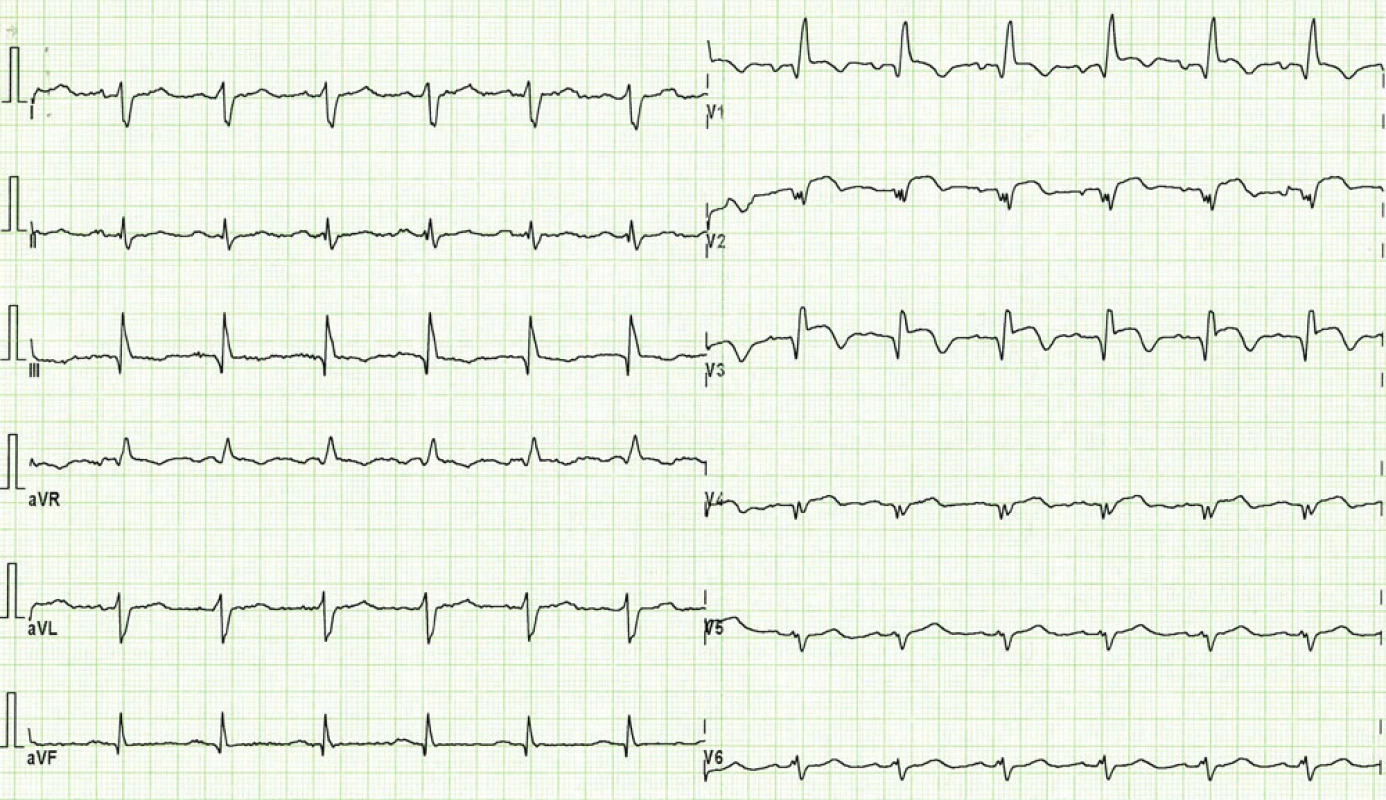
Obr. 2. RTG srdce a plic: fluidotoraxy bilaterálně. 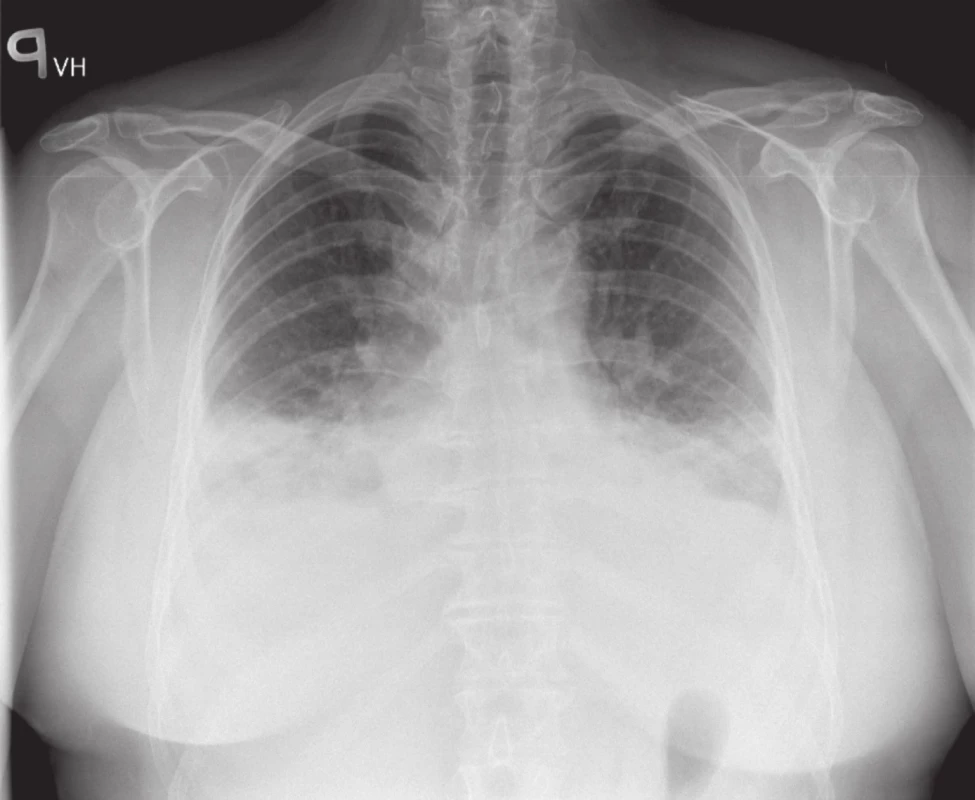
V laboratorních hodnotách nebyly zřetelné patologické hodnoty, kromě elevace troponinu I (4,31 μg/l, norma 0–0,42 µg/l) a vysoké hodnoty NT pro BNP (6 301 ng/l, norma 0,1–144,0 ng/l). Lipidový profil, kromě snížené hladiny HDL‑cholesterolu (0,85 mmol/l, norma 1,2–1,6 mol/l), i hodnoty glykemií se pohybovaly v normálním rozmezí (tab. 1).
Pacientka byla po přijetí farmakologicky zaléčena pro akutní koronární syndrom s levostrannou srdeční slabostí (nitráty, diuretika, ACE‑inhibitory, antiagregancia, nízkomolekulární heparin, statiny, po stabilizaci i beta--blokátory). Před zvažovanou kombinovanou kardiochirugickou operací (revaskularizace aortokoronárními bypassy a plastika mitrální chlopně) bylo provedeno vyšetření myokardu jednofotonovou emisní výpočetní tomografií (SPECT), které prokázalo nepříznivý nález – neviabilní tkáň myokardu anteroseptálně a apikálně v rozsahu 33 % levé komory (obr. 3, 4 a 5).
Obr. 3. SPECT myokardu – schéma konstrukce počítačově generovaných polárních map ke kvantifikaci rozsahu a závažnosti perfuzní abnormality. Klidové vyšetření jednofotonovou emisní výpočetní tomografií (SPECT) k průkazu viability myokardu s aplikací 74 MBq <sup>201</sup>thallia (<sup>201</sup>Tl) s časným a pozdním snímáním dat bylo provedeno na dvoudetektorové scintilační kameře Siemens e.cam (Siemens Medical Solutions, Erlangen, Německo) vybavené paralelními kolimátory typu LEHR, při EKG synchronizovaném nahrávání dat. 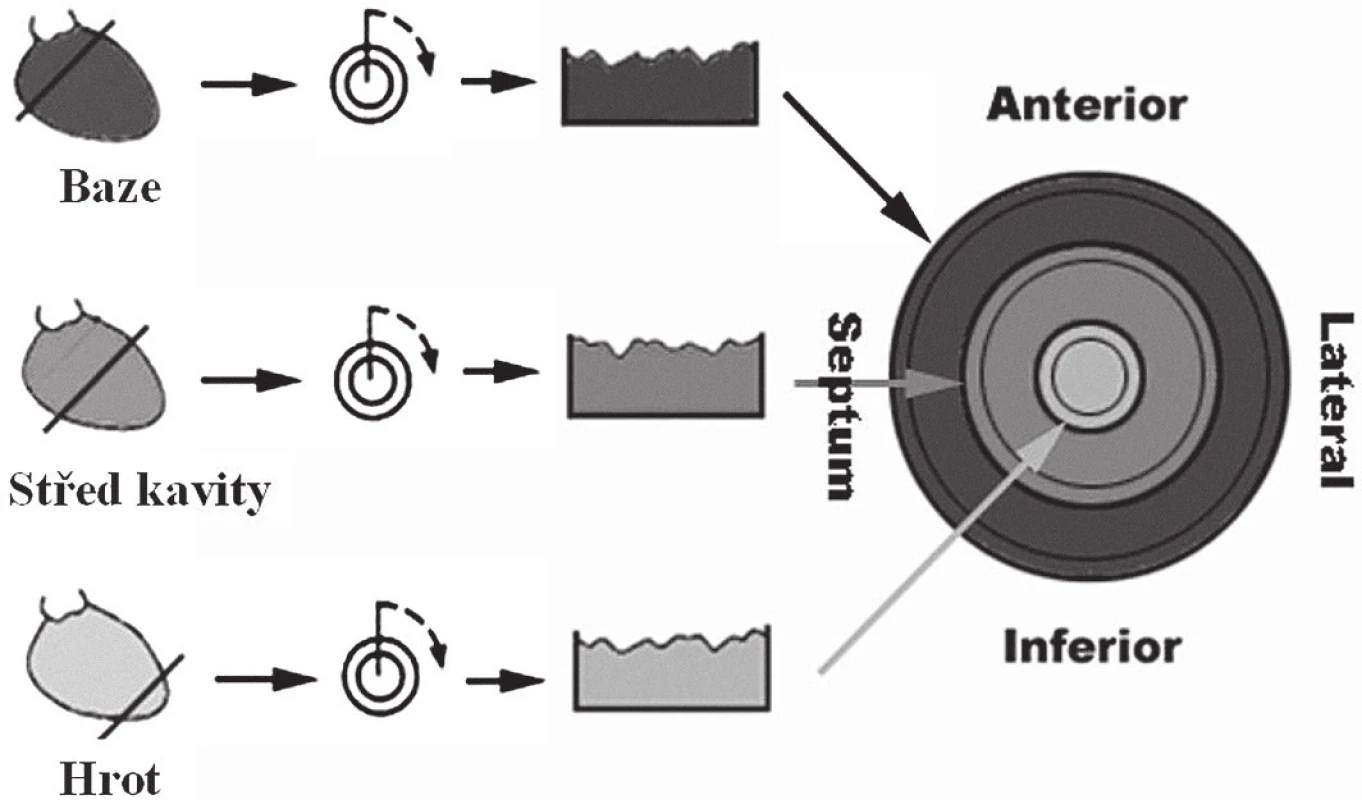
Obr. 4. Zobrazení perfuze myokardu pacientky po aplikaci radiofarmaka. Výpadek perfuze anteroseptálně, apikálně a inferolaterálně časně po aplikaci <sup>201</sup>Tl – kvantitativně se jedná o perfuzní defekt v rozsahu 43 % z levé komory (obr. 4 nahoře), při pozdním zobrazení se nález prakticky nemění (obr. 4 uprostřed). V oblasti perfuzního defektu převažuje nízký stupeň vychytávání radiofarmaka pod 50 % maxima, což svědčí pro neviabilní myokard v rozsahu 33 % z levé komory (obr. 4 dole). 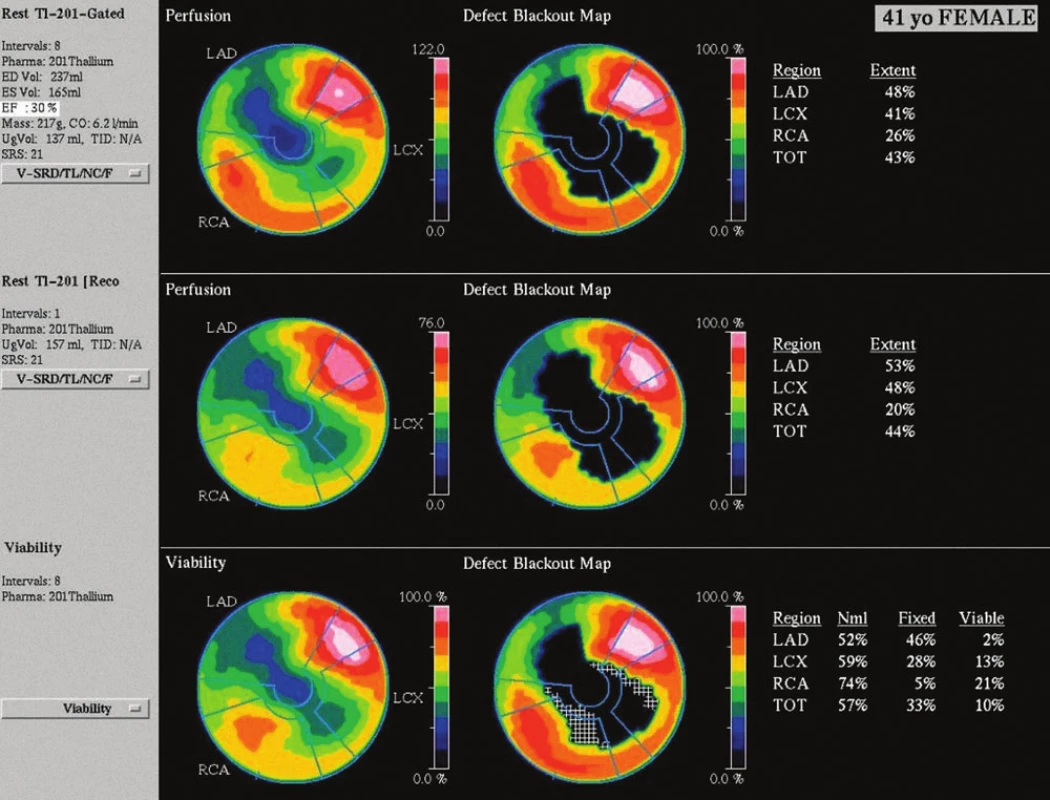
Obr. 5. Gated SPECT 3D. Znázornění endokardiálního povrchu levé komory v end-diastole a end-systole s patrnou difuzní hypokinézou a akinézou hrotu (obrazová dokumentace SPECTu myokardu s popisem – doc. MUDr. M. Kamínek, Ph.D., Klinika nukleární medicíny, FN Olomouc). 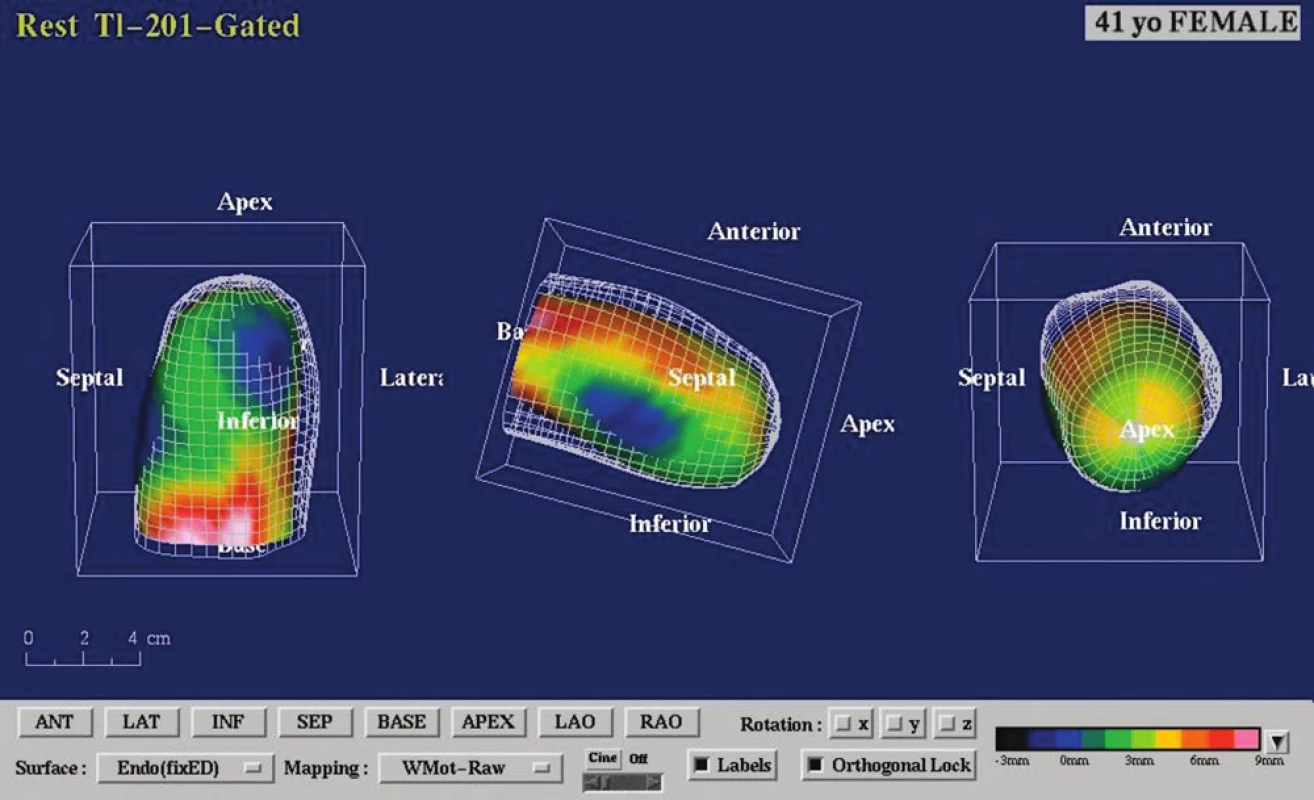
Při medikamentózní terapii se klinický stav pacientky pozvolna lepší, 7. den však dochází k polymorfní komorové tachykardii, opakovaně degenerující do fibrilace komor, která byla rezistentní na opakované defibrilační výboje a vedla k exitu pacientky (obr. 6).
Obr. 6. Polymorfní komorová tachykardie degenerující do fibrilace komor – záznam při resuscitaci. 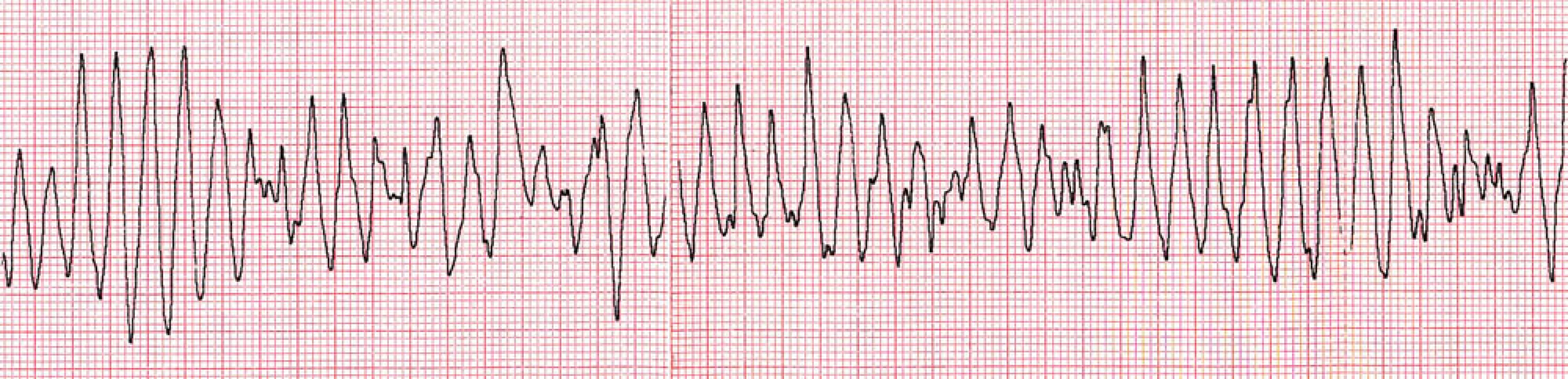
Praktický lékař potvrdil, že u pacientky byl již v dětství geneticky prokázán Turnerův syndrom (TS), ač sama pacientka tuto diagnózu ani její léčbu v anamnéze neuvedla. Z podrobné dokumentace praktického lékaře vyplývá, že se nemocná narodila jako dítě z první gravidity, s negativní perinatální anamnézou. Ve 3 měsících života byla zjištěna kongenitální dysplazie kyčlí (aplikováno široké balení, Pavlíkovy třmeny) a v pozdějším období zřetelné známky Turnerova syndromu (pterygium colli, cubiti valgi, strabizmus, retardace růstu). Pacientka byla vyšetřena ve 4 letech věku ve specializované endokrinologické poradně. Byla potvrzena gonadální dysgeneze s karyotypem 45X. V 15 letech pacientka měřila 139 cm a vážila 41 kg. Byla doporučena gynekologická hormonální substituční terapie – estrogeny, posléze v kombinaci s progesteronem: Agofollin, Agolutin, později Mestranol + Provera, posledních 11 let Klimonorm tbl. ve zvyklém cyklu (tj. estradiol-valerát 2,0 mg po 9 dní, dalších 12 dní v kombinaci s levonorgestrelem 0,15 mg s následnou sedmidenní pauzou).
Psychický vývoj pacientky byl normální, bez neurokognitivního deficitu. Z paměťových funkcí převládala paměť mechanická, velmi dobré byly verbální vyjadřovací schopnosti. Povahově byla nemocná hodnocena jako komunikativní a společenská, aktivní v mimoškolní činnosti. Dosáhla středního odborného vzdělání s průměrným školním prospěchem. Po ukončení vzdělání pracovala v oboru jemné mechaniky.
Během života byla pacientka v dětství i dospělosti opakovaně hospitalizována pro recidivující infekce močových cest při vrozené anomálii uropoetického aparátu (podkovovitá ledvina). V 19 letech jí byla diagnostikována hypertenzní nemoc. V 27 letech života byla pacientka poprvé hospitalizována a léčena (farmakoterapie) na spádovém interním oddělení pro akutní infarkt myokardu. Po propuštění byla předána do péče ambulantního kardiologa a gynekologa. K další hospitalizaci na spádové interně byla přijata ve svých 34 letech pro syndrom nestabilní anginy pectoris. Byla nastavena medikamentózní terapie a po odeznění anginózních potíží a stabilizaci stavu byla pacientka opět předána do péče ambulantního kardiologa. Při nastavené léčbě beta‑blokátory (Vasocardin), blokátory kalciového kanálu (Verogalid), nitráty (Sorbimon) a antiagregancii (Anopyrin) byla bez potíží a výsledek kontrolní ergometrie bez diagnostických změn. Poslední 3 roky přestala docházet na pravidelné kontroly do kardiologické ambulance. Pravidelně chodila na gynekologii na prohlídky a pro předpis hormonální substituční terapie.
Po exitu pacientky byla provedena patologicko‑anatomická sekce. Levá komora byla excentricky hypertrofická (550 g) a dilatovaná, tloušťka zadní stěny dosahovala 23 mm, přední stěna, ztenčená na 8 mm, byla postižena rozsáhlým anteroseptálním infarktovým ložiskem 5 × 7 cm, sahajícím od apexu k úponům mitrální chlopně, s tvorbou aneuryzmatu. Na koronárních tepnách dominoval trombotický uzávěr proximální části ramus interven-tricularis anterior ve vzdálenosti 1,5 cm od odstupu této větve z kmene a. coronaria sinistra. Trombus nasedal na excentricky uložený plát, táhnoucí se v průběhu celé tepny. Ramus circumflexus a a. coronaria dextra byly gracilní tepny, výrazně skleroticky postižené, s luminem zúženým o 25–50 % fibrózními, ložiskově kalcifikovanými pláty. Mitrální chlopeň byla jemná, mírně zkrácená v předním cípu, pravostranné chlopně byly bez patologie. Jako další abnormality na kardiovaskulárním aparátu byly nalezeny bikuspidální aortální chlopeň a zúžení aorty prstencového vzhledu za odstupem a. subclavia sinistra. Hrudní aorta byla před a za koarktací dilatována na 5 cm. Abdominální aorta se jevila nerozšířená, s vazivovými i zvápenatělými pláty. Konzistence plic byla přiměřená, řez vlhký, vzdušný, s malým množstvím zpěněné tekutiny, bronchy volné, v pleurálních dutinách bylo přítomno 700 ml serózní tekutiny. Uropoetický aparát byl tvořen jednou velkou podkovovitou ledvinou se srostlými dolními póly. Vagina i uterus byly hypoplastické a zcela chyběla ovaria. Z dalších nálezů byla zjištěna klinicky němá lymfoplazmocytární tyreoiditida.
Patologicko‑anatomický nález na srdci potvrdil klinickou diagnózu infarktu myokardu jako příčinu smrti.
Diskuze
Kazuistika popisuje akutní infarkt myokardu končící smrtí u 41leté pacientky s Turnerovým syndromem.
Turnerův syndrom, charakterizovaný geneticky kompletní či parciální monosomií chromozomu X, se fenotypicky projevuje řadou morfologických i funkčních abnormalit, z nichž zásadní význam má (kromě vrozených vad kardiovaskulárního systému) nedostatek ženských pohlavních hormonů při dysgenezi ovarií. Nedostatek estrogenů podmiňuje další četné komplikace, mezi něž patří i předčasný rozvoj ischemické choroby srdeční při chybějícím kardioprotektivním účinku estrogenů [2]. Postižení kardiovaskulárního aparátu je tak nejčastější příčinou zvýšené mortality pacientek s Turnerovým syndromem.
Turnerův syndrom byl u nemocné správně diagnostikován a geneticky potvrzen již v dětství. I přesto, že pacientka v uvedeném případu nebyla léčena v dětství růstovým hormonem, který se podává k dosažení vyššího vzrůstu, nemocná dosáhla výšky 156 cm (léčba růstovým hormonem v době dětství pacientky nebyla ještě dostupná). Svou roli zde zřejmě sehrál geneticky podmíněný vysoký vzrůst rodičů. V pubertě začala být nemocná léčena substituční hormonální terapií (estrogeny, gestagen), která umožnila vývoj sekundárních pohlavních znaků, pozitivně ovlivnila stavbu a mineralizaci kostí a přispěla k psychosomatickému rozvoji pacientky. V 19 letech byla u nemocné diagnostikována hypertenze. Ještě před dosažením 30 let pacientka prodělala první infarkt myokardu, a to i přes zmiňovanou hormonální substituční terapii ženskými pohlavními hormony a negativní rodinnou anamnézu stran předčasného výskytu ischemické choroby srdeční. Výskyt hypertenze, která je rizikovým faktorem pro rozvoj ischemické choroby srdeční, je 3krát častější u žen s Turnerovým syndromem než v běžné ženské populaci [3]. Z dalších rizikových faktorů byla přítomna dyslipoproteinemie se sníženou hladinou HDL‑cholesterolu, ale bez zvýšení celkové hladiny cholesterolu a LDL‑cholesterolu, rovněž triglyceridy byly v normě. V literatuře jsou citovány práce, které prokazují ve studiích na populaci žen s Turnerovým syndromem zvýšené hodnoty celkového cholesterolu i LDL‑cholesterolu oproti ženám s normálním karyotypem, jiné práce však tyto nálezy nepotvrdily [4–9].
Pacientka trpěla dalšími vrozenými kardiovaskulárními vadami, které velmi často provázejí Turnerův syndrom a které nebyly u pacientky za jejího života odhaleny. Dětství a adolescence pacientky je datováno do 60. a 70. let 20. století, kdy nynější vyšetřovací metody jako echokardiografie a magnetická rezonance nebyly rutinně k dispozici, a proto pátrání po kongenitálních abnormalitách bylo podstatně obtížnější. Ani při poslední hospitalizaci však nebyla za života pacientky diagnostikována bikuspidální aortální chlopeň (horší echokardiografická vyšetřitelnost pacientky), ani přítomnost koarktace aorty. K vyšetření kardiovaskulárního systému magnetickou rezonancí již nedošlo vzhledem k exitu nemocné.
U pacientky nebyla klinicky zjištěna porucha funkce štítné žlázy, histologicky však byly prokázány známky tyreoiditidy s lymfocytární infiltrací.
V dnešní době jsou všechny ženy s Turnerovým syndromem od dětství sledovány a léčeny na specializovaných ambulantních pracovištích. Vyšetření kardiovaskulárního aparátu by mělo být zaměřeno na nejčastější malformace spojené s Turnerovým syndromem, ke kterým patří kromě bikuspidální aortální chlopně a koarktace aorty také prolaps s insuficiencí mitrální chlopně a dilatace aorty. Častá dilatace aorty je rizikovým faktorem pro disekci aorty, která může být rovněž příčinou smrti pacientky s Turnerovým syndromem [10,11]. Vysoké riziko ICHS u TS je předmětem dalšího bádání.
Recentní studie u pacientek s Turnerovým syndromem ukazují na možné další souvislosti spojené s chyběním druhého chromozomu X. I když druhý chromozom X je u žen běžné populace inaktivní, některé z genů na něm lokalizovaných inaktivaci unikají, a uplatňují se tak fenotypicky. Studie Vana et al přináší srovnání souboru 118 mladých žen s Turnerovým syndromem se skupinou 51 žen srovnatelného věku a body mass indexu (BMI) s normálním karyotypem, ale předčasným selháním ovarií. Obě skupiny žen měly vysazenou substituční hormonální terapii estrogeny. U žen s TS zjistili signifikantně vyšší hladiny LDL cholesterolu a triacylglycerolů. Velikost HDL i LDL částic, studovaná spektroskopicky za využití magnetické rezonance, byla signifikantně menší u pacientek s TS než u žen s předčasným selháním ovarií. Velikost lipidových částic je považována za důležitější v aterogenitě než jejich celková hmotnost. Pacientky s TS měly více aterogenní lipidový profil nezávisle na působení estrogenů [12]. Autoři zvažují kardioprotektivní vliv druhého chromozomu X.
Při absenci jednoho z dvojice genů může hrát důležitou úlohu také genomický imprinting. Genomický imprinting je stav, kdy o aktivitě určitého genu rozhoduje jeho rodičovský původ, to znamená, zda jej daný jedinec zdědil po matce či po otci (maternální či paternální původ). Bondy et al zjistili při srovnání lipidového profilu a rozložení tělesného tuku u pacientek s monosomií chromozomu X signifikantně vyšší LDL‑cholesterol, triacylglyceroly a větší množství viscerálního tuku u žen s přítomností maternálního chromozomu X [13]. Pokud by gen či geny vázané na paternální chromozom X pozitivně ovlivňovaly lipidový metabolizmus, mohl by se tento vliv projevit u žen, a nikoli u mužů. Tato zajímavá zjištění však vyžadují v tomto směru další studie. Celý ženský genom zmapovali poprvé experti z Lékařského genetického centra Leidenovy univerzity v Nizozemsku v květnu roku 2008 (genom člověka byl poprvé popsán v roce 2001 kombinací sekvencí několika osob). Zmapování a analýza informací genomu ženy umožní lepší pochopení významu chromozomu X.
Závěr
Turnerův syndrom je spojen se zvýšenou kardiovaskulární morbiditou a mortalitou [1]. Střední délka života postižených je zkrácena o 15 i více let.
Prezentovaný případ dokládá, že pacientky s Turnerovým syndromem jsou vystaveny riziku předčasného rozvoje ischemické choroby srdeční i přes substituční hormonální terapii. Důležité je nejen sledování v gynekologických ambulancích, ale také pravidelné kardiologické sledování, aby se předešlo závažným kardiovaskulárním komplikacím. Pro budoucnost budou důležité výsledky dalších genetických studií.
Doručeno do redakce: 31. 10. 2008
Přijato po recenzi: 30. 12. 2008
MUDr. Marie Berková, Ph.D.
www.fnol.cz
e‑mail: Marie.Berkova@fnol.cz
Zdroje
1. Elsheikh M, Dunger DB, Conway GS et al. Turner Syndrome in Adulthood. Endocrine Reviews 2002; 23 : 120–140.
2. Zapletalová J, Šnajderová M. Turnerův syndrome. Praha: Galén 2003 : 149–159.
3. Gravhold CH, Juul S, Naeraa RW et al. Morbidity in Turner syndrome. J Clin Epidemiol 1998; 51 : 147–158.
4. Ross JL, Feuillan P, Long LM et al. Lipid abnormalities in Turner syndrome. J Pediatr 1995; 126 : 242–245.
5. Garden AS, Diver MJ, Fraser WD. Undiagnosed morbidity in adult women with Turner’s syndrome. Clin Endocrinol (Oxf) 1996; 45 : 589–594.
6. Gravholt CH, Naeraa RW, Nyholm B et al. Glucose metabolism, lipid metabolism and cardiovascular risk factors in adult Turner’s syndrome. The impact of sex hormone replacement. Diabetes care 1998; 21 : 1062–1070.
7. Van Teunenbroek A, de Muinck Keizer Schrama SM, Aanstoot HJ et al. Carbohydrate and lipid metabolism during various growth hormone dosing regimens in girls with Turner syndrome. Dutch working group on Growth Hormone. Metabolism 1999; 48 : 7–14.
8. Sylven L, Hagenfeldt K, Brondum-Nielsen K et al. Middle-aged women with Turner’s syndrome. Medical status, hormonal treatment, and social life. Acta Endocrinol 1991; 125 : 359–365.
9. Lanes R, Gunczler P, Palacios A et al. Serum lipids, lipoprotein lp(a), and plasminogen activator inhibitor-1 in patients with Turner’s syndrome before and during growth hormone and estrogen therapy. Fertil steril 1997; 68 : 473–477.
10. Ostberg JE, Donald AE, Halcox JPJ et al. Vasculopathy in Turner Syndrome: Arterial Dilatation and Intimal thickening without endothelial dysfunction. Clin Endocrinol Metabol 2005; 90 : 5161–5166.
11. Chlumský J, Kölbel F, Burešová M et al. Disekující aneuryzma aorty u nemocné s Turnerovým syndromem. Vnitř Lék 2000; 46 : 34–36.
12. Van PL, Bakalov V, Bondy CA. Monosomy for the X chromosome is associated with an atherogenic lipid profile. J Clin Endocrinol Metab 2006; 91 : 2867–2870.
13. Van PL, Bakalov V, Zinn A et al. Maternal X-chromosome, visceral adiposity and lipid profile. JAMA 2006; 295 : 1373–1374.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Výsledky léčby chronické hepatitidy C jsou v České republice srovnatelné s nejvyspělejšími státy světa – editorial
- Algoritmus léčby glukokortikoidy indukované osteoporózy – hledání východisek – editorial
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Srovnání tělesného složení diabetiků 1. typu, obézních jedinců a zdravých dobrovolníků metodou bioelektrické impedanční analýzy
- Vplyv bazálnej koncentrácie prolaktínu na výskyt komplikácií a na prognózu pacientov s cirhózou pečene
- Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí
-
CORD: COmparsi on of Recommended Doses of ACE inhibitors and angi otensin II receptor blockers.
Porovnání doporučených dávek ACE inhibitorů a antagonistů receptoru angi otensinu II. - Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Algoritmus liečby glukokortikoidmi indukovanej osteoporózy
- Ivabradin u nemocných se stabilní ischemickou chorobou srdeční a systolickou dysfunkcí levé srdeční komory: výsledky studie BEAUTIFUL
- Je farmakologická léčba chronické tromboembolické plicní hypertenze nadějná?
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
- Dopis redakci
- Ve dvou se to lépe táhne
- Recenze
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Exogénna alergická alveolitída – zriedkavo diagnostikovaná choroba
- Turnerův syndrom vyžaduje multidisciplinární přístup
- Srovnání různých metod pro stanovení množství tuku v těle u žen s nadváhou a obezitou
- Infarkt myokardu – příčina předčasné smrti u Turnerova syndromu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




