-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Karcinom kůry nadledvin
Adrenal cancer
Adrenal cancer is a rare disease which is often diagnosed at a late stage and usually has a poor prognosis. This review article gives a current knowledge on the etiopathogenesis, which could lead to the improvement of therapeutic strategies and possibly outcomes of therapy. Further, clinical presentation, diagnostic approach and current treatment options in patients with adrenal cancer are summarized. The multidisciplinary approach as well as centralized care is necessary for successful management of patients with adrenal cancer and for improvement of their poor prognosis.
Key words:
adrenal – cortex – cancer – aetiology – diagnosis – treatment
Autoři: M. Kršek
Působiště autorů: III. interní klinika – klinika endokrinologie a metabolizmu 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2009; 55(1): 54-61
Kategorie: Přehledné referáty
Souhrn
Karcinom kůry nadledvin je vzácné onemocnění, které je však obvykle diagnostikováno až v pokročilých stadiích a jehož prognóza bývá často nepříznivá. Tento přehledový článek shrnuje současné poznatky o etiopatogenezi tohoto onemocnění, které mohou vést ke zlepšení léčebných strategií a pokud možno i výsledků léčby. Dále je podán souhrn klinického obrazu, diagnostických přístupů a současných možností léčby pacientů s karcinomem kůry nadledvin. Pro úspěšnou péči o pacienty s karcinomem kůry nadledvin a zlepšení jejich nepříznivé prognózy je nutný multidisciplinární přístup a centralizace péče.
Klíčová slova:
nadledvina – kůra – karcinom – etiologie – diagnostika – léčbaÚvod
Tumory kůry nadledvin se v populaci vyskytují často a většinou jsou diagnostikovány náhodně při vyšetřeních zobrazovacími metodami z jiných indikací, než je podezření na onemocnění nadledvin. Jedná se však většinou o adenomy. Karcinom kůry nadledvin je onemocnění poměrně vzácné, jeho prevalence v dospělé populaci se odhaduje na 4–12 případů na 1 000 000 obyvatel a incidence na 1–2 případy na 1 000 000 obyvatel a rok [23,53,56], patří však mezi onemocnění s velmi nepříznivou prognózou [39]. Nejdůležitějším prognostickým faktorem je rozsah onemocnění v době diagnózy [20,40]. Pro zlepšení perspektivy pacientů je proto nutné zaměřit se na včasné stanovení diagnózy a léčbu. Pokud není možná radikální léčba chirurgická, není tč. k dispozici žádný lék a/nebo léčebný postup, který by byl přesvědčivě účinný u většiny pacientů. Proto je nutné zaměřit se na studium etiopatogeneze karcinomu kůry nadledvin, jehož výsledky by mohly jak zlepšit diagnostiku tohoto onemocnění, tak přispět k objevení nových a účinnějších léčebných postupů. Jelikož jde o onemocnění vzácné, je nutná mezinárodní spolupráce a kooperativní studie zahrnující dostatečné množství pacientů. V tomto přehledném článku jsou shrnuty současné poznatky týkající se etiopatogeneze, klinického obrazu, diagnostických a terapeutických postupů, které máme v současnosti k dispozici.
Etiologie a patogeneze
Pochopení etiologie a patogeneze adrenokortikálního karcinomu je nutné ke zlepšení současných a rozvoji nových diagnostických a terapeutických možností. V současnosti se tento výzkum opírá především o molekulárně-biologické metody [37].
Adrenokortikální karcinomy jsou charakterizovány monoklonální proliferací buněk, což dokazuje, že vznikají z jedné buňky, která získala díky genetické alteraci růstovou výhodu oproti buňkám ostatním. Tím se karcinomy liší od adenomů, u nichž byla kromě monoklonální proliferace prokázána i proliferace polyklonální, což svědčí pro to, že na patogenezi adenomů se kromě genetické alterace mohou podílet i faktory stimulující buňky kůry nadledvin [10].
Na etiopatogenezi adrenokortikálního karcinomu se podílí genetické alterace vedoucí k inaktivaci nádorových supresorových genů nebo aktivace onkogenů [17,52]. Nejčastěji studovanými onkogeny jsou gen pro inzulinu podobný růstový faktor-II (IGF‑II), β-catenin, ras onkogen a geny některých růstových faktorů. Mezi nejčastěji studované nádorové supresorové geny patří gen TP53, MEN-1 gen, gen pro R1A regulační podjednotku cAMP dependentní proteinkinázy A (PRKAR1A), studován je též gen receptoru pro adrenokortikotropní hormon (ACTH-R).
Gen pro IGF‑II je lokalizován v oblasti 11p15 a je exprimován pouze z paternální alely (maternální imprinting). Kromě něj je v chromozomální oblasti 11p15 lokalizován gen H19 a p57kip2, které jsou naopak exprimovány z maternální alely (paternální imprinting). IGF‑II je důležitý pro rozvoj a diferenciaci kůry nadledvin a v řadě studií byla prokázána významně zvýšená exprese mRNA pro IGF‑II v naprosté většině (asi 90 %) karcinomů nadledvin [11,20], a to nejen v porovnání s normální kůrou nadledvin, ale i s tkání adrenokortikálních adenomů [15]. Mechanizmem zodpovědným za nadměrnou expresi IGF‑II je ztráta maternální alely nebo duplikace paternální alely (paternální idiosomie) nebo méně často ztráta imprintingu. Kromě zvýšené exprese IGF‑II je v tkáni adrenokortikálního karcinomu často prokazována i zvýšená exprese IGF receptoru I. typu, prostřednictvím něhož vykonává IGF‑II své mitogenní účinky [57]. Biologická aktivita IGF‑II je kromě jiného modifikována vazebnými proteiny pro IGF (IGFBPs), které jí mohou snižovat, ale za určitých okolností i zvyšovat. V této souvislosti je zajímavé, že v adrenokortikálních karcinomech je prokazováno zvýšené množství IGFBP-2, které dle některých studií koreluje se stadiem tumoru [11]. Co se týče dalších genů chromozomálního lokusu 11p15, byla v tkáni adrenokortikálních karcinomů prokázána paternální idiosomie H19 a snížená exprese p57kip2. Alterace tohoto lokusu je spojována se zvýšeným rizikem rekurence onemocnění [12,19,20]. Genetické a epigenetické změny v oblasti 11p15 vedoucí ke zvýšené expresi IGF‑II a mutace p57kip2 jsou spojovány s rozvojem Beckwithova-Wiedemannova syndromu (tab. 1 a 2) [35,59].
β-catenin je klíčovou součástí tzv. Wnt signalizační kaskády, účastní se v procesech vzájemné adheze buněk a slouží také jako transkripční faktor aktivující transkripci genů této kaskády. Aktivace Wnt signalizační kaskády byla prokázána u familiární adenomatózní polypózy tračníku (Gardnerův syndrom) spojené se zárodečnou mutací APC genu. Familiární adenomatózní polypóza je také sdružena se zvýšeným výskytem tumorů kůry nadledvin (tab. 1 a 2). Jak u adenomů, tak u karcinomů byla prokázána zvýšená přítomnost β-cateninu, svědčící pro abnormální aktivaci Wnt kaskády. U části tumorů kůry nadledvin byla prokázána přímo somatická mutace genu pro β-catenin [10,55].
Ras onkogen patří mezi onkogeny, jejichž mutace je v souvislosti s kancerogenezou prokazována nejčastěji. Jeho úloha ve vztahu k rozvoji tumorů kůry nadledvin však není dosud zcela objasněna. Mutace K-ras byla prokázána u přibližně 50 % connovských adenomů.
Kromě faktorů uvedených v předchozí části se v rozvoji karcinomů kůry nadledvin pravděpodobně podílí řada tzv. růstových faktorů. Nejčastěji jsou v literatuře zmiňovány: bazický fibroblastový růstový faktor (b-FGF-2), vaskulární endoteliální růstový faktor (VEGF) a transformující růstový faktor β1 (TGF‑1) [3,6,11,57].
TP53 gen je nádorový supresorový gen lokalizovaný v oblasti 17p13. Jeho mutace jsou spojovány s rozvojem řady maligních nádorů u člověka. Zárodečné mutace TP53 jsou nacházeny až u 70 % pacientů s Liovým-Fraumeniho syndromem (tab. 1 a 2) [25]. U několika pacientů s tímto familiárním nádorovým syndromem byly prokázány i mutace genu hCHK2 kódujícího kinázu, která je schopna přímo forsforylovat TP53, u těchto pacientů se však jako součást syndromu nevyskytl adrenokortikální karcinom. Kromě familiárních nádorových syndromů jsou zárodečné mutace genu TP53 prokazovány u 50–80 % dětí postižených adrenokortikálním karcinomem. Na jihu Brazílie se vyskytuje adrenokortikální karcinom u dětí asi 10krát častěji než ve zbytku světa. U těchto dětí je nacházena specificky zárodečná mutace 10. exonu genu TP53. U sporadického adrenokortikálního karcinomu v dospělosti jsou somatické mutace genu TP53 nacházeny podle různých studií ve 25–70 % případů. Asi u 85 % adrenokortikálních karcinomů a pouze u asi 30 % adenomů byla prokázána ztráta heterozygozity lokusu 17p13. Uvedené alterace korelovaly s horší prognózou pacientů, a mohly by tak být použity jako ukazatel malignity [20].
MEN-1 gen lokalizovaný v oblasti 11q13 je považován za nádorový supresorový gen. Kóduje protein MENIN a jeho zárodečné mutace jsou prokazovány asi u 90 % pacientů se syndromem MEN-1 (tab. 1 a 2). Syndrom MEN-1 je kromě jeho základních součástí také spojen s častějším výskytem tumorů kůry nadledvin, běžné jsou však hyperplazie a adenomy, karcinomy jsou poměrně vzácné. Somatické mutace MEN-1 genu jsou prokazovány u tumorů kůry nadledvin vzácně. Ztráta heterozygozity lokusu 11q13 je však odchylkou nacházenou až v 90 % adrenokortikálních karcinomů, ale pouze asi ve 20 % u adenomů [51].
Gen pro PRKAR1A je lokalizován v oblasti 17q22–24 a jeho inaktivující zárodečné mutace jsou prokazovány až u přibližně 45–65 % pacientů s Carneyho komplexem (tab. 1 a 2). Somatické mutace genu pro PRKAR1A byly prokázány u sporadických hormonálně aktivních adenomů kůry nadledvin. Ztráta heterozygozity lokusu 17q22–24 byla pozorována u sporadických adrenokortikálních adenomů. Tento gen tak pravděpodobně nemá podstatný význam v patogenezi maligních tumorů kůry nadledvin [12].
Gen pro receptor pro ACTH (ACTH-R), lokalizovaný v oblasti 18p11.2, je rovněž studován v souvislosti s kancerogenezou v kůře nadledvin. Jeho up-regulace je popisována u sekrečně aktivních adenomů kůry nadledvin a jeho down-regulace u afunkčních adenomů a u karcinomů kůry nadledvin [46].
Klinický obraz
Karcinomy kůry nadledvin se u člověka v naprosté většině vyskytují sporadicky. Kromě sporadického výskytu se však mohou vyskytovat jako součást několika familiárních nádorových syndromů, jejichž charakteristiky jsou uvedeny formou tabulky (tab. 1 a 2) [37]. Karcinom kůry nadledviny se může projevit příznaky hormonální hypersekrece, příznaky vyplývajícími z lokální expanze, případně generalizace [1,39], nebo je asymptomatický a je nacházen náhodně při zobrazovacím vyšetření z jiné indikace jako tzv. incidentalom nadledviny [18,23,33,39]. Velikost karcinomu nadledviny v době diagnózy většinou přesahuje velikost 5 cm.
Většina adrenokortikálních karcinomů je sekrečně aktivních, produkuje steroidní hormony, především glukokortikoidy a androgeny a steroidní intermediární metabolity. Může však produkovat i mineralokortikoidy a estrogeny. Sekrečně aktivní karcinomy kůry nadledvin mají horší prognózu než karcinomy neaktivní [1].
Nadprodukce glukokortikoidů je nejčastější manifestací endokrinně aktivních adrenokortikálních karcinomů. Projevuje se jako tzv. Cushingův syndrom, diferenciálně diagnosticky patří do skupiny ACTH-independentního Cushingova syndromu. Cushingův syndrom je charakterizován klinicky trunkální obezitou s tenkými končetinami, charakteristickou distribucí tukové tkáně, svalovou slabostí a atrofií, steroidní atrofií kůže, striemi, podkožními hematomy, případně akné a hirzutizmem, zhoršeným hojením ran, arteriální hypertenzí, poruchou glukózové tolerance, úbytkem kostní hmoty a psychickými poruchami. U těžkých forem nacházíme i hypokalemii a hypokalemickou alkalózu. Laboratorní diagnostika spočívá v průkazu zvýšeného vylučování volného močového kortizolu/24 hod, nepřítomnosti nočního poklesu kortizolemie a nedostatečné supresibility sekrece kortizolu v dexametazonovém supresním testu s jeho nízkou dávkou. Vzhledem k autonomní nadprodukci kortizolu tumorem nadledviny jsou plazmatické koncentrace ACTH suprimované [33,43].
Nadprodukce androgenů zpravidla doprovází nadprodukci glukokortikoidů. V případě karcinomu kůry nadledvin je však často velmi významná a může i převažovat, klinicky se u žen vyskytuje hirzutizmus až virilizace, alopecie, akné, poruchy menstruačního cyklu, infertilita. Laboratorně nadprodukci androgenů diagnostikujeme podle zvýšených sérových koncentrací dehydroepiandrosteronu a jeho sulfátu, zvýšený bývá i testosteron u žen [43].
Z mineralokortikoidů jsou nejčastěji produkovány prekurzory s mineralokortikoidní aktivitou, zejména deoxykortikosteron. Nadbytek mineralokortikoidů se projeví těžkou arteriální hypertenzí, která je kontinuální, zpravidla s vymizením nočního poklesu arteriálního krevního tlaku, laboratorně je častá hypokalemie a hypokalemická alkalóza. Laboratorně je dále zvýšený příslušný mineralokortikoid a suprimovaná plazmatická reninová aktivita [33].
Málo častá je nadprodukce estrogenů tumorem, která může vést u mužů k poruše libida a gynekomastii a u žen k metrorrhagii.
Sekrečně neaktivních adrenokortikálních karcinomů je méně, neprojevují se klinicky příznaky hormonální hypersekrece, někdy můžeme biochemicky diagnostikovat zvýšené koncentrace steroidních prekurzorů, např. 17-OH-progesteronu. Tato skupina karcinomů se může projevit příznaky z lokální expanze, příznaky z generalizace a progrese tumoru, nebo je naopak asymptomatická a zjistí se často náhodně jako tzv. incidentalom nadledviny [18,31,33,39]. Příznaky z lokální expanze jsou málo časté a objevují se často až při pokročilém tumoru. Patří mezi ně: pocit tlaku či bolesti v místě tumoru, resp. v příslušném podžebří, někdy si pacient tumor sám nahmatá. Pokročilé tumory mohou vést k příznakům z obstrukce v. cava inferior, někdy se vyskytuje trombóza v. portae. Často se karcinom nadledviny projeví až obecnými příznaky pokročilého nádorového onemocnění [1].
Karcinom kůry nadledvin v dětství je raritní, jeho klinická manifestace u dětí má však některé zvláštnosti. Častěji se vyskytuje u dívek než u chlapců, má bifazickou věkovou distribuci s maximy mezi 3. a 4. rokem věku (50–60 %) a po 13. roce věku (15–20 %). Endokrinně aktivní karcinomy výrazně převažují (asi 90 %). Klinicky většinou dominuje nadprodukce androgenů (80–90 % endokrinně aktivních karcinomů) s předčasnou pseudopubertou, u chlapců izosexuální, u dívek heterosexuální s virilizací. Pokud převažuje nadprodukce glukokortikoidů (10–20 % endokrinně aktivních karcinomů), většinou se nevyvíjejí typické klinické příznaky Cushingova syndromu, ale dominuje rozvoj obezity a porucha růstu. Endokrinně afunkční karcinomy jsou u dětí málo časté (asi 10 %) [61].
Diagnostika
Zobrazovací metody
Základními zobrazovacími metodami používanými při zobrazení nadledvin jsou ultrasonografie (USG), výpočetní tomografie (CT) a magnetická rezonance (MR), v některých indikacích je možno použít metody nukleární medicíny (scintigrafie, pozitronová emisní tomografie – PET).
USG je metodou nejlevnější a nejdostupnější, nezatěžující pacienta. Její velkou výhodou je možnost posouzení dynamických vztahů k okolním orgánům. Mezi nevýhody patří zejména závislost na zkušenosti a pečlivosti vyšetřujícího lékaře, kvalitě přístroje a individuální vyšetřitelnosti každého jednotlivého pacienta [32].
CT je nejpoužívanější metodou při zobrazení nadledvin. Je levnější a dostupnější než MR, ale představuje pro pacienta vysokou radiační zátěž a nebezpečí alergické reakce vyplývající z intravenózního podání kontrastní látky. Při zobrazení tumorů nadledvin pro adrenokortikální karcinom svědčí nativně nehomogenní struktura a vysoká denzita tumoru (nad 10 HU), která se dále výrazně zvyšuje po podání kontrastní látky (zpravidla nad 40 HU), tento enhancement je opět většinou nehomogenní [13]. Pro karcinomy je dále typický nízký obsah lipidů, vyšší vaskularizace, častá přítomnost degenerativních pseudocyst a mohou se v nich vyskytovat kalcifikace. Obtížná může být diferenciální diagnostika oproti ostatním tzv. non‑adenomům, tedy zejména oproti feochromocytomům a metastázám do nadledvin.
Obr. 1. CT snímek levostranného karcinomu kůry nadledviny. 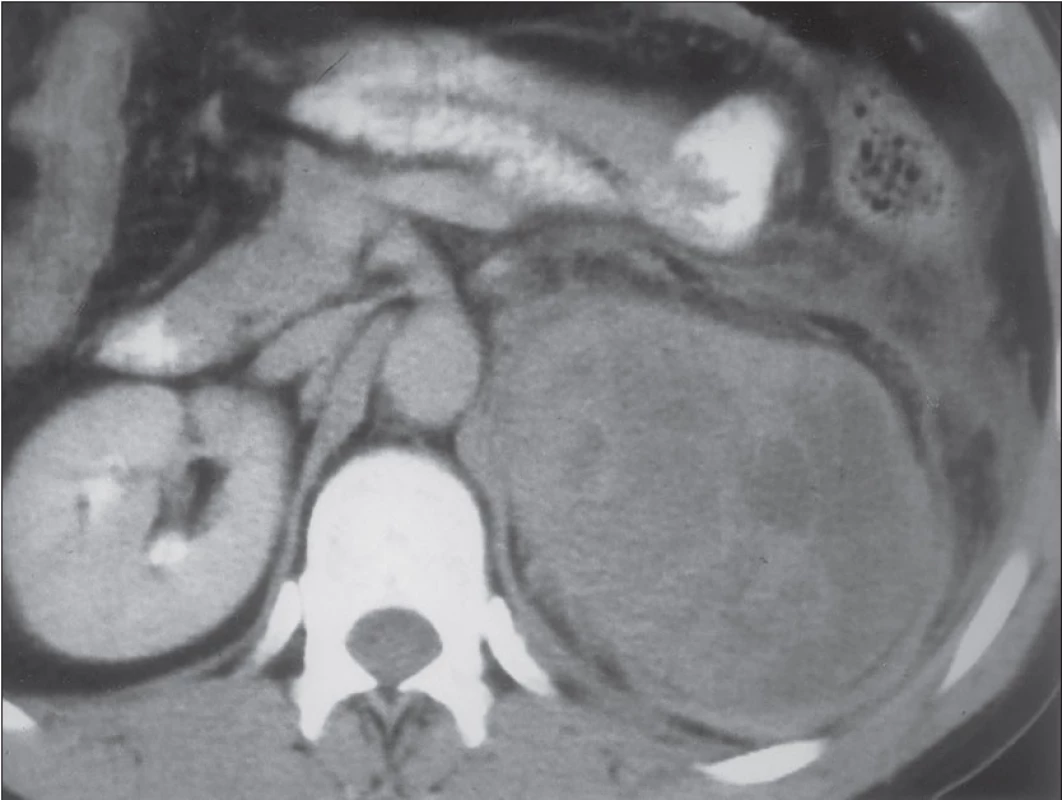
MR je dražší a méně dostupná než CT, ale nepředstavuje pro pacienta žádnou radiační zátěž a riziko alergické reakce po podání gadoliniové kontrastní látky je zanedbatelné. MR je kontraindikována u pacientů s kardiostimulátorem, implantabilním kardioverterem-defibrilátorem, kochleárním implantátem a feromagnetickým kovem v některých lokalizacích. V MR obraze jsou karcinomy kůry nadledvin opět nehomogenní s nízkým obsahem lipidů, vaskularizované a výrazně enhancující po podání kontrastní látky. Senzitivitu a specificitu v diagnostice karcinomů zvyšuje použití tzv. „techniky chemického shiftu“, která je považována za nejspolehlivější v diferenciální diagnostice adenomů a karcinomů se senzitivitou 80–100 % a specificitou 94–100 % [26].
Z metod nukleární medicíny je možno v diagnostice a diferenciální diagnostice karcinomů kůry nadledvin použít scintigrafii s použitím jodocholesterolu jako radiofarmaka, kdy u adenomů nadledvin dochází k vysokému vychytávání radiofarmaka, u karcinomů bývá vychytávání obvykle velmi nízké [22]. Vzhledem k nízké výtěžnosti a poměrně vysoké ceně vyšetření se však scintigrafie využívá v diagnostice karcinomů nadledvin velmi málo. Pro klinickou praxi je perspektivnější PET s použitím fluorodeoxyglukózy jako radiofarmaka, které je zvýšeně vychytáváno karcinomy a je přínosné při pátrání po relapsu onemocnění nebo po metastázách [36].
Biopsie nadledvin
Biopsie nadledvin je používána poměrně zřídka, neboť senzitivita a specificita vyšetření vzorků z biopsie nadledvin v diagnostice karcinomů nadledvin je srovnatelná s CT a MR vyšetřením. V některých nejasných případech může však být z diferenciálně diagnostických důvodů indikována. Provádí se obvykle pod CT kontrolou [45]. Před provedením biopsie je nutné biochemicky vyloučit feochromocytom.
Laboratorní endokrinologické vyšetření
Základní informace týkající se endokrinní aktivity tumorů nadledvin a jejího biochemického hodnocení byly uvedeny v odstavci o klinickém obrazu. V tab. 3 je uvedeno spektrum laboratorních vyšetření u pacientů s adrenokortikálním karcinomem tak, jak jej doporučuje Pracovní skupina pro adrenokortikální karcinom ENSAT (European Network for the Study of Adrenal Tumors). Pravděpodobně toto schéma však není ideální a může být optimalizováno či upravováno podle zvyklostí jednotlivých pracovišť.
Patologicko‑anatomické vyšetření
Makroskopicky je většina karcinomů kůry nadledvin v době stanovení diagnózy větší než 5 cm a váží více než 100 g. Při mikroskopickém vyšetření se hodnotí řada parametrů, především počet nekróz, mitóz a jejich charakter, architektura tumoru, angioinvaze, invaze pouzdra a některé další parametry [34,54]. Pravděpodobně nejpoužívanější při patologicko‑anatomickém vyšetřování a klasifikaci adrenokortikálních karcinomů jsou histopatologická kritéria podle Weisse [4,58]. Kromě těchto základních kritérií se při histologické diferenciální diagnostice vzorky tumoru vyšetřují imunohistochemicky, stanovuje se proliferační index Ki-67 a je možno stanovovat řadu dalších ukazatelů, např. přítomnost p53, IFG-II, cyklinu E, b-cateninu, chromograninu A apod., jejichž podrobný rozbor přesahuje rámec této publikace [29,44,48,49].
Obr. 2. Algoritmus diagnostiky a terapie pacientů s karcinomem kůry nadledvin. Upraveno podle [62]. ![Algoritmus diagnostiky a terapie pacientů s karcinomem kůry nadledvin. Upraveno podle [62].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/10e0cbbff0341ec8887406e610716ebc.png)
Staging
Na základě vyšetření pacientů s adrenokortikálním karcinomem se provádí staging onemocnění. Nejvíce používaná je klasifikace dle Mc Farlanea (tab. 4) [40].
Léčba
Základní metodou léčby karcinomu kůry nadledvin je léčba chirurgická. Pokud není tato léčba kurativní nebo není proveditelná, máme k dispozici léčbu medikamentózní, případně některé specializované metody lokální léčby.
Chirurgická léčba
Chirurgická resekce adrenokortikálního karcinomu je metodou první volby u většiny pacientů, a pokud je to možné, měla by být provedena u všech pacientů v I.–III. stadiu onemocnění dle Mc Farlanea. U pacientů ve IV. stadiu je rozhodování o chirurgické léčbě individuální a je předmětem diskuze, neboť střední doba přežití těchto pacientů je přibližně 5 měsíců. Chirurgické řešení se zvažuje i u metastatického postižení jater, pokud jsou metastázy resekabilní a není jich více než 3. Chirurgickou intervenci je nutné zvážit při porůstání tumoru do v. cava inferior [27].
Cílem chirurgické léčby je, pokud je to možné, radikální odstranění tumoru. Technika výkonu a přístup se zvažuje individuálně u každého pacienta, především na základě velikosti tumoru, jeho vztahu k okolním orgánům, cévám apod. Vzhledem k tomu, že adrenokortikální karcinomy jsou již v době diagnózy většinou velké tumory, které jsou navíc křehké a často s nejasným vztahem k okolním orgánů, je u většiny pacientů indikována otevřená operace ze subkostálního přístupu. U rozsáhlých tumorů, zejména těch, které jsou v intimním kontaktu s bránicí, může být indikován torako-abdominální přístup. Předmětem diskuze je indikace laparoskopického výkonu u pacientů s adrenokortikálním karcinomem. Laparoskopický výkon je obecně považován za akceptovatelný u tumorů menších než 6 cm, bez známek prorůstání do okolních orgánů a metastazování, tedy v praxi ve většině případů u pacientů operovaných pro tzv. incidentalomy, kdy není jasné, že jde o karcinom [21,50]. Při rozhodování o technice výkonu je nutno zohlednit poměrně vysokou operační mortalitu, přibližně 6–8%, s přihlédnutím k tomu, že v těchto případech se většinou jedná o pacienty ve III. a IV. stadiu onemocnění [1,28]. U hormonálně aktivních tumorů s nadprodukcí glukokortikoidů je nutné připomenout nutnost perioperačního a pooperačního zajištění hydrokortizonem k zamezení projevů hypokortikalizmu [33].
Chemoterapie
Mitotan (o,p’DDD; orto, para, dichloro, difenyl, dichloro etan), jehož adrenolytický účinek byl popsán již v roce 1949 [42], je do současné doby základním lékem v medikamentózní léčbě adrenokortikálního karcinomu. Kromě přímého toxického účinku na buňky kůry nadledvin je mitotan zároveň účinným blokátorem steroidogenezy (způsobuje blokádu přeměny cholesterolu na pregnenolon a 18-hydroxylaci v buňkách kůry nadledvin), čehož lze s úspěchem využít ke zlepšení klinického stavu pacientů s hormonálně aktivními karcinomy, především s nadprodukcí glukokortikoidů (Cushingův syndrom). Na léčbu mitotanem lépe reagují endokrinně aktivní karcinomy [1]. Celkově na léčbu mitotanem ale reaguje příznivě přibližně pouze 20–30 % pacientů [24,38,39]. Při léčbě mitotanem je třeba počítat s četnými nežádoucími účinky, mezi které patří především nechutenství, nauzea, zvracení, vertigo, apatie, poruchy artikulace, poruchy koncentrace, ataxie [24]. Pro tyto nežádoucí účinky je nutné postupně dle tolerance zvyšovat dávkování na cílovou dávku až 6–10 g mitotanu denně za současného monitorování sérových koncentrací mitotanu, za terapeutické rozmezí jsou považovány koncentrace 14–20 mg/l.
Kromě monoterapie mitotanem byly předmětem klinických studií různé kombinace chemoterapeutik, jejichž součástí byly cisplatina, etoposid, doxorubicin a streptozotocin [7]. Na kombinovanou léčbu mitotanem a streptozotocinem reagovalo příznivě 36 % pacientů [30]. Na léčbu kombinací mitotan, cisplatina, etoposid, doxorubicin reagovalo příznivě 48 % pacientů, což ukazuje na pravděpodobné zlepšení účinku této kombinace oproti monoterapii mitotanem [8] a tato kombinace se zdá být nejúčinnější z dosud zkoušených chemoterapeutických kombinací [2].
Kromě uvedených chemoterapeutik byla zkoušena i některá další, např. inhibitor topoizomerázy I irinonectan [5] a paclitaxel [16].
Vzhledem k neuspokojivým výsledkům léčby dosud v klinické praxi používanými chemoterapeutiky a jejich kombinací se do budoucna uvažuje o dalších možnostech, např. o použití inhibitorů angiogenezy (monoklonální protilátka anti‑VEGF bevacizumab), blokátorů EGF receptoru (cetuximab) nebo inhibitorů tyrozinkinázové aktivity EGF receptoru (erlotinib).
Metody lokální léčby
Kromě výše uvedených systémových metod protinádorové léčby adrenokortikálního karcinomu máme v současné době k dispozici některé metody lokální léčby.
Radiofrekvenční ablace je metodou, která vede k lokální destrukci nádorových buněk teplotou přibližně 60 °C, které se dosahuje po zavedení jehlové elektrody do nádorového ložiska [41]. Tato metoda je vhodná především k destrukci metastáz, zejména jaterních, plicních a kostních, je však možno ji použít i v lokalizaci adrenální, spíše při lokálních relapsech než jako primární léčbu [61].
Transarteriální chemoembolizace je další z lokálních metod, které lze použít při protinádorové léčbě. Vhodná je zejména při léčbě jaterních metastáz, kdy se intraarteriálně zavedeným katétrem lokálně aplikuje chemoterapeutikum emulzifikované v Lipiodolu [14]. Kontraindikací léčby intrahepatálních metastáz je jaterní insuficience a metastatické postižení více než 60 % jaterního parenchymu [47].
Prognóza
Prognóza pacientů s karcinomem kůry nadledvin zůstává nepříznivá. Hlavním prognostickým ukazatelem zůstává stadium onemocnění v době diagnózy, resp. v době začátku léčby [1]. Dalšími prognostickými kritérii jsou např. sekreční aktivita tumoru (endokrinně aktivní tumory mají horší prognózu), věk pacienta (starší pacienti mají horší prognózu nežli mladší) a počet mitóz v tumoru (čím větší počet mitóz, tím horší prognóza).
Závěr
Karcinom kůry nadledviny je onemocnění vzácné a jeho prognóza je většinou nepříznivá. Pacienti s karcinomem nadledviny mohou být diagnostikováni lékaři řady odborností, především pak internisty, endokrinology, urology, onkology a řadou dalších. Pro správnou diagnostiku a diferenciální diagnostiku a optimální péči o pacienty je nutná její centralizace do specializovaných center disponujících internisty, endokrinology, radiology, chirurgy či urology a onkology, kteří mají s tímto onemocněním dostatek zkušeností a zároveň mají k dispozici adekvátní vybavení tak, aby byla schopna o tyto závažně nemocné pacienty dostatečně kvalitně pečovat, a tím vylepšit jejich prognózu a kvalitu života.
Vzhledem k řídkému výskytu karcinomu kůry nadledvin je v mezinárodním měřítku nutno spoléhat na kooperativní studie a mezinárodní registry, jakými jsou v současnosti zejména ENSAT (European Network for the Study of Adrenal Tumors; http://www.ensat.org) a národní registry (COMETE ve Francii, GANIMED v Německu a NISGAD v Itálii) a dále International Adrenal Cancer Symposium: Clinical and Basic Science; http://www.med.umich.edu/intmed/endocrinology/acs.htm.
Podpořeno grantem IGA MZ ČR č. NR 9438-3.
Doručeno do redakce: 5. 9. 2008
Přijato po recenzi: 22. 10. 2008
prof. MUDr. Michal Kršek, CSc.
www.lf1.cuni.cz
e‑mail: michal.krsek@lf1.cuni.cz
Zdroje
1. Abiven G, Coste J, Groussin L et al. Clinical and biological features in the prognosis of adrenal cortical carcinoma. Poor outcome of cortisol secreting tumors in a series of 202 consecutive patients. J Clin Endocrinol Metab 2006; 91 : 2650–2655.
2. Allolio B, Hahner S, Weissmann D et al. Management of adrenocortical carcinoma. Clin Endocrinol 2004; 60 : 273–287.
3. Arnaldi G, Freddi S, Mancini T et al. Transforming growth factor beta1: implications in adrenocortical tumorigenesis. Endocr Res 2000; 26 : 905–910.
4. Aubert S, Wacrenier A, Leroy X et al. Weiss system revisited: a clinicopathologic and immunohistochemical study of 49 adrenocortical tumors. Am J Surg Pathol 2002; 26 : 1612–1619.
5. Baudin E, Docao C, Gicquel C et al. Use of a topoisomerase I inhibitor (irinotecan, CPT-11) in metastatic adrenocortical carcinoma. Ann Oncol 2002; 13 : 1806–1809.
6. Bernini GP, Moretti A, Bonadio AG et al. Angiogenesis in human normal and pathologic adrenal cortex. J Clin Endocrinol Metab 2002; 87 : 4961–4965.
7. Berruti A, Terzolo M, Pia A et al. Mitotane associated with etoposide, doxorubicin, and cisplatin in the treatment of advanced adrenocortical carcinoma. Cancer 1998; 83 : 2194–2200.
8. Berruti A, Terzolo M, Sperone P et al. Etoposide, doxorubicin and cisplatin plus Op’DDD in the treatment of advanced adrenal cortical carcinoma: a large prospective phase II trial. Endocr Relat Cancer 2005; 12 : 657–666.
9. Beuschlein F, Reincke M, Karl M et al. Clonal composition of human adrenocortical neoplasm. Cancer Res 1994; 54 : 4927–4932.
10. Blakker H, Sutter C, Kadmon M et al. Analysis of somatic APC mutations in rare extracolonic tumors of patients with familial adenomatous polyposis coli. Genes Chromosomes Cancer 2004; 41 : 93–98.
11. Boulle N, Logie A, Gicquel C et al. Increased levels of insulin‑like growth factor II (IGF‑II) and IGF‑binding protein‑2 are associated with malignancy in sporadic adrenocortical tumors. J Clin Endocrinol Metab 1998; 83 : 1713–1720.
12. Bossis I, Stratakis CA. Minireview: Prkar1a: normal and abnormal functions. Endocrinology 2004; 145 : 5452–5458.
13. Caoili EM, Korobkin M, Francis IR et al. Adrenal masses: characterization with combined unenhanced and delayed enhanced CT. Radiology 2002; 222 : 629–633.
14. de Baere T, Dufaux J, Roche A et al. Circulatory alterations induced by intra-arterial injection of iodized oil and emulsions of iodized oil and Doxorubicin: Experimental study. Radiology 1995; 194 : 165–170.
15. de Fraipont F, El Atifi M, Cherradi N et al. Gene expression profiling of human adrenocortical tumors using cDNA microarrays identifies several candidate genes as markers of malignancy. J Clin Endocrinol Metab 2005; 90 : 1819–1829.
16. Fallo F, Pilon C, Barzon L et al. Paclitaxel is an effective antiproliferative agent on the human NCI-H295 adrenocortical carcinoma cell line. Chemotherapy 1998; 44 : 129–134.
17. Fratticci A, Bertherat J. Adrenocortical cancer: pathophysiology and clinical management. Endocr Relat Cancer 2007; 11 : 13–28.
18. Fryšák Z, Záťura F, Benýšek L et al. Incidentalomy nadledvin. Klinické zkušenosti. Vnitř Lék 1998; 44 : 538–540.
19. Gao ZH, Suppola S, Liu J et al. Association of H19 promoter methylation with the expression of H19 and IGF‑II genes in adrenocortical tumors. J Clin Endocrinol Metab 2002; 87 : 1170–1176.
20. Gicquel C, Bertagna X, Gaston V et al. Molecular markers and long‑term recurrences in a large cohort of patients with sporadic adrenocortical tumors. Cancer Res 2001; 61 : 6762–6767.
21. Gonzales RJ, Shapiro S, Sarlis N et al. Laparoscopic resection of adrenal cortical carcinoma: a cautionary note. Surgery 2005; 138 : 1078–1085.
22. Gross MG, Shapiro B, Francis IR. Scintigrafic evaluation of clinically silent adrenal masses. J Nucl Med 1994; 35 : 1145–1152.
23. Grumbach MM, Biller BMK, Braunstein GD et al. Management of the clinically inaparent adrenal mass („incidentaloma“). Ann Intern Med 2003; 138 : 424–429.
24. Haak HR, Hermans J, van de Velde CJ et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in consecutive series of 96 patients. Br J Cancer 1994; 69 : 947–951.
25. Hisada M, Garber JE, Fung CY et al. Multiple primary cancers in families with Li-Fraumeni syndrome. J Natl Cancer Inst 1998; 90 : 606–611.
26. Hussain HK, Korobkin M. MR imaging of the adrenal glands. Magn Reson Imaging Clin N Am 2004; 12 : 515–544.
27. Chiche L, Dousset B, Kieffer E et al. Adrenal cortical carcinoma extending into the inferior vena cava: presentation of a 15-patient series and review of the literature. Surgery 2006; 139 : 15–27.
28. Icard P, Goudet P, Charpenay C et al. Adrenocortical carcinomas: surgical trends and results of a 253-patients series from the French Association of Endocrine Surgeons study group. World J Surg 2001; 25 : 891–897.
29. Jorda M, De MB, Nadji M. Calretinin and inhibin are useful in separating adrenocortical neoplasms from pheochromocytomas. Appl Immunohistochem Mol Morphol 2002; 10 : 67–80.
30. Khan TS, Sundin A, Juhlin C et al. Vincristine, cisplatin, teniposide, and cyclophosphamide combination in the treatment of recurrent or metastatic adrenal cortical carcinoma. Med Oncol 2004; 21 : 167–177.
31. Kloos RT, Gross RT, Francis IR et al. Incidentally discovered adrenal masses. Endocr Rev 1995; 16 : 460–484.
32. Kršek M, Matějovská H. Diferenciální diagnóza incidentalomů nadledvin a úloha zobrazovacích metod. Vnitř Lék 2002; 48 : 409–415.
33. Kršek M. Incidentalomy nadledvin. Vnitř Lék 2007; 53 : 821–825.
34. Lack EE. Recommendations for the reporting of tumors of the adrenal cortex and medulla. Association of Directors of Anatomic and Surgical Pathology. Virchows Arch 1999; 435 : 87–91.
35. Lam WW, Hatada I, Ohishi S et al. Analysis of germline CDKN1C (p57kip2) mutations in familial and sporadic Beckwith-Wiedemann syndrome (BWS) provides a novel genotype-phenotype correlation. J Med Genet 1999; 36 : 518–523.
36. Leboulleux S, Dromain C, Bonniaud G et al. Diagnostic and prognostic value of 18-fluorodeoxyglucose positron emission tomography in adrenocortical carcinoma: a prospective comparison with computed tomography. J Clin Endocrinol Metab 2005; 91 : 920–925.
37. Libé R, Gicquel C, Bertagna X et al. Molecular genetics of adrenal cortical carcinoma. 13–23. In: Bertagna X. Adrenal cancer. France, Montrouge: John Libbey Eurotext 2006, 133 s.
38. Luton JP, Cerdas S, Billaud L et al. Clinical features of adrenocortical carcinoma, prognostic factors, and the effect of mitotane therapy. N Engl J Med 1990; 322 : 1195–1201.
39. Luton JP, Martinez M, Coste J et al. Outcome in patients with adrenal incidentaloma selected for surgery: an analysis of 88 cases investigated in a single clinical center. Eur J Endocrinol 2000; 143 : 111–117.
40. MacFarlane DA. Cancer of the adrenal cortex; natural history, prognosis and treatment in a study of fifty-five cases. Ann R Coll Surg Engl 1958; 23 : 155–186.
41. McGahan J, Browning P, Brock J et al. Hepatic ablation using radiofrequency electrocautery. Invest Radiol 1990; 25 : 267–270.
42. Nelson AA, Woodard G. Severe adrenal cortical atrophy (cytotoxic) and hepatic damage produced in dogs by feeding 2,2-bis-(parachlorphenyl)-1,1-dichlorethane (DDD). Arch Pathol 1949; 48 : 387.
43. Newell‑Price J, Bertagna X, Grossman AB et al. Cushing’s syndrome. Lancet 2006; 367 : 1605–1617.
44. Pan CC, Chen PC, Tsay SH et al. Differential immunoprofiles of hepatocellular carcinoma, renal cell carcinoma, and adrenocortical carcinoma: a systemic immunohistochemical survey using tissue array technique. Appl Immunohistochem Mol Morphol 2005; 13 : 347–352.
45. Paulsen SD, Nghiem HV, Korobkin M et al. Changing role of imaging-guided percutaneous biopsy of adrenal masses: evaluation of 50 adrenal biopsies. Am J Roentgenol 2004; 182 : 1033–1037.
46. Reincke M, Beuschlein F, Menig G et al. Localization and expression of adrenocorticotropic hormone receptor mRNA in normal and neoplastic human adrenal cortex. J Endocrinol 1998; 156 : 415–423.
47. Roche A, Girish BV, de Baere T et al. Trans‑catheter arterial chemoembolisation as first‑line treatment for hepatic metastases from endocrine tumors. Eur Radiol 2003; 13 : 136–140.
48. Ross NS, Aron DC. Hormonal evaluation of the patient with an incidentally discovered adrenal mass. N Engl J Med 1990; 323 : 1401–1405.
49. Saeger W. Histopathological classification of adrenal tumors. Eur J Clin Invest 2000; 30 (Suppl 3): 58–62.
50. Saunders BD, Doherty GM. Laparoscopic adrenalectomy for malignant disease. Lancet Oncol 2004; 5 : 718–726.
51. Schulte KM, Mengel M, Heinze M et al. Complete sequencing and messenger ribonucleic acid expression analysis of the MEN 1 gene in adrenal cancer. J Clin Endocrinol Metab 2000; 85 : 441–448.
52. Soon PSH, McDonald KL, Robinson BG et al. Molecular markers and pathogenesis of adrenocortical cancer. Oncologist 2008; 13 : 548–561.
53. Soreide JA, Braband K, Thoresen SO. Adrenal cortical carcinoma in Norway, 1970–1984. World J Surg 1992; 16 : 663–667.
54. Stojadinovic A, Brennan MF, Hoos A et al. Adrenocortical adenoma and carcinoma: histopathological and molecular comparative analysis. Mod Pathol 2003; 16 : 742–751.
55. Tissier F, Cavard C, Groussin L et al. Mutations of beta‑catenin in adrenocortical tumors: activation of the Wnt signalling pathway is a frequent event in both benign and malignant adrenocortical tumours. Cancer Res 2005; 65 : 7622–7627.
56. Venkatesh S, Hickey RC, Sellin RV et al. Adrenal cortical carcinoma. Cancer 1989; 64 : 765–769.
57. Weber MM, Auernhammer CJ, Kiess W et al. Insulin‑like growth factor receptors in normal and tumorous adult human adrenocortical glands. Eur J Endocrinol 1997; 136 : 296–303.
58. Weiss LM. Comparative histologic study of 43 metastasizing and nonmetastasizing adrenocortical tumors. Am J Surg Pathol 1984; 8 : 163–169.
59. Wiedemann HR. Tumors and hemihypertrophy associated with Wiedemann‑Beckwith syndrome. Eur J Pediatr 1983; 141 : 129.
60. Wieneke JA, Thompson LDR, Heffess CS. Adrenal cortical neoplasms in the pediatric population. A clinical and immunophenotypic analysis of 83 patients. Am J Surg Pathol 2003; 27 : 867–881.
61. Wood BJ, Abraham J, Hvizda JL et al. Radiofrequency ablation of adrenal tumors and adrenocortical carcinoma metastases. Cancer 2003; 97 : 554–560.
62. Libé R, Fratticci A, Bertherat J. Adrenocortical cancer: pathophysiology and clinical management. Endocrine-Related Cancer 2007; 11 : 13–28.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Incidence pankreatického karcinomu u osob s chronickou pankreatitidou
- Kardiovaskulární rehabilitace v současnosti
- Ovlivnění hemostázy při terapii náhradními roztoky
- Infarkt myokardu, remodelace levé komory a buněčná terapie
- Účinnost anti‑TNF‑α léčiv v běžné klinické praxi a náklady na tato léčiva
- Karcinom kůry nadledvin
- Karcinom kůry nadledvin – editorial
- Diagnostika a léčba akutního peripartálního život ohrožujícího krvácení – doporučený postup
- Koronární ektazie v kombinaci s nemocí tří tepen
- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- Dopisy redakci
- Dopisy redakci
- Vítězové a poražení z New Orleans. Od rosuvastatinu k antioxidačním vitaminům – pár postřehů ze sjezdu AHA 2008
- 6. kongres Medzinárodnej spoločnosti histórie nefrológie, 2.– 4. októbra 2008, Taormina – Giardini Naxos (Taliansko)
- Recenze
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinom kůry nadledvin
- Koronární ektazie v kombinaci s nemocí tří tepen
- Kardiovaskulární rehabilitace v současnosti
- Léčba Waldenströmovy makroglobulinemie – zkušenosti jednoho pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání







