-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hemovigilance
Haemovigilance
Haemovigilance is a system of actions, comprising detection, summary and analysis of information concerning severe adverse effects and events on the part of transfusion donors and recipients and epidemiological monitoring of blood donors. In the complex conception a clinical section, which means transfusion indication criteria, their control, good practice in the course of transfusion administration, is also included in the definition. System of reporting of adverse effects of transfusions, which depends on clinical doctors knowledge and approach, is of a key importance. Superior legislative, procedure standards, operable network connecting state authorities, health care providers and transfusion service, further unmistakable data collection definition and application of findings to the practice is necessary for the effective haemovigilance system. Legislative standard for the European Union member states is Directive No. 2002/98/EC, which provides quality and safety standards for production of transfusion preparations,it does not solve the clinical section of problems. In the Czech Republic, the field of transfusion preparations production is quite well handled by the Medicine Act, while European legislative being implemented gradually. The situation in the clinical section is not optimal, especially national guidelines for indications of transfusion preparations and transfusion administration itself are missing, the problem is also the absence of undergraduate and postgraduate education in transfusiology.
Key words:
haemovigilance – transfusion safety – adverse effect
Autoři: R. Procházková
Působiště autorů: Transfuzní oddělení Krajské nemocnice Liberec, přednosta prim. MUDr. Renata Procházková
Vyšlo v časopise: Vnitř Lék 2005; 91(7 a 8): 913-917
Kategorie: 128. internistický den – XXI. Vanýskův den, Brno 2005
Souhrn
Hemovigilance je systém postupů, zahrnující detekci, shrnutí a analýzu informací o závažných nepříznivých účincích a příhodách na straně dárců a příjemců transfuzí a epidemiologické sledování dárců krve. V komplexním pojetí je do definice zahrnuta i klinická část, tzn. indikační kritéria transfuzí, jejich kontrola, správná praxe při aplikaci transfuze. Klíčový je systém hlášení nežádoucích účinků transfuze, který je závislý na znalostech a přístupu klinických lékařů. Pro efektivní systém hemovigilance je nutná kvalitní legislativa, standardy postupů, fungující síť spojující státní autority, poskytovatele zdravotní péče a transfuzní službu, dále jasná definice sběru dat a aplikace poznatků do praxe. Legislativní normou pro státy Evropské unie je směrnice 2002/98/EC, která stanoví normy kvality a bezpečnosti pro výrobu transfuzních přípravků, klinickou část problematiky neřeší. V České republice je dobře ošetřena oblast výroby transfuzních přípravků zákonem o léčivu, evropská legislativa je postupně implementována. V klinické části není situace optimální, chybí zejména celostátní guidelines pro indikace transfuzních přípravků a/nebo vlastní aplikaci transfuze, problémem je i absence pregraduální i postgraduální výuky transfuziologie.
Klíčová slova:
hemovigilance - bezpečnost transfuze - nežádoucí účinekHemovigilance (HV) je termín široce používaný v souvislosti s bezpečností hemoterapie. Směrnice 2002/98/EC jej definuje jako soubor systematických postupů, který zahrnuje detekci, shrnutí a analýzu informací o závažných nepříznivých účincích a příhodách na straně příjemců transfuzí a dárců krve a epidemiologické sledování dárců krve [1]. Cílem HV je zajistit dohled nad transfuzními aktivitami, sběr dat o závažných nežádoucích účincích hemoterapie, zdokonalit transfuzní standardy, podílet se na formulaci guidelines na tomto poli a zvýšit bezpečnost a kvalitu transfuzních procesů [2].
Termín vznikl v 90. letech 20. století ve Francii, kde byl současně položen její mandatorní základ [2], následovalo zařazení a definice pojmu HV do Doporučení Rady Evropy v roce 1995 [3]. Přestože většinou je pojem HV koncentrován na detekci neočekávaných účinků transfuze u příjemců, můžeme najít i řadu širších definic pojmu, podle kterých zavedený systém HV zahrnuje celý proces od výběru dárce krve k příjemci transfuze [3], tzn. oblast správné výrobní praxe při výrobě transfuzních přípravků (TP), v klinické části se zabývá indikačními kritérii hemoterapie a jejich kontrolou, alternativními postupy, správnou praxí při aplikaci transfuze [4]. Klíčový je funkční systém hlášení nežádoucích účinků hemoterapie a jejich analýza, sběr dat je však závislý na vzdělání a disciplíně klinických lékařů. HV je součástí státní zdravotní politiky [1]. Pro efektivní systém HV je nutná kvalitní legislativa, standardy postupů, fungující síť, která spojuje státní autority (v ČR SÚKL, Ministerstvo zdravotnictví), poskytovatele zdravotní péče a transfuzní službu, dále jasná definice sběru dat a aplikace získaných poznatků do praxe.
V Evropě existuje několik systémů, které se liší v několika aspektech:
- a) systém je dobrovolný nebo povinný;
- b) rozdílný je rozsah sběru dat - všechny reakce vs pouze závažné reakce u pacientů;
- c) organizace HV má různý stupeň centralizace, obvykle korespondující s organizací transfuzní služby ve státě.
Klasickým příkladem je rozdíl mezi francouzským a britským systémem. Ve Velké Británii je systém centralizovaný v tzv. SHOT office na národní úrovni, je dobrovolný a eviduje závažné potransfuzní reakce, nesprávně transfundované přípravky i bez klinických příznaků a tzv. near-miss (příhody, které nepoznány, by mohly způsobit změnu zdravotního stavu, např. záměny pacientů apod). Francie má národní systém se dvěma institucionálními cestami, který je povinný, eviduje všechny nežádoucí reakce včetně near-miss. Ve Spolkové republice Německo podléhají labilní krevní složky a jejich aplikace zákona o krvi a nežádoucí účinky musí být hlášeny v režimu farmakovigilance [2]. Od roku 1998 existuje European Hemovigilance Network - sdružení národních transfuzních služeb států EU, jež sleduje srovnatelné údaje členských států na evropské úrovni, důraz je kladen na vyhodnocování nežádoucích účinků transfuze a materovigilanci, tj. sledování nežádoucích účinků prostředků zdravotnické techniky. Existuje zde funkční systém varovných hlášení (rapid alert report), který má zabránit např. použití vadného PZT (???) v ostatních členských státech [2]. ČR do tohoto systému zapojena není pro neexistenci národní transfuzní služby.
V posledních 5 letech vývoj v Evropě směřoval k centralizaci systémů HV na národní úrovni s trendem centrálně hlásit pouze těžké reakce po transfuzích, a lokálně, tedy na úrovni zdravotnického zařízení, sledovat reakce středně závažné nebo všechny [2]. Lze zaznamenat přechod do režimu povinných hlášení, ukazuje se, že výtěžnost informací z tohoto systému je vyšší [4]. Očekává se postupné vytvoření společných definic, standardů, formulářů, směnitelnost informací, varovných hlášení [2].
Legislativní normou pro státy EU je Směrnice 2002/98/EC Evropského parlamentu s dodatky [1], která zabezpečuje standard kvality a bezpečnosti krve a jejích složek. Stanovuje základní normy pro odběr krve a její zpracování, testování, skladování a distribuci. Vychází z volného pohybu občanů Evropské unie a nároku občana na srovnatelnou kvalitu hemoterapie v každé zemi EU. Do české legislativy byla zčásti implementována vyhl. 411/2004 Sb. dne 13. 7. 2004. Norma ukládá povinnosti v oblasti HV jak transfuzním oddělením, tak klinickým pracovištím. Důraz klade mimo jiné na nezpochybnitelnou identifikaci každého odběru a typu krevní složky, údaje potřebné pro dohledatelnost dárce a příjemce musí být archivovány 30 let, zdravotnická zařízení mají povinnost zavést systém pro získání zpětné informace o podání TP a jeho závažného nežádoucího účinku. Dále stanoví povinnost hlásit závažné nežádoucí příhody (tzn. situace, které nerozpoznány, mohly by způsobit poškození zdraví nebo smrt) a reakce (již proběhlé nežádoucí účinky) nejen u příjemců transfuzí, ale i u dárců krve [1]. Norma je postupně dopracovávána a uváděna v praxi. Pro praxi je klíčové to, že direktiva řeší pouze oblast výroby TP a neřeší oblast klinické praxe. Ta je v kompetenci národních legislativ jednotlivých států EU.
Současný stav HV v ČR
Legislativní základ pro HV v ČR položil zákon o léčivu 79/97 Sb. Od roku 1997 stát povoluje výrobu TP a surovin pro další zpracování, stanoví povinnost hlásit závažné nežádoucí reakce po transfuzi vyplývající z kvality TP a transfuzí přenosné infekce [5]. Požadavky Směrnice 2002/98/EC na HV implementuje od 13. 7. 2004 vyhl. 411/2004 Sb. [6], na podzim roku 2005 je připravována novela zákona o léčivu.
V praxi je v ČR dobře ošetřena oblast správné výrobní praxe při výrobě TP, přestože situace v transfuzní službě není optimální (v ČR neexistuje národní transfuzní služba, není jednotné vedení, problematika oboru není ošetřena ucelenou legislativní normou). V oblasti výběru dárců krve je kladen důraz na bezpříspěvkové dárcovství, postupně je zaváděno jednotné poučení o rizikových faktorech pro dárce krve a jednotný dotazník, oblast prostředků zdravotnické techniky a materovigilance řeší zákon 123/2000 Sb. [7], vlastní výroba TP a plazmy pro průmyslové zpracování je ošetřena zákonem o léčivu, který stanoví podmínky pro činnost transfuzních oddělení vyrábějících TP, stanoví požadavky na vzdělání kvalifikovaných osob a určuje jejich postavení a odpovědnost v procesu výroby TP, základní pravidla pro vyšetření parametrů jakosti odebrané krve, povinnost tzv. look-back hlášení atd [7]. Zařízení transfuzní služby jsou kontroluje ve 2letých intervalech SÚKL.
V oblasti klinické transfuziologie není situace optimální. Postrádáme celostátní guidelines pro indikace TP a krevní deriváty, pro předtransfuzní vyšetření či vlastní aplikaci transfuze, pro alternativní postupy. Nejasná je zodpovědnost za hemoterapii, za vlastní aplikaci transfuze, prokazatelné proškolení lékařů k aplikaci transfuze není ve zdravotnických zařízeních obvyklým standardem, stejně jako informovaný souhlas pacienta s hemoterapií. Situaci navíc komplikuje vyhl. 424/2004 Sb., která umožňuje sestrám s atestací v intenzivní péči aplikaci transfuze bez jasně stanovených pravidel [8].
Nedořešena je problematika nežádoucích účinků transfuze. Platí sice povinnost hlásit SÚKL závažné nežádoucí účinky vyplývající z kvality TP a transfuzí přenosné infekce, současně probíhá sjednocený sběr dat pro statistické účely (ÚZIS), na rozdíl od zahraničí však žádné výstupy o získaných datech či epidemiologické situaci publikovány nejsou, výjimkou je NRL AIDS. Probíhají diskuse o tom, jaké reakce je třeba hlásit, trendem je hlásit jen reakce těžké i na lokální úrovni. Zde je nedoceněn význam řešení i méně závažných nežádoucích účinků transfuze pro následnou hemoterapii konkrétního pacienta (např. řešení opakovaných středně závažných nehemolytických febrilních reakcí deleukotizovanými TP, v případě alergických reakcí indikací promytých erytrocytů apod). Podporu pro hlášení a vyšetření alespoň středně těžkých potranfuzích reakcí lze najít v Doporučení Rady Evropy [3], kde je doporučeno sledovat mimo závažné reakce i reakce středně těžké během transfuze (hemolýza, nehemolytická febrilní reakce, vyrážka, erytém), dále pozdní reakce po transfuzi, výskyt aloimunizace proti krevním buňkám a transfuze nesprávných TP. V praxi je klinická diagnostika potransfuzních reakcí podceněna, například nehemolytické febrilní reakce bývají často považovány za disease-related fever, přičemž v diferenciální diagnostice nejsou zvažovány i jiné příčiny stavu jako možná počínající hemolýza či septikemie po transfuzi [9]. Svůj vliv na jistém podcenění problematiky v praxi má absence pregraduální i postgraduální výuky transfuziologie a absence kvalitních učebních textů.
Aktivity Společnosti pro transfuzní lékařství
Problematikou HV se dlouhodobě zabývá výbor Společnosti pro transfuzní lékařství. V letech 2002-2004 zahájil celostátní monitorování potransfuzních reakcí. I když data nelze považovat za komplexní a systém sběru dat se vyvíjí, ukazuje se jedno: porovnatelná data získaná v ČR se pohybují v promile na rozdíl od údajů v procentech ze zahraničí. Byl vypracován metodický návod Doporučený postup při vyšetřování a hlášení potransfuzních reakcí a nežádoucích účinků transfuze [10], který komplexně řeší problematiku na úrovni zdravotnického zařízení v klinické i laboratorní oblasti. Strukturovaný materiál obsahuje:
- definice potransfuzních reakcí (tab. 1), obsahující popis klinických projevů a diagnostická kritéria
- opatření při reakci na klinickém oddělení včetně postupu při hlášení reakce a doporučení pro odběry vzorků
- formulář pro hlášení reakcí (tab. 2)
- algoritmus vyšetření reakce
- vzorovou dokumentaci.
Tab. 1. Definice potransfuzních reakcí. 
Tab. 2. Algoritmus vyšetření potransfuzní reakce. 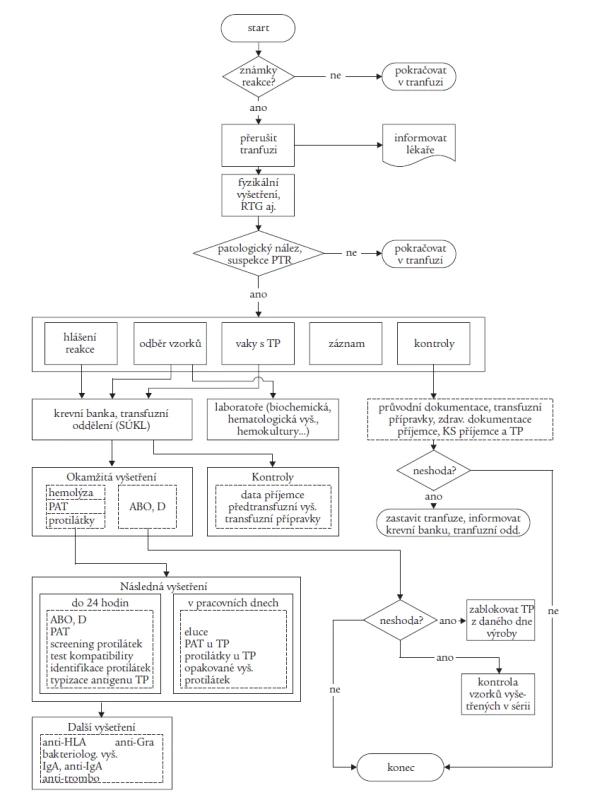
Definice potransfuzních reakcí jsou zde uváděny dle Meetingu EHN 2004 s popisem klinického obrazu a diagnostických kriterií reakce. Uvedený materiál je v současné době ověřován v Ústeckém a Libereckém kraji. Pro hlášení potransfuzních reakcí byla v STL dohodnuta zásada: centrálně hlásit závažné reakce a události (bez ohledu na pravděpodobnou příčinu), lokálně hlásit i lehké reakce a analyzovat na místě. Na centrální úrovni se výbor STL aktivně podílí na řešení problematiky ve spolupráci se SÚKL včetně implementace nové evropské legislativy do praxe.
Závěr
Problematika hemovigilance je v České republice ošetřena legislativně v oblasti výroby TP, nicméně zde chybí analýza získaných údajů a výstupy do praxe. Nedořešena je oblast klinické transfuziologie, která není ošetřena standardy zejména v oblasti praktické hemoterapie a problematiky nežádoucích účinků transfuze. Lze konstatovat, že budování systému hemovigilance jako skutečně funkčního systému je teprve v začátcích, zejména v oblasti preventivní hemovigilance. K řešení by jistě přispěla ucelená legislativní norma, jako je zákon o krvi v SRN.
prim. MUDr. Renata Procházková
www.nem.lib.cz
e-mail: renata.prochazkova@nemlib.cz
Doručeno do redakce: 14. 4. 2005
Přijato k otištění: 14. 4. 2005
Zdroje
1. Directive 2002/98/EC of the European Parliament and of the Council setting standard of quality and safety for the collection, testing, processing, storage and distribution of human blood and blood components and ammending Directive 2001/83/EC. Official J Eur Communities 2003.
2. Faber JC. Worldwide overview of existing haemovigilance systems. Transf Apher Sci 2004; 31 : 99-110.
3. Guide on the preparation, use and quality assurance of blood components. Reccomendation No. R (95) 15, 9th ed. Council of Europe, January 2003.
4. Robillard P, Chan P, Kleinman S. Hemovigilance for improvement of blood safety. Transf Apher Sci 2004; 31 : 95-98.
5. Zákon 79/1997 Sb. o léčivech a o změnách a doplnění některých souvisejících zákonů ve znění dalších novel.
6. Vyhl. MZdr. 411/2004 Sb., kterou se stanoví správná výrobní praxe, správná distribuční praxe a bližší podmínky povolování výroby a distribuce léčiv, včetně medikovaných krmiv a veterinárních autologních vakcín, změn vydaných povolení, jakož i bližší podmínky vydávání povolení k činnosti kontrolních laboratoří (vyhláška o výrobě a distribuci léčiv).
7. Zákon 123/2000 Sb. o zdravotnických prostředcích a o změně souvisejících zákonů.
8. Vyhl. 424/2004 Sb., kterou se stanoví činnosti zdravotnických pracovníků a jiných odborných pracovníků.
9. Ciavarella DJ, Harmening DM, Hoppe PA et al. Transfusion therapy: Clinical principles and practise. Bethesda: AABB Press 1999 : 359-361.
10. Procházková R, Masopust J. Návrh hlášení a vyšetření potransfuzních reakcí. Sborník abstrakt. 10. pracovní dny Společnosti pro transf. lékařství ČLS JEP, 8.-10. 9. 2004, Rožnov pod Radhoštěm.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Trombofilní stavyČlánek Protidestičková léčbaČlánek Trombocytopenické purpuryČlánek Trombocytózy a trombocytemieČlánek Anémie chronických chorobČlánek Potransfuzní reakceČlánek Z odborné literatury
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2005 Číslo 7 a 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Ferinject: správně indikovat, správně podat, správně vykázat
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo k přednáškám z XXI. Vanýskova dne
- Ohlédnutí a perspektivy současné hematologie
- Primární antitrombotická prevence žilní trombózy ve vnitřním lékařství
- Antikoagulační léčba flebotrombóz v ambulantní praxi
- Invazivní kontrolovaná léčba hluboké žilní trombózy
- Sepsa a Československé fórum pre sepsu
- Fenotypová a genotypová analýza vrodenej hypofibrinogenémie a dysfibrinogenémie
- Antifosfolipidový syndrom – diagnostika a léčba
- Trombofilní stavy
- Protidestičková léčba
- Glykoproteiny destičkové membrány z hlediska jejich genetických změn
- Glykoprotein Ia/IIa destičkové membrány z hlediska jeho genetických změn
- Glykoprotein IIb/IIIa destičkové membrány z hlediska jeho genetických změn
- Trombocytopenické purpury
- Trombocytózy a trombocytemie
- Antitrombotická léčba v etiologii akutní posthemoragické anémie
- Anémie chronických chorob
- Autoimunitní hemolytické anémie
- Některé vzácnější formy hereditárních anémií vyskytující se v dospělé populaci v ČR - β-talasemie a nestabilní hemoglobinové varianty
- Zajištění spolehlivosti vyšetření krevních obrazů
- Hemoterapie a její bezpečnost
- Potransfuzní reakce
- Refrakterita k trombocytovým transfuzním přípravkům
- Hemovigilance
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Potransfuzní reakce
- Trombocytózy a trombocytemie
- Antifosfolipidový syndrom – diagnostika a léčba
- Protidestičková léčba
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



