-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Role botulotoxinu při léčbě dysfunkce dolních cest močových u pacientů s roztroušenou sklerózou
Role of botulinum toxin in the management of multiple sclerosis lower urinary tract dysfunctions
Lower urinary tract (LUT) dysfunction is common in patients with multiple sclerosis (MS). These patients require specialized care, hospitalization and their management is a great challenge for the treatment team. Throughout the course of their disease, patients are offered different management options for treatment of incontinence and detrusor sphincter dyssynergia (DSD); the mainstay of which is antimuscarinic medications, in combination with clean intermittent self-catheterisation (CISC). The evidence for other alternative strategies aiming at improving bladder emptying is lacking and still needs more clinical trials. Botulinum toxin-A (BonT-A) has been used extensively in the management of urological manifestations of MS; as regard neurogenic detrusor overactivity (NDO) and DSD, with proven efficacy in both entities.This review will focus on the role of BonT-A in management of MS bladder and sphincteric dysfunctions, with emphasis on incidence, presentation, applications and techniques of injection of BonT-A in MS patients.
Key words:
multiple sclerosis, botulinum toxin, neurogenic detrusor overactivity, detrusor sphincter dyssynergia
Autoři: W. Mahfouz; J. Corcos
Působiště autorů: Jewish General Hospital, Canada ; Department of Urology
Vyšlo v časopise: Urol List 2011; 9(3): 53-57
Souhrn
Dysfunkce dolních cest močových (LUT) je častou poruchou u pacientů trpících roztroušenou sklerózou (MS). Vzhledem k tomu, že tito pacienti vyžadují speciální péči, představuje jejich hospitalizace i léčba výzvu pro celý lékařský tým. V průběhu choroby jsou pacientům nabízeny nejrůznější strategie pro léčbu inkontinence a detruzoro-sfinkterické dyssynergie (DSD). Podstata léčby spočívá v aplikaci antimuskarinik v kombinaci s čistou intermitentní selfkatetrizací (CISC). Nemáme však k dispozici žádné důkazy o alternativních strategiích, jejichž cílem by bylo zlepšení vyprazdňovací funkce močového měchýře. Tuto problematiku je nutné podrobit zkoumání v klinických studiích. Botulotoxin-A (BonT-A) se běžně užívá pro léčbu urologických poruch u pacientů s MS. Bylo prokázáno, že tato látka je účinná při léčbě hyperaktivního detruzoru neurogenního původu (NDO) i DSD. Tento přehledový článek hodnotí roli BonT-A při léčbě dysfunkce močového měchýře a svěrače u pacientů s MS, s důrazem na incidenci a manifestaci onemocnění a způsob aplikace BonT-A.
Klíčová slova:
roztroušená skleróza, botulotoxin, hyperaktivita detruzoru neurogenního původu, detruzoro-sfinkterická dyssynergieROZTROUŠENÁ SKLERÓZA
Roztroušená skleróza (MS) představuje nejčastější zánětlivé onemocnění centrálního nervového systému (CNS), pro niž je typický vznik plaku demyelinizací bílé hmoty CNS. Jedná se o chronické onemocnění vyznačující se řadou symptomů, které významně omezují pracovní činnost pacienta, jeho každodenní aktivity i kvalitu života (QoL). Řada symptomů není vzhledem k nedostatečné pozornosti na straně lékaře i pacienta léčena (např. únava nebo bolest). Řada preparátů pro léčbu MS je off-label, a není tedy pacientovi dostupná [1]. Prevalence MS závisí na geografické poloze a rase, nejvyšší prevalence byla zaznamenána u bělochů v mírném pásmu. V Evropě a severní Americe činí preva-lence 1/800 osob, roční incidence činí 2–10/100 000 [2]. První neurologické symptomy se obvykle projeví mezi 20. a 50. rokem života. Manifestace symptomů ve vyšším věku (> 40 let) může být spojena s vyšším rizikem progrese onemocnění [3]. U žen se tato choroba vyskytuje 2–4krát častěji než u mužů [4].
Symptomy dolních cest močových
Dysfunkce LUT je častou poruchou u pacientů s MS. Dysfunkce LUT může významně narušovat QoL pacienta a dále zhoršovat již existující omezení způsobená neurologickým onemocněním [5–9]. Až u 75 % pacientů s MS dojde v průběhu jejich choroby ke vzniku komplikací s močovým měchýřem [5,8,9]. Při diagnostikování onemocnění je u 10 % pacientů již přítomna porucha detruzoru a sfinkteru.
Porucha LUT se obvykle u pacientů s MS projevuje jednou z následujících forem:
- Dysfunkce močového měchýře v dů-sledku NDO. Tato porucha se obvykle projevuje následujícími symptomy: urgence, močová frekvence a/nebo nutkavá inkontinence (dráždivé symptomy) s prevalencí 37–99 % [10,11].
- Dysfunkce svěrače v důsledku DSD. Převládají obstrukční symptomy [12], které se vyskytují u 34–79 % pacientů, ve 25 % případů vedou k chronické močové retenci [10,11].
- Smíšená dysfunkce (NDO a DSD). U pacientů jsou přítomny dráždivé i obstrukční symptomy. Tato porucha se může vyskytovat až u 59 % mužů a 51 % žen [13].
Formy dysfunkce LUT u pacientů s MS
- hyperaktivita detruzoru neurogenního původu (NDO)
- dysfunkce svěrače (DSD)
- smíšená dysfunkce (NDO a DSD)
BOTULOTOXIN
V poslední době se objevují stále nové důkazy prokazující terapeutickou účinnost neurotoxinu botulinu (BonT-A) při léčbě různých druhů dysfunkce močové trubice a močového měchýře [14]. V současné době jsou k dispozici různé formy botulotoxinu (BTX). Toxin existuje ve dvou různých sérotyopech: typ A (botulinum toxin-A) a typ B (botulinum toxin-B). BTX-A je nejčastěji k dispozici ve formě následujících dvou preparátů: Botox® a Dysport®. Co je třeba zdůraznit – stejná dávka obou preparátů není ekvivalentní [1].
Většina studií testuje účinnost Botoxu®. Druhé místo zaujímá preparát Dysport®, jehož aplikace však byla schválena pouze v několika státech. Užívání preparátu Xeomin® bylo schváleno pouze v Německu. Jediná v současné době dostupná forma botulotoxinu B byla schválena téměř výhradně pro léčbu spastické torticollis. Aplikace tohoto preparátu je vyhrazena pouze pro pacienty, u nichž došlo ke vzniku protilátek neutralizujících účinek BonT-A [15].
Mechanizmus účinku BonT-A
Účinek botulotoxinů spočívá v inhibici uvolňování acetylcholinázy (Ach) v presynaptickém zakončení cholinergního nervu, a tedy současně v inhibici kontrakcí příčně pruhované a hladké svaloviny. Toxiny jsou syntetizovány jako jednořetězcové polypeptidy o molekulární hmotnosti přibližně 150 kD. Rodičovský řetězec se pak štěpí na aktivní dvojřetězcovou polypetidovou formu, která je tvořena řetězcem o vysoké molekulární hmotnosti (přibližně 100 kD), který je prostřednictvím disulfidického můstku (= SS vazba) navázán na řetězec o nízké molekulární hmotnosti (přibližně 50 kD) s atomem zinku [16].
Toxin vyvolává paralýzu v následujících čtyřech fázích: (i) vazbou řetězce toxinu o vysoké molekulární hmotnosti na neidentifikovaný receptor nervového zakončení, (ii) internalizací toxinu v rámci nervového zakončení, (iii) translokací řetězce o nízké molekulární hmotnosti do cytosolu a (iv) inhibicí uvolňování neurotransmiteru. Uvolňování neurotransmiteru zahrnuje transport (závislý na ATP) vezikul z cytosolu do cytoplazmatické membrány. Ukotvení vezikul vyžaduje interakci cytoplazmy, vezikul a cílových membránových proteinů, tj. proteinů SNARE (= membránový receptor SNAP). BTX-A štěpí translokační protein SNAP-25, a tak zabraňuje sloučení vezikul a plazmatické membrány [16].
Indikace BonT-A u pacientů s MS
Detruzoro-sfinkterická dyssynergie
Injekční aplikace BonT-A do močové trubice byla poprvé užita při léčbě neurogenní DSD [17–23] u pacientů s nejrůznějšími neurologickými poruchami jako např. traumatické poranění míchy (SCI) a MS. Za těchto okolností se BonT-A užívá s cílem zlepšit mikční funkci nebo usnadnit provádění čisté intermitentní katetrizace (CIC). Injekční aplikace BonT-A do zevního uretrálního svěrače (EUS) vyvolává relaxaci svaloviny, jež pravděpodobně snižuje odpor v močové trubici, a zlepšuje tak močení. [24].
Hyperaktivita detruzoru neurogenního původu
Bylo prokázáno, že BonT-A účinně snižuje tlak detruzoru během fazických mimovolních kontrakcí a během močení u pacientů s NDO i idiopatickou hyperaktivitou detruzoru (IDO), čímž zvětšuje jímací kapacitu močového měchýře [25,26]. Tento účinek svědčí o efektu BonT-A na motorické zásobení detruzoru.
Rovněž bylo prokázáno, že BonT-A potlačuje aktivitu aferentních nervů prostřednictvím inhibice uvolňování neurotransmiterů, jako jsou substance P a CGRP (protein regulující gen pro kalcitonin), ze senzorických nervových zakončení [27,28]. Zdá se tedy vysoce pravděpodobné, že kromě přímého účinku na motorické zásobení detruzoru moduluje BonT-A rovněž vnitřní reflexy v močovém měchýři prostřednictvím několikanásobného účinku na senzorické dráhy.
Techniky aplikace Botoxu
Injekční aplikace do zevního svěrače
BonT-A se obvykle aplikuje do močového svěrače pod elektromyografickou (EMG) nebo cystoskopickou navigací.
- Technika s užitím
EMG spočívá v lokalizaci EUS pomocí EMG jehly. U mužů se
jehla obvykle zavádí do perineálního raphe ve stejné vzdálenosti
od skrota i anu. Jehlu směřujeme k apexu prostaty, jenž nahmatáme skrze
rektum [23]. U žen se provádí EMG uretrálního svěrače [29].
Stejný typ jehly je zaveden jednou mediálně nebo dvakrát
paramediálně do přední poševní stěny pod střední část
močové trubice, přibližně 2 cm proximálně od meatu.
U pacientů obou pohlaví se lze ujistit o správném zavedení hrotu jehly do EUS na základě typické tonické aktivity EUS nebo reflexní aktivity vyvolané při zmáčknutí glandu či klitorisu (bulbo-kavernózní reflex). Studie s užitím MRI prokazují, že aplikace pomocí EMG navigace umožňuje přesně a specificky cílit EUS [30]. Mezi aplikací jedné injekce mediálně a dvou injekcí paramediálně do obou hemisfinkterů nebyl prokázán žádný rozdíl. - Injekce pod cystoskopickou navigací se zavádí pod přímou zrakovou kontrolou, kdy je endoskopická jehla zavedena rigidním nebo flexibilním endoskopem. Obvykle se užívá rigidní endoskop u žen a flexibilní cystoskop u mužů. Provádí se 2–4 vpichy do svěrače na pozici 12., 3., 6. a nebo 9. hodiny na ciferníku. Jehlu je nutné zavést hlouběji (1 cm) než při aplikaci „bulking“ látky, abychom toxin aplikovali přímo do svaloviny a nikoli do suburoteliálního prostoru [31].
Účinek obou technik se zdá být s ohledem na denervaci EUS a kvalitu vyprázdnění močového měchýře srovnatelný [19,23]. Volba techniky závisí na zkušenosti a preferenci lékaře.
Dávkování
Dávkování BonT-A do EUS je následující: 80–100 IU Botoxu nebo 150–250 IU Dysportu v závislosti na indikaci a lékaři. Dávka se obvykle ředí ve 2 nebo 4 ml 0,9% fyziologického roztoku. Obě techniky se obvykle provádí ambulantně v lokální anestezii (10 ml lidokainového gelu injikovaného do močové trubice 10 min před aplikací toxinu). U pacientů s poraněním míchy nad T6 je vzhledem k riziku autonomní dysreflexie nutné během procedury monitorovat krevní tlak.
Injekční aplikace do močového měchýře (obr. 1)
Techniky injekční aplikace
Injekční aplikace do močového měchýře nebyla dosud standardizována. Při léčbě NDO se BonT-A aplikuje pomocí rigidního cystoskopu [32]. Při tzv. „Dasgupta“ technice se zavádí ultratenká jehla flexibilním cystoskopem v lokální anestezii. Jednotlivé vpichy jsou pravidelně rozprostřeny po stěně močového měchýře (vyjma trigona). Výkon je rychlý a pacienty dobře snášen [33,34].
Obr. 1. Injekční aplikace Botoxu do močového měchýře. Na obrázku nahoře vlevo je zobrazena špička jehly, další schémata ukazují zavedení jehly do svaloviny detruzoru. 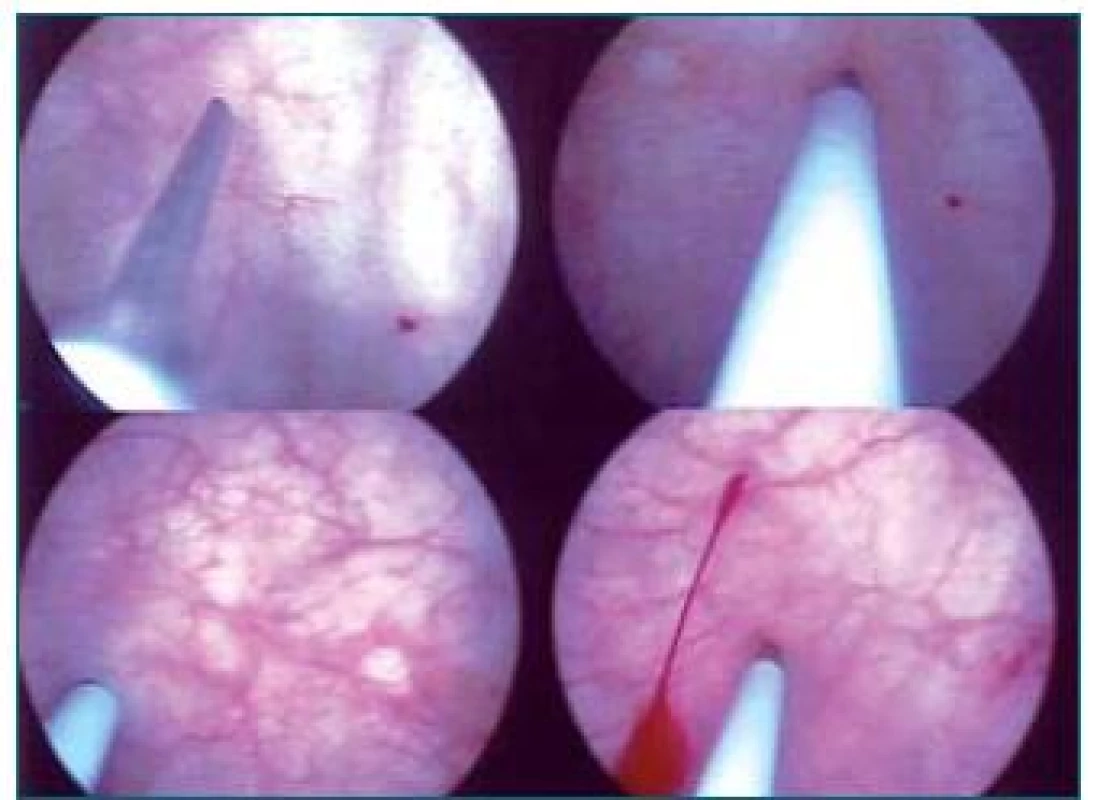
Dávkování a počet injekcí
Klasicky se botulotoxin aplikuje do 30 oblastí podél stěny močového měchýře, trigonum je vynecháno. Toxin je rozpuštěn v 30 ml 0,9% fyziologického roztoku. 30 injekcí (každá po 1 ml) se aplikuje intramuskulárně podél celé stěny močového měchýře (vyjma trigona) do hloubky 3–5 mm. Rozsáhlejší aplikace toxinu do močového měchýře byla spojena s lepším výsledkem a déletrvajícím efektem, ovšem za cenu vzniku mikční dysfunkce [35]. Počet vpichů závisí rovněž na koncentraci roztoku a užité dávce. Studie prokazující účinnost Botoxu při léčbě NDO užívaly dávku Botoxu 10 U/ml/vpich. Schurch et al [26] při srovnání aplikace dvou dávek BonT-A (200 a 300 U Botoxu) do detruzoru v rámci léčby NDO neprokázali mezi oběma protokoly žádný rozdíl. V jiné studii Smith a Chancellor prokázali, že aplikace Botoxu do sliznice prostřednictvím 10 vpichů je stejně účinná (v rámci léčby hyperaktivity detruzoru) jako aplikace prostřednictvím 30 vpichů [36].
Léčba pacientů trpících roztroušenou sklerózou představuje pro urology skutečný oříšek. Vzhledem k tomu, že u těchto pacientů je obvykle přítomen velký objem postmikční reziduální moči (PVR), povede léčba pomocí 300 U toxinu pravdě-podobně k dalšímu zvětšení PVR nebo močové retenci, jež bude vyžadovat CIC nebo zavedení katétru, což obvykle není u pacientů s MS, kteří jsou ještě v ambulantní péči a jsou schopni vymočit většinu objemu močového měchýře, žádoucí. V nedávné době bylo prokázáno, že aplikace 100 U navozuje úlevu primárních symptomů hyperaktivního močového měchýře (OAB) bez vzniku močové retence a signifikantního zvětšení PVR. Nemáme dosud žádný důkaz, že by pro efektivní léčbu OABS u pacientů trpících MS byla nutná aplikace 300 U toxinu. Léčba je obvykle zahájena aplikací menší dávky, kterou lze v případě nutnosti zvýšit, raději než podávat od počátku vysokou dávku toxinu.
Technika pro aplikaci injekce
- Injekce do zevního
uretrálního svěrače
- aplikace pomocí EMG
- aplikace pomocí cystoskopie
Obě techniky jsou srovnatelné, volba techniky závisí na zkušenosti a preferenci lékaře.
- Injekce do detruzoru
- cystoskopie s užitím rigidního cystoskopu (upřednostňovaná volba u žen)
- cystoskopie s užitím flexibilního cystoskopu (upřednostňovaná volba u mužů)
Výsledky injekční aplikace botulotoxinu u pacientů s MS
Detruzoro-sfinkterická dyssynergie
Poprvé byl botulotoxin typu A (BonT-A) v urologii využit při léčbě detruzoro-sfinkterické dyssynergie neurogenního původu (DSD) u kvadruplegiků [37].
Účinek BonT-A při léčbě neurogenní DSD byl prokázán u dvou různých populací pacientů: kvadruplegiků, kteří nemohou provádět self-katetrizaci, a pacientů s MS obou pohlaví [24]. U pacientů s roztroušenou sklerózou však má DSD obvykle jiný charakter (i důsledky) než u pacientů s poraněním míchy. Změny v horních cestách močových a úplná močová retence se vyskytují pouze u malého procenta pacientů. Nejčastější komplikací spojenou s DSD je recidivující infekce močových cest [38], jež limituje použití terapií s modulací imunitního systému, zhoršuje symptomy MS i symptomy hyperaktivního močového měchýře, jež se často vyskytují u pacientů s MS [38].
Cíl aplikace BonT-A do USS u pacientů s roztroušenou sklerózou spočívá v dostatečném snížení odporu v močové trubici, jenž zamezí vzniku chronické retence/ /močové stáze/zvýšení hladiny PVR, aniž by vyvolala vznik stresové inkontinence. Potenciální benefit BonT-A oproti čisté intermitentní katetrizaci u pacientů s MS spočívá v tom, že narušení kognitivních funkcí ani zrakové postižení a zhoršená manuální zručnost nejsou překážkou indikaci této léčby. Pacienti s MS mají rovněž jiná očekávání od léčby DSD a terapie je zaměřena na jiné cíle než u pacientů s kvadruplegickým postižením [24].
Toxin lze aplikovat do zevního močového svěrače samostatně [31,37,39–47] nebo v kombinaci s aplikací do detruzoru [47–50]. Největší zkušenosti byly zaznamenány při léčbě pacientů s DSD neurogenního původu. Botox se aplikuje v dávce v rozmezí 50–200 U; standardně bylo užito 100 U ve 4 ml fyziologického roztoku [37,40,41,47–49].
Hyperaktivita detruzoru neurogenního původu
Řada studií popisuje zmírnění symptomů NDO při aplikaci BonT-A [25,26,31,33, 51–56]. Nejčastěji byla užita dávka 300 U Botoxu. Navzdory nejednotnému designu studií většina z nich zaznamenala při aplikaci jediné injekce toxinu významné zlepšení nejrůznějších výsledných parametrů: pokles počtu epizod inkontinence, zvětšení maximální cystometrické kapacity a zvýšení maximálního tlaku detruzoru. Účinek jediné aplikace toxinu přetrval průměrně po 8 měsíců (rozmezí: 12–36 týdnů).
Autoři prospektivní studie z jednoho centra zahrnující 16 pacientů, kteří podstoupili aplikaci 300 U BTX do močového měchýře a svaloviny zevního svěrače, prokázali, že aplikace BTX do detruzoru účinně zmírňuje symptomy DO rezistentní na medikamentózní léčbu. Jednou z komplikací této léčby však nadále zůstává hromadění reziduální moči, na což je nutné pacienta upozornit.
Jiná prospektivní, open-label studie z jediného centra testující účinnost aplikace 300 U Botoxu u pacientů s MS prokázala významné snížení počtu epizod inkontinence a zmírnění urgence, frekvence močení během dne i nykturie a signifikantní zlepšení funkce močového měchýře (prokázáno pomocí urodynamického vyšetření) a rovněž trvalé zlepšení ve všech doménách kvality života. Tento efekt přetrval průměrně po dobu 9,7 měsíců. Při opakované terapii bylo dosaženo srovnatelných výsledků [54]. Ehren et al hodnotí efekt jediné injekce (500 U) Dysportu na možnost snížení dávky perorální medikace, komplianci močového měchýře, kontinenci a kvalitu života v randomizované, dvojitě zaslepené a placebem kontrolované studii zahrnující pacienty trpící inkontinencí v důsledku neuro-genní DO (včetně pacientů s MS) [27]. Výsledky studie ukazují, že tato léčba umožňuje snížit dávku perorální medikamentózní léčby, snižuje vysoký tlak detruzoru i frekvenci příhod úniku moči.
Kombinace DSD a NDO
Kombinace těchto dvou poruch představuje pro urology skutečný oříšek, neboť samotná aplikace Botoxu do detruzoru zhoršuje kontraktilitu močového měchýře, a tím zvyšuje pravděpodobnost vzniku močové retence. Pouze minimum studií prokazujících zlepšení výsledků hodnotí kombinaci injekční aplikace toxinu do detruzoru i svěrače s cílem předejít CIC [48,49].
Další indikace
Další indikace pro aplikaci BTX v rámci léčby močových symptomů u pacientů s MS zahrnují injekci BTX do detruzoru pro vyhnutí se zavádění katétru u pacientů s neurogenní DO. Jedna studie prokázala, že BTX představuje velmi účinnou a bezpečnou modalitu pro tuto indikaci [57].
Doporučení
- Vhodnost užívání BTA pro léčbu DSD u pacientů s neurogenní poruchou lze podpořit pomocí důkazů úrovně 1C. Před tím, než bude možné stanovit doporučení; je však nutné dále hodnotit klinickou roli této modality [58].
- V případě aplikace toxinu do svěrače se doporučuje aplikovat 100 U Botoxu v 4ml roztoku (stupeň doporučení C) [58].
- Léčbu NDO pomocí 300 U Botoxu nebo 500 U Dysportu lze doporučit na základě důkazů úrovně 1b [59].
- Užití BonT-A pro léčbu refrakterního NDO u pacientů ochotných používat SCIC lze hodnotit stupněm doporučení A.
- Opakovaná aplikace toxinu je rovněž účinná (stupeň doporučení B) [58].
ZÁVĚR
Bylo prokázáno, že injekční aplikace BTA je bezpečná, tato strategie však nebyla dosud hodnocena speciálně u pacientů s MS. Jedním z potenciálních vedlejších účinků BTA (zejména při aplikaci vyšších dávek) je únava. Únava související s MS může představovat závažný problém a komplikovat pacientovy aktivity v běžném životě i zaměstnání.
Dalším významným vedlejším účinkem BTA (závisejícím na velikosti dávky) je zvýšená incidence močové retence. Doporučuje se tedy léčbu zahájit nižší dávkou (100–200 U) a v případě absence odpovědi dávku zvyšovat. V případě kombinace symptomů DSD a NDO je situace komplikovanější a riziko močové retence vyšší.
Jacques Corcos, MD
Wally Mahfouz, MD
Department of Urology
Jewish General Hospital
3755 Côte Sainte-Catherine
Montreal, QC H3T 1E2, Canada
jcorcos@uro.jgh.mcgill.ca
wallymahfouz77@gmail.com
Zdroje
1. Habek M, Karni A, Balash Y et al. The place of the botulinum toxin in the management of multiple sclerosis. Clin Neurol Neurosurg 2010; 112(7): 592–596.
2. Nicholas R, Young C, Friede T. Bladder symptoms in multiple sclerosis: a review of pathophysiology and management. Expert Opin Drug Saf 2010; 9(6): 905–915.
3. Detels R, Clark VA, Valdiviezo NL et al. Factors associated with a rapid course of multiple sclerosis. Arch Neurol 1982; 39(6): 337–341.
4. Noonan CW, Williamson DM, Henry JP et al. The prevalence of multiple sclerosis in 3 US communities. Prev Chronic Dis 2010; 7(1): A12.
5. Mehnert U, Birzele J, Reuter K et al. The effect of botulinum toxin type a on overactive bladder symptoms in patients with multiple sclerosis: a pilot study. J Urol 2010; 184(3): 1011–1016.
6. de Seze M, Ruffion A, Denys P et al. The neurogenic bladder in multiple sclerosis: review of the literature and proposal of management guidelines. Mult Scler 2007; 13(7): 915–928.
7. Litwiller SE, Frohman EM, Zimmern PE. Multiple sclerosis and the urologist. J Urol 1999; 161(3): 743–757.
8. Nortvedt MW, Riise T, Frugard J et al. Prevalence of bladder, bowel and sexual problems among multiple sclerosis patients two to five years after diagnosis. Mult Scler 2007; 13(1): 106–112.
9. Panicker JN, Nagaraja D, Kovoor JM et al. Lower urinary tract dysfunction in acute disseminated encephalomyelitis. Mult Scler 2009; 15(9): 1118–1122.
10. Amarenco G, Kerdraon J, Denys P. Bladder and sphincter disorders in multiple sclerosis. Clinical, urodynamic and neurophysiological study of 225 cases. Rev Neurol 1995; 151(12): 722–730.
11. Porru D, Campus G, Garau A et al. Urinary tract dysfunction in multiple sclerosis: is there a relation with disease-related parameters? Spinal Cord 1997; 35(1): 33–36.
12. Abrams P, Cardozo L, Fall M et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. Neurourol Urodyn 2002; 21(2): 167–178.
13. Giannantoni A, Scivoletto G, Di Stasi SM et al. Urological dysfunctions and upper urinary tract involvement in multiple sclerosis patients. Neurourol Urodyn 1998; 17(2): 89–98.
14. Smith CP, Chancellor MB. Emerging role of botulinum toxin in the management of voiding dysfunction. J Urol 2004; 171 (6 Pt 1): 2128–2137.
15. Jost WH. Botulinum toxin in multiple sclerosis. Journal of neurology 2006; 253 Suppl 1: I16–I20.
16. Yoshimura N, Chancellor MB. Physiology and pharmacology of the bladder and urethra. Saunders Elsevier, Philadelphia 2007.
17. de Seze M, Petit H, Gallien P et al. Botulinum a toxin and detruzor sphincter dyssynergia: a double-blind lidocaine-controlled study in 13 patients with spinal cord disease. Eur Urol 2002; 42(1): 56–62.
18. Dykstra DD, Sidi AA. Treatment of detruzor-sphincter dyssynergia with botulinum A toxin: a double-blind study. Arch Phys Med Rehabil 1990; 71(1): 24–26.
19. Dykstra DD, Sidi AA, Scott AB et al. Effects of botulinum A toxin on detruzor-sphincter dyssynergia in spinal cord injury patients. J Urol 1988; 139(5): 919–922.
20. Gallien P, Robineau S, Verin M et al. Treatment of detruzor sphincter dyssynergia by transperineal injection of botulinum toxin. Arch Phys Med Rehabil 1998; 79(6): 715–717.
21. Petit H, Wiart L, Gaujard E et al. Botulinum A toxin treatment for detruzor-sphincter dyssynergia in spinal cord disease. Spinal Cord 1998; 36(2): 91–94.
22. Phelan MW, Franks M, Somogyi GT et al. Botulinum toxin urethral sphincter injection to restore bladder emptying in men and women with voiding dysfunction. J Urol 2001; 165(4): 1107–1110.
23. Schurch B, Hauri D, Rodic B et al. Botulinum-A toxin as a treatment of detruzor-sphincter dyssynergia: a prospective study in 24 spinal cord injury patients. J Urol 1996; 155(3): 1023–1029.
24. Karsenty G, Baazeem A, Elzayat E et al. Injection of botulinum toxin type A in the urethral sphincter to treat lower urinary tract dysfunction: a review of indications, techniques and results. Can J Urol 2006; 13(2): 3027–3033.
25. Reitz A, Stohrer M, Kramer G et al. European experience of 200 cases treated with botulinum-A toxin injections into the detruzor muscle for urinary incontinence due to neurogenic detruzor overactivity. Eur Urol 2004; 45(4): 510–515.
26. Schurch B, de Seze M, Denys P et al. Botulinum toxin type a is a safe and effective treatment for neurogenic urinary incontinence: results of a single treatment, randomized, placebo controlled 6-month study. J Urol 2005; 174(1): 196–200.
27. Chuang YC, Yoshimura N, Huang CC et al. Intravesical botulinum toxin a administration produces analgesia against acetic acid induced bladder pain responses in rats. J Urol 2004; 172 (4 Pt 1): 1529–1532.
28. Dressler D, Adib Saberi F. Botulinum toxin: mechanisms of action. Eur Neurol 2005; 53(1): 3–9.
29. Olsen AL, Benson JT, McClellan E. Urethral sphincter needle electromyography in women: comparison of periurethral and transvaginal approaches. Neurourol Urodyn 1998; 17(5): 531–535.
30. Schurch B, Hodler J, Rodic B. Botulinum A toxin as a treatment of detruzor-sphincter dyssynergia in patients with spinal cord injury: MRI controlled transperineal injections. J Neurol Neurosurg Psychiatry 1997; 63(4): 474–476.
31. Smith CP, Nishiguchi J, O'Leary M et al. Single-institution experience in 110 patients with botulinum toxin A injection into bladder or urethra. Urology 2005; 65 : 37–41.
32. Schurch B, Stohrer M, Kramer G et al. Botulinum-A toxin for treating detruzor hyperreflexia in spinal cord injured patients: a new alternative to anticholinergic drugs? Preliminary results. J Urol 2000; 164 (3 Pt 1): 692–697.
33. Popat R, Apostolidis A, Kalsi V et al. A comparison between the response of patients with idiopathic detruzor overactivity and neurogenic detruzor overactivity to the first intradetruzor injection of botulinum-A toxin. J Urol 2005; 174(3): 984–989.
34. Harper M, Popat RB, Dasgupta R et al. A minimally invasive technique for outpatient local anaesthetic administration of intradetruzor botulinum toxin in intractable detruzor overactivity. BJU Int 2003; 92(3): 325–326.
35. Kuo HC. Comparison of effectiveness of detruzor, suburothelial and bladder base injections of botulinum toxin a for idiopathic detruzor overactivity. J Urol 2007; 178 (4 Pt 1): 1359–1363.
36. Smith CP, Chancellor MB. Simplified bladder botulinum-toxin delivery technique using flexible cystoscope and 10 sites of injection. J Endourol 2005; 19(7): 880–882.
37. Dykstra DD, Sidi AA, Scott AB et al. Effects of botulinum A toxin on detruzor-sphincter dyssynergia in spinal cord injury patients. The Journal of urology 1988; 139 : 919–922.
38. Litwiller SE, Frohman EM, Zimmern PE. Multiple sclerosis and the urologist. J Urol 1999; 161(5): 743–757.
39. Seze M, Petit H, Gallien P et al. Botulinum a toxin and detruzor sphincter dyssynergia: a double-blind lidocaine-controlled study in 13 patients with spinal cord disease. Eur Urol 2002; 42(1): 56–62.
40. Dykstra DD, Sidi AA. Treatment of detruzor-sphincter dyssynergia with botulinum A toxin: a double-blind study. Arch Phys Med Rehabil 1990; 71(1): 24–26.
41. Gallien P, Reymann JM, Amarenco G et al. Placebo controlled, randomised, double blind study of the effects of botulinum A toxin on detruzor sphincter dyssynergia in multiple sclerosis patients. J Neurol Neurosurg Psychiatry 2005; 76(12): 1670–1676.
42. Gallien P, Robineau S, Verin M et al. Treatment of detruzor sphincter dyssynergia by transperineal injection of botulinum toxin. Arch Physical Med Rehabil 1998; 79(6): 715–717.
43. Petit H, Wiart L, Gaujard E et al. Botulinum A toxin treatment for detruzor-sphincter dyssynergia in spinal cord disease. Spinal Cord 1998; 36(2): 91–94.
44. Schurch B, Hauri D, Rodic B et al. Botulinum-A toxin as a treatment of detruzor-sphincter dyssynergia: a prospective study in 24 spinal cord injury patients. J Urol 1996; 155(3): 1023–1029.
45. Schurch B, Hodler J, Rodic B. Botulinum A toxin as a treatment of detruzor-sphincter dyssynergia in patients with spinal cord injury: MRI controlled transperineal injections. J Neurol Neurosurg Psychiatry 1997; 63(4): 474–476.
46. Wheeler JS Jr., Walter JS, Chintam RS et al. Botulinum toxin injections for voiding dysfunction following SCI. J Spinal Cord Med 1998; 21(3): 227–229.
47. Schulte-Baukloh H, Schobert J, Stolze T et al. Efficacy of botulinum-A toxin bladder injections for the treatment of neurogenic detruzor overactivity in multiple sclerosis patients: an objective and subjective analysis. Neurourol Urodyn 2006; 25(2): 110–115.
48. Kuo HC. Botulinum A toxin urethral injection for the treatment of lower urinary tract dysfunction. J Urol 2003; 170(5): 1908–1912.
49. Liao YM, Kuo HC. Causes of failed urethral botulinum toxin A treatment for emptying failure. Urology 2007; 70(4): 763–766.
50. Schulte-Baukloh H, Weiss C, Stolze T et al. Botulinum-A toxin detruzor and sphincter injection in treatment of overactive bladder syndrome: objective outcome and patient satisfaction. Eur Urol 2005; 48(6): 984–990.
51. Ehren I, Volz D, Farrelly E et al. Efficacy and impact of botulinum toxin A on quality of life in patients with neurogenic detruzor overactivity: a randomised, placebo-controlled, double-blind study. Scand J Urol Nephrol 2007; 41(4): 335–340.
52. Giannantoni A, Di Stasi SM, Nardicchi V et al. Botulinum-A toxin injections into the detruzor muscle decrease nerve growth factor bladder tissue levels in patients with neurogenic detruzor overactivity. J Urol 2006; 175(6): 2341–2344.
53. Giannantoni A, Di Stasi SM, Stephen RL et al. Intravesical resiniferatoxin versus botulinum-A toxin injections for neurogenic detruzor overactivity: a prospective randomized study. J Urology 2004; 172(1): 240–243.
54. Kalsi V, Gonzales G, Popat R et al. Botulinum injections for the treatment of bladder symptoms of multiple sclerosis. Ann Neurol 2007; 62(5): 452–457.
55. Kessler TM, Danuser H, Schumacher M et al. Botulinum A toxin injections into the detruzor: an effective treatment in idiopathic and neurogenic detruzor overactivity? Neurourol Urodyn 2005; 24(3): 231–236.
56. Kim JH, Rivas DA, Shenot PJ et al. Intravesical resiniferatoxin for refractory detruzor hyperreflexia: a multicenter, blinded, randomized, placebo-controlled trial. J Spin Cord Med 2003; 26(4): 358–363.
57. Lekka E, Lee LK. Successful treatment with intradetruzor Botulinum-A toxin for urethral urinary leakage (catheter bypassing) in patients with end-staged multiple sclerosis and indwelling suprapubic catheters. Eur Urol 2006; 50(4): 806–809.
58. Apostolidis A, Dasgupta P, Denys P et al. Recommendations on the use of botulinum toxin in the treatment of lower urinary tract disorders and pelvic floor dysfunctions: a European consensus report. Eur Urol 2009; 55(1): 100–119.
59. Fowler CJ, Panicker JN, Drake M et al. A UK consensus on the management of the bladder in multiple sclerosis. J Neurol Neurosurg Psychiatry 2009; 80(5): 470–477.
Štítky
Dětská urologie Urologie
Článek ÚvodníkČlánek Ze zahraničních periodik
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2011 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
-
Všechny články tohoto čísla
- Možnosti a místo chirurgické léčby superficiálního karcinomu močového měchýře
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Ileální neovezika a její varianty
- Karcinom močového měchýře – nejnovější poznatky v oblasti operační a medikamentózní léčby
- Chemoterapie u invazivního a metastatického nádoru močového měchýře
- Metabolické a maligní důsledky augmentace močových cest u dětí
- Role botulotoxinu při léčbě dysfunkce dolních cest močových u pacientů s roztroušenou sklerózou
- Ze zahraničních periodik
- Úvodník
- EAU Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu - aktualizovaná verze z roku 2011
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ileální neovezika a její varianty
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



