-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
Treatment of muscle-invasive and metastatic bladder cancer – update of the EAU Guidelines
Context:
New data regarding treatment of muscle-invasive and metastatic bladder cancer (MiM-BC) has emerged and led to an update of the European Association of Urology (EAU) guidelines for MiM-BC.Objective:
To review the new EAU guidelines for MiM-BC with a specific focus on treatment.Evidence acquisition:
New literature published since the last update of the EAU Guidelines in 2008 was obtained from Medline, the Cochrane Database of Systematic Reviews, and reference lists in publications and review articles and comprehensively screened by a group of urologists, oncologists, and a radiologist appointed by the EAU Guidelines Office. Previous recommendations based on the older literature on this subject were also taken into account. Levels of evidence (LEs) and grades of recommendations (GRs) were added based on a system modified from the Oxford Centre for Evidence-based Medicine Levels of Evidence.Evidence synthesis:
Current data demonstrate that neoadjuvant chemotherapy in conjunction with radical cystectomy (RC) is recommended in certain constellations of MiM-BC. RC remains the basic treatment of choice in localised invasive disease for both sexes. An attempt has been made to define the extent of surgery under standard conditions in both sexes. An orthotopic bladder substitute should be offered to both male and female patients lacking any contraindications, such as no tumour at the level of urethral dissection. In contrast to neoadjuvant chemotherapy, current advice recommends the use of adjuvant chemotherapy only within clinical trials. Multimodality bladder-preserving treatment in localised disease is currently regarded only as an alternative in selected, well-informed, and compliant patients for whom cystectomyis not considered formedical or personal reasons. Inmetastatic disease, the first-line treatment for patients fit enough to sustain cisplatin remains cisplatin-containing combination chemotherapy. With the advent of vinflunine, second-line chemotherapy has become available.Conclusions:
In the treatment of localised invasive bladder cancer (BCa), the standard treatment remains radical surgical removal of the bladder within standard limits, including as-yet-unspecified regional lymph nodes. However, the addition of neoadjuvant chemotherapy must be considered for certain specific patient groups. A new drug for second-line chemotherapy (vinflunine) in metastatic disease has been approved and is recommended.Key words:
bladder cancer, muscle-invasive, chemotherapy, radiation therapy, cystectomy, EAU Guidelines, multidisciplinary management, quality of life
Autoři: A. Stenzl 1; N. C. Cowan 2; M. De Santis 3; M. A. Kuczyk 4; A. S. Merseburger 4; M. J. Ribal 5; A. Sherif 6; J. A. Witjes 7
Působiště autorů: Department of Urology, Eberhard-Karls-University Tuebingen, Hoppe-Seyler-Str. 3, 7 07 Tuebingen, Germany 1; Department of Radiology, The Churchill Hospital, Oxford, United Kingdom 2; 3rd Medical Department and ACR-ITR/CEADDP and LBI-ACR Vienna-CTO, Kaiser Franz Josef Spital, Vienna, Austria 3; Department of Urology and Urologic Oncology, Hannover Medical School (MHH), Hannover, Germany 4; Department of Urology, Hospital Clinic, University of Barcelona, Barcelona, Spain 5; Department of Urology, Karolinska University Hospital, Stockholm, Sweden 6; Department of Urology, Radboud University Nijmegen Medical Centre, Nijmegen, The Netherlands 7
Vyšlo v časopise: Urol List 2011; 9(3): 75-86
Souhrn
Kontext:
Na základě nejnovějších informací v oblasti léčby metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu (MiM-BC) vznikla tato aktualizace stávajících guidelines Evropské urologické asociace (EAU).Cíl:
Hodnocení stávajících EAU Guidelines pro MiM-BC se speciální pozorností věnovanou léčbě tohoto onemocnění.Sběr důkazů:
Panel urologů, onkologů a radiologů (ustanovený EAU Guidelines Office) hodnotil nové publikace uveřejněné od poslední aktualizace EAU Guidelines v roce 2008 v databázích Medline, Cochrane Database of Systematic Reviews a literaturu citovanou v jednotlivých publikacích a přehledových článcích. Autoři rovněž vzali v úvahu starší doporučení stanovená na základě starších publikací. Na základě systému důkazů medicíny založené na důkazech “Oxford Centre for Evidence-based Medicine Levels of Evidence” klasifikovali autoři jednotlivé informace podle úrovní důkazů (LE) a stupňů doporučení (GR).Syntéza důkazů:
Současné údaje prokazují, že za určitých okolností lze pro léčbu MiM-BC doporučit neoadjuvantní chemoterapii v kombinaci s radikální cystektomií (RC). RC nadále zůstává základní léčbou volby lokalizovaného invazivního onemocnění (u pacientů obou pohlaví). Autoři se pokusili definovat nezbytný rozsah operace u pacientů obou pohlaví. Pacientům obou pohlaví by měla být nabídnuta možnost ortotopické substituce neoveziky, pakliže nejsou přítomny žádné kontraindikace v podobě tumoru na hranici preparace močové trubice. Na rozdíl od neoadjuvantní chemoterapie se adjuvantní terapie v současné době doporučuje pouze v rámci klinických studií. Multimodální léčba se zachováním močového měchýře u pacientů s lokalizovaným onemocněním představuje vhodnou alternativu u dobře zvolené, dobře informované populace pacientů, kteří jsou ochotni spolupracovat a kteří nejsou vhodnými kandidáty pro cystektomii (ať z osobních nebo medicínských důvodů). U pacientů s metastazujícím onemocněním, kteří jsou vhodnými kandidáty pro léčbu cisplatinou, představuje léčbu první volby kombinovaná chemoterapie na bázi cisplatiny. Díky zavedení preparátu vinfluninu na trh je k dispozici rovněž chemoterapie druhé volby.Závěr:
Standardní metodou léčby lokalizovaného invazivního karcinomu močového měchýře (BCa) zůstává i nadále radikální chirurgické odstranění močového měchýře podle standardních definic včetně nespecifikovaných regionálních lymfatických uzlin. U konkrétních pacientů je nutné zvážit rovněž indikaci neoadjuvantní chemoterapie. Pro chemoterapii druhé volby u pacientů s metastazujícím onemocněním bylo schváleno a je doporučováno užívání nového preparátu vinfluninu. Skupina odborníků Evropské urologické asociace zabývající se léčbou metastazujícího karcinomu močového měchýře invadujícího močový měchýř (MiM-BC) aktualizovala stávající guidelines pro léčbu MiM-BC. Dostupné důkazy podporují indikaci neoadjuvantní chemoterapie bez ohledu na další typ léčby. Standardní léčbu lokalizovaného karcinomu močového měchýře, jenž invaduje svalovinu, představuje i nadále radikální cystektomie. Byla přesně definována kritéria pro výběr pacientů, operační techniku, pooperační morbiditu a pečlivé sledování po výkonu.Klíčová slova:
karcinom močového měchýře, invadující svalovinu, chemoterapie, radioterapie, cystektomie, EAU Guidelines, multidisciplinární přístup, kvalita života1. ÚVOD
Tento dokument představuje první aktualizaci guidelines pro léčbu metastazujícího karcinomu močového měchýře invadujícího svalovinu (MiM-BC), který vydala EAU (Evropská urologická asociace) v roce 2008. Většina změn se týká chirurgické a medikamentózní léčby onemocnění, a tento přehled se tedy zaměřuje na doporučení pro léčbu MiM-BC.
Cílem EAU Guidelines, na jejichž tvorbě se podílí mezinárodní panel odborníků z nejrůznějších lékařských oborů, je pomoci urologům při léčbě MiM-BC (založené na důkazech) a začlenit doporučení guidelines do běžné klinické praxe. Každá kapitola byla vytvořena na základě důkladného průzkumu literatury týkající se MiM-BC s pomocí externích specialistů. Na základě pečlivého uvážení provedli autoři průzkum následujících databází: Cochrane Database of Systematic Reviews, Cochrane Collaboration's Central Register of Controlled Clinical Trials, Medline a Embase (platforma Dialog DataStar). Pro vyhledávání v jednotlivých databázích byly užity termíny s nejužším možným významem. Jedná se o výrazy neoplazma močového měchýře v MeSH (Medical Subject Headings) v databázi Medline a karcinom močového měchýře v Emtree v databázi Embase.
Členové panelu následně procházeli všechny vygenerované výsledky. V řadě případů bylo vzhledem k vysoké citlivosti vyhledávání nezbytné projít obrovské množství informací. Informace uváděné v těchto guidelines je přirozeně nutné dále průběžně hodnotit. Ačkoli tato aktualizovaná verze guidelines obsahuje informace pro léčbu pacientů na základě standardizovaného přístupu, je třeba zdůraznit, že doporučení stanovená na základě průzkumu literatury nemohou být závazná, neboť v neobvyklých situacích a na základě preferencí individuálních pacientů může být vhodnější nestandardní přístup.
Jednotlivé možnosti léčby MiM-BC a doporučení jsou v tomto dokumentu sjednoceny podle typu onemocnění – lokalizovaného a metastazujícího BCa. Úrovně důkazů (LE) a stupně doporučení (GR) přiřazené jednotlivým terapeutickým modalitám odpovídají kompletní verzi guidelines (viz http://www.uroweb.org/guidelines/ /online-guidelines/) [1].
2. LOKALIZOVANÝ INVAZIVNÍ KARCINOM MOČOVÉHO MĚCHÝŘE
Je definován jako onemocnění s histologicky prokázaným stadiem T ≥ 1 N0 M0.
2.1. Neoadjuvantní chemoterapie
Neoadjuvantní chemoterapie je indikována u pacientů s klinicky operovatelným, uroteliálním karcinomem močového měchýře (UC) invadujícím svalovinu (N0 M0) před provedením plánovaného definitivního radikálního výkonu (nebo radioterapie). Neoadjuvantní chemoterapie nabízí řadu výhod: 1. podává se velmi časně, kdy předpokládáme velmi malý objem mikrometastazujícího onemocnění; 2. potenciální in-vivo chemosenzitivitu; 3. přepokládá se, že pacienti chemoterapii snáší lépe před cystektomií než po ní a 4. hypoteticky, pacienti s mikrometastázami mohou lépe reagovat na neoadjuvantní terapii a mít příznivější patologický stav (na základě negativních lymfatických uzlin a negativních chirurgických okrajů).
Neoadjuvantní chemoterapie však má i své nevýhody: 1. pacienti, u nichž nejsou přítomny mikrometastázy (přibližně polovina z nich má onemocnění ve stadiu N0 M0), tak podstoupí nadbytečnou léčbu; 2. chybné stanovení stadia může hypoteticky vést k indikaci nadbytečné léčby; 3. odložení cystektomie může zhoršit konečný výsledek u pacientů, kteří nereagují na chemoterapii [2–4]; a 4. vedlejší účinky chemoterapie mohou mít dopad na výsledek operační léčby a volbu techniky močové derivace [5].
Randomizovaná studie testující účinek cystektomie po neoadjuvantní chemo-terapii prokázala srovnatelný výskyt poope-račních komplikací 3. a 4. stupně v obou větvích studie. U pacientů podstupujících chemoterapii však byl častější výskyt anémie a neuropatie [5].
Kombinované skandinávské studie NCS1 + NCS2 (n = 620) neprokázaly negativní dopad neoadjuvantní chemoterapie na počet prováděných cystektomií [6].
Vzhledem k 5–8% benefitu v celkové době přežití (OS), jenž popisují nejnovější studie a metaanalýzy, lze u pacientů s nemetastazujícím (N0 M0) karcinomem močového měchýře invadujícím svalovinu s negativními lymfatickými uzlinami zvážit možnost kombinované neoadjuvantní chemoterapie na bázi cisplatiny, bez ohledu na další plánovanou léčbu [6,7] (úroveň důkazu: 1).
PS ≥ 2 a/nebo narušená renální funkce představují kontraindikace pro neoadjuvantní chemoterapii (úroveň důkazu: 1). Obecně lze říci, že při léčbě lokalizovaného, svalovinu invadujícího N0 M0, uroteliálního karcinomu močového měchýře se samotná chemoterapie v rámci primární terapie nedoporučuje [8] (úroveň důkazu: 1). Přehled doporučení pro léčbu je uveden v tab. 1.
Tab. 1. Doporučení pro neoadjuvantní léčbu. 
2.2. Předoperační radioterapie
Několik retrospektivních studií zkoumajících účinek předoperační radioterapie (RT) u pacientů s karcinomem močo-vého měchýře prokázalo snížení stadia u 40–65 % pacientů, zlepšení lokální kontroly u 10–42 % pacientů a zlepšení doby přežití u 11–12 % pacientů. Nejvýznamnější zlepšení lokální kontroly se zdá u tumorů T3b. Patologicky prokázaná úplná remise po RT je pravděpodobně pozitivní prognostický faktor pro dobu přežití.
Role předoperační RT byla zkoumána v randomizovaných studiích [9]. Ačkoli výsledky všech studií nasvědčují tomu, že tato strategie vede ke snížení stadia tumoru a zlepšení doby přežití – zejména u tumorů ≥ pT3 – a lepším výsledkům u pacientů, kteří vykazují lepší odpověď při patologickém hodnocení a nízkou toxicitu neoadjuvantní RT, všechny studie mají řadu nedostatků v podobě absence dokumentace účinku na lokální recidivu. Metaanalýza studií prokázala OR pro rozdíl v době přežití po dobu pěti let: 0,71 (95% CI, 0,48–1,06). Tato metaanalýza však mohla být potenciálně zkreslena výsledky největší studie, v níž pacienti nepodstoupili plánovanou léčbu. Po vyloučení výsledků největší studie činil OR 0,95 (95% CI, 0,57–1,55), což ukazuje, že zlepšení doby přežití díky RT nebylo prokázáno [9].
Ačkoli novější studie dospěly k podobným závěrům, výsledky mají bohužel stejné nedostatky [10]. Tab. 2 uvádí souhrn závěrů a doporučení pro předoperační léčbu.
Tab. 2. Předoperační radioterapie: závěry a doporučení. 
2.3. Cystektomie a derivace moči
Efekt úplného odstranění močového měchýře (a odpovídajících lymfatických uzlin) a strategie se zachováním orgánu doposud nebyly srovnávány v žádné randomizované studii. V současné době však probíhají pokusy o hodnocení multimodální léčby v prospektivních randomizovaných studiích [11]. Radikální cystektomie (RC) zůstává i nadále léčbou volby u pacientů s pokročilým, lokalizovaným uroteliálním karcinomem [12] (úroveň důkazu: 2a).
2.3.1. Standardní operační technika
Pro kurativní léčbu mužů pomocí RC byly v uplynulých dvou desetiletích definovány standardní chirurgické limity, které zahrnují následující: kompletní odstranění močového měchýře včetně všech makroskopicky viditelných a resekovatelných rozšíření, jež perforují močový měchýř, odstranění přilehlých distálních močovodů a odstranění odpovídajících lymfatických uzlin. Nejrůznější modifikace této standardní techniky mohou přispívat ke zlepšení kvality života pacienta (QoL). Jsou to např. zachování 1. přední a membranózní části močové trubice včetně rabdosfinkteru, což umožní později konstrukci ortotopické neoveziky, 2. části prostatických a semenných duktů s cílem zachovat fertilitu, potenci a kontinenci a 3. pánevních autonomních a senzorických nervů pro podporu potence a kontinence. Tyto modifikace je však nutné pečlivě uvážit v kontextu s potenciálním zvýšením onkologického rizika [13] (úroveň důkazu: 3).
Zachování částí prostatické žlázy během resekce je spojeno s 23–54% rizikem vzniku adenokarcinomů, z nichž až 29 % může být klinicky významných a může vést ke vzniku lokální recidivy nebo dokonce metastáz [14–16]. Vzhledem k tomu, že uroteliální karcinom může být lokalizován i v prostatě, uvádí některé studie, že pouze u 26–33 % pacientů podstupujících cystoprostatektomii nebyl přítomen ani karcinom prostaty ani uroteliální karcinom v prostatě [17]. Nejnovější technická modifikace vytvořená s cílem zachování okolních autonomních nervů umožňuje zachovat semenné váčky (s prostatickou kapsulou nebo bez ní). Poměr potence a onkologického rizika v malých studiích (u vybrané populace) je povzbudivý, tuto strategii je však nutné prokázat ve větších studiích a v dlouhodobějším horizontu [18,19].
Standardní anteriorní pánevní exenterace u žen zahrnuje resekci močového měchýře, celé močové trubice, přilehlé vaginy, dělohy, distálních močovodů a odpovídajících lymfatických uzlin (úroveň důkazu: 3, stupeň doporučení: C). Pakliže není primární tumor lokalizován v hrdle močového měchýře nebo v močové trubici, je možné zachovat větší část funkční močové trubice a (v případě, že je možné provést kompletní resekci tumoru) jejího autonomního nervového zásobení pro případnou konstrukci ortotopické neoveziky [13,20] (úroveň důkazu: 3). Nové údaje rovněž zpochybňují potřebu odstranění dělohy nebo jakékoli části vaginy ve prospěch zlepšení anatomické podpory neoveziky a lepšího zachování okolních autonomních nervů.
Doposud nebyla definována (u obou pohlaví) adekvátní délka segmentu distálního močovodu, který je nutné odstranit spolu s močovým měchýřem. Délka resekovaného segmentu závisí na onkologických parametrech (např. rozšíření tumoru, přítomnost carcinoma in situ, typ derivace). V nedávné době provedená studie uvádí, že biopsie „nazmrzlo“ okrajů distální části močové trubice dosahuje 74% senzitivity a 99,8% specifity, celková přesnost vyšetření tedy činila 98,3 % [21]. Pomocí strategie opakovaných odběrů vzorků lze původně pozitivní ureterální okraje proměnit na negativní. Tito pacienti mají nižší riziko vzniku recidivujícího onemocnění horních cest močových [22,23].
Všechny v současné době dostupné důkazy jednohlasně podporují současné odstranění pánevních lymfatických uzlin spolu s tumorem lokalizovaným v močovém měchýři (úroveň důkazu: 3). Retrospektivní studie prokazují, že rozšířená lymfadenektomie může u pacientů s karcinomem močového měchýře invadujícím svalovinu zlepšovat dobu přežití. Skutečná kurativní hodnota lymfadenektomie však nebyla dosud stanovena a v budoucnu je nezbytné tento výkon standardizovat [7,24].
Několik studií zaměřených na lymfadenektomii (retrospektivního i prospektivního designu) prokázalo [24–27], že u pacientů s karcinomem močového měchýře se nádorem zasažené lymfatické uzliny nenacházejí mimo pánev, pakliže v pánevních lymfatických uzlinách nejsou známky tumoru [28] (úroveň důkazu: 3). Dále může existovat souvislost mezi délkou přežití bez progrese a OS a počtem lymfatických uzlin odstraněných během operace [24,25].
Další možností je laparoskopická a roboticky asistovaná RC [29]. Minimálně invazivní techniky by měly být vyhrazeny pouze pro operatéry se zkušenostmi s těmito technikami vzhledem k riziku vzniku předpojaté chyby při výběru pacientů (celkový zdravotní stav pacienta, stadium tumoru, typ močové derivace) a vzhledem k významně menšímu počtu studií zabývajících se touto technikou (ve srovnání s otevřenou cystektomií) [30].
Laparoskopická derivace moči vytvořená intrakorporálně s robotickou asistencí i bez ní byla dosud testována pouze v malých studiích [29,31]. Se v současné době dostupným vybavením se jedná o technicky náročnou a zdlouhavou proceduru, kterou je třeba prozatím považovat za experimentální. Další možností volby je laparoskopická cystektomie a pánevní lymfadenektomie (s robotickou asistencí nebo bez ní), s derivací vytvořenou extrakorporálně (úroveň důkazu: 3).
2.3.2. Derivace moči po radikální cystektomii
Z anatomického hlediska lze v současné době po cystektomii provádět tři typy močové derivace: abdominální, uretrální a rektosigmoidní. V případě abdominální nebo rektosigmoidní derivace lze močovody derivovat buď přímo (ureterokutaneostomie nebo ureterorektosigmoidostomie) nebo vložením střevního segmentu, např. žaludku, ilea, kolon nebo apendixu [32]. Nejčastější formu abdominální derivace (na základě velkých studií) představuje ureteroileokutaneostomie a konstrukce ileálního konduitu podle Brickera [12].
V nedávné době provedená retrospektivní studie s krátkou nebo středně dlouhou dobou sledování 16 měsíců prokázala u pacientů s ureterokutaneostomií významně nižší míru výskytu komplikací souvisejících s derivací než u pacientů, u nichž byl rezervoár vytvořen ze segmentu ilea nebo kolon [33]. Navzdory omezeným údajům komparativních studií je třeba uvážit, že starší údaje uvádí častější vznik striktury v kůži a vzestupné infekce močových cest ve srovnání s ileálním konduitem. Retrospektivní studie srovnávající různé formy derivace moči s užitím střevního segmentu prokázala, že ileální konduit je spojen s menším výskytem pozdních komplikací než kontinentní abdominální rezervoár nebo ortotopická neovezika [34].
Několik studií srovnává různé aspekty kvality života (spojené se zdravotním stavem), jako jsou např. sexuální funkce, močová kontinence a sebevědomí u populace pacientů, kteří podstoupili různé formy derivace moči. Tato problematika však vyžaduje další výzkum. Není možné hodnotit aspekty QoL různých forem močové derivace bez přihlédnutí k faktorům, jako jsou předoperační stadium tumoru, věk a očekávání pacienta, socioekonomické faktory, zkušenost urologa a potenciální operační komplikace. V současné době nelze doporučit jeden konkrétní typ močové derivace. Lze však říci, že ureterokutaneostomie představuje z chirurgického hlediska nejmenší zátěž pro pacienta (úroveň důkazu: 3).
Pacienta, který podstupuje jakoukoli formu močové derivace, je třeba naučit zvládat tuto situaci a osvojit si manuální zručnost nezbytnou pro obsluhu rezervoáru. Omezující neurologické a psychiatrické choroby, krátká očekávaná délka života, narušená funkce jater či ledvin a uroteliální karcinom lokalizovaný na okraji močové trubice nebo jiném chirurgickém okraji představují kontraindikace pro složitější formy močové derivace s užitím střevního segmentu (úroveň důkazu: 2b). Relativní kontraindikace, které platí pouze pro konstrukci ortotopické neoveziky, zahrnují předoperační radio-terapii o vyšším dávkování, závažnou uretrální strikturu a závažnou uretrální inkontinenci [35–38] (úroveň důkazu: 2b).
Neexistují žádné konkrétní důkazy, které by prokazovaly, že věk pacienta představuje kontraindikaci pro jakoukoli formu močové derivace. U většiny pacientů starších 75 let se však po cystektomii vzhledem k většímu počtu morbidit a horšímu zdravotnímu stavu upřednostňuje derivace s konstrukcí inkontinentního rezervoáru [39].
Standardní RC u mužů s neoplazmatem v močovém měchýři spočívá v odstranění celého močového měchýře, prostaty, semenných váčků, distálních močovodů (délka segmentu nebyla definována) a odpovídajících lymfatických uzlin (rozsah nedefinován; úroveň důkazu: 2b). V současné době nelze doporučit jediný konkrétní typ derivace moči. Většina center však upřednostňuje konstrukci ileální ortotopické neoveziky a ileálního konduitu (v závislosti na klinických zkušenostech) [12,36]. U vybrané populace představuje nejméně zatěžující formu derivace ureterokutaneostomie (úroveň důkazu: 3; stupeň doporučení: C). Doporučení týkající se RC a derivace moči jsou uvedena v tab. 3.
Tab. 3. Závěry a doporučení týkající se radikální cystektomie a derivace moči. 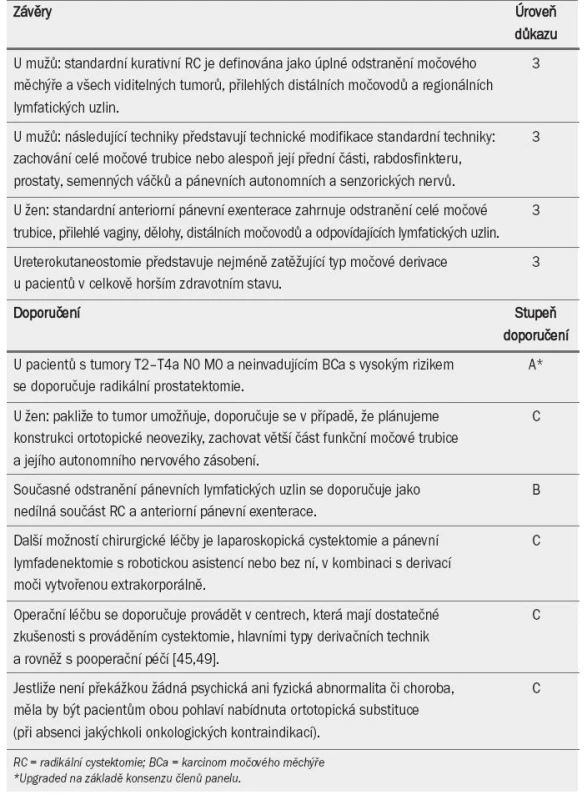
2.3.3. Onkologické výsledky operační léčby
U pacientů obou pohlaví se uvádí 66–68% doba přežití bez recidivy (RFS), 58–66% OS po pěti letech, 60–73% RFS a 43–49% OS po deseti letech [8]. U pacientů s pozitivními lymfatickými uzlinami klesá doba přežití specifická pro onemocnění po deseti letech na 27,7 % a OS na 20,9 % [40]. Ve velkých studiích testujících techniky se zachováním močového měchýře (u onemocnění odpovídajícího stadia) nebylo doposud těchto výsledků dosaženo (tab. 4).
Tab. 4. Největší studie (z jediného centra) zkoumající míru přežití bez recidivy u pacientů po cystektomii [38,43,44]. ![Největší studie (z jediného centra) zkoumající míru přežití bez recidivy u pacientů po cystektomii [38,43,44].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5db8d4932e9ac57fb689499472394b62.jpeg)
Byly vytvořeny nomogramy pro CSS (doba přežití specifická pro karcinom) po RC, které byly validovány externími experty, jejich širší užívání však nelze před ověřením v dalších studiích doporučit [41,42]. Retrospektivní studie Steina et al zahrnující 768 pacientů [37] uvádí 6% míru recidivy bez ohledu na typ zvolené močové derivace. Multivariátní statistická analýza prokázala, že zasažení prostatické žlázy primárním tumorem a kutánní derivace moči nezávisle souvisí s vyšším rizikem vzniku druhého primárního tumoru (úroveň důkazu: 2b). Bylo spočteno, že pacienti s ortotopickým rezervoárem mají 5% riziko, že u nich dojde ke vzniku druhého primárního tumoru, a pacienti s kutánním rezervoárem mají toto riziko 9 %. U povrchových (12 vs 5 %) i invazivních uroteliálních karcinomů (18 vs 5 %) byl zaznamenán rozdíl ve výskytu druhých primárních nádorů v závislosti na počátečním zasažení prostatické žlázy tumorem.
U pacientů starších 80 let je cystektomie spojena s největším snížením rizika úmrtí (v důsledku onemocnění i na jiné příčiny) [45]. Největší dosud provedená retrospektivní studie zabývající se cystektomií (z jediného centra) prokázala u pacientů starších 80 let vyšší míru pooperační morbidity, ale nikoli mortality [45] (úroveň důkazu: 3).
U pacientů s lokálně pokročilým karcinomem v pánvi, který zasahuje močový měchýř, může být přítomnost zbytkového onemocnění nevyhnutelná. V těchto případech se však paliativní RC a močová derivace (s užitím střevního segmentu nebo bez něj) provádí pouze s cílem zmírnit symptomy, jako jsou bolest, recidivující krvácení, urgence a tvorba píštělí. Morbiditu související s operační léčbou a QoL je třeba uvážit v kontextu s ostatními modalitami (úroveň důkazu: 3) [45–47].
V tab. 5 je uveden přehled doporučení týkajících se onkologických výsledků operační léčby.
Tab. 5. Doporučení týkající se onkologických výsledků operační léčby. 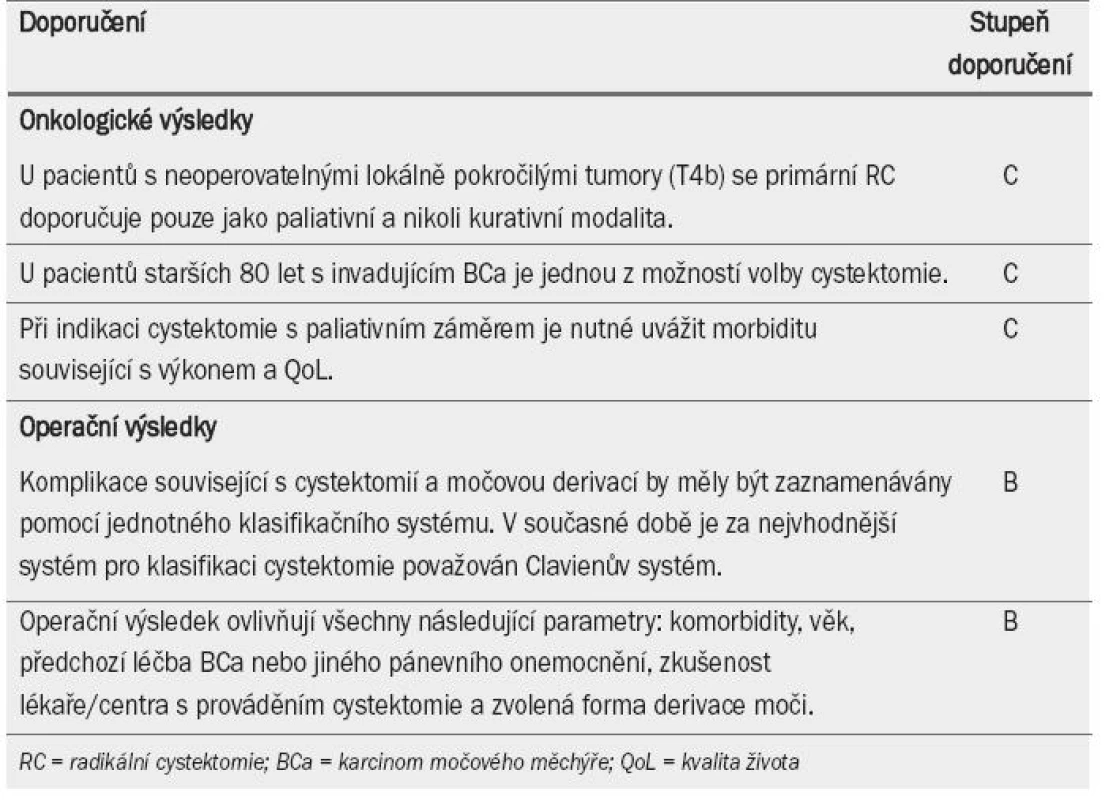
2.3.4. Výsledky radikální cystektomie
Většina operačních komplikací souvisí s močovou derivací, značné procento komplikací je zapříčiněno užíváním střevního segmentu [35,38]. Typ, míru a závažnost operačních komplikací rovněž ovlivňují faktory, jako je zručnost lékaře, zkušenost daného centra s tímto typem operace a zvolená forma derivace moči (tab. 5) [45,48,49].
Při zaznamenávání operačních komplikací při cystektomii by se měla užívat, bez ohledu na zvolenou techniku, standardizovaná a reprodukovatelná klasifikace. V nedávné době byly komplikace vyskytující se při nejrůznějších urologických výkonech (včetně otevřené [50] a laparoskopické cystektomie [51]) klasifikovány pomocí modifikovaného pětistupňového Clavienova systému (studie zahrnovala více než 6 300 výkonů) [52]. Další možností pro klasifikaci komplikací je systém „Common Terminology Criteria for Adverse Events“ [53]. Časné komplikace jsou definovány jako komplikace, k nimž dojde během 90 dnů po výkonu, a pozdní komplikace analogicky po uplynutí 90 dnů po výkonu [50,54]. Nejnovější studie zabývající se cystektomií uvádí výskyt vedlejších účinků u 54–58 % pacientů [50,53,55].
2.4. Operace se zachováním močového měchýře u pacientů s lokalizovaným onemocněním
2.4.1. Definitivní ozařování zevním paprskem
Obvykle je ozařován pouze močový měchýř s bezpečnostním okrajem 1,5–2 cm. Při kurativní radioterapii při léčbě BCa se aplikuje cílová dávka 60–66 Gy. Při užití moderních ozařovacích technik se závažné pozdní gastrointestinální nebo genitourinární komplikace vyskytují u méně než 5 % pacientů. Celková míra přežití po pět let se pohybuje v rozmezí 30–60 %, míra CSS v rozmezí 20–50 % [56–58]. V nedávné době provedená italská studie (z jediného centra) hodnotí prognostické faktory RT. Studie zahrnovala 459 pacientů nezpůsobilých podstoupit operaci, kteří podstoupili ozařování (přibližně 30 % s karcinomem T1), průměrně po 4,4 letech sledování. Multivariátní analýza prokázala následující významné faktory: věk, kategorie T (pro všechny cílové parametry) a dávka (pouze pro dobu přežití bez recidivy) [59]. Cochranova analýza (na základě dostupných studií) prokázala, že RC poskytuje oproti RT benefit v celkové době přežití [60]. U pacientů, kteří však nejsou vhodnými kandidáty pro radikální operaci, může být vhodnou alternativou ozařování zevním parskem (EBRT). Tato modalita dosahuje po třech měsících kompletní remise (prokázáno pomocí cystoskopie) u 78 % pacientů a lokální kontroly po třech letech u 56 % pacientů [61] (tab. 6). V nedávné době provedená studie (z jediného centra), která zkoumala výskyt časných komplikací (do 90. dne) RC po RT s normální dávkou, prokázala na základě Clavienova systému vyšší míru komplikací u ozařovaných (148) pacientů než u pacientů, kteří nebyli ozářeni (2 480) [62].
Tab. 6. Léčba lokalizovaného onemocnění se zachováním močového měchýře. 
2.4.2. Chemoterapie
Samotná chemoterapie dosahuje při léčbě primárního tumoru pouze výjimečně trvalé a kompletní odpovědi (CR). Obecně platí, že 56% míru CR (jež uvádějí některé studie), je třeba zvážit oproti více než 60% riziku stanovení chybného stadia [5,8]. Odpověď na chemoterapii představuje prognostický faktor pro výsledek léčby a dobu přežití [2], ačkoli v některých případech může být ovlivněna výběrem pacientů. Několik výzkumných skupin popisuje účinek chemoterapie na resekovatelné tumory (neoadjuvantní přístup) i neresekovatelné primární tumory [4,63,64]. Dva až tři cykly chemoterapie s aplikací M-VAC (metotrexát, vinblastin, adriamycin a cisplatina) nebo GC (gemcitabin a cisplatina) umožní nejen snížení stadia primárního tumoru, ale rovněž dosažení patologické CR primárního karcinomu močového měchýře následujícím způsobem: u 12–50 % pacientů po M-VAC a u 12–22 % po GC (výsledky studie II. a III. fáze) [4,63,65].
Nejnovější studie testující aplikaci GC před radikální cystektomií uvádí horší míru výskytu pT0, což může souviset s nízkou denzitou dávky a nevhodným oddalováním operace [66]. Úspěšnost výkonu se zachováním močového měchýře se hodnotí pouze pomocí cystoskopie a počítačové tomografie a pečlivého sledování pacienta. Při tomto přístupu může být snadno stanoveno chybné stadium, což pacienta vystavuje riziku vzniku lokální recidivy a/nebo metastazujícího onemocnění. U velmi pečlivě vybrané populace pacientů může transuretrální resekce se zachováním močového měchýře v kombinaci se systémovou chemoterapií na bázi cisplatiny (pokud možno s aplikací M-VAC) zajistit dlouhou dobu přežití s intaktním močovým měchýřem [11]. Tento přístup však nelze běžně doporučit.
3. METASTAZUJÍCÍ KARCINOM MOČOVÉHO MĚCHÝŘE
Pokročilý BCa je chemosenzitivní tumor. Míra odpovědi se liší v závislosti na individuálních faktorech a stadiu onemocnění před zahájením léčby. Byly definovány prognostické faktory pro odpověď na léčbu a dobu přežití [67–71]. Za hlavní prognostický faktor lze považovat skutečnost, zda je pacient vhodným kandidátem pro kombinovanou chemoterapii na bázi cisplatiny. Cisplatina nadále zůstává nejúčinnějším preparátem (v rámci mono-terapie) pro léčbu uroteliálního karcinomu.
Překážkou v užívání cisplatiny v jakékoli dávce mohou být následující faktory: věk, obstrukce způsobená tumorem, chronický zánět horních cest močových, metabolické změny v důsledku užití střevního segmentu po cystektomii, celkový zdravotní stav a/nebo špatná renální funkce. Pro účely indikace kombinované chemoterapie na bázi cisplatiny jsou pacienti klasifikováni jako „vhodní“, nebo „nevhodní“ [72] (tab. 7).
Tab. 7. Léčba metastazujícího karcinomu močového měchýře pomocí chemoterapie. 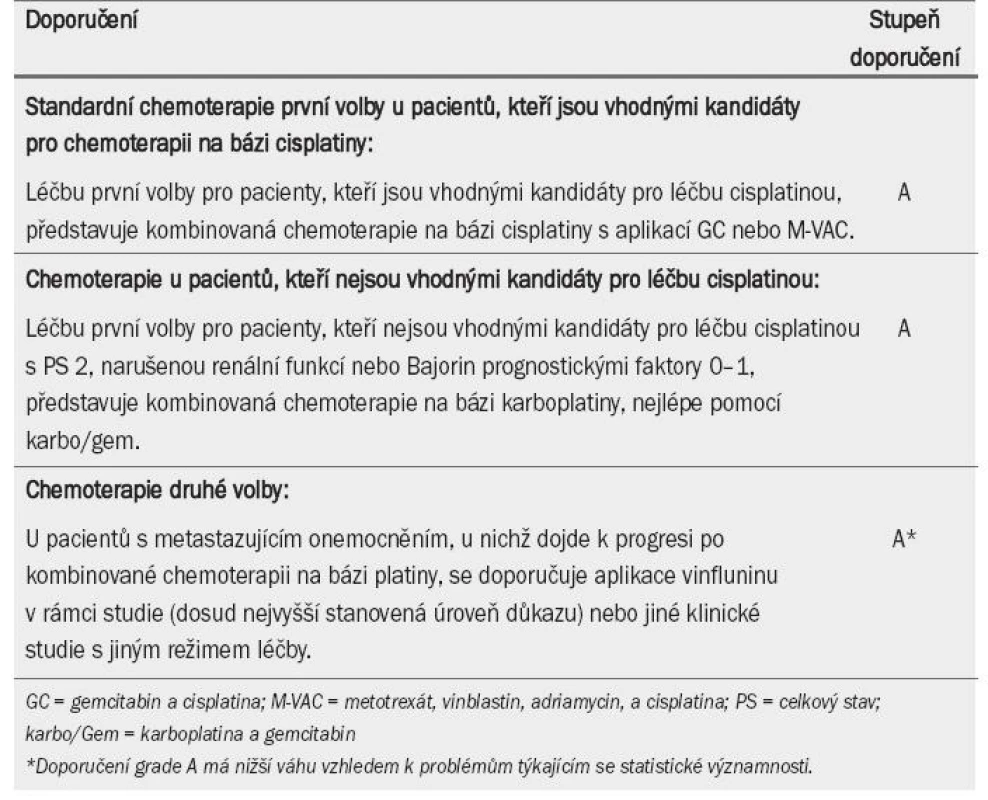
3.1. Standardní chemoterapie první volby u pacientů, kteří jsou vhodnými kandidáty pro léčbu chemoterapií
Při užívání M-VAC byl zaznamenán benefit v době přežití až do 14,8 měsíců a při užívání GC až do 13,8 měsíců, a to i při dlouhodobém sledování [73–76]. Aplikace GC se však díky nižšímu výskytu toxicity začíná stávat novým standardem léčby [75].
Ačkoli bylo prokázáno, že kombinovaná chemoterapie na bázi cisplatiny je účinná při léčbě onemocnění ve všech lokalizacích, nejvíce studií uvádí účinek na lymfatické uzliny. Při léčbě retroperitoneálních lymfatických uzlin pomocí M-VAC byla zaznamenána 66% míra odpovědi, pomocí (HD)–M-VAC o vysoké dávce 77% míra odpovědi, mimo lymfatické uzliny 29% míra při aplikaci M-VAC a při aplikaci (HD)–M--VAC 33% míra odpovědi [78].
Lokalizace onemocnění rovněž ovlivňuje dlouhodobé přežití. Po pěti letech přežívá 20,9 % pacientů s onemocněním postihujícím pouze lymfatické uzliny, zatímco pouze 6,8 % pacientů s metastázami do viscerálních orgánů [76]. Nebylo prokázáno, že by intenzivnější terapie (nové kombinace tří preparátů, protokoly s vyšší denzitou dávky, cílené terapie) dosahovaly lepšího účinku než aplikace GC nebo M-VAC. Tyto terapie jsou stále ve fázi výzkumu [79–80]. Doporučení pro chemoterapii první volby pro pacienty (kteří jsou vhodnými kandidáty pro léčbu pomocí cisplatiny) zahrnuje nadále kombinovanou terapii na bázi cisplatiny s aplikací GC nebo M-VAC, pokud možno GSCF nebo HD-M-VAC s GCSF (tab. 7).
3.2. Chemoterapie u pacientů, kteří nejsou vhodnými kandidáty pro léčbu cisplatinou
Až 50 % pacientů není vhodnými kandidáty pro chemoterapii na bázi cisplatiny buď z důvodu špatného PS a/nebo špatné renální funkce, nebo z důvodu přítomnosti komorbidit zabraňujícím možnosti zvýšené hydratace. První randomizovanou studii 2/3 fáze uskutečnila European Organisation for Research and Treatment of Cancer, která srovnává účinek kombinace metotrexátu, karboplatiny a vinblastinu (M-CAVI) a karboplatiny s gemcitabinem (karbo/Gem) u pacientů, kteří nejsou vhodnými kandidáty pro léčbu cisplatinou. Oba protokoly byly aktivní. Závažná akutní toxicita (SAT) byla zaznamenána u 13,6 % pacientů léčených pomocí karbo/Gem vs u 23 % pacientů léčených pomocí M-CAVI. Míra celkové odpovědi činila 42 % u pacientů léčených pomocí karbo/Gem a 30 % u pacientů léčených pomocí M-CAVI. Další analýza prokázala, že kombinovaná chemo-terapie poskytuje u pacientů s PS2 a narušenou renální funkcí pouze malý benefit [81]. U pacientů léčených pomocí karbo/Gem činila celková míra odpovědi 26 % a SAT rovněž 26 %, u pacientů léčených pomocí M-CAVI činila celková míra odpovědi 20 % a SAT 24 %. Nejnovější studie III. fáze tyto výsledky potvrzuje.
3.3. Chemoterapie druhé volby
Údaje týkající se chemoterapie druhé volby za těchto okolností jsou velmi rozdílné. Vinflunin je nový vinka-alkaloid třetí generace, při jehož aplikaci byla prokázána 18% míra objektivní odpovědi a 67% kontrola onemocnění [82]. V nedávné době byla publikována randomizovaná studie III. fáze testující účinnost vinfluninu a BSC (nejlepší podpůrné péče) a samotné BSC u pacientů s metastazujícím onemocněním, u nichž došlo k progresi po kombinované chemoterapii na bázi platiny [83]. Výsledky prokazují pouze skromný účinek (celková míra odpovědi: 8,6 %), klinický benefit s příznivým bezpečnostním profilem, a – co je nejvýznamnější – benefit v době přežití při aplikaci vinfluninu, který byl statisticky významný ve vhodné populaci pacientů (nikoli v populaci „intention--to-treat“). Co se týče terapie druhé volby, dostáhla studie v těchto klinických okolnostech nejvyšší doposud zaznamenané úrovně důkazů. V současné době byl jako jediný preparát pro léčbu druhé volby schválen vinflunin; všechny ostatní modality by měly být testovány pouze v rámci klinických studií (tab. 7).
3.4. Biomarkery
Poměrně nízká míra kontroly karcinomu, ovšem (sporadická) pozoruhodná odpověď u některých pacientů s uroteliálním BCa podnítila výzkum role biomarkerů při hodnocení prognózy po operační léčbě a jejich role jako indikátoru pro indikaci chemoterapie nebo monitorování. Většina biomarkerů souvisí s angiogenezí tumoru. Malé (obvykle retrospektivní) studie zkoumají denzitu cév na mikrovaskulární úrovni, změnu exprese p53 [84], růstový faktor SVEGF [85], močový a tkáňový fibroblastový růstový faktor (bFGF) [86], močový (divoký a mutantní) a tkáňový FGF receptor-3 [87] a v poslední době rovněž thrombospondin-1 [88], detekci cirkulujících karcinomatózních buněk [89] a expresi genu ve vztahu k rezistenci na různé preparáty [90]. Ačkoli u některých biomarkerů byl prokázán potenciální užitek, u žádného z nich nemáme doposud k dispozici dostatečné množství důkazů pro podporu jejich užívání v klinické praxi (úroveň důkazu: 3) (tab. 8).
Tab. 8. Doporučení pro užívání biomarkerů. 
3.5. Bisfosfonáty
U pacientů s pokročilým/metastazujícím uroteliálním karcinomem se uvádí prevalence metastáz do skeletu (MBD) 30–40 % [70]. Komplikace (spojené se skeletem) v důsledku MBD mají zničující dopad na kvalitu života pacienta, zhoršují bolestivost a rovněž zvyšují mortalitu. Užívání bisfofonátů snižuje a oddaluje výskyt nepříznivých příhod souvisejících se skeletem (SRE) v důsledku kostních metastáz. Jejich účinek spočívá v inhibici absorpce kostí. Aplikaci bisfofonátů se tedy doporučuje zvážit u všech pacientů s MBD bez ohledu na typ karcinomu [91] (tab. 9).
Tab. 9. Doporučení pro podpůrnou terapii. 
Benefit aplikace kyseliny zoledronové při léčbě kostních metastáz u pacientů s uroteliálním karcinomem doposud potvrdila pouze jediná randomizovaná, placebem kontrolovaná studie III. fáze. U těchto pacientů byl zaznamenán nižší výskyt SRE a zlepšení QoL a OS po jednom roce. Kyselina zoledronová představuje jediný typ bisfosfonátu, který byl zkoumán ve studiích [92] a [93] a schválen pro léčbu MBD u všech typů tumoru (úroveň důkazu: 2). Pacienti léčení pomocí bisfosfonátů by měli současně užívat kalcium a vitamin D. Dávkování je třeba stanovit na základě příslušných doporučení a modifikovat podle zdravotního stavu pacienta.
Autoři děkují za příspěvek Prof. Dr. Gerhardu Jakse (urolog) a Prof. Dr. Ferranu Algabovi (urologický patolog) při revizi částí tohoto dokumentu.
A. Stenzl1
N. C. Cowan2
M. De Santis3
M. A. Kuczyk4
A. S. Merseburger4
M. J. Ribal5
A. Sherif6
J. A. Witjes7
1Department of Urology, Eberhard-Karls-University Tuebingen, Hoppe-Seyler-Str. 3, 72076 Tuebingen, Germany
2Department of Radiology, The Churchill Hospital, Oxford, United Kingdom
33rd Medical Department and ACR-ITR/CEADDP and LBI-ACR Vienna-CTO, Kaiser Franz Josef Spital, Vienna, Austria
4Department of Urology and Urologic Oncology, Hannover Medical School (MHH), Hannover, Germany
5Department of Urology, Hospital Clinic, University of Barcelona, Barcelona, Spain
6Department of Urology, Karolinska University Hospital, Stockholm, Sweden
7Department of Urology, Radboud University Nijmegen Medical Centre, Nijmegen, The Netherlands
Zdroje
1. Oxford Centre for Evidence-based Medicine – levels of evidence (March 2009). Centre for Evidence-based Medicine Web site. http://www.cebm.net/index. aspx?o=1025. Updated March 2009.
2. Sternberg CN, Pansadoro V, Calabro F et al. Can patient selection for bladder preservation be based on response to chemotherapy? Cancer 2003; 97(7): 1644–1652.
3. Sanchez-Ortiz RF, Huang WC, Mick R et al. An interval longer than 12 weeks between the diagnosis of muscle invasion and cystectomy is associated with worse outcome in bladder carcinoma. J Urol 2003; 169(1): 110–115.
4. Stein JP. Contemporary concepts of radical cystectomy and the treatment of bladder cancer. J Urol 2003; 169(1): 116–117.
5. Grossman HB, Natale RB, Tangen CM et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med 2003; 349(9): 859–866.
6. Sherif A, Holmberg L, Rintala E et al. Neoadjuvant cisplatinum based combination chemotherapy in patients with invasive bladder cancer: a combined analysis of two Nordic studies. Eur Urol 2004; 45(3): 297–303.
7. Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Adjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis of individual patient data. Eur Urol 2005; 48(2): 189–201.
8. Herr HW, Bajorin DF, Scher HI. Neoadjuvant chemotherapy and bladder-sparing surgery for invasive bladder cancer: ten-year outcome. J Clin Oncol 1998; 16(4): 1298–1301.
9. Widmark A, Flodgren P, Damber JE et al. A systematic overview of radiation therapy effects in urinary bladder cancer. Acta Oncol 2003; 42(5–6): 567–581.
10. Granfors T, Tomic R, Ljungberg B. Downstaging and survival benefits of neoadjuvant radiotherapy before cystectomy for patients with invasive bladder carcinoma. Scand J Urol Nephrol 2009; 43(4): 293–299.
11. Rödel C, Weiss C, Sauder R. Trimodality treatment and selective organ preservation for bladder cancer. J Clin Oncol 2006; 24(35): 5536–5544.
12. Hautmann RE, Abol-Enein H, Hafez K et al. Urinary diversion, WHO Consensus Conference on Bladder Cancer. Urology 2007; 69 (Suppl 1): 17–49.
13. Stenzl A, Nagele U, Kuczyk M et al. Cystectomy – technical considerations in male and female patients. EAU Update Series 2005; 3 : 138–146.
14. Abdelhady M, Abusamra A, Pautler SE et al. Clinically significant prostate cancer found incidentally in radical cystoprostatectomy specimens. BJU Int 2007; 99(2): 326–329.
15. Pettus JA, Al-Ahmadie H, Barocas DA et al. Risk assessment of prostatic pathology in patients undergoing radical cystoprostatectomy. Eur Urol 2008; 53(2): 370–375.
16. Weizer AZ, Shah RB, Lee CT et al. Evaluation of the prostate peripheral zone/capsule in patients undergoing radical cystoprostatectomy: defining risk with prostate capsule sparing cystectomy. Urol Oncol 2007; 25(6): 460–464.
17. Gakis G, Schilling D, Bedke J et al. Incidental prostate cancer at radical cystoprostatectomy: implications for apex-sparing surgery. BJU Int 2010; 105(4): 468–471.
18. Ong CH, Schmitt M, Thalmann GN et al. Individualized seminal vesicle sparing cystoprostatectomy combined with ileal orthotopic bladder substitution achieves good functional results. J Urol 2010; 183(4): 1337–1341.
19. Colombo R, Hautmann RE. Open to debate. The motion: seminal-nerve sparing radical cystectomy is an efficacious and safe treatment for selected bladder cancer patients. Eur Urol 2008; 53(1): 203–207.
20. Stenzl A, Colleselli K, Poisel S et al. Rationale and technique of nerve sparing radical cystectomy before an orthotopic neobladder procedure in women. J Urol 1995; 154(6): 2044–2049.
21. Gakis G, Schilling D, Perner S et al. Sequential resection of malignant ureteral margins at radical cystectomy: a critical assessment of the value of frozen section analysis. World J Urol 2011; 29(4): 451–456.
22. Tollefson MK, Blute ML, Farmer SA et al. Significance of distal ureteral margin at radical cystectomy for urothelial carcinoma. J Urol 2010; 183(1): 81–86.
23. Schumacher MC, Scholz M, Weise ES et al. Is there an indication for frozen section examination of the ureteral margins during cystectomy for transitional cell carcinoma of the bladder? J Urol 2006; 176 (6 Pt 1): 2409–2413.
24. Herr HW, Bochner BH, Dalbagni G et al. Impact of the number of lymph nodes retrieved on outcome in patients with muscle invasive bladder cancer. J Urol 2002; 167(3): 1295–1298.
25. Leissner J, Hohenfellner R, Thuroff JW et al. Lymphadenectomy in patients with transitional cell carcinoma of the urinary bladder; significance for staging and prognosis. BJU Int 2000; 85(7): 817–823.
26. Poulsen AL, Horn T, Steven K. Radical cystectomy: extending the limits of pelvic lymph node dissection improves survival for patients with bladder cancer confined to the bladder wall. J Urol 1998; 160 (6 Pt 1): 2015–2019.
27. Ghoneim MA, Abol-Enein H. Lymphadenectomy with cystectomy: is it necessary and what is its extent? Eur Urol 2004; 46(4): 457–461.
28. Roth B, Wissmeyer MP, Zehnder P et al. A new multimodality technique accurately maps the primary lymphatic landing sites of the bladder. Eur Urol 2010; 57(2): 205–211.
29. Pruthi RS, Nix J, McRackan D et al. Robotic-assisted laparoscopic intracorporeal urinary diversion. Eur Urol 2010; 57(6): 1013–1021.
30. Hautmann RE. The oncologic results of laparoscopic radical cystectomy are not (yet) equivalent to open cystectomy. Curr Opin Urol 2009; 19(5): 522–526.
31. Haber GP, Crouzet S, Gill IS. Laparoscopic and robotic assisted radical cystectomy for bladder cancer: a critical analysis. Eur Urol 2008; 54(1): 54–64.
32. Gakis G, Stenzl A. Ileal neobladder and its variants. Eur Urol 2010; Suppl 9 : 745–753.
33. Pycha A, Comploj E, Martini T et al. Comparison of complications in three incontinent urinary diversions. Eur Urol 2008; 54(4): 825–832.
34. Nieuwenhuijzen JA, de Vries RR, Bex A et al. Urinary diversions after cystectomy: the association of clinical factors, complications and functional results of four different diversions. Eur Urol 2008; 53(4): 834–844.
35. Farnham SB, Cookson MS. Surgical complications of urinary diversion. World J Urol 2004; 22(3): 157–167.
36. Stenzl A, Sherif H, Kuczyk M. Radical cystectomy with orthotopic neobladder for invasive bladder cancer: a critical analysis of long term oncological, functional and quality of life results. Int Braz J Urol 2010; 36(5): 537–547.
37. Stein JP, Clark P, Miranda G et al. Urethral tumor recurrence following cystectomy and urinary diversion: clinical and pathological characteristics in 768 male patients. J Urol 2005; 173(4): 1163–1168.
38. Hautmann RE, Volkmer BG, Schumacher MC et al. Long-term results of standard procedures in urology: the ileal neobladder. World J Urol 2006; 24(3): 305–314.
39. Froehner M, Brausi MA, Herr HW et al. Complications following radical cystectomy for bladder cancer in the elderly. Eur Urol 2009; 56(3): 443–454.
40. Gschwend JE, Dahm P, Fair WR. Disease specific survival as endpoint of outcome for bladder cancer patients following radical cystectomy. Eur Urol 2002; 41(4): 440–448.
41. Shariat SF, Karakiewicz PI, Palapattu GS et al. Nomograms provide improved accuracy for predicting survival after radical cystectomy. Clin Cancer Res 2006; 12(22): 6663–6676.
42. Zaak D, Burger M, Otto W et al. Predicting individual outcomes after radical cystectomy: an external validation of current nomograms. BJU Int 2010; 106(3): 342–348.
43. Stein JP, Lieskovsky G, Cote R et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J Clin Oncol 2001; 19(3): 666–675.
44. Madersbacher A, Hochreiter F, Burkhard F et al. Radical cystectomy for bladder cancer today—a homogeneous series without neoadjuvant therapy. J Clin Oncol 2003; 21(4): 690–696.
45. Hollenbeck BK, Miller DC, Taub D et al. Aggressive treatment for bladder cancer is associated with improved overall survival among patients 80 years old or older. Urology 2004; 64(2): 292–297.
46. Lodde M, Palermo S, Comploj E et al. Four years experience in bladder preserving management for muscle invasive bladder cancer. Eur Urol 2005; 47(6): 773–779.
47. Nagele U, Anastasiadis AG, Merseburger AS et al. The rationale for radical cystectomy as primary therapy for T4 bladder cancer. World J Urol 2007; 25(4): 401–405.
48. Lawrentschuk N, Colombo R, Hakenberg OW et al. Prevention and management of complications following radical cystectomy for bladder cancer. Eur Urol 2010; 57(6): 983–1001.
49. Konety BR, Dhawan V, Allareddy V et al. Association between volume and charges for most frequently performed ambulatory and nonambulatory surgery for bladder cancer. Is more cheaper? J Urol 2004; 172(3): 1056–1061.
50. Hautmann RE, de Petriconi RC, Volkmer BG. Lessons learned from 1,000 neobladders: the 90-day complication rate. J Urol 2010; 184(3): 990–994.
51. Shamim Khan M, Elhage O et al. Analysis of early complications of robotic-assisted radical cystectomy using a standardized reporting system. Urology 2011; 77(2): 357–362.
52. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg 2004; 240(2): 205–213.
53. Svatek RS, Fisher MB, Matin SF et al. Risk factor analysis in a contemporary cystectomy cohort using standardized reporting methodology and adverse event criteria. J Urol 2010; 183(3): 929–934.
54. Donat SM. Standards for surgical complication reporting in urologic oncology: time for a change. Urology 2007; 69(2): 221–225.
55. Novara G, De Marco V, Aragona M et al. Complications and mortality after radical cystectomy for bladder transitional cell cancer. J Urol 2009; 182(3): 914–921.
56. De Neve W, Lybeert ML, Goor C et al. Radiotherapy for T2 and T3 carcinoma of the bladder: the influence of overall treatment time. Radiother Oncol 1995; 36(3): 183–188.
57. Mameghan H, Fisher R, Mameghan J et al. Analysis of failure following definitive radiotherapy for invasive transitional cell carcinoma of the bladder. Int J Radiat Oncol Biol Phys 1995; 31(2): 247–254.
58. Näslund I, Nilsson B, Littbrand B. Hyperfractionated radiotherapy of bladder cancer. A ten-year follow-up of a randomized clinical trial. Acta Oncol 1994; 33(4): 397–402.
59. Tonoli S, Bertoni F, De Stefani A et al. Radical radiotherapy for bladder cancer: retrospective analysis of a series of 459 patients treated in an Italian institution. Clin Oncol (R Coll Radiol) 2006; 18(1): 52–59.
60. Shelley MD, Barber J, Wilt T et al. Surgery versus radiotherapy for muscle invasive bladder cancer. Cochrane Database Syst Rev 2002; (1): CD002079.
61. Piet AH, Hulshof MC, Pieters BR et al. Clinical results of a concomitant boost radiotherapy technique for muscle-invasive bladder cancer. Strahlenther Onkol 2008; 184(6): 313–318.
62. Eisenberg MS, Dorin RP, Bartsch G et al. Early complications of cystectomy after high dose pelvic radiation. J Urol 2010; 184(6): 2264–2269.
63. Kachni LA, Kaufman DS, Heney NM et al. Bladder preservation by combined modality therapy for invasive bladder cancer. J Clin Oncol 1997; 15(3): 1022–1029.
64. Als AB, Sengelov L, von der Maase H. Long-term survival after gemcitabine and cisplatin in patients with locally advanced transitional cell carcinoma of the bladder: focus on supplementary treatment strategies. Eur Urol 2007; 52(2): 478–487.
65. Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data. Eur Urol 2005; 48(2): 202–206.
66. Weight CJ, Garcia JA, Hansel DE et al. Lack of pathologic down-staging with neoadjuvant chemotherapy for muscle-invasive urothelial carcinoma of the bladder: a contemporary series. Cancer 2009; 115(4): 792–799.
67. Loehrer PJ Sr., Einhorn LH, Elson PJ et al. A randomized comparison of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with metastatic urothelial carcinoma: a cooperative group study. J Clin Oncol 1992; 10(7): 1066–1073.
68. Bajorin DF, Dodd PM, Mazumdar M et al. Long-term survival in metastatic transitional-cell carcinoma and prognostic factors predicting outcome of therapy. J Clin Oncol 1999; 17(10): 3173–3181.
69. Bellmunt J, Albanell J, Paz-Ares L et al. Pretreatment prognostic factors for survival in patients with advanced urothelial tumors treated in a phase I/II trial with paclitaxel, cisplatin, and gemcitabine. Cancer 2002; 95(4): 751–757.
70. Bajorin D. The phase III candidate: can we improve the science of selection? J Clin Oncol 2004; 22(2): 211–213.
71. Bellmunt J, Choueiri TK, Fougeray R et al. Prognostic factors in patients with advanced transitional cell carcinoma of the urothelial tract experiencing treatment failure with platinum-containing regimens. J Clin Oncol 2010; 28(11): 1850–1855.
72. De Santis M, Bachner M. New developments in first - and second-line chemotherapy for transitional cell, squamous cell and adenocarcinoma of the bladder. Curr Opin Urol 2007; 17(5): 363–368.
73. Sternberg CN, Yagoda A, Scher HI et al. Methotrexate, vinblastine, doxorubicin, and cisplatin for advanced transitional cell carcinoma of the urothelium. Efficacy and patterns of response and relapse. Cancer 1989; 64(12): 2448–2458.
74. Sternberg CN, Yagoda A, Scher HI et al. M-VAC (methotrexate, vinblastine, doxorubicin and cisplatin) for advanced transitional cell carcinoma of the urothelium. J Urol 1988; 139(3): 461–469.
75. von der Maase H, Hansen SW, Roberts JT et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18(17): 3068–3077.
76. von der Maase H, Sengelov L, Roberts JT et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005; 23(21): 4602–4608.
77. Sternberg CN, de Mulder PH, Schornagel JH et al. European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group. Randomized phase III trial of high-dose-intensity methotrexate, vinblastine, doxorubicin, and cisplatin (MVAC) chemotherapy and recombinant human granulocyte colony-stimulating factor versus classic MVAC in advanced urothelial tract tumors: European Organization for Research and Treatment of Cancer Protocol no. 30924. J Clin Oncol 2001; 19(10): 2638–2646.
78. Sternberg CN, de Mulder P, Schornagel JH et al. Seven year update of an EORTC phase III trial of high-dose intensity M-VAC chemotherapy and G-CSF versus classic M-VAC in advanced urothelial tract tumours. Eur J Cancer 2006; 42(1): 50–54.
79. Milowsky MI, Nanus DM, Maluf FC et al. Final results of sequential doxorubicin plus gemcitabine and ifosfamide, paclitaxel, and cisplatin chemotherapy in patients with metastatic or locally advanced transitional cell carcinoma of the urothelium. J Clin Oncol 2009; 27(25): 4062–4067.
80. Hussain MH, MacVicar GR, Petrylak DP et al. Trastuzumab, paclitaxel, carboplatin, and gemcitabine in advanced human epidermal growth factor receptor-2/neu-positive urothelial carcinoma: results of a multicenter phase II National Cancer Institute trial. J Clin Oncol 2007; 25(16): 2218–2224.
81. De Santis M, Bellmunt J, Mead G et al. Randomized phase II/III trial assessing gemcitabine/carboplatin and methotrexate/carboplatin/ /vinblastine in patients with advanced urothelial cancer “unfit” for cisplatin-based chemotherapy: phase II—results of EORTC study 30986. J Clin Oncol 2009; 27(33): 5634–5639.
82. Culine S, Theodore C, De Santis M. A phase II study of vinflunine in bladder cancer patients progressing after first-line platinum-containing regimen. Br J Cancer 2006; 94(10): 1395–1401.
83. Bellmunt J, Theodore C, Demkov T et al. Phase III trial of vinflunine plus best supportive care compared with best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J Clin Oncol 2009; 27(27): 4454–4461.
84. Youssef RF, Mitra AP, Bartsch G Jr. et al. Molecular targets and targeted therapies in bladder cancer management. World J Urol 2009; 27(1): 9–20.
85. Shariat SF, Youssef RF, Gupta A et al. Association of angiogenesis related markers with bladder cancer outcomes and other molecular markers. J Urol 2010; 183(5): 1744–1750.
86. Song S, Wientjes MG, Gan Y et al. Fibroblast growth factors: an epigenetic mechanism of broad spectrum resistance to anticancer drugs. Proc Natl Acad Sci USA 2000; 97(15): 8658–8663.
87. Gomez-Roman JJ, Saenz P, Molina M et al. Fibroblast growth factor receptor 3 is overexpressed in urinary tract carcinomas and modulates the neoplastic cell growth. Clin Cancer Res 2005; 11 (2 Pt 1): 459–465.
88. Ioachim E, Michael MC, Salmas M et al. Thrombospondin-1 expression in urothelial carcinoma: prognostic significance and association with p53 alterations, tumour angiogenesis and extracellular matrix components. BMC Cancer 2006; 6 : 140.
89. Gallagher DJ, Milowsky MI, Ishill N et al. Detection of circulating tumor cells in patients with urothelial cancer. Ann Oncol 2009; 20(2): 305–308.
90. Hoffmann AC, Wild P, Leicht C et al. MDR1 and ERCC1 expression predict outcome of patients with locally advanced bladder cancer receiving adjuvant chemotherapy. Neoplasia 2010; 12(8): 628–636.
91. Aapro M, Abrahamsson PA, Body JJ et al. Guidance on the use of bisphosphonates in solid tumours: recommendations of an international expert panel. Ann Oncol 2008; 19(3): 420–432.
92. Zaghloul MS, Boutrus R, El-Hossieny H et al. A prospective, randomized, placebo-controlled trial of zoledronic acid in bony metastatic bladder cancer. Int J Clin Oncol 2010; 15(4): 382–389.
93. Rosen LS, Gordon D, Tchekmedyian NS et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors: a randomized, phase III, double-blind, placebo-controlled trial. Cancer 2004; 100(12): 2613–2621.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2011 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Možnosti a místo chirurgické léčby superficiálního karcinomu močového měchýře
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Ileální neovezika a její varianty
- Karcinom močového měchýře – nejnovější poznatky v oblasti operační a medikamentózní léčby
- Chemoterapie u invazivního a metastatického nádoru močového měchýře
- Metabolické a maligní důsledky augmentace močových cest u dětí
- Role botulotoxinu při léčbě dysfunkce dolních cest močových u pacientů s roztroušenou sklerózou
- Ze zahraničních periodik
- Úvodník
- EAU Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu - aktualizovaná verze z roku 2011
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ileální neovezika a její varianty
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



