-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Metabolické a maligní důsledky augmentace močových cest u dětí
Key words:
bladder augmentation in children, metabolic disturbances, vitamin B12 deficiency, malignacy development
Autoři: P. J. Kokorowski; J. C. Routh
Působiště autorů: Children’s Hospital BostonHarvard Medical SchoolBoston, MA, USA
Vyšlo v časopise: Urol List 2011; 9(3): 46-52
Souhrn
Klíčová slova:
augmentace močového měchýře u dětí, metabolické poruchy, nedostatečnost vitaminu B12, vznik maligního onemocněníAugmentační cystoplastika představuje důležitou terapeutickou modalitu u pacientů se závažnou dysfunkcí močového měchýře. Augmentace močového měchýře se nejčastěji provádí u pacientů s neurogenní dysfunkcí močového měchýře (např. spina bifida) nebo jeho exstrofií [1,2]. U dětí, u nichž selhala veškerá medikamentózní léčba, představuje augmentační cystoplastika efektivní prostředek pro zlepšení kapacity močového měchýře i compliance a zabezpečení močové kontinence. Při této technice se obvykle užívá detubulizovaný střevní segment z pacientova vlastního střeva. Užívání segmentu ilea, kolon a/nebo žaludku bylo v literatuře dobře popsáno, tyto segmenty se užívají při operační substituci struktur cest močových (nebo jejích částí) již více než sto let. V literatuře lze rovněž najít informace o užívání dalších variant biologického materiálu, jako jsou např. autologní močovod [3] a synteticky připravená tkáň [4], jejich užívání však není tak časté. Hodnocení dlouhodobého rizika a komplikací při užívání tohoto typu biomateriálu je však mimo rámec tohoto článku. Navzdory účinnosti této techniky sahají obvykle dětští urologové k augmentaci až jako k poslední možnosti volby, což je primárně zapříčiněno výskytem krátkodobých i dlouhodobých komplikací při tomto výkonu. Přestože cystoplastika poskytuje významný benefit v podobě zlepšení dynamiky močového měchýře, je tento výkon spojen s celou řadou potenciálně závažných či dokonce život ohrožujících komplikací. Tyto komplikace zahrnují chronickou bakteriurii, vznik konkrementů v močovém měchýři, rupturu augmentovaného měchýře, obstrukci tenkého střeva, poruchu elektrolytové rovnováhy, nedostatečnost vitaminu B12 a vznik maligního onemocnění v augmentovaném měchýři. Tento článek se zaměřuje vý-hradně na riziko vzniku dlouhodobých metabolických a maligních komplikací augmentace močového měchýře u dětí.
METABOLICKÉ DŮSLEDKY
U většiny pacientů podstupujících augmentaci močového měchýře nedojde ke klinicky významným metabolickým změnám [5]. Efekt interpozice střevního segmentu do močopohlavních cest na metabolizmus je však znám od prvních zkušeností s touto technikou [6]. Tento efekt se může projevovat ve formě poruch elektro-lytové nebo acidobazické rovnováhy, nedostatku vitaminů nebo muskuloskeletálních defektů. Incidence, typ a závažnost metabolických důsledků augmentace močového měchýře závisí zejména na užitém segmentu (tab. 1). Délka augmentovaného segmentu může zmírňovat, nebo naopak zhoršovat tyto důsledky – dle očekávání, užití kratšího segmentu je spojeno s menším výskytem metabolických komplikací [7,8].
Tab. 1. Incidence a charakteristiky abnormalit elektrolytové rovnováhy u pacientů, kteří podstoupili augmentační cystoplastiku s užitím střevního segmentu [11,13,14]. ![Incidence a charakteristiky abnormalit elektrolytové rovnováhy u pacientů, kteří podstoupili augmentační cystoplastiku s užitím střevního segmentu [11,13,14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c16a0231f735ed2653d1ee0158fd86f6.jpeg)
Porucha elektrolytové a acidobazické rovnováhy
Přesnou incidenci poruch elektrolytové a acidobazické rovnováhy u dětí podstupujících augmentaci močového měchýře je obtížné s pomocí v současně době dostupných publikací určit. V některých případech je nutné míru incidence odhadovat na základě údajů dospělých pacientů a/nebo onkologických zpráv. Většina pacientů podstupujících augmentaci močového měchýře zaznamená pouze minimum krátkodobých problémů, abnormality jsou obvykle dočasné a klinicky nevýznamné. Je však třeba zdůraznit, že ačkoli výskyt metabolických poruch není univerzální [9], mohou být tyto abnormality u postižených pacientů závažného charakteru (a potenciálně ohrožovat život pacienta) [10]. U pacientů, kteří podstoupili augmentaci, je tedy nutné užívat citlivé testy pro hodnocení elektrolytové a acidobazické rovnováhy.
Pro augmentaci močového měchýře u dětí se ze všech částí střeva nejčastěji užívá ileum [11,12]. Volba tohoto segmentu má celou řadu výhod, z nichž jednou je snadné užívání a dostupnost u dětí. Stejně významný je (pro účely tohoto článku) rovněž příznivý metabolický profil ilea. Pacienti podstupující ileocystoplastiku mají riziko vzniku hyperchloremické hypokalemické metabolické acidózy (tab. 1) [11,13,14]. Pacienti, u nichž dojde ke vzniku acidózy, obvykle trpí únavou, anorexií, úbytkem váhy, polydipsií a letargií [15]. Pacienti s narušenou funkcí ledvin mají vyšší riziko, že u nich dojde ke vzniku metabolické acidózy, než pacienti s normální renální funkcí [13]. Závažné poruchy elektrolytové rovnováhy se mohou vyskytovat až u 18 % pacientů, kteří podstoupí ileocystoplastiku [9,15]. DeFoor et al uvádí výskyt závažné metabolické acidózy u 23 % pacientů, kteří podstoupili konstrukci ileální neoveziky [11]. Doposud nebylo prokázáno, zda je výskyt acidózy stejně častý u pacientů, kteří podstoupili cystoplastiku, vzhledem k tomu, že augmentovaný měchýř má ve srovnání s neovezikou menší povrch střevní sliznice. V nedávné době provedená studie Adamse et al neprokázala žádné významné změny v hladině elektrolytů v séru ani pH u 71 dětí, které podstoupily augmentaci močového měchýře [9], statistická analýza však nezohledňuje dlouhodobou povahu údajů ani odlišnou dobu sledování u jednotlivých pacientů.
Mechanizmus vzniku hyperchloremické acidózy bývá spojován s transportem amoniových iontů [13]. V případě, že je epitel střevního segmentu vystaven působení moči, začíná střevní sliznice vylučovat sodík a hydrouhličitanové ionty při současné absorpci iontů amonia, vodíku a chloru. Klíčovou roli v tomto procesu pravděpodobně hraje transport sodíku/vodíku, jenž vede ke ztrátě amoniových a draselných iontů močí a retenci iontů chloru a vodíku [16]. Dokonce při normální hladině draslíku v séru může až 30 % pacientů pozorovat v organizmu v dlouhodobém horizontu významný úbytek draslíku [17]. Vzhledem k tomu, že úbytek iontů způsobuje osmotický gradient vyvolávající ředění moči, může docházet k závažné dehydrataci [13]. Potenciální riziko dehydratace je obzvláště významné u pacientů trpících gastroenteritidou (a pacientů, kteří mohou být dehydratovaní z jiných příčin), protože může dále přispívat k poruše elektrolytové a acidobazické rovnováhy (v důsledku augmentace). U některých pacientů lze metabolickou acidózu řešit častější katetrizací, což zajistí minimální kontakt mezi močí a střevní sliznicí, a tak omezí absorpci elektrolytů v moči. U pacientů, u nichž selžou konzervativní opatření, lze k léčbě metabolické poruchy přistupovat ve dvou fázích – první fáze spočívá v korekci acidózy a poruchy elektrolytové rovnováhy a druhá fáze v prevenci budoucího úbytku elektrolytů.
Acidózu lze účinně zvrátit aplikací hydrouhličitanu sodného, ačkoli tato léčba způsobuje významnou plynatost. Řada pacientů tedy tuto léčbu špatně snáší. Účinná může být rovněž perorální aplikace citrátu draselného, ale podobně jako při aplikaci hydrouhličitanu sodného je nutné u pacientů s renálními nebo srdečními komorbiditami pečlivě monitorovat celkový přísun sodíku a draslíku. Případně (anebo jako doplňující modalitu) lze acidózu tlumit pomocí kyseliny nikotinové nebo chlorpromazinu. Obě látky inhibují cyklický adenozin monofosfát, a blokují tak transport chlóru [18,19]. Užívání obou medikamentů může být spojeno s výskytem významných vedlejších účinků v podobě dysfunkce jater a žaludku, pacienti podstupující tuto léčbu tedy vyžadují pečlivé monitorování [18,19]. Co je však třeba zdůraznit – žádný z preparátů neumožňuje léčit již existující acidózu, tato terapie slouží pouze jako prevence výskytu dalších epizod acidózy. Tuto modalitu je tedy třeba považovat za léčbu druhé volby po korekci acidózy způsobené augmentací.
Segment kolon se užívá méně často než ileum, zčásti z toho důvodu, že tento materiál je spojen s častějším výskytem pooperačních komplikací [12,20,21] a rovněž s vyšší mírou metabolických komplikací [13]. Na základě údajů v literatuře týkajících se dospělých pacientů se abnormality elektrolytové rovnováhy vyskytují až u 50 % pacientů podstupujících rekonstrukci močových cest s užitím segmentu kolon či céka [13,15,16], což je pravděpodobně zapříčiněno zvýšenou propustností sliznice kolon pro draselné ionty (ve srovnání s ileem), ačkoli transport iontů v obou segmentech je jinak srovnatelný. Děti podstupující kolocystoplastiku mají tedy rovněž riziko, že u nich dojde ke vzniku hypokalemické, hyperchloremické metabolické acidózy, a vyšší pravděpodobnost hypokalemie než pacienti, kteří podstupují ileocystoplastiku [13,17]. Přesná délka segmentu kolon užívaná při augmentaci – céka nebo sigmoidea – pravděpodobně není důležitá vzhledem k tomu, že všechny části kolon vykazují v rámci substituce urotelu srovnatelné metabolické vlastnosti [13].
Gastrocystoplastika se ve většině center užívá méně často než techniky s užitím jiných částí střeva [12]. Zejména u pacientů s citlivou močovou trubicí může augmentace s užitím segmentu ze žaludku vyvolávat silnou bolest při močení a/nebo hematurii (tj. hematuricko-dysurický syndrom) v důsledku zvýšené kyselosti moči z funkčního segmentu žaludku [22–24]. Incidence hematuricko-dysurického syndromu se liší v závislosti na kritériích užitých pro definování této poruchy. Zatímco některé studie uvádí občasný výskyt hematurie nebo dysurie u 27–36 % pacientů po gastrocystoplastice [23,25], jiné studie uvádí, že medikamentózní či operační léčba je nezbytná pouze u 4–18 % pacientů [26,27]. Jiná studie prokázala, že užití segmentu ze žaludku způsobuje vznik hypokalemické, hypochloremické metabolické alkalózy u 6 % pacientů [23]. Ve srovnání s technikami využívajícími jiné střevní segmenty je gastrocystoplastika významně méně náchylná k produkci slizničního hlenu, tvorbě konkrementů i vzniku infekce [12,23,28,29]. Metabolické vlastnosti žaludečního segmentu mohou být navíc příhodné u pacientů s narušenou renální funkcí, syndromem krátkého střeva nebo chronickou acidózou [12,23,28,29]. Nejlepší léčbou metabolických poruch v důsledku gastrocystoplastiky a/nebo hematuricko--dysurického syndromu je hydratace a su-plementace draslíku, blokáda histaminového receptoru (např. pomocí ranitidinu) nebo inhibice protonové pumpy (např. pomocí omeprazolu) [24].
Několik center popisuje své zkušenosti s cystoplastikou s užitím kombinace různých střevních segmentů [11,12,30]. Tyto techniky obvykle kombinují žaludeční segment se segmentem ilea či kolon, ačkoli lze použít i ileokolický segment (zejména u pacientů vyžadujících opakovanou augmentaci v důsledku přetrvávající špatné kompliance nebo malé kapacity). Míra výskytu hematurie a dysurie je u těchto pacientů srovnatelná s pacienty podstupujícími samotnou gastrocystoplastiku [30], ačkoli pravděpodobnost vzniku litiázy a infekce je nižší než při užití kolon či ilea [12]. S ohledem na povahu a frekvenci poruch metabolické a elektrolytové rovnováhy při kombinované augmentaci existují protichůdné údaje, většina studií na lidských subjektech však nasvědčuje tomu, že metabolické poruchy jsou méně časté než při užívání ilea, kolon nebo samotného žaludečního segmentu [30,31].
Naopak jejunum se při augmentaci vzhledem k vysoké frekvenci a závažnosti metabolických komplikací téměř neužívá [32]. První studie prokázaly, že užívání tohoto materiálu vyvolává častý výskyt (často závažného stupně) hyponatremické, hypochloremické, hyperkalemické, metabolické acidózy, často ve spojitosti se závažnou dehydratací a azotemií [7,33], což je z velké části zapříčiněno poměrně volnou propustností jejuna pro vodu a významnou sekrecí iontů sodíku a chloru (ve srovnání s jinými střevními segmenty) [8,13].
Výše popsané abnormality jsou ještě závažnější při užití delšího nebo proximálnějšího segmentu jejuna [33]. Vzhledem k vyššímu riziku a závažnosti komplikací (ve srovnání s jinými střevními segmenty) je užívání jejuna velmi těžko obhajitelné. Autoři tedy užívání jejuna při augmentační cystoplastice u dětí neodporučují.
Nedostatek vitaminů a metabolické poruchy
Kromě poruch elektrolytové a acidobazické rovnováhy může užívání střevních segmentů při cystoplastice vést k poruchám absorpce vitaminů; pravděpodobně nejvýraznější je souvislost mezi augmentací s užitím ilea a nedostatkem vitaminu B12 (cyanocobalamin) [34–36]. Podobně jako tomu je u poruch elektrolytů, pravděpodobnost nedostatku vitaminu B12 je přímo úměrná délce užitého ileálního segmentu. Vitamin B12 je nezbytnou látkou, která se získává z potravy. Obvykle se vitamin B12 chemicky uvolňuje v kyselém prostředí žaludku, vázaný na vnitřní faktor v duodendu, a následně je absorbován v terminální části ilea. Nedostatek vitaminu B12 vyvolává megaloblastickou anémii a může mít nejrůznější neurologické důsledky. Pozdními a často nezvratnými důsledky nedostatku vitaminu B12 jsou periferní neuropatie, atrofie opticu, degenerace mozku a míchy a demence (včetně Alzheimerovy choroby). Nedostatek vitaminu B, včetně B12, způsobuje hyperhomocysteinemii. Vzhledem k tomu, že zvýšená hladina homocysteinu úzce souvisí se zvýšeným rizikem kardiovaskulárních příhod, jako jsou např. infarkt myokardu, mozková příhoda, městnavé srdeční selhání, může dlouhodobý nedostatek vitaminu B12 zvyšovat riziko kardiovaskulárního onemocnění. Zajímavým zjištěním je výsledek několika randomizovaných, kontrolovaných studií, jež neprokázaly žádný benefit suplementace vitaminu B12 na výsledný stav kardiovaskulárnícha neurologických onemocnění u dospělých [37–39]. Role nedostatku vitaminu B12 ani jeho suplementace u dětí s kardiovaskulárním onemocněním, které podstoupily augmentaci měchýře, nebyla dosud stanovena, velmi nízké riziko suplementace vitaminu B12 by však pravděpodobně bylo vyváženo potenciálním benefitem.
Ačkoli hladina vitaminu B12 se u pacientů, kteří podstoupili cystoplastiku, významně liší, Blackburn et al a Rosenbaum et al ve svých studiích uvádí slabou, ale přesto signifikantní negativní souvislost mezi hladinou vitaminu B12 a délkou sledování pacienta po ileocystoplastice (tj. hladina vitaminu B12 klesá spolu se zvětšujícím se intervalem od augmentace) [34,35]. Co je však třeba zdůraznit, vitamin B12 se může uchovávat v organizmui několik let, což znamená, že jeho nedostatek se nemusí klinicky projevit i dlouhou dobu po augmentaci.
Léčba nedostatku vitaminu B12 se zaměřuje hlavně na jeho prevenci: Rosenbaum et al doporučují, aby pacienti po augmentaci podstupovali během prvních pěti let jednou ročně screening vitaminu B12 [35]. V nedávné době publikovaná studie VanderBrinka et al prokázala, že u 97 % pacientů s nízkou hladinou vitaminu B12 vedla perorální aplikace vitaminu k návratu jeho hladiny k normálu [40]. Naopak Stein et al prokázali u pacientů, kteří podstoupili augmentační cystoplastiku před (průměrně) deseti lety, normální hladiny vitaminů A, B1, B2, B6, D, E, i K a rovněž normální hladinu mědi, zinku, železa, ferritinu, amonia, kyseliny žlučové i kyseliny listové [36].
Rovněž je známým faktem, že chronická, dlouhotrvající acidóza a úbytek elektrolytů může způsobovat závažnou demineralizaci skeletu [41,42]; rozsah této komplikace u pacientů po augmentaci je rozporuplný [43–46]. Řada studií se soustředila na měření hladiny kostních minerálů u pacientů po cystoplastice a výsledky některých skutečně prokazují výraznější úbytek kostní hmoty po augmentaci [43,45], zatímco jiné připisují pokles hladiny kostních minerálů po augmentaci spíše jiným medicínským a/nebo neurologickým stavům [17,36,44,46]. Rozsah, jakým cystoplastika negativně ovlivňuje lineární růst, je rovněž kontroverzní; existují protichůdné názory na to, zda je menší vzrůst důsledkem samotné augmentace nebo neurologického onemocnění [14,44,46–49].
MALIGNÍ KOMPLIKACE
Jedním z potenciálně nejvíce život ohrožujících důsledků rekonstrukce močových cest pomocí střevního segmentu je vznik maligního onemocnění. Souvislost mezi vznikem neoplazie a rekonstrukcí močových cest byla poprvé prokázána na základě dlouhodobého sledování pacientů podstupujících ureterosigmoidostomii, u nichž se riziko vzniku maligního onemocnění v průběhu života pohybovalo v rozmezí 5–19 % [50]. U pacientů starších 55 let se odhaduje, že ureterosigmoidostomie je spojena s osminásobným zvýšením rizika vzniku kolorektálního karcinomu. U mládeže a adolescentů je riziko maligního onemocnění odhadováno na 477násobně vyšší než v běžné populaci [51].
Dosud byly popsány nejrůznější mechanizmy vzniku metaplazie epitelu, jako např. chronický zánět, stáza moči a litiáza. Dále existuje hypotéza, že směs moči se střevní flórou podporuje vznik maligního onemocnění prostřednictvím tvorby karcinogenních nitrosaminů. Předpokládalo se, že tato rizika lze eliminovat oddělením moči a fekálií [52]. Bohužel se však ukázalo, že samotné oddělení vylučování moči a stolice nemusí být dostačující pro prevenci vzniku tumoru, a stále existují značné obavy s ohledem na maligní degeneraci po cystoplastice.
Řada studií publikovaná v uplynulých desetiletích popisuje výskyt maligních onemocnění v souvislosti s cystoplastikou. Incidence se odhaduje na 0,6–5,5 % [51,53–57]. Existují důkazy, které nasvědčují tomu, že riziko je významně vyšší u pacientů, kteří podstoupili cystoplastiku s užitím žaludečního segmentu (až 10 % v malé studii z jediného centra) [55]. Délka a kvalita sledování v různých studiích se však významně liší, a přesné riziko vzniku sekundárního maligního onemocnění tedy doposud nebylo stanoveno. Následující faktory pravděpodobně přispívají k celkově vyššímu riziku vzniku maligního onemocnění: vysoká prevalence renálních alograftů (a následné užívání imunosupresiv) a vrozená onemocnění [58,59]. Naopak u imunokompetentních pacientů je riziko vzniku maligního onemocnění pravděpodobně mnohem nižší [60].
Nejčastějším symptomem nasvědčujícím vzniku tumoru je makroskopická hematurie, která byla zaznamenána přibližně u 68 % pacientů. Tento symptom však bohužel často svědčí o pokročilém stadiu onemocnění. Další méně časté znaky a symptomy zahrnují bolest v suprapubické oblasti, frekvenci, infekci močových cest (UTI), známky metastáz, renální insuficienci, hydronefrózu a nehojící se rány. Mikrohematurie představuje nevhodný predikátor maligního onemocnění, neboť u pacientů na intermitentní katetrizaci (IC) se může mikroskopická hematurie vyskytovat při absenci maligního onemocnění (nebo jakékoli jiné onemocnění než způsobené drobným traumatem IC).
Některá centra navrhují přítomnost recidivujících UTIs jako kritérium pro výběr pacientů pro hodnocení přítomnosti maligního onemocnění [61] s odůvodněním, že recidivující infekce může souviset se zvýšenou tvorbou nitrosaminů. UTIs však představují častý nález, bez ohledu na přítomnost nebo absenci tumoru [53]. Z tohoto důvodu pravděpodobně nebudou UTI užitečným predikátorem maligního onemocnění.
Mezi operačním výkonem a vznikem maligního onemocnění pravděpodobně existuje značné latentní období. Většina tumorů je u pacientů, kteří podstoupili cystoplastiku, klinicky detekována po více než desesti letech. Není však jasné, zda je tato skutečnost zapříčiněna latencí tumorů nebo jejich pomalým růstem. Jeden přehledový článek uvádí střední délku latentního období mezi cystoplastikou a vznikem tumoru 17 let (rozmezí 3 měsíce–27 let) [51]. Autoři tohoto článku při vlastním hodnocení literatury došli k následujícímu závěru: střední doba latence 19 let (rozmezí 3 měsíce–53 let) [62]. Více než polovina tumorů vzniklých v důsledku cystoplatiky je detekována v pokročilém klinickém stadiu a téměř vždy se jedná o léze vysokého grade [63]. Naneštěstí k velmi malému počtu publikací zabývajících se tímto typem tumorů je velmi obtížné přesně predikovat délku intervalu latence. Vzhledem k závažnosti a vysoké míře mortality u pacientů s tumory v důsledku cystoplastiky doporučuje řada autorů každoroční screening asymptomatických pacientů pomocí cystoskopického a cytologického vyšetření [64–69]. Stejná doporučení se uvádí u pacientů podstupujících ureterosigmoidostomii, u nichž se doporučuje jednou ročně endoskopické vyšetření (od desátého roku po operaci) [70]. Ačkoli někteří autoři doporučují screening zahájit během 1.–8. roku po cystoplastice [64,65,69,71,72], jiní se domnívají, že v tomto období se vyskytne pouze minimální procento (pokud vůbec nějaké) tumorů a doporučují se screeningem vyčkat až po uplynutí deseti let po augmentační cystoplatice [54,73,74].
Při hodnocení účinnosti podobného screeningového programu je třeba zvážit následující otázky:
- Umožní diagnostický test detekovat onemocnění před vznikem klinických symptomů?
- Umožní časná diagnostika účinnější léčbu a povede ke zlepšení doby přežití nebo kvality života?
- Převáží tyto benefity související rizika a cenu screeningu?
Teoreticky, cystoskopie spolu s cytologickým vyšetřením mohou umožnit detekci tumoru v časném stadiu, kdy chirurgické odstranění tumoru může vést k jeho vyléčení. To by však vyžadovalo provedení cystoskopie v tom intervalu, kdy je tumor v nízkém stadiu, a přesto detekovatelný. Dále je nutné zohlednit potenciální rizika opakovaného vyšetřování u převážné většiny pacientů, u nichž po cystoplastice ke vzniku maligního onemocnění nikdy nedoje. V současné době máme k dispozici pouze minimum údajů o účinnosti cystoskopie a cytologie v rámci screeningu pacientů, kteří podstoupili cystoplastiku [73]. Higuchi et al publikovali screeningový protokol (trvající pět let) zahrnující 50 pacientů: po celkem 250 vyšetřeních byl detekován jeden případ adenomatózního polypu a žádné maligní onemocnění [61]. Studie však zaznamenala falešně pozitivní výsledky cytologie u 10 % vzorků, což vedlo k nadbytečnému provádění CT urografie a endoskopického vyšetření. Tento protokol byl následně z důvodu nízkého rizika vzniku tumoru a falešně-pozitivním výsledkům ukončen.
Existují důkazy, které zpochybňují schopnost cystoskopie a cytologie detekovat malé tumory v augmentovaném měchýři. Tvorba hlenu a celkově abnormální vzhled augmentovaného měchýře mohou zhoršovat vizualizaci a znesnadňovat identifikaci malých tumorů [59]. Špatná senzitivita může být patrná zejména u pacientů, u nichž byl při augmentaci užit žaludeční segment, neboť adenokarcinomy žaludku se tvoří hluboko v žaludeční sliznici a šíří se difuzně. Neoplazie se tak může projevovat jako mírné zesílení žaludeční stěny spíše než jasně viditelná rezistence. V nedávné době provedené studii zabývající se výskytem maligních onemocnění v souvislosti s cystoplastikou byl zaznamenán případ pacienta s normálním cystoskopickým vyšetřením a negativní biopsií měchýře navzdory přítomnosti metastazujícího onemocnění, které bylo odhaleno během CT vyšetření a potvrzeno při operačním výkonu [56]. U dalšího pacienta byl navzdory negativnímu výsledku endoskopického vyšetření přítomen tumor větších rozměrů (ovšem při pozitivním výsledku cytologie). Tyto studie jasně ukazují, že detekce tumorů během intervalu mezi viditelným tumorem a invadujícím onemocněním je problematická, zejména s přihlédnutím k vysokému histologickému grade většiny tumorů. Efektivní screeningový program by vyžadoval častější frekvenci vyšetření (přibližně každých šest měsíců (nebo dokonce méně)) než pouze jednou ročně. S cílem zlepšit prognostickou hodnotu screeningu byla zkoumána biopsie pro identifikaci pacientů s potenciálním rizikem vzniku maligního onemocnění [72]. Jedna skupina autorů prokázala přítomnost určité histologické alterace u 70 % pacientů, kteří podstoupili cystoplastiku s užitím žaludečního segmentu – od chronického zánětu až po metaplazii. Na základě těchto údajů doporučují autoři pacientům, kteří podstoupili cystoplatiku s užitím žaludečního segmentu, podstoupit screening 6–10 let po výkonu. Tyto závěry je však nutné podrobit dalšímu studiu.
Obdobné screeningové programy jsou doporučovány u pacientů se sekundárními tumory v močovém měchýři v důsledku chronické katetrizace. Několik studií zabývajících se významem cystoskopického vyšetření u pacientů s míšním poraněním vyžadujícím intermitentní katetrizaci neprokázalo definitivní benefit [75,76]. Jedna ze studií uvádí benefit v patologickém stadiu a době přežití, vyšetřovaná populace v této retrospektivní studii však podstoupila endoskopické vyšetření z důvodu recidivující nebo chronické UTI [77]. Nelze tedy prokázat, zda tyto tumory byly detekovány na základě včasného rozpoznání symptomatického onemocnění. Stejně jako v případě tumorů močového měchýře u pacientů s poraněním míchy se riziko vzniku maligního onemocnění pacientů po cystoplatice zdá být nízké, a plošný screening by tedy pravděpodobně poskytl pouze minimální benefit. Dokonce v případě, že by screening umožňoval detekovat onemocnění v časném stadiu a zlepšoval by dobu přežití u pacientů s maligním onemocněním, existuje pouze minimum informací o potenciálních rizicích opakovaného screeningu. Cystoskopické vyšetření augmentovaného měchýře s sebou nese nízké riziko perforace. Ačkoli se jedná o vzácnou komplikaci, perforace může způsobit vážné problémy nebo dokonce úmrtí. Vzhledem k nízké incidenci maligních onemocnění by screening podstoupila z větší části populace pacientů bez tumorů. Abnormální nálezy by měly za následek indikaci biopsie nebo dalších zobrazovacích vyšetření jako např. CT břicha/ /pánve. Rizika spojená se screeningem by tak vyrovnala (ať již částečně nebo úplně) benefity rutinního provádění cystoskopie. Autoři v nedávné době zkoumali roli cystoskopie a cytologie jako ekonomicky výhodné strategie pro screening pacientů po cystoplastice. Autoři vytvořili na základě odhadů systematického hodnocení literatury Markovův rozhodovací model pro pravděpodobné náklady a potenciální benefit screeningu. Autoři prokázali, že dokonce v případě, že by byl screening vysoce účinný, nasvědčuje zjevně nízké riziko vzniku maligního onemocnění spolu s dlouhodobými náklady tomu, že by tato strategie nebyla ekonomicky výhodná na základě limitů (willingness-to-pay) stanovených v USA [62].
V současné době nemáme k dispozici žádná kvalitní data, která by umožňovala stanovit optimální screeningovou strategii (pokud nějaká existuje). Rovněž nelze očekávat, že budou provedeny velké prospektivní studie, které by přímo srovnávaly různé strategie, vzhledem k tomu, že nízká míra detekce nádorů by vyžadovala velkou populaci pacientů s extrémně dlouhou dobou sledování – což je velmi nákladné vzhledem k náročné organizaci běžně kontrolované studie. Autoři se domnívají, že moudřejším přístupem je pečlivě monitorovat případné znepokojující znaky a symptomy jako např. makroskopická hematurie (tab. 2), nově vzniklá hydronefróza nebo bolest v suprapubické oblasti a vyšetřovat pouze pacienty s podezřelými symptomy (tab. 3). Případně je třeba vyvinout přesný a levný screeningový test (specifický pro tento typ tumorů), který by klinickým lékařům pomohl identifikovat jedince s vysokým rizikem vzniku maligního onemocnění, u nichž by měl být indikován screening. Někteří autoři vyjadřují obavy, že při delší době sledování může být odhalena mnohem vyšší míra výskytu maligních onemocnění než nasvědčují současné údaje [66]. Pakliže by se tato obava naplnila, byl by agresivnější screening na místě.
Tab. 2. Doporučení pro rutinní indikaci sledování asymptomatických pacientů podstupujících augmentační cystoplastiku. 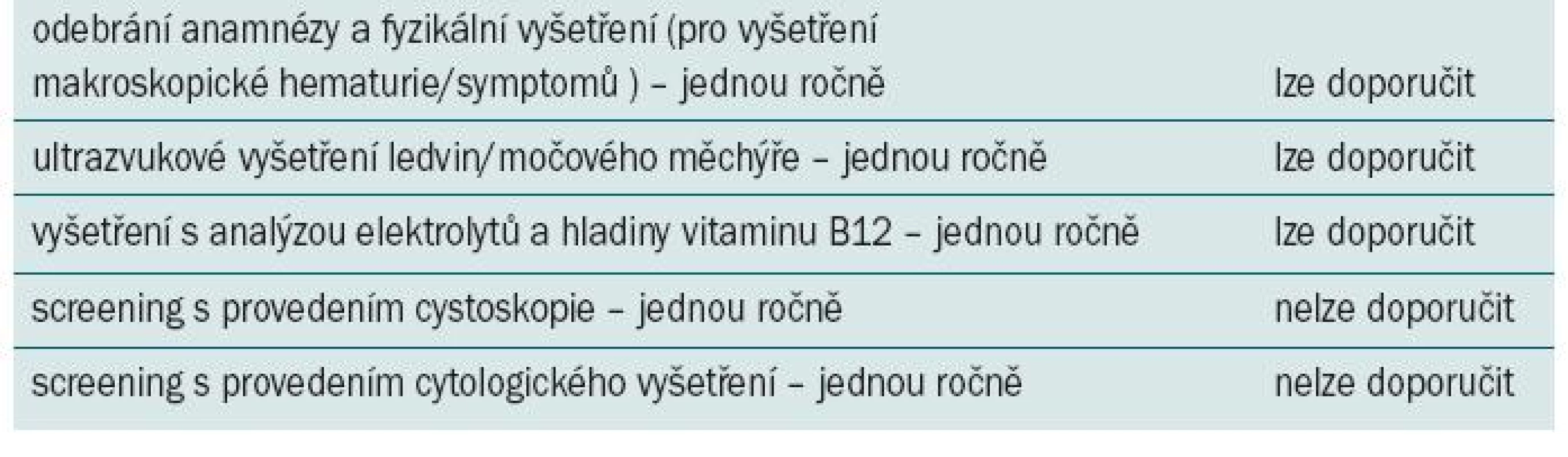
Tab. 3. Doporučení pro postup u symptomatických pacientů podstupujících augmentační cystoplastiku. 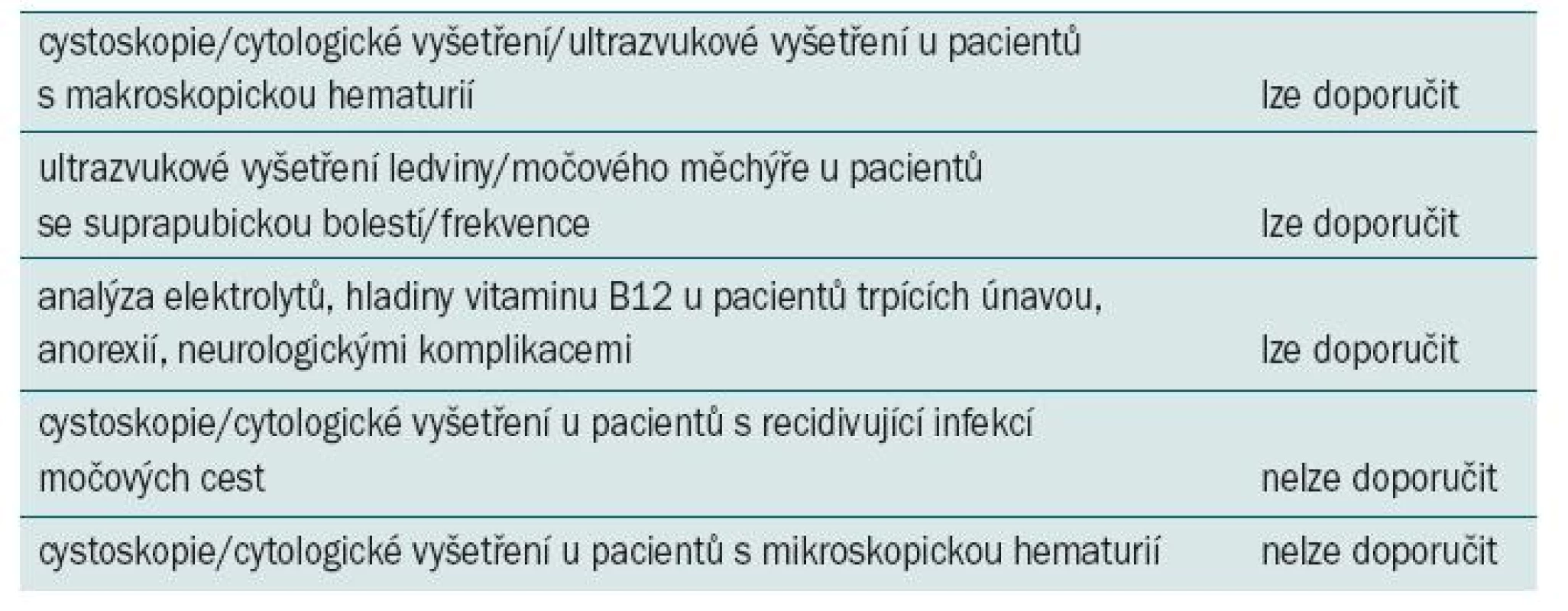
Nejenže je absolutní riziko maligního onemocnění u pacientů po augmentační cystoplastice kontroverzní, dokonce se někteří odborníci domnívají, že tito pa-cienti nemají žádné zvýšené riziko [58,60,78].
Austin et al v nedávné době uveřejnili, že pacienti se spina bifida (kteří podstoupili cystoplastiku, nebo nikoli) mají pravděpodobně vyšší riziko maligního onemocnění [58]. Vzhledem k tomu, že toto onemocnění představuje jednu z nejčastějších indikací pro cystoplastiku [1], se autoři domnívají, že zvýšené riziko souvisí s jinými faktory než s cystoplastikou [58]. Dále zdůrazňují, že karcinom močového měchýře u pacientů se spina bifida (bez ohledu na to, zda tito podstupující augmentaci, či nikoli), je agresivní povahy [78]. Toto zjištění je v ostrém rozporu s typickým karcinomem močového měchýře u dospělých pacientů, u nichž je obvykle přítomen povrchový tumor nízkého grade [60]. Jiné studie zdůrazňují přítomnost dalších významných rizikových faktorů u této populace pacientů: kouření, transplantace ledviny, anamnéza exstrofie močového měchýře a neurogenní dysfunkce močového měchýře [53,59]. Tato problematika evidentně vyžaduje další výzkum.
ZÁVĚR
Augmentační cystoplastika představuje významnou modalitu v pediatrické urologii při léčbě pacientů se závažnou dysfunkcí močového měchýře refrakterního na medikamentózní léčbu. Navzdory vynikajícím výsledkům je augmentace močového měchýře spojena s výskytem komplikací. Byla prokázána souvislost mezi augmentační cystoplastikou a poruchami elektrolytové a acidobazické rovnováhy, nedostatkem vitaminů, osteopatií, a co je možná největší obavou – potenciálním rizikem maligní degenerace. Znalost krátkodobých i dlouhodobých metabolických a maligních důsledků augmentace močového měchýře u dětí je nezbytná pro adekvátní vyšetření a léčbu komplikovaných problémů, které se často u těchto pacientů vyskytují.
Paul J Kokorowski, MD, MPH
Jonathan Routh, MD, MPH
Children’s Hospital BostonHarvard Medical SchoolBoston, MA, USA
jon.routh@gmail.com
Zdroje
1. Lendvay TS, Cowan CA, Mitchell MM et al. Augmentation cystoplasty rates at children’s hospitals in the United States: a pediatric health information system database study. J Urol 2006; 176 (4 Pt 2): 1716–1720.
2. Purves JT, Baird AD, Gearhart JP. The modern staged repair of bladder exstrophy in the female: a contemporary series. J Pediatr Urol 2008; 4(2): 150–153.
3. Bellinger MF. Ureterocystoplasty: a unique method for vesical augmentation in children. J Urol 1993; 149(4): 811–813.
4. Atala A, Bauer SB, Soker S et al. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet 2006; 367(9518): 1241–1246.
5. Mitchell ME, Piser JA. Intestinocystoplasty and total bladder replacement in children and young adults: followup in 129 cases. J Urol 1987; 138(3): 579–584.
6. Ferris DO, Odel HM. Electrolyte pattern of the blood after bilateral ureterosigmoidostomy. J Am Med Assoc 1950; 142(9): 634–641.
7. Klein EA, Montie JE, Montague DK et al. Jejunal conduit urinary diversion. J Urol 1986; 135(2): 244–246.
8. Koch MO, McDougal WS, Hall MC et al. Long-term metabolic effects of urinary diversion: a comparison of myelomeningocele patients managed by clean intermittent catheterization and urinary diversion. J Urol 1992; 147(5): 1343–1347.
9. Adams RC, Vachha B, Samuelson ML et al. Incidence of new onset metabolic acidosis following enteroplasty for myelomeningocele. J Urol 2010; 183(1): 302–305.
10. Dunn SR, Farnsworth TA, Karunaratne WU. Hypokalaemic, hyperchloraemic metabolic acidosis requiring ventilation. Anaesthesia 1999; 54(6): 566–568.
11. DeFoor WR, Heshmat S, Minevich E et al. Long-term outcomes of the neobladder in pediatric continent urinary reconstruction. J Urol 2009; 181(6): 2689–2693.
12. Metcalfe PD, Cain MP, Kaefer M et al. What is the need for additional bladder surgery after bladder augmentation in childhood? J Urol 2006; 176 (4 Pt 2): 1801–1805.
13. McDougal WS. Metabolic complications of urinary intestinal diversion. J Urol 1992; 147(5): 1199–1208.
14. Mingin GC, Nguyen HT, Mathias RS et al. Growth and metabolic consequences of bladder augmentation in children with myelomeningocele and bladder exstrophy. Pediatrics 2002; 110(6): 1193–1198.
15. Whitmore WF 3rd, Gittes RF. Reconstruction of the urinary tract by cecal and ileocecal cystoplasty: review of a 15-year experience. J Urol 1983; 129(3): 494–498.
16. Koch MO, McDougal WS, Reddy PK et al. Metabolic alterations following continent urinary diversion through colonic segments. J Urol 1991; 145(2): 270–273.
17. Stein R, Fisch M, Andreas J et al. Whole-body potassium and bone mineral density up to 30 years after urinary diversion. Br J Urol 1998; 82(6): 798–803.
18. Koch MO, McDougal WS. Nicotinic acid: treatment for the hyperchloremic acidosis following urinary diversion through intestinal segments. J Urol 1985; 134(1): 162–164.
19. Koch MO, McDougal WS. Chlorpromazine: adjuvant therapy for the metabolic derangements created by urinary diversion through intestinal segments. J Urol 1985; 134(1): 165–169.
20. Kispal Z, Balogh D, Erdei O et al. Complications after bladder augmentation or substitution in children: a prospective study of 86 patients. BJU Int 2011; 108(2): 282–289.
21. Metcalfe PD, Casale AJ, Kaefer MA et al. Spontaneous bladder perforations: a report of 500 augmentations in children and analysis of risk. J Urol 2006; 175(4): 1466–1470.
22. Chadwick Plaire J, Snodgrass WT, Grady RW et al. Long-term followup of the hematuria-dysuria syndrome. J Urol 2000; 164 (3 Pt 2): 921–923.
23. Kurzrock EA, Baskin LS, Kogan BA. Gastrocystoplasty: long-term followup. J Urol 1998; 160 (6 Pt 1): 2182–2186.
24. Plawker MW, Rabinowitz SS, Etwaru DJ et al. Hypergastrinemia, dysuria-hematuria and metabolic alkalosis: complications associated with gastrocystoplasty. J Urol 1995; 154 (2 Pt 1): 546–549.
25. Nguyen DH, Bain MA, Salmonson KL et al. The syndrome of dysuria and hematuria in pediatric urinary reconstruction with stomach. J Urol 1993; 150 (2 Pt 2): 707–709.
26. DeFoor W, Minevich E, Reeves D et al. Gastrocystoplasty: long-term followup. J Urol 2003; 170 (4 Pt 2): 1647–1649.
27. Mingin GC, Stock JA, Hanna MK. Gastrocystoplasty: long-term complications in 22 patients. J Urol 1999; 162 (3 Pt 2): 1122–1125.
28. Adams MC, Mitchell ME, Rink RC. Gastrocystoplasty: an alternative solution to the problem of urological reconstruction in the severely compromised patient. J Urol 1988; 140 (5 Pt 2): 1152–1156.
29. Sheldon CA, Gilbert A, Wacksman J et al. Gastrocystoplasty: technical and metabolic characteristics of the most versatile childhood bladder augmentation modality. J Pediatr Surg 1995; 30(2): 283–287.
30. Gong EM, MacClellan DL, Retik AB et al. Composite gastric-enteral bladder augmentation is a safe adjunct for pediatric urinary tract reconstruction. World Congress of Pediatric Urology; 2010 May 28–30; San Francisco, CA, USA.
31. Burgu B, Gökce Mí, Aydog˘du Ö et al. Combining gastric and ileal segments, does it overcome segment-related complications? An experimental study on rats. Urol Res 2011; 39(1): 39–44.
32. Gilbert SM, Hensle TW. Metabolic consequences and long-term complications of enterocystoplasty in children: a review. J Urol 2005; 173(4): 1080–1086.
33. Fontaine E, Barthelemy Y, Houlgatte A et al. Twenty-year experience with jejunal conduits. Urology 1997; 50(2): 207–213.
34. Blackburn SC, Parkar S, Prime M et al. Ileal bladder augmentation and vitamin B12: Levels decrease with time after surgery. J Pediatr Urol 2010 (In press).
35. Rosenbaum DH, Cain MP, Kaefer M et al. Ileal enterocystoplasty and B12 deficiency in pediatric patients. J Urol 2008; 179(4): 1544–1547.
36. Stein R, Lotz J, Andreas J et al. Long-term metabolic effects in patients with urinary diversion. World J Urol 1998; 16(4): 292–297.
37. Albert CM, Cook NR, Gaziano JM et al. Effect of folic acid and B vitamins on risk of cardiovascular events and total mortality among women at high risk for cardiovascular disease: a randomized trial. JAMA 2008; 299(17): 2027–2036.
38. Armitage JM, Bowman L, Clarke RJ et al.; Study of the Effectiveness of Additional Reductions in Cholesterol and Homocysteine (SEARCH) Collaborative Group. Effects of homocysteine-lowering with folic acid plus vitamin B12 vs placebo on mortality and major morbidity in myocardial infarction survivors: a randomized trial. JAMA 2010; 303(24): 2486–2494.
39. Martí-Carvajal AJ, Solà I, Lathyris D et al. Homocysteine lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev 2009; (4): CD006612.
40. VanderBrink BA, Cain MP, King S et al. Is oral vitamin B(12) therapy effective for vitamin B(12) deficiency in patients with prior ileocystoplasty? J Urol 2010;184 (4 Suppl): 1781–1785.
41. Hossain M. The osteomalacia syndrome after colocystoplasty; a cure with sodium bicarbonate alone. Br J Urol 1970; 42(2): 243–245.
42. Specht EE. Rickets following ureterosigmoidostomy and chronic hyperchloremia. A case report. J Bone Joint Surg Am 1967; 49(7): 1422–1430.
43. Abes M, Sarihan H, Madenci E. Evaluation of bone mineral density with dual X-ray absorptiometry for osteoporosis in children with bladder augmentation. J Pediatr Surg 2003; 38(2): 230–232.
44. Boylu U, Horasanli K, Tanriverdi O et al. Evaluation of bone mineral density after ileocystoplasty in children with and without myelomeningocele. Pediatr Surg Int 2006; 22(4): 375–379.
45. Hafez AT, McLorie G, Gilday D et al. Long-term evaluation of metabolic profile and bone mineral density after ileocystoplasty in children. J Urol 2003; 170 (4 Pt 2): 1639–1641.
46. Taskinen S, Fagerholm R, Mäkitie O. Skeletal health after intestinal bladder augmentation: findings in 54 patients. BJU Int 2007; 100(4): 906–910.
47. Feng AH, Kaar S, Elder JS. Influence of enterocystoplasty on linear growth in children with exstrophy. J Urol 2002; 167(6): 2552–2555.
48. Gros DA, Dodson JL, Lopatin UA et al. Decreased linear growth associated with intestinal bladder augmentation in children with bladder exstrophy. J Urol 2000; 164 (3 Pt 2): 917–920.
49. Taskinen S, Mäkitie O, Fagerholm R. Intestinal bladder augmentation at school age has no adverse effects on growth. J Pediatr Urol 2008; 4(1): 40–42.
50. Pickard R. Tumour formation within intestinal segments transposed to the urinary tract. World J Urol 2004; 22(3): 227–234.
51. Austen M, Kälble T. Secondary malignancies in different forms of urinary diversion using isolated gut. J Urol 2004; 172(3): 831–838.
52. Gittes RF. Carcinogenesis in ureterosigmoidostomy. Urol Clin North Am 1986; 13(2): 201–205.
53. Husmann DA, Rathbun SR. Long-term follow up of enteric bladder augmentations: The risk for malignancy. J Pediatr Urol 2008; 4(5): 381–385.
54. Soergel TM, Cain MP, Misseri R et al. Transitional cell carcinoma of the bladder following augmentation cystoplasty for the neuropathic bladder. J Urol 2004; 172 (4 Pt 2): 1649–1651.
55. Castellan M, Gosalbez R, Perez-Brayfield M et al. Tumor in bladder reservoir after gastrocystoplasty. J Urol 2007; 178 (4 Pt 2): 1771–1774.
56. Vemulakonda VM, Lendvay TS, Shnorhavorian M et al. Metastatic adenocarcinoma after augmentation gastrocystoplasty. J Urol 2008; 179(3): 1094–1096.
57. Metcalfe PD, Cain MP, Kaefer M et al. What is the need for additional bladder surgery after bladder augmentation in childhood? J Urol 2006; 176 (4 Pt 2): 1801–1805.
58. Austin JC, Elliott S, Cooper CS. Patients with spina bifida and bladder cancer: atypical presentation, advanced stage and poor survival. J Urol 2007; 178 (3 Pt 1): 798–801.
59. Husmann DA. Malignancy after gastrointestinal augmentation in childhood. Therapeutic Advances in Urology 2009; 1(1): 5–11.
60. Higuchi TT, Granberg CF, Fox JA et al. Augmentation cystoplasty and risk of neoplasia: fact, fiction and controversy. J Urol 2010; 184(6): 2492–2496.
61. Higuchi TT, Husmann DA. The use of annual endoscopy and urine cytology for bladder tumor surveillance following enteric augmentation cystoplasty. J Urol 2009; 181 : 403.
62. Kokorowski PJ, Routh JC, Estrada CR et al. Screening for malignancy after augmentation cystoplasty: a decision analysis. American Academy of Pediatrics, Section on Urology Scientific Program; 2010 Oct 2–4; San Francisco, CA, USA.
63. Sung MT, Zhang S, Lopez-Beltran A et al. Urothelial carcinoma following augmentation cystoplasty: An aggressive variant with distinct clinicopathological characteristics and molecular genetic alterations. Histopathology 2009; 55(2): 161–173.
64. Gepi-Attee S, Ganabathi K, Abrams PH et al. Villous adenoma in augmentation colocystoplasty: A case report and discussion of the pathogenesis. J Urol 1992; 147(1): 128–130.
65. Venn SN, Mundy AR. Long-term results of augmentation cystoplasty. Eur Urol 1998; 34 (Suppl 1): 40–42.
66. Metcalfe PD, Rink RC. Bladder augmentation: Complications in the pediatric population. Curr Urol Rep 2007; 8(2): 152–156.
67. Kälble T. The risk of malignancy after cystoplasty. Curr Opin Urol 1993; 3 : 476–479.
68. Harzmann R, Weckermann D. Problem of secondary malignancy after urinary diversion and enterocystoplasty. Scand J Urol Nephrol Suppl 1992; 142 : 56.
69. Moudouni SM, Ennia I, Turlin B et al. [Carcinoma as a late complication of ileocystoplasty for tuberculous bladder.] Annales d’Urologie 2003; 37(1): 33–35. In French.
70. Woodhouse CR; British Society for Gastroenterology; Association of Coloproctology for Great Britain and Ireland. Guidelines for monitoring of patients with ureterosigmoidostomy. Gut 2002; 51 (Suppl 5): V15–16.
71. Harzmann R, Weckermann D. Problem of secondary malignancy after urinary diversion and enterocystoplasty. Scand J Urol Nephrol Suppl 1992; 142 : 56.
72. Vajda P, Kaiser L, Magyarlaki T et al. Histological findings after colocystoplasty and gastrocystoplasty. J Urol 2002; 168(2): 698–701.
73. North AC, Lakshmanan Y. Malignancy associated with the use of intestinal segments in the urinary tract. Urol Oncol 2007; 25(2): 165–167.
74. Shokeir AA, Shamaa M, el-Mekresh MM et al. Late malignancy in bowel segments exposed to urine without fecal stream. Urology 1995; 46(5): 657–661.
75. Yang CC, Clowers DE. Screening cystoscopy in chronically catheterized spinal cord injury patients. Spinal Cord 1999; 37(3): 204–207.
76. Hamid R, Bycroft J, Arya M et al. Screening cystoscopy and biopsy in patients with neuropathic bladder and chronic suprapubic indwelling catheters: is it valid? J Urol 2003; 170 (2 Pt 1): 425–427.
77. Navon JD, Soliman H, Khonsari F et al. Screening cystoscopy and survival of spinal cord injured patients with squamous cell cancer of the bladder. J Urol 1997; 157(6): 2109–2111.
78. Austin JC. Long-term risks of bladder augmentation in pediatric patients. Curr Opin Urol 2008; 18(4): 408–12.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2011 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Možnosti a místo chirurgické léčby superficiálního karcinomu močového měchýře
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Ileální neovezika a její varianty
- Karcinom močového měchýře – nejnovější poznatky v oblasti operační a medikamentózní léčby
- Chemoterapie u invazivního a metastatického nádoru močového měchýře
- Metabolické a maligní důsledky augmentace močových cest u dětí
- Role botulotoxinu při léčbě dysfunkce dolních cest močových u pacientů s roztroušenou sklerózou
- Ze zahraničních periodik
- Úvodník
- EAU Guidelines pro léčbu uroteliálního karcinomu močového měchýře, který neinvaduje svalovinu - aktualizovaná verze z roku 2011
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ileální neovezika a její varianty
- Intravezikální instilační terapie povrchového karcinomu močového měchýře
- Léčba metastazujícího karcinomu močového měchýře a karcinomu invadujícího svalovinu - aktualizovaná verze EAU Guidelines
- Možnosti neinvazivní diagnostiky a monitorace karcinomů močového měchýře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



