-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostika karcinomu prostaty a role PCA3
DIAGNOSIS OF PROSTATE CANCER AND PCA3
Although PSA screening plays a key role in increased prostate cancer detection, PSA, as a diagnostic and prognostic marker, is not specific for prostate cancer. Investigators are thus trying to identify markers, which would be specific for prostate cancer and would improve the accuracy of prostate cancer detection. Significant over-expression of PCA3 found in prostate tumors indicates its potential as a diagnostic biomarker. The author of this article is presenting a comprehensive overview of the role of PCA3 in prostate cancer detection and prediction and its use as a valuable tool in clinical practice.
Key words:
PCA3, biomarker, prostate cancer detection
Autoři: J. A. Schalken
Působiště autorů: Department of Urology, University Hospital Nijmegen, Geert, The Netherlands
Vyšlo v časopise: Urol List 2010; 8(1): 15-21
Souhrn
Ačkoli v rámci detekce karcinomu prostaty hraje PSA screening významnou roli, prostatický specifický antigen jakožto diagnostický a prognostický marker není specifický pro karcinom prostaty. Je tedy snahou vědců identifikovat takové markery, které budou specifické pro karcinom prostaty a pomohou zvýšit přesnost jeho detekce. Signifikantní exprese PCA3 v prostatě svědčí o jeho možném využití jako diagnostického biomarkeru. Autor článku předkládá podrobný přehled využití genu PCA3 pro detekci a predikci karcinomu prostaty v klinické praxi.
Klíčová slova:
PCA3, biomarker, detekce karcinomu prostatyÚVOD
Ročně je diagnostikováno v USA 186 320 nových případů karcinomu prostaty (v Evropě 345 900 případů) a přibližně 28 660 amerických mužů každý rok (a 87 400 Evropanů) na toto onemocnění zemře [1–2]. Časná detekce karcinomu prostaty závisí na testování hladiny PSA v séru a digitálním rektálním vyšetřením (DRE). Od doby první klinické aplikace představuje hladina PSA v séru nejcennější pomůcku pro detekci, určování stadia a monitorování tohoto onemocnění. Ačkoli rutinní testování PSA v séru jistě přispělo ke zvýšení detekce karcinomu prostaty, jednou z hlavních nevýhod této strategie je její nedostatečná specifita, která má za následek vysokou míru negativního výsledku biopsie. To platí zejména u pacientů s hladinou PSA 3–10 ng/ml, u nichž se míra negativního výsledku biopsie pohybuje v rozmezí 60–75 % [3]. Specifita tohoto testu je však nízká vzhledem k tomu, že zvýšená hladina PSA v séru nepředstavuje stav specifický výhradně pro karcinom prostaty – vyšší hladina se může vyskytovat rovněž u mužů s benigní prostatickou hyperplazií (BPH) nebo prostatitidou. Přestože je biopsie prostaty považována v diagnostice karcinomu prostaty za zlatý standard, má svá omezení a může být spojena s morbiditou. Metody zvyšující specifitu PSA pomáhají klinickým lékařům při rozhodování o tom, u kterých pacientů indikovat biopsii prostaty, nemusí však nutně zvyšovat přesnost diagnostiky onemocnění ani usnadňovat volbu optimální léčby. Je tedy nezbytné vyvinout přesnější testy, které umožní pacienty rozdělit na základě rizika vzniku karcinomu prostaty a identifikovat ty jedince, u nichž bude nezbytné opakované provedení biopsie. Testování markerů specifických pro karcinom prostaty z tělesných tekutin nám umožní zvýšit specifitu diagnostiky karcinomu prostaty. Doposud již byla identifikována řada podobných biomarkerů. PCA3 (gen 3 karcinomu prostaty) byl kriticky hodnocen a byl klinicky zkoumán jeho diagnostický potenciál [4–5]. Tento článek přináší přehledné informace týkající se PCA3 od jeho identifikace a systematické a kritické analýzy po vytvoření molekulární eseje ze vzorku tělesných tekutin, který představuje užitečnou pomůcku pro predikci výsledku biopsie.
IDENTIFIKACE A CHARAKTERISTIKA
V roce 1999 byl pomocí diferenciální display analýzy (techniky užívané ke srovnání typu exprese mRNA tumoru a přilehlých non-neoplastických tkání ze vzorků získaných při radikální prostatektomii) identifikován nový gen specifický pro prostatu [6]. Analýza RNA (Northern blot analysis) prokázala u karcinomu prostaty (ve srovnání s normální prostatickou tkání u stejného pacienta) významnou over-expresi DD3 (diferenciální displej klon 3). Podle současného názvosloví užívaného pro lidský genom byl gen přejmenován na PCA3. Tento název vystihuje jeho souvislost s karcinomem prostaty. U normální prostatické tkáně a tkáně prostaty s BPH (benigní prostatickou hyperplazií) byla zjištěna nízká exprese PCA3. Naopak nadměrná exprese genu PCA3 byla prokázána u 95 % vzorků primárního karcinomu prostaty. RT-PCR (polymerázová řetězová reakce spojená s reverzní transkripcí) prokázala, že gen PCA3 je specifický pro prostatickou žlázu vzhledem k tomu, že v žádné jiné normální lidské tkáni, karcinomech prsu, čípku, endometria, vaječníků, varlete, ani v buňkách pocházejících z karcinomu močového měchýře, ledviny a vaječníků nebyla jeho exprese detekována. Exprese PCA3 byla zjištěna pouze ve dvou buněčných liniích karcinomu prostaty – LNCaP a 22Rv1 [6].
Gen dekódující PCA3 mapuje chromozom 9q21–22 a je tvořen čtyřmi exony. Molekulární charakteristika transkripční jednotky PCA3 prokázala, že alternativní polyadenylace na třech různých pozicích v exonu 4 vede ke vzniku tří transkriptů rozdílných velikostí. Dále dochází k alternativnímu spojování, kdy je vynechán exon 2 (přítomný pouze u 5 % transkriptů). Nejčastěji se vyskytující transkript (který představuje přibližně 60 % všech analyzovaných cDNA klonů) obsahuje exony 1, 3, 4a a 4b (schéma 1) [6]. ORF (otevřený čtecí rámec – „open reading frame“) analýza prokázala, že PCA3 exony jsou osazeny neobvyklým počtem stop-kodonů. Gen kódující proteiny bude obvykle obsahovat jeden dlouhý otevřený čtecí rámec omezený stop-kodónem. Velký počet stop-kodónů napříč všemi třemi čtecími rámci PCA3 a nedostatek rozšířených otevřených čtecích rámců prokazuje, že PCA3 nedekóduje protein a funguje jako nekódující RNA.
Schéma 1. Struktura transkripční jednotky PCA3. Gen dekódující PCA3 mapuje chromozom 9q21-22 a je tvořen čtyřmi exony. Alternativní polyadenylace na třech různých pozicích v exonu 4 (označeny jako 4a–4c) vede ke vzniku tří transkriptů rozdílných velikostí. Dochází k alternativnímu spojování, kdy je vynechán exon 2 (přítomný pouze u 5 % transkriptů). Nejčastěji se vyskytující transkript obsahuje exony 1, 3, 4a a 4b [6]. ![Schéma 1. Struktura transkripční jednotky PCA3. Gen dekódující PCA3 mapuje chromozom 9q21-22 a je tvořen čtyřmi exony. Alternativní polyadenylace na třech různých pozicích v exonu 4 (označeny jako 4a–4c) vede ke vzniku tří transkriptů rozdílných velikostí. Dochází k alternativnímu spojování, kdy je vynechán exon 2 (přítomný pouze u 5 % transkriptů). Nejčastěji se vyskytující transkript obsahuje exony 1, 3, 4a a 4b [6].](https://pl-master.mdcdn.cz/media/image/48cf7ad79fb5db2a8b29dcabd2e42a3c.png?version=1537790266)
DIAGNOSTICKÝ VÝZNAM PCA3
Úzká souvislost mezi nadměrnou expresí PCA3 a maligní přeměnou prostatického epitelu pomohla odhalit jeho potenciální význam jako biomarkeru pro diagnostiku karcinomu prostaty, při absenci proteinového produktu však představuje jediný využitelný substrát nebo cílovou molekulu mRNA. RNA je náchylná k degradaci zejména v biologických tekutinách, což může snižovat senzitivitu jakéhokoli testu založeného na RNA. Dobrý klinický RNA-test bude záviset na odolnosti vzorku a bude mít vysokou citlivost na jeho cíl.
V roce 2002 byla vyvinuta analýza RT-PCR v reálném čase ke kvantifikaci PCA3 mRNA ve tkáni odebraných vzorků [7]. V roce 2003 Hessels et al [8] vyvinuli senzitivní RT-PCR techniku (využívající duální time-resolved fluorescenci), exogenní interní kontrolu a externí kalibrační křivku. Obě techniky potvrdily, že PCA3 mRNA exprese je omezena na prostatickou žlázu a že v normální prostatě a prostatě s BPH je gen přítomen v nízké, kvantifikované hladině. Střední hodnota upregulace PCA3 mRNA u pacientů s karcinomem prostaty byla 66násobně vyšší než u pacientů s normální prostatickou tkání. Při užití ROC (receiver operating characteristic) křivky obě techniky prokázaly, že PCA3 má vysokou senzitivitu (0,94) i specifitu (0,98) na karcinom prostaty u vzorku karcinomu prostaty (oblast pod křivkou [AUC]) [7–9]. Střední hodnota upregulace PCA3 u vzorků prostatické tkáně, které obsahovaly < 10 % karcinomatózních buněk, byla 11násobná. Toto zjištění prokazuje, že PCA3 umožňuje detekovat malé množství buněk karcinomu prostaty na pozadí nemaligních buněk bez nutnosti mikropreparace [8]. Kombinované údaje a skutečnost, že PCA3 není obsažena v leukocytech (často přítomných v tělesných tekutinách) nasvědčuje tomu, že PCA3 je vhodný minimálně invazivní diagnostický nástroj pro detekci buněk karcinomu prostaty v tělesných tekutinách [7].
Pomocí RT-PCR PCA3 testu, který vyvinuli Hessels et al [8], byl hodnocen význam PCA3 při detekci buněk karcinomu prostaty v močovém sedimentu po DRE, a to vzhledem k předpokladu, že manipulace s prostatou vyvolá přesun karcinomatózních buněk skrze prostatické dukty do močové trubice. První vzorek moči odebraný hned po DRE obsahuje nejvyšší koncentraci sekretu z prostaty a močové trubice [10]. Močový sediment však kromě karcinomatózních buněk obsahuje rovněž non-neoplastické prostatické buňky a uroteliální buňky. K normalizaci počtu prostatických buněk byla užita PSA mRNA vzhledem k tomu, že bylo prokázáno, že jeho exprese je poměrně konstantní jak v normálních buňkách prostaty, tak v karcinomatózních buňkách [11]. Po DRE byla ve vzorku močového sedimentu stanovena hladina PCA3 i PSA mRNA [8]. PCA3 skóre vyjadřuje poměr PCA3: PSA mRNA, vynásobený tisícem. Ve skupině 108 pacientů, kteří podstoupili biopsii prostaty na základě hladiny PSA ≥ 3 ng/ml, byl při biopsii detekován karcinom u 24 mužů. Při užití biopsie prostaty jako zlatého standardu prokázala ROC analýza AUC = 0,72 (95 % CI 0,58–0,85). RT-PCR PCA3 test umožňuje detekovat karcinom prostaty se 67% senzitivitou a 83% specifitou [8]. Pro srovnání – specifita měření PSA v séru je 22 %. Tato studie jako první prokázala schopnost kvantitativního PCA3 močového testu predikovat výsledek biopsie. Při tomto testu lze rovněž užít prostatickou tekutinu hned po DRE, což zajišťuje specifitu a senzitivitu srovnatelnou se vzorkem moči [12]. Nizozemská multicentrická studie testující vzorek močového sedimentu po DRE u 583 mužů s PSA v rozmezí 3–15 ng/ml, prokázala následující AUC 0,66 (95 % CI 0,61–0,71) pro PCA3 a 0,57 (95 % CI 0,52–0,63) pro PSA v séru [13]. V tomto případě měl test 65% senzitivitu a 66% specifitu (vs 65 % a 47 % u PSA), což potvrzuje skutečnost, že PCA3 test může zvýšit specifitu diagnostiky karcinomu prostaty.
PCA3 TEST ZALOŽENÝ NA TMA
Ačkoli RT-PCR test z moči prokázal potenciál PCA3 při diagnostice karcinomu prostaty, užívaná metodologie byla příliš intenzivní a časově náročná na to, aby mohla být zařazena do běžné praxe klinických laboratoří, a omezuje tedy provádění testu pouze na výzkumné laboratoře. Dále je nutné standardizovat podmínky pro odběr a stabilizaci vzorků. Gen-Probe Inc tedy změnili původní RT-PCR PCA3 test ze vzorku na TMA (transcription-mediated amplification) platformu [14]. Tato technologie je snadná, rychlá a dostatečně senzitivní pro užití v klinické laboratoři. TMA platforma je komerčně k dispozici pro několik produktů s licencí FDA a řada laboratoří po celém světě již disponuje nezbytným vybavením.
Odběr vzorků a metody
TMA platforma zahrnuje přípravu vzorku, amplifikaci a detekci. Při technologii se užívá první vzorek moči odebraný po DRE [3] (tři stlačení každého laloku prostaty). Proces zpracování vzorku je usnadněn užitím moči namísto močového sedimentu. Buňky jsou lyzovány a RNA stabilizována prostřednictvím smíchání vzorku moči se stejným objemem stabilizačního pufru na bázi detergentu. Zpracovaný vzorek je při pokojové teplotě přemístěn do testovací laboratoře, případně může být ve zmraženém stavu uchován po delší dobu. Hladina PCA3 a PSA mRNA se stanoví pomocí podobných protokolů a reagens, pouze některé složky jsou specifické pro jednotlivé agens. Cílová mRNA je očištěna magnetickými částicemi potaženými oligonukleotidy (které jsou specifické pro daný cíl), amplifikována pomocí TMA a amplifikované produkty jsou detekovány pomocí chemiluminiscentních DNA sond v hybridizační ochranné eseji. Všechny fáze se odehrávají v jediné zkumavce, celý test trvá méně než 6 hod [14].
Výsledky testu
Analytický význam TMA PCA3 testu byl podrobně zkoumán. Některé studie uvádějí, že > 95 % vzorků odebraných po DRE obsahovalo dostatečnou RNA pro rozbor, ve srovnání s pouze 80 % ve vzorku ranní moči nebo 74 % ve vzorku odebraném před DRE [15], což prokazuje, že jakákoli manipulace s prostatou poskytne dostatečné množství buněk ve vzorku moči, aby měl vzorek dostatečnou výpovědní hodnotu. Intra-run a inter-run koeficienty variance pro stanovení hladiny PCA3 a PSA mRNA byly nízké (< 13 % a < 12 %, v tomto pořadí) [14]. Tyto údaje byly potvrzeny, dále byla prokázána malá odlišnost mezi jednotlivými výzkumy (< 9 %), což prokazuje vhodnost testu v rámci jednotlivých výzkumů i napříč jednotlivými výzkumnými centry [15–16].
Přesnost a snadnost užívání TMA PCA3 testu přestavují klíčové faktory pro jeho implementaci do klinické praxe. Objem RNA (tzn. dostatečný počet prostatických buněk) ve vzorku podmiňuje užitečnost testu, jedná se tedy o významný parametr. Účinnost TMA testu spočívá ve zjednodušení procesu zpracování vzorku, kdy je užit celý vzorek moči a nikoli pouze močový sediment, a rovněž účinnějším zachycení mRNA (tzn. odstranění inhibičních substancí v rámci první fáze testu) a amplifikační technologii [14]. V případě nedostatečného objemu RNA ve vzorku moči musí pacient podstoupit opakovaný odběr, což je nevyhovující jak pro zdravotnický systém, tak pro samotného pacienta, který musí podstoupit opakované DRE.
PCA3 JAKO PREDIKÁTOR VÝSLEDKU BIOPSIE
V roce 2006 byly pomocí kvantitativního TMA PCA3 testu hodnoceny vzorky moči odebrané okamžitě po DRE u pacientů, u nichž byla indikována biopsie prostaty (populace pacientů před podstoupením biopsie), mužů po radikální prostatektomii a zdravých mužů bez jakýchkoli rizikových faktorů pro karcinom prostaty [14]. Střední hodnota PCA3 skóre u pacientů před biopsií, u nichž biopsie později prokázala pozitivní výsledek, pacientů před biopsií, u nichž biopsie později prokázala negativní výsledek, a zdravých mužů byla významně odlišná (p < 0,001), což potvrzuje dřívější údaje [8,13]. Nejvyšší diagnostické přesnosti u pacientů před biopsií bylo dosaženo při užití PCA3 skóre = 50 jako hraniční hodnoty. Tento test umožňoval detekci karcinomu prostaty s 69% senzitivitou a 79% specifitou. Specifita PSA (při stejné senzitivitě) byla v této skupině pouze 60 %. Navzdory odlišné metodologii bylo klinické provedení srovnatelné s výše popsaným kvantitativním RT-PCR PCA3 testem (tab. 1) [8,13]. Tyto výsledky potvrdily tři nezávislé studie, užívající jako hraniční hodnotu PCA3 skóre = 35 [17–19]. Dále prokázaly, že u pacientů se zvýšenou hladinou PSA v séru a negativním výsledkem biopsie koreluje riziko pozitivního výsledku biopsie s PCA3 skóre. Deras et al [18] prokázali, že muži s PCA3 skóre < 5 mají 14% pravděpodobnost pozitivního výsledku biopsie, zatímco u 69 % mužů s PCA3 skóre > 100 byl při biopsii detekován karcinom. Analytické provedení a diagnostická přesnost PCA3 závisela na hladině PSA v séru a na skutečnosti, zda jedinec podstoupil první nebo opakovanou biopsii. PCA3 skóre nezáviselo na objemu prostaty a žádným způsobem nesouviselo s Glesonovým skóre stanoveným na základě vzorku biopsie.
Tab. 1. Výsledky PCA3 testu ze vzorku moči (různé metodologie) při predikci výsledku biopsie. 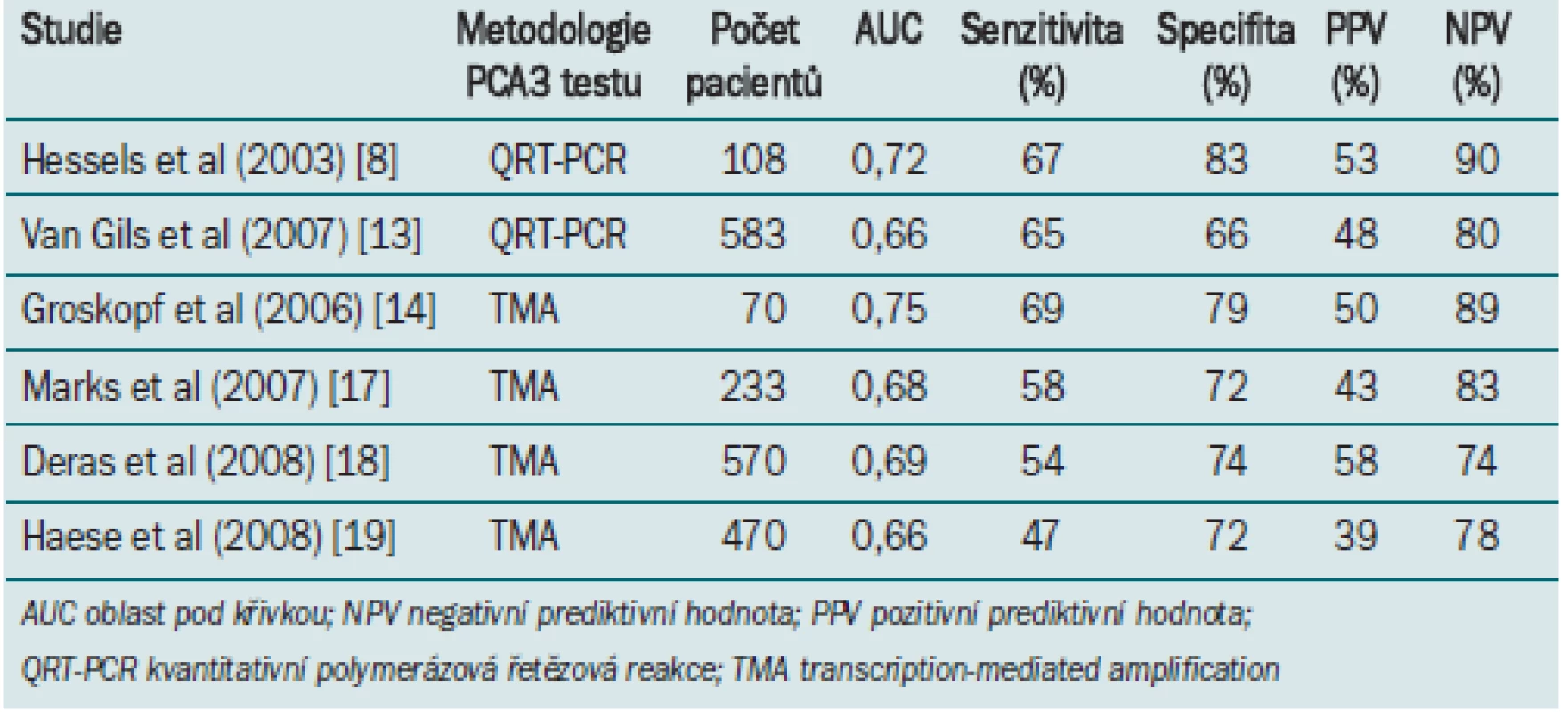
Ke zvýšení specifity detekce karcinomu prostaty se často užívá poměr volného PSA ku celkovému PSA (%fPSA). Studie Haese et al [19] prokázala vyšší diagnostickou přesnost PCA3 pro predikci výsledku opakované biopsie než %fPSA. Při užití hraniční hodnoty PCA3 = 35, měl PCA3 47% senzitivitu a 72% specifitu. Specifita %fPSA (hraniční hodnota: 25 %) byla v tom to případě pouze 23 %. Tři nezávislé studie prokázaly, že u mužů, kteří podstupují opakovanou biopsii prostaty, dosahuje PCA3 při predikci výsledku biopsie lepších výsledků než hladina PSA v séru nebo %fPSA [17–19].
KOMBINACE PCA3 S DALŠÍMI FAKTORY
Kombinace nových biomarkerů pro karcinom prostaty, jakým je například PCA3, s dalšími diagnostickými faktory, může přispět k přesnější predikci výsledku biopsie prostaty. Logistická regresní analýza prokázala, že kombinace PCA3 s faktory jako je například hladina PSA v séru, objem prostaty a nález DRE, může zvýšit diagnostickou přesnost na AUC-0,75 (ve srovnání s 0,69 při užití samotného PCA3 a 0,55 při užití PSA) [18]. Kombinace biomarkerů s dalšími diagnostickými indikátory tedy skutečně může zvyšovat přesnost diagnostiky karcinomu. Toto zjištění potvrdili Ankers et al [20] pomocí PCPT (Prostate Cancer Prevention Trial) výpočtu rizik. PCPT výpočet rizika zahrnuje šest faktorů (hladinu PSA v séru, DRE, rodinnou anamnézu karcinomu prostaty, výsledky biopsie, věk a afroamerické etnikum) pro odhad rizika vzniku karcinomu prostaty a rizika vzniku onemocnění vysokého grade (Gleasonové skóre ≥ 7). Zapojení PCA3 do výpočtu rizik vedlo k významnému zvýšení diagnostické přesnosti původního modelu. Při aplikaci u jednotlivých pacientů vedla implementace PCA3 do výpočtu rizika ke změně odhadu rizika karcinomu prostaty.
Nízké skóre PCA3 indikovalo pokles rizika pro pacienta, vysoké PCA3 skóre indikovalo zvýšení rizika vzniku karcinomu prostaty. Užijme příklad 65letého muže, u něhož byl při původním PCPT výpočtu rizika stanoven 26,5% odhad rizika. Po zahrnutí nízkého PCA3 skóre kleslo riziko na 16,9 %, zatímco po zahrnutí vysokého PCA3 skóre se riziko zvýšilo na 43,1 % [20]. Tyto údaje prokazují, že nové biomarkery jako PCA3 lze úspěšně začlenit do výpočtu rizika, a zlepšit tak detekci karcinomu prostaty.
FÚZE GENŮ PCA3 A TMPRSS2-ERG
Vzhledem k tomu, že karcinom prostaty je heterogenní onemocnění, může užívání většího počtu biomarkerů zvýšit diagnostickou přesnost. U karcinomu prostaty byla pozorována fúze 5 oblastí genu TMPRSS2 s ETS transkripčními faktory ERG, ETV1 a ETV4 [21–22]. Hessels et al [23] prokázali, že neinvazivní detekce transkriptů fúze TMPRSS2-ERG je proveditelná v močovém sedimentu vzorku odebraného hned po DRE pomocí RT-PCR testu. Díky vysoké specifitě testu (93 %) zvyšuje kombinace transkriptů fúze TMPRSS2-ERG s PCA3 senzitivitu z 62 % (samotný PCA3) na 73 % (kombinace), aniž by snižovala specifitu detekce karcinomu prostaty.
Laxman et al [24] prokázali, že SPINK1, GOLPH2 a TMPRSS2-ERG představují (stejně jako PCA3) nezávislé predikátory karcinomu prostaty při opakované biopsii. Při užití kombinace PCA3 s těmito markery v kvantitativní analýze se hodnota AUC zvýšila z 0,66 (pouze PCA3) na 0,76. Tento test ze vzorku moči měl 66% senzitivitu a 76% specifitu pro detekci karcinomu při opakované biopsii.
PCA3 JAKO PROGNOSTICKÝ INDIKÁTOR
Van Gils et al v roce 2008 hodnotili souvislost mezi PCA3 skóre a objemem tumoru při prostatektomii [25]. Autoři hledali souvislost mezi PCA3 skóre v močovém sedimentu po DRE u 62 mužů s prognostickými parametry, které se hodnotí u vzorku odebraného při radikální prostatektomii. Nebyla zjištěna žádná významná korelace mezi PCA3 a GS (p = 0,90), patologickým stadiem tumoru (p = 0,59) ani celkovým objemem tumoru (p = 0,96).
Nakanishi et al došli k o něco příznivějším výsledkům [26]. Studie zahrnovala 59 mužů, u nichž byla na základě hladiny PSA v séru > 2,5 ng/ml a/nebo abnormálního výsledku DRE indikována biopsie prostaty, a 83 mužů, u nichž byl diagnostikován karcinom prostaty, a byli kandidáty pro radikální prostatektomii. U mužů před biopsií nebyl prokázán žádný významný rozdíl mezi PCA3 skóre a GS vzorku biopsie (6 vs GS ≥ 7), což potvrdilo dřívější zjištění [18]. U vzorků odebraných během prostatektomie (p = 0,005) však byla prokázána významná souvislost mezi PCA3 skóre a objemem tumoru (p = 0,008) a GS (6 vs ≥ 7). U mužů s klinicky nesignifikantním karcinomem prostaty (objem dominantního tumoru < 0,5 ml a GS < 6) bylo PCA3 skóre významně nižší než u mužů s klinicky signifikantním karcinomem (p = 0,007). Tyto údaje nasvědčují tomu, že PCA3 skóre může pomoci při výběru vhodných kandidátů pro aktivní sledování.
Evropská multicentrická studie zahrnující 463 mužů, kteří podstoupili jednu nebo dvě biopsie s negativním výsledkem, potvrdila, že pacienti s klinicky signifikantním karcinomem prostaty mají vyšší PCA3 skóre než muži s klinicky nesignifikantním karcinomem (p = 0,0059) [19]. V této skupině pacientů bylo u mužů s tumory v klinickém stadiu T2 zaznamenáno signifikantně vyšší PCA3 skóre než u mužů s karcinomy v klinickém stadiu T1c (p = 0,005). PCA3 rovněž představoval nezávislý predikátor rozšíření tumoru mimo prostatickou žlázu (p = 0,01) a nízkého objemu tumoru (< 0,5 ml) (p = 0,04) [27]. V kombinaci s Gleasonovým skóre > 6 a předoperační hladinou PSA se ROC AUC zvýšila z 0,73 u samotného PCA3 na 0,90 pro predikci rozšíření tumoru mimo prostatu. Při užití hraniční hodnoty PCA3 skóre = 47 byla zaznamenána 57% senzitivita, 94% specifita a pozitivní predikční hodnota = 80 % pro predikci rozšíření karcinomu mimo žlázu. PCA3 tedy může být rovněž indikátorem klinického stadia a závažnosti karcinomu [26].
Výsledky ukazující na korelaci mezi PCA3 a agresivitou karcinomu lze považovat za předběžné. Nekonzistence výsledků mezi PCA3 a patologickými znaky tumoru lze vysvětlovat rozdílnou populací nebo rozdílným patologickým vyšetřováním vzorků. Jediným způsobem, jak zjistit jeho skutečnou prediktivní hodnotu, je validace v definitivních studiích.
PCA3: KLINICKÁ A BUDOUCÍ APLIKACE
Souhrn potenciálních aplikací PCA3 skóre v klinické praxi je uveden v tab. 2. PCA3 test může být nápomocný v případě, že zvažujeme provedení opakované biopsie, zejména u mužů s chronicky zvýšenou hladinou PSA v séru v důsledku chronického zánětu nebo prostatitidy. PCA3 může pomoci klasifikovat muže na základě rizika vzniku karcinomu prostaty. Negativní biopsie a nízké PCA3 skóre může být indikátorem pro volbu konzervativnějšího postupu. Na základě předběžných údajů týkajících se prognostické hodnoty PCA3 může negativní výsledek biopsie prostaty v kombinaci s vysokým PCA3 skóre indikovat nutnost detailnějšího zobrazovacího vyšetření pro lokalizaci klinicky signifikantního karcinomu prostaty. U pacienta s karcinomem prostaty a nízkým PCA3 skóre lze zvážit metodu aktivního sledování klinicky nesignifikantního tumoru. V případě pozitivního výsledku biopsie a vysokého PCA3 existuje vysoká pravděpodobnost, že detekujeme klinicky signifikantní karcinom prostaty, kdy urolog může zvážit provedení intervence.
Tab. 2. Možnosti TMA PCA3 testu v klinické praxi. 
Informace uvedené v tab. 2 vyvolávají otázku, jakou hraniční hodnotu PCA3 skóre zvolit v odlišných klinických situacích. S ohledem na identifikaci mužů s vyšší pravděpodobností pozitivního výsledku opakované biopsie umožnila hraniční hodnota v několika studiích PCA3 skóre = 35 vytvořit optimální rovnováhu mezi senzitivitou a specifitou u pacientů před biopsií [17–19].
Nízké PCA3 skóre ukazuje na nízkou pravděpodobnost karcinomu, avšak nevylučuje, že bude při biopsii detekován klinicky signifikantní karcinom. Haese et al [19] toto prokázali ve své studii: hraniční hodnota PCA3 skóre = 35 umožňuje předejít 67 % zbytečných biopsií, zatímco 21 % klinicky signifikantních karcinomů nebude identifikováno. Kdyby bylo užito PCA3 skóre = 20, vyhnuli bychom se 44 % zbytečných biopsií a nebylo by detekováno pouze 9 % klinicky signifikantních karcinomů. V této skupině byla hraniční hodnota PCA3 = 20 nejvhodnější pro předcházení zbytečným biopsiím a minimalizaci rizika přehlédnutí signifikantního karcinomu prostaty. Whitman et al [27] zjistili u skupiny pacientů před prostatektomií střední hodnotu PCA3 skóre = 26. Pokud vycházíme z definované hraniční hodnoty PCA3 skóre = 35, nebyla by polovina karcinomů v této populaci pacientů před biopsií detekována. Zda je tento rozdíl zapříčiněn vysokým procentem (25 %) afroameričanů v této populaci, není zřejmé. Afroamerické etnikum má obzvláště vysoké riziko pro vznik karcinomu prostaty. U těchto mužů byly identifikovány významné rozdíly ve frekvenci výskytu rizikových alel, což může částečně vysvětlit vyšší náchylnost ke karcinomu prostaty. Toto zjištění nasvědčuje tomu, že PCA3 skóre může být užitečnější v obou diagnostických a prognostických využitích jako spojitá proměnná v kombinaci s dalšími klinickými a/nebo patologickými údaji [18,20].
Vědci se dále snaží validovat a rozšířit klinické užití PCA3 testu. Potenciální využití zahrnují aplikaci testu před provedením první biopsie prostaty, detekci lokální recidivy po radikální prostatektomii nebo radioterapii nebo při monitorování pacientů, kteří užívají medikamentózní terapii ovlivňující hladinu PSA v séru (např. inhibitory 5-alfa-reduktázy).
Výzvou do budoucna je identifikace markerů, jež nám pomohou identifikovat přítomnost karcinomu prostaty potenciálně ohrožujícího život pacienta v kurabilním stadiu. Vzhledem k tomu, že karcinom prostaty má heterogenní povahu, poskytne nám kombinace biomarkerů (PCA3 a fúze genů TMPRSS2-ERG) větší množství informací než jediný test.
Na tkáňové úrovni je PCA3 vzhledem ke své vysoké expresi v buňkách karcinomu téměř naprosto specifický pro karcinom prostaty. V současné době probíhají studie pokoušející se vymezit rozmezí transkripčních faktorů, které reagují s PCA3 promotorem, a stanovit funkci PCA3.
ZÁVĚR
CE verze TMA PCA3 testu byla poprvé vyzkoušena na konci roku 2006, v současné době je komerčně dostupný v Evropě a USA pod obchodním názvem Progensa™ PCA3 (Gen-Probe Inc., San Diego, CA). Na rozdíl od měření hladiny PSA v séru umožňuje TMA PCA3 přímo detekovat buňky karcinomu prostaty v moči. Několik studií prokázalo, že PCA3 skóre umožňuje lépe predikovat výsledek biopsie než PSA test [8,14,17–19].
Kombinace PCA3 s fúzí genů TMPRSS2-ERG zvyšuje senzitivitu diagnostiky karcinomu prostaty, aniž by snižovala specifitu [23]. Kombinace PCA3 s dalšími diagnostickými faktory (např. hladina PSA v séru, DRE, rodinná anamnéza karcinomu prostaty v první linii, anamnéza biopsie, věk, afroamerické etnikum) [18,20] může zvyšovat přesnost diagnostiky. Předběžné údaje prokazují korelaci mezi PAC3 a GS, velikostí a klinickou závažností tumoru a rozšířením karcinomu přes kapsulu [18–19,26–27].
TMA PCA3 test je první skutečně molekulární diagnostický test (založený na RNA) specifický pro karcinom prostaty, při němž se užívá vzorek tělesné tekutiny, který mají urologové k dispozici. Tento test může pomoci při diagnostice karcinomu prostaty, slibná se zdá i jeho role prognostického indikátoru. V současné době probíhá rozbor přítomnosti dalších genetických markerů (fúze genů TTMPRSS2-ERG) v moči. Neinvazivní testování na bázi biomarkerů asistující při diagnostice karcinomu prostaty se tedy stalo realitou.
J. A. Schalken
Department of Urology,
University Hospital
Nijmegen, Geert
Grooteplein 10,
Nijmegen, NL‑6500 HB,
The Netherlands
j.schalken@ncmls.ru.nl
Zdroje
1. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2008. CA Cancer J Clin 2008; 58(2): 71–96.
2. Ferlay J, Autier P, Boniol M et al. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol 2007; 18(3): 581–592.
3. Roddam AW, Duffy MJ, Hamdy FC et al. Use of prostate-specific antigen (PSA) isoforms for the detection of prostate cancer in men with a PSA level of 2–10 ng/ml: systematic review and meta-analysis. Eur Urol 2005; 48(3): 386–399.
4. Hessels D, Verhaegh GW, Schalken JA et al. Applicability of biomarkers in the early diagnosis of prostate cancer. Expert Rev Mol Diagn 2004; 4(4): 513–526.
5. Hessels D, Rittenhouse H, Schalken J et al. Molecular diagnostics in prostate cancer. EAU Update Series 2005; 6(3): 200–213.
6. Bussemakers MJ, van Bokhoven A, Verhaegh GW et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer. Cancer Res 1999; 59(23): 5975–5979.
7. de Kok JB, Verhaegh GW, Roelofs RW et al. DD3 (PCA3), a very sensitive and specific marker to detect prostate tumors. Cancer Res 2002; 62(9): 2695 – 2698.
8. Hessels D, Klein Gunnewiek JM, van Oort I et al. DD3 (PCA3)-based molecular urine analysis for the diagnosis of prostate cancer. Eur Urol 2003; 44(1): 8–15.
9. Schalken JA, Hessels D, Verhaegh GW. New targets for therapy in prostate cancer: differential display code 3 (DD3 [PCA3]), a highly prostate cancer-specific gene. Urology 2003; 62 (5 Suppl 1): 34–43.
10. Iwakiri J, Granbois K, Wehner N et al. An analysis of urinary prostate specific antigen before and after radical prostatectomy: evidence for secretion of prostate specific antigen by the periurethral glands. J Urol 1993; 149(4): 783–786.
11. Meng FJ, Shan A, Jin L et al. The expression of a variant prostate-specific antigen in human prostate. Cancer Epidemiol Biomarkers Prev 2002; 11(3): 305–309.
12. van Gils MP, Cornel EB, Hessels D et al. Molecular PCA3 diagnostics on prostatic fluid. Prostate 2007; 67(8): 881–887.
13. van Gils MP, Hessels D, van Hooij O et al. The time-resolved fluorescence-based PCA3 test on urinary sediments after digital rectal examination; a Dutch multicenter validation of the diagnostic performance. Clin Cancer Res 2007; 13(3): 939–943.
14. Groskopf J, Aubin SM, Deras IL et al. APTIMA PCA3 molecular urine test: development of a method to aid in the diagnosis of prostate cancer. Clin Chem 2006; 52(6): 1089–1095.
15. Sokoll LJ, Ellis W, Lange P et al. A multicenter evaluation of the PCA3 molecular urine test: pre-analytical effects, analytical performance, and diagnostic accuracy. Clin Chim Acta 2008; 389(1–2): 1–6.
16. Shappell SB, Fulmer J, Arguello D et al. PCA3 urine mRNA testing for prostate carcinoma: patterns of use by community urologists and assay performance in reference laboratory setting. Urology 2009; 73(2): 363–368.
17. Marks LS, Fradet Y, Deras IL et al. PCA3 molecular urine assay for prostate cancer in men undergoing repeat biopsy. Urology 2007; 69(3): 532–535.18. Deras IL, Aubin SM, Blase A et al. PCA3: a molecular urine assay for predicting prostate biopsy outcome. J Urol 2008; 179(4): 1587–1592.
19. Haese A, de la Taille A, van Poppel H et al. Clinical utility of the PCA3 urine assay in European men scheduled for repeat biopsy. Eur Urol 2008; 54(5): 1081–1088.
20. Ankerst DP, Groskopf J, Day JR et al. Predicting prostate cancer risk through incorporation of prostate cancer gene 3. J Urol 2008; 180(4): 1303–1308.
21. Tomlins SA, Rhodes DR, Perner S et al. Recurrent fusion of TMPRSS2 and ETS transcription factor genes in prostate cancer. Science 2005; 310(5748): 644–648.
22. Tomlins SA, Mehra R, Rhodes DR et al. TMPRSS2: ETV4 gene fusions define a third molecular subtype of prostate cancer. Cancer Res 2006; 66(7): 3396–3400.
23. Hessels D, Smit FP, Verhaegh GW et al. Detection of TMPRSS2–ERG fusion transcripts and prostate cancer antigen 3 in urinary sediments may improve diagnosis of prostate cancer. Clin Cancer Res 2007; 13(17): 5103–5108.
24. Laxman B, Morris DS, Yu J et al. A first-generation multiplex biomarker analysis of urine for the early detection of prostate cancer. Cancer Res 2008; 68(3): 645–649.
25. van Gils MP, Hessels D, Hulsbergen-van de Kaa CA et al. Detailed analysis of histopathological para - meters in radical prostatectomy specimens and PCA3 urine test results. Prostate 2008; 68(11): 1215 – 1222.
26. Nakanishi H, Groskopf J, Fritsche HA et al. PCA3 molecular urine assay correlates with prostate cancer tumor volume: implication in selecting candidates for active surveillance. J Urol 2008; 179(5): 1804 – 1809.
27. Whitman EJ, Groskopf J, Ali J et al. PCA3 score before radical prostatectomy predicts extracapsular extension and tumor volume. J Urol 2008; 180 : 1975–1978.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2010 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Diagnostika karcinomu prostaty a role PCA3
- Současné klinické a patologické proměnné biopsie prostaty, které predikují významné změny grade
- Laparoskopická adrenalektomie: operační technika
- Technické aspekty provedení transperitoneální laparoskopické nefrektomie
- Laparoskopická resekce ledviny
- Rekonstrukční laparoskopie v dětské urologii
- Screening karcinomu prostaty: přehled důkazů (2009)
- Laparoskopické rekonstrukční operace na horních močových cestách u dětí – technické aspekty
- Retroperitoneoskopie
- Laparoskopická operace vedoucí k odstranění konkrementů
- Komplikace při řešení nádorů ledvin laparoskopicky
- Psychologický mechanizmus při nádorovém onemocnění a základy komunikace v jednotlivých fázích
- Výzkum výsledků zdravotní péče v oblasti urologie
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laparoskopická adrenalektomie: operační technika
- Laparoskopická resekce ledviny
- Laparoskopické rekonstrukční operace na horních močových cestách u dětí – technické aspekty
- Technické aspekty provedení transperitoneální laparoskopické nefrektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




