-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLaparoskopická resekce ledviny
LAPAROSCOPIC PARTIAL NEPHRECTOMY
With increasing detection of asymptomatic low-stage renal tumours the great importance gain miniinvasive procedures, now comparable with open procedures. Tumor is removed and most parenchymal tissue is preserved – this condition fulfils laparoscopic partial nephrectomy.
Key words:
laparoscopic partial nephrectomy, renal tumor, hemostasis
Autoři: K. Novák
Působiště autorů: Urologická klinika VFN a 1. LF UK ; Praha 2
Vyšlo v časopise: Urol List 2010; 8(1): 39-42
Souhrn
S narůstající detekcí asymptomatických nádorů ledvin nízkého stadia se stávají miniinvazivní operace rovnocennými s otevřenými operacemi. Nádor je z ledviny odstraněn a zároveň je zachováno co nejvíce funkční tkáně ledviny – tyto podmínky splňuje laparoskopická resekce ledviny.
Klíčová slova:
laparoskopická resekce ledviny, tumor ledviny, hemostázaÚVOD
Maligní nádory ledvin zahrnují kolem 3 % z incidence nádorových onemocnění a 2 % z celkové nádorové mortality [1]. Díky širokému použití moderních zobrazovacích technik (počítačová tomografie – CT, nukleární magnetická rezonance – NMR) plynule narůstá jejich detekce. Většina z nich jsou incidentálně zjištěné nádory u asymptomatických pacientů, v současnosti je přibližně 70 % z nich největším rozměrem ≤ 4 cm – tj. stadium T1a, mají často nízký maligní potenciál [2] (viz obr. 1 a 2). Právě tyto nádory jsou terapeutickým dilematem a pacienti představují zcela novou populaci prezentující se časným stadiem karcinomu ledviny (RCC – renal cell carcinoma). V mnoha případech je potom preferován aktivní přístup s odstraněním ložiska a zachováním funkčního parenchymu ledviny při nízké morbiditě výkonu. Kritéria této miniinvazivity splňuje z exstirpačních metod laparoskopická resekce ledviny (LRL).
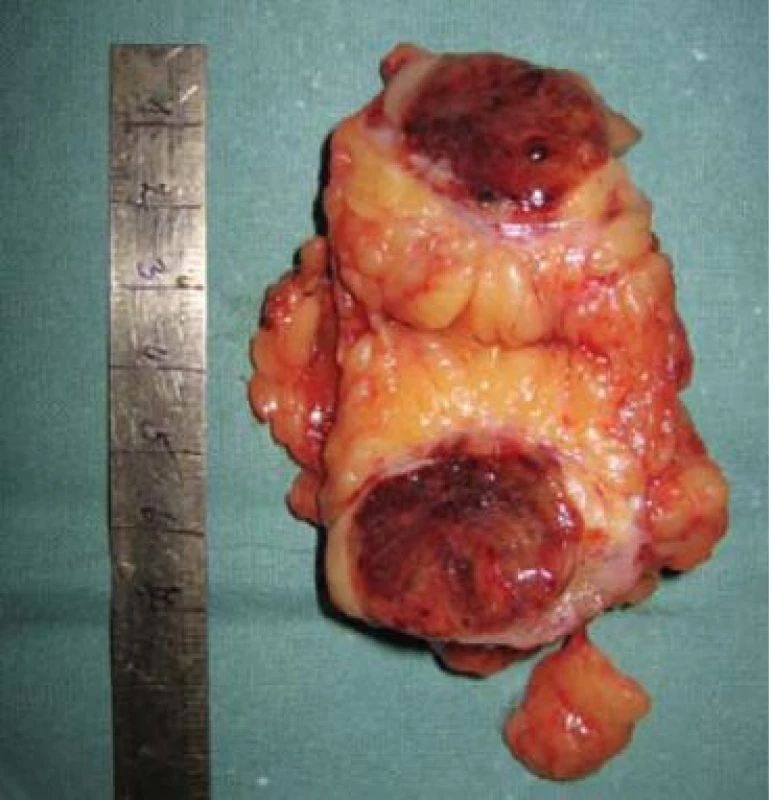
Obr. 1. Tumor dolního pólu levé ledviny indikovaný k LRL. 
Doporučeným standardem v záchovné chirurgii ledviny pro nádory velikosti pod 4 cm je klasická „otevřená“ resekce ledviny. Tento výkon má identické středně a dlouhodobé onkologické výsledky jako radikální nefrektomie, tj. odstranění celého orgánu. Resekce ledviny byla ale ještě nedávno bohužel prováděna u RCC ≤ 7 cm např. v USA jen u 9,6 % pacientů s renální malignitou [3]. S pokrokem v laparoskopické technice ale narůstá zájem o tento způsob operování. Rozšiřování indikací a výběr vhodného operačního přístupu a metody je předmětem odborné debaty. V některých centrech jsou týmž způsobem řešeny nádory ledvin i vyšších stadií (T1b – velikost 4–7 cm). Průběžná zhodnocení LRL ukazují na rovnocenné onkologické výsledky s otevřenou resekcí.
INDIKACE
LRL je minimálně invazivní alternativou k otevřené invazivní resekci ledviny. Indikace a kontraindikace jsou identické jako u „otevřené“ operace (viz tab. 1). Je třeba vážně zdůraznit, že identické indikace pro LRL a otevřené operace platí pouze pro chirurga s pokročilými laparoskopickými zkušenostmi.
Tab. 1. Indikace a kontraindikace resekce ledviny [4]. ![Indikace a kontraindikace resekce ledviny [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/09dc2668c0c8ee68dc1e1d178f9fd0ff.jpeg)
LAPAROSKOPICKÁ RESEKCE LEDVINY – VLASTNÍ OPERACE
Vlastní operace se provádí z transperitoneálního či retroperitoneálního přístupu laparoskopickou technikou. Záleží na preferenci operatéra a též na lokalizaci tumoru v ledvině. Retroperitoneální přístup má relativní nevýhodu v horší přehlednosti a menším prostoru např. při sutuře, někdy je rezervován jen pro apikální nádory horního či dolního pólu pro dobrý úhel nástrojů při sutuře, výhodou je u extrémní obezity pacienta a při intraabdominálních srůstech po břišních operacích [2]. První LRL transperitoneální cestou provedl Winfield (1993), retroperitoneoskopicky pak Gill (1994). Cílem operace je vždy dosáhnout kompletní excize tumoru v pokud možno bezkrevném poli a za spolehlivé hemostázy.
POLOHA PACIENTA
Je volena dle přístupu. U transperitoneálního přístupu je pacient v (semi)lumbotomické poloze v úhlu 45–60 °, u retroperitoneoskopického v úhlu 90 °. Rozmístění portů je individuální dle operatéra, ale při zachování zásady triangulace. Dle vlastní zkušenosti s transperitoneálním přístupem stačí vpravo čtyři porty (jeden k elevaci jater), vlevo často jen tři. Nejprve preparujeme hilové struktury, arteriální zásobení ledviny nacházíme nejčastěji dorzálně od renální žíly. Dále je ledvina dostatečně mobilizována a je identifikován tumor (možno s pomocí endoskopické ultrazvukové sondy) [5–6].
KONTROLA HILU, ISCHEMIE
Naprosto klíčovým bodem je izolace a zajištění hilu ledviny. Některé příznivě uložené tumory lze resekovat i bez jeho zajištění (malé a periferní tumory), nicméně resekce v podmínkách ischemie ledviny je častější. Na arterii (resp. arterie) se nakládá endoklip („bulldog“), někteří operatéři zajišťují celý hilus en bloc endoskopickými Satinského kleštěmi [2,4,6].
Pro další osud resekované ledviny a její budoucí funkci je rozhodující čas teplé nebo studené ischemie (TI, SI). Za kritickou dobu TI ledviny z hlediska zachování dobré funkce byl uznáván interval 30 min, tento se však dle recentních publikací zkrátil na 20 min [4,7–9]. V případě kombinace s renální hypotermií je možné tuto dobu prodloužit až na dvě hodiny, ideální je ale čas < 35 min [4,8]. SI je u LRL obtížněji proveditelná než TI, měli bychom ji zvažovat u obtížných výkonů (hilové, vícečetné komplexní tumory) tam, kde předpokládáme čas TI > 30 min [8]. Způsoby dosažení hypotermie jsou různé – nejčastější je zavedení sáčku k ledvině a jeho vyplnění ledovou tříští – 600–750 ml (Gill), kontinuální perfuzí renální arterie angiokatétrem roztokem ringerlaktátu 4 °C teplým (Janetschek) – lze dosáhnout teploty parenchymu 25 °C, retrográdním plněním dutého systému ledviny studeným fyziologickým roztokem zavedenou ureterální cévkou – teplota kortikální 24 °C, medulární 21 °C. Vzhledem k tomu, že optimální teplota k ochraně funkce ledviny je < 15 °C, tyto techniky je nutné zdokonalovat [4]. Další vliv na výslednou funkci resekované ledviny může mít způsob zajištění hilu, hypoteticky lze uvažovat o příznivé parciální oxygentaci parenchymu retrográdním venózním zpětným tokem („backflow“) při zasvorkování samotné arterie (ne kompletně celý hilus). Podobný efekt může mít venózní komprese pneumoperitoneem. Dalším příznivým vlivem je dostatečná předoperační hydratace se zajištěním dobré perfuze ledviny a diurézy. Z farmakologických možností je doporučeno peroperační podání furosemidu, podání manitolu 15–30 min před svorkováním hilu (1 ml/kg), podání inhibitoru angiotenzin-konvertujícího enzymu – enalapril 1,25 mg iv. (indukuje vazodilataci a zvýšení perfuze ledviny, je prevencí vazospazmu způsobeného ischemií a manipulací) [4,8].
Pooperační monitorování renálních funkcí je nejspolehlivější scintigrafií ledvin (MAG 3) – v praxi v intervalu do jednoho roku po LRL. V případě zdravé kontralaterální ledviny je levnější a dostatečnou metodou stanovení glomerulární filtrace vyšetřit clearance kreatininu.
RESEKCE, REKONSTRUKCE DUTÉHO SYSTÉMU, HEMOSTÁZA
Způsob vlastní resekce je různý. Obvykle je prováděna nůžkami „za studena“ s nenádorovým lemem parenchymu. Je zdůrazňován nezkreslený pohled na vitální tkáň spodiny i tumoru a možnost lepší kontroly resekční plochy, a tím radikality výkonu. Tepelné techniky resekce (harmonický skalpel, laser, elektrokauter) nejsou preferovány, mění vzhled tkáně a mohou negativně ovlivnit vizuální kontrolu roviny resekce. Na druhou stranu díky koagulaci na resekční ploše mohou redukovat riziko krvácení po reperfuzi ledviny [6].
V případě centrálně uloženého tumoru je častěji nutné rekonstruovat suturou dutý systém ledvin (většinou „Lahodny“ stehy, vicryl 2–0). Vyplatí se zavést předoperačně ureterální cévku do dutého systému a před jeho suturou aplikovat metylénovou modř ke kontrole těsnosti rekonstrukce [4].
Dalším krokem je hemostáza v oblasti resekční plochy. Zde se nabízí mnoho možností kombinovat suturu s tkáňovými lepidly a dalšími hemostatickými prostředky. Tento způsob hemostázy je nutný u téměř 4/5 LRL [10]. Používány jsou trombin v želatinové matrix – FloSeal, fibrinový gel – Tisseel, bovinní sérový albumin – BioGlue, cyanoakrylátové lepidlo - Glubran, regenerovaná metylcelulóza – Surgicel aj. Hacker popsal techniku pokračujícího stehu uzavírajícího dutý systém a působícího hemostaticky, další sutura fixuje Surgicel na resekční ploše a sbližuje parenchymové okraje, kde jsou stehy fixovány svorkami Hem-o-lock [11] (viz obr. 3). Tato technika („sliding–clip renorrhaphy“) se uplatňuje i u robotické parciální nefrektomie [12]. Podobná je technika Gilla navíc se zajištěním sutury trombinovým lepidlem (Floseal) [23]. Ke zkrácení doby TI je vhodná metoda „early unclamping“, kdy je svorka na hilu povolena již po první vrstvě hemostatické sutury. Menšinový je názor s použitím samotného lepidla (Floseal) jako jediného hemostatického způsobu zajištění resekční plochy, počet komplikací ale není vyšší než u jiných způsobů hemostázy [6,10]. Na naší klinice jsme takto též ošetřili resekční plochu u 18 LRL (viz vlastní soubor). Tento způsob umožňuje další zkrácení doby TI.
Obr. 3. Aplikace tkáňového lepidla (FloSeal) na resekční plochu. Hemostatické stehy na spodině fixované přes polymerové svorky („sliding–clip renorrhaphy“). 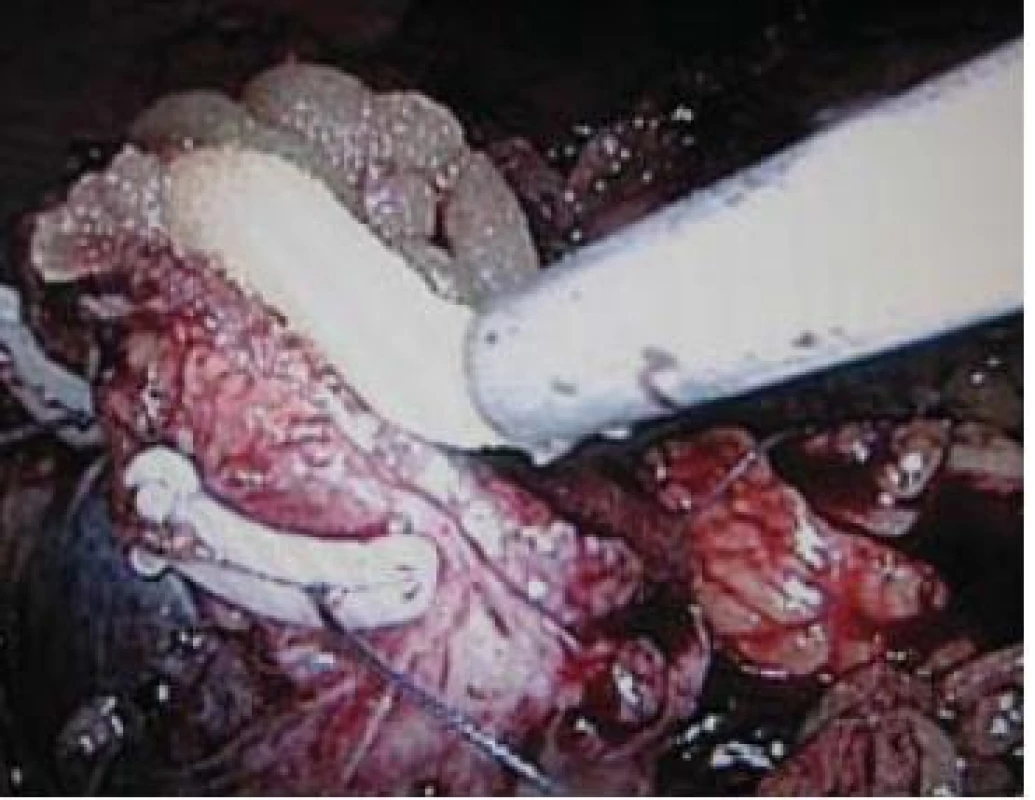
KOMPLIKACE
Četnost komplikací se snižuje se zkušeností operatéra, v první fázi i zkušení urologové popisují komplikace až u 33 % pacientů [5,14–15].
Dominantní intraoperační komplikací je krvácení, které může vést ke konverzi operace na otevřenou (cca 4 %). Krevní ztráty vyžadují substituci pouze u 3 % pacientů.
Z pooperačních komplikací je nej častější krvácení (1,5–10 %), a urinózní píštěl (2,0–10,6 %). Vyšší je výskyt u nepříznivě centrálně uložených tumorů a u vícečetných resekcí. Řešením krvácení může být substituce krve a observace, selektivní angioembolizace nebo laparoskopická či otevřená revize. Většinu urinózních píštělí lze vyřešit konzervativně optimální drenáží ureteterálním stentem, zřídka je nutná perkutánní nefrostomie. Další možnou komplikací je rozvoj arteriovenózní píštěle nebo pseudoaneuryzmatu – následkem poškození cév při sutuře dutého systému. Renální selhání je u 0,5–2 % pacientů po LRL [16].
ONKOLOGICKÉ VÝSLEDKY
Pozitivní okraje – jsou popsány u 1,8–7,0 % pacientů. Breda na souboru 855 pacientů po LRL našel u 21 (2,4 %) z nich pozitivní okraje při průměrné velikosti resekovaného tumoru 2,7 cm [17]. Frank nenašel rozdíl ve frekvenci pozitivních okrajů u centrálních nebo periferních tumorů – pozice tumoru nepředpovídá frekvenci výskytu pozitivních okrajů [18]. Na další postup u pozitivních okrajů není jednotné stanovisko – u popsaného velkého nálezu pozitivního okraje je vhodná otevřená reresekce nebo nefrektomie (i laparoskopická), u mikroskopického nálezu je na místě pozorné sledování. Ani tak pozitivní nádorové okraje nekorelují s rozvojem lokální recidivy [19]. Celková recidivita tumoru ledviny je po parciální resekci 0–6 % [20]. Frekvence pozitivních okrajů u LRL se neliší od výsledků otevřené resekce (0–14,3 %) [21].
Onkologické výsledky LRL jsou srovnatelné s otevřenými resekcemi ledviny. Nádorově specifické přežití (CSS – cancer specific survival) je 97–100 % (nejdelší studie se sledováním pět let). Gill publikoval tříleté CSS u pacientů s RCC cT1NM0 99,3 % a 99,2 % u LRL resp. otevřené resekce [21]. Ve srovnání s otevřenou resekcí ledviny se LRL odstraní více benigních patologických ložisek (26–45,6 %). To podporuje myšlenku, že indikace LRL nejsou homogenní a jsou rozšiřovány pro miniinvazivitu této metody [1].
SPECIÁLNÍ INDIKACE
- Heminefrektomie (HNE) – je definována jako resekce > 30 % renálního parenchymu. Srovnáním 41. pacienta s laparoskopickou HNE a 41. s LRL (< 30 % parenchymu) byly u skupiny HNE delší IT (39 vs 33 min), krevní ztráta (150 vs 100 ml) a operační čas (220 vs 190 min) [5].
- Centrální tumor – v blízkosti dutého systému nebo sinu ledviny. Frekvence v souborech LRL je 6,5–48 %, má vyšší procento komplikací (50 %) a tangování dutého systému (až 75 %) [1]. Bezpečně lze LRL provést též u hilového tumoru [22].
- Solitární ledvina – reprezentuje jen maximálně 4,2 % případů v největší sérii. Komplikace byly až u 45 % a tumory > 4 cm byly u 27 % pacientů [23].
- Tumory > 4 cm (T1b, T2) – v největším počtu 58 pacientů nebyl nalezen rozdíl ve srovnání s kontrolní skupinou (tumory do 4 cm) v riziku pozitivních okrajů, intra a pooperačních komplikací, pacienti s chronickou renální insuficiencí (CHRI) a tumorem > 4 cm měli osmkrát vyšší riziko progrese CHRI [24].
CENA
Zásadní je zhodnocení pooperačního průběhu. Pacienti po LRL mají jen minimální incize ve srovnání s lumbotomickým přístupem, sníženou spotřebu analgetik a kratší dobu rekonvalescence (viz obr. 4). Náklady jsou závislé na ceně materiálů a liší se v jednotlivých zemích, ani dle literatury není zřejmé, zda je LRL levnější nebo dražší ve srovnání s otevřenou operací.
Obr. 4. Kosmetický efekt u pacienta po LRL. 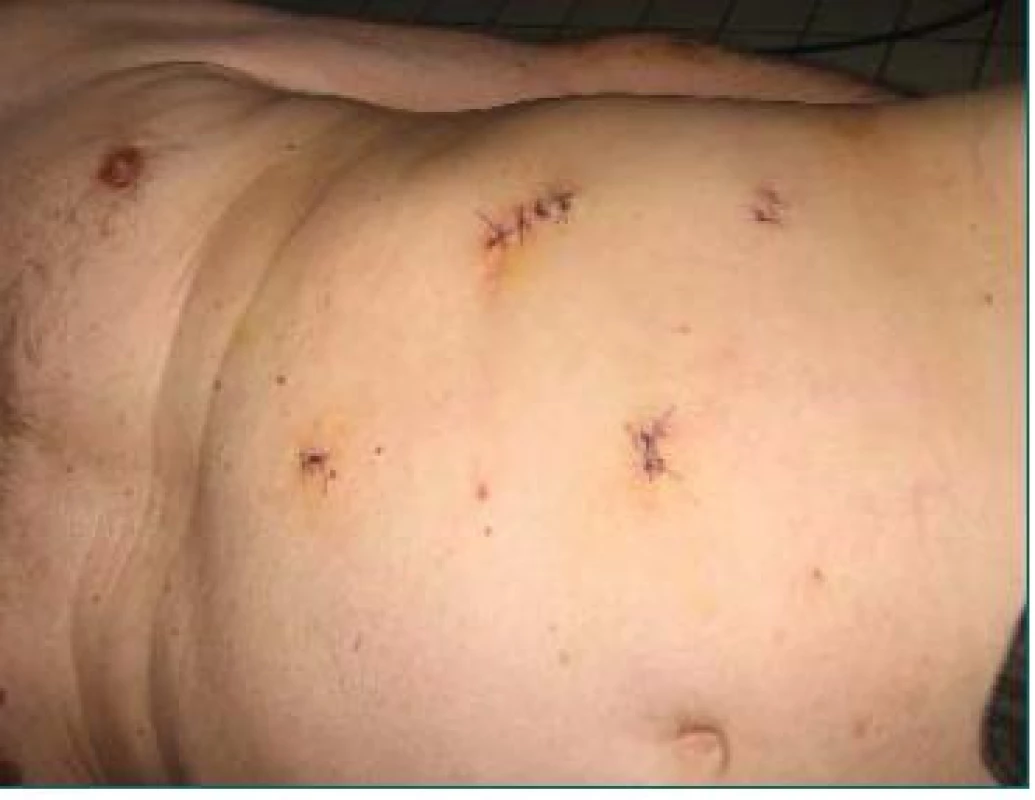
VLASTNÍ SOUBOR
Od 5/2008 jsme dosud provedli LRL u 19 pacientů (13 mužů a 6 žen) ve věku 46–77 let (průměr 60 let). O levostranný tumor šlo u 11 z nich, o pravostranný u 8. Indikováni byli pacienti, u nichž byl předpoklad onkologicky bezpečné resekce bez nutnosti sutury dutého systému ledviny. LRL jsme prováděli v teplé ischemii (u 18 pacientů) po zasvorkování renálních tepen a po předchozí preparaci nádoru a okolního parenchymu od tukového pouzdra. Hemostázy jsme dosáhli aplikací tkáňového lepidla (FloSeal) na resekční plochu společně s metylcelulózou (Surgicel) bez sutury parenchymu u 18 pacientů, u jednoho jsme resekovali exofytický tumor (bez zajištění hilu) elektrokauterem bez jiné hemostázy. Všechny operace jsme provedli z transperitoneálního přístupu.
Výsledky: Odstraněny byly tumory velikosti 19–37 mm (průměrná velikost 26 mm). U třech byl histologický nález benigní (2× onkocytom, 1× angiomyolipom), u ostatních šlo o různou formu RCC. Pozitivní okraje byly v jednom případě – šlo o benigní tumor (angiomyolipom). Doba teplé ischemie byla 13–30 min (průměr 21), doba operace 93–202 min (průměr 146), krevní ztráta 100–600 ml.
Komplikace byly u čtyř pacientů (21 %):
- časné: 1× konverze na otevřený výkon pro nedostatečnou hemostázu, 1× laparoskopická revize pro ponechané cizí těleso (jehla)
- pozdní: 1× perkutánní drenáž abscesu v místě resekce 10 dní po operaci, 1× zavedení stentu pro malý urinom (4 cm) 70 dní po operaci s následným zhojením
Všichni pacienti jsou sledováni, 10 mělo CT kontrolu a jeden MAG-3 scintigrafii bez známek poruchy funkce ledviny a bez známek recidivy tumoru.
ZÁVĚR
V léčbě incidentálních nádorů ledviny je dominantní exstirpační přístup. Vedle doporučené otevřené chirurgická resekce ledviny se rovnocennou po onkologické i funkční stránce stává LRL. Je méně invazivní variantou se všemi výhodami, které laparoskopie nabízí. Úspěšnost operace je ovlivněna materiálním zázemím s využitím moderních postupů (nástroje, technika šití, tkáňová lepidla) a též zkušeností operatérů s laparoskopií.
MUDr. Květoslav Novák, FEBU
Urologická klinika VFN a 1. LF UK
U nemocnice 2
128 08 Praha 2
slavek.novak@seznam.cz
Zdroje
1. Porpiglia F, Volpe A, Billia M et al. Laparoscopic versus open partial nephrectomy: Analysis of the current literature. Eur Urol 2008; 53 : 732–743.
2. Berger A, Crouzet S, Canes D et al. Minimally invasive nephron-sparing surgery. Curr Opin Urol 2008; 18(5): 462–466.
3. Ljundberg B, Hangary DC, Kuczyk MA et al. Renal cell carcinoma guidelines. Eur Urol 2007; 51(6): 1502–1510.
4. Monish A, Gill IS. Minimally invasive nephron-sparing surgery (MINSS) for renal tumours. Part I: Laparoscopic partial nephrectomy. Eur Urol 2007; 51(2): 337–346.
5. Haber GP, Gill IS. Laparoscopic partial nephrectomy: Contemporary technique and outcomes. Eur Urol 2006; 49(4): 660–665.
6. Wille AH, Deger S, Tüllmann M et al. Laparoscopic partial nephrectomy in renal cell cancer – indications, technique, and outcome in 80 patients. Eur Urol Suppl 2007; 6 : 635–640.
7. Thompson RH, Blute ML. At what point does warm ischemia cause permanent renal damage during partial nephrectomy? Eur Urol 2007; 52(4): 961–963.
8. Becker F, Van Poppel H, Hakenberg OW et al Assessing the impact of ischaemia time during partial nephrectomy. Eur Urol 2009; 56(4): 625–635.
9. Funaheshi Y, Hattori R, Yamamoto T et al. Ischemic renal damage after nephron-sparing surgery in patients with normal contralateral kidney. Eur Urol 2009; 55(1): 209–216.
10. Breda A, Stepanian SV, Lam JS et al. Use of hemostatic agents and glues during laparoscopic partial nephrectomy: A multiinstitutional survey from the United States and Europe of 1347 cases. Eur Urol 2007; 52 : 798–803.
11. Hacker A, Albadour A, Jauker W et al. Nephronsparing surgery for renal tumours: acceleration and facilitation of laparoscopic technique. Eur Urol 2006; 51(2): 358–365.
12. Benway BM, Wang AJ, Cabello JM et al. Robotic partial nephrectomy with sliding-clip renorrhaphy: technique et outcomes. Eur Urol 2009; 55 : 592–599.
13. Gill IS, Ramani AP, Spaliviero M et al. Improved hemostasis during laparoscopic partial nephrectomy using gelatine matrix trombin sealant. Urology 2005; 65(3): 463–466.
14. Ramani AP, Desai MM, Steinberg AP et al. Complications of laparoscopic partial nephrectomy in 200 cases. J Urol 2005; 173(1): 42–47.
15. Gill IS, Kamoi K, Aron M et al. 800 laparoscopic partial nephrectomies: a single surgeon series. J Urol 2010; 183(1): 34–41.
16. Breda A, Finelli A, Janetchek G et al. Complications of laparoscopic surgery for renal masses: Prevention, management, and comparison with the open experience. Eur Urol 2009; 55(4): 836–850.
17. Breda A, Stepanian SV, Liao J et al. Positive margins in laparoscopic partial nephrectomy in 855 cases: a multiinstitutional survey from the United States and Europe. J Urol 2007; 178 : 47–50.
18. Frank I, Colombo JR jr., Rubinstein M et al. Laparoscopic partial nephrectomy for centrally located renal tumors. J Urol 2006; 175 : 849–852.
19. Yossepowitch O, Thompson RH, Leibovich BC et al. Positive surgical margins at partial nephrectomy: predictors and oncological outcomes. J Urol 2008; 179(6): 2158–2163.
20. Lam JS, Bergman J, Breda A et al. Importance of surgical margin in the management of renal cell carcinoma. Nat Clin Pract Urol 2008; 5(6): 308–317.
21. Halachmi S, Finelli A, Mottrie A et al. Parenchymal-sparing surgery for renal lesions: Open versus laparoscopic/robotic surgery. Eur Urol Suppl 2009; 8:
753–757.
22. Lattouf JB, Beri A, D´Ambros OF et al. Laparoscopic partial nephrectomy for hilar tumors: Technique and Results. Eur Urol 2008; 54(2): 409–416.
23. Gill IS, Kavoussi LR, Lane BR et al. Comparison of 1800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol 2007; 178(1): 41–46.
24. Simmons MN, Chung BI, Gill IS. Perioperative efficacy of laparoscopic partial nephrectomy for tumors larger than 4 cm. Eur Urol 2009; 55(1): 199–207.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2010 Číslo 1- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Význam monitorování hladiny anti-Xa u pacientů užívajících profylaktické dávky enoxaparinu − série kazuistik
-
Všechny články tohoto čísla
- Diagnostika karcinomu prostaty a role PCA3
- Současné klinické a patologické proměnné biopsie prostaty, které predikují významné změny grade
- Laparoskopická adrenalektomie: operační technika
- Technické aspekty provedení transperitoneální laparoskopické nefrektomie
- Laparoskopická resekce ledviny
- Rekonstrukční laparoskopie v dětské urologii
- Screening karcinomu prostaty: přehled důkazů (2009)
- Laparoskopické rekonstrukční operace na horních močových cestách u dětí – technické aspekty
- Retroperitoneoskopie
- Laparoskopická operace vedoucí k odstranění konkrementů
- Komplikace při řešení nádorů ledvin laparoskopicky
- Psychologický mechanizmus při nádorovém onemocnění a základy komunikace v jednotlivých fázích
- Výzkum výsledků zdravotní péče v oblasti urologie
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laparoskopická adrenalektomie: operační technika
- Laparoskopická resekce ledviny
- Laparoskopické rekonstrukční operace na horních močových cestách u dětí – technické aspekty
- Technické aspekty provedení transperitoneální laparoskopické nefrektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání