-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaOhlédnutí za vývojem antitrombotické profylaxe s akcentem na posledních 25 let
Looking back at developments in antithrombotic prophylaxis, focusing on the past 25 years
As in other fields, the past 25 years have seen concentrated research in the area of drugs that reduce blood clotting-antithrombotics. Their purposeful application dates to the early 20th century and the past 25 years have seen intense acceleration of this interest. These drugs include not only classical products, but mainly new targeted drugs affecting blood clotting at specific sites. These represent the group of novel or direct anticoagulants (NOACs or DOACs).
Keywords:
NOAC – dabigatran – antithrombotics – Anticoagulants – unfractionated heparin (UFH) – low molecular weight heparin (LMWH) – warfarin – laboratory monitoring
Autoři: M. Penka; M. Matýšková; J. Michalcová
Působiště autorů: Oddělení klinické hematologie Fakultní nemocnice Brno
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 1, p. 56-64.
Kategorie: Souhrnné/edukační práce
Souhrn
V posledním čtvrtstoletí došlo stejně jako v jiných oblastech k soustředěnému výzkumu léků snižujících krevní srážení – antitrombotik. Jejich cílevědomé využití lze datovat do počátků minulého století, v posledních 25 letech dochází k jejich intenzivní akceleraci. Jedná se nejen o léky řazené do již klasických přípravků, ale zejména o léky zcela nové vyvíjené cíleně k ovlivnění krevního srážení na specifickém místě. Jedná se o skupinu nových či přímých antikoagulancií (NOAC, resp. DOAC).
Klíčová slova:
antitrombotika – antikoagulancia – UFH – LMWH – warfarin – NOAC – DOAC – laboratorní sledování
Úvod
Antitrombotická prevence či léčba představuje léčebný postup, který by měl vést ke snížení buď vystupňované aktivity krevního srážení, nebo i její normální aktivity v případě vysokého rizika trombózy.
Cílem je předcházet vzniku nebo zabránit dalšímu rozvoji tromboembolické nemoci (TEN). Patří k jedněm z nejrozšířenějších medicínských opatření. Současně běžně dostupná antikoagulancia navozují hypokoagulační stav, brání narůstání trombu, některá napomáhají endogenní fibrinolýze a rozpouštění trombu. Mezi antitrombotika v nejširším slova smyslu patří i protidestičkové léky, které jsou účinné především v léčbě a profylaxi tepenných trombóz, a antitrombotické léky v užším slova smyslu – často označované jako antikoagulancia, používané v první řadě k řešení žilních okluzí. Někteří autoři sem řadí i trombolytika, léky stupňující fibrinolytickou aktivitu za účelem rozpuštění trombu.
Od počátku minulého století jsou k léčbě trombózy používaná nepřímá antitrombotika – hepariny či antagonisté K vitaminu. Hledání ideálního antitrombotika vedlo k usilovnému bádání, které dospělo k vývoji přímých antitrombotik, která se dostala do klinické praxe v posledních letech.
HISTORIE
Již ve starém Egyptě najdeme zmínky o přikládání pijavic, které obsahují celou řadu aktivních látek včetně látek ovlivňujících krevní srážení. Není bez zajímavosti, že se jejich podávání i v současnosti opět objevuje.
Prvním cílevědomě užívaným antitrombotikem je nefrakcionovaný heparin (UFH). Před více než 100 lety medik J. McLean izoloval v laboratoři profesora W. H. Howella z psích jater látku, která vyvolávala krvácení u zvířat [1]. V roce 1918 W. H. Howell s L. E. Holtem identifikovali další podobnou látku a nazvali ji heparin. Erik Jorpes se snažil vyčistit heparin a vyhnout se jeho vedlejším účinkům. První závěry publikoval 1935 včetně zprávy o struktuře molekuly [2]. V roce 1936 začala švédská společnost Vitrium AB vyrábět parenterální heparin pro lidské použití.
V sedmdesátých letech minulého století začaly pracovat tři různé skupiny ve Stockholmu, Londýně a Hamiltonu v Ontariu na vývoji nízkomolekulárních heparinů (LMWH), které se vyrábí chemickým štěpením heparinu. Mají méně nežádoucích účinků než heparin a předvídatelnější léčebnou odpověď – jejich účinek se ve srovnání s UFH liší tím, že mají výraznější vliv na inhibici faktoru Xa [1]. Do poloviny 80. let byly přípravky LMWH testovány v klinických studiích a nyní nahrazují UFH pro většinu indikací.
V roce 1976 byla identifikována unikátní pentasacharidová sekvence heparinu, která je nezbytná pro vazbu antitrombinu, a tím i antikoagulační aktivitu.
Za asi nejznámějším antikoagulanciem stojí pátrání po příčině úhynu dobytka z důvodu krvácení. Bylo odhaleno, že k němu docházelo při spásání traviny napadené plísní – komonicí bílou. V roce 1940 izoloval K. P. Link z koncentrátu z komonice dikumarol a roku 1948 syntetizoval kumarinový derivát warfarin využívaný nejprve jako jed na hlodavce. Díky vojákům, kteří přežili sebevražedné pokusy po požití tohoto přípravku, se kumariny staly nejrozšířenějším perorálním antikoagulanciem. Jako lidské antikoagulans byl schválen v roce 1954 a jako jeden z prvních pacientů z něj profitoval americký prezident D. Eisenhower [1]. Je nutno podotknout, že by v dnešní době kumariny velmi pravděpodobně neprošly klinickým testováním, přesto zachránily miliony životů.
Antikoagulační látky byly také extrahovány z řady zvířat (klíšťata, pijavice, hadi a netopýři) a přeměněny na léky chemickou syntézou nebo metodami genetického inženýrství. Další krok ve vývoji antitrombotik představoval hirudin. Specifický inhibitor trombinu hirudin produkovaný pijavicí (Hirudo medicinalis) byl v padesátých létech izolován a charakterizován jako specifický inhibitor trombinu [3].
První úspěšná syntetická antikoagulancia fondaparinux [4] a bivalirudin byla vyvíjena v osmdesátých letech. Přirozeně se vyskytující inhibitor faktoru Xa poprvé popsal 1971 Spellman et al. u měchovce (psí parazit) [5].
Další vývoj antitrombotických léků se soustředil na přímé inhibitory trombinu a faktoru Xa (DOAC), které se do klinické praxe zařadily od roku 2008.
TYPY ANTITROMBOTIK
Antitrombotika můžeme dělit na perorálně a parenterálně podávaná, nebo podle místa jejich účinku v procesu krevního srážení (schéma 1).
Schéma 1. Ovlivnění koagulace 
(F – faktor; TF – tkáňový faktor; UFH – nefrakcionovaný heparin; LMWH – nízkomolekulární hepariny; AT – antitrombin) Ještě před 10 lety byl warfarin jediné perorálně dostupné antikoagulans. V posledních letech se objevily studie řady tzv. NOAC (nová perorální antikoagulancia, z angl. Novel Oral Anticoagulants), mezi něž je řazen přímý inhibitor trombinu dabigatran etexilát a specifické inhibitory faktoru Xa (tzv. xabany). Nyní se diskutuje nad názvem, neboť se už nejedná o „nová“ antitrombotika [6] – slovo „nová“ bylo nahrazeno pojmem „non vitamin K“. Mezinárodní společnost pro trombózu a hemostázu doporučuje používat zkratku DOAC (přímá perorální antikoagulancia, z angl. Direct Oral Anticoagulants) [7]. V literatuře ale nalezneme i jiné zkratky – TSOAC (Target-Specific Oral Anticoagulants), ODI (Oral Direct Inhibitors), nebo SODA (Specific Oral Direct Anticoagulants).
Mezi perorální antitrombotika/antikoagulancia patří tedy warfarin a DOAC. Zatímco warfarin brání jako antagonista vitaminu K vzniku aktivních forem vitamin K dependentních faktorů krevního srážení (faktory II, VII, IX a X), je působení nových, resp. přímých působků namířeno selektivně do jednoho místa koagulačního procesu, a to proti účinku trombinu (dabigatran etexilát) a o úroveň výše – proti aktivitě faktoru Xa – apixaban, rivaroxaban, edoxaban.
Parenterálně podávanými léky jsou UFH, LMWH, pentasacharidy, hirudiny a argatroban.
Pentasacharidy se váží přímo na vazebné místo antitrombinu podobně jako LMWH a tím zvyšují jeho inhibiční aktivitu. V současné době je z této skupiny dostupný pouze fondaparinux (Arixtra®), který na rozdíl od UFH a LMWH inhibuje pouze faktor Xa a nepůsobí na žádné jiné úrovni. Studie s idraparinuxem (AMADEUS) byla ukončena pro excesivní mozková krvácení [8].
Hirudin je přirozeně se vyskytující skupina protisrážlivých látek nalezená ve slinách pijavice. Tyto látky vysoce selektivně inhibují volný i vázaný trombin a vytvořený komplex je prakticky ireverzibilní. Rekombinantní hirudin se od přírodního liší přesně definovanou homogenní molekulou (např. lepirudin, desirudin). Výhodou hirudinu oproti heparinu je, že je účinný bez antitrombinu jako kofaktoru, není inaktivován heparinázami, neovlivňuje krevní destičky a inhibuje i trombin navázaný v krevní sraženině nebo na subendotel. Podání hirudinu musí být parenterální. Poločas v plazmě je cca 1–2 hodiny s maximální koncentrací přibližně za 10 minut po i. v. podání. Volný hirudin se vylučuje ze 70–90 % ledvinami. Vazba na bílkoviny je méně než 10%. Neprochází hematoencefalickou bariérou, placentou prochází jen ve stopovém množství a v experimentu na zvířeti byly u plodu zaznamenány pouze minimální koncentrace [3, 9]. Bivalirudin, syntetický analog hirudinu (hirulog), je reverzibilní inhibitor trombinu. Podává se parenterálně s poločasem 25 minut po i. v. aplikaci. Je metabolizován v játrech, pouze malá část je vylučována ledvinami [9].
Argatroban (Novastan®) je kompetitivní přímý reverzibilní inhibitor trombinu. Váže se na aktivní místo trombinu (jak volného, tak vázaného) a současně inhibuje štěpení fibrinogenu trombinem stejně jako aktivaci trombocytů trombinem. Podává se nitrožilně, jeho poločas v plazmě je 40–50 minut. Vylučování není závislé na funkci ledvin. Látka je metabolizována v játrech, a proto je nutná redukce dávkování u osob s jaterní dysfunkcí. Metabolity jsou vylučovány žlučí [10].
Základní charakteristiku antitrombotik uvádí tabulka 1.
Tab. 1. Antitrombotika 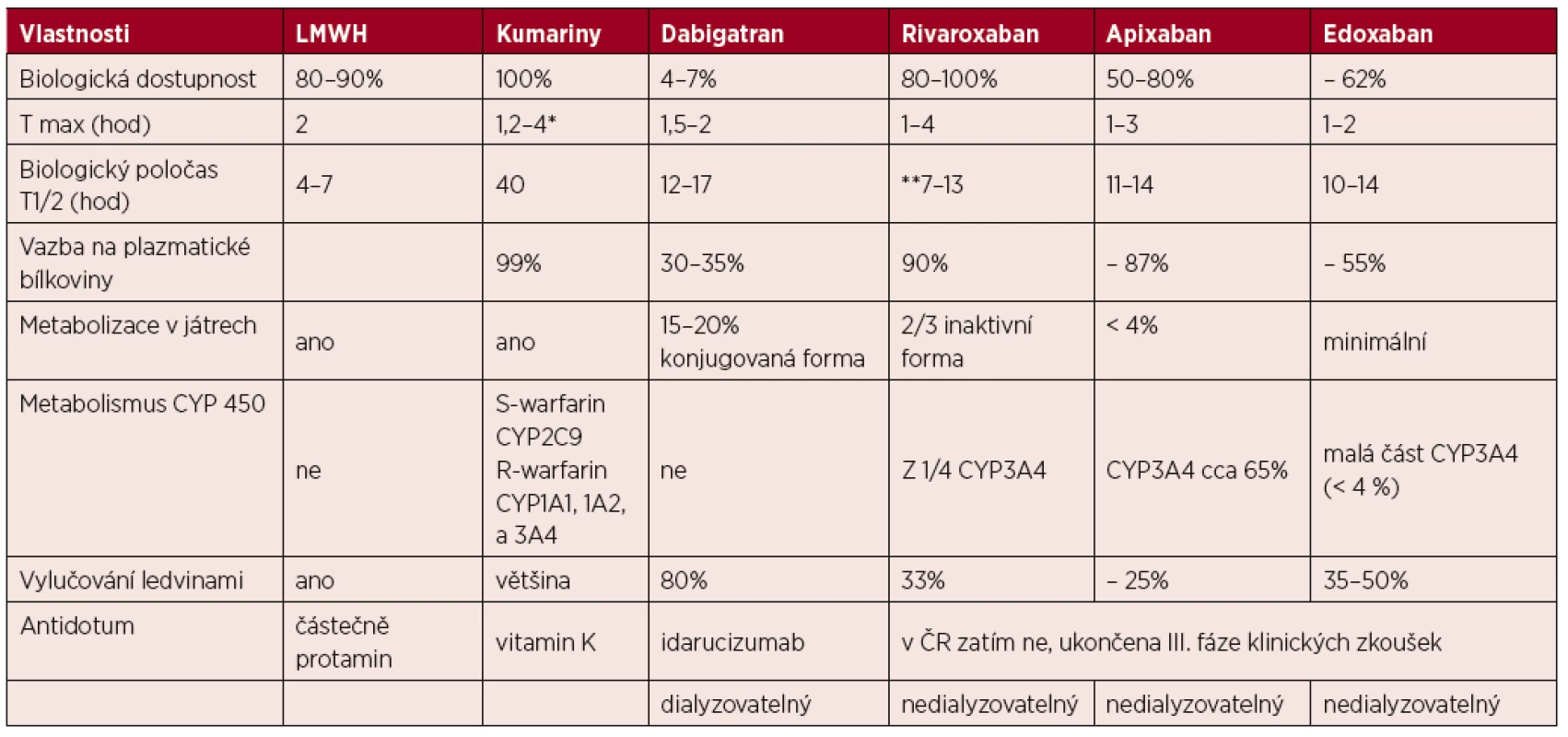
*nejedná se o maximu účinku
**závislost na věkuINDIKACE PODÁVÁNÍ
Indikace všech antitrombotik lze shrnout jednoduše jako podání zmíněných léků k prevenci, profylaxi nebo léčbě zvýšeného srážení krve. V posledních letech se indikace zúžily nejen na diagnózu, ale často i přímo na zvolený léčebný postup. Jednotlivé preparáty se mohou v indikacích navíc lišit (např. LMWH mezi sebou).
Nejširší a obecné indikace mají i z historického hlediska hepariny a warfarin, někdy označované jako „klasická“ antikoagulancia. Indikace jejich podání jsou následující:
- Léčba a prevence hluboké žilní trombózy a plicní embolie. Využití heparinů v prevenci vychází z výsledků studií, které prokázaly snížení výskytu pooperační hluboké žilní trombózy. Podkožně podávaný UFH v dávce 5000 j. dvakrát nebo třikrát denně snižuje riziko pooperační hluboké žilní trombózy z 22 na 9 % [11]. Při použití LMWH dochází k poklesu výskytu pooperační hluboké žilní trombózy dokonce o 70 % [12].
- Sekundární prevence infarktu myokardu a prevence tromboembolických komplikací (iktus nebo systémová embolie) po infarktu myokardu.
- Prevence tromboembolických komplikací (iktus nebo systémová embolie) u pacientů s fibrilací síní, onemocněním srdečních chlopní nebo s náhradou srdečních chlopní. Léčba warfarinem sníží výskyt mozkových příhod při fibrilaci síní o dvě třetiny a celkovou mortalitu o čtvrtinu [13].
- Léčba a prevence tranzitorních ischemických atak (TIA) a iktu [14].
Fondaparinux je indikován v prevenci žilní trombózy u nemocných po ortopedických operacích (např. při fraktuře kyčle, po náhradě kyčelního či kolenního kloubu), po břišních operacích (např. pro zhoubný nádor) a v neposlední řadě i u pacientů s interním onemocněním, u kterých je přítomno vysoké riziko TEN. Spolu s warfarinem je schválen v léčbě akutní žilní trombózy a plicní embolizace [15]. Fondaparinux bývá rovněž podáván u pacientů s heparinem indukovanou trombocytopenií (HIT).
V případě hirudinu je jasnou indikací k podávání HIT nebo HIT s trombózou.
Indikace DOAC [16, 17, 18, 19]
- Prevence žilního tromboembolismu u pacientů podstupujících elektivní náhradu kyčelního nebo kolenního kloubu (dabigatran, apixaban, rivaroxaban).
- Léčba hluboké žilní trombózy a plicní embolie a prevence jejich recidivy (dabigatran, apixaban, edoxaban, rivaroxaban).
- Prevence cévní mozkové příhody a systémové embolizace u nevalvulární fibrilace síní s jedním nebo více rizikovými faktory (dabigatran, apixaban, edoxaban, rivaroxaban).
- Prevence aterotrombotických příhod po akutním koronárním syndromu se zvýšenými hladinami srdečních biomarkerů v kombinaci s ASA nebo ASA + klopidogrel/tiklopidin (pouze rivaroxaban).
Nežádoucí účinky
Všechna antitrombotika provází logicky především vyšší riziko krvácení. Jednou z hlavních námitek proti warfarinu bylo riziko krvácení, které se samozřejmě zvyšuje s mírou účinnosti léčby a především při předávkování. To ale není jedinou příčinou krvácivých komplikací. Lze říct, že většina faktorů, které zvyšují riziko krvácení u warfarinu, se uplatňuje i u všech ostatních antitrombotik (tab. 2).
Tab. 2. Rizika zvyšující krvácení u warfarinu a dalších antitrombotik 
Kontraindikace
Udávané kontraindikace jsou často relativní a lékař musí zvažovat při podávání všechna rizika, současně s častým monitorováním i tam, kde to není běžně nutné. Pro všechna antitrombotika to jsou krvácivé stavy, případně stavy s vysokým rizikem krvácení, včetně souběžného podávání léků, které toto riziko zvyšují.
Nefropatie, resp. chronická renální insuficience je problematická u LMWH, které se ledvinami vylučují, podobně jako dabigatran etexilát – postup se řídí podle aktuálních hodnot clearance kreatininu, kdy buď je doporučená redukce dávkování, či dokonce je lék kontraindikován. Xabany se vylučují ledvinami jen zčásti, přesto i zde je nutná opatrnost a případné snížení dávkování, či vysazení léku při těžké renální insuficienci [16, 17, 18, 19].
Podobně těžká hepatopatie je považována za kontraindikaci podávání většiny antitrombotik.
Absolutní kontraindikací je u UFH a LMWH výskyt HIT [20].
DOAC nejsou doporučena v těhotenství ani v období kojení, protože nejsou v tomto směru k dispozici relevantní studie. LMWH lze u těhotných žen podávat; do mateřského mléka sice přecházejí, ale jsou neutralizovány kyselým pH žaludku dítěte. Warfarin je kontraindikován v I. a III. trimestru těhotenství, ve II. trimestru lze ve vybraných případech podávat po důkladném zvážení přínosu/rizika (např. pacientky s mechanickou chlopenní náhradou nebo s hereditárním defektem antitrombinu). Do mateřského mléka warfarin nepřechází, lze jej tedy podávat i u kojících žen.
INTERAKCE
Vzhledem ke zvýšenému riziku krvácení je třeba postupovat opatrně, zvláště pokud jsou pacienti současně léčeni více léky.
Interakce jsou řešeny především v souvislosti s warfarinem a jeho kompeticí s vitaminem K, který je obsažen v celé řadě potravinových doplňků, především na přírodní bázi. Od extrémních doporučení vynechávání potravin, které vitamin K obsahují, jsme se propracovali k doporučením zohledňujícím úpravy jídelníčku u potravin, které obsahují vitamin K v nekonstantním množství, a kde je třeba obezřetnosti.
Také celá řada lékových interakcí předpokládá povědomí o medikaci, na níž je nemocný užívající warfarin, a jak souběžná medikace může úroveň účinku warfarinu ovlivnit [21].
V souvislosti s metabolismem warfarinu byla snaha předurčit dávkování na základě genetické dispozice ke zvýšené či snížené odpovědi na warfarin [22].
U UFH ani LMWH nejsou udávány žádné interakce, pouze v případě heparinu je upozorněno na inkompatibilitu s hydrokortizonem, streptomycinem, cefaloridinem, tetracyklinem, prometazinem, a chlorpromazinem [23].
Dabigatran-etexilát je substrátem glykoproteinu P (P-gp). Současné podávání s induktory P-gp (např. rifampicin, karbamazepin, fenytoin, třezalka tečkovaná) vede ke snížení plazmatické koncentrace dabigatranu. Podávání silných inhibitorů P-gp je kontraindikováno (ketokonazol, cyklosporin, itrakonazol a dronedaron). Souběžná léčba s takrolimem se nedoporučuje. U slabých až středně silných inhibitorů P-gp je nutná opatrnost (např. amiodaron, posakonazol, chinidin, verapamil, tikagrelor). Souběžná léčba selektivními inhibitory zpětného vychytávání serotoninu (SSRI) nebo selektivními inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) může zvyšovat riziko krvácení.
Současné podávání rivaroxabanu s látkami, které jsou silnými inhibitory CYP3A4 i P-gp (např. systémově podávaná azolová antimytikotika, nebo ritonavir), může vést ke zvýšenému riziku krvácení. Předpokládá se, že flukonazol má menší vliv na rivaroxaban a může být souběžně s opatrností podáván. Současné podání rivaroxabanu se silnými induktory CYP3A4 může vést ke snížení jeho plazmatické koncentrace. Silné inhibitory CYP3A4 a P-gp mohou zvýšit, silné induktory CYP3A4 a P-gp snížit plazmatické koncentrace apixabanu.
LABORATORNÍ SLEDOVÁNÍ
Všechna antitrombotika mohou ovlivňovat základní koagulační testy (tab. 3). Podávaný lék tak může být jedinou příčinou prodloužení koagulačních testů a následně zbytečného došetřování. Předejít této situaci se dá tím, že se lék uvede na žádance a současně se udá i čas podání poslední dávky léku. Odběr se také může provést před podáním další dávky, případné výraznější prodloužení testů v tomto případě může svědčit pro předávkování. Informace na žádance laboratoři ušetří opakování vyšetření a telefonické konzultace s klinickými lékaři.
Tab. 3. Ovlivnění základních koagulačních testů 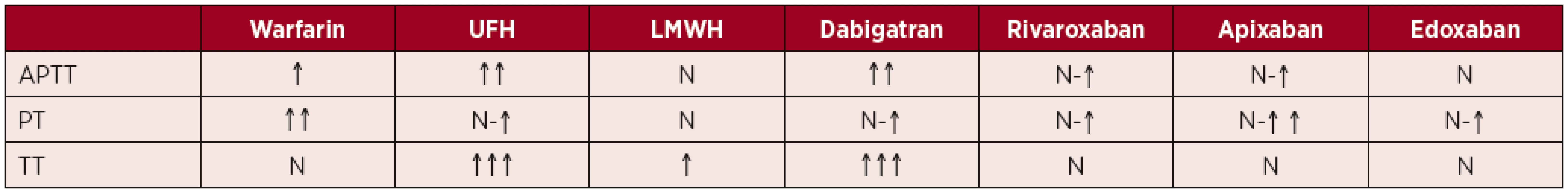
Při léčbě mohou být ovlivněna i některá speciální koagulační vyšetření, jako např. některé metody stanovení hladiny antitrombinu, rezistence k aktivovanému proteinu C či vyšetření lupus antikoagulans.
Mezi základní koagulační testy patří aktivovaný parciální tromboplastinový test (APTT), protrombinový test (PT), trombinový test (TT), fibrinogen. Výsledků protrombinového testu u všech osob, včetně pacientů na LMWH či DOAC, by měly být vydávány buď jako poměr časů (PT-R), nebo pouze čas pacienta. Dříve byly výsledky vydávány také v procentech nebo jako bezrozměrné číslo (jednalo se o odečet z kalibrační křivky). Toto se již nedoporučuje.
Laboratorní sledování je nutné u warfarinu, UFH, argatrobanu a hirudinu; naopak není obecně požadováno u LMWH, fondaparinuxu či DOAC s výjimkou stavů, kdy jde o krvácení, nutnost akutního chirurgického výkonu, renální insuficienci, suspektní předávkování, ale také třeba při podezření na nespolupráci nemocného, případně při neobvyklé hmotnosti. U LMWH je doporučováno provádět kontroly u těhotných a dětí.
Pravidelné kontroly protrombinového testu vyjádřeného jako PT-INR (mezinárodní normalizovaný poměr) jsou nezbytností u všech kumarinů. Je zde také prokazatelná závislost rizika krvácení na hodnotě PT-INR. Parametr PT-INR byl zaveden jako standardizace léčby. Jedná se o poměr protrombinového času pacienta k času normálu umocněný na ISI (mezinárodní index senzitivity tromboplastinu). Výsledek PT-INR by měl být používán pouze u osob, které užívají deriváty kumarinů. U některých jedinců se při léčbě warfarinem prodlužuje i APTT, ke sledování léčby však není vhodné. TT není ovlivněn.
Při podávání UFH je nutné sledovat hodnotu APTT. Jednotlivé reagencie pro vyšetření APTT se významně liší citlivostí k heparinu, a proto by laboratoř měla mít definováno, v jakém rozmezí by se hodnoty při terapeutickém dávkování měly pohybovat. Obecně se doporučuje, aby se výsledek pohyboval mezi 2–3násobkem normálu.
Hirudin v závislosti na dávce ovlivňuje jak APTT, tak PT a TT. Má úzké terapeutické rozmezí a jeho dávkování je nutné upravovat podle APTT (doporučené rozmezí je poměr R 1,5–2,0 za čtyři hodiny po podání). APTT dobře koreluje s koncentrací hirudinu, ale křivka je velmi plochá a závislost není zcela lineární. Pro monitorování vyšší dávky hirudinu se doporučuje použití ekarinového testu (ECT), který však v běžné praxi není dostupný.
Léčebný účinek bivalirudinu je monitorován aktivovanou dobou srážení (ACT) [9].
K monitorování léčby argatrobanem se používá APTT, doporučené terapeutické rozmezí je poměr R 1,5-3,0. Argatroban ovlivňuje také PT, což může dělat problémy při současném zavádění antikoagulační léčby antagonisty K vitaminu.
Laboratorní monitorování LMWH není nutné, přesto se stále častěji indikuje. Využívá se stanovení anti-Xa aktivity chromogenní metodou. Limitací vyšetření je, že naměřená hodnota nás informuje pouze o koncentraci molekul, které jsou schopny anti-Xa (případně anti-IIa) působení, nekoreluje však s rizikem krvácení [24] ani při předávkování. Riziko krvácení se zvyšuje především s věkem a závisí na celkovém klinickém stavu nemocného, případně na dávce LMWH [25].
K monitorování hladiny fondaparinuxu lze v případě potřeby použít chromogenní stanovení anti-Xa aktivity stejně jako u LMWH. Pro fondaparinux se však musí použít specifické kalibrátory. Léčebné rozmezí není pro daný lék jasně definováno.
DOAC
I když se rutinní laboratorní sledování u osob užívajících DOAC nepovažuje za nutné, jsou situace, kdy je nezbytné – viz výše uvedené.
Vzhledem k relativně krátkému poločasu DOAC je při interpretaci laboratorních výsledků potřeba znát čas, kdy byla podána poslední dávka. Při podezření na předávkování je odběr krve vhodné provést v době minimálního účinku. Pokud ověřujeme vstřebávání preparátu či spolupráci nemocného, je optimální odběr v době maximální koncentrace. Prodloužení základních testů závisí na typu použité reagencie, většina je na léčbu DOAC málo citlivá [26].
Ke stanovení plazmatické hladiny dabigatranu se používá ředěný trombinový čas (dTT, např. Hemoclot® Thrombin Inhibitors). Doporučován je i ECT či ekarinový chromogenní test (ECA), v našich podmínkách se ale nepoužívají. Nejvyšší hladina se očekává cca za 2 hodiny po podání léku. K orientačnímu zhodnocení antikoagulačního účinku lze využít APTT. Citlivost testu ale závisí na použité reagencii. APTT ve fyziologických mezích prakticky vylučuje terapeutickou hladinu. Prodloužení APTT nad dvojnásobek horní hranice normy v době minimálního účinku může upozornit na zvýšené riziko krvácení. Stupeň prodloužení ale nekoreluje s koncentrací dabigatranu. Dabigatran v terapeutických koncentracích PT-R prakticky neovlivňuje, v případě předávkování dochází k jeho prodloužení. Velmi citlivý je TT, který vykazuje na dávce závislou lineární odpověď. Test je využitelný, pokud chceme vyloučit, že dabigatran není v krvi přítomen.
Ke stanovení plazmatické hladiny přímých inhibitorů faktoru Xa provádíme vyšetření anti-Xa aktivity chromogenní metodou s kalibrátory pro jednotlivé přípravky (rivaroxaban, apixaban, edoxaban). Farmakodynamické účinky stanovené analýzou anti-Xa aktivity jsou předvídatelné a korelují s jejich dávkou a koncentrací.
K orientačnímu posouzení antikoagulace rivaroxabanem lze použít PT. Citlivost metody se však liší podle použité reagencie. PT je vhodný zejm. při podezření na předávkování či kumulaci léku. Apixaban a edoxaban také prodlužují PT, tyto změny jsou ale malé a podléhají vysokému stupni variability. Nelze je proto ke sledování antikoagulačního účinku použít. Hodnota APTT může být u všech inhibitorů faktoru Xa mírně prodloužená, avšak metoda není dostatečně citlivá a její použití proto není vhodné [27].
ANTIDOTUM
Látka, která by neutralizovala účinek, je u většiny antitrombotických léků problém.
UFH lze neutralizovat podáním protaminu, i když tento nemusí stoprocentně fungovat a sám může riziko krvácení zvyšovat. U LMWH protamin již ale z velké části nefunguje a fondaparinux protaminem neutralizován není. V současnosti pro něj nemáme účinné antidotum, podobně jako ani pro hirudin.
Antidotem warfarinu, či lépe kompetitivním protivníkem, je sám vitamin K, jehož účinek však nastupuje nejdříve za 4 hodiny po podání, spíše však později. Pro akutní použití je nutné podání koncentrátů protrombinového komplexu, čerstvě zmražená plazma nemá dostatečnou koncentraci potřebných koagulačních faktorů.
Fab-fragment humanizované monoklonální protilátky idarucizumab (Praxbind®) se s vysokou afinitou specificky váže na dabigatran a neutralizuje jeho účinek. Vazebná afinita je asi 300krát vyšší než afinita dabigatranu k trombinu. Výsledkem je okamžitá, úplná a přetrvávající (až 12 hodin u více než 90 % pacientů) reverze antikoagulačního účinku dabigatranu [28].
Pro inhibitory faktoru Xa byl vyvinut andexanet alfa (Andexxa®). Jedná se o modifikovaný rekombinantní faktor Xa, který není koagulačně aktivní. Byla již ukončena III. fáze klinického zkoušení [29] a v USA je přípravek registrován pro případ život ohrožujícího či nekontrolovaného krvácení u pacientů užívajících rivaroxaban nebo apixaban. V České republice ale ještě nebyl andexanet alfa ke klinickému použití schválen.
Ve vývoji je také ciraparantag (aripazine) – je to malá syntetická molekula, která se nekovalentně váže na UFH, LMWH, fondaparinux, dabigatran i xabany. Jde tedy o univerzální antidotum. Látka se aktuálně nachází ve fázi II klinického hodnocení [30].
ZÁVĚR
Zavedení DOAC do léčby tromboembolické nemoci v nejširším slova smyslu je velkým přínosem v hledání ideálního antikoagulans (tab. 4). Výstupy dosavadních studií prezentují velmi dobré výsledky, přesto se ale jedná v podstatě o nové léky – asi nejdůležitější informace přinese čas a výsledky registrů.
Tab. 4. Ideální antitrombotikum 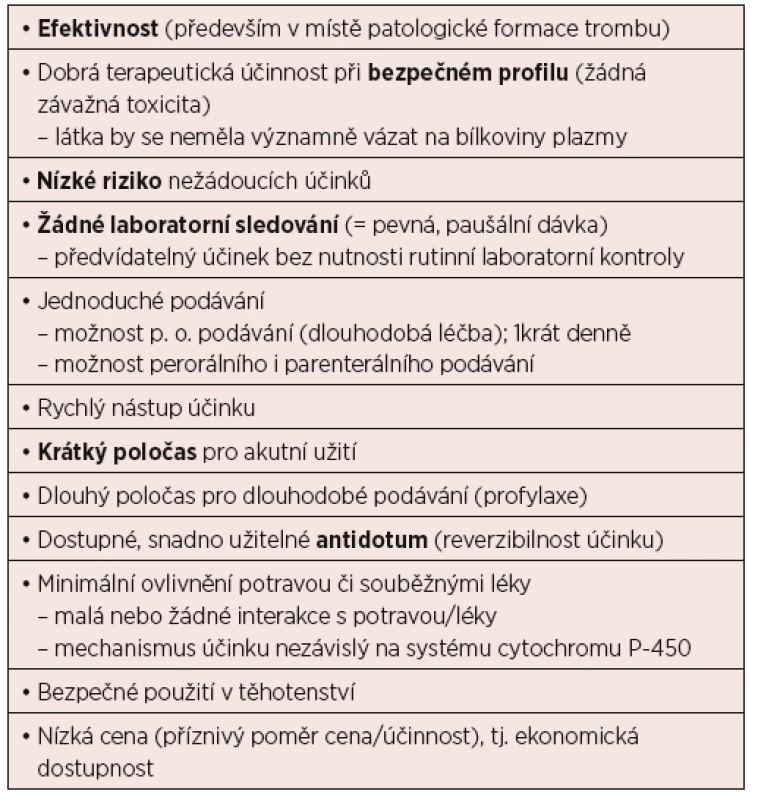
V každém případě je nutné vždy posoudit, který postup je pro nemocného optimální, je nutné zohledňovat věk a komorbidity. Pokud se zvažuje redukce dávek, měla by být jasně zdůvodněná – jak ukazují poslední práce, není toto vždy ku prospěchu nemocného [31].
Problémy mohou nastat u nemocných s poruchou funkce ledvin, kde jediný lék, který není ledvinami vylučován, je argatroban. Všechna antitrombotika jsou metabolizována a/nebo vylučována játry, proto i u těchto osob je jejich podávání problematické.
V některých klinických situacích se jako výhodná může ukazovat určitá skupina léků. Například u nemocných s trombózou a nádorovým onemocněním je upřednostňované podávání LMWH před warfarinem i DOAC. Naopak u pacientů s chlopenními náhradami je nejvhodnější warfarin, podávání DOAC se nedoporučuje.
Pro těhotné máme stále k dispozici jen LMWH, případně u pacientek s defektem antitrombinu nebo chlopenní náhradou warfarin v druhém trimestru. Při kojení je možné podávat také jen warfarin, případně LMWH (je sice exkrece do mléka, ale lék je inaktivován v žaludku dítěte – kyselé pH).
Veškeré dosud prováděné studie byly stavěny proti LMWH, warfarinu nebo placebu. Dosud neproběhly srovnávací studie „face to face“ mezi jednotlivými DOAC.
Jednou z udávaných výhod DOAC je, že není nutné laboratorní monitorování. Ukazuje se však, že máme skupinu pacientů, u kterých je monitorování hladin léků nezbytné.
Přestože léčba warfarinem vyžaduje pravidelné laboratorní sledování a dobrou spolupráci nemocného, je s tímto přípravkem stále nejvíce zkušeností, podobně jako s LMWH.
Shrnutí přínosu posledních let z hlediska antitrombotické medikace
- Systematický charakter antitrombotické prevence, terapie, sledování a depistáže podle doporučených postupů.
- Intenzivní výzkum s objevením a zavedením nových preparátů do praxe – LMWH, DOAC.
- Sofistikované propracování klinického i laboratorního sledování. Zavedení klinických skórovacích systémů – např. CHA2DS2-VASc skóre (Birmingham schéma z roku 2009) [14]. Rozšíření možností laboratorního sledování antitrombotické léčby – specifické testy pro jednotlivé způsoby medikace (PT-INR pro warfarin, anti-Xa pro inhibitory faktoru Xa, dTT pro dabigatran etexilát apod.) [32].
- Prospektivní studie a po uvedení preparátu do klinické praxe založení registrů s vyhodnocením výstupů a jejich vzájemným srovnáváním [33].
- Doporučené postupy s určením úrovně důkazu a stupně doporučení, s expertním a recenzním řízením.
- Vzájemné srovnání používaných preparátů [34].
- Vytvoření odborných mezinárodních a národních společností (ISTH, ESTH, ČSTH) a pravidelné konference včetně vědeckých standardizačních výborů (SSC) a multidisciplinární přístup [35].
Podíl autorů na přípravě rukopisu
MP – příprava první a finální verze rukopisu
MM – připomínkování a korektura rukopisu
JM – připomínkování a korektura rukopisu
Poděkování
Podpořeno granty MUNI/A/1105/2018 a MZ ČR – RVO (FNBr, 65269705).
Čestné prohlášení
V souvislosti s tématem, vznikem a publikací tohoto článku nejsou autoři ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 4. 10. 2018.
Přijato po recenzi dne 12. 11. 2018.
prof. MUDr. Miroslav Penka, CSc.
Oddělení klinické hematologie
Fakultní nemocnice Brno-Bohunice
Jihlavská 20
625 00 Brno
e-mail: penka.mirosla@vnbrno.cz
Zdroje
1. Wardrop D, Keeling D. The story of the discovery of heparin and warfarin. Br J Haematol 2008;141 : 757–763.
2. Shampo MA, Kyle ARJ. Erik Jorpes – pioneer in the identification and clinical applications ofh. Mayo Clin Proc 1997;72 : 1056.
3. Markwardt F. Historical perspective of the development of thrombin inhibitors. Pathophysiol Haemost Thromb 2002;32(suppl 3):15–22.
4. Bauer KA, Hawkins PCP, Petitou M, et al. Fondaparinux, a synthetic pentasaccharide: the first in a new class of antithrombotic agents – the selective factor Xa inhibitors. Cardiovasc Drug Rev 2002;20(1): 37–52.
5. Yeh CH, Fredenburgh JC, Weitz JI. Oral direct factor Xa inhibitors. Circ Res 2012;111 : 1069–1078.
6. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic therapy for VTE disease. CHEST Guideline and Expert Panel Report. CHEST 2016;149(2):315–352.
7. Barnes GD, Ageno W, Ansell J, Kaatz S. For the subcommittee on the control of anticoagulation. Recommendation on the nomenclature for oral anticoagulants: communication from the SSC of the ISTH. J Thromb Haemost 2015;13(6):1154–1156.
8. Nutescu EA, Burnett A, Fanikos J, et al. Pharmacology of anticoagulants used in the treatment of venous thromboembolism. J Thromb Thrombolysis 2016;41 : 15–31.
9. Greinacher A, Warkentin TE. The direct thrombin inhibitor hirudin, Thromb Haemost 2008;99 : 819–829.
10. Escolar G, Bozzo J, Maragall S. Argatroban: A direct thrombin inhibitor with reliable and predictable anticoagulant actions. Drugs Today 2006;42(4):223.
11. Clagett GP, Reisch JS. Prevention of venous thromboembolism in general surgical patients: results of meta-analysis. Ann Surg 1988;208 : 227–240.
12. Bergqvist D. Low molecular weight heparin for the prevention of venous thromboembolism after abdominal surgery. Br J Surg 2004;91 : 965–974.
13. Bultas J, Karetová D. Antitrombotika v prevenci cévní mozkové příhody, 2. Část – význam antikoagulační léčby. Kardiol Rev 2013;15(1):41–53.
14. Lip GYH, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest 2010;137 : 263–272.
15. The European Medicines Agency. Souhrn údajů o přípravku Arixtra. [online]. Dostupné na www: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000403/WC500027746.pdf.
16. The European Medicines Agency. Souhrn údajů o přípravku Pradaxa. [online]. Dostupné na www: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000829/WC500041059.pdf>.
17. The European Medicines Agency. Souhrn údajů o přípravku Eliquis. [online]. Dostupné na www: <http://www.ema.europa.eu/docs/cs_CZ/document_librar/EPAR_-_Product_Information/human/002148/WC500107728.pdf >.
18. The European Medicines Agency. Souhrn údajů o přípravku Xarelto. [online]. Dostupné na www: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000944/WC500057108.pdf>.
19. The European Medicines Agency. Souhrn údajů o přípravku Lixiana. [online]. Dostupné z: <https://www.ema.europa.eu/en/documents/product-information/lixiana-epar-product-information_cs.pdf>
20. Junqueira DR, Perini E, Penholati RR, Carvalho MG. Unfractionated heparin versus low molecular weight heparin for avoiding heparin-induced thrombocytopenia in postoperative patients. Cochrane Database Syst Rev 2012;(9):CD007557 doi: 10.1002/14651858.CD007557.pub2.
21. Matýšková M. Warfarin, potrava a potravinové doplňky. Interní Med 2010;12(2):87–91.
22. Kvasnička J, Hájková J, Bobčíková P, et al. Prevalence polymorfismů CYP2C9 a VKORC1 v České republice a zamyšlení nad výhledy antikoagulační léčby warfarinem. Cor et Vasa, Epstein et al., JACC 2010;55 : 280.
23. Heparin-leciva-spc.pdf. Dostupné na www: http://www.sukl.cz/modules/medication/detail.php?code=0091915&tab=texts.
24. Fitzmaurice DA, Blann AD, Lip GYH. Bleeding risks of antithrombotic therapy. BMJ 2002;325(7368):828–831.
25. Baglin T, Barrowcliffe TW, Cohen A, Greaves M. for the British Committee for Standards in Haematology. Guidelines on the use and monitoring of heparin. Br J Haematol 2006;133 : 19–34 doi:10.1111/j.1365-2141.2005.05953.x.
26. Samuelson BT, Cuker A, Siegal DM, et al. Laboratory assessment of the anticoagulant aktivity of direct oral anticoagulants. Chest 2017;151(1):127–138 http://dx.doi.org/10.1016/j.chest.2016.08.1462.
27. Salmonson T, Dogné J-M, Janssen H, et al. Non-vitamin-Koral anticoagulants and laboratory testing: now and in the future. Views from a workshop at the European Medicines Agency (EMA). Europ Heart J – Cardiovasc Pharmacoth 2017;3 : 42–47 doi:10.1093/ehjcvp/pvw032.
28. Pollack CV, Reilly PA, van Ryn J, et al. Idarucizumab for dabigatran reversal – full cohort Aanalysis. N Engl J Med 2017;377 : 431–441 DOI: 10.1056/NEJMoa1707278.
29. Siegal DM, Curnutte JT, Connolly SJ, et al. Andexanet alfa for the reversal of factor Xa inhibitor activity. N Engl J Med 2015;373 : 2413–2424 DOI: 10.1056/NEJMoa1510991.
30. Hu TY, Vaidya VR, Asirvatham SJ. Reversing anticoagulant effects of novel oral anticoagulants: role of ciraparantag, andexanet alfa, and idarucizumab. Vascular Health Risk Management 2016;12 : 35–44 https://doi.org/10.2147/VHRM.S89130.
31. Nielsen PB, Skjøth F, Søgaard M, et al. Effectiveness and safety of reduced dose non-vitamin K antagonist oral anticoagulants and warfarin in patients with atrial fibrillation: propensity weighted nationwide cohort study. BMJ 2017;356:j510 doi: 10.1136/bmj.j510.
32. Michalcová J, Penka, M, Buliková A, et al. Nová – přímá perorální antikoagulancia: aktuální přehled. Vnitr Lek 2016;62(10):805–813.
33. Robertson L, KestevenP, McCaslin JE. Oral direct thrombin inhibitors or oral factor Xa inhibitors for the treatment of deep vein thrombosis. Cochrane Database of Systematic Reviews 2015;6: Art. No.:CD010956 DOI: 10.1002/14651858.CD010956.pub2..
34. Cohen AT, Hamilton M, Mitchell SA, et al. Comparison of the novel oral anticoagulants apixaban, dabigatran, edoxaban, and rivaroxaban in the initial and long-term treatment and prevention of venous thromboembolism: systematic review and network meta-analysis. PLoS ONE 2015;10(12):e0144856 doi.org/10.1371/journal.pone.0144856.
35. Kvasnička J, Penka M, Kvasnička T, et al. Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti
J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilátem, apixabanem a rivaroxabanem. Vnitr Lek 2015;61(6):537–546.Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Úvodník
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- Posledních 25 let v diagnostice a léčbě myelodysplastického syndromu
- Vývoj transfuzní služby v České republice po roce 1990
- Vývoj léčby chronické myeloidní leukemie v posledních 25 letech
- 25 let nepříbuzenského darování krvetvorných buněk
- Vývoj transplantací hematopoetických buněk v posledních 25 letech
- 25 rokov podpornej antiinfekčnej liečby v hematoonkológii
- 25 let vývoje metod molekulární biologie a jejich uplatnění v hemato(onko)logii
- 25 let vývoje dětské hematologie
- 25 rokov v komplexnej starostlivosti a liečbe hemofílie
- Ohlédnutí za vývojem antitrombotické profylaxe s akcentem na posledních 25 let
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
- Úvodník
- Transfuze a hematologie dnes – průřez historií
- Ohlédnutí za čtvrtstoletím léčby chronické lymfocytární leukemie
- Non-Hodgkinův lymfom v České republice
- Hodgkinův lymfom – nekončící příběh
- Vývoj diagnostiky a léčby mnohočetného myelomu v průběhu posledních 25 let
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hodgkinův lymfom – nekončící příběh
- Non-Hodgkinův lymfom v České republice
- Vývoj transfuzní služby v České republice po roce 1990
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



