-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
18 MONOKLONÁLNÍ GAMAPATIE NEJASNÉHO VÝZNAMU (MGUS): DOPORUČENÍ PRO SLEDOVÁNÍ A PRO STRATIFIKACI RIZIKA PŘECHODU V MNOHOČETNÝ MYELOM
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. Supplementum1, p. 151-155.
Kategorie: Diagnostika a léčba mnohočetného myelomu
Monoklonální gamapatie nejasného významu (MGUS) je nejčastější se vyskytující typ monoklonálních gamapatií (MG). Diagnóza MGUS je definována přítomností monoklonálního proteinu (M-proteinu), který je možné zjistit v séru/v moči pacienta, nebo přítomností patologického poměru volných lehkých řetězců (FLC) v séru, přičemž nejsou splněna diagnostická kritéria mnohočetného myelomu (MM), Morbus Waldenström (WM), AL-amyloidózy (AL) nebo jiného lymfoproliferativního onemocnění [Kyle, 2002; Rajkumar, 2014, 2016]. Každému MM předchází vývojové stadium MGUS – obrázek 1 [Landgren, 2009].
Obr. 1. Vývojová stadia 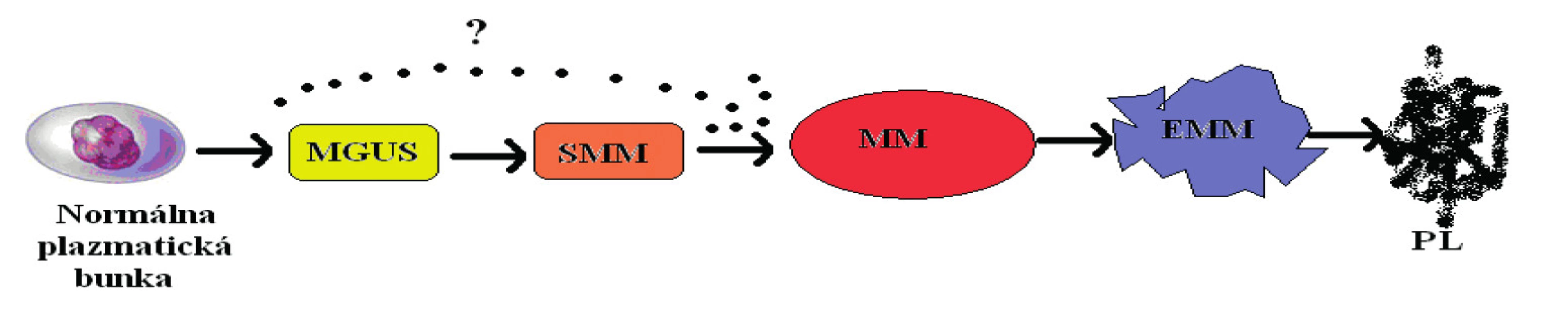
MGUS – monoklonální gamapatie nejasného významu, SMM – doutnající (smoldering) mnohočetný myelom, MM – mnohočetný myelom, EMM – extramedulární myelom, PL – plazmocelulární leukemie (Upraveno podle [Konigsberg et al., 2000].) 18. 1 Diagnóza MGUS
Diagnóza MGUS se stanovuje „per exclusionem“, to znamená na podkladě splnění všech laboratorních kritérií a po vyloučení jiné MG, případně jiného zhoubného B-lymfoproliferativního onemocnění. Poměrně často je MG asociována s kožními a revmatickými chorobami. S možným výskytem M-proteinu, někdy jenom přechodným, je třeba počítat i u imunodeficiencí [Križalkovičová, 2010; Klincová, 2011]. Diagnostická kritéria MGUS byla aktualizována v roce 2016. Hodnota M-proteinu v séru (non-IgM typ) musí být pod 30 g/l, počet klonálních plazmocytů (PC) v kostní dřeni nesmí přesáhnout hodnotu 10 % a nesmí být přítomny známky orgánového poškození (CRAB-symptomy), které by souvisely s plazmocelulárním onemocněním (tab. 18. 1) [Rajkumar, 2014, 2016, IMWG].
Tabulka 18. 1 Diagnostická kritéria MGUS 
(Upraveno podle [Rajkumar et al., 2014, 2016].) 18. 2 Prognostické faktory maligní transformace MGUS
Riziko maligní transformace MGUS do MM nebo jiných asociovaných nemocí je přibližně 1 % ročně [Kyle et al., 2002, 2007]. Pro MGUS typu IgM je riziko maligní transformace o něco vyšší – 1,5 % ročně [Kyle et al., 2005]. Mezi významné prognostické markery maligní transformace patří: koncentrace sérového M-proteinu [Cesana et al., 2002; Kyle et al., 2004], stabilita koncentrace sérového M-proteinu v čase (evolving a non-evolving typ MGUS [Rosinol et al., 2007], izotyp těžkého řetězce M-proteinu [Kyle et al., 2002; Cesana et al., 2002, Kyle et al., 2004], poměr volných lehkých řetězců v séru (FLC ratio) [Rajkumar et al., 2005], přítomnost B-J proteinurie [Cesana et al., 2002], infiltrace kostní dřeně plazmocyty (PC) [Van de Vonk et al., 2014; Cesana et al., 2002; Rosinol et al., 2007], imunoparéza neklonálních imunoglobulinů [Pika et al., 2015; Perez-Persona, et al., 2010; Katzmann et al., 2013], poměr fenotypově normálních a abnormálních populací PC za pomoci flowcytometrické analýzy [Perez-Persona et al., 2007, 2010], přítomnost cirkulujících PC v periferní krvi [Kumar et al., 2005], stanovení těžkých řetězců metodikou hevylite [Radocha, 2015], DNA aneuploidie a cytogeneticlé změny [Kaufmann et al., 2004; Drach et al., 2005]. Ze zobrazovacích vyšetření mají své místo v predikci rizika maligní transformace vyšetření pomocí magnetickou rezonancí (MRI) a pozitronovou emisní tomografií (PET/CT) [Hillengass et al., 2014; Heuck et al., 2011].
18. 3 Rizikové modely maligní transformace MGUS
MAYO model
V roce 2005 byl Mayo klinikou navržen první rizikově-stratifikační model (MAYO model) predikce maligního zvratu MGUS. Tento model byl založen na detekci tří rizikových faktorů: ≥ 15 g/l koncentrace sérového M-proteinu, non-IgG izotyp těžkého řetězce M-proteinu a abnormální (< 0,26 nebo > 1,65) poměr FLC v séru. Bylo zjištěno, že 58 % pacientů s těmito třemi faktory v rizikových hodnotách progreduje během 20 let od stanovení diagnózy (tab. 18. 2) [Rajkumar et al., 2005].
Tabulka 18. 2 Srovnání rizika maligní transformace pacientů s MGUS v jednotlivých rizikových skupinách definovaných pomocí tří známých rizikově-stratifikačních modelů 
Upraveno podle [Rajkumar et al., 2005; Perez-Persona et al., 2007; Perez-Persona et al., 2010; Sandecká et al., 2017]. Mayo model (2005) – čtyři rizikové skupiny pacientů s MGUS definovány na základě přítomnosti 0–3 rizikových faktorů: ≥ 15 g/l koncentrace sérového M-proteinu, non-IgG izotyp těžkého řetězce M- proteinu a abnormální poměr FLC v séru. PETHEMA model (2007) – dvě rizikové skupiny pacientů s MGUS definovány na základě 0–2 rizikových faktorů: ≥ 95% proporce aPC v rámci všech PC v kostní dřeni a aneuploidie DNA. PETHEMA model (2010) – tři rizikové skupiny pacientů s MGUS definovány na základě 0–2 rizikových faktorů: ≥ 95 % proporce aPC v rámci všech PC v kostní dřeni a „evolving“ povaha sérového M-proteinu. CMG model (2017) – pět rizikových skupin pacientů s MGUS definovány na základě přítomnosti 0–5 rizikových faktorů: koncentrace M-proteinu v séru ≥ 15 g/l ,patologický poměr FLC < 0,26 or > 1,65), infiltrace kostní dřeně PC > 5%, imunoparéza a hodnota sérového hemoglobinu < 120 g/l. PETHEMA model
V roce 2007 byl Pethema skupinou publikován rizikově-stratifikační model (PETHEMA model) maligní transformace pacientů s MGUS založený na stanovení procenta fenotypově abnormálních PC (aPC) v rámci všech PC kostní dřeně a přítomnosti aneuploidních změn (tzv. DNA index) [Perez-Persona et al., 2007]. Autoři této studie zjistili, že pacienti s MGUS, u nichž je ≥ 95 % PC kostní dřeně abnormálního fenotypu a zároveň je přítomna aneuploidie, mají 46% riziko maligního zvratu v nadcházejících 5 letech sledování. O tři roky později publikovala stejná výzkumná skupina podobný rizikově-stratifikační model progrese pacientů s MGUS, který zahrnoval analýzu proporce aPC stejně jako předchozí model a kontinuální hodnocení stability množství sérového M-proteinu v čase. Vyvíjející se MGUS, tzv. „evolving“, byl definován jako minimálně 10% zvýšení koncentrace M-proteinu v séru během 3 let, jež bylo potvrzeno dvěma následujícími měřeními po nejméně jednom měsíci. Bylo popsáno, že 72 % pacientů s MGUS s ≥ 95% proporcí aPC v rámci všech PC v kostní dřeni a „evolving“ charakterem progreduje během následujících 7 let od stanovení diagnózy, viz tabulka 18. 2 [Perez-Persona et al., 2010].
CMG model
V roce 2017 byl Českou myelomovou skupinou navržen třetí rizikově-stratifikační model (CMG model) predikce maligního zvratu MGUS do MM nebo jiné hematologické malignity. Model byl postaven na základě pěti rizikových faktorů: koncentrace M-proteinu v séru ≥ 15 g/l, patologický poměr FLC (< 0,26 nebo >1,65), infiltrace kostní dřeně PC > 5 %, přítomnost imunoparézy a hodnota sérového hemoglobinu < 120 g/l. Riziko progrese při 10letém sledování bylo 1,6 % pro skupinu bez rizikového faktoru; 16,9 % pro skupinu s 1 rizikovým faktorem; 22,9 % pro skupinu se 2 rizikovými faktory; 39,4 % pro skupinu se 3 rizikovými faktory a 52,3 %, pokud bylo přítomno 4–5 rizikových faktorů (p < 0,001). MGUS skupina, která měla 4–5 rizikových faktorů, měla 63krát vyšší riziko progrese při porovnání s referenční skupinou (p < 0,001) [Sandecká et al., 2017].
18. 4. Diagnostický algoritmus MGUS
V průběhu sledování osob s MGUS používáme standardní panel vyšetření (krevní obraz, základní biochemické vyšetření zahrnující stanovení sérových koncentrací urey, kreatinu, vápníku, celkové bílkoviny, C-reaktivního proteinu, beta2-mikroglobulinu, albuminu, laktátdehydrogenázy, jaterních enzymů, glukózy, dále kvantitativní stanovení imunoglobulinů a FLC v séru včetně stanovení jejich poměru, elektroforézu, případně imunofixaci séra a moči). Vyšetření kostní dřeně není nutné u asymptomatických pacientů s MGUS typu IgG, jestliže sérový M-protein je ≤ 15 g/l a nejsou známky orgánového poškození. Na druhé straně, vyšetření kostní dřeně by mělo být součástí diagnostického algoritmu pro všechny pacienty s MGUS typu IgA a IgM. Zobrazovací vyšetření není běžně doporučováno u pacientů s M-proteinem typu IgG ≤ 15 g/l a při M-proteinu typu IgA ≤ 10 g/l bez kostních bolestí. U všech ostatních pacientů je vhodné provedení RTG celého skeletu, resp. dnes spíše „low-dose“ CT, případně celotělového MR, PET/CT nebo PET/MR vyšetření [Van de Vonk et al., 2014].
18. 5. Dispenzarizace MGUS pacientů
Vzhledem k tomu, že u pacientů s MGUS nedochází s délkou sledování ke snížení rizika progrese, je doporučeno jejich celoživotní sledování.
V prvním roce sledování je doporučeno upřesnit dynamiku nárůstu M-proteinu (např. vyšetření 2., 4., 7. a 12. měsíc v prvním roce) pro určení dynamiky MGUS. Pacienti s nízkým rizikem by měli být dále sledováni po 6 měsících. Pokud jde o stabilní stav bez známek progrese, pak stačí dále již jen každé 2–3 roky. Všichni ostatní pacienti s MGUS by měli být kontrolováni po 4–6 měsících, a pokud jde o stabilní stav, pak stačí jednou ročně [Sandecká et al., 2017, Van de Vonk et al., 2014]. Obecně platí, že s délkou sledování při stabilním MGUS může postupně klesat počet kontrol. Minimální interval jednoho roku mezi kontrolami se však zdá z praktického hlediska optimální dobou, neboť při větším rozvolnění intervalů se pacienti častěji ztrácí ze systému dispenzarizace.
18. 6 Správný a úplný zápis diagnózy MGUS
Správným diagnostickým výstupem je např. následný vzorový zápis.
MGUS IgG-kappa, nízké riziko transformace
= doporučeny pravidelné kontroly á 12–18 měsíců od druhého roku sledování
MGUS IgG-kappa, nízké až střední riziko transformace
= doporučeny pravidelné kontroly á 6–12 měsíců od druhého roku sledování
MGUS IgG-kappa, střední až vysoké riziko transformace
= doporučeny pravidelné kontroly á 4–6 měsíců od druhého roku sledování
MGUS IgG-kappa, vysoké riziko transformace
= doporučeny pravidelné kontroly á 2–4 měsíce od druhého roku sledování
18. 7. Doporučení pro sledování pacientů s MGUS a pro stratifikaci rizika přechodu v MM
- Po vyloučení jiného typu MG musí být pro stanovení diagnózy MGUS splněna kritéria podle IMWG z roku 2016 (stupeň doporučení C, úroveň důkazu IV).
- Optimálním diagnostickým výstupem je zápis obsahující: typ Ig paraproteinu, určení rizika transformace s doporučenou frekvencí sledování (stupeň doporučení C, úroveň důkazu IV).
- Doporučený panel vyšetření v rámci sledování zahrnuje: krevní obraz, základní biochemické vyšetření zahrnující stanovení sérových koncentrací urey, kreatinu, vápníku, celkové bílkoviny, C-reaktivního proteinu, beta2-mikroglobulinu, albuminu, laktátdehydrogenázy, jaterních enzymů, glukózy, dále kvantitativní stanovení imunoglobulinů a FLC v séru včetně stanovení jejich poměru, elektroforézu, případně imunofixaci séra a moči. Vyšetření kostní dřeně je doporučeno u IgG MGUS v případě sérového M-proteinu ≥ 15 g/l a u všech IgA a IgM typů MGUS. Zobrazovací vyšetření není běžně doporučováno u pacientů s M-proteinem typu IgG ≤ 15 g/l a při M-proteinu typu IgA ≤ 10 g/l bez kostních bolestí. U všech ostatních pacientů je vhodné provedení RTG celého skeletu, resp. dnes spíše „low-dose“ CT, případně celotělového MRI, PET/CT či PET/MRI vyšetření (stupeň doporučení C, úroveň důkazu IV).
- Frekvence sledování v prvním roce upřesňuje dynamiku MGUS ( interval 2–4 měsíce). Kontrolní vyšetření od druhého roku sledování jsou v intervalech od 2–4 měsíců do 12–18 měsíců v závislosti na míře rizika transformace. Minimální interval jednoho roku mezi kontrolami je optimální dobou z praktického hlediska (stupeň doporučení C, úroveň důkazu IV).
Zdroje
1. Kyle RA, Rajkumar V. Monoclonal gammopathies of undetermined significance. Myeloma. London: Martin Dunitz Ltd 2002 : 415–432.
2. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International myeloma working group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014;15 : 538–548.
3. Rajkumar SV. CME Information: Multiple Myeloma: 2016 update on diagnosis, risk-factors and management. Am J Hematol. 2016; 91 : 719–734.
4. Landgren O, Kyle RA, Pfeiffer RM et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood 2009; 113 : 5412–5417.
5. Konigsberg R, Zojer N, Ackermann J, et al. Predictive role of interphase cytogenetics for survival of patients with multiple myeloma. J Clin Oncol 2000; 18 : 804–812.
6. Krizalkovicová V, Maisnar V, Pour L, Radocha J, Hájek R.: Monoclonal gammopathies of undetermined significance. Klin Onkol. 2008;21(4):160–164.
7. Klincová M., Mikulášová A., Kovářová L., Sandecká V. et al. Prognóza vysoko rizikovej skupiny monoklonálnej gamapatie nejasného významu (MGUS) a asymptomatického mnohopočetného myelómu (SMM). Onkologie 2011; 5(3): 146–150.
8. Kyle RA, Therneau TM, Rajkumar SV, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. The New England journal of medicine, 2002; 346(8):564–569.
9. Kyle RA, Rajkumar SV: Monoclonal gammopathy of undetermined significance and smouldering multiple myeloma: emphasis on risk factors for progression. British Journal of Haematology, 2007;139(5):730–743.
10. Kyle RA, Rajkumar SV, Therneau TM, et al. Prognostic factors and predictors of outcome of immunoglobulin M monoclonal gammopathy of undetermined significance. Clin Lymphoma. 2005; Mar;5(4):257–260.
11. Cesana C, Klersy C, Barbarano L et al. Prognostic factors for malignant transformation in monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. J Clin Oncol., 2002; 20 : 1625–1634.
12. Kyle RA, Therneau TM, Rajkumar SV, et al. Long-term follow-up of 241 patients with monoclonal gammopathy of undetermined significance: the original Mayo Clinic series 25 years later. Mayo Clinic proceedings. 2004; 79(7):859–866.
13. Rosiňol L, Cibeira MT, Montoto S et al. Monoclonal gammopathy of undetermined significance: predictors of malignant transformation and recognition of an evolving type characterized by a progressive increase in M protein size. Mayo Clin Proc. 2007; 82 : 428–434
14. Rajkumar SV, Kyle RA, Therneau TM et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood. 2005;106 : 812–817.
15. Van de Donk NW, Palumbo A, Johnsen HE et al. The clinical relevance and management of monoclonal gammopathy of undetermined significance and related disorders: recommendations from the European Myeloma Network. Haematologica 2014; 99(6):984–996.
16. Pika T, Lochman P, Sandecka V, Maisnar V, et al. Immunoparesis in MGUS - Relationship of uninvolved immunoglobulin pair suppression and polyclonal immunoglobuline levels to MGUS risk categories.Neoplasma. 2015;62(5):827–832.
17. Perez-Persona E, Mateos G, Garcia-Sanz R, et al. Risk of progression in smouldering myeloma and monoclonal gammopathies of unknown significance: comparative analysis of the evolution of monoclonal component and multiparameter flow cytometry of bone marrow plasma cells. Brit J Haematol. 2010; 148(1): 110–114.
18. Katzmann JA, Clark R, Kyle RA, et al. Suppresion of uninvolved immunoglobulins defined by heavy/light chain pair suppression is a risk factor for progression of MGUS. Leukemia. 2013;27(1):208–212.
19. Perez-Persona E, Vidriales MB, Mateo G et al. New criteria to identify risk of progression in monoclonal gammopathy of uncertain significance and smoldering multiple myeloma based on multiparameter flow cytometry analysis of bone marrow plasma cells. Blood, 2007; 110 : 2586–2592.
20. Kumar S, Rajkumar SV, Kyle RA et al. Prognostic value of circulating plasma cells in monoclonal gammopathy of undetermined significance. J Clin Oncol. 2005; 23 : 5668–5674.
21. Radocha J. HevyLite™ - nová metoda detekce monoklonálních imunoglobulinů – editorial. Vnitr Lek. 2015 Jan;61(1):13–14.
22. Kaufmann H, Ackermann J, Baldia C, et al. Both IGH translocations and chromosome 13q deletions are early events in monoclonal gammopathy of undetermined significance and do not evolve during transition to multiple myeloma. Leukemia, 2004; 18(11):1879–1881.
23. Drach J, Angerler J, Schuster J, et al. Interphase fluorescence in situ hybridization identifies chromosomal abnormalities in plasma cells from patients with monoclonal gammopathy of undetermined significance. Blood, 1995; 86(10):3915–3921.
24. Hillengass J, Weber MA, Kilk K, et al. Prognostic significance of whole - body MRI in patients with monoclonal gammopathy of undetermined significance. Leukemia, 2014;28(1):174–178.
25. Heuck C, Sexton R, Dhodapkar M, et al. SWOG S0120 Observational Trial for MGUS and Asymptomatic Multiple Myeloma (AMM): Imaging Predictors of Progression for gammopathy of undetermined significance does not affected outcomes in patients undergoing solid organ transplants. Transplantation, 2011;92(5):570–574.
26. Sandecká V, Hájek R, Pour L et al. A first Czech analysis of 1887 cases with monoclonal gammopathy of undetermined significance. Eur J Haematol. 2017 Jul;99(1):80–90.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek 7 LÉČEBNÉ STRATEGIEČlánek Úvodní slovo
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2018 Číslo Supplementum1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
-
8 Léčba mnohočetného myelomu
8. 9 Panobinostat -
8 Léčba mnohočetného myelomu
8. 10 Bendamustin -
8 Léčba mnohočetného myelomu
8. 11 Alkylační a jiná cytostatika, glukokortikoidy - 9 VYSOKODÁVKOVANÁ CHEMOTERAPIE S TRANSPLANTACÍ AUTOLOGNÍCH KMENOVÝCH BUNĚK
- 10 ALOGENNÍ TRANSPLANTACE KRVETVORNÝCH BUNĚK
- 11 UDRŽOVACÍ A KONSOLIDAČNÍ LÉČBA
- 12 LÉČBA MNOHOČETNÉHO MYELOMU U NEMOCNÝCH SE SELHÁNÍM FUNKCE LEDVIN
- 13 VYBRANÉ OBLASTI Z KOMPLEXNÍ PODPŮRNÉ LÉČBY MNOHOČETNÉHO MYELOMU
- 14 LÉKY INHIBUJÍCÍ OSTEOLÝZU U PACIENTŮ S MNOHOČETNÝM MYELOMEM V ROCE 2018
- 15 KOMPLEXNÍ PODPŮRNÁ LÉČBA – ANÉMIE
- 16 PROFYLAXE TROMBOEMBOLICKÉ NEMOCI U PACIENTŮ S MNOHOČETNÝM MYELOMEM
- 17 PROFYLAXE INFEKČNÍCH KOMPLIKACÍ
- 18 MONOKLONÁLNÍ GAMAPATIE NEJASNÉHO VÝZNAMU (MGUS): DOPORUČENÍ PRO SLEDOVÁNÍ A PRO STRATIFIKACI RIZIKA PŘECHODU V MNOHOČETNÝ MYELOM
- 19 REÁLNÁ DATA O LÉČBĚ Z REGISTRU MONOKLONÁLNÍCH GAMAPATIÍ
- 1 METODICKÉ POSTUPY TVORBY DOPORUČENÍ
- 2 EPIDEMIOLOGIE MNOHOČETNÉHO MYELOMU
- 3 NEJČASTĚJŠÍ PROJEVY NEMOCI A VYŠETŘENÍ VEDOUCÍ K ROZPOZNÁNÍ A KE STANOVENÍ ROZSAHU NEMOCI
- 4 KRITÉRIA PRO STANOVENÍ DIAGNÓZY MNOHOČETNÉHO MYELOMU A JEHO KLINICKÉHO STADIA, KRITÉRIA DALŠÍCH PLAZMOCELULÁRNÍCH CHOROB
- 5 KRITÉRIA PRO HODNOCENÍ LÉČEBNÉHO EFEKTU A DLOUHODOBÉ ÚSPĚŠNOSTI LÉČBY
- 6 OBECNÉ INFORMACE O LÉČBĚ MNOHOČETNÉHO MYELOMU
- 7 LÉČEBNÉ STRATEGIE
- Úvodní slovo
-
8 Léčba mnohočetného myelomu
8. 1 Thalidomid -
8 Léčba mnohočetného myelomu
8. 2 Lenalidomid - DIAGNOSTIKA A LÉČBA MNOHOČETNÉHO MYELOMU
-
8 Léčba mnohočetného myelomu
8. 3 Pomalidomid -
8 Léčba mnohočetného myelomu
8.4 BORTEZOMIB -
8 Léčba mnohočetného myelomu
8. 5 Karfilzomib -
8 Léčba mnohočetného myelomu
8. 6 Ixazomib -
8 Léčba mnohočetného myelomu
8. 7 Daratumumab -
8 Léčba mnohočetného myelomu
8. 8. Elotuzumab
-
8 Léčba mnohočetného myelomu
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- DIAGNOSTIKA A LÉČBA MNOHOČETNÉHO MYELOMU
- 3 NEJČASTĚJŠÍ PROJEVY NEMOCI A VYŠETŘENÍ VEDOUCÍ K ROZPOZNÁNÍ A KE STANOVENÍ ROZSAHU NEMOCI
- 11 UDRŽOVACÍ A KONSOLIDAČNÍ LÉČBA
- 18 MONOKLONÁLNÍ GAMAPATIE NEJASNÉHO VÝZNAMU (MGUS): DOPORUČENÍ PRO SLEDOVÁNÍ A PRO STRATIFIKACI RIZIKA PŘECHODU V MNOHOČETNÝ MYELOM
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



