-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
The significance of heavy/light chain immunoglobulin pairs (Hevylite™) in multiple myeloma
This article aims to provide information regarding the benefits of the new, highly sensitive analytical method for serum immunoglobulins (HevyliteTM). The assay allows separate quantitative analysis of heavy/light chain immunoglobulin pairs (HLC), i.e. monoclonal („involved“) and polyclonal („uninvolved“) pairs, including their mutual ratio (HLC-r) in multiple myeloma. The article compares in depth the benefits of HevyliteTM versus standard techniques in the diagnosis and monitoring of multiple myeloma course; the evaluation of response to treatment, including minimal residual disease; the early detection of relapse and the prognostic stratification in terms of response duration and overall survival.
Key words:
multiple myeloma, monoclonal immunoglobulin heavy/light chain pairs, HevyliteTM, diagnosis, stratification, minimal residual disease, prognosis
Autoři: V. Ščudla 1; T. Pika 2; J. Minařík 2
Působiště autorů: 3. interní klinika-NRE Lékařské fakulty Univerzity Palackého a Fakultní nemocnice, Olomouc 1; Hemato-onkologická klinika Fakultní nemocnice, Olomouc 2
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. 4, p. 107-116.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Náplní sdělení je informace o přínosu nové, vysoce senzitivní analytické metody imunoglobulinů séra (HevyliteTM), umožňující separátní kvantitativní vyšetření párů těžkých/lehkých řetězců imunoglobulinu (HLC), tj. monoklonálního („involved“) a polyklonálního („noninvolved“) izotypu včetně jejich poměru (HLC-r) u mnohočetného myelomu. Hlubší pozornost je věnována srovnání přínosu HevyliteTM metody oproti standardním technikám v diagnostice a monitorování průběhu mnohočetného myelomu, hodnocení hloubky léčebné odezvy včetně minimální reziduální choroby, časné detekci relapsu a prognostické stratifikaci z pohledu trvání léčebné odezvy a celkového přežívání.
Klíčová slova:
mnohočetný myelom, monoklonální imunoglobulin, páry těžkých/lehkých řetězců imunoglobulinu, HevyliteTM, diagnóza, stratifikace, minimální reziduální nemoc, prognózaÚvod
Mnohočetný myelom (MM) je zhoubné onemocnění krvetvorného systému, vyznačující se monoklonální proliferací plazmatických buněk produkujících monoklonální imunoglobulin (MIg) nebo jeho strukturální komponentu, tj. lehký řetězec (LŘ) kappa (K) nebo lambda (L) a přítomností příznakového komplexu CRAB (hyperkalcemie, porucha renální funkce, anémie a postižení skeletu charakteru „myeloma bone disease“) (1, 2, 3). Odlišení normálního imunoglobulinu (Ig) od MIg včetně přesné kvantifikace obou typů Ig v séru patří k základním postupům v diagnostice, sledování průběhu, výběru léčby a odhadu prognózy MM (4, 5, 6, 7). Analýza proteinů séra u MM má tři hlavní cíle: detekci MIg, jeho imunochemickou typizaci a kvantifikaci (9). IMWG (International Myeloma Working Group) guidelines a další odborníci doporučují jako základní „screeningové“ metody v diagnostice a sledování MM standardní elektroforézu séra (SPE) a/nebo moče, imunofixační elektroforézu (IFE), nefelometrické vyšetření bílkovin séra (NEF) a vyšetření hladin volných lehkých řetězců imunoglobulinu (VLŘ) kappa a lambda metodou FreeliteTM, včetně výpočtu indexu monoklonality tj. poměru K/L (1, 2, 4, 5, 6, 8). Je známo, že použitelnost SPE je limitována nízkou hodnotou MIg v séru, (0,5–3 g/l), umístěním proužku MIg a úzkostí jeho fokusace v gelu (5). V případě IgA typu MIg nutno zohlednit „fenomén překrytí“, neboť jeho anodální elektroforetická migrační pozice interferuje s dalšími proteiny séra, např. v oblasti α s haptoglobinem, v oblasti β frakce s transferinem, lipoproteiny a C3 složkou komplementu. Katodální proužek IgG imunoglobulinu lze detekovat mnohem snadněji nežli anodální IgA mající navíc sklon k polymeraci. Všechny předestřené okolnosti přinášejí významné zkreslení opravdové koncentrace MIg v séru a/nebo v moči, a tím i nepřesné posouzení celkové nálože nádorové tkáně v organismu (4, 6, 10, 11, 12). Vyšetření celkové hladiny imunoglobulinu (Ig) s pomocí NEF některé z těchto limitací eliminuje, má však sklon zejména v případě vysoké koncentrace IgG M-proteinu jeho výši nadhodnocovat a neumožňuje diskriminaci mezi monoklonální (MIg) a polyklonální formou Ig (PIg) (6, 14). Tyto limitace, stejně jako další zkreslení výšky sérové hladiny MIg v důsledku změny objemu plazmy, hodnoty hematokritu a rozdílného poločasu katabolismu jednotlivých tříd Ig vedou k nespolehlivému určení koncentrace MIg v séru a k nepřesnému zhodnocení celkové myelomové masy (5, 6, 9, 12). Přesné stanovení MIg s pomocí SPE denzitometrie selhává u 46 % (6), 57 % (10) resp. u 33 % (11) nemocných s IgA typem MM zatímco u IgG typu pouze ve 4 % (6). Významným nedostatkem IFE je přes její vysokou citlivost v rozpoznání izotypu MIg nemožnost jeho kvantifikace, nedostatkem je i pouze vizuální hodnocení IFE proužku (5, 13). IFE ale zastává v současnosti pro svou vysokou citlivost a přes uvedené limitace roli „zlatého standardu“ v detekci a typizaci M-proteinu všech tříd Ig, tj. IgG, IgA, IgM, IgD, IgE (12). Metoda FreeliteTM, dnes již standardní nefelometrická, případně turbidimetrická technika využívaná k hodnocení sérových hladin VLŘ imunoglobulinu se vyznačuje vysokou přesností s kvantitativním vyjádřením klonality procesu (poměr K/L) a se zohledněním proměnlivosti renálního metabolismu VLŘ i změn krevního objemu, neposkytuje však informaci o syntéze intaktní formy MIg (4, 5).
Charakteristika Hevylite™ metody
Všeobecně známé limitace standardních metod odstraňuje metoda HevyliteTM, zavedená Bradwellem v roce 2009 (4, 5, 13). Tato nefelometrická, případně turbidimetrická technika umožňuje díky použití vysoce specifických, avidních polyklonálních protilátek proti junkčním epitopům umístěným mezi konstantními doménami těžkých a lehkých řetězců molekul Ig přesnou separátní kvantitativní analýzu páru těžkých/lehkých řetězců Ig kappa a lambda (HLC-K a HLC-L) (4, 5, 9, 13, 16, 17). Příprava univerzální, reproduktibilní a analyticky spolehlivého imunoanalytického testu je ale limitována strukturální variabilitou terčových epitopů, umístěných oboustranně na obou raméncích řetězců molekuly Ig (5). Metoda HevyliteTM tedy umožňuje přesnou separátní identifikaci a kvantifikaci sérové hladiny HLC-K a HLC-L, tj. nádorového („involved“) MIg vytvářeného myelomovými plazmocyty a nenádorového, polyklonálního, normálního („noninvolved“) Ig téhož izotypu, vytvářeného normálními reziduálními plazmatickými buňkami a tím i zhodnocení hloubky „imunoparézy“ (4, 5, 6, 13). U MM jde tedy o typ IgG-K/IgG-L a IgA-K/IgA-L s velmi důležitou možností výpočtu jejich vzájemného poměru (HLC-r), tj. poměru monoklonálního/polyklonálního Ig (HLC-K / HLC-L) (7, 8, 18, 19). Takto získané zhodnocení klonality procesu je přínosné v diagnostice a monitorování průběhu nemoci, stratifikaci, při časné detekci relapsu/progrese a prognózy nemocných nejen s MM (17), ale i s ostatními monoklonálními gamapatiemi (MG), tj. monoklonální gamapatii nejistého významu (MGUS) (13), AL amyloidózy (20) a Waldenströmovy makroglobulinemie (7, 8, 9, 18, 21). HevyliteTM metoda umožňuje v případě izolované pozitivity IFE kvantitativní vyhodnocení hladin HLC-K , HLC-L a jejich poměru (HLC-r) (5). Z dosavadních zkušeností vysvítá, že v případě IgG typu MIg je nález abnormální hodnoty HLC-r méně častý, nežli v případě typu IgA, neboť IgA imunoanalytický test je ve srovnání s testem IgG v hodnocení M-komponenty citlivější (5). Na podkladě rozsáhlé analýzy testovacího panelu dárců krve byla výrobcem (The Binding Site, Birmingham) doporučena pro klinickou praxi rozmezí normálních hladin HLC-K a HLC-L, včetně jejich poměru (HLC-r), viz tabelární přehled (tab. 1).
Tab. 1. Normální referenční meze párů těžkých/lehkých řetězců imunoglobulinu a jejich poměru kappa/lambda při použití metody Hevylite.TM 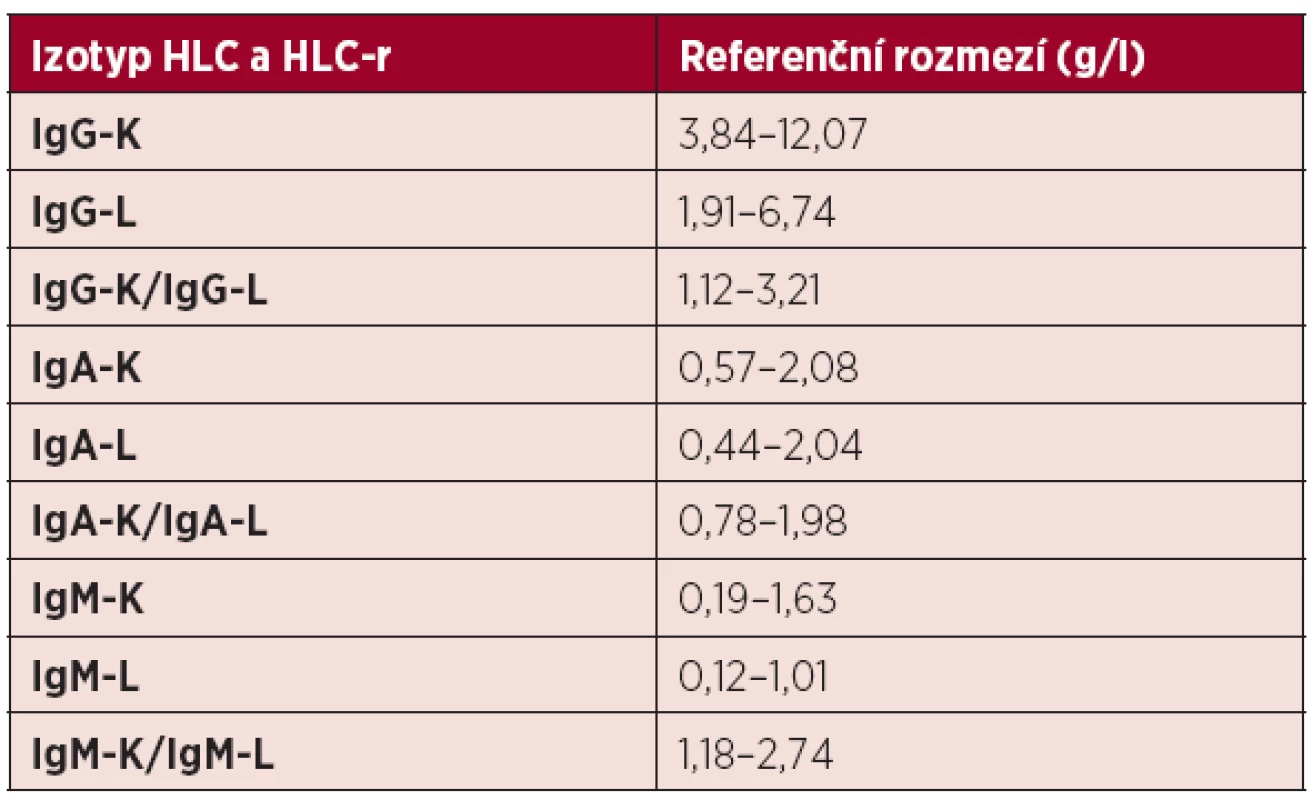
HLC – páry těžkých/lehkých řetězců imunoglobulinu, HLC-r – poměr HLC-kappa/HLClambda, K-kappa, L-lambda Východiska zavedení HLC analýzy u monoklonálních gamapatií
Již z biologické podstaty choroby se nemocní s MM vyznačují abnormální koncentrací HLC-K a HLC-L s různě výrazně odchylným vzájemným vztahem, tj. HLC-r. Abnormální hodnoty HLC-r, signalizující monoklonální charakter neoplastického procesu jsou výsledkem nikoliv pouze vzestupu tumorózního („involved“) MIg, ale i suprese netumorózního, tj. normálního („uninvolved“) Ig. Ve srovnání s MIg IgG typu se jeví HevyliteTM analýza u IgA a IgM typu MIg citlivější, nežli standardní SPE a do značné míry srovnatelná s výsledky IFE (4, 5). U nemocných s MM s izolovanou pozitivitou IFE přináší HevyliteTM technika navíc kvantitativně vyjádřené výsledky, přičemž stanovení HLC-r v důsledku zohlednění hloubky „imunoparézy“ významně rozšiřuje spektrum nalezených změn oproti pouhému stanovení výše MIg s pomocí SPE. Současné vyšetření hodnot HLC a HLC-r poskytuje mnohem přesnější a kvantitativní hodnocení změn postiženého Ig a podstatně dynamičtější informaci, nežli ostatní standardně používané techniky (9, 18). Hlavní příčinou abnormální hodnoty HLC-r může být u některých nemocných imunosuprese, dokumentovaná snížením koncentrace netumorózního („noninvolved“) HLC identifikující klonalitu procesu i v případě normální koncentrace nádorového („involved“) HLC (5). Výhodou stanovení HLC-r oproti SPE je nezkreslení získaného výsledku změnami objemu krve, výše hematokritu a variabilitou katabolismu MIg, způsobující až 30–50% kolísání MIg bez vztahu k vlastní neoplastické produkci a rozsahu nádorové masy (22). Hodnoty hematokritu a objem plazmy v krevním řečišti ovlivňují hodnoty M-proteinu všech tříd poněkud protichůdně (22). Vzestup hematokritu, např. po úspěšné léčbě MM vede k zvýšení koncentrace MIg bez skutečné změny jeho množství, přičemž nutno vzít v potaz i odlišné setrvání jednotlivých typů MIg ve vaskulárním kompartmentu (u IgM v 90 %, u IgG v 50 % a v případě sVLŘ pouze ve 20 %) v důsledku rozdílné velikosti jejich molekul. U MG dochází vzhledem k osmotické aktivitě molekul MIg ke změnám plazmatického objemu, neboť vysoká hodnota MIg objem plazmy zřetelně zvyšuje, takže klesne-li po léčbě koncentrace MIg, klesne i plazmatický objem a „vice versa“ (22, 23). Pouhé sledování hladiny M-proteinu v séru tedy skutečné změny nádorové produkce podhodnocuje a není spolehlivým výrazem změny objemu nádorové masy. V případě IgG jsou molekuly Ig odstraňovány z cirkulace procesy závislými na jejich koncentraci, takže jeho hladiny v séru neodpovídají skutečné nádorové produkci (8). Z uvedených příčin není hodnota MIg stanovená při diagnóze MM vhodným prognostickým ukazatelem, zatímco hladina sVLŘ, včetně poměru kappa/lambda ano (8). Výše IgA i IgM M-proteinu závisí v podstatné míře na stupni jejich degradace (24). Neonatální Fc receptory pro IgG (FcRn) se vyznačují vedle vazby na albumin i vazbou na IgG typ Ig (25). Heterodimerické molekuly FcRn tak ochraňují molekuly IgG a albuminu, z malé části i IgA před proteolytickou digescí, což vede k jejich mnohonásobné recyklaci s uvolňováním do kolující krve (26). Při vysoké koncentraci IgG v séru dochází k úplné saturaci FcRn způsobující, že IgG vázaný na FcRn je recyklován, zatímco volný IgG bez vazby na FcRn je urychleně degradován. Katabolický poločas IgG a to obdobně monoklonální i polyklonální frakce je při jeho normální koncentraci v séru ~ 21 dnů, zatímco v případě vysoké koncentrace má frakce nevázaná na FcRn receptory katabolický poločas pouze ~ 3 dny. Při velmi nízké koncentraci IgG dosahuje katabolický poločas tohoto izotypu Ig v důsledku vystupňované ochrany délky i několika týdnů (25, 26, 27). V případě IgA i IgM třídy Ig není jejich clearence závislá na koncentraci a proto katabolický poločas IgA typu M-proteinu je ~ 6 dnů, u IgM typu 5 dnů, takže nálož myelomové masy je u IgA MM ve srovnání s obdobnou koncentrací IgG typu relativně větší (24). Přínosem HevyliteTM metody je skutečnost, že měří nádorem produkované Ig přesněji, nežli poskytuje měření celkové hodnoty Ig s pomocí NEF a koncentrace MIg s pomocí SPE (8). I když hladiny IgA-K a IgA-L mají tendenci k navyšování hodnot s narůstajícím věkem, hodnota IgA HLC-r (12) stejně jako HLC-r u IgG typu (28) nemá k věku významný vztah. Přínosem vyšetřování HLC a HLC-r s pomocí HevyliteTM není tedy pouze pomoc v diagnostice a sledování průběhu MM, ale i poskytnutí informace o biologických vlastnostech nádorových a normálních plazmocytů, a tím i patogenezi MM (5, 6, 8, 13).
Klinický přínos vyšetřování HLC u mnohočetného myelomu
Diagnostika mnohočetného myelomu
První zkušenosti ukázaly, že vyšetření HLC-r s pomocí metody HevyliteTM je senzitivní ukazatel v diagnostice MM, neboť v prvotních studiích se všichni nemocní vyznačovali přítomností různě abnormálních hodnot (5, 6, 8, 15, 18). Bylo uváděno, že u MM je koncentrace monoklonálního HLC IgA-K a HLC IgA-L vždy abnormální (5, 15). Některé pozdější studie ale nalezly abnormální hodnoty HLC-r u IgA typu MM pouze v 95,6 % a u IgA-L typu v 92 % (12, 28) a v případě IgG typu v 97 % (28). Z dosavadních zkušeností vyplývá, že vyšetření HevyliteTM je v klinické praxi přínosné zejména tehdy, pokud monoklonální IgA komigruje při použití SPE s některými normálními proteiny, znemožňujícími přesnou denzitometrickou kvantifikaci MIg (15). M-protein třídy IgA může mít při SPE analýze formu širokého pruhu, případně i 2–3 proužků, odpovídajících přítomnosti monomerických a multimerických molekul, ztěžujících denzitometrickou kvantifikaci. HevyliteTM metoda se v diagnostice IgA typu MM vyznačuje velmi dobrou senzitivitou a specificitou, neboť zjištěná hodnota HLCr zohledňuje jak vzestup monoklonálního („involved“), tak i supresi normálního („noninvolved“), izotypu Ig (15). K přínosům HevyliteTM metody patří schopnost přesné kvantifikace MIg v případě obtížně vyšetřitelného SEP a NEF (6). Při srovnání výsledku IgA HLC-r s výsledkem IFE vykazuje HevyliteTM přístup 95,6% senzitivitu. IFE je tedy ve srovnání s HevyliteTM většinou citlivější a nelze ji pro nebezpečí selhání detekce MIg u některých nemocných s MM nahradit pouze vyšetřením IgA HLC-r s pomocí HevyliteTM techniky (12). Při interpretaci výsledku HLC-r je nutno rovněž zohlednit možnost vyšší hodnoty v případě významného vzestupu hladiny polyklonálního Ig ve třídě IgA, např. u jaterní cirhózy. Někteří autoři dokonce doporučují u těchto stavů použití širšího referenčního rozmezí, nežli je doporučené rozmezí normálních hodnot (tab. 1) (12). Nutno uvést, že přes četné limitace existuje u řady nemocných význačný stupeň shody mezi hodnotou MIg a tumorózním („involved“) HLC Ig (8). Byl rovněž zaznamenán pozitivní vztah mezi hodnotami HLC-r a celkovou koncentrací IgA HLC k procentuálnímu zastoupení plazmocytů v kostní dřeni (KD) (12). V případě vysoké hodnoty IgG HLC převyšující medián HLC, byla zjištěna korelace s tíží a s pokročilostí MM, charakterizovanou hodnotami Hb, výškou VLŘ-r a stupněm infiltrace KD myelomovými plazmocyty a v případě HLC-r navíc i s hodnotou β 2-M, nikoliv ale s hodnotou albuminu, LDH, kreatininu, vápníku, hladinou VLŘ v séru a stupněm pokročilosti myelomové kostní nemoci (18).
Monitorování mnohočetného myelomu
Monitorování průběhu MM podle změn výšky MIg v séru vyhodnocené SPE není dostatečně spolehlivé, neboť neodráží zcela věrohodně produkci MIg s ohledem na vlastnosti nádorové tkáně. Při monitorování IgA typu MM, koncentrace HLC IgA-K i IgA-L korelují do jisté míry s hodnotami MIg vyšetřenými SPE, technika HevyliteTM je ale přesnější a přínosnější, neboť poskytuje reprodukovatelné výsledky hladin nejen monoklonálního („involved“), ale i normálního („noninvolved“) izotypu Ig (15). Monitorování hodnoty HLC-r obdobně jako VLŘ může rozpoznat klonální evoluci, nepostřehnutelnou s použitím standardních technik (29). Oproti monitoraci MIg s pomocí SPE má sledování hodnoty HLC-r vyšší senzitivitu v rozpoznání nedostatečné léčebné odezvy a schopnost časného rozpoznání „evolving“ relapsu/progrese MM, což je cenné zejména u oligosekreční formy MM s MIg < 10 g/l (15). Monitorování HLC-r jako nový přístup u nemocných s obtížně měřitelnou hodnotou M-proteinu umožňuje hodnocení klonality i při nízké hladině MIg (6). U některých nemocných s IgG typem MM byla zjištěna překvapivá perzistence abnormální hodnoty HLC-r i při negativitě IFE, nebo zjištění abnormální hodnoty HLC-r dříve nežli s pomocí IFE (5). Obdobnou zkušenost zaznamenala i další studie věnovaná IgA typu MM, v níž abnormální hodnota HLC-r vedla k časnému podchycení „evolving“ relapsu ještě v období normální hodnoty MIg IgA (SPE) a HLC IgA-K (HevyliteTM) s dodatečným vývinem pozitivity IFE v odstupu 5,5 měsíců (6). Dlouhodobé monitorování změn HLC-r má tedy slibný potenciál nejen k citlivému zhodnocení hloubky kompletní remise (KR), rozpoznání neúplné léčebné odezvy, ale i k časnému odhalení nastupujícího relapsu/progrese MM a to zejména u oligosekreční formy MM (30). U hyposekreční formy MM byla zjištěna uspokojivá korelace výsledků HevyliteTM analýzy s NEF (15). Je zajímavé, že HevyliteTM metoda se u některých nemocných ukázala v detekci a monitorování minimální reziduální nemoci (MRD) citlivější nejen nežli SPE, ale dokonce i IFE, neboť může odhalit její perzistenci i při negativitě obou standardních technik (6). Bylo popsáno, že současná normalizace hladiny VLŘ, včetně poměru K/L a hodnoty HLC-r v období maximální léčebné odezvy je přínosnější pro hodnocení vývoje MM nežli výsledek IFE (31). Sledování HLC-r v průběhu terapie MM přináší nepřímo a neinvazivní cestou rychlou a dynamickou informaci o míře selektivního zániku myelomových plazmocytů a o změnách výskytu normálních/nemaligních plazmocelulárních elementů v KD tj. hodnocení stupně selektivní redukce nádorové populace v důsledku účinné léčby (4,5,6). Vyšetření HLC, především HLC-r umožňuje zejména u IgA a oligosekrečního typu MM díky precizní kvantifikaci M-proteinu podchycení delikátních změn MIg, rozpoznatelných tradičně pouze kvalitativně s pomocí IFE (13, 32, 33). Nelze nezmínit, že existují ovšem i ojedinělá pozorování normálních výsledků HevyliteTM metody přes pozitivitu SPE a IFE. V případě nízké hodnoty MIg mohlo jít spíše o MGUS nebo o iniciální stadium „low risk“ MM s nízkou produkcí MIg („involved“ Ig) a normální hladinou normálních („noninvolved“) Ig (6). V případě výskytu tzv. oligoklonálních proužků zejména v období po vysokodávkované chemoterapii s podporou autologní transplantaci kmenových buněk (VDT-ATKB) poskytuje HevyliteTM metoda informaci o jejich migrační pozici, napomáhající odlišení mezi rekurencí originálního M-proteinu a oligoklonálními proužky Ig stejného HLC izotypu s pouze odlišnou elektroforetickou migrací (9).
Hodnocení léčebné odezvy
Bazální hodnoty HLC a HLC-r vyšetřené při diagnóze MM nepredikují kvalitu léčebné odpovědi po indukční léčbě (6). Hodnoty HLC-r vyšetřené v období nejvyšší léčebné odezvy se ale významně liší podle její dosažené hloubky, tj. v KR (kompletní remise), nKR („nearly“ KR), VGPR („very good“ parciální remise), PR (parciální remise), MR (minimální léčebná odezva) a SD („stable disease“) (6). Bylo zjištěno, že nemocní s dosažením > VGPR a normalizací HLC-r po indukční terapii před VDT-ATKB se vyznačovali nízkým rizikem léčebného selhání a přítomnosti delšího intervalu do progrese nemoci (PFS) (6). Bylo pozorováno, že u IgA MM normalizace HLC-r předcházela detekci MRD dříve, nežli s pomocí IFE, neboť IFE poskytuje velmi citlivou informaci pouze o pohybu M-komponenty zatímco HLC o vývoji jak monoklonálního („involved“), tak i polyklonálního („noninvolved“) Ig (12, 15, 32). Úpravu HLC-r lze tedy interpretovat jako „neinvazivní“ informaci o paralelním vzestupu PIg jako projevu rekonstituce normálních plazmocytů a současného poklesu MIg jako výrazu suprese myelomového klonu (15). Validační studie prokázala, že pro monitorování v období po dosažení KR je metoda HevyliteTM podstatně citlivější nežli SPE a obdobně citlivá jako IFE (5, 15). Z jiného úhlu pohledu je podle některých autorů HLC-r spíše marker imunní rekonstituce po intenzivní léčbě nežli ukazatel MRD (34). Bylo popsáno, že hodnocení léčebné odezvy, založené na současné přítomnosti úpravy HLC a VLŘ-r je přínosnější nežli sKR. Časná normalizace hodnot HLC-r, zejména ale „HLC-diference“ < 1,8 vs. ≥ 1,8 g/l (rozdíl „involved“ a „noninvolved“ HLC) vyšetřené po 2 cyklech, tj. po 8 týdnech intenzivní chemoimunoterapie je u vysoce rizikových nemocných časným a nezávislým indikátorem rychlé a hluboké odezvy na antimyelomovou terapii, což umožňuje individuální úpravu léčby (35). Ukázalo se, že sledování FLC-r s pomocí FreeliteTM metody bylo oproti HLC-r (HevyliteTM) méně citlivé s přítomností diskordantních výsledků, dokumentujících variabilitu klonální evoluce v průběhu MM (6). Vedle perzistence původního nádorového klonu dochází zřejmě k vývinu nových subklonů, schopných produkce intaktní formy MIg (36, 37). Praktickou použitelnost klonální teorie MM potvrzuje pozorování nového záchytu produkce samotného LŘ, nebo nového izotypu intaktního MIg v koexistenci s původním izotypem intaktního MIg vytvářeného původní populací myelomových buněk, což přináší neinvazivní cestou cenné individuální informace o klonální evoluci MM (6, 36, 37). Univariační analýza prokázala významnou korelaci mezi supresí páru HLC, definovanou jako 50% redukci pod dolní hodnotu normálního rozmezí (tab. 2) a vysoce rizikovým cytogenetickým nálezem, tj. t(4;14), t(4;16), del 17p, ampl 1q21), nikoliv ale k tíži infiltrace KD plazmatickými buňkami (39). Analýza vztahu vysoce abnormálních hodnot HLC-r, převyšujících medián naměřených hodnot ve zkoumaném souboru IgG a IgA typu MM odhalila statisticky významný vztah k délce PFS, přičemž většina pacientů se vyznačovala snížením „noninvolved“ izotypu Ig (8). Samostatná analýza, věnovaná pouze IgA typu MM vztah HLC-r k PFS překvapivě nepotvrdila (8). Zvýšená hodnota HLC-r s přítomností imunoparézy korelovala s délkou časového období do zahájení terapie (TTT). Nebyl zjištěn významný vztah nižší nebo vyšší koncentrace netumorózního izotypu nežli byl medián v souboru nemocných s IgA (typ IgG a IgM ) a v souboru IgG (typ IgA a IgM) typu MM k PFS (8), ojedinělá sdělení ale vztah mezi koncentrací „uninvolved“ izotypem jako ukazatelem imunoparézy a PFS i OS popisovala (38). Parciální remise (PR) dokumentovaná > 50% poklesem iniciální hodnoty MIg (SEP) a pozitivitou IFE se většinou vyznačuje rovněž abnormální hodnotou HLC-r, zatímco kompletní remise (KR) s negativitou SEP a IFE obvykle normální hodnotou HLC-r (32,41). V případě neúplné remise s izolovanou pozitivitou IFE bývá většinou rovněž přítomna abnormální hodnota HLC-r. S pomocí vyšetření HLC-r lze rozpoznat přítomnost MM u 26 % nemocných splňujících standardní kritéria KR (6). Složitost hodnocení KR ovšem dokládá pozorování, že v případě KR není vzácností diskordance mezi výsledkem vyšetření HLC-r a indexem monoklonality VLŘ (VLŘ-r) s doloženou perzistencí MM průkazem abnormální hodnoty HLC-r v KR u ~ 26 %, zatímco normální hodnota FLC-r se vyskytovala v 12 % (6). Nález abnormální hodnoty HLC-r u některých nemocných s IFE negativní KR nasvědčuje individuálně vyšší senzitivitě metody HevyliteTM v detekci reziduálního MIg, potvrzené kratší délkou celkového přežití (OS) od dosažení maximální léčebné odezvy (6). Kontradikcí tohoto zjištění je naopak pozorování normální hodnoty HLC-r u 34 % IFE-pozitivních nemocných splňujících konvenční kritéria nKR nebo VGPR (6). Nález normální hodnoty HLC-r je v této situaci vysvětlitelný současným vzestupem produkce PIg při nízké hodnotě MIg po dosažení léčebné odezvy s perzistencí nízké hodnoty MIg pozorovaná u některých nemocných je vysvětlitelná prolongovaným katabolickým poločasem při velmi nízké hladině MIg (23) a/nebo perzistencí malého plazmatického klonu nevymýceného předchozí terapií (6). Sekvenční sledování HLC-r s nálezem aberantních hodnot upozornilo na situaci, že nemocní, splňující s pomocí konvenční SPE, NEF a IFE kritéria KR mohou mít stále reziduální onemocnění. Srovnání senzitivity HevyliteTM techniky s multiparametrickou průtokovou cytometrií (M-FC) v hodnocení hloubky KR, tj. MRD v předtransplantační a potransplantační fázi terapie prokázalo vyšší citlivost M-FC, tj. 100 % vs. 80 % a 70 % (42).
Bylo zjištěno, že sekvenční monitorování HLC-r umožňuje rozpoznat „evolving“ relaps ještě před průkazem MIg s pomocí SPE a u ~ 10 % jedinců dokonce před vývinem pozitivity IFE (6). Důsledné sledování HLC-r tedy poskytuje v případě záchytu abnormální hodnoty časnou informaci o relapsu MM přes dočasnou negativitu IFE s tím, že k pozitivitě IFE a zmnožení plazmocytů v KD dochází dodatečně, někdy i v několikaměsíčním odstupu (32, 33, 43). Je tedy zřejmé, že HLC-r je přínosný a prakticky použitelný indikátor relapsu/progrese MM (43). Ukazuje se, že HLC-r může jako nový senzitivní ukazatel MM přispívat k hodnocení průběhu MM a tím i výběru racionální léčby, zejména udržovací a konzolidační terapie.
Přestože vyšetření s pomocí M-FC, HevyliteTM, FreeliteTM a ostatními standardními vyšetřovacími technikami analýzy proteinů vydávají vesměs rozdílné výsledky, poskytují v souhrnu významné komplementární informace pro reálné hodnocení hloubky léčebné odezvy. Vzájemně se nezastupují, nýbrž doplňují a proto by měly být v rámci komplexního pohledu především na individuálně složitý stav provedeny (40, 44). Jejich hodnocení ovšem vyžaduje dostatečnou zkušenost a znalost řady interpretačních úskalí.
Prognostický význam HevyliteTM u mnohočetného myelomu
Bylo prokázáno, že vyšetření hladin HLC a hodnoty HLC-r (HevyliteTM) má v případě IgA i IgG typu MM prognostický význam, vyznačující se v případě abnormální hodnoty HLC-r krátkou délkou PFS (8, 31, 42) i délky celkového přežití (OS) (39, 42, 45). Normalizace HLC-r v léčebně navozené plateau fázi MM se vyznačuje prolongovanou léčebnou odezvou (45). Příčinou vztahu HLC-r k délce PFS není jenom výška hladiny nádorového („involved“) MIg, ale i relativní suprese normálního („uninvolved“), izotypově specifického HLC, zřejmě jako důsledek změn v mikroprostředí KD pod vlivem působků produkovaných nádorovými plazmocyty (8, 33, 38). Ze studie Ludwiga vysvítá, že iniciální, vysoce abnormální hodnoty HLC-r (< 0,022 - > 45 vs. 0,222 - 45) jsou provázeny kratším mediánem OS (35 vs. 60 měsíců) a odlišným 5letým přežitím (tj. 33,4 % vs. 58,9 %) (6, 39), což je v souladu se závěry studií, věnovaných prognostickému významu FLC-r (6,46,47). Normalizace hodnoty HLC-r po léčbě je ovšem významnějším prediktorem prognózy nežli normalizace hladin FLC (6). Suprese páru HLC se vyznačuje vysoce významnou diferencí OS s 5letým přežitím 43 % vs. 70 % a mediánem OS 4,8 vs. 8,5 let, zatímco suprese noninvolved izotypu Ig (např. koncentrace IgG u IgA typu MM) vztah k OS nemá (6). Nemocní, splňující kritéria KR a s úpravou hodnot VLŘ a HLC-r měli významně delší PFS, nežli jedinci bez úpravy obou těchto parametrů (31). Multivariační analýza nemocných s IgG a IgA typem MM odhalila, že HLC-r spolu s β2-M jsou nezávislými rizikovými faktory OS, nikoliv FLC-r a LDH nebo albumin (6,45). Zajímavým poznatkem je zjištění, že hodnota HLC-r má větší prognostický význam u IgG nežli u IgA typu MM, tento závěr je ale nutno ověřit na rozsáhlejším souboru nemocných (8,39). Univariační a multivariační regresní analýza provedená pilotně ve studii Bradwella prokázala, že v případě aberantních hodnot HLC-r a β2-M byl přítomen významnější vztah k délce PFS nežli při vyhodnocení prognostického významu hladiny albuminu, FLC-r a překvapivě i cytogenetických nálezů charakteru del13, t(4;14) a del17p (8).
Stratifikace mnohočetného myelomu do „rizikových skupin“
Výsledky prognostické analýzy, zaměřené na HLC-r (HevyliteTM) byly ve třech studiích světového písemnictví použity k sestavení nově zkoncipovaných stratifikačních systémů MM (tab. 2 a 3) (6, 8, 11). Abnormální hodnoty HLC-r (< 0,022 a > 45) a β2-M > 5,5 mg/l, vyšetřené při diagnóze MM z hlediska vztahu k OS se projevily jako dva nezávislé prognostické faktory (6). Stratifikace, rozdělující nemocné vyšetřené při diagnóze MM do dvou rizikových skupin podle hodnoty HLC-r (< 0,022 a > 45) byla spojena s významně odlišnou délkou OS (6). Dva stratifikační modely, rozčleňující nemocné s MM do 3 „rizikových skupin“ jsou založeny na hodnotách β2-M a HLC-r (tab. 2). Statistická analýza potvrdila významnou rozdílnost mezi skupinou 1 vs. 0 a vs. 2 s 5letým OS v rizikových skupinách 0, 1 a 2 79 %, 52 % a 50 % (40). V posléze navrženém stratifikačním modelu bylo vedle hodnoty β2-M použito hodnocení > 50% suprese HLC (tab. 2) (40). V souboru 156 nemocných bylo 75% OS ve skupinách 0, 1 a 2 významně odlišné, tj. 41, 25 a 13 měsíců (39). Třístupňový stratifikační systém dle Avet-Lousiaua a Bradwella, („low“, „intermediate“ a „high risk“), založený na analýze HLC-r < 0,01 a > 200 v kombinaci s β2-M (< 3,5 mg/l) v 318členném souboru (tab. 3) se vyznačoval těsnějším vztahem k PFS (p = 0,0000022), nežli ve stážovacím systému dle International Staging System (ISS) (2, 8, 48). Prognostická analýza srovnávající kombinaci HLC-r a β2-M vs. albumin a β2-M (viz ISS) vyzněla v obou stratifikačních modelech příznivěji pro kombinaci se začleněním HLC-r (6,8). Je nasnadě, že nově zkoncipované stratifikační modely MM založené na hodnotě HLC-r vyžadují před případným zavedením do klinické praxe ověřovací studie provedené na dostatečně rozsáhlých souborech nemocných léčených moderní biologickou léčbou a s rozšířením analýzy PFS o vyhodnocení vztahu k délce celkového přežití (OS).
Tab. 2. Stratifikační modely mnohočetného myelomu dle Ludwiga rozdělující nemocné do 3 „ rizikových skupin“, založené na hodnotách β2 -mikroglobulinu a: A – poměru párů těžkých/lehkých řetězců imunoglobulinu (HLC- kappa/HLC-lambda (6) a B – 50% supresi normálního izotypu z páru těžkých/lehkých řetězců imunoglobulinu (40). 
A: HLC-r – poměr párů těžkých/lehkých řetězců imunoglobulinu kappa/lambda, β2-M - β2-mikroglobulin, MM – mnohočetný myelom B: 50% suprese HLC – normálního izotypu z páru těžkého/lehkého řetězce imunoglobulinu: IgG-kappa < 1,92 g/l; IgG-lambda < 0,95 g/l; IgA-kappa < 0,28 g/l; IgA-lambda < 0,22 g/l Tab. 3. Stratifikační model mnohočetného myelomu dle Avet–Lousiaua a Bradwella založený na hodnotách β2-mikroglobulinu a poměru párů těžkých/lehkých řetězců imunoglobulinu kappa/lambda (HLC-r), rozdělující nemocné do 3 „rizikových skupin“ (8). 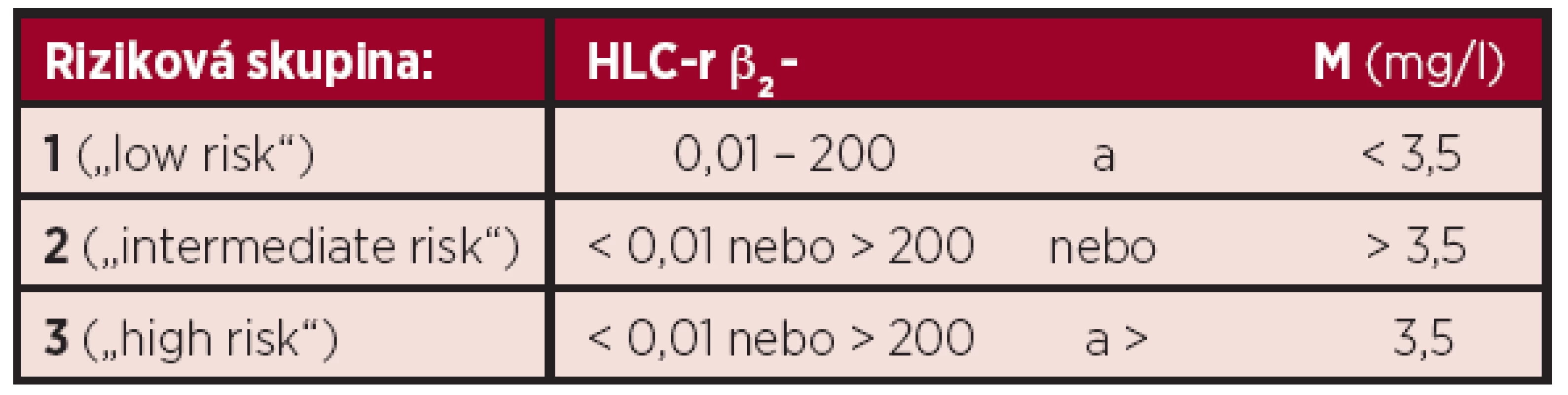
MM – mnohočetný myelom, β2-M –β2-mikroglobulin, HLC-r – poměr páru těžkých/lehkých řetězců imunoglobulinu kappa/lambda Závěr
Z dosavadních zkušeností vyplývá, že metoda HevyliteTM , umožňující přímé měření frakcí páru těžkých/lehkých řetězců Ig (HLC) a jejich poměru K/L (HLC-r) má nadějný potenciál k obohacení dosavadní palety metod, standardně používaných při analýze imunoglobulinů séra v diagnostice a v monitorování průběhu MM, neboť překonává některé jejich limitace a poskytuje další informace. V případě MM jde o metodicky dostupnou, reproduktibilní, citlivou a dynamickou metodu přinášející kvantitativní výsledky, přednostně využitelnou u nízkých koncentrací MIg a pro hodnocení selektivní suprese normálního, „noninvolved“ Ig páru HLC převyšující možnosti SPE a doplňující případně i výsledky IFE. U MM „zjemňuje“ diagnostiku zejména iniciálních hyposekrečních forem MM, rozšiřuje dosavadní možnosti stratifikace do různých „rizikových“ skupin, u části nemocných přispívá ke zvýšení senzitivity v hodnocení hloubky léčebné odezvy zejména MRD, zrychluje možnost časné detekce relapsu/progrese MM a zpřesňuje výpočet doby do progrese nemoci (PFS), uplatňuje se i v odhadu délky přežívání (OS) – to vše je ve svém souhrnu přínosné zejména v kontextu stále sofistikovanějších léčebných postupů. Je nasnadě, že využití předložených možností ovšem vyžaduje použití metody HevyliteTM kontinuálně po celou dobu sledování MM již od jeho diagnózy. Z dosavadních zkušeností vyplývá, že HevyliteTM má reálný potenciál brzkého doplnění klasických metod analýzy monoklonálních a polyklonálních Ig vedoucí k zvýšení úrovně diagnostiky MM. Definitivní, prakticky použitelný indikační algoritmus metody HevyliteTM vyplyne teprve na podkladě rozšíření dosavadně omezených klinických zkušeností a z výsledků validačních studií, postavených na dostatečně rozsáhlých kohortách nemocných, probíhajících i v podmínkách ČR v rámci programu České myelomové skupiny na hradeckém pracovišti i pracovišti autora.
Seznam použitých zkratek
β2-M β2-mikroglobulin
CRAB hyperkalcemie, renální insuficience, anémie, myelomová kostní choroba („bone disease“)
FcRn neonatální receptory pro IgG typ imunoglobulinu
FLC-r poměr volných lehkých řetězců imunoglobulinu kappa/lambda
HLC pár těžkých/lehkých řetězců imunoglobulinu
HLC-r poměr párů HLC-kappa/HLC - lambda
IFE imunofixační elektroforéza proteinů séra
Ig imunoglobulin
IMWG International Myeloma Working Group
ISS International Staging System
K kappa
KD kostní dřeň
K/L poměr volných lehkých řetězců imunoglobulinu kappa/lambda
KR kompletní remise
L lambda
LDH laktátdehydrogenáza
LŘ lehký řetězec imunoglobulinu
M-FC multiparametrická průtoková cytometrie
MG monoklonální gamapatie
MGUS monoklonální gamapatie nejistého významu
MIg monoklonální imunoglobulin
MM mnohočetný myelom
M-protein monoklonální protein
MR minimální léčebná odpověď
MRD minimální reziduální nemoc
NEF nefelometrické stanovení hladiny imunoglobulinů séra
nKR „nearly“ kompletní remise
OS délka celkového přežívání
PFS délka léčebné odezvy do progrese nemoci
PIg polyklonální imunoglobuliny séra
PR parciální remise
SD stabilita nemoci při terapii
SPE elektroforéza proteinů séra
TTT délka intervalu do nasazení terapie
VDT-ATKB vysokodávkovaná chemoterapie s podporou autologní transplantace periferních kmenových buněk
VLŘ-r poměr VLŘ kappa/lambda
Podíl autorů na přípravě rukopisu
V. Š. – celkové zpracování rukopisu
T. P. – dílčí podíl na přípravě finální verze
J. M. – dílčí podíl na přípravě finální verze
Poděkování
Podpora granty IGA MZ ČR - NT 12451-5 a NT 14400-3.
Doručeno do redakce: 6. 8. 2014
Přijato po recenzi: 13. 10. 2014
Prof. MUDr. Vlastimil Ščudla, CSc.
3. IK-NRE FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: vlastimil.scudla@fnol.cz
Zdroje
1. International Myeloma Working Group Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International myeloma working group. Brit J Haematol 2003; 121 : 749-757.
2. Hájek R, Adam Z, Ščudla V, et al. Souhrn doporučení CMG 2012 „Diagnostika a léčba mnohočetného myelomu“. Transfuze Hematol dnes 2012; Suppl. 1 118 : 5-89.
3. Vávrová J. Stanovení volných lehkých řetězců a HevyliteTM u monoklonálních gamapatií. In: Maisnar V, Tichý M, et al. Monoklonální imunoglobuliny – výskyt, význam a možnosti jejich průkazu. 1. vyd. Praha: Nucleus Hradec Králové 2012 : 55-60. ISBN: 978-80-87009-97-1.
4. Bradwell AR. Analysis of immunoglobulin heavy chain/light chain pairs (HevyliteTM ). In: Bradwell AR. Serum free light chain analysis (plus Hevylite). 6th edit, Birmingham: The Binding Site Ltd 2010 : 301 till 320. ISBN: 9780704427969.
5. Bradwell AR, Harding SJ, Fourrier NJ, et al. Assessment of monoclonal gammopathies by nephelometric measurement of individual immunoglobulin kappa/lambda ratios. Clin Chemistry 2009; 55 : 1646-1655.
6. Ludwig H, Milosavljevic D, Zojer N, et al. Immunoglobulin heavy/light chain ratios improve paraprotein detection and monitoring, identify residual disease and correlate with survival in multiple myeloma patients. Leukemia 2013; 27 : 213-219.
7. Ščudla V, Pika T, Heřmanová Z. Hevylite – nová analytická metoda v diagnostice a hodnocení průběhu monoklonálních gamapatií. Klin Biochem Metab 2010; 18 : 62-68.
8. Bradwell A, Harding S, Fourrier N, et al. Prognostic utility of intact immunoglobulin Ig´kappa/Ig´lambda ratios in multiple myeloma patients. Leukemia 2013; 27 : 202-207.
9. Keren DF. Heavy/light-chain analysis of monoclonal gammopathies. Clin Chemistry 2009; 55 : 1606-1608.
10. Wang H, Gao C, Xu L, et al. Laboratory characterisations on 2007 cases of monoclonal gammopathies in East China. Cell Mol Immunol 2008; 5 : 293-298.
11. Avet-Loiseau H, Harousseau JL, Moreau P, et al. Heavy/light chain specific immunoglobulin ratios at presentation are prognostic for progression free survival in the IFM 2005-01 Myeloma trial. Blood 2009; 114 : 1818.
12. Wolff F, Debaugnies F, Rozen L, et al. Assessment of the diagnostic performance of IgA heavy and light chain pairs in patiens with IgA monoclonal gammopathy. Clin Biochemistry 2013; 46 : 79-84.
13. Katzmann JA, Kyle RA, Benson J, et al. Screening panels for detection of monoclonal gammopathies. Clin Chemistry 2009; 55 : 1517-1522.
14. Murray DL, Ryu E, Snyder MR, et al. Quantification of serum monoclonal proteins: relationship between agarose gel electrophoresis and immunonephelometry. Clin Chemistry 2009; 55 : 1523-1529.
15. Lakomy D, Lemaire-Ewing S, Denimal D, et al. Evaluation of the new HevyliteTM IgA assay for the diagnosis and follow-up of monoclonal gammopathies. Ann Biol Clin 2013; 71 : 157-163.
16. Legg A, Harding S, Hughes RG, et al. Serum free light chain and Hevylite analysis in the diagnosis, monitoring and prognosis of B cell disorders. Klin Biochem Metab 2010; 18 : 56-61.
17. Avet-Loiseau H, Mirbahai L, Mathiot C, et al. Nephelometric assays Ig´kappa and Ig´lambda used for diagnosing and monitoring multiple myeloma. Haematologica 2011; 96 : 393.
18. Koulieris E, Panayiotidis P, Harding SJ, et al. Ratio of involved/unilvolved immunoglobulin quantification by HevyliteTM assay: clinical and prognostic impact in multiple myeloma. Exp Hematol Oncol 2012; 1 : 9. http://www.enhoonline.org/content/1/1/9
19. Pika T, Heřmanová Z, Lochman P, et al. Systém HevyLiteTM u IgA monoklonálních gamapatií – první zkušenosti. Klin Biochem Metab 2011; 19 : 86-91.
20. Wechalekar A, Harding S, Lachmann H, et al. Serum immunoglobulin heavy/light chain ratios (Hevylite) in patients with systemic AL amyloidosis. Amyloid 2010; 17 : 186.
21. Leleu X, Koulieris E, Maltezas D, et al. Novel M-component based biomarkers in Waldenström´s macroglobulinemia. Clin Lymphoma, Myeloma Leukemia 2011; 11 : 164-167.
22. Alexanian R. Blood volume in monoclonal gammopathy. Blood 1997; 49 : 301-307.
23. Waldmann TA, Strober W. Metabolism of immunoglobulins. Prog Allergy 1969; 13 : 1-110.
24. Salmon S, Smith B. Immunoglobulin synthesis and total body tumor cell number in IgG multiple myeloma. J Clin Invest 1970; 49 : 1114-1121.
25. Anderson C, Chandbury C, Kim J, et al.: Perspective-FcRn transports albumin: relevance to immunology and medicine. Trends Immunol 2006; 27 : 343-348.
26. Wines BD, Hogarth PM. IgA receptors in health and disease. Tissue Antigens 2006; 68 : 103-114.
27. Chandhury C, Brooks C, Carter D, et al. Albumin binding to FcRn: distinct from the FcRn-IgG interaction. Biochemistry 2006;45 : 4983-4990.
28. Ščudla V, Lochman P, Pika T, et al. Analýza vztahu sérových hladin párů těžkých/lehkých řetězců imunoglobulinu (HevyliteTM) k výsledkům standardní gelové elektroforézy a nefelometrického vyšetření bílkovin séra při diagnóze mnohočetného myelomu. Čas Lék Čes 2014; (v tisku).
29. Mirbahai L, Young P, Harding S, et al. Serum free light chain (FLC) and heavy/light chain (HLC) assays provide sensitive quantitative methods for monitoring IgA multiple myeloma patients. Haematologica 2012; 97 : 604.
30. Harding S, Drayson M, Lachmann H, et al. Novel nephelometric immunoassays for the sensitive detection on of IgA monoclonal gammopathies in multiple myeloma and AL amyloidosis. Haematologica 2008; 93 : 668.
31. Drayson M, Berlanga O, Plant T, et al. Immunoglobulin heavy/light chain measurements during monitoring provide prognostic information of relapse after therapy in multiple myeloma patients. Blood 2012; 120 : 3964a.
32. Lakomy D, Lemaire-Ewing S, Lafon I, et al. IgA heavy/light chain analysis-a new marker for the diagnosis and monitoring of myeloma patients. Haematologica 2012; 97 : 590.
33. Katzmann JA, Rajkumar SV. A windows into immunoglobulin quantitation and plasma cell disease: antigen epitopes defined by the junction of immunoglobulin heavy and light chains. Leukemia 2013; 27 : 1-2.
34. Tovar N, Fernandez de Larrea C, Elena M, et al. Prognostic impact of serum immunoglobulin heavy/light chain ratio in patients with multiple myeloma in complete remission after autologous stem cell transplantation. Biol Blood Marrow Transplant 2012; 18 : 1076-107.
35. Bhutani M, Landgren O, Korde N. Serum heavy-light chains (HLC) and free light chains (FLC) as predictors for early CR in newly diagnosed myeloma patients treated with carfilzomib, lenalidomide and dexamethasone (CRd). Blood 2013; 122 : 762a.
36. Fernández de Larrea C, Tovar N, Cibeira MT, et al. Emergence of oligoclonal bands in patients with multiple myeloma in complete remission after induction therapy: association with the use of novel agents. Haematologica 2011; 96 : 171-173.
37. Leibson PJ, Loken MR, Panem S, et al. Clonal evolution of myeloma cells leeds to quantitative changes in immunoglobulin secretion and surface antigen expression. Proc Natl Acad Sci ISA 1979; 76 : 2937-2941.
38. Murillo-Florez I, Andrade-Campos M, Montes-Limon A, et al. Predictive value of light and heavy chain analysis in multiple myeloma patients treated with bortezomib. Haematologica 2013; 98 : 1519a.
39. Ludwig H, Milosavljevic D, Zojer N, et al. Supression of the non-involved HLC pair correlates with survival in newly diagnosed and relapsed/refraktory patients with myeloma. Haematologica 2014; 99(S1): P 980.
40. Matsue K, Sugihara H, Nishida Y, Yamakura M, et al. Heterogeneity of IMWG defined response assessed by FLC assay, multicolor flow cytometry, and heavy/light analysis. Clin Lymphoma Myeloma Leukemia 2013; 13 : 203.
41. Avet-Louisiau H, Mirbahai L, Harousseau JL, et al. Serum immunoglobulin heavy/light chain ratios are independent risk factors for predict progression free survival in multiple myeloma. Haematologica 2010; 95 : 953.
42. Donato LJ, Zeldenrust SR, Murray DL, et al. A 71-year-old woman with multiple myeloma status after stem cell transplantation. Clin Chemistry 2011; 57 : 1645-1649.
43. Olivero B, Robillard N, Wuilleme S, et al. Heavy/light chain assay, potential new tool in minimal residual disease assessment. A biological study from IFM 2008 trial. Haematologica 2011; 96 : 79.
44. Kraj M, Kruk B, Poglod R, et al. Evaluation of IgG, IgA and IgM monoclonal and biclonal gammopathies by nephelometric measurement of individual immunoglobulin kappa/lambda ratios – Hevylite assay versus immunofixation. Acta Haematologica Polonica 2011; 42 : 257-271.
45. Koulieris E, Maltezas D, Eytychia N, et al. Impact of novel M-component based biomarkers on to progression free survival after treatment in intact immunoglobulin multiple myeloma. Blood 2012; 120 : 21.
46. Kyrtsonis MC, Vassilakopoulos TP, Kafasi N, Sachanas S, et al. Prognostic value of serum free light chain ratio at diagnosis in multiple myeloma. Br J Haematol 2007 : 137 : 240-243.
47. Dispenzieri A, Zhang L, Katzmann JA, et al. Appraisal of immunoglobulin free light chain as a marker of response. Blood 2008;111 : 4908-4915.
48. Greipp PR, San Miguel J, Durie BG, et al. International staging system for multiple myeloma. J Clin Oncol 2005;23 : 3412-3420.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2014 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- 50 tisíc dárců českého národního registru dárců dřeně (ČNRDD) a obhájení akreditace WMDA: dobrá zpráva pro program transplantací krvetvorných buněk ČR
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
- Phase IV open-label study of the efficacy and safety of deferasirox after allogeneic stem cell transplantation
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Činnost transfuzní služby v České republice v období 1989–2013
- Indikátory kvality Českého národního registru dárců dřeně za rok 2013 a srovnání s předchozími roky
- The prognostic significance of early treatment response in pediatric relapsed acute myeloid leukemia: results of the international study Relapsed AML 2001/01
- Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials
- A novel integrated cytogenetic and genomic classification refines risk stratification in pediatric acute lymphoblastic leukemia
- Tacrolimus/sirolimus vs tacrolimus/methotrexate as GVHD prophylaxis after matched, related donor allogeneic HCT
- Factors that predict thrombosis in relatives of patients with venous thromboembolism
- Outcome of aplastic anemia in adolescence: a survey of the Severe Aplastic Anemia Working Party of the European Group for Blood and Marrow Transplantation
- Obsah ročníku 20/2014
- Vybrané odborné akce v roce 2015
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Činnost transfuzní služby v České republice v období 1989–2013
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



